Una proteina in azione: l'emoglobina - Università degli Studi di ...
Una proteina in azione: l'emoglobina - Università degli Studi di ...
Una proteina in azione: l'emoglobina - Università degli Studi di ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
4 A. <strong>Una</strong> <strong>prote<strong>in</strong>a</strong> <strong>in</strong> <strong>azione</strong>: l’emoglob<strong>in</strong>a © 88-08-07893-0<br />
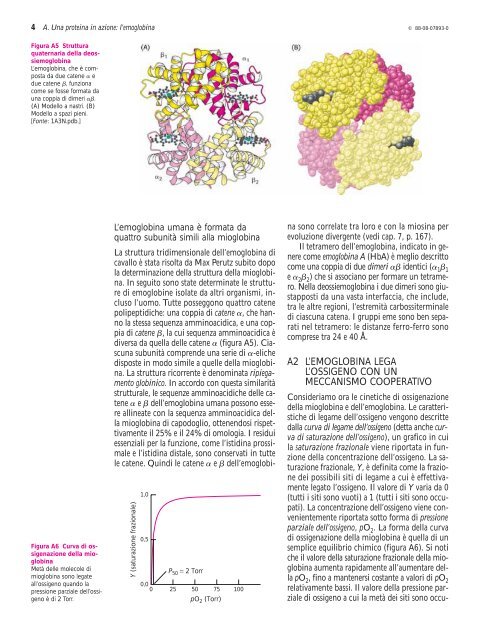
Figura A5 Struttura<br />
quaternaria della deossiemoglob<strong>in</strong>a<br />
L’emoglob<strong>in</strong>a, che è composta<br />
da due catene e<br />
due catene , funziona<br />
come se fosse formata da<br />
una coppia <strong>di</strong> <strong>di</strong>meri .<br />
(A) Modello a nastri. (B)<br />
Modello a spazi pieni.<br />
[Fonte: 1A3N.pdb.]<br />
Figura A6 Curva <strong>di</strong> ossigen<strong>azione</strong><br />
della mioglob<strong>in</strong>a<br />
Metà delle molecole <strong>di</strong><br />
mioglob<strong>in</strong>a sono legate<br />
all’ossigeno quando la<br />
pressione parziale dell’ossigeno<br />
è <strong>di</strong> 2 Torr.<br />
L’emoglob<strong>in</strong>a umana è formata da<br />
quattro subunità simili alla mioglob<strong>in</strong>a<br />
La struttura tri<strong>di</strong>mensionale dell’emoglob<strong>in</strong>a <strong>di</strong><br />
cavallo è stata risolta da Max Perutz subito dopo<br />
la determ<strong>in</strong><strong>azione</strong> della struttura della mioglob<strong>in</strong>a.<br />
In seguito sono state determ<strong>in</strong>ate le strutture<br />
<strong>di</strong> emoglob<strong>in</strong>e isolate da altri organismi, <strong>in</strong>cluso<br />
l’uomo. Tutte posseggono quattro catene<br />
polipepti<strong>di</strong>che: una coppia <strong>di</strong> catene , che hanno<br />
la stessa sequenza amm<strong>in</strong>oaci<strong>di</strong>ca, e una coppia<br />
<strong>di</strong> catene , la cui sequenza amm<strong>in</strong>oaci<strong>di</strong>ca è<br />
<strong>di</strong>versa da quella delle catene (figura A5). Ciascuna<br />
subunità comprende una serie <strong>di</strong> -eliche<br />
<strong>di</strong>sposte <strong>in</strong> modo simile a quelle della mioglob<strong>in</strong>a.<br />
La struttura ricorrente è denom<strong>in</strong>ata ripiegamento<br />
glob<strong>in</strong>ico. In accordo con questa similarità<br />
strutturale, le sequenze amm<strong>in</strong>oaci<strong>di</strong>che delle catene<br />
e dell’emoglob<strong>in</strong>a umana possono essere<br />
all<strong>in</strong>eate con la sequenza amm<strong>in</strong>oaci<strong>di</strong>ca della<br />
mioglob<strong>in</strong>a <strong>di</strong> capodoglio, ottenendosi rispettivamente<br />
il 25% e il 24% <strong>di</strong> omologia. I residui<br />
essenziali per la funzione, come l’istid<strong>in</strong>a prossimale<br />
e l’istid<strong>in</strong>a <strong>di</strong>stale, sono conservati <strong>in</strong> tutte<br />
le catene. Qu<strong>in</strong><strong>di</strong> le catene e dell’emoglobi-<br />
Y (satur<strong>azione</strong> frazionale)<br />
1,0<br />
0,5<br />
P 50 = 2 Torr<br />
0,0<br />
0 25 50 75 100<br />
pO 2 (Torr)<br />
na sono correlate tra loro e con la mios<strong>in</strong>a per<br />
evoluzione <strong>di</strong>vergente (ve<strong>di</strong> cap. 7, p. 167).<br />
Il tetramero dell’emoglob<strong>in</strong>a, <strong>in</strong><strong>di</strong>cato <strong>in</strong> genere<br />
come emoglob<strong>in</strong>a A (HbA) è meglio descritto<br />
come una coppia <strong>di</strong> due <strong>di</strong>meri identici ( 1 1<br />
e 2 2) che si associano per formare un tetramero.<br />
Nella deossiemoglob<strong>in</strong>a i due <strong>di</strong>meri sono giustapposti<br />
da una vasta <strong>in</strong>terfaccia, che <strong>in</strong>clude,<br />
tra le altre regioni, l’estremità carbossiterm<strong>in</strong>ale<br />
<strong>di</strong> ciascuna catena. I gruppi eme sono ben separati<br />
nel tetramero: le <strong>di</strong>stanze ferro-ferro sono<br />
comprese tra 24 e 40 Å.<br />
A2 L’EMOGLOBINA LEGA<br />
L’OSSIGENO CON UN<br />
MECCANISMO COOPERATIVO<br />
Consideriamo ora le c<strong>in</strong>etiche <strong>di</strong> ossigen<strong>azione</strong><br />
della mioglob<strong>in</strong>a e dell’emoglob<strong>in</strong>a. Le caratteristiche<br />
<strong>di</strong> legame dell’ossigeno vengono descritte<br />
dalla curva <strong>di</strong> legame dell’ossigeno (detta anche curva<br />
<strong>di</strong> satur<strong>azione</strong> dell’ossigeno), un grafico <strong>in</strong> cui<br />
la satur<strong>azione</strong> frazionale viene riportata <strong>in</strong> funzione<br />
della concentr<strong>azione</strong> dell’ossigeno. La satur<strong>azione</strong><br />
frazionale, Y, è def<strong>in</strong>ita come la fr<strong>azione</strong><br />
dei possibili siti <strong>di</strong> legame a cui è effettivamente<br />
legato l’ossigeno. Il valore <strong>di</strong> Y varia da 0<br />
(tutti i siti sono vuoti) a 1 (tutti i siti sono occupati).<br />
La concentr<strong>azione</strong> dell’ossigeno viene convenientemente<br />
riportata sotto forma <strong>di</strong> pressione<br />
parziale dell’ossigeno, pO 2. La forma della curva<br />
<strong>di</strong> ossigen<strong>azione</strong> della mioglob<strong>in</strong>a è quella <strong>di</strong> un<br />
semplice equilibrio chimico (figura A6). Si noti<br />
che il valore della satur<strong>azione</strong> frazionale della mioglob<strong>in</strong>a<br />
aumenta rapidamente all’aumentare della<br />
pO 2 , f<strong>in</strong>o a mantenersi costante a valori <strong>di</strong> pO 2<br />
relativamente bassi. Il valore della pressione parziale<br />
<strong>di</strong> ossigeno a cui la metà dei siti sono occu