Una proteina in azione: l'emoglobina - Università degli Studi di ...
Una proteina in azione: l'emoglobina - Università degli Studi di ...
Una proteina in azione: l'emoglobina - Università degli Studi di ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
16 A. <strong>Una</strong> <strong>prote<strong>in</strong>a</strong> <strong>in</strong> <strong>azione</strong>: l’emoglob<strong>in</strong>a © 88-08-07893-0<br />
A4 Le mutazioni dei geni che co<strong>di</strong>ficano per le subunità<br />
dell’emoglob<strong>in</strong>a sono responsabili <strong>di</strong> alcune malattie<br />
L’anemia a cellule falciformi è causata dalla sostituzione <strong>di</strong> un residuo<br />
<strong>di</strong> glutammato con uno <strong>di</strong> val<strong>in</strong>a nella catena dell’emoglob<strong>in</strong>a.<br />
Si genera così una zona idrofoba sulla superficie della deossiemoglob<strong>in</strong>a<br />
(stato T), che provoca la form<strong>azione</strong> <strong>di</strong> polimeri fibrosi.<br />
Le fibre alterano la forma dei globuli rossi, conferendo loro<br />
un aspetto a falce. L’anemia a cellule falciformi è stata la prima malattia<br />
<strong>di</strong> cui è stato possibile ricondurre l’<strong>in</strong>sorgenza a un cambiamento<br />
nella sequenza amm<strong>in</strong>oaci<strong>di</strong>ca <strong>di</strong> una <strong>prote<strong>in</strong>a</strong>. Le varie for-<br />
me <strong>di</strong> talassemia sono causate da una ridotta produzione della catena<br />
o della catena dell’emoglob<strong>in</strong>a. Vengono prodotti tetrametri<br />
emoglob<strong>in</strong>ici contenenti un solo tipo <strong>di</strong> subunità. Tali tetrametri<br />
sono caratterizzati da una <strong>di</strong>m<strong>in</strong>uita capacità <strong>di</strong> rilascio dell’ossigeno<br />
e da una bassa solubilità, che provocano la lisi dei globuli<br />
rossi durante il loro sviluppo. I precursori dei globuli rossi normalmente<br />
producono un lieve eccesso <strong>di</strong> catene rispetto alle catene<br />
. Per prevenirne l’aggreg<strong>azione</strong>, essi producono una <strong>prote<strong>in</strong>a</strong> stabilizzante<br />
l’-emoglob<strong>in</strong>a, che si lega specificamente ai monomeri<br />
, formando un complesso solubile.<br />
APPENDICE Si possono proporre modelli <strong>di</strong> legame <strong>di</strong> tipo cooperativo <strong>in</strong> term<strong>in</strong>i quantitativi:<br />
il grafico <strong>di</strong> Hill e il modello concertato<br />
Il grafico <strong>di</strong> Hill<br />
Un modo utile per descrivere quantitativamente il legame <strong>di</strong> tipo<br />
cooperativo, com’è quello dell’emoglob<strong>in</strong>a, è stato sviluppato da Archibald<br />
Hill nel 1913. Consideriamo l’ipotetico equilibrio tra una<br />
<strong>prote<strong>in</strong>a</strong> X e un ligando S:<br />
X + nS X(S) n (1)<br />
dove n è una variabile che può assumere valori <strong>in</strong>teri o frazionari.<br />
Il parametro n è una misura del grado <strong>di</strong> cooperatività del legame<br />
<strong>di</strong> S, anche se l’equ<strong>azione</strong> 1 non si riferisce a un vero e proprio processo<br />
fisico. Per X = emoglob<strong>in</strong>a e S = O 2 , il massimo valore che n<br />
può assumere è 4. Questo valore potrebbe essere raggiunto se il legame<br />
dell’ossigeno con l’emoglob<strong>in</strong>a fosse completamente cooperativo,<br />
cioè se la cooperatività fosse la massima possibile. Se <strong>in</strong>vece<br />
il legame dell’ossigeno fosse totalmente non cooperativo, il valore<br />
<strong>di</strong> n sarebbe 1.<br />
Analizzando l’equilibrio della re<strong>azione</strong> 1, si ottiene la seguente<br />
espressione per la satur<strong>azione</strong> frazionale, Y:<br />
[ S]<br />
n<br />
Y =<br />
[ S] + [ S50] n n<br />
dove [S 50 ] è la concentr<strong>azione</strong> alla quale la satur<strong>azione</strong> del ligando<br />
X è pari al 50% (X è saturato per metà). Per l’emoglob<strong>in</strong>a l’espressione<br />
<strong>di</strong>venta<br />
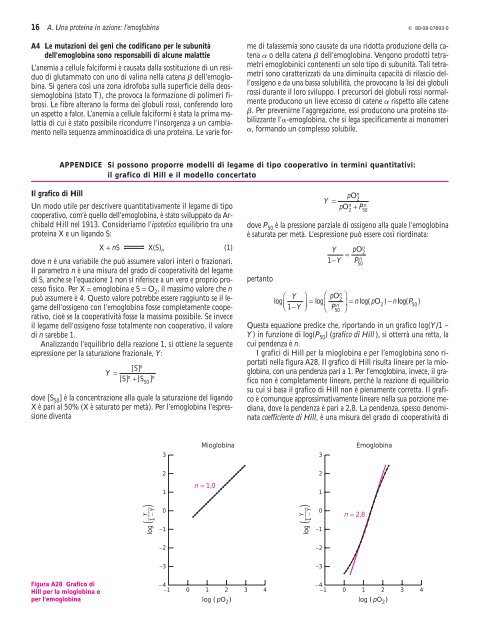
Figura A28 Grafico <strong>di</strong><br />
Hill per la mioglob<strong>in</strong>a e<br />
per l’emoglob<strong>in</strong>a<br />
Y<br />
log (––––) 1 − Y<br />
3<br />
2<br />
1<br />
0<br />
−1<br />
−2<br />
−3<br />
−4<br />
−1<br />
0<br />
Mioglob<strong>in</strong>a<br />
n = 1,0<br />
log ( pO 2 )<br />
dove P 50 è la pressione parziale <strong>di</strong> ossigeno alla quale l’emoglob<strong>in</strong>a<br />
è saturata per metà. L’espressione può essere così riord<strong>in</strong>ata:<br />
pertanto<br />
1 2 3 4<br />
pOn<br />
2 Y =<br />
pO+ P<br />
Y p<br />
=<br />
1 −Y<br />
P n<br />
O<br />
⎛ Y ⎞ p n<br />
2<br />
log log nlog( p ) n<br />
⎝<br />
⎜<br />
1 −Y<br />
⎠<br />
⎟<br />
P n<br />
=<br />
⎛ O ⎞<br />
⎜ ⎟ = O2 − log( P50) ⎝ ⎠<br />
50<br />
n n<br />
2 50<br />
n<br />
2<br />
50<br />
Questa equ<strong>azione</strong> pre<strong>di</strong>ce che, riportando <strong>in</strong> un grafico log(Y/1 –<br />
Y ) <strong>in</strong> funzione <strong>di</strong> log(P 50 ) (grafico <strong>di</strong> Hill ), si otterrà una retta, la<br />
cui pendenza è n.<br />
I grafici <strong>di</strong> Hill per la mioglob<strong>in</strong>a e per l’emoglob<strong>in</strong>a sono riportati<br />
nella figura A28. Il grafico <strong>di</strong> Hill risulta l<strong>in</strong>eare per la mioglob<strong>in</strong>a,<br />
con una pendenza pari a 1. Per l’emoglob<strong>in</strong>a, <strong>in</strong>vece, il grafico<br />
non è completamente l<strong>in</strong>eare, perché la re<strong>azione</strong> <strong>di</strong> equilibrio<br />
su cui si basa il grafico <strong>di</strong> Hill non è pienamente corretta. Il grafico<br />
è comunque approssimativamente l<strong>in</strong>eare nella sua porzione me<strong>di</strong>ana,<br />
dove la pendenza è pari a 2,8. La pendenza, spesso denom<strong>in</strong>ata<br />
coefficiente <strong>di</strong> Hill, è una misura del grado <strong>di</strong> cooperatività <strong>di</strong><br />
Y<br />
log (––––) 1 − Y<br />
3<br />
2<br />
1<br />
0<br />
−1<br />
−2<br />
−3<br />
−4<br />
−1<br />
0<br />
n = 2,8<br />
Emoglob<strong>in</strong>a<br />
1 2 3 4<br />
log ( pO 2 )