lezione 13 biochimica - Omero
lezione 13 biochimica - Omero
lezione 13 biochimica - Omero
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
•<br />
•<br />
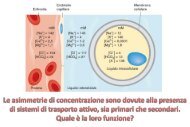
Il trasporto del glucosio<br />
Il glucosio non<br />
nelle cellule<br />
può diffondere direttamente<br />
Esso entra nelle cellule mediante due<br />
meccanismi di trasporto:<br />
a) diffusione facilitata Na + indipendente<br />
b) co-trasporto Na + -monosaccaride
•<br />
•<br />
•<br />
•<br />
•<br />
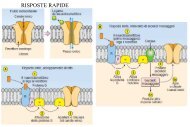
Diffusione facilitata Na +<br />
indipendente<br />
Avviene secondo il gradiente di concentrazione, per<br />
cui non richiede energia!<br />
E’ un processo mediato da una famiglia di proteine<br />
comprendente almeno 14 trasportatori (GLUT-<br />
1…..GLUT-14)<br />
L’espressione è tessuto specifica (Glut-1 G. Rossi ed<br />
encefalo, Glut-2 fegato, rene...)<br />
Questi trasportatori si trovano nella membrana<br />
cellulare<br />
Il glucosio extracellulare si lega al trasportatore,<br />
esso modifica la propria conformazione e così<br />
trasporta il glucosio attraverso la membrana
•<br />
•<br />
•<br />
•<br />
•<br />
Co-trasporto Na + monosaccaride<br />
Richiede energia !<br />
Trasporta il glucosio contro<br />
concentrazione<br />
E’<br />
il suo<br />
mediato da un trasportatore<br />
gradiente di<br />
Il trasporto del glucosio è accoppiato al<br />
gradiente di concentrazione del Na+<br />
(contemporaneamente trasportato dentro la<br />
cellula)<br />
Questo trasporto avviene nelle cellule epiteliali<br />
dell’intestino, dei tubuli renali e del plesso<br />
corioideo
•<br />
•<br />
•<br />
•<br />
•<br />
Le reazioni della glicolisi (2)<br />
(1) Fosforilazione del glucosio<br />
Intrappola lo zucchero nel citosol (gli<br />
zuccheri fosforilati non attraversano le<br />
membrane cellulari)<br />
è irreversibile<br />
è catalizzata dall’enzima esochinasi (uno dei 3<br />
enzimi regolatori della glicolisi, insieme a<br />
fosfofruttochinasi e piruvato chinasi)<br />
Nel fegato e nel pancreas è catalizzata dalla<br />
glucochinasi
•<br />
•<br />
•<br />
•<br />
•<br />
L’<br />
esochinasi<br />
L’esochinasi catalizza la fosforilazione del glucosio<br />
nella maggior parte dei tessuti<br />
Ha un’ampia specificità per il substrato (fosforila<br />
anche altri esosi)<br />
è inibita dal prodotto della reazione (glucosio 6fosfato)<br />
ha una Km alta)<br />
bassa<br />
per il glucosio (e quindi un’affinità<br />
ha una Vmax bassa, per cui non possono essere<br />
fosforilati più zuccheri di quanti la cellula non ne<br />
possa utilizzare.
•<br />
•<br />
•<br />
La glucochinasi<br />
E’ il principale enzima responsabile della fosforilazione<br />
del glucosio nel fegato e nelle cellule delle isole<br />
pancreatiche.<br />
Nel fegato facilita la fosforilazione del glucosio<br />
durante l’iperglicemia.<br />
Differisce dalla esochinasi perché:<br />
1) ha una Km >> esochinasi (cioè richiede una<br />
[ glucosio] più elevata per raggiungere 1/2 Vmax) perciò<br />
funziona soltanto quando la [glucosio] negli epatociti è<br />
alta (p.es. dopo un pasto ricco di carboidrati)<br />
2) ha una Vmax elevata (permette al fegato di eliminare<br />
con efficienza dal sangue portale il glucosio, anche dopo<br />
un pasto ricco di carboidrati, minimizzando<br />
l’iperglicemia durante il periodo dell’assorbimento)
REGOLAZIONE DELLA GLUCOCHINASI<br />
•<br />
INSULINA<br />
Negli epatociti, <br />
l’attività<br />
della glucochinasi.<br />
FRUTTOSIO 6-FOSFATO e GLUCOSIO<br />
Nel nucleo c’è una proteina regolatrice della<br />
glucochinasi:<br />
1) in presenza di fruttosio 6-fosfato (che si trova in<br />
equilibrio con il glucosio 6-fosfato), l’enzima si<br />
trasferisce nel nucleo, si lega alla proteina regolatrice e<br />
diventa inattivo.<br />
2) un di glucosio attiva l’enzima poiché provoca il<br />
distacco della glucochinasi dalla proteina regolatrice.<br />
L’enzima migra nel citosol e fosforila il glucosio a<br />
glucosio 6-fosfato
•<br />
•<br />
•<br />
•<br />
•<br />
•<br />
•<br />
(2) L’isomerizzazione del glucosio 6-fosfato in<br />
fruttosio 6-fosfato<br />
E’<br />
E’<br />
catalizzata dalla fosfoglucosio-isomerasi<br />
reversibile<br />
(3) Fosforilazione del fruttosio 6-fosfato a<br />
fruttosio 1,6 bisfosfato<br />
è irreversibile<br />
è catalizzata dalla fosfofruttochinasi-1 (PFK-1)<br />
E’ il punto di controllo più importante della glicolisi ed è<br />
la tappa che limita la velocità della via<br />
La PFK-1 è inibita da: ATP, citrato<br />
La PFK-1 è attivata da: AMP, fruttosio 2,6bisfosfato.
•<br />
<br />
•<br />
•<br />
Regolazione della<br />
fosfofruttochinasi-1 (PFK-1)<br />
La PFK-1 è<br />
INIBITA<br />
in modo allosterico da:<br />
[ATP] (indicano abbondanza di composti<br />
ad alta energia)<br />
<br />
[citrato]<br />
La PFK-1 è ATTIVATA in modo allosterico<br />
da:<br />
[AMP] (indicano un impoverimento della<br />
riserva energetica della cellula)<br />
fruttosio 2,6-bisfosfato
•<br />
•<br />
•<br />
•<br />
•<br />
Il più potente ATTIVATORE della PFK-1<br />
èil fruttosio 2,6-bisfosfato<br />
esso è<br />
sintetizzato in tutti i tessuti<br />
la sua sintesi è<br />
glucagone<br />
(+)<br />
dall’insulina e (-)<br />
funge da segnale intracellulare,<br />
indicando un’abbondanza di glucosio<br />
dal<br />
La sua azione contemporanea sulla<br />
glicolisi [(+) fosfofruttochinasi-1] e sulla<br />
gluconeogenesi [(-) fruttosio 1,6<br />
bisfosfatasi] fa sì che le due vie non<br />
siano attive nello stesso momento,<br />
evitando un ciclo futile.
•<br />
•<br />
Durante lo stato alimentato nel fegato<br />
[fruttosio 2,6 bisfosfato] con della<br />
glicolisi.<br />
Durante il digiuno<br />
nel fegato si ha una<br />
[fruttosio 2,6 bisfosfato ] con<br />
conseguente della gluconeogenesi.
•<br />
•<br />
Regolazione della piruvato chinasi<br />
(a livello epatico)<br />
Nel fegato, la piruvato chinasi è<br />
attivata<br />
da un<br />
[fruttosio 1,6-bisfosfato] (il prodotto della<br />
reazione della fosfofruttochinasi-1)<br />
Questa regolazione collega l’attività delle due<br />
chinasi:<br />
attività fosfofruttochinasi (PFK-1)<br />
<br />
[fruttosio 1,6-bisfosfato]<br />
<br />
(+) piruvato chinasi
•<br />
•<br />
La fosforilazione della piruvato chinasi (ad opera di<br />
una proteina chinasi cAMP dipendente) determina la<br />
sua inattivazione<br />
1) Quando la [glucosio] è<br />
bassa:<br />
[glucagone] [cAMP] intracellulare <br />
fosforilazione della piruvato chinasi (-) piruvato<br />
chinasi<br />
2) Il fosfoenolpiruvato (PEP) non può continuare la via<br />
glicolitica e sarà utilizzato nella via gluconeogenica<br />
La defosforilazione della piruvato chinasi (ad opera<br />
di una fosfatasi) riattiva l’enzima
•<br />
•<br />
•<br />
•<br />
•<br />
REGOLAZIONE DELLA GLICOLISI<br />
La regolazione della glicolisi è affidata a tre passaggi di<br />
importanza strategica:<br />
1) fosforilazione del glucosio (esochinasi e glucochinasi);<br />
2) la formazione di fruttosio 1,6-bisfosfato (PFK-1);<br />
3) la formazione di piruvato (piruvato chinasi).<br />
Nei tessuti, la glicolisi è un processo molto inibito cioè<br />
funziona ad una velocità molto bassa rispetto alla Vmax .<br />
In tal modo le cellule possono modulare velocemente<br />
questo processo, senza ricorrere alla produzione di<br />
nuove proteine ed enzimi.<br />
La regolazione della glicolisi è affidata ad enzimi<br />
regolatori che, in condizioni basali, sono molto inibiti.<br />
Il controllo di questi enzimi avviene ad opera di<br />
effettori allosterici (piccole molecole che si legano ad<br />
un sito diverso dal sito attivo) o per mezzo di<br />
modificazioni covalenti (fosforilazione di una proteina).
•<br />
•<br />
•<br />
REGOLAZIONE ORMONALE<br />
DELLA GLICOLISI<br />
La sintesi dei 3 enzimi chiave della glicolisi<br />
(glucochinasi, fosfofruttochinasi e piruvato<br />
chinasi) è:<br />
dall’ insulina<br />
dal glucagone<br />
Un pasto ricco di carboidrati o la<br />
somministrazione di insulina la sintesi dei<br />
3 enzimi (è favorita la conversione del<br />
glucosio in piruvato)<br />
Nel digiuno e nel diabete, la [glucagone] è <br />
e la sintesi dei 3 enzimi è
Champe et al., Le basi della <strong>biochimica</strong>, Ed. Zanichelli
Destini alternativi del piruvato<br />
1) Decarbossilazione ossidativa<br />
• via importante nei tessuti con elevata capacità<br />
ossidativa (cuore)<br />
• catalizzata dalla piruvato deidrogenasi<br />
• converte irreversibilmente il piruvato in acetil CoA<br />
(utilizzato nel Ciclo di Krebs o per la sintesi degli<br />
acidi grassi)<br />
2) Carbossilazione ad ossalacetato<br />
• catalizzata dalla piruvato carbossilasi<br />
• rigenera gli intermedi del ciclo di Krebs e fornisce<br />
substrati alla gluconeogenesi<br />
3) Riduzione del piruvato ad etanolo (F. alcolica)<br />
• avviene nei lieviti e in alcuni batteri