genetica3.pdf
genetica3.pdf
genetica3.pdf
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
POLIMORFISMI DI LUNGHEZZA DI SEQUENZE SEMPLICI (SSLP)<br />
Minisatelliti<br />
• Noti anche come VNTR, cioè Ripetizioni in Tandem a Numero Variabile.<br />
• Sono sequenze in cui l’unità ripetitiva è di circa 25 nucleotidi.<br />
• La variabilità consiste nel numero di volte in cui sono ripetute.<br />
• Non sono distribuite uniformemente su tutto il genoma ma più frequenti nelle regioni telomeriche. Alleli > 300 bp.<br />
Microsatelliti<br />
• Noti anche come STR, cioè Ripetizioni in Tandem Semplici.<br />
• Sono sequenze in cui l’unità ripetitiva è più corta (2-4 nucleotidi).<br />
• Sono distribuite più uniformemente in tutto il genoma, quindi più utili ai fini della applicazione in genetica.<br />
• Gli alleli sono più corti rispetto a quelli dei minisatelliti (< 300 bp).<br />
• Sono 6,5 x 10 5 in un genoma umano.<br />
Analisi di microsatelliti mediante PCR<br />
Il gene mutato è associato all’allele 4, il gene normale all’allele 7<br />
In questo albero genealogico vengono seguiti un gene malattia dominante ed<br />
un polimorfismo di microsatelliti.<br />
• Rosso gli alleli polimorfici<br />
• Nero soggetti affetti<br />
• Bianco soggetti sani<br />
Considerando che il soggetto II-1 è malato e ha genotipo 1/2, e che il gene in<br />
esame è strettamente associato al locus polimorfico, si possono fare 2 ipotesi:<br />
1. il gene malato è associato all’allele 1, il gene sano all’allele 2<br />
2. il gene malato è associato all’allele 2, il gene sano all’allele 1<br />
In seguito a ricombinazione, il gene mutato risulta essere<br />
associato all’allele 7 invece che all’allele 4<br />
I nonni sono entrambi deceduti, quindi non abbiamo informazioni sufficienti a capire quale delle due disposizioni è quella<br />
giusta. Se analizziamo la progenie, notiamo che tutti i figli malati (tranne uno) portano l’allele 1, mentre i figli sani (tranne uno) portano<br />
l’allele 2. In questi figli, gli alleli 3 e 4 derivano dal padre che è sano, quindi non sono rilevanti ai fini dell’analisi.<br />
Figli<br />
1. 1 – malato<br />
2. 2 – sano<br />
3. 1 – malato<br />
4. 1 – malato<br />
5. 2 – sano<br />
6. 2 - malato<br />
Ipotesi 1<br />
• allele 1 gene malato<br />
• allele 2 gene sano<br />
Parentale<br />
Parentale<br />
Parentale<br />
Parentale<br />
Parentale<br />
Ricombinante<br />
Ipotesi 2<br />
• allele 1 gene sano<br />
• allele 2 gene malato<br />
Ricombinante<br />
Ricombinante<br />
Ricombinante<br />
Ricombinante<br />
Ricombinante<br />
Parentale<br />
ipotesi 1<br />
ipotesi 2<br />
Nell’ipotesi 1, il risultato effettivamente osservato verrebbe ottenuto con un unico evento di ricombinazione. La frequenza di<br />
ricombinazione è 1/6, cioè il 16,7%.<br />
Nell’ipotesi 2, per ottenere il risultato osservato occorrerebbero 5 eventi di ricombinazione. Pur essendo più probabile l’ipotesi<br />
1, non si può del tutto escludere l’ipotesi 2. Queste incertezze si possono esprimere utilizzando il LOD Score. Se la nonna fosse<br />
disponibile, e se si stabilisse che il suo genotipo è 1-5, si potrebbe dire con certezza che in questa famiglia l’allele malattia è associato<br />
all’allele 1.<br />
21
SQUILIBRIO DA LINKAGE<br />
La mutazione compare per la prima volta in un soggetto A3, B3/A4, B4 sul cromosoma che<br />
porta gli alleli A3 e B3. Per effetto delle vicinanza del locus C rispetto al locus B, la mutazione<br />
tenderà ad essere trasmessa ai discendenti insieme all’allele B3 (pochi eventi di ricombinazione tra<br />
B e C). Invece, potranno verificarsi più crossing-over tra C e A, quindi nelle generazioni il gene<br />
mutato si dissocia dall’allele A3 che era presente nel cromosoma originario.<br />
Se il gene mutato è vantaggioso, si osserverà un aumento della frequenza dell’aplotipo<br />
B3/C rispetto agli altri aplotipo possibili. Se la mutazione è svantaggiosa si osserverà il contrario.<br />
POLIMORFISMI DI SINGOLI NUCLEOTIDI (SNP)<br />
• Posizioni del genoma in corrispondenza delle quali alcuni soggetti hanno un nucleotide (ad es. G) ed altri uno diverso (ad es. C).<br />
• Presenti in gran numero nel genoma (circa 1,4 x 10 6 ).<br />
• Solo alcuni generano RFLP perché la sequenza nella quale si trovano non è riconosciuta da enzimi di restrizione.<br />
• Possono essere evidenziati con metodi diversi dall’elettroforesi su gel.<br />
Rivelazione di SNP mediante ibridazione in soluzione<br />
22<br />
Sonda specifica per un SNP, complementarietà<br />
non totale con la sequenza normale.<br />
Fluorocromo inibito, nessuna fluorescenza visibile.<br />
Rivelazione di SNP su filtro mediante oligonucleotidi allele-specifici (ASO)<br />
Perfetta complementarietà dovuta ad un SNP:<br />
quando c’è ibridazione la sonda si apre.<br />
Fluorocromo attivo, forte fluorescenza visibile e<br />
misurabile per via strumentale.<br />
SNP-1 SNP-2<br />
La sonda specifica per SNP-2 non ibridizza con SNP-1 La sonda specifica per SNP-2 ibridizza con SNP-2<br />
Ovviamente, la sonda specifica per SNP-1 darà un risultato complementare.<br />
GENETICA DI POPOLAZIONI – LEGGE DI HARDY-WEINBERG<br />
Condizioni di validità Premesse<br />
1. Popolazione di dimensioni infinite<br />
2. Panmissia, cioè incroci casuali<br />
3. Assenza di mutazioni (o equilibrio)<br />
4. Assenza di migrazione tra popolazioni<br />
5. Assenza di selezione (tutti i genotipi hanno lo stesso successo riproduttivo)<br />
1. Locus singolo con due alleli: A e a<br />
2. Frequenza dell’allele A = p<br />
3. Frequenza dell’allele a = q<br />
4. p + q = 1<br />
5. 1 – q = p<br />
In una popolazione panmittica, le frequenze degli alleli e dei genotipi restano costanti di generazione in generazione e sono<br />
facilmente deducibili. E’ più facile che la popolazione sia panmittica per un carattere non visibile come il gruppo sanguigno.
EQUAZIONE DI HARDY-WEINBERG<br />
Dal momento che ciascun soggetto ha due alleli per un gene, la distribuzione dei genotipi alla generazione successiva è:<br />
(p + q) 2<br />
cioè<br />
p 2 (AA) + 2pq (Aa) + q 2 (aa) = 1<br />
Ogni soggetto della popolazione deriva dall’unione di due gameti nei quali i due alleli A ed a possono<br />
presentarsi con probabilità p e q rispettivamente. Quindi, l’intera popolazione (quadrato di lato 1) è costituita<br />
dalla somma delle frequenze dei tre genotipi possibili.<br />
In caso di dominanza completa, i genotipi AA ed Aa avranno uguale fenotipo, quindi non saranno identificabili. In questo<br />
caso, il calcolo delle frequenze può essere eseguito basandosi sui soggetti il cui genotipo è certo, vale a dire gli omozigoti per l’allele<br />
recessivo aa.<br />
Esempio<br />
Su 100 soggetti è stata determinata l’appartenenza al gruppo sanguigno RH.<br />
Risultati: RH + = 84<br />
RH - = 16<br />
Calcolo delle frequenze. 16 soggetti su 100 sono aa quindi q 2 = 16/100<br />
quindi q = 16 / 100 = 4/10 cioè 0,4<br />
di conseguenza p = 1 – q = 1 – 0,4 = 0,6<br />
In caso di codominanza, i genotipi omozigoti ed eterozigoti avranno fenotipo diverso, quindi sono facilmente identificabili. In<br />
questo caso, il calcolo delle frequenze alleliche può essere eseguito partendo dalle frequenze genotipiche e contando tutti gli alleli<br />
presenti nella popolazione. Ciò fornisce un risultato più attendibile.<br />
Esempio<br />
Su 100 soggetti è stata determinata l’appartenenza al gruppo sanguigno MN (M ed N sono codominanti)<br />
• Soggetti di gruppo M (quindi MM) = 32<br />
• Soggetti di gruppo MN (quindi MN) = 48<br />
• Soggetti di gruppo N (quindi NN) = 20<br />
Gli alleli M presenti nella popolazione sono (32 x 2 + 48) / 200 = 0,56 = p<br />
Gli alleli N presenti nella popolazione sono (20 x 2 + 48) / 200 = 0,44 = q<br />
Esempio di locus con più alleli: il gruppo sanguigno AB0<br />
• sia p = la frequenza dell’allele I A<br />
• sia q = la frequenza dell’allele I B<br />
• sia r = la frequenza dell’allele i<br />
e la somma delle frequenze alleliche sia p + q + r = 1<br />
p + q = 1<br />
La distribuzione delle frequenze genotipiche è data dalla seguente tabella:<br />
gruppo genotipo<br />
frequenza<br />
genotipo<br />
frequenza<br />
gruppo<br />
0 ii r 2 r 2<br />
A<br />
I A I A<br />
I A i<br />
p 2<br />
2pr<br />
p 2 + 2pr<br />
B<br />
I B I B<br />
I B i<br />
q 2<br />
2qr<br />
q 2 + 2qr<br />
AB I A I B 2pq 2pq<br />
La frequenza dei soggetti di gruppo 0 è r 2 . Quindi, r equivale alla radice quadrata della frequenza dei soggetti di gruppo 0.<br />
La frequenza dei soggetti di gruppo A è p 2 + 2pr.<br />
La somma delle frequenze dei soggetti di gruppo A e di quelli di gruppo 0 è p 2 + 2pr + r 2 , cioè (p + r) 2 .<br />
Quindi p + r = A + 0 e di conseguenza p = A + 0 - r<br />
23
La frequenza dei soggetti di gruppo B è q 2 + 2qr.<br />
La somma delle frequenze dei soggetti di gruppo B e di quelli di gruppo 0 è q 2 + 2qr + r 2 , cioè (q + r) 2 .<br />
Quindi q + r = B + 0 e di conseguenza q = B + 0 - r<br />
Esempio: in una popolazione, la frequenza dei fenotipi osservati è la seguente:<br />
• gruppo A: 80<br />
• gruppo B: 26<br />
• gruppo 0: 90<br />
• gruppo AB: 6<br />
• TOTALE: 202<br />
Calcolo della frequenza r dell’allele i: soggetti ii = 90/202<br />
quindi r = 90 / 202 r = 0,66<br />
Calcolo della frequenza p dell’allele I A : soggetti A + 0 = 170/202<br />
quindi p + r = 170 / 202 = 0,917 p = 0,91 – 066 = 0,25<br />
Calcolo della frequenza q dell’allele I B : soggetti B + 0 = 116/202<br />
quindi q + r = 116 / 202 = 0,76 q = 0,76 – 0,66 = 0,1<br />
Nel caso di caratteri legati ad X, un calcolo semplificato delle frequenze alleliche può essere effettuato partendo da un<br />
campione di maschi.<br />
Ad esempio, su un campione di 100 soggetti di sesso maschile, 9 sono risultati daltonici. Poiché il gene per il daltonismo<br />
risiede sul cromosoma X e i maschi sono emizigoti per questo cromosoma, la frequenza dell’allele per daltonismo viene ricavata<br />
direttamente dal numero di maschi daltonici:<br />
• 9/100 è la frequenza di maschi daltonici<br />
• la frequenza q dell’allele d è 9/100 = 0,09<br />
• la frequenza p dell’allele D è 1 – 0,09 = 0,91<br />
Nella popolazione dalla quale deriva il campione di maschi, le frequenze genotipiche delle donne sono date da:<br />
• p 2 = 0,91 2 = 0,83 frequenza delle donne DD<br />
• 2pq = 2 x 0,91 x 0,09 = 0,164 frequenza delle donne Dd (portatrici sane)<br />
• q 2 = 0,09 2 = 0,008 frequenza delle donne dd (daltoniche)<br />
Determinare se una popolazione è in equilibrio (secondo la legge di Hardy-Weinberg) per gli alleli di un determinato gene<br />
L M e L N sono due alleli codominanti che determinano il gruppo sanguigno MN.<br />
In un campione di 5961 americani di origine caucasica, si trovano le seguenti proporzioni:<br />
La differenza tra Noss e Natt non è significativa (p=0,19), quindi la popolazione è in equilibrio.<br />
Coefficiente di selezione (s): probabilità di un genotipo di non riuscire a riprodursi, dovuta alla selezione naturale:<br />
• s = 0 tipo più adatto<br />
• s = 1 carattere letale<br />
Fitness: valore adattativo di un genotipo. Viene misurato dal suo contributo proporzionale di progenie alla generazione successiva ed<br />
è uguale a 1 – s.<br />
In una malattia autosomica recessiva, ad ogni generazione si perdono sq 2 geni patologici. Se la frequenza non diminuisce è<br />
perché la perdita viene compensata da nuove mutazioni alla velocità di µ(1 – sq 2 ), dove µ è il tasso di mutazione per gene per<br />
generazione. All’equilibrio, sq 2 = µ(1 – sq 2 ). Siccome q è piccolo, in pratica µ = sq 2 . Per la maggior parte dei geni, µ = 10 -5 – 10 -7 .<br />
Esempio<br />
La fibrosi cistica è una malattia rara, determinata dagli alleli F ed f, che colpisce in Italia 1/3250 neonati. Qual è la frequenza<br />
dei portatori sani (Ff)?<br />
• q 2 = 1/3250 = 0,00031<br />
• q = 0,0175<br />
• p = 0,9825<br />
FFf = 2pq = 0,0344 cioè 1/29<br />
24
• La probabilità che due Ff si incrocino è 0,0344 x 0,0344 = 0,0012.<br />
• Tra i loro figli 1/4 sarà ff 0,0012/4 = 0,0003, cioè 1/3333, molto simile al 1/3250 osservato.<br />
La fibrosi cistica in Inghilterra colpisce 1/2000 neonati.<br />
• q 2 = 1/2000 = 0,0005<br />
• q = 0,022<br />
• p = 0,978<br />
Portatori sani FFf = 2pq = 0,043 cioè 1/23<br />
• La probabilità che due Ff si incrocino è 0,043 x 0,043 = 0,0018.<br />
• Tra i loro figli 1/4 sarà ff 0,0018/4 = 0,0005, cioè 1/2000 come osservato.<br />
Per la fibrosi cistica:<br />
• s = 1<br />
• q 2 = 0,0005<br />
• quindi µ = 0,0005 = 5 x 10 -4 MOLTO IMPROBABILE. Il tasso di mutazione è troppo alto e ci sono prove che nuove mutazioni<br />
compaiono molto più raramente.<br />
Vantaggio dell’eterozigote<br />
La frequenza relativamente elevata di alleli che determinano una ridotta fitness negli omozigoti è stata spiegando assumendo<br />
che gli eterozigoti (Aa) abbiano una fitness più elevata rispetto ad entrambi gli omozigoti (AA ed aa). Nel caso della fibrosi cistica<br />
(CF), si pensa che gli eterozigoti siano più resistenti agli effetti disidratanti di malattie che causano diarrea. Gli eterozigoti per HbS<br />
(l’allele dell’anemia falciforme) hanno un’aumentata resistenza alla malaria.<br />
Genotipo Frequenza prima della selezione Fitness o 1 – selezione Frequenza dopo la selezione<br />
AA p 2 1-t p 2 (1-t)<br />
Aa 2pq 1 2pq<br />
aa q 2 1-s q 2 (1-s)<br />
• t è il coefficiente di selezione contro il genotipo AA<br />
• s è il coefficiente di selezione contro il genotipo aa<br />
Dopo la selezione, le frequenze genotipiche sono cambiate. La nuova frequenza allelica viene calcolata come segue:<br />
qdopo selezione = qds = [pq + q 2 (1 - s)]/(1 - p 2 t - q 2 s)<br />
La variazione della frequenza allelica è la differenza tra q e qds, ovvero:<br />
variazione di q = [pq + q 2 (1 - s)]/(1 - p 2 t - q 2 s –q) = pq(pt – qs)/(1 - p 2 t – q 2 s)<br />
In una situazione all’equilibrio per vantaggio dell’eterozigote, la variazione della frequenza allelica da una generazione all’altra<br />
dovrebbe essere nulla. Ciò significa che deve verificarsi una delle seguenti condizioni:<br />
p = 0, o q = 0<br />
o pt – qs = 0<br />
se pt – qs = 0, allora pt = qs<br />
poiché p = 1 – q, allora qeq = t/(s + t) e peq = s/(s + t)<br />
Pertanto, all’equilibrio per vantaggio dell’eterozigote, le frequenze all’eliche sono determinate dai coefficienti di selezione.<br />
Vantaggio dell’eterozigote<br />
Nel caso della fibrosi cistica, siano s1 e s2 i coefficienti di selezione contro i genotipi FF ed ff.<br />
All’equilibrio, p x s1 = q x s2, cioè s1 = q/p x s2<br />
dato che p = 0,978; q = 0,022 e s2 = 1<br />
s1 = 0,022<br />
Fenotipi<br />
FF 1 – s1 0,978<br />
Ff 1 - 0 1,0<br />
ff 1 – s2 0<br />
La frequenza degli alleli f verrebbe mantenuta se gli eterozigoti Ff avessero, in media, 2,3% di figli in più rispetto agli omozigoti FF.<br />
25
In condizioni di panmissia e in assenza di selezione, le frequenze alleliche e le frequenze genotipiche non cambiano di<br />
generazione in generazione.<br />
N° soggetti 350<br />
Genotipo AA 180<br />
Genotipo Aa 100<br />
Genotipo aa 70<br />
Fitness AA 1,0000<br />
Fitness Aa 1,0000<br />
Fitness aa 1,0000<br />
Frequenza iniziale A 0,6571<br />
Frequenza iniziale a 0,3429<br />
In condizioni di selezione, gli alleli dannosi possono scomparire e quelli favorevoli fissarsi nella popolazione.<br />
N° soggetti 280<br />
Genotipo AA 100<br />
Genotipo Aa 150<br />
Genotipo aa 30<br />
Fitness AA 1,0000<br />
Fitness Aa 1,0000<br />
Fitness aa 0,0000<br />
Frequenza iniziale A 0,625000<br />
Frequenza iniziale a 0,375000<br />
Esempio di equilibrio bilanciato in una popolazione nella quale c’è vantaggio dell’eterozigote:<br />
N° soggetti 282<br />
Genotipo AA 100<br />
Genotipo Aa 180<br />
Genotipo aa 2<br />
Fitness AA 0,9000<br />
Fitness Aa 1,0000<br />
Fitness aa 0,0000<br />
Frequenza iniziale A 0,8156<br />
Frequenza iniziale a 0,1844<br />
26<br />
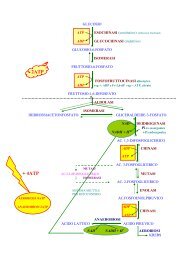
EMOGLOBINE<br />
Il 70% delle proteine nella cellula è costituito da emoglobine:<br />
• prelevano ossigeno a livello degli alveoli polmonari e lo portano ai tessuti periferici;<br />
• sono presenti nelle cellule in forma solubile.<br />
Pseudogene: gene non più attivo.<br />
Cromosoma 16 Cromosoma 11<br />
Tra transizione da emoglobina fetale a emoglobina adulta avviene bruscamente al momento della nascita.<br />
Esistono molte varianti dell’Hb che in diversa maniera riducono l’efficienza dell’emoglobina. Queste varianti vengono<br />
mantenute perché rendono il globulo rosso più resistente ad alcuni parassiti come il plasmodio della malaria.
Numero di varianti di Hb<br />
Tipo Numero<br />
Varianti della catena alfa 199<br />
Varianti della catena beta<br />
Varianti della catena gamma:<br />
335<br />
• G-gamma = 38<br />
• A-gamma = 20<br />
68<br />
• Ignote = 3<br />
• Speciali = 7<br />
Varianti della catena delta 28<br />
Varianti con 2 sostituzioni amminoacidiche:<br />
• alfa = 1<br />
• beta = 17<br />
Varianti a catene ibride 10<br />
Varianti a catene più lunghe:<br />
• al C-terminale = 9<br />
• al N-terminale = 4<br />
Varianti con delezioni (15); con inserzioni (4); con delezioni ed inserzioni (3) 22<br />
TOTALE 693<br />
Allineamento dei prodotti dei geni alfa<br />
Allineamento dei prodotti dei geni beta delle globine<br />
Al momento dello switch da emoglobina fetale a emoglobina<br />
adulta, c’è una degradazione delle catene gamma che determina l’ittero.<br />
Catena alfa dell’emoglobina<br />
• Localizzazione: 16p13.3<br />
• Dimensioni: 141 amminoacidi; 15126 Da<br />
• Subunità: eterotetramero di:<br />
• 2 catene alfa e 2 catene beta nell’emoglobina A<br />
adulta (HbA)<br />
• 2 catene alfa e 2 catene delta nell’emoglobina A2<br />
adulta (HbA2)<br />
• 2 catene alfa e 2 catene epsilon nell’emoglobina<br />
embrionale Gower-2<br />
• 2 catene alfa e 2 catene gamma nell’emoglobina<br />
fetale (HbF)<br />
• Dà il colore rosso al sangue.<br />
• Appartiene alla famiglia delle globine.<br />
Catena beta dell’emoglobina<br />
• Localizzazione: 11p15.5<br />
• Dimensioni: 146 amminoacidi; 15867 Da<br />
• Funzione: coinvolta nel trasporto dell’ossigeno dai polmoni ai vari<br />
tessuti periferici<br />
• Subunità: eterotetramero di 2 catene alfa e 2 catene beta<br />
nell’emoglobina A adulta (HbA)<br />
• Ptm: il glucosio reagisce non enzimaticamente con l’N terminale<br />
della catena beta per formare un legame chetoaminico stabile.<br />
Questo accade lentamente e in continuazione durante la vita di<br />
120 giorni del globulo rosso. Il tasso di glicosidazione aumenta nei<br />
pazienti con diabete mellito.<br />
• Ptm: S-nitrosilata; un gruppo di ossido nitrico è prima legato al<br />
Fe(II) (o ione ferro) e poi trasferito al Cys-93 per permettere la<br />
cattura dell’O2.<br />
• Appartiene alla famiglia delle globine.<br />
18<br />
13<br />
27
PRINCIPALI VARIANTI STRUTTURALI DELL’EMOGLOBINA<br />
Emoglobine con nuove proprietà fisiche<br />
HbS<br />
HbC<br />
Emoglobine instabili<br />
Hb Hammersmith<br />
Singola sostituzione nucleotidica (β 42 Phe Ser)<br />
28<br />
Varianti che causano anemie emolitiche<br />
Polimerizzazione dell’HbS deossigenata, cellule falciformi, occlusione<br />
vascolare ed emolisi: le cellule falciformi sono più suscettibili di rottura.<br />
Tendenza alla cristallizzazione della HbC ossigenata, cellule meno deformabili,<br />
blanda emolisi. Nei soggetti HbS:HbC fenotipo a cellule falciformi lieve.<br />
Hb instabile, precipitabile, emolisi e bassa affinità per O2.<br />
Hb Hyde Park<br />
Emoglobine con alterato trasporto di O2<br />
La sostituzione rende il ferro ossidato dell’eme resistente alla metemoglobina<br />
Singola sostituzione nucleotidica (β 92 His Tyr) riduttasi. Questa HbM non trasporta O2. Cianosi nei portatori.<br />
Hb Kempsey<br />
Singola sostituzione nucleotidica (β 99 Asp Asn)<br />
La sostituzione mantiene la Hb nella struttura ad alta affinità per O2. Poco<br />
ossigeno ai tessuti, policitemia (se c’è un ridotto apporto di ossigeno, il midollo<br />
produce più globuli rossi<br />
Hb Kansas<br />
La sostituzione mantiene Hb nella struttura a bassa affinità per O2.<br />
Singola sostituzione nucleotidica (β 102 Asn Thr) Cianosi asintomatica nei portatori.<br />
HbE<br />
Varianti con fenotipo talassemico<br />
La mutazione porta alla sintesi di una Hb anormale e ad una sintesi<br />
Singola sostituzione nucleotidica (β 26 Glu Lys)<br />
ridotta per difetto di splicing dell’RNA. Talassemia lieve.<br />
Hb Lepore<br />
Sintesi ridotta, talassemia grave negli omozigoti o in soggetti che<br />
Crossing over ineguale tra i geni δ e b, proteina di fusione δβ,<br />
di lunghezza pari a quella di una catena non-α<br />
presentano anche alleli β-talassemici.<br />
TALASSEMIE<br />
Sono dovute ad un’alterazione quantitativa delle α o delle β globine:<br />
• α-talassemie: difetto di produzione di α-globina<br />
• β-talassemie: difetto di produzione di β-globina<br />
Normale Talassemia α Talassemia β
Crossing-over ineguale e generazione di clusters alfa con uno e con tre geni:<br />
Talassemia minor: asintomatico.<br />
Eterozigote ββ 0<br />
Eterozigote ββ +<br />
↑<br />
↓<br />
29
Talassemia intermedia: sintomatico, ma non richiede trasfusione.<br />
Due mutazioni lievi<br />
Una mutazione molto lieve + α-talassemia o persistenza di HbF<br />
Talassemia maior: sintomatologia grave, richiede<br />
trasfusioni.<br />
Omozigote β 0 β 0<br />
Eterozigote β 0 β +<br />
La mutazione dell’emoglobina E<br />
30<br />
Mutazioni nel promotore del gene β-globinico che danno origine a talassemia-β + :<br />
Questa mutazione dà origine sia ad un’anomalia quantitativa, dovuta all’attivazione di un sito donatore di splicing criptico, sia<br />
ad una qualitativa, poiché il messaggero maturo corretto contiene una lisina al posto di un acido glutammico, al codone 26. La A al<br />
codone 26 è, almeno in apparenza, sufficiente ad attivare questo sito donatore di splicing alternativo, che viene quindi utilizzato il 40%<br />
delle volte.<br />
Meccanismi molecolari responsabili di HPFH<br />
• In A sono mostrate 3 delezioni HPFH che rimuovono<br />
grandi segmenti di DNA all’estremità 3’ del cluster βglobinico,<br />
comprendente i geni dell’adulto. Tuttavia,<br />
non tutte le delezioni di questo tipo sono responsabili di<br />
HPFH, come mostrato dalle 3 mutazioni δβ-talassemia<br />
rappresentate.<br />
• In B sono indicate le localizzazioni di mutazioni<br />
(numerate rispetto al sito di capping) nel promotore dei<br />
geni G γ e A γ delle globine fetali, riscontrate in individui<br />
con HPFH (indicati con la freccia sopra la linea).<br />
Queste posizioni presumibilmente indicano la posizione<br />
di importanti sequenze di controllo, ma nella maggior<br />
parte dei casi non coinvolgono i comuni elementi del<br />
promotore (CACCC, CCAAT o TATA). La barra al di<br />
sotto della sequenza indica la posizione di una piccola<br />
delezione in un paziente, che rimuove il secondo<br />
CCAAT box.<br />
MECCANISMO CONSEGUENZA