Aldeidi e Chetoni.pdf - PianetaChimica.it
Aldeidi e Chetoni.pdf - PianetaChimica.it
Aldeidi e Chetoni.pdf - PianetaChimica.it
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
www.pianetachimica.<strong>it</strong><br />
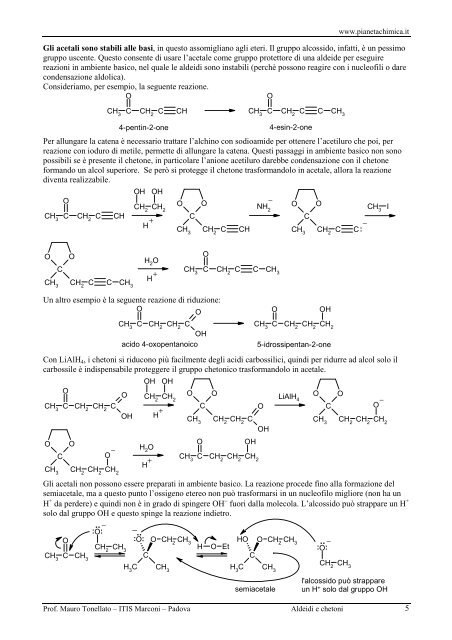
Gli acetali sono stabili alle basi, in questo assomigliano agli eteri. Il gruppo alcossido, infatti, è un pessimo<br />
gruppo uscente. Questo consente di usare l’acetale come gruppo protettore di una aldeide per eseguire<br />
reazioni in ambiente basico, nel quale le aldeidi sono instabili (perchè possono reagire con i nucleofili o dare<br />
condensazione aldolica).<br />
Consideriamo, per esempio, la seguente reazione.<br />
O<br />
O<br />
CH 3<br />
C CH 2<br />
C CH<br />
CH 3<br />
C CH 2<br />
C C<br />
CH 3<br />
4-pentin-2-one 4-esin-2-one<br />
Per allungare la catena è necessario trattare l’alchino con sodioamide per ottenere l’acetiluro che poi, per<br />
reazione con ioduro di metile, permette di allungare la catena. Questi passaggi in ambiente basico non sono<br />
possibili se è presente il chetone, in particolare l’anione acetiluro darebbe condensazione con il chetone<br />
formando un alcol superiore. Se però si protegge il chetone trasformandolo in acetale, allora la reazione<br />
diventa realizzabile.<br />
O<br />
CH 3<br />
C CH 2<br />
C CH<br />
OH<br />
OH<br />
CH 2<br />
CH 2<br />
H +<br />
O<br />
CH 3<br />
C<br />
O<br />
CH 2<br />
C CH<br />
−<br />
NH O O<br />
2<br />
CH 3<br />
I<br />
C<br />
CH 3<br />
CH 2<br />
C C: −<br />
O<br />
CH 3<br />
C<br />
O<br />
CH 2<br />
C C<br />
O<br />
H 2<br />
O<br />
CH 3<br />
C CH 2<br />
C C<br />
CH<br />
H +<br />
3<br />
CH 3<br />
Un altro esempio è la seguente reazione di riduzione:<br />
O<br />
O<br />
CH 3<br />
C CH 2<br />
CH 2<br />
C<br />
OH<br />
acido 4-oxopentanoico<br />
CH 3<br />
C CH 2<br />
CH 2<br />
CH 2<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 5<br />
O<br />
OH<br />
5-idrossipentan-2-one<br />
Con LiAlH 4 , i chetoni si riducono più facilmente degli acidi carbossilici, quindi per ridurre ad alcol solo il<br />
carbossile è indispensabile proteggere il gruppo chetonico trasformandolo in acetale.<br />
O<br />
CH 3<br />
C CH 2<br />
CH 2<br />
C<br />
O<br />
CH 3<br />
C<br />
O<br />
OH<br />
OH<br />
OH<br />
CH 2<br />
CH<br />
O O<br />
2<br />
LiAlH 4<br />
C<br />
O<br />
H + CH 3<br />
CH 2<br />
CH 2<br />
C<br />
OH<br />
O<br />
O<br />
OH<br />
− H 2<br />
O<br />
O CH 3<br />
C CH 2<br />
CH 2<br />
CH 2<br />
H +<br />
CH 2<br />
CH 2<br />
CH 2<br />
O<br />
CH 3<br />
C<br />
O<br />
O −<br />
CH 2<br />
CH 2<br />
CH 2<br />
Gli acetali non possono essere preparati in ambiente basico. La reazione procede fino alla formazione del<br />
semiacetale, ma a questo punto l’ossigeno etereo non può trasformarsi in un nucleofilo migliore (non ha un<br />
H + da perdere) e quindi non è in grado di spingere OH − fuori dalla molecola. L’alcossido può strappare un H +<br />
solo dal gruppo OH e questo spinge la reazione indietro.<br />
.. −<br />
: O:<br />
− ..<br />
O<br />
: O:<br />
O CH 2<br />
CH 3<br />
O<br />
.. −<br />
CH 2<br />
CH 3<br />
H O Et<br />
: O:<br />
CH 3<br />
C CH 3<br />
C<br />
C<br />
C H 3<br />
CH 3<br />
C H 3<br />
H O CH 2<br />
CH 3<br />
CH 2<br />
CH 3<br />
CH 3<br />
semiacetale<br />
l'alcossido può strappare<br />
un H + solo dal gruppo OH