Le leggi dei gas - I@PhT
Le leggi dei gas - I@PhT
Le leggi dei gas - I@PhT
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
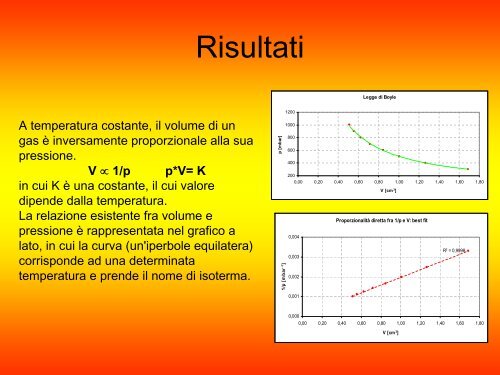
Risultati<br />
<strong>Le</strong>gge di Boyle<br />
A temperatura costante, il volume di un<br />
<strong>gas</strong> è inversamente proporzionale alla sua<br />
pressione.<br />
V ∝ 1/p p*V= K<br />
in cui K è una costante, il cui valore<br />
dipende dalla temperatura.<br />
La relazione esistente fra volume e<br />
pressione è rappresentata nel grafico a<br />
lato, in cui la curva (un'iperbole equilatera)<br />
corrisponde ad una determinata<br />
temperatura e prende il nome di isoterma.<br />
p [mbar]<br />
1/p [mbar -1 ]<br />
1200<br />
1000<br />
800<br />
600<br />
400<br />
200<br />
0,00 0,20 0,40 0,60 0,80 1,00 1,20 1,40 1,60 1,80<br />
V [cm 3 ]<br />
Proporzionalità diretta fra 1/p e V: best fit<br />
0,004<br />
R 2 = 0,9998<br />
0,003<br />
0,002<br />
0,001<br />
0,000<br />
0,00 0,20 0,40 0,60 0,80 1,00 1,20 1,40 1,60 1,80<br />
V [cm 3 ]