You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
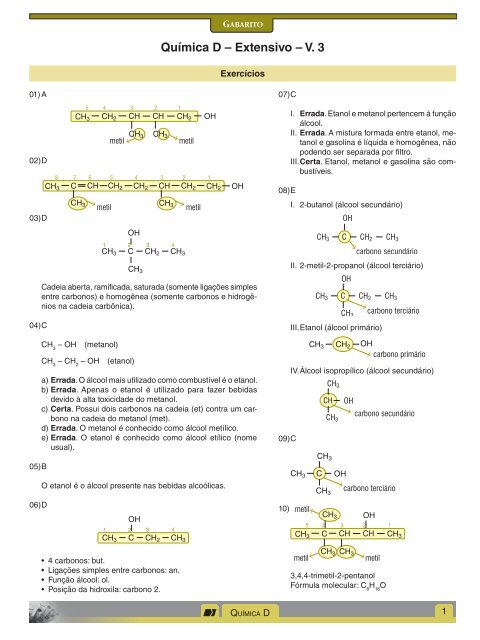
01) A<br />
02) D<br />
03) D<br />
04) C<br />
05) B<br />
06) D<br />
GABARITO<br />
<strong>Química</strong> D <strong>–</strong> <strong>Extensivo</strong> <strong>–</strong> V. 3<br />
Exercícios<br />
Cadeia aberta, ramificada, saturada (somente ligações simples<br />
entre carbonos) e homogênea (somente carbonos e hidrogênios<br />
na cadeia carbônica).<br />
CH 3 <strong>–</strong> OH (metanol)<br />
CH 3 <strong>–</strong> CH 2 <strong>–</strong> OH (etanol)<br />
a) Errada. O álcool mais utilizado como combustível é o etanol.<br />
b) Errada. Apenas o etanol é utilizado para fazer bebidas<br />
devido à alta toxicidade do metanol.<br />
c) Certa. Possui dois carbonos na cadeia (et) contra um carbono<br />
na cadeia do metanol (met).<br />
d) Errada. O metanol é conhecido como álcool metílico.<br />
e) Errada. O etanol é conhecido como álcool etílico (nome<br />
usual).<br />
O etanol é o álcool presente nas bebidas alcoólicas.<br />
• 4 carbonos: but.<br />
• Ligações simples entre carbonos: an.<br />
• Função álcool: ol.<br />
• Posição da hidroxila: carbono 2.<br />
<strong>Química</strong> D<br />
07) C<br />
08) E<br />
09) C<br />
10)<br />
I. Errada. Etanol e metanol pertencem à função<br />
álcool.<br />
II. Errada. A mistura formada entre etanol, metanol<br />
e gasolina é líquida e homogênea, não<br />
podendo ser separada por filtro.<br />
III. Certa. Etanol, metanol e gasolina são combustíveis.<br />
I. 2-butanol (álcool secundário)<br />
OH<br />
CH3 C CH2 CH3<br />
carbono secundário<br />
II. 2-metil-2-propanol (álcool terciário)<br />
OH<br />
CH3 C CH2 CH3<br />
CH3<br />
carbono terciário<br />
III. Etanol (álcool primário)<br />
CH3 CH2<br />
OH<br />
carbono primário<br />
IV. Álcool isopropílico (álcool secundário)<br />
CH3 C<br />
CH3<br />
CH OH<br />
CH3<br />
carbono secundário<br />
CH3<br />
CH3<br />
OH<br />
carbono terciário<br />
3,4,4-trimetil-2-pentanol<br />
Fórmula molecular: C 8 H 18 O<br />
1
11) B<br />
12) C<br />
13) C<br />
OH fenol<br />
CH3<br />
GABARITO<br />
I. Certa.<br />
II. Errada. A cadeia é alifática (aberta), porém é<br />
homogênea (sem heteroátomo entre carbonos).<br />
III. Errada. Tem apenas quatro átomos de carbono secundários<br />
(ligados a outros dois carbonos).<br />
IV. Certa. A cadeia principal possui duas duplas ligações<br />
entre carbonos.<br />
Carbono quiral é o carbono assimétrico, no centro da<br />
cadeia. A hidroxila presa a esse carbono que é saturado<br />
(somente simples ligações) caracteriza a função álcool. Os<br />
carbonos ligados ao anel caracterizariam a função fenol.<br />
14) 01<br />
HO<br />
HO<br />
OH<br />
C CH2NH CH3<br />
H<br />
álcool<br />
01. Certa. Na nomenclatura usual, chama-se a hidroxila de<br />
álcool e a cadeia carbônica como se fosse um radical<br />
ligado a hidroxila, utilizando a terminação “ílico”.<br />
H<br />
H H H<br />
C<br />
H<br />
C C<br />
OH<br />
H<br />
H<br />
propanol 2<br />
álcool isipropílico<br />
02. Errada. O álcool metílico é o metanol.<br />
H<br />
H C OH metanol<br />
H<br />
alcool metílico<br />
carbinol<br />
2 <strong>Química</strong> D<br />
04. Errada. Existem carbonos primários.<br />
H<br />
H<br />
H<br />
H<br />
C<br />
C<br />
C<br />
H<br />
prim.<br />
sec.<br />
prim.<br />
OH<br />
OH<br />
OH<br />
glicerina (propanotriol)<br />
08. Errada. O nome oficial do álcool propargílico é<br />
2-propinol.<br />
16. Errada. O álcool alílico (2-propenol) possui dois<br />
carbonos insaturados.<br />
H<br />
H<br />
ins. ins.<br />
C<br />
H<br />
H<br />
C C<br />
H<br />
OH<br />
32. Errada. O álcool benzílico é um álcool primário<br />
(hidroxila presa a carbono primário).<br />
H<br />
C OH<br />
primário<br />
H<br />
álcool benzílico<br />
64. Errada. Se a hidroxila estivesse diretamente<br />
ligada ao núcleo benzênico, seria um fenol, e<br />
não álcool.<br />
H<br />
C<br />
H<br />
álcool benzílico<br />
OH
15) 08<br />
etil C C C C metil<br />
C 5<br />
C<br />
C 4<br />
carbonol<br />
OH<br />
C C<br />
isopropil<br />
OH<br />
C 3<br />
C<br />
C 1<br />
C C2 2,3-dimetil-3-pentanol<br />
16) O álcool utilizado nas bebidas é o etanol, todavia<br />
o álcool de nome metanol possui alta toxicidade,<br />
podendo causar cegueira, e provavelmente é o<br />
contaminante da bebida ingerida.<br />
17) Incorreta. Com a combustão incompleta, mais<br />
monóxido de carbono é eliminado (CO), porém, na<br />
combustão completa, o produto principal é dióxido<br />
de carbono (CO 2 ), que é menos poluente. Todavia,<br />
em um ou outro tipo de combustão, sempre haverá a<br />
eliminação de resíduos e até mesmo vapor d’água.<br />
A possibilidade de não lançar qualquer substância<br />
química na atmosfera é o erro da questão.<br />
18) D<br />
I. Certa. O metanol é muito mais perigoso e por<br />
isso seu uso é evitado na linha comercial, porém,<br />
pode ser usado como combustível.<br />
II. Errada. O metanol não pode ser usado em bebidas<br />
devido a sua alta toxicidade.<br />
III. Certa. O metanol atualmente é obtido por<br />
processo industrial a partir de um gás de<br />
síntese, hidrogênio e monóxido de carbono<br />
(CO + H 2 → H 3 C <strong>–</strong> OH), ou do carvão.<br />
IV. Certa. 2H 3 C <strong>–</strong> OH + 3O 2 → 2CO 2 + 4H 2 O<br />
V. Errada. Apenas etanol pode ser produzido a<br />
partir da cana-de-açúcar.<br />
19) a) Uma maneira simples de verificar o combustível<br />
é medir a sua densidade. Espera-se que o álcool<br />
hidratado tenha densidade maior que a mistura<br />
álcool/gasolina.<br />
b) Etanol: C 2 H 6 O<br />
Água: H 2 O<br />
(álcool hidratado)<br />
20) a) Não se trata de uma “fervura” como a causada<br />
pelo calor, mas sim da formação de bolhas de gás<br />
carbônico que podem ser vistas sendo liberadas<br />
pela reação de fermentação:<br />
C 12 H 22 O 11 + H 2 O → 4C 2 H 5 OH + 4CO 2<br />
GABARITO<br />
<strong>Química</strong> D<br />
b) I. C 12 H 22 O 11 + H 2 O → C 6 H 12 O 6 + C 6 H 12 O 6<br />
sacarose glicose frutose<br />
21) 74,3 Kg<br />
22) C<br />
II. C 6 H 12 O 6 → 2C 2 H 6 O + 2CO 2<br />
açúcar etanol gás carbônico<br />
Cálculo da massa de etanol correspondente a 50 L:<br />
Etanol: massa volume<br />
0,8 g <strong>–</strong><strong>–</strong><strong>–</strong> 1 cm 3 = 1 mL<br />
X <strong>–</strong><strong>–</strong><strong>–</strong> 50.000 mL (50 L)<br />
X = 40.000 g = 40 Kg<br />
1C 12 H 22 O 11 → 4C 2 H 6 O<br />
sacarose etanol<br />
342 g <strong>–</strong><strong>–</strong><strong>–</strong> 4,46 g (padrão)<br />
YK g <strong>–</strong><strong>–</strong><strong>–</strong> 40 Kg<br />
Y = 74,3 Kg<br />
CH3<br />
CH3<br />
H3C<br />
CH2<br />
CH2<br />
CH3<br />
C<br />
OH<br />
CH3<br />
OH etanol (mm = 46 )<br />
CH2 CH2<br />
OH<br />
t-butanol (mm = 74 )<br />
n-butanol (mm = 74 )<br />
Cada uma das três estruturas possui uma hidroxila. Segue<br />
que a diferença no ponto de ebulição será dada pela cadeia<br />
carbônica. Quanto maior a cadeia, maior o ponto de<br />
ebulição, pois a molécula terá maior massa. Sendo assim,<br />
o de menor ponto de ebulição é o etanol (menor massa<br />
molecular). Entre n-butanol e t-butanol, terá maior ponto<br />
de ebulição o n-butanol. Isso ocorre pois haverá mais pontos<br />
de contato entre duas moléculas de n-butanol do que<br />
entre duas moléculas de t-butanol. Havendo mais pontos<br />
de contato, as forças intermoleculares serão mais intensas,<br />
dificultando a evaporação (aumento no ponto de ebulição).<br />
OH<br />
CH3 CH2 CH2 CH2 OH<br />
H3C C CH3<br />
CH3 CH2 CH2 CH2 OH<br />
CH3<br />
H3C<br />
CH3<br />
C CH3<br />
OH<br />
3
23) C<br />
24) B<br />
25) C<br />
26) B<br />
27) A<br />
28) E<br />
CH 3 <strong>–</strong> CH 2 <strong>–</strong> CH 2 <strong>–</strong> OH<br />
Propanol (C 3 H 7 OH)<br />
álcool, C 10 H 20 O<br />
2CH 3 OH + 3O 2 → 2CO 2 + 4H 2 O<br />
2 mols <strong>–</strong><strong>–</strong><strong>–</strong> 2 mols<br />
5 mols <strong>–</strong><strong>–</strong><strong>–</strong> x<br />
x = 5 mols<br />
O combustível dissolvente e componente de bebidas<br />
é o etanol. É dissolvente pois pode dissolver tanto a<br />
gasolina quanto a água, estando presente nos dois<br />
combustíveis (gasolina e álcool hidratado). Isso ocorre<br />
pois a molécula de etanol possui uma região polar<br />
(que pode dissolver água) e uma região apolar (que<br />
pode dissolver gasolina).<br />
CH3 C<br />
CH3<br />
CH3<br />
OH<br />
terc butil<br />
Quanto maior o número de carbonos na cadeia, maior<br />
é o ponto de fusão e ebulição pois a molécula terá<br />
maior massa.<br />
PF↑ PE↑ nº de C↑<br />
1) etanol (2 C) <strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong> 78 °C (B)<br />
2) 1-butanol (4 C) <strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong> 118 °C (D)<br />
3) 1-propanol (3 C) <strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong> 97 °C (C)<br />
4) metanol (1 C) <strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong><strong>–</strong> 65 °C (A)<br />
GABARITO<br />
4 <strong>Química</strong> D<br />
29) E<br />
Etanol: dois carbonos.<br />
1-propanol: três carbonos.<br />
Hexano: seis carbonos.<br />
Heptano: sete carbonos.<br />
Solubilidade:<br />
A água é solvente polar e tornará miscível (solúvel) um<br />
composto também polar (semelhante dissolve semelhante).<br />
O etanol e o 1-propanol são polares pois têm a hidroxila<br />
e por isso dissolvem na água. O hexano e o heptano são<br />
apolares e por isso não se dissolvem em água.<br />
Ponto de ebulição:<br />
↑ nº de carbonos ↑ PE<br />
I. Composto insolúvel e de menor ponto de ebulição:<br />
hexano.<br />
II. Composto solúvel e de menor ponto de ebulição: etanol.<br />
III. Composto solúvel e de maior ponto de ebulição: 1-propanol.<br />
IV. Composto insolúvel e de maior ponto de ebulição:<br />
heptano.<br />
30) 49<br />
Enol possui a hidroxila ligada a um carbono insaturado<br />
(de dupla ligação).<br />
H<br />
1. Certa. C C OH<br />
H<br />
H<br />
31) A<br />
02. Errada. É um álcool (hidroxila em carbono saturado).<br />
04. Errada. É um fenol (hidroxila em anel aromático).<br />
08. Errada. É um álcool (hidroxila em carbono saturado).<br />
H<br />
16. Certa. H C C C OH<br />
H<br />
H<br />
32. Certa. H C C C H<br />
H<br />
H<br />
OH<br />
H<br />
H<br />
64. Errada. É um álcool (hidroxila em carbono saturado).<br />
OH<br />
CH3<br />
o cresol (C HO)<br />
7 8
32) B<br />
33) C<br />
x<br />
y<br />
Posição para (1,4)<br />
OH<br />
Cℓ<br />
fenol<br />
monocloro (1 cloro)<br />
fenol álcool<br />
H OH H OH<br />
H H H<br />
H<br />
H H H<br />
H<br />
H H H H<br />
34) Faltam dados.<br />
35) C<br />
36) A<br />
a) Errada. O fenol é insaturado (duplas ligações) e<br />
aromático.<br />
b) Errada. C 6 H 5 OH + 7O 2 → 6CO 2 + 3H 2 O<br />
c) Certa. ←<br />
Na reação inversa, o ânion C 6 H 5 O - recebe o cátion<br />
H + (base de Brönsted-Lowry).<br />
d) Errada. O fenol tem caráter ácido.<br />
e) Errada. A água solubiliza pequena quantidade de<br />
fenol. Uma solução em proporção 1:1 de água e fenol<br />
será heterogênea.<br />
I.<br />
HO<br />
HO<br />
CH2CH2NH2 Dopamina: possui as funções fenol e amina.<br />
HO<br />
CH2CH2NH2 II.<br />
N<br />
H<br />
Serotonina: possui as funções fenol e amina.<br />
GABARITO<br />
III.<br />
37) D<br />
38) A<br />
39) C<br />
40)<br />
<strong>Química</strong> D<br />
HO<br />
HO<br />
CHCH2NH2 OH<br />
Norepinefrina: possui as funções fenol, amina e<br />
álcool.<br />
* Optou-se pela representação simplificada devido ao<br />
tamanho da cadeia. Octil (8), dodec (12).<br />
a) Errada. Pertence aos álcoois.<br />
b) Errada. É um álcool primário (hidroxila ligada a carbono<br />
primário).<br />
c) Errada. É um álcool de cadeia alifática (aberta).<br />
d) Certa. Isso poderia ser verificado no nome “1-ol.<br />
1, 2, 3-propanotriol<br />
Álcool primário: hidroxila ligada a carbono primário.<br />
Carbono terciário: carbono ligado a outros três carbonos.<br />
OBS: I é aldeído, II é fenol, IV é álcool terciário, V é<br />
álcool secundário.<br />
a) A molécula pertence à função fenol (hidroxila ligada<br />
ao anel aromático).<br />
b) o-hidroximetilbenzeno ou 1,2-hidroximetilbenzeno.<br />
c) Hibridização sp 2 (carbonos que fazem dupla ligação).<br />
5
41) E<br />
Os fenóis possuem diversas aplicações práticas tais<br />
como:<br />
desinfetantes (fenóis e cresóis);<br />
preparação de resinas e polímeros, como a baquelite;<br />
preparação do ácido pícrico, usado no preparo de<br />
explosivos;<br />
síntese da aspirina (AAS) e de outros medicamentos;<br />
catalisadores;<br />
quinonas <strong>–</strong> entre os dihidroxifenóis, a hidroquinona<br />
é a mais importante. A partir dela se produzem as<br />
quinonas, que são compostos coloridos, variando do<br />
amarelo ao vermelho.<br />
42) 20<br />
H3C<br />
43) E<br />
NO2<br />
OH<br />
OH<br />
fenol CH3 fenol<br />
CH3<br />
fenol<br />
CH3 OH<br />
CH3<br />
Dois são álcoois e três são fenóis.<br />
OH<br />
OH<br />
CH<br />
álcool<br />
difenol<br />
CH3<br />
OH<br />
CH3<br />
OH<br />
álcool<br />
Um difenol possui duas hidroxilas presas ao anel aromático.<br />
GABARITO<br />
6 <strong>Química</strong> D<br />
44) E<br />
45) C<br />
fenol<br />
OH<br />
CH2<br />
O<br />
éter<br />
C<br />
H<br />
H<br />
C<br />
H<br />
H<br />
CH2<br />
dupla<br />
(ins.)<br />
a) Certa. Seis no anel mais dois na parte inferior.<br />
b) Certa. Possui duplas ligações entre carbonos.<br />
c) Certa.<br />
d) Certa.<br />
e) Errada. Não aparece a função álcool.<br />
CH3<br />
OH<br />
* Todas as outras opções apresentam a função álcool.<br />
46) A<br />
47) C<br />
HC<br />
3<br />
HC<br />
3<br />
CH3<br />
O<br />
éter<br />
O<br />
OH<br />
OH<br />
fenol<br />
ácido carboxílico<br />
H3CO OCH3<br />
éter éter
48) D<br />
49) B<br />
50) C<br />
HO<br />
HO<br />
fenol<br />
cinamaldeído<br />
(aldeído)<br />
51) C<br />
fenol<br />
HO<br />
ácido carboxílico<br />
O COH 2<br />
O<br />
éster<br />
HO<br />
éter<br />
O<br />
O CH3O<br />
O<br />
HO<br />
OCH3<br />
vanilina<br />
(fenol, éter, aldeído)<br />
OH<br />
OH<br />
fenol<br />
OH<br />
fenol<br />
álcool<br />
OH<br />
OH<br />
eugenol<br />
(fenol, éter)<br />
a) Errada. Dois compostos são éteres aromáticos.<br />
b) Errada. Dois compostos são aldeídos aromáticos.<br />
c) Certa.<br />
d) Errada. É um aldeído aromático.<br />
e) Errada. Nenhum é alceno.<br />
A função hidrocarboneto não possui oxigênio. Já as<br />
funções éster, fenol e ácido carboxílico possuem, além<br />
de hidrogênio e carbono, o oxigênio.<br />
52) a) O 2 (oxigênio).<br />
b) CH 3 <strong>–</strong> O <strong>–</strong> CH 3 (éter etílico).<br />
GABARITO<br />
53) D<br />
54) D<br />
55) C<br />
56) C<br />
57) D<br />
<strong>Química</strong> D<br />
éter metil fenílico<br />
O CH3<br />
a) Errada. Possui quatro carbonos primários e dois<br />
secundários.<br />
b) Errada. Não há carbono terciário.<br />
c) Errada. A cadeia é heterogênea.<br />
d) Certa.<br />
e) Errada. O grupo funcional caracteriza um éter.<br />
Um éter simétrico possui radicais iguais ligados ao<br />
oxigênio.<br />
HC<br />
3<br />
HC<br />
3<br />
éter<br />
O<br />
O<br />
éter<br />
H H<br />
O<br />
éter<br />
CH2 CH2<br />
CH3<br />
NH2<br />
amina<br />
H H<br />
éter<br />
H H<br />
H C C O C C H<br />
Éter etílico é um poderoso anestésico.<br />
H<br />
H<br />
7
58) 63<br />
⎧etoxietano<br />
⎪<br />
⎪<br />
éter etílico<br />
⎪solvente<br />
de tint as<br />
⎨<br />
⎪anestésico<br />
⎪CH<br />
4 10O<br />
⎪<br />
⎩cadeiaheterogênea<br />
59) 83<br />
H<br />
H<br />
H<br />
C<br />
C<br />
H H<br />
HC<br />
3<br />
CH3<br />
CH3<br />
C<br />
C<br />
C<br />
GABARITO<br />
8 <strong>Química</strong> D<br />
C<br />
H<br />
O H<br />
H<br />
C C<br />
O<br />
éter<br />
C<br />
C<br />
C<br />
H<br />
T.H.C<br />
(ionizável)<br />
fenol<br />
H +<br />
C<br />
C<br />
H<br />
01. Certa.<br />
02. Certa. Nome oficial.<br />
04. Certa. Nome usual.<br />
08. Certa.<br />
16. Certa.<br />
32. Certa.<br />
64. Errada. É de cadeia heterocíclica ou heterogênea.<br />
CH2 CH2 CH2<br />
n-pentil<br />
CH2<br />
01. Errada. Possui apenas as funções fenol e éter.<br />
02. Errada.<br />
04. Certa.<br />
08. Certa.<br />
16. Errada.<br />
32. Certa. O hidrogênio do fenol é ácido devido ao fenômeno de ressonância do anel.<br />
64. Errada.<br />
CH3