You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
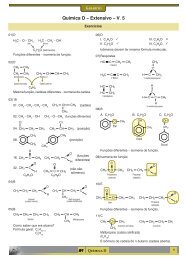
15) 08<br />
etil C C C C metil<br />
C 5<br />
C<br />
C 4<br />
carbonol<br />
OH<br />
C C<br />
isopropil<br />
OH<br />
C 3<br />
C<br />
C 1<br />
C C2 2,3-dimetil-3-pentanol<br />
16) O álcool utilizado nas bebidas é o etanol, todavia<br />
o álcool de nome metanol possui alta toxicidade,<br />
podendo causar cegueira, e provavelmente é o<br />
contaminante da bebida ingerida.<br />
17) Incorreta. Com a combustão incompleta, mais<br />
monóxido de carbono é eliminado (CO), porém, na<br />
combustão completa, o produto principal é dióxido<br />
de carbono (CO 2 ), que é menos poluente. Todavia,<br />
em um ou outro tipo de combustão, sempre haverá a<br />
eliminação de resíduos e até mesmo vapor d’água.<br />
A possibilidade de não lançar qualquer substância<br />
química na atmosfera é o erro da questão.<br />
18) D<br />
I. Certa. O metanol é muito mais perigoso e por<br />
isso seu uso é evitado na linha comercial, porém,<br />
pode ser usado como combustível.<br />
II. Errada. O metanol não pode ser usado em bebidas<br />
devido a sua alta toxicidade.<br />
III. Certa. O metanol atualmente é obtido por<br />
processo industrial a partir de um gás de<br />
síntese, hidrogênio e monóxido de carbono<br />
(CO + H 2 → H 3 C <strong>–</strong> OH), ou do carvão.<br />
IV. Certa. 2H 3 C <strong>–</strong> OH + 3O 2 → 2CO 2 + 4H 2 O<br />
V. Errada. Apenas etanol pode ser produzido a<br />
partir da cana-de-açúcar.<br />
19) a) Uma maneira simples de verificar o combustível<br />
é medir a sua densidade. Espera-se que o álcool<br />
hidratado tenha densidade maior que a mistura<br />
álcool/gasolina.<br />
b) Etanol: C 2 H 6 O<br />
Água: H 2 O<br />
(álcool hidratado)<br />
20) a) Não se trata de uma “fervura” como a causada<br />
pelo calor, mas sim da formação de bolhas de gás<br />
carbônico que podem ser vistas sendo liberadas<br />
pela reação de fermentação:<br />
C 12 H 22 O 11 + H 2 O → 4C 2 H 5 OH + 4CO 2<br />
GABARITO<br />
<strong>Química</strong> D<br />
b) I. C 12 H 22 O 11 + H 2 O → C 6 H 12 O 6 + C 6 H 12 O 6<br />
sacarose glicose frutose<br />
21) 74,3 Kg<br />
22) C<br />
II. C 6 H 12 O 6 → 2C 2 H 6 O + 2CO 2<br />
açúcar etanol gás carbônico<br />
Cálculo da massa de etanol correspondente a 50 L:<br />
Etanol: massa volume<br />
0,8 g <strong>–</strong><strong>–</strong><strong>–</strong> 1 cm 3 = 1 mL<br />
X <strong>–</strong><strong>–</strong><strong>–</strong> 50.000 mL (50 L)<br />
X = 40.000 g = 40 Kg<br />
1C 12 H 22 O 11 → 4C 2 H 6 O<br />
sacarose etanol<br />
342 g <strong>–</strong><strong>–</strong><strong>–</strong> 4,46 g (padrão)<br />
YK g <strong>–</strong><strong>–</strong><strong>–</strong> 40 Kg<br />
Y = 74,3 Kg<br />
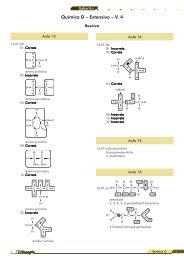
CH3<br />
CH3<br />
H3C<br />
CH2<br />
CH2<br />
CH3<br />
C<br />
OH<br />
CH3<br />
OH etanol (mm = 46 )<br />
CH2 CH2<br />
OH<br />
t-butanol (mm = 74 )<br />
n-butanol (mm = 74 )<br />
Cada uma das três estruturas possui uma hidroxila. Segue<br />
que a diferença no ponto de ebulição será dada pela cadeia<br />
carbônica. Quanto maior a cadeia, maior o ponto de<br />
ebulição, pois a molécula terá maior massa. Sendo assim,<br />
o de menor ponto de ebulição é o etanol (menor massa<br />
molecular). Entre n-butanol e t-butanol, terá maior ponto<br />
de ebulição o n-butanol. Isso ocorre pois haverá mais pontos<br />
de contato entre duas moléculas de n-butanol do que<br />
entre duas moléculas de t-butanol. Havendo mais pontos<br />
de contato, as forças intermoleculares serão mais intensas,<br />
dificultando a evaporação (aumento no ponto de ebulição).<br />
OH<br />
CH3 CH2 CH2 CH2 OH<br />
H3C C CH3<br />
CH3 CH2 CH2 CH2 OH<br />
CH3<br />
H3C<br />
CH3<br />
C CH3<br />
OH<br />
3