ünite 1 maddenin yapısı ve özellikleri
ünite 1 maddenin yapısı ve özellikleri
ünite 1 maddenin yapısı ve özellikleri
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
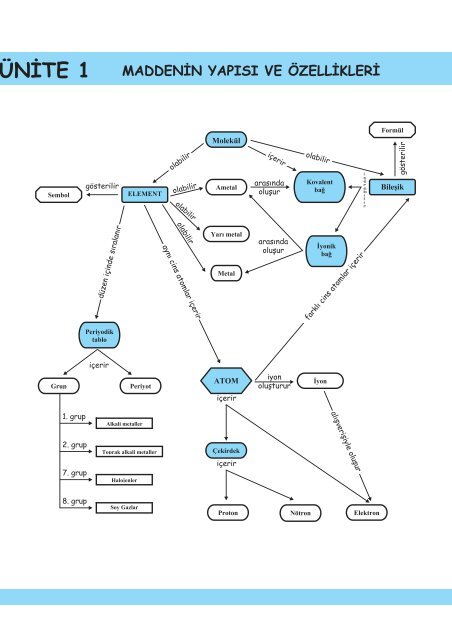
NİTE 1<br />
MADDENİN YAPISI VE ÖZELLİKLERİ<br />
gösterilir<br />
olabilir<br />
olabilir<br />
olabilir<br />
içerir<br />
arasında<br />
oluşur<br />
olabilir<br />
i<br />
ç<br />
e<br />
r<br />
e<br />
b<br />
i<br />
l<br />
i<br />
r<br />
gösterilir<br />
düzen içinde sıralanır<br />
olabilir<br />
aynı cins atomlar içerir<br />
arasında<br />
oluşur<br />
farklı cins atomlar içerir<br />
içerir<br />
içerir<br />
iyon<br />
oluşturur<br />
1. grup<br />
alış<strong>ve</strong>rişiyle oluşur<br />
2. grup<br />
7. grup<br />
içerir<br />
8. grup<br />
Soy Gazlar
1<br />
Giriş Etkinlikleri<br />
Atomun boyutu<br />
Yandaki resimler<br />
dizisini inceledikten sonra<br />
atomun büyüklüğü<br />
hakkındaki düşüncelerinizi<br />
öğretmeninizle <strong>ve</strong><br />
arkadaşlarınızla tartışınız.<br />
Tartışmanın sonuçlarını<br />
defterinize not ediniz.<br />
Ünite sonunda sonuçları<br />
kısa bir tartışma ile gözden<br />
geçiriniz.<br />
Virüs<br />
Sabun molekülü<br />
(50 atomdan çok)<br />
Bütün atomların çapı<br />
1 nanometreden küçüktür.<br />
Orta büyüklükte<br />
bir köpek<br />
Tırnak<br />
Toplu iğne başı<br />
Bakteri<br />
Kırmızı kan hücresi<br />
(Alvuyar)<br />
Kılcal damarlar<br />
A<br />
B<br />
Mum yanarken A <strong>ve</strong> B noktalarında değişimler<br />
meydana geliyor.Söz konusu değişimler sizce ne tür<br />
değişimlerdir. Arkadaşlarınızla tartışınız <strong>ve</strong><br />
düşüncelerinizi not alınız. Ünite sonunda notlarınızı<br />
tekrar gözden geçiriniz.<br />
Bir demir çiviyi demirin özeliğini gösteren en<br />
küçük parçalara bölseydiniz ne elde ederdiniz?<br />
Su gibi diğer maddeleri de özeliklerini gösteren<br />
en küçük parçalara bölmeniz mümkün olsaydı aynı<br />
sonucu elde eder miydiniz? Arkadaşlarınızla<br />
tartışınız, not alınız <strong>ve</strong> notlarınızı <strong>ünite</strong> sonunda<br />
yeniden gözden geçiriniz.<br />
2
MADDENİN YAPISI VE ÖZELİKLERİ<br />
Maddenin Yapısı <strong>ve</strong> Özellikleri<br />
Atomlar çok çok küçük olduklarından kimse onları çok güçlü bir mikroskopla bile göremez.<br />
Elektron mikrografikleri milyonlarca atomun birleşerek meydana getirdiği büyük molekülleri gösterir.<br />
Elektron mikrografikleri Büyük Çin Setti'nin uzaydan çekilmiş fotoğrafına benzetilebilir. Fotoğrafta<br />
Çin Setti duvarını görebilirsiniz; fakat duvarı meydana getiren taşları göremezsiniz.<br />
Grafitin elektron mikrografiğinden düzgün örgülü<br />
yapıya sahip karbon atomlarının varlığı anlaşılır.<br />
Büyük Çin Setti<br />
Yaklaşık 2400 yıl önce eski Yunanlı filozof Democritus bir madde<br />
sonsuza dek küçük parçalara bölünürse en sonunda o <strong>maddenin</strong> en küçük<br />
parçacığının elde edilebileceğini ileri sürdü. Atom adı Yunanca<br />
bölünemeyen anlamına gelen ”atomos”tan gelir.<br />
Democritus'un görüşü metaller gibi basit maddelerin yapılarının<br />
açıklanmasında günümüzdeki modern atom teorisi ile uyuşur.<br />
Demir çivi demir<br />
atomlarından oluşur.<br />
Diğer eski Yunanlı filozoflardan Plato <strong>ve</strong> Aristo o dönemde<br />
Demecritus'un fikrini kabul etmemişlerdi.<br />
Gerçekten de eski<br />
yunanlı bilim insanlarının o dönemde atom hakkında herhangi bir<br />
deney yapmadan fikir ileri sürmeleri günümüz bilim insanlarına çok<br />
etkileyici gelmektedir. Daha sonraları ise bilim, atom konusunda<br />
2000 yıl gibi uzun bir süre bilim insanlarının gündemi dışında kaldı<br />
ta ki İngiliz bilim insanı John Dalton (1766-1844) ileri sürdüğü<br />
atom teorisini açıklayıncaya kadar.<br />
Ünitede geçmişten günümüze kadar ortaya çıkan atom<br />
teorilerini <strong>ve</strong> atomun <strong>yapısı</strong> hakkındaki bilgileri öğrenerek<br />
atomların elektron alarak, <strong>ve</strong>rerek <strong>ve</strong>ya ortaklayarak<br />
meydanagetirdiği yapılar hakkında bilgi sahibi olacağız.<br />
Demecritus<br />
3
1 SON ÜÇ ASIRDA ATOM FİKRİ<br />
John Dalton<br />
atom modeli<br />
J.J. Thomson<br />
atom modeli<br />
Bohr atom<br />
modeli<br />
Günümüzde kullanılan<br />
atom modeli<br />
Dalton, eski Yunanlı filozof Democritus'un<br />
fikrinden yola çıkarak yaptığı deneyler<br />
sonucunda atomu içi boş bir küreye benzetmişti.<br />
Günümüzde kimya derslerinde kullandığımız katlı<br />
oranlar kanununu <strong>ve</strong> sabit oranlar kanununu<br />
kullanarak 1807'de Atom Teorisini ileri sürdü.<br />
Teori, elementler <strong>ve</strong> bileşikler hakkında<br />
aşağıdaki bilgileri içermekteydi.<br />
Tüm maddeler atomlardan oluşur.<br />
Aynı cins elementlerin atomları<br />
birbiriyle tamamen aynıdır.<br />
Farklı cins elementlerin , atomları da<br />
farklıdır.<br />
Kimyasal tepkimelerde atomlar bir<br />
bütün olarak davranır. Atomlar<br />
parçalanamaz <strong>ve</strong> yeniden oluşturulamaz.<br />
Atomlar belirli oranlarda birleşerek<br />
bileşikleri oluştururlar.<br />
Dalton'dan sonra J.J.Thomson atomla ilgili<br />
teorisinde (1897) elektronu keşfetti <strong>ve</strong> atomun<br />
pozitif bir küreden oluştuğunu <strong>ve</strong> elektronların<br />
bu küre içerisinde gelişigüzel dağıldığını ileri<br />
sürdü. Teorisini açıklarken de atomu üzümlü bir<br />
keke, elektronları ise bu kek içerisinde<br />
Çekirdeği proton <strong>ve</strong><br />
nötronlar oluşturur.<br />
Demecritus tüm maddelerin<br />
atomlardan yapıldığını ileri sürdü.<br />
John Dalton atom teorisi aynı cins<br />
elementlerin atomları aynıdır. Farklı<br />
cins elementler birleşince bileşikleri<br />
oluşturur.<br />
J.J. Thomson elektronu buldu.<br />
Ernest Rutherford protonu keşfetti.<br />
Ernest Rutherford çekirdeği keşfetti.<br />
Niels Bohr elektronların çekirdeğin<br />
etrafında belirli enerji seviyelerinde<br />
hareket ettiğini ileri sürdü.<br />
James Chadwick nötronların<br />
varlığını ispatladı.<br />
gelişigüzel dağılmış üzümlere benzetti. Oxford üni<strong>ve</strong>rsitesinde J.J. Thomson'ın<br />
asistanı olan Ernest Rutherford, Thomson'ın teorisini desteklemek için yaptığı<br />
deneyde atomun bir çekirdeğinin olduğunu keşfetti. Çekirdeğin <strong>ve</strong> atomun çapını<br />
kıyaslamak için de ünlü benzetmesini yaptı. Bir bezelye tanesi bir atomun<br />
çekirdeği olarak kabul edilirse <strong>ve</strong> bir stadyum ortasına yerleştirilirse, tribünlerde<br />
dolaşan sinekler de atomun hacmini belirleyen elektronlar olarak kabul edilebilir.<br />
Rutherford modeli merkezinde çekirdek bulunan elektronların gezegenler gibi<br />
dolandığı bir daire gibi de düşünülebilir.<br />
1913 yılında Danimarkalı fizikci Niels Bohr atom modelinde elektronların<br />
çekirdeğin etrafında belirli enerji seviyelerinde haraket ettiğini ileri sürdü. Bohr<br />
Modeli, aynı yörüngede birden çok gezegen bulunan güneş sistemine benzetilebilir.1932yılında ise<br />
James Chadwick nötronların varlığını ispatladı.<br />
Günümüzde kabul edilen Modern Atom Teorisi ise atomu elektron bulutuna benzetmektedir. Bu<br />
durum lambanın etrafında gelişigüzel dönen sineklerin oluşturduğu bir küreye benzetilebilir. Eski atom<br />
modelleri günümüzde geçerli olan birçok ilkeyi içerdiğinden halen kullanılır. Örneğin kitabımızda atom<br />
modeli, Bohr Atom Modeline göre çizilmiştir <strong>ve</strong> <strong>ünite</strong>de göreceğimiz iyon oluşumunu da kolayca<br />
açıklayan modeldir.<br />
400 BC<br />
1807<br />
1897<br />
1909<br />
1911<br />
1913<br />
1932<br />
Çekirdeğin<br />
etrafındaki elektronlar<br />
4
Maddenin Yapısı <strong>ve</strong> Özellikleri<br />
1.1 A - Atomun İçi <strong>ve</strong> Dışı<br />
Bir elementin diğerine göre farklı özelikler göstermesinin nedeni nedir?<br />
Yüzyıllardır biliminsanları atomun en küçük parçacık olduğunu düşünüyordu. Daha sonraları ise<br />
atomun temel tanecikleri olan proton, nötron <strong>ve</strong> elektronlar keşfedildi. Her elementin kendine özgü<br />
proton, nötron <strong>ve</strong> elektron sayıları vardır. Böylece her element bir diğerine göre farklı özelikler<br />
gösterir.<br />
Helyum atomu<br />
Sodyum atomu<br />
Potasyum atomu<br />
Proton Sayısı<br />
2<br />
11<br />
19<br />
Nötron Sayısı<br />
2<br />
12<br />
20<br />
Elektron Sayısı<br />
2<br />
11<br />
19<br />
M<br />
L<br />
K<br />
proton <strong>ve</strong> nötronlar çekirdekte<br />
bulunur.<br />
çekirdek<br />
elektron bulutu<br />
elektronlar belirli enerji<br />
seviyelerinde bulunur.<br />
Atom<br />
Elektronun kütlesi çekirdekte bulunan proton <strong>ve</strong> nötronların kütlesine oranla yok denecek<br />
kadar azdır . Bir atomun kütlesini hemen hemen çekirdek oluşturur. Çekirdekteki parçacıklar arasında<br />
başka yerde göremediğimiz özel çekim kuv<strong>ve</strong>tleri vardır. Çekirdek <strong>ve</strong> elektronların bulunduğu enerji<br />
seviyeleri(katmanlar) arasında çok büyük bir boşluk vardır.<br />
Aşağıdaki tablo, atomu meydana getiren parçacıkların yük <strong>ve</strong> kütlesini gösterir.<br />
Tanecik<br />
Proton<br />
Nötron<br />
Elektron<br />
Yük<br />
+1<br />
0<br />
-1<br />
Kütle (Atom kütle birimi)<br />
1<br />
1<br />
0(1/1840)<br />
Proton <strong>ve</strong> nötronların kütlesi hemen hemen aynıdır.<br />
Elektronlar o kadar hafiftir ki kütlesini sıfır kabul<br />
edebiliriz. Yaklaşık 1840 tane elektronun kütlesi bir nötron<br />
<strong>ve</strong>ya protonun kütlesine denk gelir.<br />
1-Atomun temel tanecikleri hangileridir?<br />
2-Atomun çekirdeğinde hangi parçacıklar bulunur?<br />
3-Elektronlar atomun neresinde bulunur?<br />
Araştır: Proton, nötron <strong>ve</strong> elektronların gerçek kütlesini<br />
araştırınız.<br />
Biliyor muydunuz?<br />
Atomlar yalnızca proton nötron<br />
<strong>ve</strong> elektronlardan meydana<br />
gelmez. Bilim insanları bu<br />
parçacıkları oluşturan en az 37<br />
parçacığın varlığından söz<br />
ediyor. Bunlardan bazıları<br />
lepton-lar, kuarklar, fotonlar,<br />
bozonlar, gravitonlardır.<br />
Bir önyargıyı kırmak atomu parçalamaktan güçtür.<br />
5
1 1.1 B - Elektronların Dizilişi<br />
Protonların <strong>ve</strong> nötronların atomun merkezi olan çekirdekte, elektronların ise çekirdek<br />
etrafında belli enerji seviyelerinde (katmanlarda) dönerek hareket ettiklerini biliyoruz.<br />
Atom çekirdeğine en yakın olan elektronların enerjisi en düşük, çekirdekten en uzak olan<br />
elektronların enerjileri ise en yüksektir. Elektronlar, çekirdeğe en yakın katmandan başlayarak , en<br />
uzak katmana doğru yerleşir. Başka bir ifade ile elektronlar en düşük enerji seviyesinden en yüksek<br />
enerji seviyesine doğru yerleşir.<br />
Birinci enerji seviyesi K katmanı<br />
İkinci enerji seviyesi L katmanı .<br />
Üçüncü enerji seviyesi ise M katmanı<br />
olarak adlandırılır.<br />
N<br />
M<br />
L<br />
K<br />
+<br />
+ +<br />
+<br />
+<br />
+<br />
1. enerji seviyesinde en fazla 2 elektron,<br />
2. enerji seviyesinde en fazla 8 elektron,<br />
3. enerji seviyesinde en fazla 18 elektron bulunabilir.<br />
Atomlardaki elektronların yerleşiminin gösterilmesine elektron dizilişi denir.<br />
Örneğin potasyum atomunun 19 elektronu olduğuna göre, elektron dizilişi<br />
elektronların<br />
atomda dizilişi<br />
2,8,9 yanlıştır<br />
2,8,8,1 'dir<br />
Oktet kuralına göre birinci katman hariç atomların en dış enerji seviyelerinde en fazla sekiz<br />
elektron bulunur. Bu nedenle ilk yirmi atomun elektron dizilişi birinci enerji seviyesinde 2, ikinci enerji<br />
seviyesinde 8, üçüncü enerji seviysinde 8 elektron olacak biçimdedir.<br />
Aşağıdaki tablo ilk 20 elementin elektron dizilişi ile birlikte bu atomlardaki yerleşimini<br />
göstermektedir. Oktet kuralına göre 19 <strong>ve</strong> 20 atom numaralı elementlerin elektronları üçüncü enerji<br />
seviyesine 8 elektron yerleşince geriye kalan elektronlar 4. katmana yerleşirler.<br />
Hidrojen<br />
1<br />
H<br />
İlk 20 elementin elektronlarının<br />
atomda dizilişi<br />
Helyum<br />
2<br />
He<br />
Lityum<br />
3<br />
1<br />
Li Berilyum<br />
4<br />
Be Bor<br />
5<br />
B Karbon<br />
6<br />
C Azot<br />
7<br />
N Oksijen<br />
8<br />
O Flor<br />
9<br />
F Neon<br />
10<br />
2<br />
Ne<br />
2,1<br />
Sodyum<br />
11<br />
2,8,1<br />
Potasyum<br />
19<br />
2,8,8,1<br />
Na<br />
2,2<br />
Magnezyum Mg<br />
12<br />
2,8,2<br />
K Kalsiyum<br />
20<br />
2,8,8,2<br />
Ca<br />
2,3<br />
Alüminyum<br />
13<br />
2,8,3<br />
2,4<br />
Al Silisyum<br />
14<br />
2,8,4<br />
2,5<br />
Si Fosfor<br />
15<br />
2,8,5<br />
2,6<br />
P Kükürt<br />
16<br />
2,8,6<br />
S Klor<br />
17<br />
2,7<br />
2,8,7<br />
element sembol<br />
adı<br />
atom<br />
numarası<br />
atom modeli<br />
elektronların<br />
dizilişi<br />
Cl Argon<br />
18<br />
2,8<br />
2,8,8<br />
Ar<br />
Biliyor muydunuz?<br />
Modern atom teorisine göre<br />
bir elektronun yeri <strong>ve</strong> hızı<br />
aynı anda belirlenemez.<br />
Elektronların bulunma<br />
ihtimalinin fazla olduğu<br />
bölgeye orbital denir.<br />
6
Maddenin Yapısı <strong>ve</strong> Özellikleri<br />
1.1 C - Atomların Kimliği<br />
Atom numarası <strong>ve</strong> kütle numarası<br />
Sodyum atomuna bakınca 11 protonu olduğunu göreceksiniz. Sadece sodyum atomlarının 11<br />
protonu vardır. Diğer atomların tümünün de kendine özgü proton sayısı vardır. Bir atomun kimliğini<br />
belirten en temel öğesi protondur. Atomların kimliklerini proton sayılarına bakarak tespit edebiliriz.<br />
Bir atomdaki proton sayısına atom numarası denir.Böylece sodyumun<br />
atom numarası 11'dir deriz.<br />
Atom numarası = proton sayısı<br />
Nötr atomların proton sayıları elektron sayılarına eşit<br />
olduklarından dolayı yük bakımından nötrdür.<br />
Proton sayısı = Elektron sayısı<br />
Kütle numarası: Atomdaki elektronların kütlesi yok denecek<br />
kadar küçüktür. Atomun kütlesini, çekirdeğinde bulunan<br />
protonlar <strong>ve</strong> nötronlar belirler.Bir atomdaki<br />
proton <strong>ve</strong> nötronların toplam kütlesine Kütle numarası <strong>ve</strong>ya<br />
Nükleon sayısı denir.<br />
Kütle numarası =Atomdaki proton sayısı + atomdaki nötron sayısı<br />
Bir sodyum atomunun 11 protonu <strong>ve</strong> 12 nötronu vardır, kütle numarası 23'tür.<br />
Atom numarası yalnızca proton sayısı olduğuna göre;<br />
Kütle numarası - Atom numarası = Nötron sayısı<br />
Sodyum atomunun yükü:<br />
Sodyum atomunun nötron sayısı = (23-11) =12 dir.<br />
Atom <strong>ve</strong> kütle numaralarının kısaltılması<br />
protonların herbirinin yükü +1<br />
olduğundan dolayı toplam yük +11'dir<br />
Kimlik kartı<br />
Adı<br />
Proton sayısı<br />
Atom numarası<br />
Sembolü<br />
Adres<br />
Kütle numarası<br />
Atom numarası<br />
Sodyum atomu için<br />
Sembolü =Na<br />
Proton sayısı =11<br />
Kütle Numarası =23<br />
Bu bilgiler kısaca :<br />
Sodyum<br />
11<br />
11<br />
Na<br />
Dünya (şimdilik)<br />
A<br />
X Z<br />
23<br />
11Na<br />
Elementin sembolü<br />
olarak sembolize edilir.<br />
1-Lityum'un atom numarası 3 , kütle numarası ise 7'dir.<br />
a) Lityum atomunda kaç proton , nötrön <strong>ve</strong> elektron vardır?<br />
b) Lityum atomunun sembolik gösterimini yazınız?<br />
2-Aşağıdaki atomların isimlerini yazınız <strong>ve</strong> her atomun kaç Proton, nötron<br />
<strong>ve</strong> elektrona sahip olduğunu belirtiniz.<br />
12 16 27 56 65 238<br />
Her elektronun yükü -1 olduğundan<br />
dolayı toplam yük -11'dir<br />
Yükleri toplayınca: +11<br />
-11<br />
Net yük : 0<br />
Atomun toplam yükü sıfırdır.<br />
6<br />
C<br />
8<br />
O<br />
13Al 26Fe 30Zn 92U<br />
3-Proton sayıları <strong>ve</strong>rilen atomların 9. sayfadaki periyodik tabloya bakarak isimlerini yazınız. X=2 ,<br />
Y=16 , Z= 20<br />
7
1 1.1 D - Aynı Elementin Atomlarındaki Farklılık<br />
Bir elementin tüm atomları her zaman aynı olmayabilir. Aynı olmamaları çekirdekte bulunan<br />
nötron sayılarının farklı olmasındandır. Proton sayıları aynı nötron sayıları farklı,bunun sonucunda<br />
kütle numaraları farklı olan atomlara izotop atomlar denir.<br />
Soluk aldığımız havadaki tüm oksijen atomlarının çekirdeğinde 8 proton vardır. Atomlar nötr<br />
olduklarından 8 tane de elektronları vardır.<br />
Soluduğumuz oksijenin büyük bir bölümünde 8 nötron vardır. Oksijenin böylece kütle numarası<br />
(8+8 =16) 16 olarak bulunur.<br />
Soluduğumuz oksijenin az bir miktarı ise 9 nötrona sahiptir. Bu oksijen<br />
atomlarının kütle numarası ise (8+9=17) 17'dir.<br />
16 17<br />
8O <strong>ve</strong><br />
8O<br />
oksijenin izotoplarıdır deriz. Oksijenin üçüncü izotopu ise çok az<br />
18<br />
miktarda bulunan<br />
8O'dir. Bu izotoplara, oksijen-16, oksijen-17 <strong>ve</strong> oksijen-18 de<br />
denilebilir.<br />
Yanda Mısır'da bulunan bir mumyanın fotoğrafı<br />
görülmektedir. Mumyanın 3100 yaşında olduğu, vücudunda bulunan<br />
kütle numarası 14 olan karbon ( C) atomlarının miktarı ölçülerek<br />
saptanmıştır.<br />
14 Karbon-14 izotopu sayesinde<br />
Mısır'da bulunan mumyanın<br />
yaşı 3100 olarak tesbit edildi.<br />
Hemen hemen bütün elementlerin izotopu vardır. Oksijen, karbon gibi çoğu elementin izotopları<br />
doğada bulunur. Bazı izotoplar ise özel olarak laboratuvarlarda oluşturulur. İzotopların çoğunluğu<br />
ışınlar yayarak başka izotoplara dönüşür. Söz konusu ışınlar canlılar için zararlıdır. Ancak ışınların<br />
etkinliği azaltılarak tıp alanında kullanılır. Örneğin; kripton-81 izotopu akciğerleri kontrol etmede<br />
kullanılır. Bu amaçla kripton-81 izotopunun bir bölümü akciğerlere solunarak alınır. Akciğerlerin iyi<br />
çalışmayan bölgelerine bu izotop ulaşmaz. O bölgeler ekranda siyah olarak görülür. Kobalt-60<br />
izotopuysa kanser tedavisinde kullanılır.<br />
izotop Element adı Atom no<br />
35<br />
17 Cl<br />
37<br />
17 Cl<br />
12<br />
25 Mg<br />
26<br />
12 Mg<br />
Kobalt-60 izotopu kanser tedavisinde kullanılır.<br />
Kütle no P e N<br />
Biliyor muydunuz?<br />
Biliyor muydunuz? Bütün bitki , insan <strong>ve</strong><br />
diğer hayvanlar küçük bir miktar karbon-14<br />
izotopu içerirler. Bir canlıda bu miktar hep<br />
aynıdır, çünkü sürekli olarak kullanılır <strong>ve</strong><br />
yerine hep yenisi konur ( besin <strong>ve</strong> karbon<br />
dioksit olarak ). Ancak canlı öldüğünde<br />
karbon-14 miktarı azalmaya başlar, çünkü<br />
karbon-14 izotopu radyoaktif bir izotop<br />
olduğundan yarılanma süresi vardır (5715<br />
yıl). Antropolojik kazılar sonunda bazı<br />
hayvan kemikleri bulunduğunda yaşı<br />
hesaplanabilir.<br />
35 37<br />
Klor elementi doğada %75<br />
17Cl <strong>ve</strong> %25<br />
17Cl<br />
olarak bulunur. Bu yüzden klorun ortalama<br />
atom kütlesi 35.5 olarak hesaplanır.<br />
8
Maddenin Yapısı <strong>ve</strong> Özellikleri<br />
1.2 A - Periyodik Tablo<br />
1869 yılında Rus bilim insanı Dimitri Mendeleev o dönemde<br />
bilinen 63 elementi sınıflandırmıştır. Mendeleev bazı elementlerin<br />
neden aynı davrandığına dair bir sıra bulmaya çalışmıştı.<br />
Elementleri atom kütlesine göre listelemişti. Benzer özeliklere<br />
sahip olan elementlerin periyodik özelikler gösterdiğini bulmuş,<br />
elementler listesinde düzgün bir sıra oluşturmuştu.<br />
Mendeleev elementleri düzenli bir şekilde listelemek için bir<br />
tablo hazırladı <strong>ve</strong> tablosuna Periyodik Tablo adını <strong>ve</strong>rdi. Tablosunda<br />
o dönemde keşfedilmemiş elementler için boşluklar bıraktı,<br />
isimlerini eka-aleminyum, eka-boron <strong>ve</strong> eka-silikon olarak koydu <strong>ve</strong><br />
bu elementlerin bazı özeliklerini önceden tahmin etti. Kısa bir süre sonra galyum, skandiyum <strong>ve</strong><br />
germanyumun keşfedilmesi <strong>ve</strong> tahmin ettiği <strong>özellikleri</strong>n doğrulanması Mendeleev'in Periyodik<br />
Tablo'sunun bilim dünyası tarafından 19. yüzyılın sonlarına doğru kabul görmesini sağladı.<br />
Günümüzde kullandığımız modern Periyodik Tablo, Mendeleev'in Periyodik Tablo’sundan oldukça<br />
farklıdır. Modern Periyodik Tablo'da elementler atom numaralarına göre sıralanmıştır. Tabloda<br />
görülen yatay sıralara periyod, atomların elektron dizinimine göre düzenlenmiş dikey sütünlara grup<br />
denir.<br />
8<br />
H<br />
He<br />
alkali<br />
metaller<br />
3<br />
11<br />
1 2<br />
Li<br />
lityum<br />
Na<br />
sodyum<br />
19<br />
K<br />
potasyum<br />
37<br />
Rb<br />
rubidyum<br />
55<br />
Cs<br />
sezyum<br />
4<br />
Be<br />
berilyum<br />
12<br />
Mg<br />
magnezyum<br />
20<br />
Ca<br />
kalsiyum<br />
38<br />
Sr<br />
stronsiyum<br />
56<br />
Ba<br />
baryum<br />
Modern Periyodik Tablo<br />
Sc Ti V Cr Mn Fe Co Ni Cu Zn<br />
21 22 23 24 25 26 27 28 29 30<br />
skandiyum titanyum vanadyum krom manganez demir kobalt nikel bakır çinko<br />
Y Z Nb Mo Tc Ru Rh Pd Ag Cd<br />
39 40 41 42 43 44 45 46 47 48<br />
İtriyum zirkonyum niyobyum molibden teknetyum rutenyum rodyum paladyum gümüş kadmiyum<br />
La Hf Ta W Re Os Ir Pt Au Hg<br />
57 72 73 74 75 76 77 78 79 80<br />
lantan hafniyum tantal Tungsten renyum osniyum iridyum platin altın civa<br />
Etkinlik<br />
Periyodik tablodaki elementlerin grup numaraları <strong>ve</strong> en dış katmanlarındaki elektron sayıları<br />
arasındaki ilişkiyi tabloya bakarak açıklayınız. Elementlerin katman sayısı <strong>ve</strong> periyod numarası<br />
arasındaki ilişkiyi tabloya bakarak açıklayınız.<br />
1- a)Atom numarası 11 olan elementin periyodik tablodaki grubu <strong>ve</strong> periyodunu bulunuz.<br />
b)Atom numarası 17 olan elementin grubu <strong>ve</strong> periyodunu<br />
bulunuz<br />
Biliyor muydunuz?<br />
2- Periyodik tabloda 2. grup 3. periyoddaki elementin<br />
elektron <strong>ve</strong> proton sayısını bulunuz.<br />
Araştır<br />
1-Termometrede kullanılan <strong>ve</strong> oda sıcaklığında sıvı olan<br />
metalik element nedir?<br />
2-Pilin içeriğinde kullanılan grafit hangi elementtir?<br />
3-Manyetik olan üç elementin adını yazınız.<br />
1<br />
hidrojen<br />
3 4 5 6 7<br />
B C N O F Ne<br />
5 6 7 8 9 10<br />
bor karbon azot oksijen flor neon<br />
Al Si P S Cl Ar<br />
13 14 15 16 17 18<br />
alüminyum silisyum fosfor kükürt klor argon<br />
Ga Ge As Se Br Kr<br />
31 32 33 34 35 36<br />
galyum germanyum arsenik selenyum brom kripton<br />
In Sn Sb Te I Xe<br />
49 50 51 52 53 54<br />
indiyum kalay antimon tellür iyot ksenon<br />
Tl Pb Bi Po At Rn<br />
81 82 83 84 85 86<br />
helyum<br />
talyum kurşun bizmut polonyum astatin radon<br />
toprak alkali metaller geçiş metalleri halojenler<br />
Metalik elementler yeni kesildiğinde<br />
parlak yüzeyli katılardır.Isı <strong>ve</strong> elektriği<br />
iletirler.<br />
Ametallerin çoğu oda sıcaklığında<br />
gazdır. Sadece brom elementi sıvı, geri<br />
kalanı ise katıdır. Ametaller ısı <strong>ve</strong><br />
elektriği iletmezler.<br />
Mendeleev'in periyodik tablosunun bir<br />
benzerini de alman bilim adamı L.Mayer<br />
aynı dönemde yapmıştı.<br />
2<br />
soygazlar<br />
9
1 1.2 B - Elementlerin Birleşmesi<br />
İki <strong>ve</strong>ya daha fazla farklı elementin birleşmesinden bileşiklerin meydana geldiğini<br />
biliyoruz.Bileşiğin formülü, kendisini meydana getiren elementlerin sembolleri kullanılarak yazılır.<br />
Elementlerin birleşme oranları ise sembollerin sağ alt köşesine yazılan sayılarla gösterilir.<br />
Su molekülü bir oksijen atomunun iki hidrojen atomuyla birleşmesinden oluşur. Suyun kimyasal<br />
formülü HO<br />
2<br />
'dur. Sofra tuzu eşit miktarda sodyum atomu klor atomu içerir , kimyasal formülü<br />
NaCl'dir.<br />
Yağın içinde korunan<br />
sodyum metali.<br />
Gaz kavanozunda<br />
bulunan klor gazı.<br />
Sodyum metali ısıtılıp klor dolu gaz<br />
kavanozuna konunca parlak bir alevle yanar.<br />
Sonuç olarak gaz kavanozunun çeperlerinden<br />
sıyırarak topladığımız beyaz katı sofra tuzudur.<br />
Sodyum + Klor Sodyum Klorür<br />
Denklemdeki + işareti tepkimeye girme, işareti ise oluşma anlamındadır. Sodyum <strong>ve</strong><br />
klor gibi birçok element tepkimeye girerek bileşik oluşturur. Yukarıdaki, kimyasal denklemi düzgün<br />
bir cümle ile defterinize yazınız.<br />
Bileşikler nasıl oluşur?<br />
Atomların birleşmesinde <strong>ve</strong>ya kimyasal bağ oluşturmasında etkin olan parçacıklar atomun<br />
en dış katmanındaki elektronlardır.<br />
VIII. Grup elementleri tepkimeye girmedikleri için bileşik oluşturmazlar. Bu nedenle asal<br />
gazlar olarak adlandırılırlar. Soy gaz tepkime <strong>ve</strong>rmeyen gaz anlamını taşır. Helyum hariç en dış<br />
katmanlarında sekiz elektronları vardır. En dış elektron katmanı tamamen dolu olan atomlar<br />
kararlıdırlar <strong>ve</strong> kimyasal tepkime <strong>ve</strong>rmezler.<br />
Helyum atomu :<br />
Dış katmanı tamamen<br />
dolu <strong>ve</strong> kararlı<br />
K<br />
Neon atomu:<br />
Dış Katmanı<br />
tamamen dolu<br />
<strong>ve</strong> kararlı<br />
L<br />
K<br />
Argon atomu :<br />
Dış katmanı<br />
tamamen dolu<br />
<strong>ve</strong> kararlı<br />
M<br />
L<br />
K<br />
1-Asal gazlar niçin tepkime <strong>ve</strong>rmezler?<br />
2-Kalsiyum + Flor Kalsiyum florür denklemini<br />
bir cümle ile ifade ediniz.<br />
3- 'Demir, oksijenle tepkimeye girince demir oksit<br />
oluşur' cümlesini bir denklemle ile ifade ediniz.<br />
Biliyor muydunuz?<br />
Kripton, Ksenon <strong>ve</strong> Argonun<br />
özel şartlar altında florlu<br />
bileşikleri elde edilmiştir.<br />
10
Maddenin Yapısı <strong>ve</strong> Özellikleri<br />
1.2 C - İyon Oluşumu<br />
Diğer atomlar kendisine en yakın soy gazın elektron dizilimine benzeyip kararlı bir yapıya sahip<br />
olmak için ya elektron alıp <strong>ve</strong>rirler ya da elektronlarını ortaklarlar.<br />
İyon oluşumu: Bazı elementlerin atomları başka elementlerin atomlarıyla tepkimeye girerek,<br />
tamamen dolu bir elektron katmanına sahip olmak için, ya elektron alırlar ya da elektron <strong>ve</strong>rirler.<br />
Elektron <strong>ve</strong>rme:Sodyum metalinin en dış katmanında bir elektron vardır. Sodyum elektronunu<br />
başka bir atoma <strong>ve</strong>rerek en dıştaki M-katmanını tamamen boşaltır. Böylece bir iç katmanı olan L-<br />
katmanı tamamen dolu olmuş olur. Sonuç olarak +1 yüklü sodyum iyonu oluşur. Bu durumda sodyum<br />
iyonunun 11 protonuna karşılık 10 elektronu kalmış olduğundan net yükü +1 olur.<br />
Sodyum atomu<br />
M<br />
L<br />
K<br />
Na<br />
M- Katmanı boşalır<br />
Bir elektron<br />
kaybeder<br />
Sodyum iyonu<br />
L<br />
K<br />
L- Katmanı en dış katman olur<br />
Sodyum iyonunun yükü<br />
11protonun yükü : +11<br />
10 elektronun yükü : -10<br />
Net yük : +1<br />
Pozitif yüklü iyonlara katyon<br />
denir.<br />
Katyon elektron <strong>ve</strong>ren<br />
iyondur.<br />
Na + Cl -<br />
Elektron alma: Klor atomunun en dış katmanında 7 elektron vardır, sodyum gibi başka bir atomdan<br />
elektron alarak M- katmanını tamamen doldurur <strong>ve</strong> kararlı bir yapıya ulaşarak -1 yüklü klorür<br />
iyonunu oluşturur. Klor atomu<br />
Klorür iyonu<br />
yakala<br />
teşekkürler<br />
metal atomlar elektronlarını<br />
a metal atomlarına <strong>ve</strong>rirler<br />
Na<br />
2,8,1<br />
Na +<br />
2,8<br />
M- katmanı 1 elektron<br />
eksik olduğundan kararsızdır<br />
Bir<br />
elektron<br />
alır<br />
III. periyot elementleri <strong>ve</strong> oluşturacağı iyonlar<br />
Mg<br />
2,8,2<br />
Mg +2<br />
2,8<br />
M<br />
L<br />
K<br />
Cl<br />
Al<br />
2,8,3<br />
Al +3<br />
2,8<br />
Si<br />
2,8,4<br />
P<br />
2,8,5<br />
* P -3<br />
2,8,8<br />
S<br />
2,8,6<br />
S -2<br />
2,8,8<br />
Cl<br />
2,8,7<br />
Cl -1<br />
2,8,8<br />
Klorür iyonunun yükü:<br />
17 protonun yükü : +17<br />
18 elektronun yükü: -18<br />
Net yük: -1<br />
Negatif yüklü iyonlara anyon<br />
denir.<br />
Anyon.<br />
elektron<br />
kazanan iyondur<br />
Ar<br />
2,8,8<br />
Ar<br />
2,8,8<br />
*silikon genelde iyon oluşturmaz.<br />
İyonlar tüm canlılar için çok önemlidir. Her gün suyla birlikte iyonlar içiyoruz. Tüm bitkiler kendileri için gerekli<br />
iyonları suda çözünmüş maddelerden alır <strong>ve</strong> besin oluşturmak için<br />
M<br />
L<br />
K<br />
kullanır.<br />
1-Magnezyum iyonunun yükünün neden +2 olduğunu açıklayınız?<br />
2-Alüminyum atomunun modelini çizerek iyon oluşumunu<br />
gösteriniz.<br />
3-Yukarıdaki tablonun benzerini II. Periyot elementleri için<br />
düzenleyiniz.<br />
4- İyonlar kaç çeşittir? İsimlerini yazınız <strong>ve</strong> anlamlarını<br />
açıklayınız.<br />
M- katmanı doludur<br />
<strong>ve</strong> kararlıdır<br />
Biliyor muydunuz?<br />
-2 -<br />
Karbonat(CO<br />
3<br />
), Hidroksit (OH ),<br />
- -2<br />
Nitrat (NO<br />
3), Sülfat (SO<br />
4<br />
) gibi<br />
birden fazla elementin<br />
birleşmesinden oluşan çok atomlu<br />
iyonlar vardır.<br />
11
1 1.3 A - Kovalent Yapılı Moleküller<br />
A-metallerin atomları elektron alıp en dış elektron katmanını tamamlayarak soy gaz elektron<br />
dizilimine benzemek ister. Aynı <strong>ve</strong>ya farklı elementlerden oluşan iki a-metal atomu tepkimeye<br />
girince ikisi de elektron almak istediğinden en dış katmanlarındaki elektronlarını paylaşırlar<br />
(ortaklarlar). Böylece atomlar ortaklanan elektronları kendilerinin gibi kabul ederek en dış<br />
katmanlarındaki elektronlarını tamamlamış olurlar.<br />
Hidrojen molekülü: Hidrojen atomunun bir elektronu vardır. Kendisine en yakın soy gaz olan<br />
helyumun <strong>yapısı</strong>na benzemek için bir elektron daha alabilir. İki hidrojen atomu birbirine yeterince<br />
yakınlaşınca elektron katmanları birbirinin içine girer <strong>ve</strong> elektronlarını ortaklarlar.<br />
K K K K<br />
H H H H<br />
iki hidrojen atomu<br />
kovalent bağ<br />
hidrojen molekülü<br />
Bir elementin oluşturduğu<br />
kovalent bağ sayısı en dış<br />
elektron katmanını<br />
tamamlamak için alması<br />
gereken <strong>ve</strong>ya ortakladığı<br />
elektron sayısına eşittir.Ör:<br />
Cl=2,8,7 Bir elektron alması<br />
gerektiğinden oluşturacağı<br />
bir molekülde tek bağ yapar.<br />
A-metal - A-metal atomları arasında elektron ortaklanması sonucu oluşan çok güçlü çekim kuv<strong>ve</strong>tine<br />
kovalent bağ denir. Bir grup atomun kovalent bağlarla birleşmesine molekül denir.Moleküller element<br />
molekül <strong>ve</strong>ya bileşik molekül olabilir. Hidrojen gazı hidrojen moleküllerinden meydana gelir bu yüzden<br />
moleküler yapıya sahiptir.<br />
Oksijen molekülü: Oksijen atomu (2,6) soy gaz olan neonun <strong>yapısı</strong>na benzemek için iki elektron almak<br />
ister. İki oksijen atomu birbirine yaklaşınca çift bağlı bir molekül oluşur.<br />
iki kovalent bağ<br />
L<br />
L L L<br />
K K K K<br />
O<br />
O<br />
O<br />
O<br />
oksijen molekül modeli<br />
iki oksijen atomu<br />
oksijen molekülü<br />
Hidrojen Klorür molekülü:Hidrojen <strong>ve</strong> klor atomları birer elektron eksildiğinden atomlar kovalent<br />
yapılı bir bileşik oluştururlar.<br />
K<br />
M<br />
L K<br />
K<br />
kovalent bağ<br />
M<br />
H<br />
O<br />
H<br />
hidrojen atomu klor atomu klor molekülü<br />
1-Aşağıdaki maddeleri iyonik bileşik, Element<br />
molekül <strong>ve</strong> Bileşik molekül olarak sınıflandırınız.<br />
NH 3,MgBr 2, N 2 , CaCl 2, H2O, NO 2, CuSO 4,<br />
2- Flor <strong>ve</strong> brom gibi yedinci grup elementleri<br />
moleküllerinde kaç bağ yapar?<br />
L K<br />
O<br />
12<br />
Biliyor muydunuz?<br />
Suda çözünebilen katıların <strong>ve</strong>ya<br />
sıvıların iyonik ya da kovalent yapılı<br />
oldukları elektriksel iletkenlikleri<br />
ölçülerek anlaşılabilir.
Maddenin Yapısı <strong>ve</strong> Özellikleri<br />
1.3 B - Fiziksel <strong>ve</strong> Kimyasal Değişim<br />
Maddeler ısıtılınca , üzerine su ila<strong>ve</strong> edilince, başka maddelerle karıştırılınca <strong>ve</strong> buna benzer<br />
işlemlere tabii tutulunca değişime uğrayabilirler. Değişim iki şekilde olabilir ;<br />
1- Kimyasal Değişim<br />
2- Fiziksel değişim<br />
Kimyasal Değişim:<br />
Demir tozu <strong>ve</strong><br />
kükürt karışımı<br />
Demir tozları mıknatıs<br />
tarafından çekilir<br />
Kükürdün metil<br />
benzendeki<br />
(toluen) çözeltisi<br />
1- Biraz demir tozu ,sarı<br />
kükürt tozu ile karıştırılır<br />
mıknatıs<br />
2-Bir mıknatıs yardımı ile<br />
karışımı kolayca ayırabiliriz…<br />
Demir çözünmeden<br />
kalır<br />
3-…<strong>ve</strong>ya kükürdü metil benzende<br />
çözerek yine ayırabiliriz.<br />
Bunzen beki<br />
uzaklaştırılınca<br />
kızıllık<br />
devam eder.<br />
Siyah katı<br />
Mıknatıs<br />
metil benzen<br />
Siyah katı<br />
çözünmez<br />
4-Karışım ısıtıldığında kızılca bir<br />
parlama görülür, sarı kükürt lekeleri<br />
kaybolur <strong>ve</strong> siyah bir katı madde oluşur<br />
5-Siyah madde artık karışım<br />
değildir , mıknatıstan etkilenmez…<br />
6-…<strong>ve</strong> metil benzende<br />
çözünmez.<br />
Isı etkisiyle oluşan siyah katı yeni bir kimyasal maddedir.<br />
Değişim sonucunda yeni bir madde meydana geliyorsa yapılan değişime kimyasal değişim denir.<br />
Karışım <strong>ve</strong> bileşik arasındaki fark:<br />
Yukarıdaki karışımda demir <strong>ve</strong> kükürt tanecikleri birbiriyle kimyasal bağ yapmadan gelişigüzel<br />
karıştığından elementler kendi <strong>özellikleri</strong>ni korumuştur ( 2 <strong>ve</strong> 3, resimler). Karışımı meydana getiren<br />
maddeler kendi <strong>özellikleri</strong>ni korurlar.<br />
Demir <strong>ve</strong> kükürt tanecikleri tepkimeye girdiklerinde birbirleriyle belli bir oranda bağlanırlar.<br />
Oluşan yeni bileşikte çözücünün <strong>ve</strong> mıknatısın etkisi yoktur ( 5 <strong>ve</strong> 6. resimler). Bileşiğin özelikleri<br />
kendisini meydana getiren elementlerden farklıdır.<br />
Karışımın <strong>ve</strong> bileşiğin birleşme oranları hakkında sınıf<br />
tartışması yapınız.<br />
Biliyor muydunuz?<br />
Karışım<br />
Bileşik<br />
Demir sülfür yer kabuğunda<br />
pirit olarak bulunur.<br />
Hidrojen yanıcı, oksijen yakıcı,<br />
bu elementlerden meydana<br />
gelen su ise yangını söndürmek<br />
için kullanılır.<br />
13
1 1.3C-Değişimin Belirtileri<br />
Kimyasal değişime genellikle kimyasal tepkime <strong>ve</strong>ya kimyasal reaksiyon denir. Kimyasal<br />
tepkimenin meydana geldiğini nasıl anlarız?<br />
1. Tepkime sonucunda bir <strong>ve</strong>ya daha fazla yeni madde oluşur.<br />
Yeni madde <strong>ve</strong>ya maddeler başlangıçtaki maddelerden<br />
oldukça farklıdır.<br />
Demir + Kükürt Demir Sülfür<br />
(Metalik toz) (Sarı Toz) ( Siyah Katı)<br />
2. Kimyasal tepkimede enerji <strong>ve</strong>rilir <strong>ve</strong>ya alınır<br />
Yumurtayı kavururken<br />
Önceki konuda gördüğümüz tepkimeyi başlatmak için çok az ısı enerjisi meydana gelen tepkime<br />
bunzen bekinden <strong>ve</strong>rilir. Tepkime başlayınca çok daha fazla ısı açığa çıkar. endotermiktir.<br />
Bir tepkimede ısı enerjisi açığa çıkıyorsa tepkime<br />
Ekzotermiktir (ısı <strong>ve</strong>ren). Bir tepkimede ısı gerekiyorsa<br />
tepkime Endotermiktir (ısı alan). Demir <strong>ve</strong> kükürt arasında<br />
meydana gelen tepkime ekzotermik, yumurtayı kızartırken<br />
meydana gelen tepkime ise endotermiktir. Bazı kimyasal<br />
tepkimelerde ısının yanında ışık <strong>ve</strong> ses enerjisi de açığa<br />
çıkabilir. Magnezyum havada yanarken parlak bir ışık görülür<br />
tıslama sesi de duyulur.<br />
3. Kimyasal değişim genellikle tersinir değildir.<br />
Demir sülfürden demiri <strong>ve</strong> kükürtü yeniden elde etmek çok<br />
zordur <strong>ve</strong> birçok başka kimyasal tepkime gerektirir.<br />
Magnezyum yandığında ısı ışık<br />
<strong>ve</strong> ses enerjisi açığa çıkar.<br />
Bu nedenle havai fişek yapımında<br />
Fiziksel Değişim<br />
magnezyum kullanılır.<br />
buz eriyor<br />
şeker<br />
o<br />
Buz 0 C 'ta suya dönüşür.<br />
Oluşan suyu tekrar buza<br />
dönüştürmek kolaydır.<br />
alkol<br />
Şeker alkolde çözünür . İkisini<br />
tekrar ayrımsal damıtarak<br />
kolayca ayırabiliriz.<br />
Fiziksel değişimlerde yeni maddeler meydana gelmez. Örneğin buz <strong>ve</strong> su farklı görünseler bile her<br />
ikisini de su molekülleri meydana getirir.<br />
Değişim sonucunda yeni kimyasal maddeler meydana gelmiyorsa yapılan değişim Fiziksel<br />
değişimdir.<br />
1. Demir tozu <strong>ve</strong> kükürt tozu karışımı ile demir sülfür bileşiği arasındaki farkları tablo şeklinde<br />
yazınız.<br />
2. Aşağıdaki değişimlerin kimyasal <strong>ve</strong>ya fiziksel olduğuna Biliyor muydunuz?<br />
karar <strong>ve</strong>rin?<br />
a) Suyun donması b) Demirin paslanması c) Petrolun yanması Fotoğraf çekerken güneş ışığı<br />
d) Mumun erimesi e) Mumun yanması f) Sütün ekşimesi,<br />
filme çarpar <strong>ve</strong> filmdeki gümüş<br />
g) Kolonyanın buharlaşması h) Taşın parçalanması<br />
bromür gibi foto kimyasallar<br />
değişikliğe uğrar.<br />
14
Maddenin Yapısı <strong>ve</strong> Özellikleri<br />
TEST 1<br />
1-Proton <strong>ve</strong> nötronların benzerlik <strong>ve</strong> farklılıklarından iki tanesini yazınız.<br />
2-Aşağıdakilerin atom modellerini çizerek gösteriniz.<br />
12 40 31 24<br />
a)<br />
6C, b)<br />
18Ar , c)<br />
15P, d)<br />
12Mg<br />
3- Aşağıdaki tabloyu periyodik tablodan yararlanarak tamamlayınız <strong>ve</strong> defterinize yazınız..<br />
Elementin<br />
adı<br />
Sembol Atom No. Kütle No. Nötron<br />
sayısı<br />
5<br />
11<br />
40 22<br />
14 28<br />
20<br />
26<br />
13<br />
10<br />
30<br />
27<br />
A<br />
ZX<br />
4-X atomunun atom numarası 19, kütle numarası ise 39'dur.<br />
a) X atomunun proton, nötron <strong>ve</strong> elektron sayısını bulunuz.<br />
b) X atomunun en dış enerji seviyesinde kaç elektron bulunur?<br />
c) X elementinin oluşturacağı iyonun sembolünü yazınız.<br />
d) X elementinin periyodik tablodaki grup <strong>ve</strong> periyodu nedir?<br />
5-<br />
Element<br />
Q<br />
R<br />
S<br />
T<br />
X<br />
Atom<br />
numarası<br />
3<br />
20<br />
18<br />
8<br />
9<br />
Kütle<br />
numarası<br />
7<br />
40<br />
40<br />
18<br />
19<br />
Elektron<br />
dizilimi<br />
2,1<br />
2,8,8,2<br />
2,8,8,<br />
2,6<br />
2,8,8,1<br />
a) Hangi elementin atomlarında 22 nötron vardır?<br />
b) Hangi element bir asal gazdır?<br />
c) Hangi iki element neonun elektron dizilimine benzeyerek iyon oluşturur.<br />
d) Hangi iki element periyodik tablonun aynı grubundadır?<br />
6- Baryum elementinin atom numarası 56'dır <strong>ve</strong> periyodik tabonun 2. grubunda yer almaktadır.<br />
a- Baryum atomunun en dış enerji seviyesinde kaç elektron bulunur?<br />
b- Baryum atomunun oluşturacağı iyonun yükü nedir? Sebebini açıklayınız.<br />
8-Aşağıdaki listeye bakarak soruları yanıtlayınız<br />
Argon, Alüminyum, Karbondioksit, Magnezyum oksit, Sodyum klorür, Su, Hidrojen<br />
a- Tek atomlu maddeyi yazınız. b-Moleküler yapılı iki bileşiği yazınız.<br />
c- İyonik yapılı iki maddeyi yazınız. d- Kovalent yapılı maddeleri yazınız<br />
35 15
1<br />
Çoklu Zeka Etkinlikleri<br />
Vücudumuzda olan bir karbon atomu belki de<br />
milyonlarca yıl önce yaşayan bir dinazorun <strong>ve</strong>ya bir<br />
zeytin ağacının atomlarından biriydi; siz de kendi<br />
hayal gücünüzü kullanarak karbon atomunun<br />
başından geçen yolculuk hakkında bir hikaye<br />
yazınız.<br />
Aşağıda ilk yirmi elementin bağlanma gücünü<br />
gösteren kartlar vardır. Bu kartları kullanarak<br />
oluşabilecek iyonik <strong>ve</strong> kovalent yapılı bileşiklerin<br />
formüllerini ortaya çıkarabilirsiniz.<br />
H Li Na K Cl F<br />
He Ne Ar<br />
Be Mg S Ca O<br />
B Al N P<br />
C<br />
Si<br />
Kovalent yapılı olan azot molekülünü oyun hamuru<br />
(<strong>ve</strong>ya hamurla) <strong>ve</strong> kürdan kullanarak yapılan topçubuk<br />
modeli, azot atomunun elektron diziliminden<br />
faydalanılarak da yapılabilir.<br />
Azot molekülü.<br />
elektron dizilişi = 2,5<br />
Azot atomu en dış katmanını tamamlamak için 3<br />
elektron istediğinden dolayı 3 bağ yapar. Böylece 3<br />
kürdan gerekir.<br />
Seçeceğiniz bir arkadaşınızla rap şarkısı<br />
besteleyiniz. Bestenizi hazırlarken aşağıdaki gibi<br />
örnek cümleler kullanabilirsiniz<br />
Dalton atomu içi boş küreye benzetti.<br />
Thomson ise onu üzümlü topkek zannetti......vs.<br />
Sizler tasarlayacağınız bazı molekül modellerini<br />
ametallerin elektron diziliminden faydalanarak<br />
yapabilirsiniz.<br />
16
Maddenin Yapısı <strong>ve</strong> Özellikleri<br />
Çoklu Zeka Etkinlikleri<br />
Atom modellerinin basit çizimlerle gösterildiği bir<br />
poster hazırlayınız.<br />
Atom modelleri<br />
Aşağıdaki etkinliği yapınız.<br />
CAN sözcüğü kalsiyum ( Ca ) <strong>ve</strong> Azot (N)<br />
elementlerinin sembollerinden oluşturulmuştur.<br />
Aşağıdaki kelimelerin hangi elementlerin<br />
sembollerinden oluştuğunu bulunuz.<br />
POLİS, BANANE, TELİF, ASKI.<br />
Bu kelimelerle birlikte sizlerin de oluşturduğu<br />
kelimelerden bir poster hazırlayınız.<br />
Polis = Polonyum + Lityum + Kükürt<br />
Dinamitin ana maddesi olan TNT'yi bulan bilim<br />
adamı Alfred Nobel yaptığı bileşiğin dağları<br />
parçalayıp yol yapımında kullanımından dolayı<br />
insanlığa faydalı bir buluş sunmuştu daha sonra ise<br />
savaşlarda kullanılmasından dolayı büyük vicdan<br />
azabı çekmişti. Atomun parçalanmasından, atom<br />
bombası <strong>ve</strong> nükleer santral yapımı gibi <strong>ve</strong>ya<br />
laboratuvarda sentezlenen bazı ilaçlar gibi,<br />
bulacağınız örneklerle bir tablo oluşturunuz.<br />
Buluş<br />
Atomun<br />
parçalanması<br />
Fayda<br />
Enerji<br />
santralleri,<br />
kanser<br />
tedavisi<br />
Zarar<br />
Atom<br />
bombası<br />
Aşağıda <strong>ve</strong>rilen elementlerden yararlanarak mini<br />
bir periyodik tablo tasarlayınız.<br />
Si, H, P, He, Be, Al, B, C, Na, N, Ca, O, K, F, S, Cl,<br />
Ne, Ar, Li, Mg<br />
Si<br />
Örneğin silikonu sizin için biz yerleştirelim.<br />
14Si=284<br />
3 enerji seviyesi olduğundan dolayı 3. periyot. En<br />
dış enerji seviyesinde 4 elektron olduğundan dolayı<br />
ise 4. grupta yer alır.<br />
17
NOTLAR<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................<br />
.......................................................................................................................................................