Elektrochemische Thermodynamik
Elektrochemische Thermodynamik
Elektrochemische Thermodynamik
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Thermodynamik</strong><br />
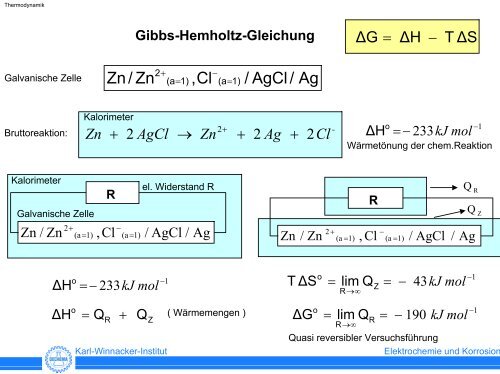
Galvanische Zelle<br />
Bruttoreaktion:<br />
Kalorimeter<br />
Galvanische Zelle<br />
Gibbs-Hemholtz-Gleichung<br />
2+<br />
−<br />
Zn / Zn (a=<br />
1) , Cl (a=<br />
1) / AgCl / Ag<br />
Kalorimeter<br />
2+<br />
Zn + 2 AgCl → Zn + 2 Ag + 2Cl<br />
R<br />
el. Widerstand R<br />
2+<br />
−<br />
Zn / Zn (a = 1) , Cl (a = 1) / AgCl /<br />
o<br />
∆H<br />
= − 233kJ<br />
mol<br />
o<br />
∆H = QR<br />
+<br />
Q<br />
Z<br />
−1<br />
Ag<br />
( Wärmemengen )<br />
∆G = ∆H −<br />
T ∆S<br />
Karl-Winnacker-Institut Elektrochemie und Korrosion<br />
-<br />
∆H<br />
2+<br />
−<br />
Zn / Zn (a = 1) , Cl (a = 1)<br />
T ∆S<br />
∆G<br />
o<br />
o<br />
o<br />
= − 233kJ<br />
mol<br />
−1<br />
Wärmetönung der chem.Reaktion<br />
R<br />
/<br />
AgCl<br />
= lim Q = − 43kJ<br />
mol<br />
R→∞<br />
Z<br />
/<br />
Q<br />
Q<br />
Ag<br />
= lim Q = − 190 kJ mol<br />
R→∞<br />
Quasi reversibler Versuchsführung<br />
R<br />
R<br />
−1<br />
−1<br />
Z