6-Spektren-Atombau - member
6-Spektren-Atombau - member
6-Spektren-Atombau - member
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Allg. & anorganische Chemie 6-<strong>Spektren</strong>-<strong>Atombau</strong> (3/4AK) 1/8<br />
05.10.2009 C.N. R.Z. C.B.<br />
6. Atomspektren / Atomorbitale<br />
6.1. spektroskopische Grundlagen<br />
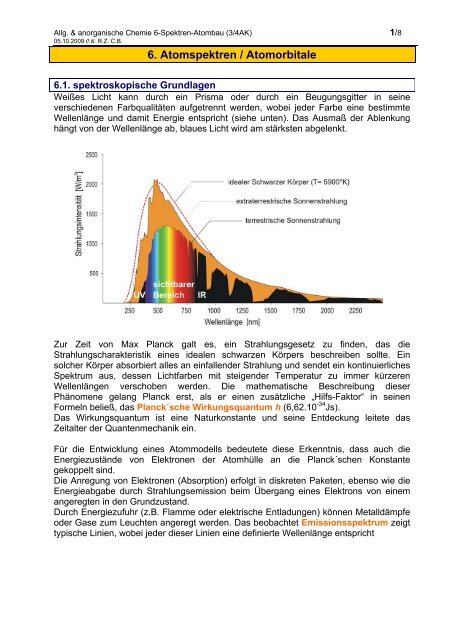
Weißes Licht kann durch ein Prisma oder durch ein Beugungsgitter in seine<br />
verschiedenen Farbqualitäten aufgetrennt werden, wobei jeder Farbe eine bestimmte<br />
Wellenlänge und damit Energie entspricht (siehe unten). Das Ausmaß der Ablenkung<br />
hängt von der Wellenlänge ab, blaues Licht wird am stärksten abgelenkt.<br />
Zur Zeit von Max Planck galt es, ein Strahlungsgesetz zu finden, das die<br />
Strahlungscharakteristik eines idealen schwarzen Körpers beschreiben sollte. Ein<br />
solcher Körper absorbiert alles an einfallender Strahlung und sendet ein kontinuierliches<br />
Spektrum aus, dessen Lichtfarben mit steigender Temperatur zu immer kürzeren<br />
Wellenlängen verschoben werden. Die mathematische Beschreibung dieser<br />
Phänomene gelang Planck erst, als er einen zusätzliche „Hilfs-Faktor“ in seinen<br />
Formeln beließ, das Planck´sche Wirkungsquantum h (6,62.10 -34 Js).<br />
Das Wirkungsquantum ist eine Naturkonstante und seine Entdeckung leitete das<br />
Zeitalter der Quantenmechanik ein.<br />
Für die Entwicklung eines Atommodells bedeutete diese Erkenntnis, dass auch die<br />
Energiezustände von Elektronen der Atomhülle an die Planck´schen Konstante<br />
gekoppelt sind.<br />
Die Anregung von Elektronen (Absorption) erfolgt in diskreten Paketen, ebenso wie die<br />
Energieabgabe durch Strahlungsemission beim Übergang eines Elektrons von einem<br />
angeregten in den Grundzustand.<br />
Durch Energiezufuhr (z.B. Flamme oder elektrische Entladungen) können Metalldämpfe<br />
oder Gase zum Leuchten angeregt werden. Das beobachtet Emissionsspektrum zeigt<br />
typische Linien, wobei jeder dieser Linien eine definierte Wellenlänge entspricht
Allg. & anorganische Chemie 6-<strong>Spektren</strong>-<strong>Atombau</strong> (3/4AK) 2/8<br />
05.10.2009 C.N. R.Z. C.B.<br />
Quecksilber (Hg) Cadmium (Cd)<br />
Absorptionsspektren beobachtet man, wenn Gase oder Metalldämpfe mit weißem<br />
Licht bestrahlt werden, so werden genau jene Wellenlängen absorbiert, die sie<br />
typischerweise im Emissionsspektrum zeigen.<br />
Für das Absorptionsspektrum bedeutet dies, dass an diesen Stellen im kontinuierlichen<br />
Spektrum dunkle Linien beobachtet werden.<br />
Nach dem Kirchhoff´schen Gesetz (1859) kann jeder Stoff nur Licht jener<br />
Wellenlänge oder Frequenz absorbieren, die er selbst zu emittieren vermag.<br />
Durch Energiezufuhr (zB. Flamme) werden Elektronen auf energiereichere (angeregte)<br />
Zustände gehoben. Nach 10 -8 Sekunden springen Elektronen wieder zurück und<br />
senden dabei Photonen (Licht) aus. Es gelten folgende Beziehungen:<br />
c λ⋅<br />
ν<br />
= (c= 2,998 10 8 m/s)<br />
h ⋅ c<br />
∆E = h ⋅ ν =<br />
λ<br />
Jeder Linie in einem Emissionsspektrum entspricht daher eine bestimmte Wellenlänge<br />
bzw. bestimmte Frequenz und bestimmte Energie.<br />
Balmer zeigte 1885 dass die Wellenlängen im sichtbaren Wasserstoffspektrum<br />
folgender Beziehung entsprechen, wobei n´< n sein muss<br />
1<br />
λ<br />
⎛ 1 1<br />
R⎜<br />
− 2<br />
⎝ n n′<br />
= 2<br />
⎞<br />
⎟<br />
⎠<br />
(R= 1,097 10 7 /m)<br />
Mit Hilfe des Bohr´schen Postulates, dass es für ein Elektron stationäre Zustände in<br />
Form kreisförmiger Orbitale gibt, konnte anhand der <strong>Spektren</strong> die Energie errechnet<br />
werden, die ein Elektron auf einer bestimmten Bahn haben muss.<br />
Für den Drehimpuls eines Elektrons auf einer Kreisbahn gilt:<br />
⎛ h<br />
m ⋅ v ⋅ r = n⋅<br />
⎜<br />
⎝ 2π<br />
⎞<br />
⎟<br />
⎠<br />
n = 1, 2, 3, 4,<br />
m = Masse des Elektrons 9,109 10 -32 kg<br />
v= Geschwindigkeit des Elektrons<br />
n ist in dieser Formel die Hauptquantenzahl und kann ganzzahlige positive Werte<br />
annehmen<br />
Wenn man von der Annahme ausgeht, dass für eine stabile Kreisbahn die<br />
Zentrifugalkraft genau gleich der Anziehungskraft zwischen Kern und Elektron sein<br />
muss, dann
Allg. & anorganische Chemie 6-<strong>Spektren</strong>-<strong>Atombau</strong> (3/4AK) 3/8<br />
05.10.2009 C.N. R.Z. C.B.<br />
r<br />
n<br />
2<br />
ε0<br />
⋅h<br />
⋅ n<br />
=<br />
π ⋅ m ⋅e<br />
e<br />
2<br />
2<br />
n = 1, 2, 3, 4,<br />
m = Masse des Elektrons 9,109 10 -32 kg<br />
ε0=Dielektrizitätskonstante im Vakuum 8,854 10 -12 F/m<br />
e=Elementarladung 1,602 10 -19 C<br />
Setzt man für n = 1 so ergibt sich für das erste Orbital des Wasserstoffes ein Radius<br />
von 52,93pm.<br />
Als Folge dieser Überlegungen sind nur bestimmte Orbitale für ein Elektron erlaubt. Die<br />
Energieübergänge sind nur in Quanten (definierten Paketen) möglich.<br />
Der Übergang eines Elektrons auf eine unendlich große Bahn ist gleichbedeutend mit<br />
der Abtrennung des Elektrons aus dem Atomverband und entspricht der<br />
Ionisierungsenergie.<br />
h ⋅c<br />
⎛ 1 1<br />
EI En<br />
− En1<br />
= = h⋅<br />
c ⋅ R⎜<br />
− 2<br />
λ ⎝ 1 ∞<br />
= ∞ 2<br />
⎞<br />
⎟<br />
⎠<br />
Das Bohr´sche Atommodell kann man mit den Methoden der klassischen Mechanik<br />
nicht erklären, es hat seine Berechtigung nur durch die Übereinstimmungen mit<br />
Beobachtungen.<br />
Es lässt sich damit aber nur das Wasserstoffspektrum erklären, die Ausdrücke zur<br />
Bestimmung der Ionisierungsenergie oder des Atomradius und ist für andere Atome<br />
nicht anwendbar!<br />
Das Bohr´sche Atommodell leitete den Übergang zur Quantenmechanik ein, es erklärt<br />
aber nicht, warum ein e - beim Kreisen um den Kern keine Energie verliert.<br />
6.2. Grundlagen der Wellenmechanik<br />
Elektromagnetische Strahlen (einschließlich Licht) können durch folgende Größen<br />
beschrieben werden:<br />
Wellenlänge<br />
λ<br />
Amplitude A (sie ist proportional zu Intensität, bei Photonen )<br />
Ausbreitungs-<br />
geschwindigkeit<br />
c (unabhängig von der Wellenlänge, sie ist für elektromagnetische Strahlung<br />
gleich der Lichtgeschwindigkeit c = 2,9979 ⋅ 10 8 m/s)<br />
Frequenz ν (Zahl der Wellen, die an einem bestimmten Ort pro Sekunde<br />
vorbeikommen. Die Einheit für die Frequenz ist Hertz, Hz)<br />
Für die Zusammenhänge zwischen Geschwindigkeit, Wellenlänge und Frequenz gilt:<br />
c = λ ⋅ ν<br />
ν =<br />
c<br />
λ<br />
λ =<br />
c<br />
ν<br />
E = h ⋅ ν = m ⋅ c<br />
Monochromatisches Licht ist Licht mit einer bestimmten Wellenlänge, in polychromatischem<br />
sichtbaren Licht sind alle Wellenlängen zwischen 400 und 700nm<br />
vertreten.<br />
2
Allg. & anorganische Chemie 6-<strong>Spektren</strong>-<strong>Atombau</strong> (3/4AK) 4/8<br />
05.10.2009 C.N. R.Z. C.B.<br />
Im Prinzip kann jede Art von Strahlung als elektromagnetische Strahlung beschrieben<br />
werden, erweitert man die Skala des Sonnenspektrums über den sichtbaren Bereich<br />
hinaus, so kommt man bei langen Wellenlängen zur Mikrowellen- und<br />
Rundfunkstrahlung, bei kurzen Wellenlängen zur Röntgen-, γ- und schließlich zu<br />
hochenergetischen Teilchenstrahlungen<br />
Für die weitere Entwicklung eines Atommodells waren zwei weitere physikalische<br />
Formulierungen notwendig.<br />
Nach Luis de Broglie (1892-1987) ist jede bewegte Masse als Welle beschreibbar.<br />
Damit wird auch ein Elektron als Welle beschrieben, was 1927 experimentell durch die<br />
Beugungserscheinungen von Elektronenstrahlen bestätigt wurde.<br />
In der de Broglie Beziehung wird eine klassisch mechanische Beschreibung, das<br />
Drehmoment (m v), mit einer Welleneigenschaft, der Wellenlänge (λ), verknüpft.<br />
λ<br />
h<br />
=<br />
m ⋅ v<br />
Beschleunigt man Elektronen in einem elektrischen Feld so nimmt deren Wellenlänge<br />
mit steigender Geschwindigkeit ab. Mit Hilfe der Elektronenbeugung lassen sich daher<br />
Kristallstrukturen aufklären<br />
Eine Aussage der Heisenberg´sche Unschärferelation besagt, dass es unmöglich ist,<br />
von einem Quantenobjekt (z.B. einem Elektron) gleichzeitig den Impuls und seinen<br />
Aufenthaltsort mit beliebiger Genauigkeit zu bestimmen. Eine klassische<br />
Versuchsanordnung zur Erklärung ist die Beugung am Spalt. Je kleiner der Spalt für ein<br />
durchtretendes Photon (oder Elektron) wird<br />
(also je genauer der Ort bestimmt ist), desto<br />
stärker kann es nach dem Spalt abgelenkt sein.<br />
Das Ausmaß der Ablenkung kann vor der<br />
Messung nicht vorhergesagt werden.<br />
Eine wesentliche Schlussfolgerung aus den<br />
Heisenberg´schen Formulierungen war die<br />
Tatsache, dass die Art der Messanordnung das<br />
Ergebnis beeinflusste.<br />
∆x ⋅<br />
∆p ><br />
h
Allg. & anorganische Chemie 6-<strong>Spektren</strong>-<strong>Atombau</strong> (3/4AK) 5/8<br />
05.10.2009 C.N. R.Z. C.B.<br />
Aussagen über Elektronenbahnen im klassischen Sinn waren nach diesen<br />
Erkenntnissen nicht mehr möglich.<br />
Für Elektronen gibt es aber die Möglichkeit einen wahrscheinlichen Aufenthaltsort<br />
anzugeben, über das Quadrat seiner Wellenfunktion ψ.<br />
6.3. Die Schrödingergleichung<br />
2 2 2<br />
2<br />
∂ ψ ∂ ψ ∂ ψ 8π m<br />
+ + +<br />
2 2 2 2<br />
∂x<br />
∂y<br />
∂z<br />
h<br />
( E −V<br />
) ⋅ ψ = 0<br />
h = 6,62.10 -34 Js<br />
m = Masse des Elektrons 9,109 10 -32 kg<br />
Ε=Gesamtenergie<br />
V=potentielle Energie des Teilchens<br />
Im 3-dimensionalen Raum lassen sich im Wasserstoffatom mit Hilfe der<br />
Schrödingergleichung Lösungen für die Wellenfunktion ψ finden. Sie beschreibt<br />
das Verhalten eines Elektrons in einem bestimmten Atomorbital.<br />
Verschiedene Wellenfunktionen sind möglich, allerdings entsprechen ihnen auch<br />
bestimmte Energiewerte.<br />
In der Wellenmechanik von Schrödinger kann man sich das e - als dreidimensionale<br />
stehende Welle vorstellen .
Allg. & anorganische Chemie 6-<strong>Spektren</strong>-<strong>Atombau</strong> (3/4AK) 6/8<br />
05.10.2009 C.N. R.Z. C.B.<br />
6.4. Die Quantenzahlen (QZ)<br />
Schrödinger´s Gleichung lässt sich statt in den 3 Raumdimensionen (x, y, und z) auch in<br />
Form von Polarkoordinaten darstellen, in der die räumliche Darstellung mit Hilfe eines<br />
Radiusvektors und eines Winkels erfolgt.<br />
Als Lösungen der Schrödingergleichung erhält man dann Radius- bzw.<br />
Winkelabhängige Funktionen.<br />
Die Hauptquantenzahl n (n ) führt zu Lösungen für die Radialfunktion der<br />
( 1 −∞<br />
)<br />
Wellengleichung.<br />
Zwei weitere Quantenzahlen l und ml ergeben sich durch Lösung der Winkelfunktion der<br />
Wellengleichung.<br />
Haupt-QZ Schale bzw. Sphäre n = 1,2,3…<br />
Neben-QZ Form des Orbitals und<br />
Orbitaldrehimpuls<br />
Magnet-QZ Ausrichtung der jeweils<br />
energiegleichen Orbitale<br />
l = 0, 1, 2, 3…n-1 bzw.<br />
= s, p, d, f<br />
ml= +l,…1,0,-1,…-l<br />
Spin-QZ Eigendrehimpuls des e - ms= +1/2 und -1/2<br />
Durch die Quantenzahlen ergeben sich verschiedene mögliche Orbitale:<br />
In der ersten Schale mit n = 1 kann l nur 0 sein und damit auch ml<br />
Es gibt somit in der innersten Schale nur ein s-Orbital.<br />
Für die zweite Schale mit n = 2 kann l 0 oder 1 sein und damit ml –1, 0 oder +1.<br />
Die zweite Schale besitzt demnach ein s-Orbital (n=2, l=0) und 3 p-Orbitale (n=2, l=1)<br />
die sich durch ihre Magnetquantenzahl unterscheiden (-1, 0 und +1). Weil es 3 mögliche<br />
p-Orbitale gibt spricht man von 3-fach entarteten Orbitalen.<br />
Die radiale Verteilungsfunktion zeigt für die einzelnen Orbitale die Wahrscheinlichkeit<br />
an, mit der ein Elektron sich in einem bestimmten Abstand vom Kern befindet. Die<br />
räumliche Ausrichtung der Orbitale wird durch den winkelabhängigen Anteil der<br />
Wellenfunktion festgelegt.
Allg. & anorganische Chemie 6-<strong>Spektren</strong>-<strong>Atombau</strong> (3/4AK) 7/8<br />
05.10.2009 C.N. R.Z. C.B.<br />
Orbital n l ml radiale Wellenfunktion R(r) winkelabhängige Wellenfunktion A(θ,ϕ)<br />
1s 1 0 0 −r<br />
2e<br />
2s 2 1 0<br />
2<br />
1 r<br />
2<br />
− 2 ( 2 − r)<br />
⋅ e<br />
1 r<br />
2px 2 1 +1 − 2<br />
r e<br />
2 6<br />
1 r<br />
2py 2 1 -1 − 2<br />
r e<br />
2 6<br />
1 r<br />
2pz 2 1 0 − 2<br />
r e<br />
2 6<br />
1<br />
2 π<br />
1<br />
⋅ 3( sinθcosϕ)<br />
⋅ 3( sinθ<br />
sinϕ)<br />
⋅ 3( cosθ<br />
)<br />
Für die s-Orbitale ergibt sich keine Winkelabhängigkeit, sie sind daher<br />
radialsymmetrisch (kugelförmig). Die p-Orbitale sind winkelabhängig, das pz Orbital<br />
allerdings nur von θ und nicht von ,dem „Höhen“-Winkel ϕ weshalb es im karthesischen<br />
Koordinatensystem entlang des z-Achse verläuft<br />
Um den Orbitalzustand eines Elektrons vollständig zu beschreiben ist eine weitere<br />
Quantenzahl, die Spinquantenzahl ms notwendig. Aus Sicht der klassischen Physik lässt<br />
sie sich mit der Rotation des Elektrons um seine Achse vergleichen. Für die<br />
Spinquantenzahl sind 2 Werte erlaubt, + 1 /2 und – 1 /2 . Die Spinquantenzahl bedingt, dass<br />
sich in einem Orbital maximal zwei Elektronen mit entgegengesetztem Spin aufhalten<br />
dürfen. Diese Tatsache erklärt das Pauli-Prinzip.<br />
Pauli untersuchte um 1925 die typische Linienaufspaltung in den Emissionsspektren<br />
von Alkalimetallen, wenn die Anregung innerhalb eines starken externen Magnetfeldes<br />
erfolgt (Zeeman-Effekt). Die Gruppierung der Elemente im Periodensystem ließ sich mit<br />
Hilfe der ersten drei Quantenzahlen nur dann erklären, wenn Orbitale maximal 2-fach<br />
mit Elektronen besetzt sind und deren Spin entgegengesetzt ist.<br />
6.5. Die Besetzung der Orbitale<br />
Jedem Orbital entspricht eine bestimmte Energie. Die Orbitale mit der niedrigsten<br />
Energie werden zuerst belegt.<br />
In jedem Orbital haben max. 2 eֿ Platz. Beide Elektronen haben dieselbe Energie,<br />
sie unterscheiden sich durch Spin-Quantenzahl.<br />
Kein Elektron in einem Atom ist in allen vier Quantenzahlen gleich (Pauli-Verbot)<br />
Orbitale, die sich nur durch die Magnet-QZ unterscheiden, besitzen dieselbe<br />
Energie, sie werden entartete Orbitale genannt.<br />
die Anzahl erlaubter Werte für die Magnetquantenzahl bedingt die Zahl entarteter<br />
Orbitale: ein s-Orbital 3 p-Orbitale, 5 d-Orbitale, 7 f-Orbitale<br />
2<br />
2<br />
2<br />
2<br />
π<br />
π<br />
π<br />
π
Allg. & anorganische Chemie 6-<strong>Spektren</strong>-<strong>Atombau</strong> (3/4AK) 8/8<br />
05.10.2009 C.N. R.Z. C.B.<br />
Die Besetzung von energiegleichen Orbitalen erfolgt so, dass sie zuerst einfach<br />
besetzt werden (Hundsche Regel)<br />
z.B. Stickstoff Sauerstoff<br />
14<br />
N (1s2, 2s2, 2p3) O (1s2, 2s2, 2p4)<br />
16<br />
7<br />
<br />
2p x 2p y 2p z 2p x 2p y 2p z<br />
Die Energieniveaus der einzelnen Orbitale beginnen ab der 3 Sphäre zu<br />
überlappen Schachbrettregel<br />
5s <br />
4p <br />
3d <br />
4s <br />
3p <br />
3s <br />
2p <br />
2s <br />
1s <br />
Schreibweise der Elektronenkonfiguration:<br />
8<br />
1s<br />
2s<br />
2p 3s<br />
3p 4s<br />
3d 4p 5s<br />
4d 5p 6s<br />
4f 5d 6p 7s<br />
5f 6d 7p 8s<br />
z.B. Cl (Z=17): 1s 2 2s 2 2p 6 3s 2 3p 5 Kurzschreibweise: [Ne]3s 2 3p 5<br />
6.5.1. die räumliche Darstellung der Orbitale<br />
Die Wellenfunktion ψ aus der Schrödinger-Gleichung ergibt als ψ 2 die<br />
Aufenthaltswahrscheinlichkeit von Elektronen für eine bestimmte Entfernung vom Kern.<br />
Den Bereich mit hoher Aufenthaltswahrscheinlichkeit nennt man Ladungswolke oder<br />
Orbital. Es gibt keine scharfen Grenzen.<br />
Die Geometrie der Orbitale ist bei der Bildung von Verbindungen entscheidend.<br />
s-Orbitale (l=0) sind kugelförmig.<br />
p-Orbitale (l=1) sind hantelförmig und in den drei Raumachsen ausgerichtet.<br />
Orbitale einer Sphäre können miteinander zu gemeinsamen Hybridorbitalen<br />
“vermischen“.