A. Data Definition Tables
A. Data Definition Tables
A. Data Definition Tables
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
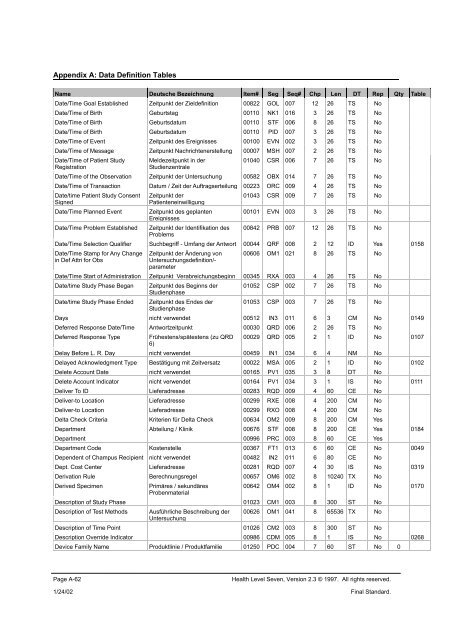
Appendix A: <strong>Data</strong> <strong>Definition</strong> <strong>Tables</strong><br />
Name Deutsche Bezeichnung Item# Seg Seq# Chp Len DT Rep Qty Table<br />
Date/Time Goal Established Zeitpunkt der Zieldefinition 00822 GOL 007 12 26 TS No<br />
Date/Time of Birth Geburtstag 00110 NK1 016 3 26 TS No<br />
Date/Time of Birth Geburtsdatum 00110 STF 006 8 26 TS No<br />
Date/Time of Birth Geburtsdatum 00110 PID 007 3 26 TS No<br />
Date/Time of Event Zeitpunkt des Ereignisses 00100 EVN 002 3 26 TS No<br />
Date/Time of Message Zeitpunkt Nachrichtenerstellung 00007 MSH 007 2 26 TS No<br />
Date/Time of Patient Study Meldezeitpunkt in der<br />
01040 CSR 006 7 26 TS No<br />
Registration<br />
Studienzentrale<br />
Date/Time of the Observation Zeitpunkt der Untersuchung 00582 OBX 014 7 26 TS No<br />
Date/Time of Transaction Datum / Zeit der Auftragserteilung 00223 ORC 009 4 26 TS No<br />
Date/time Patient Study Consent Zeitpunkt der<br />
01043 CSR 009 7 26 TS No<br />
Signed<br />
Patienteneinwilligung<br />
Date/Time Planned Event Zeitpunkt des geplanten<br />
Ereignisses<br />
00101 EVN 003 3 26 TS No<br />
Date/Time Problem Established Zeitpunkt der Identifikation des<br />
Problems<br />
00842 PRB 007 12 26 TS No<br />
Date/Time Selection Qualifier Suchbegriff - Umfang der Antwort 00044 QRF 008 2 12 ID Yes 0158<br />
Date/Time Stamp for Any Change Zeitpunkt der Änderung von 00606 OM1 021 8 26 TS No<br />
in Def Attri for Obs<br />
Untersuchungsdefinition/parameter<br />
Date/Time Start of Administration Zeitpunkt Verabreichungsbeginn 00345 RXA 003 4 26 TS No<br />
Date/time Study Phase Began Zeitpunkt des Beginns der<br />
Studienphase<br />
01052 CSP 002 7 26 TS No<br />
Date/time Study Phase Ended Zeitpunkt des Endes der<br />
Studienphase<br />
01053 CSP 003 7 26 TS No<br />
Days nicht verwendet 00512 IN3 011 6 3 CM No 0149<br />
Deferred Response Date/Time Antwortzeitpunkt 00030 QRD 006 2 26 TS No<br />
Deferred Response Type Frühestens/spätestens (zu QRD<br />
6)<br />
00029 QRD 005 2 1 ID No 0107<br />
Delay Before L. R. Day nicht verwendet 00459 IN1 034 6 4 NM No<br />
Delayed Acknowledgment Type Bestätigung mit Zeitversatz 00022 MSA 005 2 1 ID No 0102<br />
Delete Account Date nicht verwendet 00165 PV1 035 3 8 DT No<br />
Delete Account Indicator nicht verwendet 00164 PV1 034 3 1 IS No 0111<br />
Deliver To ID Lieferadresse 00283 RQD 009 4 60 CE No<br />
Deliver-to Location Lieferadresse 00299 RXE 008 4 200 CM No<br />
Deliver-to Location Lieferadresse 00299 RXO 008 4 200 CM No<br />
Delta Check Criteria Kriterien für Delta Check 00634 OM2 009 8 200 CM Yes<br />
Department Abteilung / Klinik 00676 STF 008 8 200 CE Yes 0184<br />
Department 00996 PRC 003 8 60 CE Yes<br />
Department Code Kostenstelle 00367 FT1 013 6 60 CE No 0049<br />
Dependent of Champus Recipient nicht verwendet 00482 IN2 011 6 80 CE No<br />
Dept. Cost Center Lieferadresse 00281 RQD 007 4 30 IS No 0319<br />
Derivation Rule Berechnungsregel 00657 OM6 002 8 10240 TX No<br />
Derived Specimen Primäres / sekundäres<br />
Probenmaterial<br />
00642 OM4 002 8 1 ID No 0170<br />
Description of Study Phase 01023 CM1 003 8 300 ST No<br />
Description of Test Methods Ausführliche Beschreibung der<br />
Untersuchung<br />
00626 OM1 041 8 65536 TX No<br />
Description of Time Point 01026 CM2 003 8 300 ST No<br />
Description Override Indicator 00986 CDM 005 8 1 IS No 0268<br />
Device Family Name Produktlinie / Produktfamilie 01250 PDC 004 7 60 ST No 0<br />
Page A-62 Health Level Seven, Version 2.3 © 1997. All rights reserved.<br />
1/24/02 Final Standard.