m- Nitrobenzaldehyd.pdf - Institut für Chemie - Humboldt-Universität ...
m- Nitrobenzaldehyd.pdf - Institut für Chemie - Humboldt-Universität ...
m- Nitrobenzaldehyd.pdf - Institut für Chemie - Humboldt-Universität ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Humboldt</strong> <strong>Universität</strong> zu Berlin 07.05.200<br />
<strong>Institut</strong> <strong>für</strong> Organische <strong>Chemie</strong><br />
Brook-Taylor Straße 2<br />
12489 Berlin<br />
OC-Grundpraktikum SS2008<br />
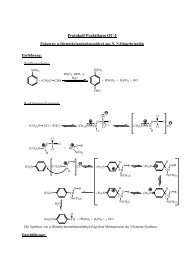
m-<strong>Nitrobenzaldehyd</strong><br />
In einer elektrophilen Substitution wird Benzaldehyd zu m-<strong>Nitrobenzaldehyd</strong><br />
umgesetzt. Bei elektrophilen Substitutionen an aromatischen Systemen wird im<br />
allgemeinen ein aromatisch gebundenes Wasserstoffatom durch ein Elektrophil<br />
ersetzt. Reagiert ein Nitrylkation als Elektrophil spricht man von einer Nitrierung.<br />
Aufgrund des deaktivierenden Einflusses der Aldehydgruppe auf den Aromaten,<br />
lagert sich das Nitrylkation bevorzugt in meta-Stellung an.<br />
Reaktionsmechanismus<br />
CHO<br />
Im ersten Schritt lagert sich das Nitrylkation in meta-Position an das das<br />
Benzaldehyd an.<br />
CHO<br />
C +<br />
+<br />
CHO<br />
N +<br />
O O<br />
H<br />
N<br />
O<br />
O<br />
H 2 SO 4 HNO 3<br />
CHO<br />
N +<br />
O<br />
CHO<br />
NO 2<br />
Dabei bildet sich zunächst das mesomeriestabilisierte Benzeniumion.<br />
C +<br />
CHO<br />
H<br />
N<br />
O<br />
O<br />
O<br />
CHO<br />
C +<br />
CHO<br />
C +<br />
H<br />
N<br />
O<br />
H<br />
N<br />
O<br />
O<br />
S E<br />
O
OC-Grundpraktikum SS2008<br />
m-<strong>Nitrobenzaldehyd</strong><br />
07.05.2008<br />
Zur Rückbildung des energetisch günstigen aromatischen Zustandes wird<br />
anschließend ein Proton abgegeben. Es entsteht m-<strong>Nitrobenzaldehyd</strong>.<br />
Versuchsbeschreibung<br />
Zur Herstellung der Nitriersäure wurden 5 ml 100%-ige HNO 3 in einem<br />
Dreihalskolben vorgelegt und unter Rühren und Kühlen im Eiswasser langsam 7ml<br />
95-97 %-ige H 2 SO 4 hin zugegeben. Zur der auf 10°C gekühlten Nitriersäure wurde<br />
anschließend Benzaldehyd ( 5,23 g, 0,05 mol) zu getropft. Auch hierbei sollte die<br />
Temperatur unter 10°C gehalten werden um Oxidation zu vermeiden. Nach<br />
beendeter Zugabe wurde die Reaktionsmischung drei Stunden gerührt und<br />
anschließend in 150 ml Eiswasser überführt. Das als Feststoff anfallende<br />
m-<strong>Nitrobenzaldehyd</strong> wurde abfiltriert, mit Wasser gewaschen, in einem EtOH/H 2 O-<br />
Gemisch um kristallisiert und abschließend mit Hilfe eines Rotationsverdampfer<br />
getrocknet. Der Schmelzpunkt des Rohproduktes lag danach bei 51,5 °C (Literatur:<br />
54 - 58°C), daraufhin wurde der Wasch -und Trocknungsvorgang eine weiteres Mal<br />
wiederholt. Man erhält das gereinigte Produkt (1,51 g, 0,01 mol) als gelblichen<br />
Feststoff.<br />
Analytik<br />
Ausbeute: 20% (Literatur: 40%)<br />
Schmelzpunkt: 55,6°C °C bei 1013 mbar (Literatur 1 : 54 - 58 °C)<br />
Fehlerdiskussion<br />
Während der Zugabe des Benzaldehyd zur Nitriersäure entstanden nitrose Gase,<br />
welche Anzeichen <strong>für</strong> Oxidationsvorgänge sind. Dabei könnte Benzaldehyd zur<br />
Benzoesäure oxidiert worden sein.<br />
Die geringe Ausbeute könnte auf den wiederholten Wasch- und Trocknungsvorgang<br />
zurückzuführen sein.<br />
Der etwas zu niedrige Schmelzpunkt deutet auf Lösungsmittelrückstände oder<br />
Verunreinigungen im Feststoff hin.<br />
Literatur<br />
Organikum S.360<br />
1 Laborkatalog Merc<br />
CHO<br />
C +<br />
H<br />
N<br />
O<br />
O<br />
2<br />
CHO<br />
N<br />
O<br />
O<br />
+<br />
H +



![Photoswitchable ionophores based on 1,3-alternate calix[4]arenes ...](https://img.yumpu.com/12290271/1/190x253/photoswitchable-ionophores-based-on-13-alternate-calix4arenes-.jpg?quality=85)