Darstellung von Zinksulfat-Monohydrat - Chemie und ihre Didaktik ...
Darstellung von Zinksulfat-Monohydrat - Chemie und ihre Didaktik ...
Darstellung von Zinksulfat-Monohydrat - Chemie und ihre Didaktik ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Experiment 10<br />
<strong>Darstellung</strong> <strong>von</strong> <strong>Zinksulfat</strong>-<strong>Monohydrat</strong> aus alkoholischer Lösung<br />
<strong>Darstellung</strong> <strong>von</strong> <strong>Zinksulfat</strong>-<strong>Monohydrat</strong><br />
aus alkoholischer Lösung<br />
Zeitbedarf für die Versuchsdurchführung: ca. 10 Min. / bis zur nächsten Unterrichtsst<strong>und</strong>e<br />
Geräte:<br />
Heizrührer mit Magnetrührstäbchen<br />
Becherglas (100 ml)<br />
Waage<br />
Filterapparatur<br />
Messzylinder<br />
Spatel<br />
Trockenschrank<br />
Chemikalien:<br />
<strong>Zinksulfat</strong>-Hexahydrat,<br />
ZnSO 4 • 6 H 2 O, Xi, N, R36/38-50/53, S22-25-60-61<br />
Ethanol,<br />
C 2 H 5 OH, F, R11, S7-16<br />
Kupfersulfat (wasserfrei),<br />
CuSO 4 , Xn, N, R22-36/38-50/53, S22-60-61<br />
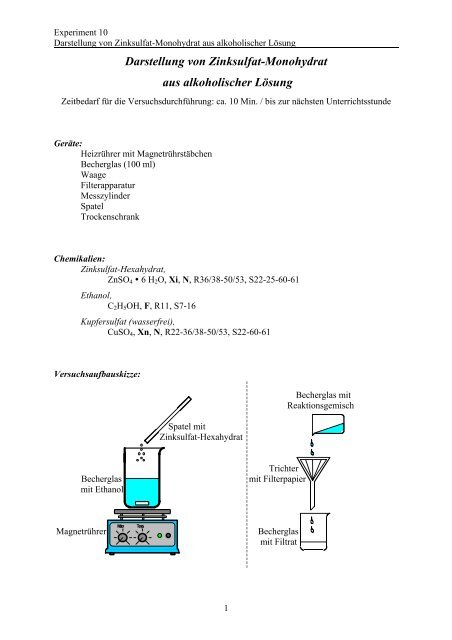
Versuchsaufbauskizze:<br />
Spatel mit<br />
<strong>Zinksulfat</strong>-Hexahydrat<br />
Becherglas mit<br />
Reaktionsgemisch<br />
Becherglas<br />
mit Ethanol<br />
Trichter<br />
mit Filterpapier<br />
Magnetrührer<br />
Motor<br />
Temp.<br />
Becherglas<br />
mit Filtrat<br />
1
Experiment 10<br />
<strong>Darstellung</strong> <strong>von</strong> <strong>Zinksulfat</strong>-<strong>Monohydrat</strong> aus alkoholischer Lösung<br />
Durchführung:<br />
In ein Becherglas mit 20 ml Ethanol werden 10,0 g <strong>Zinksulfat</strong>-Hexahydrat gegeben <strong>und</strong> dann<br />
das Gemisch kurz bis zum Siedepunkt erhitzt.<br />
Anschließend wird der Bodenkörper abfiltriert <strong>und</strong> 1 Tag im Trockenschrank bei 75°C<br />
getrocknet, abgekühlt <strong>und</strong> gewogen. Das Filtrat wird mit wasserfreiem Kupfersulfat versetzt<br />
<strong>und</strong> kurz erhitzt. (Blindversuch: Das eingesetzte Ethanol wird mit weißem Kupfersulfat<br />
versetzt.)<br />
Vom entstandenen getrockneten Produkt ist die Molmasse zu bestimmen!<br />
Anmerkung:<br />
Für die Löslichkeit in Ethanol lassen sich folgende Werte angeben: 1<br />
Temp. [°C] 15 25 35 55<br />
g ZnSO 4 /<br />
100 g C 2 H 5 OH<br />
0,038 0,034 0,029 0,020<br />
Beobachtung:<br />
Beim Erhitzen der Lösung tritt eine Trübung auf, das Filtrat ist klar.<br />
Die Masse des pulvrigen weißen Filtratrückstandes hat abgenommen (aus 10,0 g Einwaage<br />
<strong>Zinksulfat</strong>-Hexahydrat erhält man 6,67 g Produkt).<br />
Das zum Filtrat zugegebene weiße Kupfersulfat färbt sich bläulich. Beim Blindversuch mit<br />
Ethanol bleibt das Kupfersulfat weiß.<br />
Deutung:<br />
Beim Erhitzen verteilt sich das <strong>Zinksulfat</strong> in der Lösung, so dass eine Trübung durch fein<br />
verteiltes <strong>Zinksulfat</strong> auftritt.<br />
<strong>Zinksulfat</strong>-Hexahydrat besitzt die Molmasse 269,57 g/mol.<br />
1 aus: „Gmelins Handbuch der anorganischen <strong>Chemie</strong>: ZINK-Ergänzungsband“, 8. Aufl., Verlag <strong>Chemie</strong> GmbH,<br />
Weinheim, 1956 S. 958<br />
2
Experiment 10<br />
<strong>Darstellung</strong> <strong>von</strong> <strong>Zinksulfat</strong>-<strong>Monohydrat</strong> aus alkoholischer Lösung<br />
10,00 g <strong>Zinksulfat</strong>-Hexahydrat entsprechen demnach 0,037 mol <strong>Zinksulfat</strong>-Hexahydrat.<br />
Das Gewicht des entstandenen Produktes ist 66,7% des ursprünglichen Gewichtes <strong>von</strong><br />
<strong>Zinksulfat</strong>-Hexahydrat (<strong>von</strong> 10,00 g auf 6,67 g).<br />
Die Anzahl der Mole ( n ) bleibt nahezu erhalten, da die Löslichkeit <strong>von</strong> <strong>Zinksulfat</strong> in Ethanol<br />
sehr gering ist, so dass sich kaum <strong>Zinksulfat</strong> löst. Der evtl. entstehende Fehler ist so klein,<br />
dass er vernachlässigt werden kann.<br />
Demnach ist eine Molmasse des Produktes <strong>von</strong> 179,80 g/mol zu erwarten.<br />
( M(Produkt) =<br />
6,67 g<br />
0,037 mol<br />
= 179,80 g/mol )<br />
Da sich das ins Filtrat zugegebene weiße Kupfersulfat blau färbt, ist offensichtlich<br />
Kristallwasser aus dem <strong>Zinksulfat</strong>-Hexahydrat-Komplex entwichen.<br />
Man kann die Molmassen <strong>von</strong> <strong>Zinksulfat</strong> mit einer unterschiedlichen Anzahl <strong>von</strong><br />
Wassermolekülen als Liganden berechnen <strong>und</strong> diese mit der ermittelten Molmasse<br />
vergleichen.<br />
M(ZnSO 4 • 5 H 2 O)<br />
M(ZnSO 4 • 4 H 2 O)<br />
M(ZnSO 4 • 3 H 2 O)<br />
M(ZnSO 4 • 2 H 2 O)<br />
M(ZnSO 4 • 1 H 2 O)<br />
M(ZnSO 4 )<br />
= 251,55 g/mol<br />
= 233,53 g/mol<br />
= 215,51 g/mol<br />
= 197,49 g/mol<br />
= 179,57 g/mol<br />
= 161,45 g/mol<br />
Ein Vergleich der Molmassen zeigt, dass es sich bei dem entstandenen Produkt um<br />
<strong>Zinksulfat</strong>-<strong>Monohydrat</strong> handelt.<br />
Es findet folgende Reaktion statt, wobei Ethanol als hygroskopisches Medium die<br />
Wassermoleküle (Liganden), die nicht so fest am Zentralatom geb<strong>und</strong>en sind, entfernt. Das<br />
3
Experiment 10<br />
<strong>Darstellung</strong> <strong>von</strong> <strong>Zinksulfat</strong>-<strong>Monohydrat</strong> aus alkoholischer Lösung<br />
letzte Mol Wasser wird erst bei 240°C entfernt 2 , was zeigt, wie fest dieses Wassermolekül<br />
geb<strong>und</strong>en ist.<br />
Reaktionsgleichung:<br />
ZnSO 4 • 6 H 2 O<br />
Ethanol, 75°C<br />
ZnSO 4 • H 2 O + 5 H 2 O<br />
Nachweisreaktion auf Wasser:<br />
CuSO 4 + 5 H 2 O CuSO 4 • 5 H 2 O<br />
weiss<br />
blau<br />
Entsorgung:<br />
Das Filtrat muss der Entsorgung für organische Lösungsmittel zugeführt werden. Der<br />
Rückstand muss dem Schwermetallabfall zugeführt werden.<br />
2 aus: „CD Römpp <strong>Chemie</strong> Lexikon“, Vers. 1.0, Stuttgart/ New York: Georg Thieme Verlag, 1995, Stichwort<br />
„<strong>Zinksulfat</strong>“<br />
4