13. Gasaustausch I - Institut für Umweltphysik
13. Gasaustausch I - Institut für Umweltphysik
13. Gasaustausch I - Institut für Umweltphysik
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
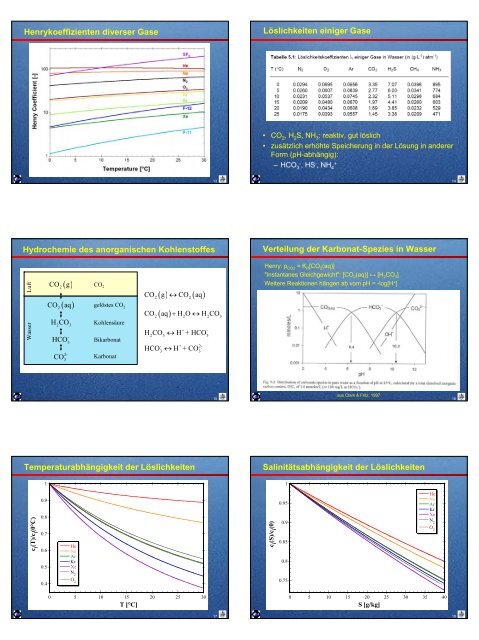
Henrykoeffizienten diverser Gase<br />
Löslichkeiten einiger Gase<br />
• CO 2 , H 2 S, NH 3 : reaktiv, gut löslich<br />
• zusätzlich erhöhte Speicherung in der Lösung in anderer<br />
Form (pH-abhängig):<br />
– HCO 3- , HS - , NH 4<br />
+<br />
13<br />
14<br />
Hydrochemie des anorganischen Kohlenstoffes<br />
Verteilung der Karbonat-Spezies in Wasser<br />
Luft<br />
Wasser<br />
CO2<br />
CO2<br />
( g)<br />
( aq)<br />
HCO<br />
2 3<br />
-<br />
HCO 3<br />
2-<br />
CO 3<br />
CO 2<br />
gelöstes CO 2<br />
Kohlensäure<br />
Bikarbonat<br />
Karbonat<br />
( ) ↔ ( )<br />
CO g CO aq<br />
2 2<br />
( )<br />
CO aq + H O ↔H CO<br />
HCO<br />
2 2 2 3<br />
↔ H + HCO<br />
+ -<br />
2 3 3<br />
HCO<br />
↔ H + CO<br />
- + 2-<br />
3 3<br />
Henry: p CO2 = K H [CO 2 (aq)]<br />
"Instantanes Gleichgewicht": [CO 2 (aq)] ↔ [H 2 CO 3 ]<br />
Weitere Reaktionen hängen ab vom pH = -log[H + ]<br />
15<br />
aus Clark & Fritz, 1997<br />
16<br />
Temperaturabhängigkeit der Löslichkeiten<br />
Salinitätsabhängigkeit der Löslichkeiten<br />
1<br />
1<br />
c i (T)/c i (0°C)<br />
0.9<br />
0.8<br />
0.7<br />
0.6<br />
0.5<br />
0.4<br />
He<br />
Ne<br />
Ar<br />
Kr<br />
Xe<br />
N 2<br />
O 2<br />
c i (S)/c i (0)<br />
0.95<br />
0.9<br />
0.85<br />
0.8<br />
0.75<br />
He<br />
Ne<br />
Ar<br />
Kr<br />
Xe<br />
N 2<br />
O 2<br />
0 5 10 15 20 25 30<br />
T [°C]<br />
0 5 10 15 20 25 30 35 40<br />
S [g/kg]<br />
17<br />
18