PROTEINANALYTIK
PROTEINANALYTIK
PROTEINANALYTIK
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>PROTEINANALYTIK</strong>
Proteinanalytik<br />
• Proteineigenschaften<br />
• Proteinquellen<br />
• Proteinisolierung<br />
• Proteinnachweis<br />
• Proteincharakterisierung
Aminosäuren
Proteine<br />
Molekulare Eigenschaften<br />
• Chemische Grundstruktur<br />
• Größe<br />
• Säure/Base-Eigenschaften<br />
• Hydrophilie - Hydrophobizität<br />
• Biologische Aktivität
Strukturmerkmale<br />
• Primär<br />
• Sekundär<br />
• Tertiär<br />
• Quartär<br />
Struktur
Strukturmerkmale
Nativer Proteinzustand
Protein-Denaturierung
Proteinquellen (1)<br />
Natürliche Proteinquellen<br />
•Gewebe vonTieren und Pflanzen<br />
•Extrazelluläre Flüssigkeiten<br />
•Mikroorganismen (E. coli, Hefe)<br />
Individuelle Proteinkonzentration oft gering
Proteinquellen (2)<br />
Gentechnisch hergestellte Proteine<br />
• Mikrobielle Systeme (E. coli, Hefe)<br />
• Klonierung in höheren Systemen (Zell-Linien<br />
aus Säugetieren, transgene Tiere,<br />
Insektenzellen, Pflanzenzellen)<br />
Hohe Proteinkonzentration (Überproduktion)<br />
Modifizierung des Proteins ?
Proteinisolierung (1)<br />
Intrazelluläre Proteine:<br />
• Zelldisruption<br />
• Abtrennung von unlöslichem Material<br />
Extrazelluläre Proteine<br />
• Zellabtrennung<br />
• Abtrennung von unlöslichem Material
Proteinisolierung (2)<br />
Homogenisierung (Gewebe ⇒ Zellen)<br />
Zellaufschluß (Zelle ⇒ Zellbestandteile)<br />
Proteinisolierung und -trennung<br />
Fällung, Zentrifugation, Chromatographie<br />
Abtrennung von Salzen<br />
Dialyse, Ultrafiltration, Gelchromatographie
Homogenisierung<br />
von Geweben<br />
Voraussetzungen für Homogenisierungsmedien:<br />
Schutz der Zellen vor osmotischer Lyse<br />
Schutz vor Proteasen<br />
Erhalt der biologischen Funktion<br />
Verhinderung von Aggregation<br />
Geringe Zerstörung von Organellen<br />
Keine Interferenz mit biologischen Analysen und<br />
funktionellen Tests
Zellaufschluss<br />
• Schwache Scherkräfte (bei sehr empfindlichen Zellen,<br />
z.B. Leukocyten)<br />
• Osmolytisches Aufbrechen (z.B. Isolierte Blutzellen)<br />
• Einfrieren/Auftauen (bei Bakterien)<br />
• Trocknen (bei Hefen)<br />
• Entwässerung durch organische Lösungsmittel<br />
• Mechanische Zerkleinerung (Vibrationszellmühle,<br />
Messerhomogenisator, Ultraschall, French- Presse, ...)
Proteinisolierung (Summary)
Proteinlöslichkeit (1)
Proteinlöslichkeit (2)<br />
Effekt geringer Ionenkonzentration<br />
Je geringer die Ionenkonzentration im<br />
Lösungsmittel ist, umso eher neigen die<br />
Proteine dazu ihre Oberflächenladung<br />
gegenseitig durchAggregatbildung zu<br />
kompensieren. Große Aggregate fallen aus.<br />
Praxis:<br />
Verdünnen oder Dialyse gegen Wasser.<br />
Bei physiologischer Ionenstärke werden die<br />
Ladungen der Proteine durch Salzionen<br />
kompensiert
Proteinlöslichkeit (3)
Proteinlöslichkeit (4)
Proteinfällung (1)<br />
• Salze<br />
• Organische Lösungsmittel<br />
• Trichloressigsäure<br />
Isolierung des Proteinpräzipitats durch Zentrifugation
Abtrennung von Salzen<br />
(und hydrophilen Molekülen)<br />
• Dialyse<br />
• Ultrafiltration<br />
• Gelchromatographie<br />
• Reversed phase-Chromatographie
Dialyse<br />
Entfernung oder Austausch von kleinen<br />
Molekülen aus einer Lösung über eine<br />
semipermeable Membran<br />
• Standardverfahren zum Entfernen von (NH4)2SO4 aus<br />
Ammoniumsulfatfällungen oder zur „Umpufferung“ von Proteinlösungen<br />
für die Säulenchromatographie.<br />
• Prinzip:<br />
Semipermeable Membran, die von Proteinen nicht durchquert werden kann.<br />
Anorganische Salze und niedermolekulare Verbindungen können passieren<br />
Cut-Off der Membranen (PVDF, Cellulose) von 1-50 kDa. Dialyseschlauch<br />
muß durch Kochen in 0.1 M NaHCO3/10 mM EDTA und sorgfältiges Spülen<br />
rehydratisiert werden (Aufbewahrung in 70% EtOH)
Konzentrierung<br />
• Fällung<br />
• Ultrafiltration und Diafiltration
Proteinstabilisierung (1)<br />
Schutz vor Proteasen (biochemischer Abbau)<br />
Protease-Inhibitoren (oft als „Cocktail")<br />
• Phenylmethylsulfonylfluorid (PMSF) Serinproteasen<br />
• Aprotinin<br />
• e-Amino-n-capronsäure<br />
• Pepstatin Aspartatproteasen<br />
• Leupeptin Cysteinproteasen<br />
• Antipain<br />
• Ethylendiamintetraessigsäure (EDTA) Metalloproteasen
Proteinstabilisierung (2)<br />
Schutz vor Denaturierung (physikalischer oder<br />
chemischer Effekt)<br />
Erhaltung des nativen Zustands und der biologischen Aktivität<br />
pH-Wert (Säure-Basen-Gruppen)<br />
Salzkonzentration (physiologisch)<br />
Proteinkonzentration (Aggregationen)<br />
Detergenzien (hydrophobe Proteine)<br />
Reduzierende Agenzien (Mercaptoethanol, Dithiothreitol-DTT)
Proteinstabilisierung (3)<br />
Hydrophobe Proteine
Proteinnachweis (1)<br />
Proteinbestimmungsmethoden<br />
• Biuret-Test<br />
• Lowry-Test<br />
• BC-Assay<br />
• Bradford-Assay<br />
• UV-Methoden<br />
<br />
Aktivitätstests<br />
• einfacher enzymatischer Assay<br />
• gekoppelter enzymatischer Assay<br />
• Bindungstests<br />
Immunchemische Verfahren<br />
• ELISA<br />
• Western-Blot
Proteinnachweis (2)<br />
Biuret-Reaktion<br />
Bicinchoninsäure-Assay<br />
Coomassie-Blau/ Bradford-Assay
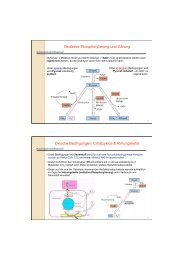
Zentrifugation (1)<br />
Physikalisches Prinzip:<br />
Trennung nach Größe und Dichte<br />
Beschleunigung: B = ω 2 . r<br />
ω…Winkelgeschwindigkeit<br />
r….Radius<br />
Relative Zentrifugalbeschleunigung (RZB):<br />
bezogen auf die Erdbeschleunigung RZB = B/ 981<br />
Sedimentationsgeschwindigkeit v (Svedberg-Gleichung)<br />
v = D 2 .(ρ p -ρ m ).RZB / 18η<br />
D Teilchendurchmesser<br />
ρ Dichte (Probe/Medium)<br />
η Viskosität
Zentrifugation (2)<br />
Sedimentationskoeffizient s:<br />
s = v / rω 2<br />
s ist die Sedimentationsgeschwindigkeit unter<br />
geometrisch vorgegebenen Bedingungen des<br />
Zentrifugalfeldes.<br />
s wird in Svedberg-Einheiten (S)angegeben:<br />
1 S = 10 -13 s
Zentrifugationstechniken<br />
• Differentielle Zentrifugation<br />
Ausnützen unterschiedlicher Sedimentationsgeschwindigkeiten<br />
im Festwinkelrotor<br />
• Zonenzentrifugation<br />
Selektion durch Einbringen eines “flachen” Gradienten<br />
• Isopyknische Zentrifugation<br />
Trennung von Teilchen gleicher Größe, aber unterschiedlicher Dichte<br />
Dichtegradienten<br />
Kontinuierlicher oder diskontinuierlicher Gradient (CsCl, Sucrose,<br />
Polysaccharide, jodierte Aromaten)
Zonenzentrifugation
Rotoren für die Zentrifugation
Dichte und Sedimentationskonstanten<br />
von Zellbestandteilen