8-Stoffwechsel Ib
8-Stoffwechsel Ib
8-Stoffwechsel Ib
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
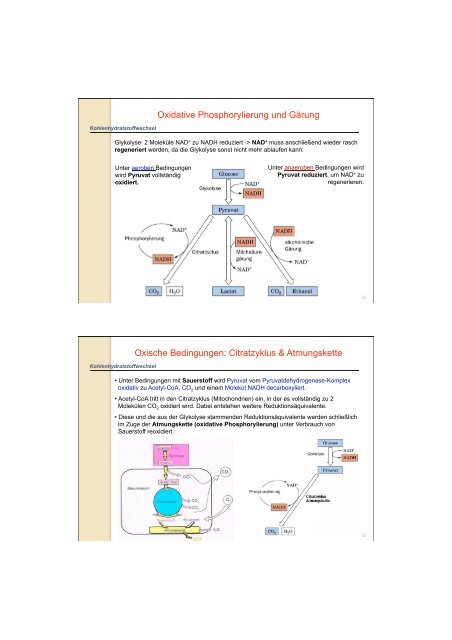
Kohlenhydratstoffwechsel<br />
Unter aeroben Bedingungen<br />
wird Pyruvat vollständig<br />
oxidiert.<br />
Oxidative Phosphorylierung und Gärung<br />
Glykolyse: 2 Moleküle NAD + zu NADH reduziert -> NAD + muss anschließend wieder rasch<br />
regeneriert werden, da die Glykolyse sonst nicht mehr ablaufen kann:<br />
Kohlenhydratstoffwechsel<br />
Unter anaeroben Bedingungen wird<br />
Pyruvat reduziert, um NAD + zu<br />
regenerieren.<br />
Oxische Bedingungen: Citratzyklus & Atmungskette<br />
• Unter Bedingungen mit Sauerstoff wird Pyruvat vom Pyruvatdehydrogenase-Komplex<br />
oxidativ zu Acetyl-CoA, CO 2 und einem Molekül NADH decarboxyliert.<br />
• Acetyl-CoA tritt in den Citratzyklus (Mitochondrien) ein, in der es vollständig zu 2<br />
Molekülen CO 2 oxidiert wird. Dabei entstehen weitere Reduktionsäquivalente.<br />
• Diese und die aus der Glykolyse stammenden Reduktionsäquivalente werden schließlich<br />
im Zuge der Atmungskette (oxidative Phosphorylierung) unter Verbrauch von<br />
Sauerstoff reoxidiert.<br />
42<br />
43
Kohlenhydratstoffwechsel<br />
Oxische Bedingungen: Citratzyklus & Atmungskette<br />
• Unter Bedingungen mit Sauerstoff wird Pyruvat vom Pyruvatdehydrogenase-Komplex<br />
oxidativ zu Acetyl-CoA, CO 2 und einem Molekül NADH decarboxyliert.<br />
• Acetyl-CoA tritt in den Citratzyklus (Mitochondrien) ein, in der es vollständig zu 2<br />
Molekülen CO 2 oxidiert wird. Dabei entstehen weitere Reduktionsäquivalente.<br />
• Diese und die aus der Glykolyse stammenden Reduktionsäquivalente werden schließlich<br />
im Zuge der Atmungskette (oxidative Phosphorylierung) unter Verbrauch von<br />
Sauerstoff reoxidiert.<br />
Kohlenhydratstoffwechsel<br />
Anoxische Bedingungen: Gärung<br />
In den Gärungsschritten wird im Gegensatz zum aeroben Abbauweg kein ATP gebildet.<br />
In der ALKOHOLISCHEN GÄRUNG (Hefen)<br />
wird aus Pyruvat in 2 Reaktionen durch<br />
die Pyruvatdecarboxylase und die<br />
Alkoholdehydrogenase Ethanol gebildet.<br />
Dabei wird das NADH aus der Glykolyse<br />
zu NAD + reoxidiert.<br />
Milchsäurebakterien und auch die<br />
Muskelzellen im Menschen betreiben die<br />
MILCHSÄUREGÄRUNG. Hierbei wird Pyruvat<br />
durch eine Lactatdehydrogenase mittels<br />
NADH zu L-Lactat und NAD + reduziert.<br />
44<br />
45
Kohlenhydratstoffwechsel<br />
Homofermentative Milchsäuregärung:<br />
Milchsäuregärung<br />
• homofermentativen Milchsäurebakterien<br />
• bei Sauerstoffmangel von einigen Pilzen, Pflanzen, Tieren und<br />
Menschen<br />
Dabei werden Zucker zunächst in der Glykolyse zu Pyruvat<br />
abgebaut. Dieses wird von der Laktatdehydrogenase mit NADH<br />
zu Lactat (Anion der Milchsäure) reduziert. Das NADH wird<br />
dabei zu NAD + oxidiert.<br />
Im Verlauf der Glykolyse werden je Molekül Glucose je 2<br />
Moleküle Lactat, NADH und ATP gebildet, so dass die<br />
Nettoenergieausbeute 2 Moleküle ATP je Molekül Glucose<br />
beträgt.<br />
Kohlenhydratstoffwechsel<br />
Glucose + 2 ADP + 2 Pi 2 Lactat + 2 ATP + 2 H 2 O + 2 H +<br />
Milchsäuregärung beim Menschen<br />
Im Vergleich zur aeroben Atmung wird bei Gärungen<br />
nur eine geringe Menge Energie (dafür rasch)<br />
gewonnen, da dabei nur die<br />
Substratkettenphosphorylierung genutzt wird.<br />
Auf Milchsäuregärung spezialisierte Zellen beim<br />
Menschen:<br />
• Erythrozyten: keine Mitochondrien -> können Glu<br />
nur unter anaeroben Bedingungen verstoffwechseln<br />
• Muskelzellen: wenn nicht genügend O 2 für aerobe Atmung (bei anstrengender<br />
Muskeltätigkeit) -> Körper zerlegt im Muskel gespeichertes Glykogen ohne ATP-<br />
Verbrauch in Glu-6-P-> anaerob zu Lactat abgebaut -> Lactat sammelt sich in Muskeln<br />
-> Übersäuerung -> Muskelerschöpfung und Müdigkeit -> Lactat in Ruhephasen<br />
durch Blut in Leber transportiert und zu Pyruvat oxidiert (Glucose-Synthese)<br />
ATP Produktion in der Glycolyse ist ca. 100-mal schneller als durch oxidative<br />
Phosphorylierung. Daher verbraucht der Muskel überwiegend „glykolytisches“ ATP.<br />
46<br />
47
Kohlenhydratstoffwechsel<br />
Kohlenhydratstoffwechsel<br />
Reaktion der Lactatdehydrogenase<br />
NADH überträgt ein Hydridion (H - ) auf<br />
die Ketogruppe des Pyruvat.<br />
-> Säure-katalysiert (His 195)<br />
Die Lactatdehydrogenase findet man im Cytosol der Zellen<br />
des gesamten menschlichen Organismus -> 5 Isoenzyme:<br />
LDH-1 – Herz<br />
LDH-2 – Lymphsystem<br />
LDH-3 – Lunge<br />
LDH-4 – Nieren<br />
LDH-5 – Leber, Quergestreifte Muskulatur<br />
Alkoholische Gärung<br />
Glucose + 2 ADP + 2 Pi 2 Ethanol + CO 2 + 2 ATP + 2 H 2 O + 2 H +<br />
Hefen haben in der alkoholischen Gärung eine alternative Möglichkeit zur E-<br />
Gewinnung, wenn kein O 2 zur Verfügung steht. Im Vergleich zur Zellatmung entsteht<br />
dabei aber weniger Energie: bei vollständiger Oxidation werden aus 1 Molekül Glucose<br />
38 ATP gewonnen, bei der alkoholischen Gärung nur 2 ATP (aus der Glykolyse).<br />
Die zwei weiteren Reaktionsschritte der Gärung (Ethanolproduktion) dienen nur mehr der<br />
Regeneration von NAD + . Hefe regeneriert NAD + dabei durch einen zweistufigen<br />
Prozess, bei der Pyruvat zunächst in Acetaldehyd umgewandelt wird und dieser dann<br />
unter Verwendung von NADH zu Ethanol reduziert wird:<br />
Pyruvatdecarboxylase: TPP (B1) – abhängig<br />
48<br />
49
Kohlenhydratstoffwechsel<br />
Kohlenhydratstoffwechsel<br />
Reaktion der Alkoholdehydrogenase<br />
NADH überträgt ein Hydridion (H - ) auf die Ketogruppe des Acetaldehyds!<br />
-> Metallionen-katalysiert (Zn 2+ )<br />
Acetaldehyd ist sehr giftig und wird deshalb schnell<br />
durch die ADH umgesetzt:<br />
ADH enthält ein Zink-Ion (Zn 2+ ), welches die<br />
Carbonylgruppe am Acetaldehyd polarisiert. Dadurch<br />
können 2 e - und 1 H + vom NADH auf Acetaldehyd<br />
übertragen werden, wodurch es zu EtOH reduziert und<br />
NAD + regeneriert wird.<br />
Andere Hexosen werden während der Investmentphase in die Glykolyse<br />
eingeschleust:<br />
Galactosämie: Galactose<br />
kann nicht in G6P<br />
umgewandelt werden<br />
Angeborene Fructose-Intoleranz:<br />
Fructose kann in der Leber nicht<br />
abgebaut werden (selten)<br />
Abbau anderer Hexosen<br />
50<br />
51
Kohlenhydratstoffwechsel<br />
Abbau anderer Hexosen: Beispiel<br />
GALAKTOSE-Eintritt in Glykolyse:<br />
• Spaltung von Lactose (Milchzucker) in D-Glucose und D-Galactose<br />
• D-Galactose durch Galactokinase unter ATP-Verbrauch in Galactose-1-P umgewandelt<br />
• Austausch von UDP-gebundener Glucose mit Galactose (durch GALT: Galactose-1-<br />
phosphat-Uridyltransferase) -> es entsteht Glucose-1-P und UDP-Galactose<br />
-> bei Galactosämie fehlt GALT<br />
• Glucose-1-P zu Glucose-6-P isomerisiert<br />
• UDP-Galactose zu UDP-Glucose epimerisiert<br />
Kohlenhydratstoffwechsel<br />
Gluconeogenese<br />
Wenn keine Kohlenhydrate in der Nahrung zur<br />
Verfügung stehen und die Glycogenspeicher<br />
verbraucht sind, werden Zucker aus „Nicht-<br />
Kohlenhydraten“ in der Leber synthetisiert:<br />
Gluconeogenese = Neusynthese von Glucose<br />
aus organischen Nicht-Kohlenhydrat-Bausteinen<br />
wie Pyruvat, Lactat und Abbauprodukte von<br />
Aminosäuren.<br />
Täglicher Glucose-Bedarf: ca. 160 g.<br />
Fettsäuren können NICHT für die<br />
Gluconeogenese verwendet werden,<br />
da diese direkt zu Acetyl-CoA<br />
abgebaut werden, und es keinen<br />
Nettoumsatz zu Oxalacetat (dem<br />
zentralen Metaboliten der<br />
Gluconeogenese) gibt!<br />
Mitochondrium<br />
ER<br />
Cytosol<br />
52<br />
53
Kohlenhydratstoffwechsel<br />
Kohlenhydratstoffwechsel<br />
Oxalacetat, zentraler Metabolit der Gluconeogenese<br />
Bis auf drei enzymatische Schritte (Kinase-katalysiert) ist die Gluconeogenese die<br />
Umkehrung der Glykolyse:<br />
Glu -> Glu-6-P (Hexokinase)<br />
Fru-6-P -> Fru-1,6-BP (Phosphofructokinase)<br />
PEP -> Pyruvat (Pyruvatkinase)<br />
Oxalacetat, zentraler Metabolit der Gluconeogenese<br />
54<br />
Zwei dieser Umkehr-Reaktion<br />
dienen der Umwandlung von<br />
Pyruvat in PEP :<br />
55
Kohlenhydratstoffwechsel<br />
Pyruvatcarboxylase<br />
Pyruvatcarboxylase ist ein Biotin-abhängiges Enzym und carboxyliert Pyruvat zu<br />
Oxalacetat:<br />
Biotin als prostthetische Gruppe fungiert dabei als mobiler Carrier von aktiviertem CO 2 .<br />
Das Biotin ist über seine Carboxygruppe an einem Lysinrest gebunden. Dadurch entsteht<br />
ein flexibler Arm, wodurch die Biotingruppe von einem aktiven Zentrum zum zweiten<br />
„schwingen“ kann.<br />
Kohlenhydratstoffwechsel<br />
Die Reaktion von Pyruvat zu Oxalacetat besteht aus zwei Phasen -><br />
Mechanismus der Pyruvatcarboxylase: Schritt 1<br />
Die Reaktion der Pyruvatcarboxylase vollzieht sich in zwei Phasen:<br />
56<br />
57
Kohlenhydratstoffwechsel<br />
Phosphoenolpyruvat (PEP)-Carboxykinase: Schritt 2<br />
Im 2. Schritt reagiert das „aktivierte“ Pyruvat mit GTP (ähnlich dem ATP eine<br />
energiereiche Verbindung) zu Phosphoenolpyruvat:<br />
Von Pyruvat zu Glucose müssen insgesamt 6 Moleküle ATP (4 ATP + 2 GTP)<br />
aufgewendet werden.<br />
Der Abbau von Glucose zu Pyruvat und Resynthese von Glucose verbraucht<br />
daher netto 4 Moleküle ATP!<br />
Kohlenhydratstoffwechsel<br />
Pentosephosphatweg<br />
Neben ATP benötigt der Organismus auch Reduktionskraft (=Äquivalente), die für<br />
anabolische Reaktionen (Biosynthesen) benötigt werden:<br />
-> der Pentosephosphatweg (Hexosemonophosphat-Shunt) im Cytosol stellt eine<br />
Möglichkeit der Verwertung von Kohlenhydraten dar, bei dem<br />
Reduktionsäquvialente in Form von NADPH generiert werden.<br />
-> Weiters dient er der Interkonversion von verschiedenen Kohlenhydraten.<br />
-> Dieser Seitenweg der Glycolyse ist vor allem in der Leber aktiv, wo ca. 30% der<br />
Glucose über diesen <strong>Stoffwechsel</strong>weg oxidiert werden.<br />
Die Reaktionen lassen sich wie folgt zusammenfassen:<br />
3 G6P + 6 NADP + + 3 H 2 O 6 NADPH + 6 H + + 3 CO 2 + 2 F6P + GAP<br />
58<br />
59
Kohlenhydratstoffwechsel<br />
Die 3 Phasen bzw. 2 Äste des Pentosephosphatweges<br />
Phase 1 (Oxidativer, irreversibler Ast):<br />
Oxidation von Glu-6-P erzeugt NADPH und Ribulose-5-phosphat (Ru-5-P):<br />
3 Glu-6-P + 6 NADP + + 3 H 2 6 NADPH + 6 H + + 3 CO 2 + 3 Ru-5-P<br />
Nicht-OX.<br />
Phase 2 (Nicht-Oxidativer, reversibler Ast):<br />
Isomerisierung und Epimerisierung von Ru-5-P zu<br />
Ribose-5-Phosphat bzw. Xylulose-5-Phosphat:<br />
3 Ru-5-P R-5-P + 2 Xu-5-P<br />
Phase 3 (Nicht-Oxidativer, reversibler Ast):<br />
Umwandlung der Zucker<br />
NADPH Produktion im Pentosephosphatweg (oxidativ. Ast)<br />
Kohlenhydratstoffwechsel<br />
1. Phase: Zwei Reaktionen stellen NADPH bereit<br />
Intramolekularer Ester<br />
OX.<br />
60<br />
61
Kohlenhydratstoffwechsel<br />
Phase 3: Reorganisation der Zucker (nicht-oxidativ. Ast)<br />
In der 3. Phase werden verschiedene Monosaccharide ineinander umgewandelt.<br />
Dabei entstehen Monosaccharide, die für die Biosynthese von anderen Verbindungen<br />
essentiell sind, wie z. B. Ribose-5-Phosphat und Erythrose-4-Phosphat:<br />
Transketolase<br />
Transaldolase<br />
Transketolase<br />
(Reaktionen siehe nächste Folie!)<br />
62<br />
63
Verwendung der Zucker aus dem Pentosephosphatweg<br />
Kohlenhydratstoffwechsel<br />
Kohlenhydratstoffwechsel<br />
Bereitstellung von NADPH für:<br />
• Synthese von FS<br />
• Synthese von Steroiden<br />
• Entgiftungsreaktionen<br />
Bereitstellung von R5P für:<br />
• RNA Biosynthese<br />
• DNA Biosynthese<br />
Glycolyse und Pentosephospatweg<br />
Nukleinsäurebiosynthese<br />
Biosynthese von Aromaten, Lignin<br />
& Polyphenolen<br />
64<br />
65
Kohlenhydratstoffwechsel<br />
NADPH in Entgiftungsreaktionen<br />
NADPH wird auch für Entgiftungsreaktionen benötigt!<br />
-> besondere Rolle bei der Entgiftung von toxischen<br />
Hydroperoxiden: Erythrozyten z.B. sind durch den<br />
Transport von Sauerstoff besonders gefährdet vor<br />
oxidativen Schäden durch reaktive<br />
Sauerstoffspezies (ROS), wie z.B.<br />
Wasserstoffperoxid (H 2 O 2 ).<br />
Glutathion-Peroxidase verwendet GSH =<br />
reduziertes Glutathion (γ-L-Glutamyl-L-Cysteinyl-<br />
Glycin), um Hydroperoxide zu Alkohol und Wasser zu<br />
reduzieren. Dabei entsteht GSSG, oxidiertes<br />
Glutathion.<br />
Die Glutathion-Reduktase verwendet NADPH, um<br />
das oxidierte GSSG wieder zu GSH zu reduzieren.<br />
Dieser Reaktionszyklus ist essentiell für Erythrocyten,<br />
d.h. sie sind völlig auf den Pentose-P-Weg angewiesen.<br />
Ein Mangel an NADPH führt zu vorzeitigem Zelltod.<br />
Kohlenhydratstoffwechsel<br />
Medikamente<br />
Nahrungsmittel<br />
Glutathion-Peroxidase<br />
Glutathion-Reduktase<br />
G6PDH<br />
Mangel an Glucose-6-Phosphatdehydrogenase<br />
Menschen mit G6P-Dehydrogenase Mangel können an einer schweren hämolytischen<br />
Anämie erkranken:<br />
DURCH EINEN DEFEKT IN DER G6PDH SIND DIE ERYTHROZYTEN ERHÖHTEM OXIDATIVEN<br />
STRESS AUSGESETZT -> ZU WENIG NADPH GENERIERT, SO DASS Z.B. OXIDATIVEN SCHÄDEN<br />
IN DER BLUTKÖRPERCHEN-MEMBRAN ENTSTEHEN -> DARUM HÄMOLYTISCHE ANÄMIE!<br />
Auslöser Symptome der hämolytischen Anämie:<br />
• hohe Dosen von Medikamenten, wie z.B. Anti-<br />
malariamittel Primaquin<br />
• bestimmte Nahrungsmittel enthalten Substanzen,<br />
die ebenfalls Symptome verursachen können<br />
(Fava-Bohnen, Vicia faba: Favismus)<br />
Vicia faba<br />
66<br />
67
Kohlenhydratstoffwechsel<br />
G6PDH Mangel & Malaria<br />
G6PDH Mangel ist eine der am weitesten<br />
verbreitete genetische Erkrankung (ca. 400<br />
Mio. Menschen sind Träger).<br />
G6PDH-Mangel ist erblich und weist einen Xchromosomalen<br />
Erbgang auf -> d.h.<br />
heterozygote Träger (Frauen) haben ein<br />
geringeres Erkrankungsrisiko.<br />
G6PDH-Defizienz ist weit verbreitet in<br />
Gebieten, in denen die Malaria heimisch ist<br />
(ca. 50% der Menschen sind Träger). Warum?<br />
VERBREITUNGSKARTE VON MALARIA<br />
Menschen mit einem G6PDH-Defekt haben einen erhöhten Schutz gegen<br />
Malaria, da sich der Erreger Plasmodium falciparum in den Erythrozyten<br />
vermehrt, aber sehr empfindlich gegenüber oxidativen Stress ist -><br />
Selektionsvorteil: Ein G6PDH-Mangel ist in den Gegenden verbreitet, bei<br />
denen Malaria häufig auftritt.<br />
68