5.1.6: Tetraphenylcyclopentadienon
5.1.6: Tetraphenylcyclopentadienon
5.1.6: Tetraphenylcyclopentadienon
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
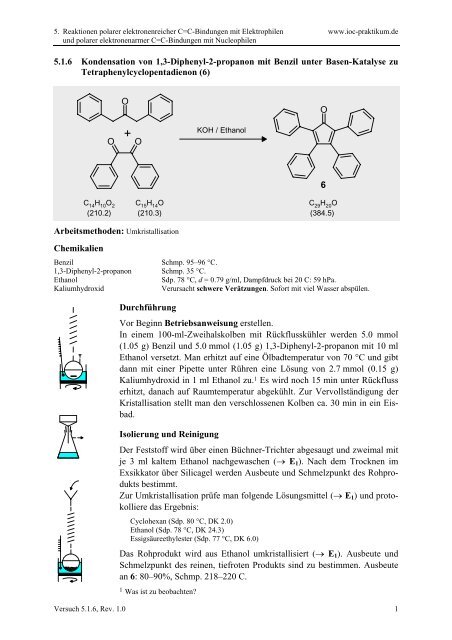
<strong>5.1.6</strong> Kondensation von 1,3-Diphenyl-2-propanon mit Benzil unter Basen-Katalyse zu<br />
<strong>Tetraphenylcyclopentadienon</strong> (6)<br />
O<br />
O<br />
O<br />
+<br />
O<br />
KOH / Ethanol<br />
C 14<br />
H 10<br />
O 2<br />
(210.2)<br />
C 15<br />
H 14<br />
O<br />
(210.3)<br />
6<br />
C 29<br />
H 20<br />
O<br />
(384.5)<br />
Arbeitsmethoden: Umkristallisation<br />
Chemikalien<br />
Benzil<br />
1,3-Diphenyl-2-propanon<br />
Ethanol<br />
Kaliumhydroxid<br />
Schmp. 95–96 °C.<br />
Schmp. 35 °C.<br />
Sdp. 78 °C, d = 0.79 g/ml, Dampfdruck bei 20 C: 59 hPa.<br />
Verursacht schwere Verätzungen. Sofort mit viel Wasser abspülen.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einem 100-ml-Zweihalskolben mit Rückflusskühler werden 5.0 mmol<br />
(1.05 g) Benzil und 5.0 mmol (1.05 g) 1,3-Diphenyl-2-propanon mit 10 ml<br />
Ethanol versetzt. Man erhitzt auf eine Ölbadtemperatur von 70 °C und gibt<br />
dann mit einer Pipette unter Rühren eine Lösung von 2.7 mmol (0.15 g)<br />
Kaliumhydroxid in 1 ml Ethanol zu. 1 Es wird noch 15 min unter Rückfluss<br />
erhitzt, danach auf Raumtemperatur abgekühlt. Zur Vervollständigung der<br />
Kristallisation stellt man den verschlossenen Kolben ca. 30 min in ein Eisbad.<br />
Isolierung und Reinigung<br />
Der Feststoff wird über einen Büchner-Trichter abgesaugt und zweimal mit<br />
je 3 ml kaltem Ethanol nachgewaschen (→ E 1 ). Nach dem Trocknen im<br />
Exsikkator über Silicagel werden Ausbeute und Schmelzpunkt des Rohprodukts<br />
bestimmt.<br />
Zur Umkristallisation prüfe man folgende Lösungsmittel (→ E 1 ) und protokolliere<br />
das Ergebnis:<br />
Cyclohexan (Sdp. 80 °C, DK 2.0)<br />
Ethanol (Sdp. 78 °C, DK 24.3)<br />
Essigsäureethylester (Sdp. 77 °C, DK 6.0)<br />
Das Rohprodukt wird aus Ethanol umkristallisiert (→ E 1 ). Ausbeute und<br />
Schmelzpunkt des reinen, tiefroten Produkts sind zu bestimmen. Ausbeute<br />
an 6: 80–90%, Schmp. 218–220 C.<br />
1 Was ist zu beobachten?<br />
Versuch <strong>5.1.6</strong>, Rev. 1.0 1
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
Hinweise zur Entsorgung (E)<br />
E 1 : Filtrat bzw. Mutterlaugen → Entsorgung (RH).<br />
Auswertung des Versuchs<br />
1 H-NMR-Spektrum von 6 (300 MHz, CDCl 3 ): δ = 6.90–6.97 (4 H), 7.13–7.21 (4 H), 7.21–7.30 (12 H).<br />
7.5 7.0<br />
6.5<br />
8.0 7.0 6.0 5.0 4.0<br />
3.0 2.0 [ppm] 0.0<br />
13 C-NMR Spektrum von 6 (75.5 MHz, CDCl 3 ): δ = 125.31 (C), 127.50 (CH), 128.02 (CH), 128.07 (CH),<br />
128.54 (CH), 129.36, (CH), 130.17 (CH), 130.75 (C), 133.05 (C), 154.50 (C), 200.39 (C).<br />
LM<br />
135<br />
130<br />
125<br />
220<br />
200<br />
180<br />
160<br />
140<br />
120<br />
100 80 60 40 20 [ppm] 0<br />
IR-Spektrum von 6 (KBr):<br />
100<br />
T [%]<br />
3030<br />
3055<br />
50<br />
1600<br />
1710<br />
0<br />
~<br />
4000 3000 2000 1500 1000 ν [cm -1 ]<br />
* Formulieren Sie den zu 6 führenden Reaktionsmechanismus.<br />
Versuch <strong>5.1.6</strong>, Rev. 1.0 2
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
Weitere denkbare Reaktionsprodukte:<br />
O<br />
O<br />
O<br />
H 5<br />
C 6<br />
HO OH<br />
H 5<br />
C 6<br />
C 6<br />
H 5<br />
C 6<br />
H 5<br />
C 6<br />
H 5<br />
H 5<br />
C 6<br />
OH<br />
C 6<br />
H 5<br />
H 5<br />
C 6<br />
C 6<br />
H 5 H 5<br />
C 6<br />
C 6<br />
H 5<br />
H 5<br />
C 6<br />
C 6<br />
H 5<br />
H 5<br />
C 6<br />
C 6<br />
H 5<br />
H 5<br />
C 6<br />
C 6<br />
H 5<br />
A B C D<br />
C 6<br />
H 5<br />
* Mit welchen spektroskopischen Daten lassen sich A–D ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen. In welchem Zusammenhang stehen A/B sowie C/D?<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
Literatur, auf der dieser Versuch beruht: [1]. Die zweite Wasserabspaltung erfordert höhere Temperaturen; wird<br />
die Reaktion bei Raumtemperatur durchgeführt, lässt sich das Produkt B isolieren. [2]<br />
Die cyclisierende einfache oder zweifache Aldolkondensation hat erhebliche präparative Bedeutung. [3] Hierher<br />
gehört z.B. auch die Robinson-Anellierung und die sog. Weiss-Reaktion (siehe Kap. 5.5).<br />
[1] J.R. Johnson, O. Grummit in Organic Syntheses Coll. Vol. 3 (Hrsg. E.C. Horning), J. Wiley & Sons, New<br />
York, 1955, S. 806–807.<br />
[2] E. A. Harrison, Jr., J. Chem. Educ. 1988, 65, 828.<br />
[3] Siehe z.B.: G.L. Buchanan, C. Maxwell, W. Henderson, Tetrahedron 1965, 21, 3273–3276.<br />
Versuch <strong>5.1.6</strong>, Rev. 1.0 3