5.2.2: 4-tert-Butyl-2-acetylcyclohexanon
5.2.2: 4-tert-Butyl-2-acetylcyclohexanon
5.2.2: 4-tert-Butyl-2-acetylcyclohexanon
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
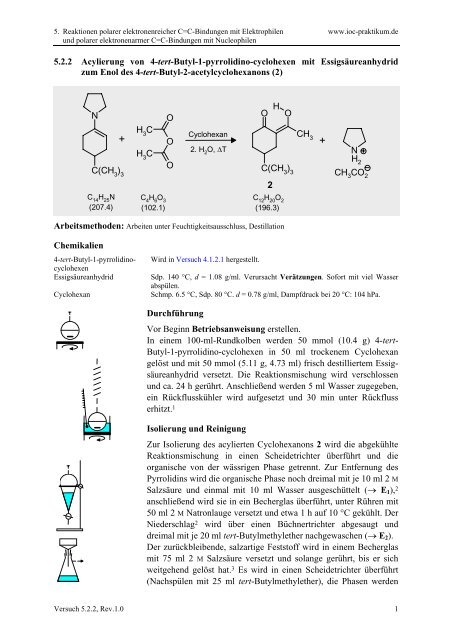
<strong>5.2.2</strong> Acylierung von 4-<strong>tert</strong>-<strong>Butyl</strong>-1-pyrrolidino-cyclohexen mit Essigsäureanhydrid<br />
zum Enol des 4-<strong>tert</strong>-<strong>Butyl</strong>-2-<strong>acetylcyclohexanon</strong>s (2)<br />
N<br />
C(CH 3<br />
) 3<br />
C 14<br />
H 25<br />
N<br />
(207.4)<br />
+<br />
H 3<br />
C<br />
H 3<br />
C<br />
C 4<br />
H 6<br />
O 3<br />
(102.1)<br />
O<br />
O<br />
O<br />
Cyclohexan<br />
2. H 2<br />
O, ΔT<br />
O<br />
H<br />
O<br />
C(CH 3<br />
) 3<br />
CH 3<br />
2<br />
C 12<br />
H 20<br />
O 2<br />
(196.3)<br />
+<br />
N<br />
H 2<br />
CH 3<br />
CO 2<br />
Arbeitsmethoden: Arbeiten unter Feuchtigkeitsausschluss, Destillation<br />
Chemikalien<br />
4-<strong>tert</strong>-<strong>Butyl</strong>-1-pyrrolidinocyclohexen<br />
Essigsäureanhydrid<br />
Cyclohexan<br />
Wird in Versuch 4.1.2.1 hergestellt.<br />
Sdp. 140 °C, d = 1.08 g/ml. Verursacht Verätzungen. Sofort mit viel Wasser<br />
abspülen.<br />
Schmp. 6.5 °C, Sdp. 80 °C. d = 0.78 g/ml, Dampfdruck bei 20 °C: 104 hPa.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einem 100-ml-Rundkolben werden 50 mmol (10.4 g) 4-<strong>tert</strong>-<br />
<strong>Butyl</strong>-1-pyrrolidino-cyclohexen in 50 ml trockenem Cyclohexan<br />
gelöst und mit 50 mmol (5.11 g, 4.73 ml) frisch destilliertem Essigsäureanhydrid<br />
versetzt. Die Reaktionsmischung wird verschlossen<br />
und ca. 24 h gerührt. Anschließend werden 5 ml Wasser zugegeben,<br />
ein Rückflusskühler wird aufgesetzt und 30 min unter Rückfluss<br />
erhitzt. 1<br />
Isolierung und Reinigung<br />
Zur Isolierung des acylierten Cyclohexanons 2 wird die abgekühlte<br />
Reaktionsmischung in einen Scheidetrichter überführt und die<br />
organische von der wässrigen Phase getrennt. Zur Entfernung des<br />
Pyrrolidins wird die organische Phase noch dreimal mit je 10 ml 2 M<br />
Salzsäure und einmal mit 10 ml Wasser ausgeschüttelt (→ E 1 ), 2<br />
anschließend wird sie in ein Becherglas überführt, unter Rühren mit<br />
50 ml 2 M Natronlauge versetzt und etwa 1 h auf 10 °C gekühlt. Der<br />
Niederschlag 2 wird über einen Büchnertrichter abgesaugt und<br />
dreimal mit je 20 ml <strong>tert</strong>-<strong>Butyl</strong>methylether nachgewaschen (→ E 2 ).<br />
Der zurückbleibende, salzartige Feststoff wird in einem Becherglas<br />
mit 75 ml 2 M Salzsäure versetzt und solange gerührt, bis er sich<br />
weitgehend gelöst hat. 3 Es wird in einen Scheidetrichter überführt<br />
(Nachspülen mit 25 ml <strong>tert</strong>-<strong>Butyl</strong>methylether), die Phasen werden<br />
Versuch <strong>5.2.2</strong>, Rev.1.0 1
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
getrennt und die salzsaure, wässrige Phase noch zweimal mit je 20<br />
ml <strong>tert</strong>-<strong>Butyl</strong>methylether extrahiert (→ E 1 ). Die vereinigten<br />
organischen Phasen werden über Magnesiumsulfat getrocknet. Nach<br />
dem Abfiltrieren des Trockenmittels (→ E 3 ) wird das Lösungsmittel<br />
am Rotationsverdampfer abdestilliert (→ R 1 ) und der Rückstand bei<br />
vermindertem Druck in einer kleinen Destillationsapparatur mit<br />
Spinne und tarierten Vorlagekölbchen fraktionierend destilliert. Man<br />
führe ein Destillationsprotokoll und bestimme Ausbeute und<br />
Brechungsindices der einzelnen Fraktionen (→ E 4 ). Fraktionen mit<br />
gleichem Brechungsindex werden vereinigt. Ausbeute an 2: 65–<br />
75%, Sdp. 99–100 °C/1.4 hPa.<br />
1 Warum wird Wasser zugegeben? Welche Reaktion läuft ab?<br />
2 Es liegt das schwerlösliche Reaktionsprodukt von 2 mit Natronlauge vor.<br />
Worum könnte es sich handeln?<br />
3 Welche Umsetzung liegt hier vor? Ein in Ether unlösliches Produkt geht in ein<br />
etherlösliches Produkt über.<br />
4 Formulieren Sie diese Umsetzung.<br />
Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel<br />
E 1 : Wässrige Phasen mit organischen Verunreinigungen, Neutralisation mit verd. Natronlauge → Entsorgung<br />
(H 2 O mit RHal/Halogenid).<br />
E 2 : Wässriges Filtrat mit Lösungsmittel, Neutralisation mit verd. Salzsäure → Entsorgung (H 2 O mit<br />
RHal/Halogenid).<br />
E 3 : Kontaminiertes Magnesiumsulfat → Entsorgung (Anorg. Feststoffe).<br />
E 4 : Destillationsrückstand und verunreinigte Fraktionen in wenig Aceton aufnehmen → Entsorgung (RH).<br />
R 1 : Abdestilliertes Lösungsmittel → Recycling (<strong>tert</strong>-<strong>Butyl</strong>methylether).<br />
Auswertung des Versuchs<br />
1 H-NMR-Spektrum von 2 (300 MHz, CDCl 3 ): δ = 0.86 (9 H), 1.09–1.29 (2 H), 1.73–1.84 (1 H), 1.89–2.02 (1<br />
H), 2.07 (3 H), 2.19–2.40 (3 H), 15.81 (1 H).<br />
3.0<br />
2.0<br />
1.0<br />
LM<br />
16.0<br />
14.0 12.0 10.0 8.0 6.0<br />
4.0 2.0 [ppm] 0.0<br />
Versuch <strong>5.2.2</strong>, Rev.1.0 2
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
13 C-NMR Spektrum von 2 (75.5 MHz, CDCl 3 ): δ = 22.84 (CH 2 ), 25.02 (CH 3 ), 25.63 (CH 2 ), 27.30 (CH 3 ), 32.03<br />
(CH 2 ), 32.34 (C), 44.54 (CH), 106.81 (C), 181.83 (C), 199.23 (C).<br />
LM<br />
220<br />
200<br />
180<br />
160<br />
140<br />
120<br />
100 80 60 40 20 [ppm] 0<br />
IR-Spektrum von 2 (Film):<br />
100<br />
T [%]<br />
50<br />
2870<br />
2960<br />
1620<br />
0<br />
~<br />
4000 3000 2000 1500 1000 ν [cm -1 ]<br />
* Formulieren Sie den zu 2 führenden Reaktionsmechanismus unter Beachtung Fragestellungen 1–3.<br />
Weitere denkbare Reaktionsprodukte:<br />
N<br />
O<br />
C(CH 3<br />
) 3<br />
CH 3<br />
O<br />
N<br />
CH 3<br />
O<br />
N<br />
C(CH 3<br />
) 3<br />
O<br />
CH 3<br />
CH 3<br />
O<br />
O<br />
C(CH 3<br />
) 3<br />
CH 3<br />
O<br />
O<br />
C(CH 3<br />
) 3<br />
O<br />
CH 3<br />
CH 3<br />
H 3<br />
C<br />
O<br />
O<br />
O<br />
C(CH 3<br />
) 3<br />
CH 3<br />
A B C D E F<br />
* Mit welchen spektroskopischen Daten lassen sich A–F ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen. In welchem Zusammenhang stehen A/C, A/D/2 und<br />
E/F?<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
Siehe Einführung Kap. 5.2. Die Acylierung von Enaminen mit Carbonsäureanhydrid ist eine allgemeine<br />
Methode. [1] Für die Acylierung können auch eingesetzt werden: Ethylchloroformiat (Cl–CO 2 Et), Chlorcyan<br />
(Cl–CN) u.a.<br />
[1] G. Stork, A. Brizzolara, H. Landesman, J. Szmuszkovicz, R. Terrell, J. Am. Chem. Soc. 1963, 85, 207–222.<br />
Versuch <strong>5.2.2</strong>, Rev.1.0 3