2.1.6 Eliminierung von Toluolsulfonsäure aus (â)-Menthyltosylat mit ...
2.1.6 Eliminierung von Toluolsulfonsäure aus (â)-Menthyltosylat mit ...
2.1.6 Eliminierung von Toluolsulfonsäure aus (â)-Menthyltosylat mit ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
2. <strong>Eliminierung</strong>sreaktionen www.ioc-praktikum.de<br />
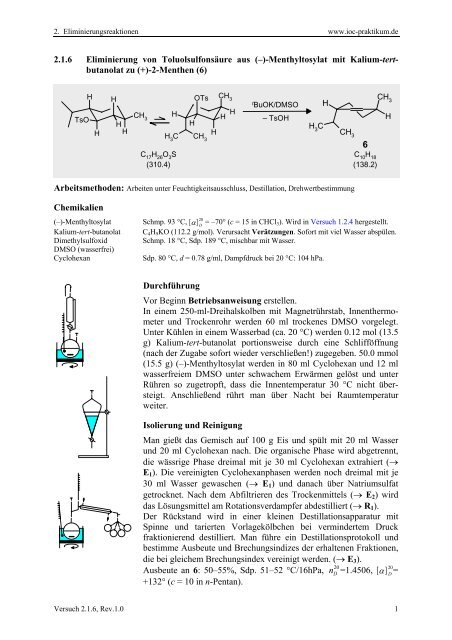
<strong>2.1.6</strong> <strong>Eliminierung</strong> <strong>von</strong> Toluolsulfonsäure <strong>aus</strong> (–)-<strong>Menthyltosylat</strong> <strong>mit</strong> Kalium-tertbutanolat<br />
zu (+)-2-Menthen (6)<br />
TsO<br />
H<br />
H<br />
H<br />
H<br />
H<br />
CH 3<br />
H<br />
C 17<br />
H 26<br />
O 3<br />
S<br />
(310.4)<br />
H<br />
OTs<br />
H 3<br />
C CH 3<br />
H<br />
CH 3<br />
H<br />
H<br />
t<br />
BuOK/DMSO<br />
– TsOH<br />
H<br />
CH 3<br />
H 3<br />
C CH3<br />
H<br />
6<br />
C 10<br />
H 18<br />
(138.2)<br />
Arbeitsmethoden: Arbeiten unter Feuchtigkeits<strong>aus</strong>schluss, Destillation, Drehwertbestimmung<br />
Chemikalien<br />
(–)-<strong>Menthyltosylat</strong><br />
20<br />
Schmp. 93 °C, [ α ] D<br />
= –70° (c = 15 in CHCl 3 ). Wird in Versuch 1.2.4 hergestellt.<br />
Kalium-tert-butanolat C 4 H 9 KO (112.2 g/mol). Verursacht Verätzungen. Sofort <strong>mit</strong> viel Wasser abspülen.<br />
Dimethylsulfoxid Schmp. 18 °C, Sdp. 189 °C, mischbar <strong>mit</strong> Wasser.<br />
DMSO (wasserfrei)<br />
Cyclohexan<br />
Sdp. 80 °C, d = 0.78 g/ml, Dampfdruck bei 20 °C: 104 hPa.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einem 250-ml-Dreihalskolben <strong>mit</strong> Magnetrührstab, Innenthermometer<br />
und Trockenrohr werden 60 ml trockenes DMSO vorgelegt.<br />
Unter Kühlen in einem Wasserbad (ca. 20 °C) werden 0.12 mol (13.5<br />
g) Kalium-tert-butanolat portionsweise durch eine Schlifföffnung<br />
(nach der Zugabe sofort wieder verschließen!) zugegeben. 50.0 mmol<br />
(15.5 g) (–)-<strong>Menthyltosylat</strong> werden in 80 ml Cyclohexan und 12 ml<br />
wasserfreiem DMSO unter schwachem Erwärmen gelöst und unter<br />
Rühren so zugetropft, dass die Innentemperatur 30 °C nicht übersteigt.<br />
Anschließend rührt man über Nacht bei Raumtemperatur<br />
weiter.<br />
Isolierung und Reinigung<br />
Man gießt das Gemisch auf 100 g Eis und spült <strong>mit</strong> 20 ml Wasser<br />
und 20 ml Cyclohexan nach. Die organische Phase wird abgetrennt,<br />
die wässrige Phase dreimal <strong>mit</strong> je 30 ml Cyclohexan extrahiert (→<br />
E 1 ). Die vereinigten Cyclohexanphasen werden noch dreimal <strong>mit</strong> je<br />
30 ml Wasser gewaschen (→ E 1 ) und danach über Natriumsulfat<br />
getrocknet. Nach dem Abfiltrieren des Trocken<strong>mit</strong>tels (→ E 2 ) wird<br />
das Lösungs<strong>mit</strong>tel am Rotationsverdampfer abdestilliert (→ R 1 ).<br />
Der Rückstand wird in einer kleinen Destillationsapparatur <strong>mit</strong><br />
Spinne und tarierten Vorlagekölbchen bei vermindertem Druck<br />
fraktionierend destilliert. Man führe ein Destillationsprotokoll und<br />
bestimme Ausbeute und Brechungsindizes der erhaltenen Fraktionen,<br />
die bei gleichem Brechungsindex vereinigt werden. (→ E 3 ).<br />
Ausbeute an 6: 50–55%, Sdp. 51–52 °C/16hPa, n 20 20<br />
D<br />
=1.4506, [ α ] D<br />
=<br />
+132° (c = 10 in n-Pentan).<br />
Versuch <strong>2.1.6</strong>, Rev.1.0 1
2. <strong>Eliminierung</strong>sreaktionen www.ioc-praktikum.de<br />
Hinweise zur Entsorgung (E), Recycling (R) der Losungs<strong>mit</strong>tel<br />
E 1 : Wässrige Phasen → Entsorgung (H 2 O <strong>mit</strong> RHal/Halogenid).<br />
E 2 : Verunreinigtes Natriumsulfat → Entsorgung (Anorg. Feststoffe).<br />
E 3 : Destillationsrückstand und verunreinigte Fraktionen <strong>mit</strong> wenig Aceton aufnehmen → Entsorgung (RH).<br />
R 1 : Abdestilliertes Lösungs<strong>mit</strong>tel → Recycling (Cyclohexan).<br />
Auswertung des Versuchs<br />
1 H-NMR-Spektrum <strong>von</strong> 6 (300 MHz, CDCl 3 ): δ = 0.88 (6 H), 0.95 (3 H), 1.03–1.33 (2 H), 1.48–1.64 (1 H),<br />
1.65–1.75 (1 H), 1.78–1.88 (1 H), 1.88–1.98 (1 H), 2.04–2.19 (1 H), 1.54–1.58 (2 H).<br />
H 2 O<br />
5.6 5.4<br />
2.0 1.5 1.0 1.0 0.8<br />
6.0 5.0<br />
4.0<br />
3.0 2.0 1.0 [ppm] 0.0<br />
13 C-NMR-Spektrum (75.5 MHz, CDCl 3 ) <strong>von</strong> 6: δ = 19.26 (CH 3 ), 19.59 (CH 3 ), 22.01 (CH 3 ), 25.61 (CH 2 ), 30.96<br />
(CH), 31.98 (CH 2 ), 32.19 (CH), 41.92 (CH), 129.93 (CH), 133.99 (CH).<br />
LM<br />
140<br />
120<br />
100<br />
80<br />
60 40 20 [ppm] 0<br />
IR-Spektrum <strong>von</strong> 6 (Film):<br />
100<br />
T [%]<br />
50<br />
3015<br />
1455<br />
2870<br />
2925<br />
2955<br />
0<br />
4000 3000 2000 1500 1000 ν ~ [cm -1 ]<br />
* Formulieren Sie den zu 6 führenden Reaktionsmechanismus.<br />
Versuch <strong>2.1.6</strong>, Rev.1.0 2
2. <strong>Eliminierung</strong>sreaktionen www.ioc-praktikum.de<br />
Weitere denkbare Reaktionsprodukte:<br />
CH 3<br />
H 3<br />
C CH 3<br />
CH 3 CH 3<br />
OC(CH 3<br />
) 3<br />
H 3<br />
C CH 3<br />
H 3<br />
C CH 3<br />
A B C<br />
* Mit welchen spektroskopischen Daten und einfachen Versuchen lassen sich A–C <strong>aus</strong>schließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen.<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
Mit Natriumethanolat in Ethanol wird bei der <strong>Eliminierung</strong> neben 6 auch das 1-Menthen (etwa 8%) gebildet. [1]<br />
Nach Umwandlung eines Alkohols in den 4-Toluolsulfonsäureester stellt die baseninduzierte Abspaltung der<br />
Tosylatgruppe eine wertvolle Alternative zur säurekatalysierten Wasserabspaltung <strong>aus</strong> Alkoholen dar. [2] In<br />
cyclischen Systemen verlaufen anti-<strong>Eliminierung</strong>en über Konformationen <strong>mit</strong> einer anti-periplanaren Anordnung<br />
des <strong>aus</strong>tretenden Protons und der Abgangsgruppe. [3]<br />
[1] A.L.J. Beckwith, G. Phillipou, Aust. J. Chem. 1976, 29, 877–882.<br />
[2] F.A. Carey, R.J. Sundberg, Organische Chemie, VCH, Weinheim, 1995, S. 360–370.<br />
[3] siehe z.B. J. Závada, J. Krupička, J. Sicher, Collect. Czech. Chem. Commun. 1968, 33, 1393–1414.<br />
Versuch <strong>2.1.6</strong>, Rev.1.0 3