4.1.1.4
4.1.1.4
4.1.1.4
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
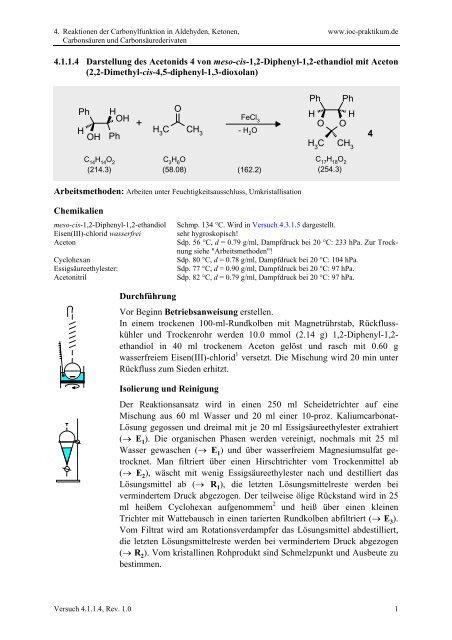
<strong>4.1.1.4</strong> Darstellung des Acetonids 4 von meso-cis-1,2-Diphenyl-1,2-ethandiol mit Aceton<br />
(2,2-Dimethyl-cis-4,5-diphenyl-1,3-dioxolan)<br />
Ph<br />
H<br />
OH<br />
H<br />
OH<br />
Ph<br />
+<br />
O<br />
H 3<br />
C CH 3<br />
FeCl 3<br />
- H 2<br />
O<br />
Ph<br />
H<br />
O<br />
C H 3<br />
Ph<br />
H<br />
O<br />
CH 3<br />
4<br />
C 14<br />
H 14<br />
O 2<br />
(214.3)<br />
C 3<br />
H 6<br />
O<br />
(58.08)<br />
(162.2)<br />
C 17<br />
H 18<br />
O 2<br />
(254.3)<br />
Arbeitsmethoden: Arbeiten unter Feuchtigkeitsausschluss, Umkristallisation<br />
Chemikalien<br />
meso-cis-1,2-Diphenyl-1,2-ethandiol<br />
Eisen(III)-chlorid wasserfrei<br />
Aceton<br />
Cyclohexan<br />
Essigsäureethylester:<br />
Acetonitril<br />
Schmp. 134 °C. Wird in Versuch 4.3.1.5 dargestellt.<br />
sehr hygroskopisch!<br />
Sdp. 56 °C, d = 0.79 g/ml, Dampfdruck bei 20 °C: 233 hPa. Zur Trocknung<br />
siehe "Arbeitsmethoden"!<br />
Sdp. 80 °C, d = 0.78 g/ml, Dampfdruck bei 20 °C: 104 hPa.<br />
Sdp. 77 °C, d = 0.90 g/ml, Dampfdruck bei 20 °C: 97 hPa.<br />
Sdp. 82 °C, d = 0.79 g/ml, Dampfdruck bei 20 °C: 97 hPa.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einem trockenen 100-ml-Rundkolben mit Magnetrührstab, Rückflusskühler<br />
und Trockenrohr werden 10.0 mmol (2.14 g) 1,2-Diphenyl-1,2-<br />
ethandiol in 40 ml trockenem Aceton gelöst und rasch mit 0.60 g<br />
wasserfreiem Eisen(III)-chlorid 1 versetzt. Die Mischung wird 20 min unter<br />
Rückfluss zum Sieden erhitzt.<br />
Isolierung und Reinigung<br />
Der Reaktionsansatz wird in einen 250 ml Scheidetrichter auf eine<br />
Mischung aus 60 ml Wasser und 20 ml einer 10-proz. Kaliumcarbonat-<br />
Lösung gegossen und dreimal mit je 20 ml Essigsäureethylester extrahiert<br />
(→ E 1 ). Die organischen Phasen werden vereinigt, nochmals mit 25 ml<br />
Wasser gewaschen (→ E 1 ) und über wasserfreiem Magnesiumsulfat getrocknet.<br />
Man filtriert über einen Hirschtrichter vom Trockenmittel ab<br />
(→ E 2 ), wäscht mit wenig Essigsäureethylester nach und destilliert das<br />
Lösungsmittel ab (→ R 1 ), die letzten Lösungsmittelreste werden bei<br />
vermindertem Druck abgezogen. Der teilweise ölige Rückstand wird in 25<br />
ml heißem Cyclohexan aufgenommem 2 und heiß über einen kleinen<br />
Trichter mit Wattebausch in einen tarierten Rundkolben abfiltriert (→ E 3 ).<br />
Vom Filtrat wird am Rotationsverdampfer das Lösungsmittel abdestilliert,<br />
die letzten Lösungsmittelreste werden bei vermindertem Druck abgezogen<br />
(→ R 2 ). Vom kristallinen Rohprodukt sind Schmelzpunkt und Ausbeute zu<br />
bestimmen.<br />
Versuch <strong>4.1.1.4</strong>, Rev. 1.0 1
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
Zur Umkristallisation prüfe man folgende Lösungsmittel und protokolliere<br />
die Löslichkeit:<br />
Acetonitril (Sdp. 81 °C, DK 37.5); ( E 4 )<br />
Cyclohexan (Sdp. 80 °C, DK 2.0); ( E 4 )<br />
Methylcyclohexan (Sdp. 101 °C, DK ca. 2); ( E 4 )<br />
Zur Reinigung wird in einem 25 ml Rundkolben mit Rückflusskühler aus<br />
Acetonitril umkristallisiert, Kristallisation im Eisbad, Absaugen auf einem<br />
Hirschtrichter (→ E 3 ). Man bestimme Ausbeute und Schmelzpunkt des<br />
Reinprodukts. Ausbeute an 4: 60–70%, Schmp. 61–62 °C.<br />
1 Welche Funktion hat das FeCl 3 ?<br />
2 Um welches Produkt handelt es sich bei dem in Cyclohexan unlöslichen Rückstand?<br />
Prüfen!<br />
Hinweise zur Entsorgung (E), Reycling (R) der Lösungsmittel<br />
E 1 : Wässrige Phasen → Entsorgung (H 2 O mit RH).<br />
E 2 : Kontaminiertes Trockenmittel → Entsorgung (Anorg. Feststoffe).<br />
E 3 : Wattebausch mit org. Rückstand, Papierfilter → Entsorgung (Org. Feststoffe).<br />
E 4 : Mutterlaugen → Entsorgung (RH).<br />
R 1 : Destillat → Recycling (Essigsäureethylester).<br />
R 2 : Destillat → Recycling (Cyclohexan).<br />
Auswertung des Versuchs<br />
1 H-NMR-Spektrum von 4 (300 MHz, CDCl 3 ): δ = 1.65 (3 H), 1.87 (3 H), 5.55 (2 H), 6.96–7.13 (10 H).<br />
8.0 6.0 4.0 2.0 [ppm] 0.0<br />
13 C-NMR Spektrum von 4 (75,5 MHz, CDCl 3 ): δ = 24.58 (CH 3 ), 26.82 (CH 3 ), 81.53 (CH), 126.98 (CH),<br />
127.21 (CH), 127.58 (CH), 137.74 (C).<br />
LM<br />
140<br />
120<br />
100 80<br />
60 40 20 [ppm] 0<br />
Versuch <strong>4.1.1.4</strong>, Rev. 1.0 2
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
IR-Spektrum von 4 (KBr):<br />
100<br />
T [%]<br />
50<br />
3065<br />
3030<br />
2895<br />
2935<br />
2990<br />
1605<br />
1495<br />
0<br />
4000 3000 2000 1500 1000 ν ~ [cm -1 ]<br />
* Formulieren Sie den zu 4 führenden Reaktionsmechanismus.<br />
* Welchen Zweck hat die Darstellung von 4? Ziehen Sie das Ergebnis der Reaktion von 4 mit Säuren bzw.<br />
Basen heran.<br />
Weitere denkbare Reaktionsprodukte:<br />
Ph Ph Ph Ph Ph Ph<br />
Ph Ph<br />
Ph<br />
H 3<br />
C<br />
H<br />
H C<br />
H<br />
3 O OH H H<br />
O<br />
H H H H H<br />
O OH H<br />
O<br />
O<br />
HO<br />
O<br />
H C<br />
CH 2<br />
CH 3<br />
3<br />
C OH<br />
H 3<br />
Ph<br />
H<br />
A B C D E<br />
* Mit welchen spektroskopischen Daten lassen sich A–E ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen. In welchem Zusammenhang stehen A, D und B, C?<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
[2]<br />
Literatur, auf der dieser Versuch beruht: [1]. An Stelle von FeCl 3 kann wasserfreises CuSO 4 oder ZnCl 2<br />
eingesetzt werden. [3]<br />
[1] D. R. Paulson, A.L. Hartwig, G. F. Movan, J. Chem. Educ. 1973, 50, 216–217.<br />
[2] R.P. Hanzlik, M. Leimwetter, J. Org. Chem. 1978, 43, 438–440.<br />
[3] A.I. Vogel, Vogel’s Textbook of Practical Organic Chemistry, Burnt Mill, Harlow 1989, 5. Auflage S. 651.<br />
Versuch <strong>4.1.1.4</strong>, Rev. 1.0 3