5.3.1: Acetessigsäureisobutylester
5.3.1: Acetessigsäureisobutylester
5.3.1: Acetessigsäureisobutylester
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
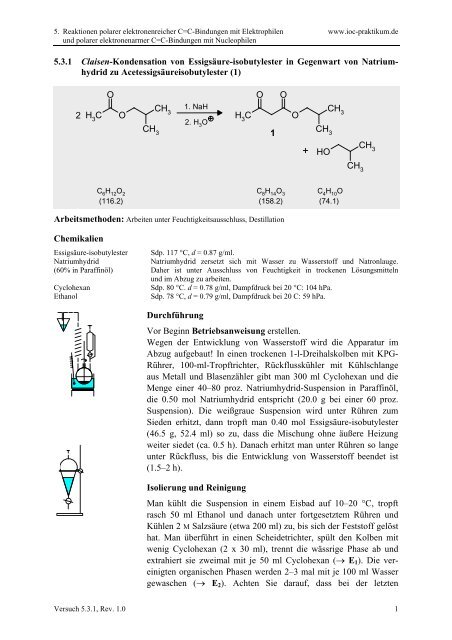
<strong>5.3.1</strong> Claisen-Kondensation von Essigsäure-isobutylester in Gegenwart von Natriumhydrid<br />
zu Acetessigsäureisobutylester (1)<br />
2<br />
H 3<br />
C<br />
O<br />
O<br />
O O<br />
CH 1. NaH<br />
3<br />
H 3<br />
C O<br />
2. H 3<br />
O<br />
CH 3 1<br />
CH 3<br />
CH 3<br />
+<br />
HO<br />
CH 3<br />
CH 3<br />
C 6<br />
H 12<br />
O 2<br />
(116.2)<br />
C 8<br />
H 14<br />
O 3<br />
(158.2)<br />
C 4<br />
H 10<br />
O<br />
(74.1)<br />
Arbeitsmethoden: Arbeiten unter Feuchtigkeitsausschluss, Destillation<br />
Chemikalien<br />
Essigsäure-isobutylester Sdp. 117 °C, d = 0.87 g/ml.<br />
Natriumhydrid<br />
Natriumhydrid zersetzt sich mit Wasser zu Wasserstoff und Natronlauge.<br />
(60% in Paraffinöl) Daher ist unter Ausschluss von Feuchtigkeit in trockenen Lösungsmitteln<br />
und im Abzug zu arbeiten.<br />
Cyclohexan<br />
Sdp. 80 °C. d = 0.78 g/ml, Dampfdruck bei 20 °C: 104 hPa.<br />
Ethanol<br />
Sdp. 78 °C, d = 0.79 g/ml, Dampfdruck bei 20 C: 59 hPa.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
Wegen der Entwicklung von Wasserstoff wird die Apparatur im<br />
Abzug aufgebaut! In einen trockenen 1-l-Dreihalskolben mit KPG-<br />
Rührer, 100-ml-Tropftrichter, Rückflusskühler mit Kühlschlange<br />
aus Metall und Blasenzähler gibt man 300 ml Cyclohexan und die<br />
Menge einer 40–80 proz. Natriumhydrid-Suspension in Paraffinöl,<br />
die 0.50 mol Natriumhydrid entspricht (20.0 g bei einer 60 proz.<br />
Suspension). Die weißgraue Suspension wird unter Rühren zum<br />
Sieden erhitzt, dann tropft man 0.40 mol Essigsäure-isobutylester<br />
(46.5 g, 52.4 ml) so zu, dass die Mischung ohne äußere Heizung<br />
weiter siedet (ca. 0.5 h). Danach erhitzt man unter Rühren so lange<br />
unter Rückfluss, bis die Entwicklung von Wasserstoff beendet ist<br />
(1.5–2 h).<br />
Isolierung und Reinigung<br />
Man kühlt die Suspension in einem Eisbad auf 10–20 °C, tropft<br />
rasch 50 ml Ethanol und danach unter fortgesetztem Rühren und<br />
Kühlen 2 M Salzsäure (etwa 200 ml) zu, bis sich der Feststoff gelöst<br />
hat. Man überführt in einen Scheidetrichter, spült den Kolben mit<br />
wenig Cyclohexan (2 x 30 ml), trennt die wässrige Phase ab und<br />
extrahiert sie zweimal mit je 50 ml Cyclohexan (→ E 1 ). Die vereinigten<br />
organischen Phasen werden 2–3 mal mit je 100 ml Wasser<br />
gewaschen (→ E 2 ). Achten Sie darauf, dass bei der letzten<br />
Versuch <strong>5.3.1</strong>, Rev. 1.0 1
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
Phasentrennung keine Wassertröpfchen in der organischen Phase<br />
zurück bleiben, damit sich das Trocknen mit einem Trockenmittel<br />
erübrigt. Man destilliert das Lösungsmittel bei vermindertem Druck<br />
am Rotationsverdampfer ab (→ R 1 ), wobei das in der organischen<br />
Phase noch gelöste Wasser durch azeotrope Destillation entfernt<br />
wird. Das zurückbleibende Öl wird in einen 50 ml-Kolben überführt<br />
und in einer kleinen Destillationsapparatur mit Spinne und tarierten<br />
Vorlagekölbchen bei vermindertem Druck destilliert. Nach einem<br />
kleinen Vorlauf (ca. 1–2 ml) erhält man 1 als farbloses Öl (→ E 3 ).<br />
Ausbeute an 1: 45–53%, Sdp. 90–92 °C/21 hPa, n D 20 = 1.4245.<br />
Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel<br />
E 1 : Wässrige halogenhaltige Lösung mit organischen Verunreinigungen, Neutralisation mit verd. Natronlauge<br />
→ Entsorgung (H 2 O mit RHal/Halogenid).<br />
E 2 : Wässrige Lösung mit organischen Verunreinigungen → Entsorgung (H 2 O mit RH).<br />
E 3 : Destillationsrückstand und verunreinigte Fraktionen in wenig Aceton aufnehmen → Entsorgung (RH).<br />
R 1 : Abdestilliertes Lösungsmittel → Recycling (Cyclohexan).<br />
Auswertung des Versuchs<br />
1 H-NMR-Spektrum von 1 (300 MHz, CDCl 3 ): δ = 0.88 (6 H), 1.90 (1 H), 2.22 (3 H), 3.42 (2 H), 3.87 (2 H).<br />
*) 3.84 (d, teilweise verdeckt), 4.95 (s), 12.05 (s), alle anderen Signale verdeckt.<br />
1164.3 Hz<br />
1157.7 Hz<br />
1151.0 Hz<br />
596.8 Hz<br />
589.0 Hz<br />
582.2 Hz<br />
575.5 Hz<br />
568.8 Hz<br />
562.1 Hz<br />
555.4 Hz<br />
548.7 Hz<br />
542.0 Hz<br />
267.0 Hz<br />
260.3 Hz<br />
a) b) c)<br />
c)<br />
*<br />
a)<br />
b)<br />
*<br />
LM<br />
*<br />
*<br />
14.0 12.0 10.0 8.0 6.0<br />
4.0 2.0 [ppm] 0.0<br />
Versuch <strong>5.3.1</strong>, Rev. 1.0 2
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
13 C-NMR Spektrum von 1 (75.5 MHz, CDCl 3 ): δ = 18.97 (CH 3 ), 27.59 (CH 3 ), 30.15 (CH), 50.05 (CH 2 ), 71.39<br />
(CH 2 ), 167.19 (C), 200.67 (C).<br />
*) 21.15 (CH 3 ), 27.70 (CH 3 ), 30.81 (CH), 69.95 (CH 2 ), 89.70 (CH), 172.71 (C), 175.38 (C), alle anderen Signale<br />
verdeckt.<br />
LM<br />
** * * * *<br />
220<br />
200<br />
180<br />
160<br />
140<br />
120<br />
100 80 60 40 20 [ppm] 0<br />
IR-Spektrum von 1 (Film):<br />
100<br />
T [%]<br />
2885<br />
2980<br />
50<br />
1760<br />
1725<br />
0<br />
~<br />
4000 3000 2000 1500 1000 ν [cm -1 ]<br />
* Formulieren Sie den zu 1 führenden Reaktionsmechanismus.<br />
* Neben den Signalen von 1 sind im 1 H- und 13 C-NMR-Spektrum Signale einer 2. Substanz (keine<br />
Verunreinigung!) zu erkennen (mit * gekennzeichnet). Um welche Substanz könnte es sich hierbei handeln?<br />
Formulieren Sie!<br />
Weitere denkbare Reaktionsprodukte:<br />
H 3<br />
C<br />
CH 3<br />
O<br />
H 3<br />
C<br />
HO<br />
O<br />
O<br />
CH 3<br />
CH 3<br />
O<br />
CH<br />
O<br />
3<br />
O O<br />
O<br />
H 3<br />
C<br />
CH 3<br />
CH 3<br />
CH 3<br />
O<br />
O<br />
A B C<br />
CH 3<br />
CH 3<br />
* Mit welchen spektroskopischen Daten lassen sich A–C ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen.<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
Siehe Einführung Kap. 5.3. An Stelle von NaH wird häufig elementares Natrium eingesetzt, [1] in beiden Fällen<br />
ist die Esterenolat-Bildung irreversibel.<br />
[1] J.K.H. Inglis, K.C. Roberts in Organic Syntheses Coll. Vol. 1 (Hrsg. H. Gilman, A.H. Blatt), J. Wiley &<br />
Sons, New York, 1941, S. 235–236.<br />
Versuch <strong>5.3.1</strong>, Rev. 1.0 3