5.6.1: Weiss-Reaktion
5.6.1: Weiss-Reaktion
5.6.1: Weiss-Reaktion
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
5. <strong>Reaktion</strong>en polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
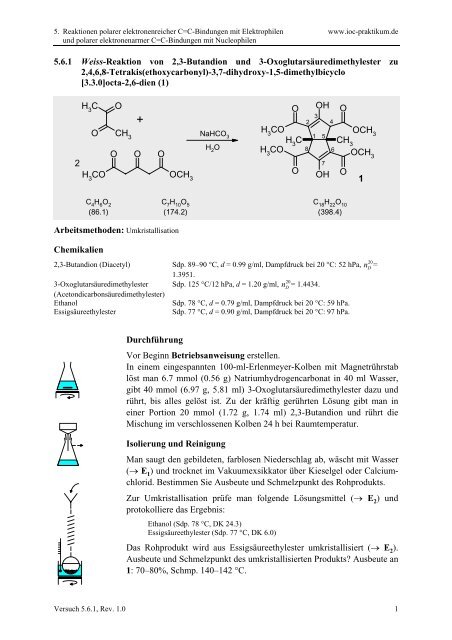
<strong>5.6.1</strong> <strong>Weiss</strong>-<strong>Reaktion</strong> von 2,3-Butandion und 3-Oxoglutarsäuredimethylester zu<br />
2,4,6,8-Tetrakis(ethoxycarbonyl)-3,7-dihydroxy-1,5-dimethylbicyclo<br />
[3.3.0]octa-2,6-dien (1)<br />
H 3<br />
C O<br />
O CH 3<br />
+<br />
O O O<br />
2<br />
H 3<br />
CO OCH 3<br />
NaHCO 3<br />
H 2<br />
O<br />
O OH O<br />
H 3<br />
CO<br />
OCH<br />
1 5<br />
3<br />
H 3<br />
C CH 3<br />
H 3<br />
CO 8 6<br />
OCH 3<br />
O<br />
2 3 4<br />
7<br />
OH<br />
O<br />
1<br />
C 4<br />
H 6<br />
O 2<br />
(86.1)<br />
C 7<br />
H 10<br />
O 5<br />
(174.2)<br />
C 18<br />
H 22<br />
O 10<br />
(398.4)<br />
Arbeitsmethoden: Umkristallisation<br />
Chemikalien<br />
2,3-Butandion (Diacetyl) Sdp. 89–90 °C, d = 0.99 g/ml, Dampfdruck bei 20 °C: 52 hPa, n 20 D<br />
=<br />
1.3951.<br />
3-Oxoglutarsäuredimethylester Sdp. 125 °C/12 hPa, d = 1.20 g/ml, n 20 D<br />
= 1.4434.<br />
(Acetondicarbonsäuredimethylester)<br />
Ethanol<br />
Sdp. 78 °C, d = 0.79 g/ml, Dampfdruck bei 20 °C: 59 hPa.<br />
Essigsäureethylester<br />
Sdp. 77 °C, d = 0.90 g/ml, Dampfdruck bei 20 °C: 97 hPa.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einem eingespannten 100-ml-Erlenmeyer-Kolben mit Magnetrührstab<br />
löst man 6.7 mmol (0.56 g) Natriumhydrogencarbonat in 40 ml Wasser,<br />
gibt 40 mmol (6.97 g, 5.81 ml) 3-Oxoglutarsäuredimethylester dazu und<br />
rührt, bis alles gelöst ist. Zu der kräftig gerührten Lösung gibt man in<br />
einer Portion 20 mmol (1.72 g, 1.74 ml) 2,3-Butandion und rührt die<br />
Mischung im verschlossenen Kolben 24 h bei Raumtemperatur.<br />
Isolierung und Reinigung<br />
Man saugt den gebildeten, farblosen Niederschlag ab, wäscht mit Wasser<br />
(→ E 1 ) und trocknet im Vakuumexsikkator über Kieselgel oder Calciumchlorid.<br />
Bestimmen Sie Ausbeute und Schmelzpunkt des Rohprodukts.<br />
Zur Umkristallisation prüfe man folgende Lösungsmittel (→ E 2 ) und<br />
protokolliere das Ergebnis:<br />
Ethanol (Sdp. 78 °C, DK 24.3)<br />
Essigsäureethylester (Sdp. 77 °C, DK 6.0)<br />
Das Rohprodukt wird aus Essigsäureethylester umkristallisiert (→ E 2 ).<br />
Ausbeute und Schmelzpunkt des umkristallisierten Produkts? Ausbeute an<br />
1: 70–80%, Schmp. 140–142 °C.<br />
Versuch <strong>5.6.1</strong>, Rev. 1.0 1
5. <strong>Reaktion</strong>en polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
Hinweise zur Entsorgung (E)<br />
E 1 : Wässriges Filtrat mit organischen Verunreinigungen → Entsorgung (H 2 O mit RH)<br />
E 3 : Mutterlauge → Entsorgung (RH)<br />
Auswertung des Versuchs<br />
* Prüfen Sie das Vorliegen enolisierter 1,3-Dicarbonyl-Einheiten mit der Eisen(III)-chlorid-<strong>Reaktion</strong>. Lösen<br />
Sie einige mg des Produkts in wenig Ethanol und geben Sie dazu einige Tropfen einer 0.4 proz. Lösung von<br />
Eisen(III)-chlorid in einem Gemisch aus Ethanol und Wasser (4:1), das 0.1 M Salzsäure enthält. Was ist zu<br />
beobachten?<br />
1 H-NMR-Spektrum von 1 (300 MHz, CDCl 3 ): δ = 1.27 (6 H), 3.73 (6 H), 3.86 (6 H), 3.92 (2 H), 10.61 (2 H).<br />
LM<br />
11.0 10.0 9.0 8.0 7.0 6.0 5.0 4.0 3.0 2.0 [ppm] 0.0<br />
13 C-NMR Spektrum von 1 (75.5 MHz, CDCl 3 ): δ = 18.06 (CH 3 ), 51.77 (CH 3 ), 52.30 (CH 3 ), 54.17 (C), 58.14<br />
(CH), 109.46 (C), 169.39 (C), 170.63 (C), 170.88 (C).<br />
180 160 140<br />
IR-Spektrum von 1 (KBr):<br />
100<br />
T [%]<br />
120<br />
100 80<br />
60 40 20 [ppm] 0<br />
50<br />
2990<br />
2960<br />
1745<br />
1670<br />
1635<br />
0<br />
~<br />
4000 3000 2000 1500 1000 ν [cm -1 ]<br />
* Formulieren Sie den zu 1 führenden <strong>Reaktion</strong>smechanismus.<br />
Versuch <strong>5.6.1</strong>, Rev. 1.0 2
5. <strong>Reaktion</strong>en polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
Weitere denkbare <strong>Reaktion</strong>sprodukte:<br />
O<br />
E<br />
O<br />
E<br />
O<br />
E<br />
O<br />
E<br />
E<br />
E<br />
C H 3<br />
CH 3<br />
H 3<br />
C CH 3<br />
H 3<br />
C<br />
HO<br />
OH<br />
E<br />
E HO<br />
CH 3<br />
E<br />
O<br />
O<br />
A B C D<br />
E<br />
E<br />
CH<br />
H 3<br />
C<br />
3<br />
E<br />
E = CO 2<br />
Me<br />
* Mit welchen spektroskopischen Daten lassen sich A–D ausschließen?<br />
* Diskutieren Sie die denkbaren <strong>Reaktion</strong>smechanismen. In welchem Zusammenhang stehen A/C und B/D?<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
Siehe Einführung Kap. 5.6. Die 1968 von <strong>Weiss</strong> und Edwards beschriebene Cyclokondensation von α-<br />
Diketonen mit 3-Oxoglutarsäuredimethylester ist der beste Zugang zu Bicyclo[3.3.0]octan-Derivaten, auch 1,5-<br />
überbrückten ([n.3.3]Propellanen), die man aus cyclischen α-Diketonen erhält. [1]<br />
[1] S. H. Bertz, J. M. Cook, A. Gawish, U. <strong>Weiss</strong> in Organic Syntheses Coll. Vol. 7 (Hrsg. J. P. Freeman), J.<br />
Wiley & Sons, New York, 1990, S. 50–56.<br />
Versuch <strong>5.6.1</strong>, Rev. 1.0 3