4.2.2.8: cis-4-Cyclohexen-1,2-dicarbonsäuredimethylester
4.2.2.8: cis-4-Cyclohexen-1,2-dicarbonsäuredimethylester
4.2.2.8: cis-4-Cyclohexen-1,2-dicarbonsäuredimethylester
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
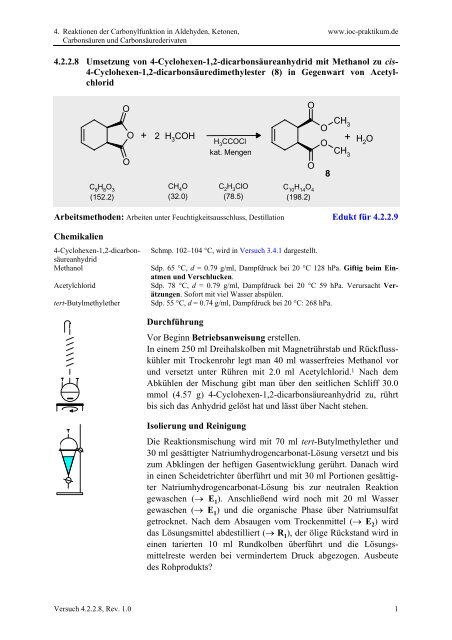
<strong>4.2.2.8</strong> Umsetzung von 4-<strong>Cyclohexen</strong>-1,2-dicarbonsäureanhydrid mit Methanol zu <strong>cis</strong>-<br />
4-<strong>Cyclohexen</strong>-1,2-dicarbonsäuredimethylester (8) in Gegenwart von Acetylchlorid<br />
O<br />
O<br />
C 8<br />
H 8<br />
O 3<br />
(152.2)<br />
O<br />
O<br />
C 2<br />
H 3<br />
ClO<br />
(78.5)<br />
O<br />
C 10<br />
H 14<br />
O 4<br />
(198.2)<br />
O CH 3<br />
+ 2 H 3<br />
COH<br />
+<br />
CH 4<br />
O<br />
(32.0)<br />
H 3<br />
CCOCl<br />
kat. Mengen<br />
O<br />
CH3<br />
8<br />
H 2<br />
O<br />
Arbeitsmethoden: Arbeiten unter Feuchtigkeitsausschluss, Destillation Edukt für 4.2.2.9<br />
Chemikalien<br />
4-<strong>Cyclohexen</strong>-1,2-dicarbonsäureanhydrid<br />
Methanol<br />
Acetylchlorid<br />
tert-Butylmethylether<br />
Schmp. 102–104 °C, wird in Versuch 3.4.1 dargestellt.<br />
Sdp. 65 °C, d = 0.79 g/ml, Dampfdruck bei 20 °C 128 hPa. Giftig beim Einatmen<br />
und Verschlucken.<br />
Sdp. 78 °C, d = 0.79 g/ml, Dampfdruck bei 20 °C 59 hPa. Verursacht Verätzungen.<br />
Sofort mit viel Wasser abspülen.<br />
Sdp. 55 °C, d = 0.74 g/ml, Dampfdruck bei 20 °C: 268 hPa.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einem 250 ml Dreihalskolben mit Magnetrührstab und Rückflusskühler<br />
mit Trockenrohr legt man 40 ml wasserfreies Methanol vor<br />
und versetzt unter Rühren mit 2.0 ml Acetylchlorid. 1 Nach dem<br />
Abkühlen der Mischung gibt man über den seitlichen Schliff 30.0<br />
mmol (4.57 g) 4-<strong>Cyclohexen</strong>-1,2-dicarbonsäureanhydrid zu, rührt<br />
bis sich das Anhydrid gelöst hat und lässt über Nacht stehen.<br />
Isolierung und Reinigung<br />
Die Reaktionsmischung wird mit 70 ml tert-Butylmethylether und<br />
30 ml gesättigter Natriumhydrogencarbonat-Lösung versetzt und bis<br />
zum Abklingen der heftigen Gasentwicklung gerührt. Danach wird<br />
in einen Scheidetrichter überführt und mit 30 ml Portionen gesättigter<br />
Natriumhydrogencarbonat-Lösung bis zur neutralen Reaktion<br />
gewaschen (→ E 1 ). Anschließend wird noch mit 20 ml Wasser<br />
gewaschen (→ E 1 ) und die organische Phase über Natriumsulfat<br />
getrocknet. Nach dem Absaugen vom Trockenmittel (→ E 2 ) wird<br />
das Lösungsmittel abdestilliert (→ R 1 ), der ölige Rückstand wird in<br />
einen tarierten 10 ml Rundkolben überführt und die Lösungsmittelreste<br />
werden bei vermindertem Druck abgezogen. Ausbeute<br />
des Rohprodukts?<br />
Versuch <strong>4.2.2.8</strong>, Rev. 1.0 1
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
Das Rohprodukt wird in einer Mikrodestille mit Spinne und tarierten<br />
Vorlagekölbchen bei vermindertem Druck fraktionierend destilliert,<br />
Fraktionen mit gleichem Brechungsindex werden vereinigt (Destillationsrückstand<br />
→ E 3 ). Man bestimme die Ausbeute (g, %) des<br />
Reinprodukts. Ausbeute an 8: 60–70%, Sdp. 80–81 °C/0.1 hPa,<br />
141–142 °C/27 hPa,<br />
n = 1.4725.<br />
20<br />
D<br />
1 Welche Funktion hat das Acetylchlorid?<br />
Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel<br />
E 1 : Wässrige Phasen → Entsorgung (H 2 O mit RHal/Halogenid).<br />
E 2 : Trockenmittel → Entsorgung (Anorg. Feststoffe).<br />
E 3 : Destillationsrückstand in wenig Aceton lösen → Entsorgung (RH).<br />
R 1 : abdestilliertes Lösungsmittel → Recycling (tert-Butylmethylether).<br />
Auswertung des Versuchs<br />
1 H-NMR-Spektrum von 8 (300 MHz, CDCl 3 ): δ = 2.21–2.35 (2 H), 2.41–2.55 (2 H), 2.97 (2 H), 3.61 (6 H),<br />
5.60 (2 H).<br />
a)<br />
b)<br />
c)<br />
a)<br />
b) c)<br />
6.0<br />
5.0 4.0 3.0<br />
2.0<br />
1.0 [ppm] 0.0<br />
13 C-NMR-Spektrum von 8 (75.5 MHz, CDCl 3 ): 25.67 (CH 2 ), 39.62 (CH), 51.76 (CH 3 ), 125.06 (CH), 173.66<br />
(C).<br />
LM<br />
180<br />
160<br />
140 120<br />
100<br />
80<br />
60 40 20 [ppm] 0<br />
Versuch <strong>4.2.2.8</strong>, Rev. 1.0 2
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
IR-Spektrum von 8 (Film):<br />
100<br />
T [%]<br />
3030<br />
2850<br />
50<br />
2950<br />
1735<br />
0<br />
4000 3000 2000 1500 1000 ν ~ [cm -1 ]<br />
* Formulieren Sie den zu 8 führenden Reaktionsmechanismus.<br />
Weitere denkbare Reaktionsprodukte:<br />
O<br />
O O<br />
O<br />
OH<br />
OMe<br />
O<br />
OMe<br />
CH 3<br />
OMe<br />
OMe<br />
O<br />
A B C<br />
O<br />
O<br />
* Mit welchen spektroskopischen Daten lassen sich A–C ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen. In welchem Zusammenhang stehen A und B?<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
Acetylchlorid in Methanol ist eine milde HCl-Quelle für die sauer katalysierte Veresterung. [1,2] Siehe auch<br />
Einführung Kap. 4.2.2.<br />
[1] U. Gerlach, Th. Haubenreich, S. Hünig, Chem. Ber. 1994, 127, 1969–1980.<br />
[2] A. Nudelman, Y. Bechor, E. Falb, B. Fischer, B.A. Wexler, A. Nudelman, Synth. Commun. 1998, 28, 471–<br />
474.<br />
Versuch <strong>4.2.2.8</strong>, Rev. 1.0 3