4.2.2.6: Zimtsäurenitril
4.2.2.6: Zimtsäurenitril
4.2.2.6: Zimtsäurenitril
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
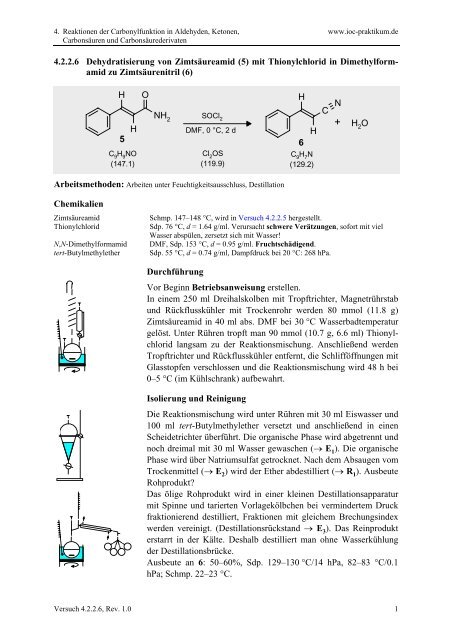
<strong>4.2.2.6</strong> Dehydratisierung von Zimtsäureamid (5) mit Thionylchlorid in Dimethylformamid<br />
zu Zimtsäurenitril (6)<br />
H<br />
5<br />
H<br />
C 9<br />
H 9<br />
NO<br />
(147.1)<br />
O<br />
NH 2<br />
SOCl 2<br />
DMF, 0 °C, 2 d<br />
Cl 2<br />
OS<br />
(119.9)<br />
H<br />
H<br />
6<br />
C 9<br />
H 7<br />
N<br />
(129.2)<br />
C<br />
N<br />
+<br />
H 2<br />
O<br />
Arbeitsmethoden: Arbeiten unter Feuchtigkeitsausschluss, Destillation<br />
Chemikalien<br />
Zimtsäureamid<br />
Thionylchlorid<br />
N,N-Dimethylformamid<br />
tert-Butylmethylether<br />
Schmp. 147–148 °C, wird in Versuch 4.2.2.5 hergestellt.<br />
Sdp. 76 °C, d = 1.64 g/ml. Verursacht schwere Verätzungen, sofort mit viel<br />
Wasser abspülen, zersetzt sich mit Wasser!<br />
DMF, Sdp. 153 °C, d = 0.95 g/ml. Fruchtschädigend.<br />
Sdp. 55 °C, d = 0.74 g/ml, Dampfdruck bei 20 °C: 268 hPa.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einem 250 ml Dreihalskolben mit Tropftrichter, Magnetrührstab<br />
und Rückflusskühler mit Trockenrohr werden 80 mmol (11.8 g)<br />
Zimtsäureamid in 40 ml abs. DMF bei 30 °C Wasserbadtemperatur<br />
gelöst. Unter Rühren tropft man 90 mmol (10.7 g, 6.6 ml) Thionylchlorid<br />
langsam zu der Reaktionsmischung. Anschließend werden<br />
Tropftrichter und Rückflusskühler entfernt, die Schlifföffnungen mit<br />
Glasstopfen verschlossen und die Reaktionsmischung wird 48 h bei<br />
0–5 °C (im Kühlschrank) aufbewahrt.<br />
Isolierung und Reinigung<br />
Die Reaktionsmischung wird unter Rühren mit 30 ml Eiswasser und<br />
100 ml tert-Butylmethylether versetzt und anschließend in einen<br />
Scheidetrichter überführt. Die organische Phase wird abgetrennt und<br />
noch dreimal mit 30 ml Wasser gewaschen (→ E 1 ). Die organische<br />
Phase wird über Natriumsulfat getrocknet. Nach dem Absaugen vom<br />
Trockenmittel (→ E 2 ) wird der Ether abdestilliert (→ R 1 ). Ausbeute<br />
Rohprodukt?<br />
Das ölige Rohprodukt wird in einer kleinen Destillationsapparatur<br />
mit Spinne und tarierten Vorlagekölbchen bei vermindertem Druck<br />
fraktionierend destilliert, Fraktionen mit gleichem Brechungsindex<br />
werden vereinigt. (Destillationsrückstand → E 3 ). Das Reinprodukt<br />
erstarrt in der Kälte. Deshalb destilliert man ohne Wasserkühlung<br />
der Destillationsbrücke.<br />
Ausbeute an 6: 50–60%, Sdp. 129–130 °C/14 hPa, 82–83 °C/0.1<br />
hPa; Schmp. 22–23 °C.<br />
Versuch <strong>4.2.2.6</strong>, Rev. 1.0 1
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel<br />
E 1 : Wässrige Phasen → Entsorgung (H 2 O mit RHal/Halogenid).<br />
E 2 : Trockenmittel → Entsorgung (Anorg. Feststoffe).<br />
E 3 : Destillationsrückstand in wenig Aceton lösen → Entsorgung (RH).<br />
R 1 : Abdestilliertes Lösungsmittel → Recycling (tert-Butylmethylether).<br />
Auswertung des Versuchs<br />
1 H-NMR-Spektrum von 6 (300 MHz, CDCl 3 ): δ = 5.87 (1 H), 7.38 (1 H), 7.37–7.48 (5 H).<br />
2222.8 Hz<br />
2206.0 Hz<br />
a) b)<br />
1769.9 Hz<br />
1753.2 Hz<br />
a) b)<br />
LM<br />
8.0 7.0<br />
6.0<br />
5.0<br />
4.0<br />
3.0 2.0 1.0 [ppm] 0.0<br />
13 C-NMR Spektrum von 6 (75.5 MHz, CDCl 3 ): δ = 96.36 (CH), 118.26 (C), 127.43 (CH), 129.17 (CH), 131.28<br />
(CH), 133.53 (C), 150.61 (CH).<br />
LM<br />
160<br />
140<br />
120<br />
100<br />
80<br />
60 40 20 [ppm] 0<br />
IR-Spektrum von 6 (Film):<br />
100<br />
T [%]<br />
50<br />
3055<br />
3030<br />
2225<br />
1620<br />
0<br />
4000 3000 2000 1500 1000 ν ~ [cm -1 ]<br />
* Formulieren Sie den zu 6 führenden Reaktionsmechanismus. Welche Funktion hat DMF?<br />
Versuch <strong>4.2.2.6</strong>, Rev. 1.0 2
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
Weitere denkbare Reaktionsprodukte:<br />
H 5<br />
C 6<br />
-CH=CH N CH=CH-C 6<br />
H 5<br />
N<br />
H 5<br />
C 6<br />
-CH=CH CH=CH-C 6<br />
H 5<br />
N N<br />
N<br />
CH=CH-C 6<br />
H 5<br />
NH<br />
NH<br />
H 5<br />
C 6<br />
-CH=CH O CH=CH-C 6<br />
H 5<br />
A B C<br />
* Mit welchen spektroskopischen Daten lassen sich A–C ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen.<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
Alkylnitrile werden üblicherweise durch Umsetzung von Alkylhalogeniden mit KCN in Substanz, in dipolar<br />
aprotischen Solventien oder mit Hilfe der Phasentransfer-Katalyse dargestellt (siehe Einführung Kap. 1.4).<br />
Arylnitrile können auch aus Arylhalogeniden durch nucleophile aromatische Substitution mit Kupfercyanid bei<br />
hohen Temperaturen erhalten werden (Rosenmund-von Braun-Reaktion). [1] Die wichtigste Methode ist allerdings<br />
die Sandmeyer-Reaktion von Diazoniumsalzen mit Cyanid-Ionen (siehe Einführung Kap. 7.4).<br />
In vielen Fällen ist die hier behandelte Dehydratisierung von Carbonsäureamiden die Methode der Wahl, da sie<br />
die Alkyl- und Arylnitrile mit besseren Ausbeuten liefert. [2–4]<br />
[1] D.T. Mowry, Chem. Rev. 1948, 42, 189–289.<br />
[2] E.A. Lawton, D.D. McRitchie, J. Org. Chem. 1959, 24, 26–28.<br />
[3] C.S. Marvel, M.M. Martin, J. Am. Chem. Soc. 1958, 80, 6600–6604.<br />
[4] K. Wallenfels, G. Bachmann, D. Hofmann, R. Kern, Tetrahedron 1965, 21, 2239–2256.<br />
Versuch <strong>4.2.2.6</strong>, Rev. 1.0 3