7.1.5: 2,4,6-Tribromanilin
7.1.5: 2,4,6-Tribromanilin
7.1.5: 2,4,6-Tribromanilin
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
7. Substitutionen an Aromaten und Heterocyclen www.ioc-praktikum.de<br />
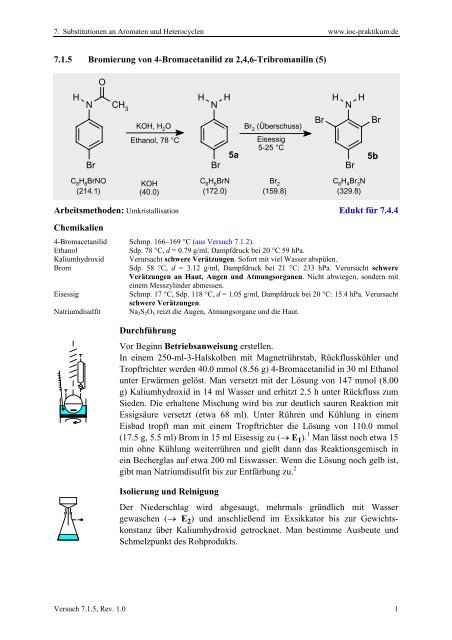
<strong>7.1.5</strong> Bromierung von 4-Bromacetanilid zu 2,4,6-<strong>Tribromanilin</strong> (5)<br />
O<br />
H<br />
N<br />
CH 3<br />
N H<br />
N H<br />
H<br />
Br<br />
H Br<br />
KOH, H 2<br />
O<br />
Br 2<br />
(Überschuss)<br />
Br<br />
Br<br />
Br<br />
Ethanol, 78 °C<br />
5a<br />
Eisessig<br />
5-25 °C<br />
5b<br />
C 8<br />
H 8<br />
BrNO<br />
(214.1)<br />
KOH<br />
(40.0)<br />
C 6<br />
H 6<br />
BrN<br />
(172.0)<br />
Br 2<br />
(159.8)<br />
C 6<br />
H 4<br />
Br 3<br />
N<br />
(329.8)<br />
Arbeitsmethoden: Umkristallisation Edukt für 7.4.4<br />
Chemikalien<br />
4-Bromacetanilid Schmp. 166–169 °C (aus Versuch 7.1.2).<br />
Ethanol<br />
Sdp. 78 °C, d = 0.79 g/ml, Dampfdruck bei 20 °C 59 hPa.<br />
Kaliumhydroxid Verursacht schwere Verätzungen. Sofort mit viel Wasser abspülen.<br />
Brom<br />
Sdp. 58 °C, d = 3.12 g/ml, Dampfdruck bei 21 °C: 233 hPa. Verursacht schwere<br />
Verätzungen an Haut, Augen und Atmungsorganen. Nicht abwiegen, sondern mit<br />
einem Messzylinder abmessen.<br />
Eisessig<br />
Schmp. 17 °C, Sdp. 118 °C, d = 1.05 g/ml, Dampfdruck bei 20 °C: 15.4 hPa. Verursacht<br />
schwere Verätzungen.<br />
Natriumdisulfit Na 2 S 2 O 5 reizt die Augen, Atmungsorgane und die Haut.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einem 250-ml-3-Halskolben mit Magnetrührstab, Rückflusskühler und<br />
Tropftrichter werden 40.0 mmol (8.56 g) 4-Bromacetanilid in 30 ml Ethanol<br />
unter Erwärmen gelöst. Man versetzt mit der Lösung von 147 mmol (8.00<br />
g) Kaliumhydroxid in 14 ml Wasser und erhitzt 2.5 h unter Rückfluss zum<br />
Sieden. Die erhaltene Mischung wird bis zur deutlich sauren Reaktion mit<br />
Essigsäure versetzt (etwa 68 ml). Unter Rühren und Kühlung in einem<br />
Eisbad tropft man mit einem Tropftrichter die Lösung von 110.0 mmol<br />
(17.5 g, 5.5 ml) Brom in 15 ml Eisessig zu (→ E 1 ). 1 Man lässt noch etwa 15<br />
min ohne Kühlung weiterrühren und gießt dann das Reaktionsgemisch in<br />
ein Becherglas auf etwa 200 ml Eiswasser. Wenn die Lösung noch gelb ist,<br />
gibt man Natriumdisulfit bis zur Entfärbung zu. 2<br />
Isolierung und Reinigung<br />
Der Niederschlag wird abgesaugt, mehrmals gründlich mit Wasser<br />
gewaschen (→ E 2 ) und anschließend im Exsikkator bis zur Gewichtskonstanz<br />
über Kaliumhydroxid getrocknet. Man bestimme Ausbeute und<br />
Schmelzpunkt des Rohprodukts.<br />
Versuch <strong>7.1.5</strong>, Rev. 1.0 1
7. Substitutionen an Aromaten und Heterocyclen www.ioc-praktikum.de<br />
Hinweise zur Entsorgung (E)<br />
Zur Umkristallisation prüfe man folgende Lösungsmittel und protokolliere<br />
die Löslichkeiten:<br />
Ethanol (Sdp. 78 °C, DK 24.3) (→ E 3 )<br />
Toluol (Sdp. 111 °C, DK 2.4) (→ E 3 )<br />
Wasser (Sdp. 100 °C, DK 78.5) (→ E 2 )<br />
Ethanol/Wasser (→ E 2 )<br />
Zur Reinigung kristallisiert man aus Ethanol um, Kristallisation im Eisbad,<br />
Absaugen auf einem Büchnertrichter (Mutterlauge → E 3 ), Vakuumexsikkator<br />
über Silicagel. Man bestimme Ausbeute und Schmelzpunkt des<br />
Reinprodukts. Ausbeute an 5b: 65–80%, Schmp. 122 °C.<br />
1<br />
2<br />
Welches Produkt reagiert mit Brom (4-Bromacetanilid oder 4-Bromanilin 5a)?<br />
Woher rührt die Gelbfärbung? Reaktion mit Natriumhydrogensulfit?<br />
E 1 : Alle mit Brom verunreinigten Geräte werden mit einer wässr. Natriumdisulfit- oder Natriumthiosulfat-<br />
Lösung zur Reduktion des Broms zu Bromid gespült → Abwasser.<br />
E 2 : Wässriges Filtrat und Mutterlauge → Entsorgung (H 2 O mit RHal/Halogenid).<br />
E 3 : Mutterlauge → Entsorgung (RHal).<br />
Auswertung des Versuchs<br />
1 H-NMR-Spektrum von 5b (250 MHz, CDCl 3 ): δ = 4.56 (s, 2 H, breit), 7.50 (s, 2 H).<br />
13 C-NMR Spektrum von 5b (62.9 MHz, CDCl 3 ): δ = 108.84 (C), 110.23 (C), 133.85 (CH), 141.38 (C).<br />
IR-Spektrum von 5b (KBr):<br />
100<br />
T [%]<br />
50<br />
3415<br />
3075<br />
3300<br />
1615<br />
0<br />
4000 3000 2000 1500 1000 ν ~ [cm -1 ]<br />
* Formulieren Sie den zu 5 führenden Reaktionsmechanismus.<br />
Weitere denkbare Reaktionsprodukte:<br />
Br<br />
Br<br />
HNCOCH 3<br />
NH 2<br />
NHBr<br />
Br<br />
Br<br />
Br<br />
A B C<br />
* Mit welchen spektroskopischen Daten lassen sich A–C ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen.<br />
Versuch <strong>7.1.5</strong>, Rev. 1.0 2
7. Substitutionen an Aromaten und Heterocyclen www.ioc-praktikum.de<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
Die Hydrolyse von 4-Bromacetanilid erzeugt 4-Bromanilin 5a, das zum dreifach bromierten 5b substituiert wird.<br />
Der Vergleich der Versuche 7.1.2 und <strong>7.1.5</strong> zeigt die unterschiedlich aktivierende Kraft von Acetamino- und<br />
Amino-Gruppen als Donor-Substituenten und die größere Donorstärke der Amino-Gruppe.<br />
Versuch <strong>7.1.5</strong>, Rev. 1.0 3