Physik und Umwelt I Lösungen der Übungen Nr. 7 LOES-PU-I-Ü7-1 ...
Physik und Umwelt I Lösungen der Übungen Nr. 7 LOES-PU-I-Ü7-1 ...
Physik und Umwelt I Lösungen der Übungen Nr. 7 LOES-PU-I-Ü7-1 ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
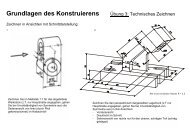
Aufgabe 7.1<br />
<strong>Physik</strong> <strong>und</strong> <strong>Umwelt</strong> I<br />
Lösungen <strong>der</strong> Übungen <strong>Nr</strong>. 7<br />
Barometrische Höhenformel:<br />
h<br />
p = p exp( − )<br />
0<br />
H<br />
RT<br />
H = (Skalenhöhe)<br />
gM m<br />
Die Skalenhöhe H hat für T = 273 K den Wert: H ≈ 8000 m<br />
Wegen<br />
1 gM<br />
m<br />
= <strong>und</strong><br />
H RT<br />
p<br />
ρ RT<br />
= folgt<br />
0<br />
0<br />
M<br />
m<br />
1 ρ g<br />
0<br />
= .<br />
H p<br />
0<br />
Damit erhält die barometrische Höhenformel die Form<br />
ρ g<br />
0<br />
p = p exp( − h) .<br />
0<br />
p<br />
0<br />
Der Schweredruck eines Gases nimmt mit <strong>der</strong> Höhe h um so schneller ab, je größer seine<br />
−3<br />
3<br />
Bodendichte ρ 0<br />
ist. Mit den Zahlenwerten p 0 = 1013,25 hPa <strong>und</strong> ρ = 1,293⋅10<br />
g / cm für<br />
0<br />
eine Temperatur T entsprechend von ϑ = 0° C erhält man für den Luftdruck p in <strong>der</strong> Höhe h:<br />
n<br />
−0,125<br />
h / km<br />
p = 1013,25⋅<br />
e hPa.<br />
Die barometrische Höhenformel wurde bereits 1686 erstmals durch den englischen <strong>Physik</strong>er<br />
<strong>und</strong> Astronom Edmond Halley (1656 - 1742) angegeben.<br />
a) p(h) für h = 10 km:<br />
p(h) = 1013,25⋅<br />
e<br />
p = 290 hPa<br />
b) p = 982 hPa<br />
1013,25 hPa<br />
p 0<br />
=<br />
−1,25<br />
hPa = 290 hPa<br />
.<br />
−0,125<br />
h / km<br />
p = 1013,25⋅<br />
e hPa<br />
h / km<br />
=<br />
h = 251 m<br />
1<br />
ln<br />
0,125<br />
p<br />
p<br />
0 =<br />
0,2506<br />
<strong>LOES</strong>-<strong>PU</strong>-I-Ü7-1
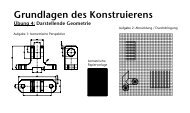
Aufgabe 7.2<br />
<strong>Physik</strong> <strong>und</strong> <strong>Umwelt</strong> I<br />
Lösungen <strong>der</strong> Übungen <strong>Nr</strong>. 7<br />
Es gilt:<br />
Δ ϑ / ° C = ΔT / K<br />
l = l (1 + αΔϑ)<br />
0<br />
l = l (1 + α Δϑ)<br />
= 500m(1 + 23,1 ⋅10<br />
K ⋅100K)<br />
= 501,15m<br />
Al 0 Al<br />
l = l (1 + α Δϑ)<br />
= 500m(1 + 12 ⋅10<br />
K ⋅100K)<br />
= 500,6m<br />
St 0 St<br />
−6<br />
−6<br />
−1<br />
−1<br />
Längenunterschied:<br />
Δ l = 0,55m<br />
Aufgabe 7.3<br />
Lösungsalternative 1:<br />
γ = 3 α<br />
Δ<br />
0<br />
V = γV<br />
Δϑ<br />
V<br />
4π<br />
3<br />
3<br />
= r<br />
0 0<br />
d = 200 mm<br />
r 0<br />
= 10cm<br />
V = 4189,0 cm<br />
0<br />
3<br />
3<br />
Δ V = 20,7cm<br />
Lösungsalternative 2:<br />
V =<br />
4π<br />
r<br />
3<br />
3<br />
r = r (1 + α Δϑ)<br />
= 10,0165cm<br />
0 Cu<br />
V = 4209,6<br />
3<br />
cm<br />
Δ V = V − V = 20,7 cm<br />
0<br />
3<br />
<strong>LOES</strong>-<strong>PU</strong>-I-Ü7-2
Aufgabe 7.4<br />
<strong>Physik</strong> <strong>und</strong> <strong>Umwelt</strong> I<br />
Lösungen <strong>der</strong> Übungen <strong>Nr</strong>. 7<br />
Abk.:<br />
ρ = ρ ; = V<br />
0 20 C<br />
0 20°<br />
C<br />
V<br />
°<br />
Es gilt:<br />
m m<br />
20 C 50 ° C<br />
°<br />
= = m<br />
Eine gegebene Masse bleibt unverän<strong>der</strong>t, wenn sich ihre Temperatur än<strong>der</strong>t!<br />
m<br />
ρ =<br />
0<br />
V<br />
ρ<br />
0<br />
m<br />
=<br />
50° C<br />
V50<br />
° C<br />
Das Volumen ist temperaturabhängig: V = V (1 + γΔϑ)<br />
0<br />
Δ ϑ =<br />
50 ° C − 20°<br />
C = 30°<br />
C<br />
ρ =<br />
m m ρ<br />
0<br />
=<br />
=<br />
V V (1 + γΔϑ)<br />
(1 + γΔϑ)<br />
0<br />
3 3<br />
ρ = 0,764<br />
⋅10<br />
kg / m<br />
50 ° C<br />
Hinweis: Im Allgemeinen wird bei Dichteangaben von Flüssigkeiten eine Bezugstemperatur<br />
von ϑ = 20 C gewählt!<br />
Z<br />
°<br />
Aufgabe 7.5<br />
Für die Stoffmenge n einer Gasmasse m gilt:<br />
n =<br />
m<br />
M m<br />
M m<br />
= 28g / mol = 0,028kg / mol ist die molare Masse von Stickstoff.<br />
In 1 g Stickstoff befindet sich die Stoffmenge:<br />
n 1g 1<br />
= = mol<br />
28g / mol 28<br />
=<br />
0,0357 mol<br />
Für die Zahl N <strong>der</strong> N -Moleküle folgt:<br />
2<br />
N = n ⋅ N = 0,0357 mol ⋅ 6,022 ⋅10<br />
mol = 2,15⋅10<br />
A<br />
N<br />
A<br />
ist die Avogadro-Konstante.<br />
23<br />
−1<br />
22<br />
Moleküle.<br />
<strong>LOES</strong>-<strong>PU</strong>-I-Ü7-3
<strong>Physik</strong> <strong>und</strong> <strong>Umwelt</strong> I<br />
Lösungen <strong>der</strong> Übungen <strong>Nr</strong>. 7<br />
Aufgabe 7.6<br />
Zustandsgleichung für ideale Gase:<br />
p V = n R T<br />
n ist die Stoffmenge, m ist die Gasmasse.<br />
n =<br />
m<br />
M m<br />
M m<br />
= 2g / mol = 0,002kg / mol ist die molare Masse von Wasserstoff ( H ).<br />
2<br />
pV =<br />
m<br />
M<br />
m<br />
RT<br />
m =<br />
pVM<br />
RT<br />
m<br />
Daten: p = 7,6 kPa = 7,6 ⋅ 10 Pa<br />
T = 273,15 K ( ϑ = 0 °C)<br />
−<br />
V = 4,0 l = 4 ⋅ 10<br />
3 m 3<br />
R = 8,314 J/(mol K)<br />
m = 0,0268 g = 26,8 mg<br />
H 2<br />
3<br />
Aufgabe 7.7<br />
Ausgehend von <strong>der</strong> Zustandsgleichung idealer Gase<br />
pV =<br />
m<br />
M<br />
m<br />
RT<br />
folgt mit <strong>der</strong> spezifischen Gaskonstanten<br />
pV = mR T .<br />
S<br />
R = R<br />
S<br />
M<br />
:<br />
m<br />
pV<br />
mR S<br />
=<br />
T<br />
Mit<br />
p<br />
6<br />
= 0,81 10 Pa , T 1<br />
= (273,15 + 12) K = 285,15K<br />
<strong>und</strong> V = 0,855m<br />
folgt:<br />
1<br />
1<br />
⋅<br />
3<br />
<strong>LOES</strong>-<strong>PU</strong>-I-Ü7-4
<strong>Physik</strong> <strong>und</strong> <strong>Umwelt</strong> I<br />
Lösungen <strong>der</strong> Übungen <strong>Nr</strong>. 7<br />
mR<br />
p V<br />
1<br />
=<br />
T<br />
1<br />
=<br />
S<br />
1<br />
2428,72J / K<br />
An<strong>der</strong>erseits gilt für dieselbe Gasmasse:<br />
p V<br />
2<br />
mR =<br />
S<br />
T<br />
2<br />
2<br />
O<strong>der</strong>:<br />
T<br />
2<br />
mR<br />
2 S<br />
V<br />
2<br />
p =<br />
320K<br />
p = 2428,72J / K = 0,972MPa = 972kPa<br />
2 3<br />
0,8m<br />
Aufgabe 7.8<br />
Die gefüllte Gasflasche besitzt die Stoffmenge n. Nach Entnahme <strong>der</strong> Stoffmenge<br />
verbleibt in <strong>der</strong> Gasflasche die Stoffmenge n = n − n .<br />
Anwendung <strong>der</strong> Zustandsgleichung idealer Gase auf die drei isothermen Zustände liefert:<br />
pV = nRT (volle Gasflasche)<br />
p V = n RT (Restmenge in <strong>der</strong> Gasflasche nach Entnahme)<br />
x x<br />
p V = n RT (Zustandsgleichung für entnommene Gasmenge).<br />
E E E<br />
Es gilt:<br />
x<br />
E<br />
n<br />
E<br />
p<br />
x<br />
n RT (n − n )RT<br />
x<br />
E<br />
= =<br />
(Gl. 8.1)<br />
V V<br />
pV<br />
n = <strong>und</strong><br />
RT<br />
n<br />
E<br />
p V<br />
E E<br />
= (Gl. 8.2)<br />
RT<br />
Einsetzen von Gl. 8.2 in Gl. 8.1 liefert:<br />
p<br />
x<br />
=<br />
pV<br />
−<br />
p<br />
V<br />
E<br />
V<br />
E<br />
p<br />
x<br />
150⋅10<br />
=<br />
5<br />
Pa ⋅0,05m<br />
3<br />
0,05m<br />
−1⋅10<br />
3<br />
5<br />
Pa ⋅0,5m<br />
3<br />
= 140⋅10<br />
5<br />
Pa<br />
<strong>LOES</strong>-<strong>PU</strong>-I-Ü7-5