EpiTan Ltd. - Clinuvel Pharmaceuticals
EpiTan Ltd. - Clinuvel Pharmaceuticals
EpiTan Ltd. - Clinuvel Pharmaceuticals
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
27.10.2004 11:13<br />
<strong>EpiTan</strong> <strong>Ltd</strong>.<br />
Pharma<br />
> Click here for Disclaimer<br />
Hauptprodukt „Melanotan“ sonnt sich im<br />
Blockbuster-Potenzial<br />
Rating:<br />
Spekulativer Kauf seit: 07.10.2004<br />
Kursziel: AUD 3,50<br />
seit: 07.10.2004<br />
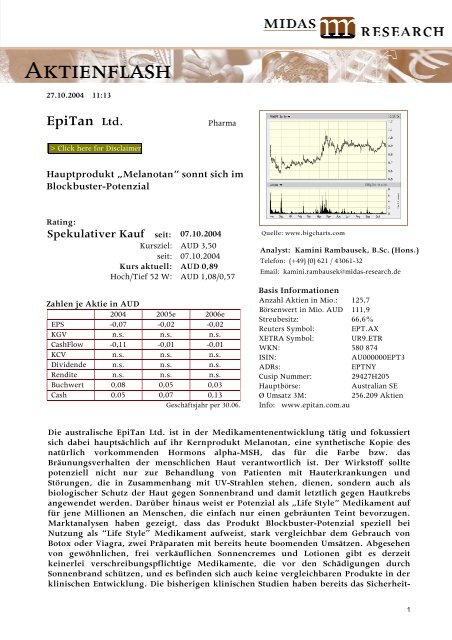
Kurs aktuell: AUD 0,89<br />
Hoch/Tief 52 W: AUD 1,08/0,57<br />
Zahlen je Aktie in AUD<br />
2004 2005e 2006e<br />
EPS -0,07 -0,02 -0,02<br />
KGV n.s. n.s. n.s.<br />
CashFlow -0,11 -0,01 -0,01<br />
KCV n.s. n.s. n.s.<br />
Dividende n.s. n.s. n.s.<br />
Rendite n.s. n.s. n.s.<br />
Buchwert 0,08 0,05 0,03<br />
Cash 0,05 0,07 0,13<br />
Geschäftsjahr per 30.06.<br />
Quelle: www.bigcharts.com<br />
Analyst: Kamini Rambausek, B.Sc. (Hons.)<br />
Telefon: (+49) (0) 621 / 43061-32<br />
Email: kamini.rambausek@midas-research.de<br />
Basis Informationen<br />
Anzahl Aktien in Mio.: 125,7<br />
Börsenwert in Mio. AUD 111,9<br />
Streubesitz: 66,6%<br />
Reuters Symbol: EPT.AX<br />
XETRA Symbol: UR9.ETR<br />
WKN: 580 874<br />
ISIN:<br />
AU000000EPT3<br />
ADRs:<br />
EPTNY<br />
Cusip Nummer: 29427H205<br />
Hauptbörse:<br />
Australian SE<br />
Ø Umsatz 3M:<br />
256.209 Aktien<br />
Info: www.epitan.com.au<br />
Die australische <strong>EpiTan</strong> <strong>Ltd</strong>. ist in der Medikamentenentwicklung tätig und fokussiert<br />
sich dabei hauptsächlich auf ihr Kernprodukt Melanotan, eine synthetische Kopie des<br />
natürlich vorkommenden Hormons alpha-MSH, das für die Farbe bzw. das<br />
Bräunungsverhalten der menschlichen Haut verantwortlich ist. Der Wirkstoff sollte<br />
potenziell nicht nur zur Behandlung von Patienten mit Hauterkrankungen und<br />
Störungen, die in Zusammenhang mit UV-Strahlen stehen, dienen, sondern auch als<br />
biologischer Schutz der Haut gegen Sonnenbrand und damit letztlich gegen Hautkrebs<br />
angewendet werden. Darüber hinaus weist er Potenzial als „Life Style“ Medikament auf<br />
für jene Millionen an Menschen, die einfach nur einen gebräunten Teint bevorzugen.<br />
Marktanalysen haben gezeigt, dass das Produkt Blockbuster-Potenzial speziell bei<br />
Nutzung als “Life Style” Medikament aufweist, stark vergleichbar dem Gebrauch von<br />
Botox oder Viagra, zwei Präparaten mit bereits heute boomenden Umsätzen. Abgesehen<br />
von gewöhnlichen, frei verkäuflichen Sonnencremes und Lotionen gibt es derzeit<br />
keinerlei verschreibungspflichtige Medikamente, die vor den Schädigungen durch<br />
Sonnenbrand schützen, und es befinden sich auch keine vergleichbaren Produkte in der<br />
klinischen Entwicklung. Die bisherigen klinischen Studien haben bereits das Sicherheit-<br />
1
und Wirksamkeitsprofil von Melanotan ermittelt. Umfassende globale Phase-III-Studien<br />
sind nun für 2005 terminiert, in deren Anschluss dann die Markteinführung des<br />
Medikamentes zu erwarten ist. Hierfür sucht das Unternehmen aktuell einen oder auch<br />
mehrere Entwicklungs- und Vermarktungspartner, der bzw. die relativ früh im Verlauf<br />
von 2005 bekannt gegeben werden sollten. Aber auch bei Schwierigkeiten auf der Suche<br />
nach einem geeigneten Pharmapartner innerhalb der nächsten 12 Monate verfügt <strong>EpiTan</strong><br />
als Ergebnis einer jüngsten Finanzierungsrunde über ausreichende Liquidität, um<br />
weitere klinische Studien wenigstens auf den Weg zu bringen.<br />
<strong>EpiTan</strong> - Unternehmensprofil<br />
<strong>EpiTan</strong> Limited mit Hauptsitz in Melbourne (Australien) und seit Februar 2001 an der<br />
Australischen Börse notiert, ist ein Pharmaunternehmen, das sich hauptsächlich auf die<br />
Entwicklung und Vermarktung seines wichtigsten Produktes, Melanotan, fokussiert. Die<br />
Entwicklung des Produktes begann bereits Mitte der 1980er Jahre an der Universität von<br />
Arizona in den USA. 1995 wurde die Melanotan Corporation Inc. gegründet mit dem Ziel,<br />
einen Pharmapartner zur weiteren Entwicklung und Vermarktung von Melanotan zu finden, und<br />
<strong>EpiTan</strong> nahm bereits kurz darauf Verhandlungen mit dieser Gruppe auf, um die exklusiven<br />
Rechte an dem Produkt zu erhalten. <strong>EpiTan</strong> erwarb schließlich diese exklusiven Rechte und die<br />
Melanotan Corp. wurde im Gegenzug zu einem der Großaktionäre des Unternehmens. Aktuell<br />
hält diese Gesellschaft noch einen Anteil von 2,5%. <strong>EpiTan</strong> hat ferner einen umfassenden<br />
Patentschutz in Bezug auf Melanotan für sich erwirken können, verfügt über weltweite<br />
Vermarktungsrechte und hat darüber hinaus weitere Schritte im Hinblick auf seine<br />
Marktexklusivität unternommen, um mögliche Wettbewerber von irgendwelchen<br />
Marktanteilsgewinnen abzuhalten.<br />
Australien wies bereits die höchste Rate an Hautkrebs weltweit auf, noch lange bevor das<br />
Ozonloch zu einem Thema globaler Beunruhigung wurde. Entsprechend gibt es gerade dort ein<br />
weit verbreitetes Interesse und rigorose Kampagnen, um der Öffentlichkeit die Folgen einer<br />
übermäßigen Aussetzung gegenüber dem Sonnenlicht bewusst zu machen. <strong>EpiTan</strong>s<br />
geographische Lage stellte insofern ideale Voraussetzungen für eine rasche Entwicklung des<br />
Unternehmens dar und bildete so zugleich die Basis für die Allianz mit der Melanotan<br />
Corporation.<br />
<strong>EpiTan</strong>s Strategie<br />
Derzeit hat <strong>EpiTan</strong> drei Zielmärkte für Melanotan ins Visier genommen: prophylaktische,<br />
therapeutische sowie kosmetische Anwendungen. Marktanalysen haben bereits „Blockbuster<br />
Potenzial“ für das Produkt aufgezeigt, das folglich Millionen an Dollar für den<br />
Entwicklungspartner und damit letztlich für <strong>EpiTan</strong> selbst zu generieren in der Lage sein könnte.<br />
Zusätzlich könnte ein unter Umständen signifikanter „latenter“ Markt bestehen, der solche<br />
Menschen umfasst, die ein verschreibungspflichtiges Medikament nur aus Gründen der Eitelkeit<br />
bzw. des Wohlfühlens nachfragen. Dieser Markt weist damit starke Parallelen zu demjenigen für<br />
Botox oder Viagra auf, zwei Produkte mit boomenden Umsätzen. Der Markt für<br />
Erektionsstörungen wurde bei Markteinführung von Viagra auf ca. USD 100 Mio. geschätzt –<br />
inzwischen beläuft er sich sage und schreibe auf USD 2,2 Mrd.<br />
<strong>EpiTan</strong>s aktuelle Strategie besteht darin, einen oder mehrere geeignete Partner zur<br />
gemeinsamen Weiterentwicklung sowie zur Vermarktung und zum Vertrieb des Produktes in<br />
2
den USA, Europa und anderswo zu finden, während das Unternehmen die Kommerzialisierung in<br />
Australien und Neuseeland in Eigenregie behält. <strong>EpiTan</strong> dürfte dabei eher nach verschiedenen<br />
Partnern Ausschau halten, jeder aber mit einer dominierenden Marktstellung in seiner jeweiligen<br />
Region (Europa, USA, Rest der Welt). Eindeutig haben der us-amerikanische sowie der<br />
europäische Markt in Anbetracht des Anteils der hellhäutigen Bevölkerung das größte Potenzial.<br />
Wir gehen davon aus, dass das Unternehmen Gespräche mit möglichen Pharmapartnern aktiv<br />
voran treibt und erwarten eine diesbezügliche Ankündigung zumindest im 2. Quartal 2005.<br />
<strong>EpiTan</strong> kalkuliert damit, von dem neuen Partner eine Einmalzahlung bei Vertragsabschluss,<br />
weitere meilensteinabhängige Zahlungen, Finanzierung der restlichen klinischen Studien und<br />
Vertriebs- bzw. Marketingkosten (für die USA und Europa) sowie eine zweistellige<br />
Umsatzbeteiligung zu erhalten. Grundsätzlich stellen die Finanzierung der klinischen Studien<br />
sowie von Vertrieb und Marketing immer eine Herausforderung für ein Biotech-Unternehmen<br />
dar. Sollte <strong>EpiTan</strong> tatsächlich eine derart umfassende Unterstützung erreichen können, wäre<br />
damit allerdings höchst wahrscheinlich eine Aufgabe der Kontrolle über Melanotan –<br />
wenigstens partiell – verbunden. Der Pharmapartner könnte nämlich eine vollständige Kontrolle<br />
über die klinische Entwicklung verlangen und zudem den zeitlichen Ablauf mit Blick auf die<br />
anderen Produkte in seiner Pipeline festlegen. Dies ist voraussichtlich ein wesentlicher<br />
Diskussionspunkt in den Gesprächen mit möglichen Pharmapartnern, und wir warten mit<br />
großem Interesse auf die endgültige Vereinbarung. In jeden Fall geht <strong>EpiTan</strong> davon aus, die<br />
Region Australien / Neuseeland sowie die weltweiten Patentrechte an Melanotan behalten zu<br />
können, während der oder die Partner die vollständigen und exklusiven Vermarktungs- und<br />
Vertriebsrechte an Melanotan für alle übrigen Gebiete übernehmen.<br />
<strong>EpiTan</strong> beabsichtigt mit Melanotan eine klinische Phase-II-Studie als Therapeutikum zur<br />
Behandlung des polymorphen Lichtexanthems (PMLE) (i.e. Lichtausschlag) aufzunehmen,<br />
wobei die Studien in den Wintermonaten vor allem in Deutschland und Großbritannien beginnen<br />
sollen. Laut Aussage leiden 10-20% der Bevölkerung in Großbritannien, Skandinavien und den<br />
USA an PMLE. PMLE, auch Sonnenvergiftung genannt, ist eine Hautallergie, die durch UV-<br />
Strahlen verursacht wird.<br />
Am Anfang der klinischen Tests wird PMLE zunächst bei den Patienten herbeigeführt. Sobald<br />
sich dann die entsprechenden Symptome zeigen, erhalten die Patienten Melanotan (als festes<br />
Implantat, aus dem die Substanz langsam in den Körper abgegeben wird), und werden im<br />
Anschluss erneut PMLE ausgesetzt. Eine Messung der Pigmentierung (d.h. des Melanin-Niveaus)<br />
erfolgt dann nach ein bis zwei Monaten. Kriterium für die Wirksamkeit ist dabei die Reduzierung<br />
der Symptome (Hautausschlag oder Beschwerden des Patienten). Unter Umständen verlaufen die<br />
Studien auch schneller, da es ein eindeutig definiertes medizinisch Wirksamkeitskriterium als<br />
Endpunkt der Untersuchungen gibt. Außerdem besteht die Chance auf eine schnelle behördliche<br />
Genehmigung im Falle dieses bisher anderweitig nicht gedeckten medizinischen Bedarfsfalles.<br />
Melanotan – der Wirkstoff<br />
Melanotan ist eine synthetische Kopie des natürlich vorkommenden Hormons alpha-MSH,<br />
welches die Melanin-Produktion der Haut anregt. Melanin ist das für die Dunkelfärbung bzw.<br />
gebräunte Erscheinung der Haut verantwortliche Pigment. Studien haben gezeigt, dass<br />
Melanotan sogar noch vielfach wirksamer als das natürliche alpha-MSH selbst ist. Erhöhte<br />
Melanin-Pegel schützen den Körper vor Hauterkrankungen als Folge von Sonnenbrand und<br />
werden mit einem verringerten Auftreten von Hautkrebs in Verbindung gebracht.<br />
3
Ein wesentlicher Aspekt bei der Anwendung von Melanotan als Medikament für den<br />
Massenmarkt ist die Frage der richtigen Darreichungsform. Gemäß der ursprünglichen<br />
Entwicklung ist es als Flüssigkeit durch Injektion zu verabreichen, aber diese<br />
Behandlungsweise hat sich nicht als besonders patientenfreundlich erwiesen, da zehn<br />
Tagesinjektionen bis zum Erreichen einer effektiven Melanotan-Dosis von Nöten sind. <strong>EpiTan</strong> hat<br />
daraufhin alternative Formen der Verabreichung erforscht (siehe Diagramm) und hat für diese<br />
auch zusätzlichen Patentschutz erworben.<br />
<strong>EpiTan</strong>: Melanotan – Darreichungsformen<br />
Quelle: <strong>EpiTan</strong>, MIDAS Research<br />
Insbesondere ist in Zusammenarbeit mit dem Southern Research Institute (Alabama, USA) die<br />
Entwicklung eines injezierbaren festen Implantats gelungen, aus dem die Substanz<br />
kontinuierlich über einen längeren Zeitraum in den Körper abgegeben wird. Das Implantat selbst<br />
ist so klein und dünn, dass es dem Patienten mit einer normalen Bluttransfusionsnadel<br />
eingespritzt werden kann. Zukünftige klinische Studien, sowie auch die Kommerzialisierung,<br />
werden sich nun auf dieses Implantat als das Produkt der ersten Generation konzentrieren. Das<br />
Implantat wird durch eine einzige Injektion verabreicht (am besten in der Nähe des Oberarmes)<br />
und bewirkt in den folgenden 15 bis 20 Tagen eine stetige Abgabe von Melanotan in den<br />
Blutkreislauf. Es ist aus dem gleichen Material wie selbst auflösende Fäden hergestellt und<br />
braucht somit am Ende der Behandlung nicht entfernt zu werden.<br />
<strong>EpiTan</strong> führt zurzeit mit dem Implantat Tests zur Ermittlung der optimalen Dosis in Brisbane<br />
durch. Wir erwarten, dass diese bis Dezember 2004 beendet sind und die Ergebnisse Anfang<br />
2005 bereit stehen. Die nächste klinische Studie, eine Phase-II-Studie bei PMLE in Europa, wird<br />
dann das Implantat verwenden. Eine separate Phase-II-Studie bei Sonnenbrand-Verletzungen soll<br />
in den USA erfolgen - diese Information wurde auf der Hauptversammlung des Unternehmens am<br />
1. Oktober 2004 publik – und ebenfalls umgehend nach Feststellung der Dosierungsergebnisse<br />
aufgenommen werden.<br />
Im September 2003 nahm <strong>EpiTan</strong> die Zusammenarbeit mit pSiMedica <strong>Ltd</strong>., einer<br />
Tochtergesellschaft der australischen pSivida, auf, um unter Verwendung der „BioSilicon“-<br />
4
Nanotechnologie von pSivida eine Darreichungsform für Melanotan zur langsamen Abgabe auf<br />
Basis einer Flüssigkeit zu entwickeln. Die mikroskopisch kleine, honigwabenartig poröse<br />
Struktur von BioSilicon sollte dabei eine leichte Aufnahme von Melanotan ermöglichen. Diese<br />
Verabreichung zur langfristigen Wirkstoffabgabe soll ebenfalls durch eine einzelne Injektion,<br />
aber als Flüssigkeit, erfolgen und könnte von <strong>EpiTan</strong> für zukünftige Produktgenerationen von<br />
Melanotan entwickelt werden.<br />
In Zusammenarbeit mit der Monash Universität hat Epitan ferner die Möglichkeit einer oralen<br />
Darreichungsform von Melanotan evaluiert. Dies stellt u.E. insofern eine besondere<br />
Herausforderung dar, da das Medikament - ein Peptide - seine Wirksamkeit verlieren könnte,<br />
sobald es in Kontakt mit der säurehaltigen Umgebung des Magens kommt. In diesem<br />
Zusammenhang ist darauf hinzuweisen, dass selbst für Insulin die Entwicklung einer<br />
erfolgreichen oralen Darreichungsform noch aussteht.<br />
Eine näher liegende Herausforderung stellt für <strong>EpiTan</strong> sicherlich die Entwicklung einer<br />
äußerlichen Darreichungsform dar, die patientenfreundlicher und auch leichter zu vermarkten<br />
und verkaufen wäre als ein Implantat. Nach Vereinbarungen mit mehreren, auf transdermale<br />
Medikation spezialisierten Firmen - u.a. CollaGenex Pharmaceutical (USA), Thomas Sköld<br />
(Sweden) und Transdermal Technologies Inc., befindet sich inzwischen eine äußerliche<br />
Darreichungsmöglichkeit von Melanotan als Lotion, Sprach oder Pflaster in der Entwicklung.<br />
Vorklinische Studien mit vielversprechenden Ergebnissen konnten bereits abgeschlossen werden<br />
und weitere Details sind in den nächsten Wochen zu erwarten. Die Aufnahme einer klinischen<br />
Phase-I-Humanstudie ist für Ende 2004 geplant.<br />
Epitan hat eine so genannte „Investigational New Drug“ (IND) Antragstellung bei der FDA in<br />
Vorbereitung. Nach entsprechender fachkundiger Beratung in Bezug auf das<br />
Zulassungsverfahren und Gesprächen mit der FDA selbst beabsichtigt <strong>EpiTan</strong> die Antragstellung<br />
zur Erlaubnis von klinischen Studien in den USA einzureichen, sobald die Dosierungstests<br />
abgeschlossen sind. Indem <strong>EpiTan</strong> die Fertigstellung der australischen Dosierungsstudien<br />
abwartet, wird eine zweite Dosierungsstudie in den USA vermieden und die klinische Erprobung<br />
kann direkt auf der Phase-II-Ebene starten. Diese Phase-II-Studie sollte dann direkt in eine Phase-<br />
III-Studie übergehen und in 2005 begonnen werden.<br />
Als Ergebnis der ersten Gespräche mit der FDA im November 2003 sieht <strong>EpiTan</strong> die<br />
wahrscheinlichste Indikation für Melanotan in der Prävention bzw. der Verminderung von<br />
durch UV-Strahlung ausgelösten Hautschädigungen bei Personen mit einem genetisch bedingten<br />
hohen Risiko. Das Implantat zur langsamen Wirkstoffabgabe dürfte als erstes genehmigt werden,<br />
da sich schon vergleichbare Produkte auf dem Markt befinden, so etwa Zoladex von AstraZeneca<br />
zur Behandlung von Prostata-Krebs. Dabei ist eine Einstufung von Melanotan als ein<br />
verschreibungspflichtiger „Sonnenschutz“ in Form des Implantats zu erwarten.<br />
Melanotan – das Marktpotenzial<br />
Eine unabhängige Studie, die vor kurzem von PharmaVentures (Oxford, UK) durchgeführt<br />
wurde, hat drei wesentliche Märkte für Melanotan identifiziert. Dabei gilt es zu beachten, dass<br />
PharmaVentures kein vergleichbares Produkt finden konnte, und zwar weder am Markt noch in<br />
der Entwicklung. Dies macht die Preisermittlung für das Medikament besonders schwierig,<br />
jedoch wurden Preisannahmen aufgrund anderer dermatologischer Produkte vorgenommen.<br />
5
Als Zielgruppe des Marktes für die prophylaktische Verwendung gelten Personen, die nicht<br />
leicht bräunen und folglich einem erhöhten Hautkrebsrisiko unterliegen. Dies schließt Menschen<br />
mit heller, sonnenempfindlicher Haut ein, vor allem Hauttypen I und II eingestuft nach<br />
Fitzpatrick, für die ein wirkungsvoller Schutz vor Sonnenbrand und schädlicher, das Risiko von<br />
Hautkrebs erhöhender UV-Strahlung, von großer Bedeutung ist.<br />
Eine Anmerkung zu der Fitzpatrick Klassifikation<br />
Melanin bestimmt die Hautfarbe eines Menschen. Die Menge an Melanin, das die Melanozyten<br />
eines Menschen produzieren, ist dabei genetisch vorgegeben. Melanin hilft, die Haut vor<br />
Sonnenbrand zu schützen. Hellhäutige oder blonde Personen haben z.B. wenig Melanin,<br />
dunkelhäutige Personen dagegen mehr. Fitzpatrick hat die Beschreibung der Hauttypen,<br />
bekannt als Fitzpatrick-Hauttypen-Klassifikation, entwickelt. Diese Klassifikation bezeichnet 6<br />
verschiedene Hauttypen, Hautfarben und ihre Reaktion auf Sonnenlicht:<br />
Typ I (sehr weiss oder sommersprossig) – Verbrennt immer<br />
Typ II (weiß) – Verbrennt meist<br />
Typ III (weiß bis olivenfarbig) – Verbrennt manchmal<br />
Typ IV (braun) – Verbrennt selten<br />
Typ V (dunkelbraun) – Verbrennt sehr selten<br />
Typ VI (schwarz) – Verbrennt nie<br />
Quelle: www.emedicine.com<br />
Hautkrebs ist die am weitesten verbreitete Krebsart. Die Weltgesundheitsorganisation vermutet<br />
weltweit pro Jahr 2-3 Millionen gutartige und über 130.000 bösartige Hautkrebs-<br />
Neuerkrankungen. Australien hat mit durchschnittlich 750.000 Neufällen pro Jahr dabei die<br />
höchste Hautkrebsanfallrate der Welt. Die australische Regierung gibt jedes Jahr Millionen an<br />
Dollar aus, um das öffentliche Bewusstsein gegenüber der zerstörerischen Natur von UV-<br />
Strahlung zu steigern und der Markt für Sonnenschutzprodukte (Sonnencremes, Sun Blocker,<br />
usw.) prosperiert entsprechend. In den USA sind beispielsweise die Verkäufe von<br />
Sonnenschutzprodukten im Zeitraum von 1997 bis 2000 um 36% gestiegen und haben dabei ein<br />
Volumen von USD 547 Mio. erreicht (Quelle: www.marketresearch.com). In Australien betrug der<br />
Umsatz in 2002 ungefähr AUD 26 Mio. und Marktforschungsergebnisse zeigen, dass sich der<br />
Europäische Markt für Sonnenschutzprodukte 1996 auf USD 1,4 Mrd. belaufen hat.<br />
PharmaVentures schätzt den Markt für prophylaktische Verwendungen auf einen<br />
Jahresumsatz von ca. USD 1 Mrd.<br />
Der therapeutische Markt zielt auf Personen mit lichtbedingten Hauterkrankungen wie z.B.<br />
polymorphes Lichtexanthem (PMLE), Schuppenflechte, Rosazea (Form der Akne), Licht-Utikaria<br />
oder Nesselausschlag, Porphyrie (i.e. Enzymdefekt), Vitiligo (Weißfleckenkrankheit infolge<br />
Pigmentmangels) sowie den Albinismus. PharmaVentures hat dabei unterstellt, dass das feste,<br />
injezierbare, den Wirkstoff langsam abgebende Implantat als Produkt der ersten Generation<br />
sowohl für den therapeutischen, den prophylaktischen als auch den kosmetischen Markt<br />
Verwendung findet.<br />
6
PharmaVentures schätzt den Markt für therapeutische Verwendungen auf einen<br />
Jahresumsatz von mehr als USD 500 Mio.<br />
Der Markt für die kosmetische Verwendung besteht aus Personen, die - ohne besondere<br />
Gesundheitsgründe - einfach nur gut aussehen möchten und dazu etwa Sonnenstudios und<br />
Solarien besuchen. Der Markt für Sonnenstudios in den USA alleine wird auf USD 2 Mrd. pro<br />
Jahr geschätzt; hinzukommen mehr als USD 100 Millionen, die für Selbstbräunungsprodukte<br />
ausgegeben werden. <strong>EpiTan</strong>s primäres Ziel ist es, ein verschreibungspflichtiges Arzneimittel zu<br />
entwickeln, um Hauterkrankungen vorzubeugen. Damit gerät das Unternehmen jedoch auch<br />
unweigerlich in einen Anwendungsbereich hinein, den man als „sonnenfreies“ Bräunen<br />
bezeichnen könnte. Entsprechend sollte die Verwendung von Melanotan letztlich den Besuch<br />
von Sonnenstudios bzw. die Notwendigkeit zum Sonnenbaden generell reduzieren und damit<br />
zugleich auch die Auswirkungen schädlicher UV-Strahlung.<br />
PharmaVentures schätzt den Markt für kosmetische Verwendungen auf einen<br />
Jahresumsatz von mehr als USD 3,7 Mrd.<br />
Ausser dem kosmetischen Markt, hat PharmaVentures auch einen potenziellen so genannten<br />
„latenten“ Markt identifiziert. Dies beschreibt Menschen, die bisher überhaupt keine<br />
künstlichen Bräunungsmethoden anwenden. Melanotan stellt aber einen neuen Weg des<br />
Sichwohlfühlens und Besseraussehens dar. Verschreibungspflichtige Produkte wie Botox (zur<br />
Glättung von Gesichtsfalten) oder Viagra (zur Behandlung von Erektionsstörungen) haben bereits<br />
Millionen von Menschen zu einer besseren Lebensqualität verholfen. Aufgrund dieser neu<br />
geschaffenen Märkte hält es PharmaVentures für möglich, dass sich Melanotan einem USD 7<br />
Mrd. Potenzial gegenüber sieht.<br />
Schutzrechte<br />
Quelle: <strong>EpiTan</strong>, MIDAS Research<br />
<strong>EpiTan</strong> besitzt derzeit 34 zuerkannte Patente und hat aktuell Patentschutz für weitere<br />
Techniken angemeldet, die in Zusammenhang mit den neuen Darreichungsformen entstehen:<br />
Implantat zur langsamen Wirkstoffabgabe, Lotionen, Pflaster, etc. Diese Patente sollen einen<br />
Marktschutz bis über das Jahr 2020 hinaus gewährleisten.<br />
7
Die originären Patente der Universität von Arizona laufen allerdings bereits 2008 aus, während<br />
die Markteinführung von Melanotan erst in 2006 bzw. 2007 erfolgen dürfte. Laut<br />
Rechtsvorschriften (Hatch-Waxman Gesetz von 1984) genießen <strong>EpiTan</strong> (bzw. seine Partner)<br />
jedoch in den USA für weitere 5 Jahre nach Markteinführung kommerzielle Exklusivität.<br />
Ebenso besteht Exklusivität für Melanotan auch in Europa bis zu 8 Jahre nach<br />
Produkteinführung.<br />
Quelle: <strong>EpiTan</strong>, MIDAS Research<br />
Wir konnten bis lang keine Konkurrenzprodukte für Melanotan (im Umfeld<br />
verschreibungspflichtiger Arzneimittel) ermitteln. Nach unserem (und <strong>EpiTan</strong>s) Wissen gibt es<br />
auch keine Produkte für diese Indikation in klinischer Entwicklung. Bestenfalls sind<br />
Sonnenstudios und Solarien als Konkurrenz zu nennen. Selbst wenn ab sofort ein<br />
verschreibungspflichtiges Arzneimittel klinisch entwickelt würde, dauerte es mindestens 8 Jahre<br />
bis zur Marktreife. Melanotan - und folglich <strong>EpiTan</strong> - bleiben somit dem Wettbewerb weit<br />
voraus.<br />
Ausserdem besitzt <strong>EpiTan</strong> Patente an mehreren hundert von mit dem alpha-MSH Molekül<br />
strukturverwandten Stoffen (so genannte Analogstoffe, d.h. Stoffe mit einer dem natürlich<br />
vorkommenden Hormon vergleichbaren chemischen Struktur) für die Melanogenese, i.e. der<br />
Prozess der Melaninproduktion. Diese Analogstoffe waren ursprünglich an der Universität von<br />
Arizona synthetisiert worden.<br />
Sonstige Produkte<br />
Im Juli 2004 verkündete <strong>EpiTan</strong> den Erwerb von drei Produkten als Teil der Strategie, sich auf<br />
verschreibungspflichtige, dermatologische Produkte zu spezialisieren.<br />
Linotar (Ekzeme) und Exorex (Schuppenflechte) wurden von der Transdermal <strong>Pharmaceuticals</strong><br />
Australia Pty. <strong>Ltd</strong>. erworben. Beide Präparate werden zurzeit auf dem australischen Markt<br />
verkauft und generieren Umsätze von ca. AUD 0,5 Mio. Bei Exorex erwartet <strong>EpiTan</strong> zudem die<br />
Nachricht über die Aufnahme in das so genannte „Pharmaceutical Benefits Scheme“ – eine Art<br />
Leistungsverzeichnis des australischen Gesundheitswesens -, was die Umsätze weiter ankurbeln<br />
würde.<br />
8
Eine (nicht genannte) südafrikanische Firma besitzt die Schutzrechte an beiden Produkten.<br />
<strong>EpiTan</strong> ist gegenwärtig damit befasst, den Vertrag insbesondere hinsichtlich der<br />
Lieferbedingungen zu finalisieren. Deshalb kann sich das Unternehmen auch noch keine Umsätze<br />
mit diesen beiden Produkten zurechnen. Wir erwarten bis Ende 2004 weitere Informationen zu<br />
dem Geschäft. Ein ausgegliedertes Verkaufsteam für beide Produkte steht schon bereit, so dass<br />
<strong>EpiTan</strong> nicht viel Geld in die Schulung entsprechenden Personals wird investieren müssen.<br />
Die Lizenz für ein drittes Produkt, Zindaclin (Akne), wurde von Strakan <strong>Pharmaceuticals</strong> (UK)<br />
erworben, finanzielle Details wurden nicht bekannt. Zindaclin wartet auf die Zulassung durch die<br />
TGA (Therapeutic Goods Administration, i.e. Ministerium für Therapeutische Produkte) in<br />
Australien.<br />
Alle drei Produkte sollen zunächst nur in Australien und Neuseeland vermarktet werden bei<br />
einer Umsatzerwartung von AUD 3 Mio. für den Zeitraum 2005/2006.<br />
<strong>EpiTan</strong> gab auf der Hauptversammlung am 1. Oktober 2004 ferner bekannt, dass das<br />
Management aktiv nach weiteren dermatologischen Produkten Ausschau hält, für die<br />
Einlizensierungsmöglichkeiten bestehen, insbesondere zur Behandlung von Schuppenflechte,<br />
Akne und Hautkrebs. Weitere Details wurden nicht bekannt, wir gehen aber von laufenden<br />
Gesprächen mit Unternehmen in Großbritannien und den USA aus. Von Interesse ist dabei aus<br />
unserer Sicht insbesondere die Frage, ob diese Produkte bereits am Markt sind, und wir erwarten<br />
mit Interesse weitere Informationen zu diesem Komplex. Gegenwärtig gehen wir davon aus, dass<br />
<strong>EpiTan</strong> bis zum Ende des laufenden Geschäftsjahres wenigstens über sechs dermatologische<br />
Produkte verfügen dürfte einschließlich der drei hier genannten.<br />
Aktionärsstruktur und Finanzdaten<br />
<strong>EpiTan</strong> schätzt die Kosten für die verbleibenden klinischen Tests (weltweit) sowie die<br />
Marketing- und Vertriebsaufwendungen für Melanotan (Australien und Neuseeland) auf<br />
ungefähr AUD 35 Mio. und erwartet eine Finanzierung dieses Betrages von dem zukünftigen<br />
Entwicklungspartner. Ein Vorteil für das Unternehmen sind sicherlich die erheblich geringeren<br />
Kosten der klinischen Entwicklung von Melanotan im Vergleich zu typischen therapeutischen<br />
Produkten, da die Studiendauer geringer ist und es sich bei den Patienten um gesunde Freiwillige<br />
handelt, zumindest bei den Studien zu Verletzungen durch Sonnenbrand.<br />
Bezüglich der PMLE Indikation deutet die hohe Patientenanzahl – über 100 Mio. Menschen<br />
leiden weltweit an der Krankheit – ebenfalls auf einen relativ einfachen Rekrutierungsprozess für<br />
die nächste Phase-II-Studie (Europa).<br />
In 2003 hat sich <strong>EpiTan</strong> bereits erfolgreich AUD 8.9 Mio. an Eigenmitteln beschafft, sowie<br />
weitere AUD 8 Mio. im August 2004. <strong>EpiTan</strong>s aktuelle Liquidität beläuft sich damit auf AUD<br />
10,9 Mio. Für das laufende Fiskaljahr ist folgende Verwendung dieser Mittel zu erwarten:<br />
Laufende Kosten des Geschäftsbetriebs von ungefähr AUD 1,5 Mio.<br />
AUD 7 Mio. an Kosten für die Weiterentwicklung von Melanotan<br />
Ausgaben von ungefähr AUD 0,5 Mio. für die neu erworbenen Produkte<br />
<strong>EpiTan</strong> erzielt bis dato noch keinerlei Umsätze aus Produktverkäufen, andererseits ist der<br />
laufende Liquiditätsverbrauch mit AUD 0,5 pro Monat auch relativ gering.<br />
9
Am Grundkapital von <strong>EpiTan</strong>, eingeteilt in 125.699.085 Stammaktien, sind u.a. folgende<br />
Großaktionäre beteiligt (per 30. September 2004):<br />
Weighton Pty.(Wayne Millen, CEO von <strong>EpiTan</strong>): 14,2%<br />
Melanotan Corporation Inc.: 12,1%<br />
FM Fund Management (Absolute Return Europe Fund): 7,1%<br />
Wie am 15.10.2004 bekannt wurde, hat sich der Anteil der Melanotan Corp. Inc. inzwischen<br />
durch Umschichtungen innerhalb des Aktionärskreises auf 2,5% reduziert, ohne dass dies jedoch<br />
auf absehbare Zeit einen Einfluss auf die Streubesitzquote hat.<br />
Im Juli hat <strong>EpiTan</strong> ein Level One American Depositary Receipt (ADR) Programm lanciert, mit<br />
der Bank of New York als Depotbank. Jedes ADR entspricht dabei 10 <strong>EpiTan</strong> Stammaktien, wie<br />
sie an der ASX (Australian Stock Exchange, i.e. die Australische Börse) gehandelt werden.<br />
Seit 1. September 2004 notiert <strong>EpiTan</strong> auch an der Frankfurter Börse sowie auf Xetra.<br />
Bewertung und Börsenbeurteilung<br />
Auf Grundlage der Zahlen der PharmaVentures Studie, beauftragt von <strong>EpiTan</strong>, haben wir eine<br />
Bewertung (als Kapitalwert bzw. Net Present Value NPV) für Melanotan unter<br />
Berücksichtigung der verschiedenen Märkte (nämlich therapeutische, prophylaktische sowie<br />
kosmetische Verwendung) sowie eine Bewertung für die <strong>EpiTan</strong>-Aktie insgesamt als<br />
Discounted Cashflow Analyse abgeleitet. Außerdem haben wir das Potenzial des Produktes<br />
separat für den australischen und neuseeländischen (ANZ) Markt ermittelt, da <strong>EpiTan</strong> in dieser<br />
Region Melanotan allein vermarkten und verkaufen wird und dadurch separate Kosten zu tragen<br />
hat.<br />
Die nachfolgende Tabelle fasst unsere Annahmen und Ergebnisse der Kapitalwertanalyse für<br />
Melanotan zusammen. Wahrscheinlich die wichtigste Annahme unserer Bewertung ist die<br />
Tatsache, dass das Arzneimittel überhaupt klinische Phase-III-Studien aufnehmen und in den<br />
USA, Europa und Australien/Neuseeland auch am Markt eingeführt werden wird. In gleicher<br />
Weise wichtig ist unsere Unterstellung, dass sich das Unternehmen einen Pharmapartner sichern<br />
kann, der die restliche klinische Forschung sowie die mit Markteinführung, Marketing und<br />
Vertrieb von Melanotan in den USA und in Europa verbundenen Kosten finanziert. Unsere<br />
Bewertung beschränkt sich ferner auf das Produkt der ersten Generation, also die feste,<br />
injezierbare Darreichungsform mit langfristiger Wirkstoffabgabe, so wie sie in den aktuellen<br />
klinischen Tests gerade evaluiert wird. Als Umsatzbeteiligung haben wir mit 15 Prozent einen<br />
branchenüblichen Durchschnittssatz angenommen. Hinsichtlich des Marktanteils bleiben wir<br />
mit maximal 15 Prozent konservativ – in welchem Maße es Melanotan schaffen wird, den<br />
Markt zu durchdringen, sollte nämlich größtenteils von dem Vertriebs- und Verkaufsteam des<br />
Pharmapartners abhängen. Nach der entsprechenden Bekanntgabe können wir unsere<br />
Einschätzung in Abhängigkeit von der Marktposition des Partners dann immer noch anpassen.<br />
Einen baldigen Beginn von Phase-III-Studien unterstellt kalkulieren wir schließlich mit einer<br />
Wahrscheinlichkeit von 65 Prozent, dass das Produkt die klinische Erprobung besteht<br />
und 2007 am Markt eingeführt wird.<br />
10
Unsere Erörterungen mit dem Management in Kombination mit unseren Analysen haben uns zu<br />
der Verkaufspreisstruktur geführt wie in der Tabelle unten wiedergegeben. Es mag<br />
eingewendet werden, dass Kosten von USD 250 pro Behandlung pro Jahr zu hoch angesetzt<br />
sind – uns erscheint dies vor dem Hintergrund anderer, verschreibungspflichtiger<br />
dermatologischer Medikamente und dem Preis von „Life Style“ Produkten wie Botox jedoch<br />
realistisch. Da es keine direkt vergleichbaren Produkte am Markt gibt, ist eine exakte<br />
Preisannahme natürlich schwierig – selbst PharmaVentures wollte sich auf keine Zahl festlegen.<br />
Auch in diesem Punkt sollten wir aber mehr Klarheit gewinnen, sobald ein Partner an Bord ist.<br />
U.E. dürfte <strong>EpiTan</strong> bis zu USD 20 Mio. an Voraus- und Meilensteinzahlungen (z.B. für Phase III,<br />
Genehmigung und Registrierung) zwischen 2005 und 2007, dem Jahr der Markteinführung,<br />
erhalten können. Diese Mittel bedeuteten einen signifikanten Schub für das Unternehmen und<br />
sollten insbesondere helfen, die Pläne zum Ausbau der Vertriebs- und Marketingbemühungen in<br />
Australien und Neuseeland (ANZ), wo das Medikament ja eigenständig vertrieben werden soll, zu<br />
finanzieren.<br />
Anfängliche<br />
Zielgröße an<br />
Patienten<br />
(weltweit, ohne<br />
ANZ)<br />
Marktanteil<br />
Kosten pro<br />
Behandlung<br />
Kapitalwert (NPV)<br />
MIN MAX und Jahr nach Steuern (30%) pro Aktie<br />
Angenommener<br />
(USD)<br />
Maximalumsatz AUD EUR<br />
Therapie (PMLE) 20.740.000 0,1% 10,0% 250 USD 623 Mio. (2010) 0,79 0,45<br />
Prophylaxe 44.350.000 1,0% 10,0% 200 USD 1.3 Mrd. (2012) 1,39 0,80<br />
Kosmetik 51.220.000 2,0% 15,0% 100 USD 997 Mio. (2011) 1,10 0,63<br />
Quelle: MIDAS Research<br />
3,28 1,89<br />
Unsere Schlussfolgerung lautet, dass der prophylaktische Markt mit einem Kapitalwert von<br />
EUR 0,80 pro Aktie (AUD 1,39) bei einem Verkaufspreis von ca. USD 200 (EUR 160) pro Patient<br />
und Jahr das größte kommerzielle Potenzial für Melanotan darstellt. Wie schon erläutert umfasst<br />
der prophylaktische Markt Personen, „die nicht leicht bräunen und folglich einem erhöhten<br />
Hautkrebsrisiko unterliegen“ (laut PharmaVentures). Der heutigen Gesellschaft wird zunehmend<br />
bewusst, dass die übermäßige Aussetzung gegenüber der UV-Strahlung eine der Hauptursachen<br />
von Hauterkrankungen und Hautkrebs ist. Allein in den USA hat der Umsatz von<br />
Sonnenschutzprodukten (inklusive Sonnencremes) USD 500 Mio. in 2000 erreicht. Klinische<br />
Untersuchungen konnten zeigen, dass Melanotan die Wirksamkeit besitzt, (durch UV-Strahlung<br />
verursachte) Schädigungen von Hautzellen um bis zu 50% zu reduzieren. Wesentlich für den<br />
prophylaktischen Markt sollte die Notwendigkeit zur Entwicklung einer äußerlichen<br />
Darreichungsmöglichkeit bleiben. Als Lotion, Gel oder Pflaster dürfte Melanotan ein noch<br />
größeres Marktpotenzial - auch für Kinder - besitzen.<br />
Auch dem therapeutischen Markt bei Patienten mit Hauterkrankungen oder -störungen im<br />
Zusammenhang mit UV-Strahlung messen wir einen, allerdings etwas geringeren, kommerziellen<br />
Wert zu. Für unsere Bewertung haben wir uns dabei auf PMLE (eine Sonnenallergie) gestützt, da<br />
<strong>EpiTan</strong> seine zukünftige klinische Forschung auf PMLE-Patienten aufbauen wird und Melanotan<br />
zunächst zur Behandlung von PMLE vermarktet werden dürfte. Für diese Indikation gehen wir<br />
von einem höheren Verkaufspreis für das Produkt von ca. USD 250 (EUR 200) pro Patient und<br />
Jahr aus. Der resultierende Kapitalwert von EUR 0,45 (AUD 0,79) pro Aktie zeigt den<br />
11
therapeutischen Wert von Melanotan, verglichen mit einem aktuellen Aktienkurs von EUR 0,52<br />
(AUD 0,89).<br />
Der Marktanteil für diese Indikation dürfte vermutlich anfänglich noch gering sein, da es<br />
zunächst verschiedene Hürden zu überwinden gilt und es insbesondere etwas Zeit brauchen<br />
sollte, bis sich die Menschen mit der Idee eines Implantats, was ja mit einem Arztbesuch<br />
verbunden ist, angefreundet haben. Vieles dürfte davon abhängen, inwieweit es gelingt, die<br />
Hautärzte, die ja die Behandlung durchführen und Melanotan empfehlen, zu überzeugen – und<br />
natürlich den Marketingbemühungen generell. Die Marktposition des Partners im Bereich<br />
Dermatologie wird auch in diesem Punkt eine kritische Rolle spielen.<br />
Der kosmetische Markt für Melanotan besteht aus Personen, die - ohne besondere<br />
Gesundheitsgründe – mit einem braunen Teint einfach nur gut aussehen möchten. Hier könnte<br />
die Patientenzahl allein schon aufgrund des Marktes für Solarien mit seinem Marktwert von über<br />
USD 2 Mrd. in den USA rasch in die Höhe schnellen. Die heutige Gesellschaft diktiert die<br />
Wichtigkeit zu einem gesünderen Lebensstil: sich gut zu fühlen genügt nicht, gut auszusehen ist<br />
genauso wichtig. U.E. hat <strong>EpiTan</strong> die Chance, die höchsten Umsätze in diesem Marktsegment zu<br />
erzielen, sofern das Produkt frei verkäuflich ist.<br />
Dies sollte sich insbesondere dann bewahrheiten, wenn die zweite Produktgeneration mit<br />
äußerlicher Anwendung als Lotion, Gel oder Pflaster auf den Markt kommt, denn solch ein<br />
Produkt wäre dann auch für Kinder oder Jugendliche attraktiv. Allerdings dauerte die<br />
Markteinführung hierfür länger als bei dem Implantat, weshalb wir uns im Folgenden auf das<br />
feste Implantat als Produkt auch für den kosmetischen Markt im Sinne einer konservativen<br />
Betrachtungsweise beschränkt haben. Hohe Markteintrittsbarrieren und damit eine geringe<br />
Marktdurchdringung unterstellt führen uns zu einem Kapitalwert von EUR 0,63 (AUD 1,10) pro<br />
Aktie bei Kosten von ca. USD 100 (EUR 80) pro Anwendung und Jahr. Wenn der Markt für Botox<br />
als Vergleichsmaßstab geeignet ist, sollte sich unsere Vorsicht aber als wohl übertrieben<br />
herausstellen.<br />
Innerhalb des kosmetischen Marktes hat PharmaVentures auch einen „latenten“ Markt<br />
identifiziert. Dieser beschreibt Menschen, die bisher überhaupt keine künstlichen<br />
Bräunungsmethoden anwenden, aber durchaus in der Folge feststellen könnten, dass auch sie in<br />
den Genuss der Vorzüge eines derartigen Produktes kommen könnten. Gleichwohl erachten wir<br />
es derzeit als wesentlich zu spekulativ, diesen Teilmarkt schon heute zu bewerten, und haben<br />
daher keinen Wertansatz vorgenommen.<br />
Da <strong>EpiTan</strong> beabsichtigt, Melanotan in Australien und Neuseeland selbst zu vermarkten und zu<br />
verkaufen, haben wir hierfür eine separate Bewertung aufgrund der Bevölkerungsstatistiken<br />
für diese Region und den nachfolgenden Annahmen ermittelt:<br />
eine höhere Marktdurchdringung, besonders auf dem Markt für präventive<br />
Anwendungen (bis zu 17% in 2010), da es sich um ein „einheimisches“ Produkt handelt<br />
Vertriebskosten in Höhe von 30% vom Umsatz<br />
Herstellungskosten von 5%<br />
10% vom Umsatz als Gebühr bzw. Anteil der Melanotan Corp. und weiterer Partner im<br />
Zusammenhang mit der Darreichungsform<br />
Markteinführungskosten von bis zu 20% der Umsatzerlöse im ersten Jahr, bzw. einen<br />
Betrag von ca. AUD 9 Mio.<br />
12
Im Ergebnis resultiert ein Kapitalwert von EUR 0,91 (AUD 1,57) nach Steuern für alle drei<br />
Teilmärkte (Prävention, Therapie, Kosmetik) für die ANZ-Region.<br />
Unser mittels DCF-Methode ermittelter Fairer Wert für die <strong>EpiTan</strong>-Gruppe als Ganzes<br />
basiert sich auf den gleichen Umsatzannahmen wie die obige Kapitalwertbestimmung nach<br />
Produktverwendung, also den Umsätzen aus allen drei Teilmärkten einschließlich solcher aus der<br />
ANZ-Region. Er berücksichtigt ferner den geringen Umsatzbeitrag der drei weiteren Produkte<br />
(Linotar, Exorex, Zindaclin), die gemeinschaftlich ab 2007 im Schnitt AUD 3-5 Mio. erwirtschaften<br />
sollten. Wie vom Management angedeutet hofft <strong>EpiTan</strong> bis zum Ende des laufenden Fiskaljahres<br />
über insgesamt sechs Produkte im Portfolio zu verfügen, die sämtlich entweder vor der<br />
Zulassung stehen oder aber bereits am Markt eingeführt sind. Weitere Informationen hierzu<br />
erwarten wir in den kommenden Wochen und haben zunächst nur die drei genannten Präparate<br />
in die Bewertung einbezogen. Der DCF-Ansatz berücksichtigt ferner allgemeine Aufwendungen<br />
auf Gruppenebene, die in die Kapitalwertermittlung auf Produktbasis nicht eingerechnet<br />
worden sind.<br />
Das DCF-Modell zeigt einen Fairen Wert von EUR 2,13 bzw. AUD 3,63 pro Aktie. Dieser Wert<br />
ist vergleichbar mit dem ersten Bewertungsansatz, der Summe der Kapitalwerte nach<br />
Produktverwendung in Höhe von EUR 1,89 oder AUD 3,29 – ohne ANZ-Region – bzw. EUR 2,79<br />
oder AUD 4,85 einschließlich der Erlöse in der ANZ-Region.<br />
Bedenkt man, dass all diese Projektionen und Schätzungen fast vollständig davon abhängen,<br />
dass <strong>EpiTan</strong> sich in den nächsten sechs Monaten einen Partner sichert, ist die Aktie u.E. in der<br />
Tat sehr spekulativ. Gleichzeitig erscheint jedoch das Potenzial exzellent, sobald ein Partner<br />
bekannt wird. Somit stellt der aktuelle Kurs von EUR 0,52 bzw. AUD 0,89 eine klare<br />
Kaufgelegenheit dar, da die Aktie aufgrund der vom Management in den Raum gestellten, zu<br />
erwartenden Unternehmensmeldungen (u.a. Partnervereinbarung, Phase-III-Studien, weitere<br />
Darreichungsformen) in den nächsten sechs bis zwölf Monaten signifikante Kursgewinne erzielen<br />
sollte. Schließlich erachten wir es in Anbetracht des Kurses von EUR 0,52 als vertretbar – und<br />
lohnend -, ein überschaubares Risiko einzugehen.<br />
Wir nehmen die Analyse von <strong>EpiTan</strong> mit einer „Spekulativ Kaufen“ Empfehlung auf. Unser<br />
anfängliches Kursziel setzen wir bei EUR 2,00 bzw. AUD 3,50 je Aktie, nahe des<br />
Durchschnitts aus den Ergebnissen der beiden dargestellten Bewertungsvarianten.<br />
13
Aktienflash<br />
Zusammenfassung der klinischen Studien<br />
Klinische Phase<br />
Phase I/II<br />
Pharmakokinese<br />
Beginn/Ende<br />
beendet Nov./Dez. 2001<br />
Ort der Studie<br />
Royal Adelaide Hospital<br />
Phase II<br />
beendet Q3/2003<br />
Sonnenbrand<br />
Studie<br />
Royal Prince Alfred<br />
Hospital (Sydney),<br />
Royal Adelaide Hospital<br />
Phase Ib<br />
Implantat,<br />
Dosierung<br />
Phase II<br />
Genotypus<br />
Studie<br />
Beginn Nov. 2003<br />
Wiederaufnahme Juni<br />
2004 mit einer Reihe<br />
kleinerer Implantate<br />
Ergebnisse Q4/2004e<br />
Beginn Ende 2004e<br />
Q-Pharm Einrichtungen,<br />
Clive Berghofer Cancer<br />
Research Centre, Royal<br />
Brisbane Hospital<br />
Queensland Institute of<br />
Medical Research (QIMR)<br />
Phase II<br />
PMLE Studie<br />
Beginn Ende 2004e Deutschland, UK<br />
(Europäischer Winter)<br />
Phase III<br />
Beginn Mitte 2005e<br />
Verletzungen<br />
durch<br />
Sonnenbrand<br />
Global (Australien, USA,<br />
Europa)<br />
Patienten/Behandlungsweise<br />
12 gesunde Freiwillige;<br />
Subkutane Injektionen an 10<br />
aufeinander folgenden Tagen;<br />
61 mit Melanotan behandelt,<br />
20 mit Placebo;<br />
Subkutane Injektionen; Behandlung<br />
an 3 X 10 Tagen<br />
über 3 Monate;<br />
Injektion des Implantats mit<br />
langsamer Wirkstoffabgabe<br />
unter der Haut;<br />
6 Patienten erhielten das Implantat<br />
im Nov. 2003<br />
Kaukasische Hauttypen mit<br />
genetischer Disposition für<br />
Sonnenbrand, Hautkrebs,<br />
Sonnenallergie der Haut<br />
Patienten mit Polymorphem<br />
Lichtexanthem (PMLE);<br />
Behandlung mit dem Implantat<br />
zur langsamen Wirkstoffabgabe;<br />
1.000-2.000 gesunde Personen<br />
Ziel<br />
Sicherheits- und<br />
Verträglichkeitsprofil<br />
Wirksamkeit zur Anregung von<br />
Bräunung bei reduzierter Schädigung<br />
der Hautzellen nach<br />
kontrollierter UV-Bestrahlung<br />
Optimale Dosierung, Sicherheit,<br />
Verträglichkeit, Wirksamkeit<br />
des Implantats<br />
Ermittlung der Sicherheit und<br />
des Bräunungsgrades bei diesen<br />
genetisch prädisponierten Probanden<br />
Ziel: Reduzierung der Symptome<br />
(Sonnenbrand, Ausschlag, Bläschen,<br />
Flecken);<br />
Messung der Melaninzunahme<br />
Wirksamkeit zur Anregung der<br />
Melaninproduktion bei reduzierter<br />
Schädigung der Hautzellen<br />
nach kontrollierter UV-<br />
Bestrahlung<br />
Beschreibung der Studie<br />
Schnelle Absorptionsrate, kurze<br />
Halbwertszeit, erhöhter Melaninspiegel<br />
in der Haut; sicher und keine<br />
erkennbaren Nebenwirkungen<br />
Signifikante Zunahme an Melanin;<br />
Melanin-Dichte um 100% erhöht bei<br />
weißhäutigen Patienten;<br />
Hautzellenschädigungen nach kontrollierter<br />
UV-Bestrahlung um 50%<br />
verringert;<br />
Erhöhter Melaninspiegel in der Haut<br />
hervorgerufen durch eine andere<br />
Wirkungsweise als durch Schädigungen<br />
der Zellen mit UV-Bestrahlung<br />
Ergebnisse im Feb. 2004 zeigten geringeren<br />
Melanotan-Bedarf beim<br />
Implantat;<br />
Neue Reihe mit weniger Wirkstoff<br />
und kleineren Implantat aufgesetzt;<br />
Gewinnung von Proben zwecks Erkennung<br />
von Defekten an den Melanin-Rezeptoren<br />
PMLE betrifft 10-20% der Bevölkerung<br />
in den nördlichen Breitengraden;<br />
Feststellung der Individuen mit<br />
dem höchsten Nutzen durch die Verwendung<br />
von Melanotan;<br />
<strong>EpiTan</strong> sucht Partner zur Kostenteilung,<br />
Mitentwicklung, Marketing<br />
und Vertrieb von Melanotan; Markteinführung<br />
für Ende 2006 / Anfang<br />
2007 angestrebt;
Wechselkurse per 07.10.2004 (Datum der englischsprachigen Originalfassung)<br />
1 AUD = 0.7267 USD = 0.5915 EUR<br />
Quellen:<br />
<strong>EpiTan</strong> Limited<br />
MIDAS Research GmbH<br />
www.reuters.com<br />
www.maxblue.de<br />
www.marketresearch.com<br />
www.yahoo.com.au<br />
www.bigcharts.com<br />
www.emedicine.com<br />
MIDAS Research Abo<br />
Möchten Sie unsere Analysen auch direkt per Email erhalten, registrieren Sie sich bitte auf unserer Web<br />
Site http://www.midasresearch.de unter „RESEARCH ABO“<br />
Haftungsausschluss / Disclaimer<br />
This report is not suited for any individuals resident in any jurisdiction in which access to such reports is regulated by<br />
applicable laws. No investment decision must be based on any aspect of, or statement in, this report. If you are<br />
uncertain if this might apply in your case you should not access and consider this report.<br />
Die vorliegende Publikation wurde von der MIDAS Research GmbH erstellt. Sie stellt lediglich eine unverbindliche Einschätzung der Entwicklung<br />
an den Kapitalmärkten sowie von börsennotierten Gesellschaften dar und gibt Auskunft über die Zusammensetzung bzw. Veränderung des von<br />
der MIDAS Research GmbH zusammengestellten Musterportfolios. Zweck der Publikation ist die Bereitstellung von Informationen zur<br />
persönlichen Meinungsbildung. Sie ist keine Anlageberatung oder Aufforderung zum Abschluss bestimmter Börsengeschäfte und kann auch keine<br />
Anlageberatung ersetzen. Jeder Leser bleibt aufgefordert, sich zwecks Erörterung eines möglichen Kaufs oder Verkaufs eines oder mehrerer der<br />
nachstehend beschriebenen Wertpapiere vor einer solchen Maßnahme seinen Anlageberater zu konsultieren. Die dieser Publikation zugrunde<br />
liegenden Daten und Fakten sind keiner eigenständigen Prüfung durch die MIDAS Research GmbH unterzogen worden und die MIDAS Research<br />
GmbH übernimmt trotz sorgfältiger Analyse keinerlei Haftung für den Inhalt dieser Publikation. Sofern in der Publikation zukunftsgerichtete<br />
Aussagen insbesondere zur Kursentwicklung von Wertpapieren oder Geschäftsentwicklung von Unternehmen getroffen werden, handelt es sich<br />
um Prognosen. Die Eintrittswahrscheinlichkeit der prognostizierten Umstände unterliegt erheblichen Risiken und kann in keiner Weise<br />
zugesichert werden. Die in der Publikation geäußerten Einschätzungen sowie Angaben zum Musterportfolio der MIDAS Research GmbH haben<br />
nur Gültigkeit für den Zeitpunkt des auf der Publikation vermerkten Redaktionsschlusses und können sich jederzeit ohne vorherige Ankündigung<br />
ändern oder geändert haben.<br />
Die MIDAS Research GmbH nimmt keine Eigengeschäfte in Aktien oder darauf begebenen Derivaten der in dieser Publikation besprochenen<br />
Gesellschaften vor. Dies gilt auch für die Autoren und sonstige mit der MIDAS Research GmbH verbundene Personen, sofern sie mit dem Inhalt<br />
der Publikation vertraut sind oder aufgrund ihrer Tätigkeit für die MIDAS Research GmbH hätten vertraut sein können, jedoch ist eine Haftung<br />
hierfür seitens der MIDAS Research GmbH ausgeschlossen.<br />
Sofern die MIDAS Research GmbH mit in dieser Publikation besprochenen Gesellschaften Research-Betreuungsmandate oder sonstige<br />
Dienstleistungsverträge direkt oder indirekt unterhält oder innerhalb der letzten fünf Kalenderjahre direkt oder indirekt unterhalten hat, werden<br />
diese Gesellschaften nachfolgend angezeigt: <strong>EpiTan</strong> <strong>Ltd</strong>.<br />
Jede Reproduktion, Veränderung oder Verwendung dieser Publikation ohne vorherige schriftliche Zustimmung der MIDAS Research GmbH ist<br />
unzulässig.<br />
EMAIL: info@midas-research.de INTERNET: http://www.midasresearch.de KONTAKT: Simone Drepper (verantw.) +49(0)621/430 613 0<br />
15