1. Kurshalbjahr – Energetik und Gleichgewichtsreaktionen in Natur ...
1. Kurshalbjahr – Energetik und Gleichgewichtsreaktionen in Natur ...
1. Kurshalbjahr – Energetik und Gleichgewichtsreaktionen in Natur ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
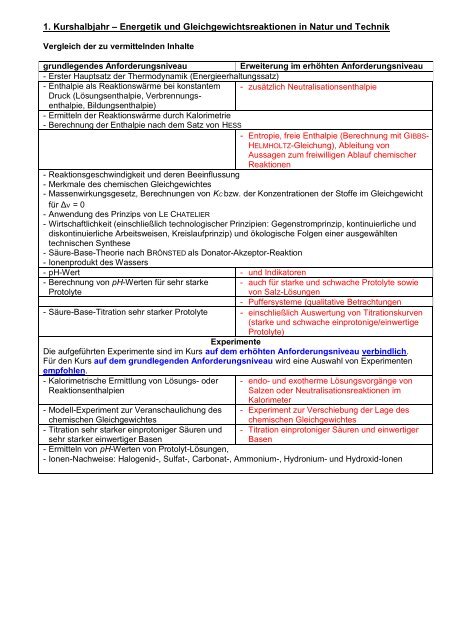
<strong>1.</strong> <strong>Kurshalbjahr</strong> <strong>–</strong> <strong>Energetik</strong> <strong>und</strong> <strong>Gleichgewichtsreaktionen</strong> <strong>in</strong> <strong>Natur</strong> <strong>und</strong> Technik<br />
Vergleich der zu vermittelnden Inhalte<br />
gr<strong>und</strong>legendes Anforderungsniveau Erweiterung im erhöhten Anforderungsniveau<br />
- Erster Hauptsatz der Thermodynamik (Energieerhaltungssatz)<br />
- Enthalpie als Reaktionswärme bei konstantem - zusätzlich Neutralisationsenthalpie<br />
Druck (Lösungsenthalpie, Verbrennungsenthalpie,<br />
Bildungsenthalpie)<br />
- Ermitteln der Reaktionswärme durch Kalorimetrie<br />
- Berechnung der Enthalpie nach dem Satz von HESS<br />
- Entropie, freie Enthalpie (Berechnung mit GIBBS-<br />
HELMHOLTZ-Gleichung), Ableitung von<br />
Aussagen zum freiwilligen Ablauf chemischer<br />
Reaktionen<br />
- Reaktionsgeschw<strong>in</strong>digkeit <strong>und</strong> deren Bee<strong>in</strong>flussung<br />
- Merkmale des chemischen Gleichgewichtes<br />
- Massenwirkungsgesetz, Berechnungen von KC bzw. der Konzentrationen der Stoffe im Gleichgewicht<br />
für Δν = 0<br />
- Anwendung des Pr<strong>in</strong>zips von LE CHATELIER<br />
- Wirtschaftlichkeit (e<strong>in</strong>schließlich technologischer Pr<strong>in</strong>zipien: Gegenstrompr<strong>in</strong>zip, kont<strong>in</strong>uierliche <strong>und</strong><br />
diskont<strong>in</strong>uierliche Arbeitsweisen, Kreislaufpr<strong>in</strong>zip) <strong>und</strong> ökologische Folgen e<strong>in</strong>er ausgewählten<br />
technischen Synthese<br />
- Säure-Base-Theorie nach BRÖNSTED als Donator-Akzeptor-Reaktion<br />
- Ionenprodukt des Wassers<br />
- pH-Wert - <strong>und</strong> Indikatoren<br />
- Berechnung von pH-Werten für sehr starke - auch für starke <strong>und</strong> schwache Protolyte sowie<br />
Protolyte<br />
von Salz-Lösungen<br />
- Puffersysteme (qualitative Betrachtungen<br />
- Säure-Base-Titration sehr starker Protolyte - e<strong>in</strong>schließlich Auswertung von Titrationskurven<br />
(starke <strong>und</strong> schwache e<strong>in</strong>protonige/e<strong>in</strong>wertige<br />
Protolyte)<br />
Experimente<br />
Die aufgeführten Experimente s<strong>in</strong>d im Kurs auf dem erhöhten Anforderungsniveau verb<strong>in</strong>dlich.<br />
Für den Kurs auf dem gr<strong>und</strong>legenden Anforderungsniveau wird e<strong>in</strong>e Auswahl von Experimenten<br />
empfohlen.<br />
- Kalorimetrische Ermittlung von Lösungs- oder - endo- <strong>und</strong> exotherme Lösungsvorgänge von<br />
Reaktionsenthalpien<br />
Salzen oder Neutralisationsreaktionen im<br />
Kalorimeter<br />
- Modell-Experiment zur Veranschaulichung des - Experiment zur Verschiebung der Lage des<br />
chemischen Gleichgewichtes<br />
chemischen Gleichgewichtes<br />
- Titration sehr starker e<strong>in</strong>protoniger Säuren <strong>und</strong> - Titration e<strong>in</strong>protoniger Säuren <strong>und</strong> e<strong>in</strong>wertiger<br />
sehr starker e<strong>in</strong>wertiger Basen<br />
Basen<br />
- Ermitteln von pH-Werten von Protolyt-Lösungen,<br />
- Ionen-Nachweise: Halogenid-, Sulfat-, Carbonat-, Ammonium-, Hydronium- <strong>und</strong> Hydroxid-Ionen
Vergleich der zu vermittelnden Kompetenzen<br />
S. 19 im RLP: "Die Beiträge zur Kompetenzentwicklung <strong>in</strong> den nachfolgenden Übersichten zeigen<br />
allgeme<strong>in</strong> auf, <strong>in</strong> welcher Tiefe die verb<strong>in</strong>dlichen Inhalte zu behandeln s<strong>in</strong>d."<br />
Leider s<strong>in</strong>d hier die zu vermittelnden Kompetenzen nicht so gut aufe<strong>in</strong>ander abgestimmt wie die zu<br />
vermittelnden Inhalte. E<strong>in</strong> Aufbau bzw. e<strong>in</strong>e Vertiefung vom gr<strong>und</strong>legenden zum erhöhten Anforderungsniveau<br />
(wie auf S. 15 bzw. 33 im RLP dargestellt) ist nicht erkennbar.<br />
Beispiele:<br />
Zu vermittelnder Inhalt: "Berechnung der Enthalpie nach dem Satz von HESS"<br />
Aber nur im erhöhten Anforderungsniveau steht: "berechnen Reaktionsenthalpien unter Anwendung des<br />
Satzes von HESS" Im gr<strong>und</strong>legenden Anforderungsniveau brauchen die SuS diese Kompetenz nicht<br />
auszubilden?<br />
Im gr<strong>und</strong>legenden Anforderungsniveau sollen die SuS "die Bee<strong>in</strong>flussbarkeit chemischer Gleichgewichte<br />
erklären". Im erhöhten Anforderungsniveau sollen die SuS "Voraussagen formulieren über die Änderung<br />
der Gleichgewichtslage".<br />
Hier kommt dem schul<strong>in</strong>ternen Plan besondere Bedeutung zu.<br />
gr<strong>und</strong>legendes Anforderungsniveau erhöhtes Anforderungsniveau<br />
Die Schüler<strong>in</strong>nen <strong>und</strong> Schüler<br />
- beschreiben <strong>und</strong> erläutern Phänomene der - erklären makroskopische Ersche<strong>in</strong>ungen der<br />
Stoff- <strong>und</strong> Energieumwandlung bei chemischen chemischen Reaktion mithilfe der sub-<br />
Reaktionen <strong>und</strong> erklären diese Phänomene auf mikroskopischen Betrachtungsweise (Merkmale<br />
der Gr<strong>und</strong>lage von Teilchen- <strong>und</strong><br />
e<strong>in</strong>er chemischen Reaktion)<br />
B<strong>in</strong>dungsmodellen<br />
- wenden den Ersten Hauptsatz der<br />
- beurteilen chemische Reaktionen energetisch<br />
Thermodynamik auf chemische Reaktionen an unter Nutzung des Ersten Hauptsatzes der<br />
<strong>und</strong> bestimmen Reaktionswärmen<br />
Thermodynamik<br />
experimentell <strong>und</strong> mathematisch,<br />
- bewerten die Bedeutung energetischer - def<strong>in</strong>ieren Enthalpie als Reaktionswärme bei<br />
Betrachtungen chemischer Reaktionen z. B. konstantem Druck,<br />
anhand der Heizwerte von Energieträgern <strong>und</strong> - unterscheiden Enthalpiearten (Reaktions-,<br />
der Brennwerte von Lebensmitteln<br />
Bildungs-, Verbrennungs- <strong>und</strong> Lösungsenthalpie)<br />
sowie molarer <strong>und</strong> nichtmolarer<br />
Größen<br />
- wenden die Kalorimetrie als Methode zur<br />
Bestimmung von Reaktionsenthalpien an,<br />
- berechnen Reaktionsenthalpien unter<br />
Anwendung des Satzes von HESS,<br />
- berechnen Reaktionsentropien <strong>und</strong> leiten<br />
Aussagen aus den Werten ab,<br />
- leiten Voraussagen über den freiwilligen<br />
Verlauf chemischer Reaktionen ab <strong>und</strong><br />
bestimmen den Wahrheitsgehalt dieser<br />
Aussagen mittels der GIBBS-HELMHOLTZ-<br />
Gleichung,<br />
- begründen die E<strong>in</strong>flüsse verschiedener<br />
Faktoren auf die Geschw<strong>in</strong>digkeit chemischer<br />
Reaktionen,<br />
- beschreiben Gleichgewichtszustände<br />
- erläutern die Merkmale des chemischen<br />
chemischer Reaktionen <strong>und</strong> erklären die<br />
Gleichgewichtes<br />
Bee<strong>in</strong>flussbarkeit chemischer Gleichgewichte - berechnen Kc bzw. die Konzentrationen der<br />
- formulieren mithilfe des Massenwirkungs- Stoffe im Gleichgewicht für Δν = 0 <strong>und</strong> nutzen<br />
gesetzes (MWG) quantitative Aussagen zur das Massenwirkungsgesetz unter anderem zur<br />
Lage von <strong>Gleichgewichtsreaktionen</strong>,<br />
Diskussion der Reaktionsführung technischer<br />
Synthesen,<br />
- formulieren Voraussagen über die Änderung<br />
der Gleichgewichtslage durch Druck-,<br />
Temperatur- <strong>und</strong> Konzentrationsänderung<br />
(Pr<strong>in</strong>zip von LE CHATELIER),
- beurteilen unter Nutzung des MWG<br />
bedeutende großtechnische Synthesen, wie z.<br />
B. das HABER-BOSCH-Verfahren, h<strong>in</strong>sichtlich<br />
ihrer Wirtschaftlichkeit,<br />
- wenden das MWG auf Gleichgewichte <strong>in</strong><br />
wässrigen Lösungen an,<br />
- stellen den Zusammenhang von Ionenprodukt<br />
des Wassers <strong>und</strong> pH-Wert dar,<br />
- berechnen pH-Werte <strong>und</strong> stellen die<br />
Bedeutung des pH-Wertes <strong>in</strong> Alltag <strong>und</strong><br />
Technik dar,<br />
- führen selbstständig Säure-Base-Titrationen<br />
durch,<br />
- planen zunehmend selbstständig, welche<br />
Experimente zu welchem erkenntnistheoretischen<br />
Zweck e<strong>in</strong>gesetzt werden können, um<br />
eigene Fragestellungen <strong>in</strong> Bezug auf e<strong>in</strong><br />
naturwissenschaftlich-chemisches Problem zu<br />
beantworten<br />
- beschreiben <strong>und</strong> erläutern Möglichkeiten der<br />
Steuerung chemischer Reaktionen durch<br />
Variation von Reaktionsbed<strong>in</strong>gungen,<br />
- erläutern Durchführung <strong>und</strong> technische<br />
Pr<strong>in</strong>zipien e<strong>in</strong>er ausgewählten technischen<br />
Synthese (z. B. das HABER-BOSCH-Verfahren),<br />
- diskutieren die Wirtschaftlichkeit <strong>und</strong><br />
ökologische Folgen e<strong>in</strong>er ausgewählten<br />
technischen Synthese<br />
- beschreiben die Säure-Base-Theorie nach<br />
BRÖNSTED als Donator-Akzeptor-Reaktion,<br />
- leiten das Ionenprodukt des Wassers aus der<br />
Autoprotolyse des Wassers her,<br />
- def<strong>in</strong>ieren den Begriff pH-Wert <strong>und</strong> erläutern<br />
den Zusammenhang zum Ionenprodukt des<br />
Wassers,<br />
- berechnen pH-Werte sehr starker, starker <strong>und</strong><br />
schwacher Protolyte sowie pH-Werte von Salz-<br />
Lösungen <strong>und</strong> ermitteln diese experimentell<br />
unter Verwendung geeigneter Indikatoren,<br />
- beschreiben Puffersysteme <strong>und</strong> deren<br />
Bedeutungen,<br />
- führen Säure-Base-Titrationen durch <strong>und</strong><br />
berechnen Konzentrationen, Massen <strong>und</strong><br />
Stoffmengen der Titranden,<br />
- werten Titrationskurven aus,