Leistungsverzeichnis - Dr. Treder und Kollegen
Leistungsverzeichnis - Dr. Treder und Kollegen
Leistungsverzeichnis - Dr. Treder und Kollegen
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Leistungsverzeichnis</strong><br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN<br />
14. September 2012
Inhaltsverzeichnis<br />
1 Vorwort 5<br />
2 Allgemeine Laborinformation 6<br />
2.1 Ansprechpartner . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6<br />
2.2 Ärzteteam . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 8<br />
2.3 Öffnungszeiten . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10<br />
2.4 Qualitätsmanagement . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11<br />
2.5 Präanalytik . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13<br />
2.6 Abkürzungen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 17<br />
3 Molekularbiologie 19<br />
3.1 Präanalytik . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 19<br />
3.2 Erregerdiagnostik . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 22<br />
3.3 Humangenetik . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32<br />
4 Funktionsteste 39<br />
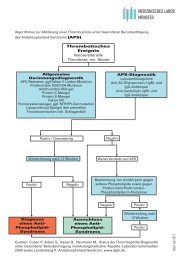
4.1 ACTH-Test . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40<br />
ACTH-Test bei V.a. NNR-Insuffizienz . . . . . . . . . . . . . . . . . . . . . . . . 40<br />
ACTH-Test bei V.a. late-onset adrenogenitales Syndrom (21-Hydroxylasemangel) . . 41<br />
4.2 Aldosteron-Suppressionstest . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42<br />
4.3 Arginin-Stimulationstest . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43<br />
4.4 Calcium-Stimulationstest . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44<br />
4.5 Captopril-Suppressionstest . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45<br />
4.6 Clonidin-Test . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46<br />
4.7 CRH-Test . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47<br />
4.8 Dexamethason-Hemmtest (niedrig dosiert) . . . . . . . . . . . . . . . . . . . . . . 49<br />
4.9 Dexamethason-Hemmtest (hoch dosiert) . . . . . . . . . . . . . . . . . . . . . . . 50<br />
4.10 Dimaval-Test . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 51<br />
4.11 D-Xylose-Test . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52<br />
4.12 Eisenresorptionstest . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54<br />
4.13 Fructose-Belastungstest . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55<br />
4.14 GHRH-Test . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 56<br />
4.15 Glucagon-Test . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 57<br />
4.16 Glucose-Suppressionstest . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58<br />
4.17 Helicobacter pylori-Atemtest . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 59<br />
4.18 Insulinhypoglykämie-Test . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 60<br />
Insulinhypoglykämie-Test bei V.a. adrenocorticotrope Insuffizienz . . . . . . . . . . 60<br />
Insulinhypoglykämie-Test bei V.a. somatotrope Insuffizienz . . . . . . . . . . . . . 61<br />
4.19 Lactose-Belastungstest . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62<br />
4.20 LHRH-Test (GnRH-Test) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63<br />
3
Inhaltsverzeichnis<br />
4.21 Metoclopramid-Test . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65<br />
4.22 Oraler Glucosetoleranztest (OGTT) . . . . . . . . . . . . . . . . . . . . . . . . . . 66<br />
Oraler Glucosetoleranztest bei V.a. Diabetes mellitus . . . . . . . . . . . . . . . . . 66<br />
Oraler Glucosetoleranztest bei V.a. Gestationsdiabetes . . . . . . . . . . . . . . . . 67<br />
Oraler Glucosetoleranztest, Vortest bei Schwangeren . . . . . . . . . . . . . . . . . 68<br />
4.23 Orthostase-Test . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 69<br />
4.24 Pentagastrin-Stimulationstest . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 70<br />
4.25 TRH-Test . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 71<br />
TRH-Test bei V.a. latente Hyperprolactinämie . . . . . . . . . . . . . . . . . . . . 71<br />
TRH-Test bei V.a. sek<strong>und</strong>äre / tertiäre Hypothyreose . . . . . . . . . . . . . . . . . 72<br />
5 Mikrobiologie 73<br />
5.1 Allgemeine Gr<strong>und</strong>sätze . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 73<br />
5.2 Versandmaterial . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 75<br />
Allgemeine Transportgefäße . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 75<br />
Spezielle Transportgefäße . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 76<br />
5.3 Alphabetisches Register . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 77<br />
6 Antibiotic Stewardship (ABS) 128<br />
7 Hygiene 129<br />
8 Stuhldiagnostik 130<br />
9 Zusätzliches Informationsmaterial 135<br />
10 Alphabetisches <strong>Leistungsverzeichnis</strong> 136<br />
Index 381<br />
4 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
1 Vorwort<br />
Liebe Kollegin, lieber Kollege, liebes Praxis-Team,<br />
liebe Pflegerin <strong>und</strong> lieber Pfleger im Krankenhaus,<br />
die Labormedizin in Deutschland <strong>und</strong> damit unser Labor in Münster befinden sich in einem<br />
Prozess des erheblichen Wandels. Dieser Wandel betrifft sowohl die Analytik selbst, die durch<br />
Einführung neuer Methoden <strong>und</strong> Fortentwicklung bestehender Verfahren rasch voranschreitet,<br />
als auch die Organisation der Laboratorien, die durch Spezialisierung einerseits <strong>und</strong> Bildung<br />
von Laborverb<strong>und</strong>en andererseits eine Erhöhung der Qualität bei besserer Wirtschaftlichkeit realisiert.<br />
So ist unser Labor seit zwei Jahren Teil des größten Laborverb<strong>und</strong>s Deutschlands, des Limbach-<br />
Verb<strong>und</strong>es. Unser Verb<strong>und</strong> wird ärztlich geleitet <strong>und</strong> hat als Ziel, Sie bei der Versorgung Ihrer<br />
Patienten im labordiagnostischen Bereich optimal zu unterstützen <strong>und</strong> zu beraten.<br />
Das <strong>Leistungsverzeichnis</strong>, das Sie in den Händen halten, ist zum ersten Mal kein<br />
eigenständiges Produkt, sondern ein Auszug aus unserem wesentlich umfangreicheren Online-<br />
<strong>Leistungsverzeichnis</strong>. Letzteres ist unter www.labor-muenster.de abrufbar <strong>und</strong> enthält viele<br />
wertvolle Hinweise zur Präanalytik sowie zu den Untersuchungsindikationen <strong>und</strong> Bef<strong>und</strong>interpretationen,<br />
die den Rahmen des gedruckten Verzeichnisses gesprengt hätten. Das Online-Verzeichnis<br />
ist zudem stets tagesaktuell, während das gedruckte Verzeichnis naturgemäß eine Momentaufnahme<br />
darstellen muss.<br />
Dieses Verzeichnis gliedert sich in die Bereiche Allgemeine Laborinformation“ , Moleku-<br />
” ”<br />
larbiologie“ , Funktionsteste“ , Mikrobiologie“ , Antibiotic Stewardship“ , Hygiene“ <strong>und</strong><br />
” ” ” ”<br />
” Stuhldiagnostik“ . Es folgt unter der Rubrik Zusätzliches Informationsmaterial“ eine Liste<br />
”<br />
diagnostischer Algorithmen <strong>und</strong> Übersichten, die bei unserem Außendienst oder unserem Versand<br />
kostenlos angefordert werden können. Danach finden Sie im Alphabetischen <strong>Leistungsverzeichnis</strong>“<br />
”<br />
eine Ausführung der in unserem Labor verfügbaren, nicht-mikrobiologischen Untersuchungen,<br />
einschließlich der Leistungen der Molekularbiologie. Abger<strong>und</strong>et wird das Buch durch einen<br />
alphabetischen Seiten-Index, auch ein Novum das, so wie wir hoffen, die Handhabung des Werkes<br />
erheblich erleichtern wird.<br />
Wir freuen uns sehr, Ihnen dieses komplett überarbeitete <strong>Leistungsverzeichnis</strong> vorlegen zu<br />
können. Für Kritik <strong>und</strong> Anregungen bezüglich Inhalt oder Layout sind wir jederzeit dankbar.<br />
Wir bedanken uns für die gute Zusammenarbeit <strong>und</strong> hoffen, dass dieses Verzeichnis Ihnen in<br />
Ihrer täglichen Arbeit eine wertvolle Hilfe sein wird.<br />
Prof. <strong>Dr</strong>. Paul Cullen<br />
Geschäftsführer des Labors<br />
5
2 Allgemeine Laborinformation<br />
2.1 Ansprechpartner<br />
Zentrale Telefon / Telefax E-Mail<br />
0251 60916-0 / -100 info@labormuenster.de<br />
Verwaltung Telefon / Telefax E-Mail<br />
0251 60916 - @labor-muenster.de<br />
Abrechnung<br />
- Privatpatienten Petra Janssen -133 / -100 petra.janssen<br />
- Inkasso Anne Bombe -135 / -139 anne.bombe<br />
- Krankenhaus Petra Janssen -133 / -100 petra.janssen<br />
Einsenderbetreuung Anja Hagemann -134 / -100 anja.hagemann<br />
DFÜ Dominic David -281 / -100 dominic.david<br />
Ralf Rabe -281 / -100 ralf.rabe<br />
Kurierdienst W. Rensinghoff -292 / -294 winfried.rensinghoff<br />
Versand Sabine Wolters -161 / -164 versand<br />
Leitung Ronald Seus -121 / -139 ronald.seus<br />
Laborbereiche Telefon / Telefax E-Mail<br />
0251 60916- @labor-muenster.de<br />
Klinische Chemie Alide Vrielink -231 / -286 alide.vrielink<br />
Mikrobiologie Ulrike Hachmann -171 / -189 ulrike.hachmann<br />
Molekularbiologie <strong>Dr</strong>. rer. nat.<br />
Frank Thiemann<br />
6<br />
-241 / -189 frank.thiemann
2 Allgemeine Laborinformation<br />
Laborbereiche Telefon / Telefax E-Mail<br />
Hygiene <strong>Dr</strong>. med. <strong>Dr</strong>. rer. nat.<br />
Wolfgang <strong>Treder</strong><br />
-106 / -103 w.treder<br />
Technische Leitung Norbert Brink -211 / -100 norbert.brink<br />
Qualitätsmanagement Marion Eich -283 / -100 marion.eich<br />
Annika Janich -285 / -100 annika.janich<br />
Unsere E-Mail-Stammadresse lautet @labor-muenster.de<br />
Wenn Sie also eine E-Mail beispielsweise an unseren Versand schicken möchten, so lautet die<br />
vollständige E-Mail-Adresse versand@labor-muenster.de,<br />
möchten Sie z.B. mit Frau Eich von unserem Qualitätmanagement Kontakt aufnehmen, würden Sie<br />
Ihre E-Mail an marion.eich@labor-muenster.de richten.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 7
2 Allgemeine Laborinformation<br />
2.2 Ärzteteam<br />
Kontakt<br />
Prof. <strong>Dr</strong>. med. Paul Cullen 0251 60916 – 105<br />
Geschäftsführer<br />
p.cullen@labor-muenster.de<br />
Facharzt für Laboratoriumsmedizin<br />
Facharzt für Innere Medizin<br />
Klinischer Chemiker<br />
<strong>Dr</strong>. med. Dominik Löer 0251 60916 – 135<br />
Facharzt für Laboratoriumsmedizin d.loeer@labor-muenster.de<br />
<strong>Dr</strong>. med. <strong>Dr</strong>. rer. nat.<br />
Wolfgang <strong>Treder</strong><br />
Facharzt für Mikrobiologie, Virologie <strong>und</strong><br />
Infektionsepidemiologie,<br />
Facharzt für Hygiene <strong>und</strong> Umweltmedizin<br />
0251 60916 – 106<br />
w.treder@labor-muenster.de<br />
<strong>Dr</strong>. med. Susanne Adam 0251 60916 – 119<br />
Fachärztin für Transfusionsmedizin<br />
s.adam@labor-muenster.de<br />
mit Zusatzbezeichnung Hämostaseologie,<br />
Fachärztin für Laboratoriumsmedizin<br />
Sabine Riepe 0251 60916 – 104<br />
Fachärztin für Laboratoriumsmedizin sabine.riepe@labor-muenster.de<br />
<strong>Dr</strong>. med. Aurélien Schubert 0251 60916 – 109<br />
Facharzt für Laboratoriumsmedizin a.schubert@labor-muenster.de<br />
<strong>Dr</strong>. med. Max Georg Weyer 0251 60916 – 102<br />
Facharzt für Laboratoriumsmedizin,<br />
max-georg.weyer@labor-muenster.de<br />
Facharzt für Mikrobiologie, Virologie <strong>und</strong><br />
Infektionsepidemiologie<br />
<strong>Dr</strong>. med. Uwe Lang 0251 60916 – 116<br />
Facharzt für Mikrobiologie, Virologie <strong>und</strong><br />
Infektionsepidemiologie<br />
u.lang@labor-muenster.de<br />
<strong>Dr</strong>. med. Jana Thiel 0251 60916 – 115<br />
Fachärztin für Mikrobiologie, Virologie <strong>und</strong><br />
Infektionsepidemiologie<br />
j.thiel@labor-muenster.de<br />
8 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Kontakt<br />
<strong>Dr</strong>. med. Andreas Uekötter 0251 60916 – 359<br />
Facharzt für Mikrobiologie, Virologie <strong>und</strong><br />
Infektionsepidemiologie<br />
a.uekoetter@labor-muenster.de<br />
<strong>Dr</strong>. med. Matthias Aymanns 0251 60916 – 108<br />
Assistenzarzt m.aymanns@labor-muenster.de<br />
2 Allgemeine Laborinformation<br />
<strong>Dr</strong>. med. Ursula Westerhoff 0251 60916 – 113<br />
Assistenzärztin u.westerhoff@labor-muenster.de<br />
Kim Koop, M.Sc. 0251 60916 – 180<br />
Master of Science (Mikrobiologie) kim.koop@labor-muenster.de<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 9
2 Allgemeine Laborinformation<br />
2.3 Öffnungszeiten<br />
Telefonzentrale<br />
Montag bis Freitag 8.00 bis 19.00 Uhr<br />
Blutentnahme<br />
Montag bis Freitag 8.00 bis 16.00 Uhr<br />
Kontakt<br />
Zentrale 0251 – 60916-0<br />
Telefax 0251 – 60916-100<br />
Internet http://www.labor-muenster.de<br />
10 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
2.4 Qualitätsmanagement<br />
2 Allgemeine Laborinformation<br />
Einleitung<br />
Seit Januar 2004 ist unser Institut ein durch die DAkkS (Deutsche Akkreditierungsstelle) akkreditiertes<br />
Prüflabor nach DIN EN ISO 15189 (D-ML13111-01-00).<br />
Die Aufrechterhaltung <strong>und</strong> Weiterentwicklung unseres Qualitätsstandards resultiert aus einem<br />
kontinuierlichen Prozess, der unter anderem folgende Punkte beinhaltet:<br />
- Dokumentation <strong>und</strong> Pflege von Standard-Arbeitsanweisungen (engl. Standard Operating Procedures<br />
(SOP)) für alle bei uns durchgeführten Untersuchungsverfahren<br />
- Transparenz aller qualitätsrelevanten Tätigkeiten durch standardisierte Verfahrens- <strong>und</strong> Arbeitsanweisungen<br />
- Management Reviews der Geschäftsleitung<br />
- Regelmäßige Durchführung interner Audits<br />
- Regelmäßige externe Begutachtung durch die Deutsche Akkreditierungsstelle (DAkkS)<br />
- Kontinuierliche interne <strong>und</strong> externe Weiterbildung der Mitarbeiter/innen<br />
- Interne Qualitätssicherung durch die Auswertung der Qualitätskontrollen nach den Richtlinien der<br />
B<strong>und</strong>esärztekammer (RiLiBÄK)<br />
- Teilnahme an externen Ringversuchen <strong>und</strong> Laborvergleichsmessungen<br />
Alle nicht akkreditierten Leistungen werden im Analysenverzeichnis mit (N) gekennzeichnet.<br />
Meßunsicherheit <strong>und</strong> Signifikanz<br />
Jedes Messergebnis ist einer Messunsicherheit unterworfen. Diese Unsicherheit entsteht einerseits<br />
aus Fehlern <strong>und</strong> Ungenauigkeiten bei der Probenentnahme <strong>und</strong> der Analyse, andererseits aufgr<strong>und</strong><br />
Unkenntnis aller Faktoren, die das Ergebnis beeinflussen können.<br />
Nach ISO/DIN 3534-1 ist ein Messergebnis definiert als ein Schätzwert, der den Wertebereich angibt,<br />
innerhalb dessen der wahre Wert zu erwarten ist.<br />
Zur Beurteilung der Messunsicherheit reicht die alleinige Beurteilung der Wiederholbarkeit <strong>und</strong><br />
Vergleichbarkeit nicht aus (Richtlinien zur Interpretation der Normenserie EN 45000 <strong>und</strong> ISO GUIDE<br />
25). Vielmehr müssen alle relevanten Quellen der Unsicherheit, insbesondere die Probenentnahme,<br />
die im medizinischen Laboratorium eine entscheidende Rolle spielt, berücksichtigt werden.<br />
Die für die Signifikanzbetrachtung entscheidende Gesamtmessunsicherheit im medizinischen<br />
Laboratorium wird beeinflusst unter anderem von:<br />
- Einflussgrößen (= in vivo Determinanten):<br />
biologisch-physiologische Einflüsse wie Geschlecht, Alter, Ernährung, Belastungszustand,<br />
Körperlage, Tagezeit<br />
- Einflüsse diagnostischer <strong>und</strong> therapeutischer Maßnahmen wie intravenöse Injektionen, Medikamente,<br />
pathologische Einflüsse wie Trauma, Operationen oder Schock sowie Faktoren, die sich aus<br />
der Probenentnahme ergeben (s.u.)<br />
- Störfaktoren (= in vitro Determinanten):<br />
als Konsequenz diagnostischer <strong>und</strong>/oder therapeutischer Maßnahmen, insbesondere Störung durch<br />
Pharmaka<br />
- Störung durch Probenbestandteile, die noch vor Abnahme in vivo oder durch falsche Lagerung der<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 11
2 Allgemeine Laborinformation<br />
Probe in vitro auftreten<br />
- Faktoren, die mit der Entnahme der Probe zusammenhängen<br />
- in vivo Einflussgrößen wie die Art der Probe, Körperlage, Stauungszeit, Tageszeit, Lipämie oder<br />
Hämolyse<br />
- in vitro Störfaktoren wie Gerinnung, Hämolyse, Lagerung, Licht oder Raumluft<br />
- anderen Faktoren der Präanalytik wie Transport oder Probenvorbereitung<br />
- der Präzision des analytischen Laborprozesses. Die Präzision misst den statistischen Fehler bei<br />
wiederholter Messung (Streuung). Ihr Maß ist der Variationskoeffizient. Der Variationskoeffizient<br />
hängt von der Lage des Messwertes stark ab: die relative Streuung ist in der Regel größer bei<br />
niedrigen Messsignalen als bei hohen<br />
- der Richtigkeit des analytischen Laborprozesses als Maß für die Messsystem-abhängige Abweichung<br />
vom “ wahren Wert”<br />
Im Rahmen der Qualitätskontrolle werden die Berechnungen der analytischen Präzision <strong>und</strong><br />
Richtigkeit für alle quantitativen Parameter ständig aktualisiert. Auf Anfrage erteilen wir Ihnen gern<br />
Auskunft über die analytischen Variablen der Messunsicherheit bei quantitativen Prüfverfahren.<br />
Wir haben uns bemüht, die für die Beurteilung der Gesamtmessunsicherheit wichtigen Faktoren wie<br />
beispielsweise die Halbwertszeit bei Medikamenten in dieser Analysenübersicht aufzulisten.<br />
Gerne stehen wir Ihnen zur Besprechung einzelner Bef<strong>und</strong>e sowie möglicher Störfaktoren jederzeit<br />
zur Verfügung.<br />
Fremdanalysen<br />
Alle Fremdanalysen sind in der Analysenübersicht mit W (Weiterleitung) oder U (Unterauftrag)<br />
gekennzeichnet. Die Auftragsvergabe erfolgt an kompetente Fachlabore, über deren Qualitätsstandard<br />
wir uns regelmäßig informieren.<br />
Ansprechpartner<br />
Für Fragen, Anregungen <strong>und</strong> Kritik steht Ihnen unser Qualitätsmanagement gerne zur Verfügung.<br />
Marion Eich<br />
Telefon: 0251/60916-283<br />
Fax: 0251/60916-100<br />
E-Mail: marion.eich@labor-muenster.de<br />
Annika Janich<br />
Telefon: 0251/60916-285<br />
Fax: 0251/60916-100<br />
E-Mail: annika.janich@labor-muenster.de<br />
12 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
2.5 Präanalytik<br />
2 Allgemeine Laborinformation<br />
Allgemeines<br />
Für die Präzision <strong>und</strong> Richtigkeit labormedizinischer Untersuchungen ist die korrekte Einhaltung<br />
der präanalytischen Bedingungen von entscheidender Bedeutung. Neben der Entnahme ist die<br />
Verwendung der richtigen Probengefäße sowie die sachgerechte Lagerung <strong>und</strong> der Transport<br />
mitentscheidend für ein korrektes Messergebnis. Allgemeine Hinweise, die Sie beim optimalen<br />
Umgang mit der Probe unterstützen, finden sie auf den folgenden Seiten. Darüber hinaus finden<br />
Sie ausführliche Kommentare <strong>und</strong> Hinweise in den speziellen Kapiteln der Fachbereiche. Sowohl<br />
das alphabetische Analysenverzeichnis als auch die nachfolgenden Kapitel enthalten detaillierte<br />
Informationen zu Entnahmebedingungen, Probennahme, benötigtem Material sowie Lagerungs- <strong>und</strong><br />
Transportbedingungen der einzelnen Untersuchungen. Selbstverständlich stehen wir Ihnen bei Fragen<br />
jederzeit gerne zur Verfügung.<br />
Beschriftung von Material <strong>und</strong> Begleitschein<br />
Unmittelbar nachdem die Probe unser Labor erreicht hat, wird sie auf Übereinstimmung der<br />
Identitäten von Probenmaterial <strong>und</strong> Begleitschein geprüft, damit Verwechslungen ausgeschlossen<br />
werden können. Verwechslungsgefahr besteht insbesondere, wenn mehrere Probenmaterialien einem<br />
Patienten zugeordnet werden müssen oder Proben verschiedener Patienten in einer Versandtasche<br />
transportiert werden. Eine eindeutige Identifikation <strong>und</strong> Zuordnung ist nur dann gegeben, wenn<br />
sowohl Begleitschein als auch das Probenmaterial vollständig beschriftet sind.<br />
Bitte zusätzlich folgende Hinweise beachten<br />
Immer das Material mit Vor- <strong>und</strong> Zunamen, bei Blutgruppenbestimmungen auch mit Geburtsdatum<br />
beschriften.<br />
Bei seltenen oder ausländischen Vornamen bitte Geschlecht angeben.<br />
Einsenderangaben, d.h. Praxis- oder Stationsstempel nicht vegessen.<br />
Bitte Material <strong>und</strong> zugehöriges Begleitformular immer in der gleichen Versandtasche einsenden.<br />
Visuell schwer identifizierbares Material (z.B. Punktat, Liquor) auf dem Überweisungsschein<br />
benennen<br />
Immer nur das Probenröhrchen beschriften (nicht das Versandröhrchen oder die Umhülle).<br />
Bei Funktionstesten, Tagesprofilen o.ä. unbedingt Probenröhrchen eindeutig beschriften (z.B. vor<br />
bzw. nach Medikamenten-Gabe, Entnahmezeit).<br />
Vollblutröhrchen nicht mit schwarzem Filzstift beschriften: Nicht lesbar. Aufkleber verwenden.<br />
Entnahmeort bei Abstrichen angeben.<br />
Den Untersuchungsauftrag bitte konkret <strong>und</strong> eindeutig formulieren. Aufträge wie zum Beispiel<br />
” Abklärung Bauchschmerzen“ , ” Virusdiagnostik“ oder arbeitsmedizinische Untersuchungen“<br />
”<br />
können von uns nicht bearbeitet werden, da ohne genaue Kenntnis des klinischen Bildes <strong>und</strong> der<br />
bereits ausgeschlossenen Differentialdiagnosen eine Eingrenzung der Analytik nicht möglich ist.<br />
Angaben über Klinik <strong>und</strong> Therapie helfen uns bei der Interpretation des Bef<strong>und</strong>es <strong>und</strong> sind z.B.<br />
auch für eine gezielte Antibiotikaaustestung wichtig. Vollständige Angaben über Patient, Material<br />
<strong>und</strong> Herkunft des Materials beschleunigen die präzise Bearbeitung der Probe <strong>und</strong> ermöglichen eine<br />
zügige Bearbeitung ohne Zeitverlust.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 13
2 Allgemeine Laborinformation<br />
Probenmaterial <strong>und</strong> Probengefäße<br />
Serum: weiße Monovette<br />
Als Serum bezeichnet man den Teil des Blutes, der nach der Gerinnung von den zellulären<br />
Bestandteilen <strong>und</strong> Fibrin getrennt wurde. Aus Serum wird die Mehrzahl der Untersuchungen<br />
durchgeführt, insbesondere spezifische Antikörpernachweise von Infektionserregern. Das entnommene<br />
Blut in der weißen Vollblut-Monovette gut schwenken. Wird für die angeforderte<br />
Untersuchung ausdrücklich Serum benötigt, die Monovette einige Minuten aufrecht stehen lassen<br />
<strong>und</strong> anschließend wenn möglich zentrifugieren. Das gewonnene Serum vom Blutkuchen trennen <strong>und</strong><br />
in ein Serumröhrchen füllen.<br />
Vollblut: weiße Monovette<br />
Manche Untersuchungen erfolgen aus dem Vollblut, d. h. es müssen alle Bestandteile des Blutes<br />
in der Probe enthalten sein (z. B. irreguläre erythrozytäre Antikörper). Die Monovette darf nicht<br />
zentrifugiert werden. Bitte die Angaben in der Analysenübersicht beachten!<br />
Citrat-Blut: grüne Monovette<br />
Natriumcitrat verhindert die Blutgerinnung. Das durch Zentrifugation gewonnene Citrat-Plasma<br />
wird u.a. für Gerinnungsanalysen benötigt. Für bestimmte Untersuchungen muss gefrorenes Plasma<br />
versendet werden. Vor dem Tieffrieren bitte unbedingt das Plasma von den Blutzellen trennen<br />
(Hämolyse!). Ergänzende Angaben finden Sie unter den entsprechenden Untersuchungen.<br />
EDTA-Blut: rote Monovette<br />
Ethylen-diamin-tetra-acetat ist ein Komplexbildner <strong>und</strong> verhindert ebenfalls die Gerinnung des Blutes<br />
in der Monovette. Auf gute Durchmischung achten <strong>und</strong> das Röhrchen mehrmals schwenken (nicht<br />
schütteln!). Das EDTA-Blut wird u.a. für die Erstellung von Blutbildern, alle molekulargenetischen<br />
Untersuchungen sowie für einige Medikamentennachweise verwendet. Das durch Zentrifugation<br />
gewonnene EDTA-Plasma ist z. B. notwendig für den PCR-Nachweis von Viren.<br />
Ammonium-Heparinat-Blut: blaue Monovette<br />
Heparin ist ein Komplex aus Glykosaminoglykanen, der die Blutgerinnung hemmt. Heparinat-Blut<br />
wird z.B. für die HLA B27–Diagnostik oder die Bestimmung von Histamin im Vollblut verwendet<br />
Lithium-Heparinat: orange Monovette<br />
Lithium-Heparinat-Blut wird u.a. für den Nachweis von Tuberkulose-reaktiven T-Lymphozyten<br />
mittels TB-Elispot oder Quantiferon-Test benötigt.<br />
Na-Fluorid-Blut: gelbe Monovette<br />
Natrium-Fluorid hemmt die Glykolyse. Dieses Blut wird für die Bestimmung von Kohlenhydraten<br />
wie Glucose oder Fructose verwendet. Glucose-Bestimmungen aus Serum können durch die in<br />
vitro-Verstoffwechselung des Zuckers durch die Leukozyten falsch niedrig ausfallen.<br />
GlucoEXACT-Röhrchen (Citrat-NaF-Blut): graue Monovette<br />
Das Gemisch aus Citrat/Citratpuffer <strong>und</strong> Natrium-Fluorid hemmt die Glykolyse zuverlässig <strong>und</strong><br />
unmittelbar. Leitliniengemäß wird dieses Material zur Glucosebestimmung im Rahmen des oralen<br />
Glucosetoleranztests (OGTT) bei V.a. Gestationsdiabetes empfohlen.<br />
14 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
2 Allgemeine Laborinformation<br />
Rollrandröhrchen:<br />
Diese werden überwiegend für die Untersuchung auf Lösungsmittel <strong>und</strong> andere flüchtige Substanzen<br />
eingesetzt. Die Benutzung von Rollrandröhrchen ist bei der jeweiligen Anforderung genau<br />
beschrieben. Überführen Sie bitte die angegebene Menge Blut in das Röhrchen <strong>und</strong> gehen Sie dann<br />
weiter vor wie beschrieben.<br />
Entnahmereihenfolge:<br />
Werden von einem Patienten verschiedene Blutproben benötigt, halten Sie bitte folgende Reihenfolge<br />
bei der Blutentnahme ein:<br />
1. Blutkultur<br />
2. Nativblut (Vollblut/Serum)<br />
3. Citratblut<br />
4. EDTA-, Heparinat-Blut<br />
5. Fluorid-Blut<br />
Probentransport<br />
Der von uns beauftragte Kurierdienst sorgt für einen zügigen <strong>und</strong> sachgerechten Transport des<br />
Materials in unser Labor. Sämtliche Fahrzeuge sind mit Transport- <strong>und</strong> Kühlboxen ausgerüstet,<br />
um transportbedingte präanalytische Fehler weitestgehend zu vermeiden. Selbstverständlich wird<br />
für die strikte Einhaltung der aktuellen Vorschriften über den Transport von medizinischen Untersuchungsmaterialien<br />
Sorge getragen. Die Einteilung der Fahrrouten ist so gewählt, dass die Proben<br />
schnellstmöglich das Labor erreichen. Wir bitten Sie um Verständnis, dass eine Tourenplanung<br />
naturgemäß nicht immer den optimalen Anfahrzeitpunkt für Ihre Praxis erreichen kann. Trotzdem<br />
möchten wir Sie herzlich bitten, die Proben zum verabredeten Zeitpunkt abholbereit zu haben, um<br />
unnötige Wartezeiten auch im Namen der anderen <strong>Kollegen</strong> zu vermeiden. Für Ihr Verständnis recht<br />
herzlichen Dank. Selbstverständlich ist auch eine Einsendung der Probe über den Postweg möglich.<br />
Bitte benutzen Sie hierfür die von uns zur Verfügung gestellten Versandtaschen. Das Porto wird<br />
von uns übernommen. Wir möchten Sie darauf aufmerksam machen, dass ein Postversand unter<br />
Umständen länger als 24 St<strong>und</strong>en dauern kann <strong>und</strong> raten von einem Versand über das Wochenende<br />
oder einem Feiertag ab.<br />
Versandmaterial<br />
Versandmaterialien, Formulare, Entnahmematerialien <strong>und</strong> Probengefäße können mit dem Vordruck<br />
Bestellschein für Versandmaterialien bestellt werden. Ein neuer Bestellschein wird Ihnen bei jeder<br />
Lieferung beigefügt. Selbstverständlich können Sie Ihre Bestellwünsche auch telefonisch oder per<br />
Fax an uns richten. Für Auskünfte stehen Ihnen unsere Mitarbeiter gerne zur Verfügung.<br />
Probenannahme / Versand<br />
Tel. 0251 / 60 91 6 161<br />
Fax 0251 / 60 91 6 164<br />
Bef<strong>und</strong>übermittlung<br />
Der Bef<strong>und</strong>bericht erfolgt schriftlich als Bef<strong>und</strong>druck, per Fax oder per Datenfernübertragung<br />
(siehe unten). Eil- oder Notfallbef<strong>und</strong>e werden umgehend telefoniert oder per Fax versendet. Sollte<br />
ein Ergebnis in jedem Falle telefoniert oder gefaxt werden, so teilen Sie uns dieses bitte auf dem<br />
Begleitschein mit. Nicht immer lassen sich nachträgliche Korrekturen aufgr<strong>und</strong> unserer internen<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 15
2 Allgemeine Laborinformation<br />
Qualitätskontrolle bzw. aufgr<strong>und</strong> von Reklamationen des einsendenden Arztes vermeiden. In diesen<br />
Fällen erhalten Sie von uns einen als ” Korrekturbef<strong>und</strong>“ gekennzeichneten berichtigten Bef<strong>und</strong><br />
verb<strong>und</strong>en mit der Bitte, den fehlerhaften Bef<strong>und</strong> zu vernichten. Unsere EDV hat in der Regel<br />
die Telefonnummer <strong>und</strong> das dazugehörige Faxgerät Ihrer Praxis in den Adressdaten hinterlegt, so<br />
dass ein Faxbef<strong>und</strong> mittels Knopfdruck ausgelöst werden kann. Sollte ein dringlicher Bef<strong>und</strong> an<br />
eine abweichende Ruf- oder Faxnummer übermittelt werden, bitten wir um Angabe der Nummer<br />
auf dem Überweisungsschein (bitte deutlich kennzeichnen). Eine Bef<strong>und</strong>kopie für einen weiterbehandelnden<br />
<strong>Kollegen</strong> bzw. für den Patienten erstellen wir gerne auf Ihren Wunsch. Sollten wir<br />
im Rahmen der gesetzlichen Meldepflicht (Infektionsschutzgesetz, IfSG) ein Untersuchungsergebnis<br />
an das zuständige Ges<strong>und</strong>heitsamt weiterleiten, so werden Sie auf dem Bef<strong>und</strong> hierüber informiert.<br />
Elektronische Bef<strong>und</strong>übermittlung (DFÜ)<br />
Mit der DFÜ bieten wir Ihnen eine zeitgemäße, schnelle <strong>und</strong> sichere Art der Bef<strong>und</strong>übermittlung. Sie<br />
können die Bef<strong>und</strong>e inklusive der Referenzbereiche <strong>und</strong> Abrechnungsziffern von unserer Mailbox<br />
abrufen. Das erspart Ihnen <strong>und</strong> Ihrem Team Zeit. Die übertragenen Laborergebnisse können Sie<br />
sofort in Ihre Praxis-Software übernehmen. Übermittelt werden LDT-Dateien – auf Wunsch auch<br />
verschlüsselt <strong>und</strong> komprimiert – über sichere Telefon- oder Internet-Verbindungen.<br />
16 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
2.6 Abkürzungen<br />
2 Allgemeine Laborinformation<br />
AAS Atom-Absorptions-Spektroskopie<br />
BAT Biologischer Arbeitsstoff-Toleranz-Wert<br />
CEDIA Cloned Enzyme Donor Immuno Assay<br />
CLIA Chemilumineszenz Immuno Assay<br />
CMIA Chemilumineszenz Mikropartikel<br />
Immuno Assay<br />
ECLIA Elektrochemilumineszenz Immuno Assay<br />
EIA Enzyme Immuno Assay<br />
EIDA Enzyme Immuno Dot Assay<br />
ELFA Enzyme Linked Fluoreszenz Assay<br />
ELISA Enzyme Linked Immunosorbent Assay<br />
FC Flow Cytometry<br />
FEIA Fluoreszenz Enzym Immuno Assay<br />
FPIA Fluoreszenz Polarisations Immuno Assay<br />
GC Gas-Chromatographie<br />
GC/ECD GC mit Elektroneneinfangdetektor<br />
GC/FID GC mit Flammenionisierungsdetektor<br />
GC/MS Gas-Chromatographie / Massenspektrometrie<br />
HPLC High Performance Liquid Chromatography<br />
IA Immuno Assay<br />
ICP/MS Inductively Coupled Plasma / Mass Spectometry<br />
IEF Isoelektrische Fokussierung<br />
IF Immunfixation<br />
IFT Immunfluoreszenz-Test<br />
IHA Indirekte Hämagglutination<br />
IIFT Indirekter Immunfluoreszenz-Test<br />
ILMA Immunoluminometrischer Assay<br />
IR Infrarotspektrometrie<br />
IRMA Immunoradiometrischer Assay<br />
ISE Ionenselektive Elektrode<br />
ITC Ionenaustauschchromatographie<br />
KBR Komplementbindungsreaktion<br />
LC/MS Liquid Chromatography Mass Spectometry<br />
LC-MS/MS Liquid Chromatography Tandem<br />
Mass Spectometry<br />
LIA Lumineszenz Immunoassay<br />
LIEMA Lumineszenzverstärkter<br />
immunoenzymometrischer Assay<br />
MEIA Mikropartikel Immunoassay<br />
PAGE Polyacrylamid Gelelektrophorese<br />
PCR Polymerase Chain Reaction<br />
PCR-SSP Polymerase Chain Reaction Sequence Specific<br />
Primer<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 17
2 Allgemeine Laborinformation<br />
PETNIA Partikelverstärkter Turbidimetrischer Inhibitions<br />
Immunoassay<br />
REA Radioenzymatischer Assay<br />
RIA Radioimmunoassay<br />
RIA DA PEG Radioimmunoassay<br />
Doppelantikörper Polyäthylenglykol<br />
RID Radioimm<strong>und</strong>iffusion<br />
RIP Radioimmunpräzipitation<br />
RRA Radiorezeptorassay<br />
RT-PCR Reverse Transkription<br />
Polymerase Chain Reaction<br />
RZM-RIP/AUR RIP radioaktiv markierter Zellextrakte (RZM),<br />
Autoradiographie<br />
18 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
3 Molekularbiologie<br />
3.1 Präanalytik<br />
1. Serum oder Plasma<br />
Für den PCR-Nachweis viraler RNA oder DNA bitte immer eine gesonderte Vollblut- oder<br />
EDTA-Monovette (2x 2,7 ml Monovetten oder 1x 9,0 ml Monovette) einsenden. Monovette nach<br />
Blutentnahme nicht öffnen.<br />
Der Transport in das Labor sollte am Tag der Blutentnahme erfolgen. Ist ein tagesgleicher Transport<br />
nicht möglich, Probe gekühlt bei 4°C im Kühlschrank aufbewahren. Eventuell Rücksprache mit dem<br />
Labor.<br />
2. Humangenetische Untersuchungen<br />
Molekulargenetische Untersuchungen zum Nachweis von Mutationen oder Polymorphismen können<br />
nur aus EDTA-Blut, Citrat-Blut oder aus M<strong>und</strong>schleimhaut-Abstrichen (s. u.) erfolgen. Serum<br />
oder Plasma sind hierfür nicht geeignet! Das Blut oder der Abstrich kann über Nacht bei 4°C im<br />
Kühlschrank gelagert werden.<br />
Zum Nachweis von strukturellen oder numerischen Chromosomenaberrationen (Fremdleistung!)<br />
werden 10 ml Li-Heparinat-Blut benötigt. Die entsprechenden Monovetten erhalten Sie nach<br />
Rücksprache in unserem Versand (0251 / 60916 – 161)<br />
Für eine humangenetische Untersuchung benötigen wir eine Einverständniserklärung des<br />
Patienten (§ 8 GenDG).<br />
3. Abstriche<br />
a) zum Nachweis viraler DNA:<br />
Je nach Indikation entsprechend mit Tupfer abstreichen (z. B. Nasen-Rachenabstriche,<br />
Bläscheninhalt) <strong>und</strong> in das Röhrchen einbringen. Keine Tupfer mit Gelmedium verwenden,<br />
weil eine DNA-Isolierung dann nicht mehr möglich ist! Spezielle Abstrichbestecke mit flüssigem<br />
Transportmedium auf Anfrage erhältlich.<br />
Lagerung <strong>und</strong> Transport bei Raumtemperatur.<br />
b) zum Nachweis bakterieller DNA (insbesondere zum MRSA-Nachweis):<br />
Für den PCR-Nachweis (MRSA-Schnelltest) einen Trockentupfer ohne Transportmedium verwenden!<br />
Tupfer mit steriler 0,89%iger NaCl-Lösung befeuchten. Zuerst den Rachen <strong>und</strong> dann<br />
beide Nasenvorhöfe mit einem Tupfer abstreichen. Einen W<strong>und</strong>abstrich ggf. gesondert abnehmen.<br />
Nachfolgend Abstrichbesteck mit Transportmedium verwenden <strong>und</strong> nochmals abstreichen. Diese<br />
19
3 Molekularbiologie<br />
Abstriche werden für den kulturellen Nachweis benötigt, wenn der Schnelltest positiv ist. Nur so<br />
kann ggf. eine Resistenzbestimmung <strong>und</strong> Typisierung erfolgen.<br />
Lagerung <strong>und</strong> Transport bei Raumtemperatur.<br />
c) humangenetische Untersuchung:<br />
Tupfer kräftig 4–5 mal über die Wangenschleimhaut drehen. Der Patient sollte vorher nicht den<br />
M<strong>und</strong> ausgespült haben (z. B. Zähneputzen, M<strong>und</strong>spülwasser etc.). Tupfer in das Röhrchen ohne<br />
Transportmedium einbringen (s. o.).<br />
Lagerung <strong>und</strong> Transport bei Raumtemperatur.<br />
4. Urethra-/Zervix-Abstriche:<br />
Mit dem dicken Tupfer Zervixschleim <strong>und</strong> eventl. Ausfluß entfernen. Mit dem dünnen Tupfer<br />
zellreichen Abstrich entnehmen. Beim Mann dazu den Tupfer 2–3 cm in Urethra einführen <strong>und</strong> mind.<br />
3x drehen. Tupfer in Transportmedium einbringen <strong>und</strong> Tupferstiel am Röhrchenrand abbrechen.<br />
Röhrchen gut verschließen. Für den HPV-Nachweis sind spezielle Bürsten verfügbar. Lagerung<br />
<strong>und</strong> Transport bei Raumtemperatur. Die entsprechenden Abstrichröhrchen erhalten Sie in unserem<br />
Versand (0251 / 60916 – 161)<br />
5. Liquor<br />
Nach der Lumbal- / Subokzipitalpunktion die ersten 5 Tropfen in steriles Gefäß tropfen lassen <strong>und</strong><br />
verwerfen (Abtrennung von Desinfektionsmitteln, Gewebsflüssigkeit, Blut). Danach ca. 1 ml Liquor<br />
in sterilem Röhrchen auffangen.<br />
Tagesgleicher Transport ins Labor bei Raumtemperatur.<br />
Eventl. Lagerung für einen PCR-Nachweis bei 4°C über Nacht, wenn ein tagesgleicher Transport<br />
nicht möglich ist<br />
Rückstellproben bei –20°C lagern <strong>und</strong> tiefgekühlt ins Labor senden.<br />
6. Sputum<br />
Morgensputum: Sekret aus den tiefen Atemwegen, das sich über Nacht angesammelt hat, ist am<br />
besten geeignet.<br />
Den M<strong>und</strong> vor der Expektoration mit frischem Leitungswasser ausspülen. Keine M<strong>und</strong>wässer oder<br />
Zahnpasta benutzen (Desinfizientien).<br />
Wenn Spontangewinnung nicht möglich ist, eventl. Provokationsversuch durch Inhalation eines ca.<br />
45°C warmen Aerosols (hyperton, z. B. 10% NaCl-Lsg. in 15% Propylenglykol) versuchen.<br />
Lagerung <strong>und</strong> tagesgleicher Transport bei Raumtemperatur.<br />
20 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
7. Bronchialsekret / Trachealsekret<br />
3 Molekularbiologie<br />
Verschickung sollte in RINGER-LACTAT-Lösung erfolgen (nicht physiologische NaCl, da bakterizide<br />
Wirkung möglich).<br />
Lagerung <strong>und</strong> tagesgleicher Transport bei Raumtemperatur.<br />
8. Bronchoalveoläre Lavage (BAL)<br />
mit RINGER-LACTAT-Lösung durchführen. Zum Nachweis von Pneumocystis jirovecii, Chlamydia/Mykoplasma<br />
pneumoniae, Legionellen u. a. Keimen. BAL-Flüssigkeit in sterilen Serumröhrchen<br />
verschicken.<br />
Lagerung <strong>und</strong> tagesgleicher Transport bei Raumtemperatur.<br />
9. Ejakulat<br />
Direkt nach Gewinnung in steriles Röhrchen einbringen, bei Raumtemperatur transportieren.<br />
Bei längerer Lagerung (über Nacht) bei 4°C aufbewahren.<br />
10. Urin:<br />
10–20 ml Morgenurin (Erststrahl!) für Chlamydia trachomatis-Diagnostik in sterilem Becher auffangen.<br />
10 ml in Urinmonovette (gelber Deckel) oder in Transportröhrchen (oranger Deckel) mit<br />
beiliegender Pipette bis zum Sichtfenster umfüllen).<br />
Transport bei Raumtemperatur. Bei längerer Lagerung (über Nacht) bei 4°C aufbewahren.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 21
3 Molekularbiologie<br />
3.2 Erregerdiagnostik<br />
Adenovirus(W)<br />
Methode: PCR, qualitativ<br />
Indikation: Verdacht auf Adenovirus-Infektion<br />
Probenmaterial: je nach Indikation: Abstrich (Konjunktiva), 5 g Stuhl, 1 ml Liquor, 1 ml resp.<br />
Material, 3 ml EDTA-Blut<br />
Hinweise: Bei direktem Nachweis im Konjunktivalabstrich namentlich meldepflichtiger Erreger.<br />
Kassenleistung nur bei Nachweis aus Liquor!<br />
BK-(Polyoma)-Virus<br />
Methode: PCR, qualitativer <strong>und</strong> quantitativer Nachweis<br />
Indikation: hämorrhagische Zystitis bei immunsupprimierten Patienten (nach Knochenmarktransplantation),<br />
interstitielle Nephritis, Ureterstenose (nach Nierentransplantation).<br />
Probenmaterial: 3 ml EDTA-Blut, 10 ml Urin<br />
Hinweise: Eine Ausscheidung der Viren im Urin wird auch bei über 60% der Patienten mit systemischem<br />
Lupus erythematodes (SLE) beobachtet. Im Gegensatz zu transplantierten Patienten zeigen<br />
SLE-Patienten jedoch in der Regel keine Virämie. Die asymptomatische Ausscheidung der Viren bei<br />
ges<strong>und</strong>en Personen wird mit 0-16% angegeben.<br />
Bordetella pertussis / parapertussis<br />
Methode: PCR, qualitativ<br />
Indikation: Verdacht auf Pertussis<br />
Probenmaterial: tiefer Nasen- oder Rachenabstrich; (Abstrich ohne Transportmedium); bitte im<br />
Versand anfordern)<br />
Hinweise: Die PCR ermöglicht den Nachweis von Bordetella pertussis in sehr frühen als auch sehr<br />
späten Stadien der Infektion. Der Antikörpernachweis ist frühestens am Übergang vom Stadium<br />
catarrhale in das Stadium convulsivum möglich<br />
Borrelia burgdorferi<br />
Methode: PCR<br />
Indikation: Verdacht auf Lyme-Borreliose oder Lyme-Arthritis<br />
Probenmaterial: 1 ml Gelenkpunktat, 1 ml Liquor, Hautbiopsie<br />
Hinweise: Kassenleistung nur bei Nachweis aus Liquor!<br />
22 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Candida albicans(W)<br />
3 Molekularbiologie<br />
Methode: PCR<br />
Indikation: Verdacht auf systemische Candidose<br />
Probenmaterial: 3 ml EDTA-Vollblut, 1 ml Liquor, Abstrich ; (Abstrich ohne Transportmedium);<br />
bitte im Versand anfordern)<br />
Hinweise: Kassenleistung nur bei Nachweis aus Liquor!<br />
Chlamydia trachomatis<br />
Methode: PCR<br />
Indikation: Nachweis einer Chlamydieninfektion bei Zervicitis, Urethritis, Adnexitis, Konjunktivitis,<br />
Prostatitis, Epididymitis; Mutterschaftsvorsorge,Screeninguntersuchung (Frauen bis zum 25.<br />
Lebensjahr)<br />
Probenmaterial: 10–20 ml Morgenurin!! (Anfangsstrahl), Abstrich (Spezialabstrichbesteck auf<br />
Anforderung!), 1 ml Ejakulat<br />
Hinweise: Bitte auf dem Ü-Schein angeben, ob die Untersuchung im Rahmen der MuVo, der<br />
Empfängnisregelung (‘Screening´ für Frauen bis zum 25. Lebensjahr) oder bei V. a. Infektion<br />
durchgeführt werden soll. Gleichzeitiger Nachweis von Neisseria gonorrhoeae aus derselben Probe<br />
möglich<br />
Chlamydia pneumoniae<br />
Methode: PCR<br />
Indikation: Differentialdiagnose der atypischen Pneumonie<br />
Probenmaterial: Sputum, BAL, Trachealsekret<br />
Hinweise: –<br />
Clostridium difficile<br />
Methode: PCR<br />
Indikation: V. a. Antibiotika assoziierte Kolitis oder pseudo-membranöse Kolitis<br />
Probenmaterial: 2 g Stuhl<br />
Hinweise: Nachweis des Toxin A- <strong>und</strong> B-Gens Auf Anforderung Nachweis einer 117 nt Deletion<br />
des tcd C-Gens (molekulargenetischer Hinweis auf Ribotyp O27); Keine Kassenleistung!<br />
Cytomegalie-Virus<br />
Methode: PCR, qualtativer <strong>und</strong> quantitativer Nachweis<br />
Indikation: Nachweis einer CMV-Primärinfektion (besonders in der Gravidität <strong>und</strong> bei Neugeborenen)<br />
oder einer CMV-Reaktivierung (besonders bei Immunsupprimierten) bei Retinitis, Hepatitis,<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 23
3 Molekularbiologie<br />
Pneumonie. Therapiemonitoring einer CMV-Infektion<br />
Probenmaterial: je nach Indikation: 1 ml Fruchtwasser, 0,5 ml fetales EDTA-Blut, 1 ml Liquor, 10<br />
ml Urin, 1 ml respiratorisches Material, 3 ml EDTA-Blut, Kammerwasser, Chorionbiopsie<br />
Hinweise: Kassenleistung nur bei organtransplantierten <strong>und</strong> immunsupprimierten Patienten<br />
EHEC (entero-hämorrhagischer Escherichia coli)<br />
Methode: PCR<br />
Indikation: E. coli-induzierte Diarrhöen, hämolytisch urämisches Syndrom, thrombotische thrombozytopenische<br />
Purpura.<br />
Probenmaterial: –<br />
Hinweise: kein Direktnachweis! Nachweis erfolgt aus Kultur! Nachweis des stx1-, stx2- <strong>und</strong> des<br />
eae-Gens, keine Kassenleistung!<br />
Enteroviren(W): Coxsackie-, ECHO- <strong>und</strong> Polioviren<br />
Methode: PCR<br />
Indikation: seröse Meningitis, unklare Peri-, Myokarditis, akute/chronische Kardiomyopatie,<br />
Enteritis<br />
Probenmaterial: je nach Indikation: 3 ml EDTA-Blut, 1 ml Liquor, Biopsie, Nasopharyngealabstrich<br />
Hinweise: Kassenleistung nur bei Nachweis aus Liquor!<br />
Epstein-Barr-Virus<br />
Methode: PCR, qualitativer <strong>und</strong> quantitativer Nachweis<br />
Indikation: Verdacht auf EBV-Infektion bei Patienten unter Immunsuppression mit Imm<strong>und</strong>efekt,<br />
Verdacht auf EBV-assoziierte Enzephalitis, orale Haarzelleukoplakie, EBV-assoziierte lymphoproliferative<br />
Erkrankungen, EBV-assoziierte neoplastische Erkrankungen (nasopharyngeales Karzinom,<br />
Burkitt-Lymphom), Pfeiffersches <strong>Dr</strong>üsenfieber<br />
Probenmaterial: 3 ml EDTA-Blut, 1 ml Liquor, Trockenabstrich, Biopsiematerial<br />
Hinweise: Der Nachweis von EBV-DNA in den Leukozyten <strong>und</strong> im EDTA-Plasma weist auf eine<br />
produktive Infektion hin. Der alleinige Nachweis in den Leukozyten spricht für einen erhöhten Anteil<br />
EBV-infizierter bzw. transformierter B?Zellen, der zu einer lymphoproliferativen Störung führen<br />
kann. Kassenleistung bei organtransplantierten Patienten<br />
FSME – Virus(W)<br />
Methode: RT-PCR<br />
Indikation: V. a. Infektion mit FSME nach Aufenthalt in Hochendemiegebieten<br />
Probenmaterial: 3 ml EDTA-Blut, 1 ml Liquor,<br />
24 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
3 Molekularbiologie<br />
Hinweise: Die Inkubationszeit beträgt ca. 7 – 14 Tage. Namentlich meldepflichtiger Krankheitserreger.<br />
Kassenleistung nur bei Nachweis aus Liquor!<br />
Hepatitis A – Virus(W)<br />
Methode: PCR, qualitativer Nachweis<br />
Indikation: Verdacht auf akute Hepatitis A, Nachweis der Hepatitis A-Virämie, Umgebungsuntersuchungen<br />
bei Hepatitis A-Ausbrüchen<br />
Probenmaterial: 3 ml EDTA-Blut, 5 g Stuhl, Leberbiopsie (tiefgefroren (-20°C)<br />
Hinweise: keine Kassenleistung!<br />
Hepatitis B – Virus<br />
Methode: PCR, quantitativer Nachweis<br />
Indikation: Bestimmung der Virusmenge ("viral load") des Patienten zur Beurteilung<br />
des Infektionsstatus <strong>und</strong> zur Therapiekontrolle<br />
Probenmaterial: 10 ml EDTA-Blut<br />
Hinweise: Ausnahmekennziffer 32005 (Therapie Hepatitis B+C) oder 32006 (Verdacht auf<br />
meldepflichtige Erkrankung)<br />
Hepatitis B – Virus(W): genotypische Resistenzbestimmung (pol-Gen)<br />
Methode: PCR <strong>und</strong> Sequenzierung<br />
Indikation: Verdacht auf Resistenz gegenüber den eingesetzten Medikamenten zur Therapie einer<br />
HBV-Infektion (Lamivudine, ggf. Adefovir oder andere); bei:Therapieversagen (HBV-Viruslast-<br />
Anstieg unter Therapie) oder Primärinfektion mit ggf. resistenten HBV-Stämmen oder Beginn einer<br />
HBV-Therapie<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweis: vorher bestimmen: Hepatitis B-DNA-Nachweis quantitativ (Voraussetzung für die Resistenztestung:<br />
Viruslast > 2000 IU/ml) Ausnahmekennziffer 32005 (Therapie Hepatitis B+C) oder<br />
32006 (Verdacht auf meldepflichtige Erkrankung)<br />
Hepatitis C – Virus<br />
Methode: RT-PCR, quantitativer Nachweis<br />
Indikation: atypische Verlaufsformen (anti-HCV negativ bei akuter Hepatitis), Prüfung auf Infektiosität,<br />
Voruntersuchung bei geplanter Therapie, Verlaufskontrolle bei Therapie<br />
Probenmaterial: 10 ml EDTA-Blut<br />
Hinweise: Ausnahmekennziffer 32005 (Therapie Hepatitis B+C) oder 32006 (Verdacht auf<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 25
3 Molekularbiologie<br />
meldepflichtige Erkrankung)<br />
Hepatitis C – Genotypisierung<br />
Methode: RT-PCR mit anschließender reverser Dot-Blot Hybridisierung<br />
Indikation: Voruntersuchung bei geplanter Therapie<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Ausnahmekennziffer 32005 (Therapie Hepatitis B+C)<br />
Hepatitis D-Virus(W)<br />
Methode: RT-PCR<br />
Indikation: Verdacht auf Superinfektion einer chronischen Hepatitis B-Infektion<br />
Probenmaterial: 10 ml EDTA-Blut<br />
Hinweise: Ausnahmekennziffer 32006 (Verdacht auf meldepflichtige Erkrankung)<br />
Herpes simplex Typ 1 / 2<br />
Methode: PCR mit anschließender Schmelzkurvenanalyse zur Differenzierung<br />
Indikation: Nachweis einer HSV-Infektion, insbesondere bei akuter ZNS-Erkrankung<br />
Probenmaterial: je nach Indikation: 1 ml Liquor, 3 ml EDTA-Blut, Bläscheninhalt (Trockenabstrich),<br />
Kammerwasser, 1 ml respiratorisches Material<br />
Hinweise: Abstrich ohne Transportmedium; bitte im Versand anfordern. Kassenleistung nur bei<br />
Nachweis aus Liquor!<br />
Humanes Imm<strong>und</strong>efizienz-Virus (HIV)<br />
Methode: RT-PCR, quantitativer Nachweis<br />
Indikation: Verlaufskontrolle bei Therapie<br />
Probenmaterial: 10 ml EDTA-Blut<br />
Hinweise: Therapie der HIV-Infektion Ausnahmekennziffer 32021<br />
HIV-Resistenzbestimmung(W)<br />
Methode: Sequenzierung<br />
Indikation: V. a. Therapieversagen<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Therapie der HIV-Infektion Ausnahmekennziffer 32021<br />
26 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Humanes Papilloma-Virus<br />
3 Molekularbiologie<br />
Methode: PCR<br />
Indikation: V. a. Infektion, Vorsorgeuntersuchung<br />
Probenmaterial: Zervikal-, Urethralabstrich, Biopsiematerial<br />
Hinweise: Differenzierung in:"Low Risk"-Typen: (6, 11, 42, 43, 44); bei positivem<br />
Ergebnis gleichzeitiger Einzelnachweis der Typen 6 <strong>und</strong> 42<br />
"High-Risk"-Typen: (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58; 59; 68); bei positivem<br />
Ergebnis gleichzeitiger Einzelnachweis der Typen 16 <strong>und</strong> 18<br />
Influenza A/B<br />
Methode: RT-PCR<br />
Indikation: Verdacht auf eine Influenza-Infektion, insbesondere bei plötzlich einsetzendem hohen<br />
Fieber, Kopf- <strong>und</strong> Gliederschmerzen, ggf. auch Pneumonie <strong>und</strong> selten Meningoenzephalitits<br />
Probenmaterial: Rachenspülwasser, Nasopharyngealabstrich<br />
Hinweise: Der Nachweis der Influenza A <strong>und</strong> B-RNA erfolgt in einem Reaktionsansatz. Die<br />
Differenzierung erfolgt mittels spezifischer Sonden.<br />
Legionella pneumophila<br />
Methode: PCR<br />
Indikation: Differentialdiagnose der atypischen Pneumonie<br />
Probenmaterial: Sputum, BAL, Trachealsekret<br />
Hinweise: Der Nachweis von Legionellen-DNA im Blut oder Urin ist nur bei Verdacht auf<br />
hämatogene Streuung sinnvoll. Keine Kassenleistung!<br />
Listeria monocytogenes(W)<br />
Methode: PCR<br />
Indikation: V.a. Infektion (z.B. bei Immunsupprimmierten, gelegentlich in Gravidität)<br />
Probenmaterial: 3 ml EDTA-Blut, 1 ml Liquor<br />
Hinweise: Namentlich meldepflichtiger Krankheitserreger (Meldepflicht nur für den direkten<br />
Nachweis aus Blut, Liquor oder anderen normalerweise sterilen Substraten sowie aus Abstrichen von<br />
Neugeborenen). Kassenleistung nur bei Nachweis aus Liquor<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 27
3 Molekularbiologie<br />
Metapneumovirus, humanes Typ A <strong>und</strong> B (hMPV)<br />
Methode: RT-PCR<br />
Indikation: Kindliche Atemwegsinfektionen, atypische Pneumonien (Säuglinge, auch Kinder <strong>und</strong><br />
Erwachsene), Bronchiolitis, Krupp<br />
Probenmaterial: Nasopharyngealabstrich, 1 ml respiratorisches Sekret<br />
Hinweise: gleichzeitiger Nachweis des humanen Parainfluenza- <strong>und</strong> des Respiratory Syncytial-Virus<br />
möglich. Keine Kassenleistung!<br />
MRSA-Direktnachweis (Methilicin-resistenter Staphylococcus aureus)<br />
Methode: PCR<br />
Indikation: Ermittlung des Besiedlungsstatus bei Risikopatienten<br />
Probenmaterial: kombinierter Nasen-Rachenabstrich, W<strong>und</strong>abstrich<br />
Hinweise: Abstrichtupfer ohne Transportmedium für PCR-Nachweis! Nachfolgend zusätzlich Abstrichtupfer<br />
mit Transportmedium verwenden. (ggf. Resistenztestung <strong>und</strong> Typisierung bei positivem<br />
Bef<strong>und</strong>!)<br />
Mycobakterium tuberculosis-Komplex (M. tuberculosis, M. bovis, M.<br />
africanum, M. microti)<br />
Methode: PCR<br />
Indikation: Verdacht auf Tuberkulose<br />
Probenmaterial: je nach Indikation: Sputum, BAL, Biopsie, Urin, Liquor<br />
Hinweise: Direktnachweis aus den dekontaminierten Materialien<br />
Mycobakterien (atypische)<br />
Methode: PCR mit anschließender Dot-Blot Hybridisierung<br />
Indikation: Verdacht auf Tuberkulose<br />
Probenmaterial: –<br />
Hinweise: Die Differenzierung erfolgt mittels PCR <strong>und</strong> anschließender reverser Dot Blot-<br />
Hybridisierung aus einer Flüssigkultur<br />
Mycoplasma pneumoniae<br />
Methode: PCR<br />
Indikation: Verdacht auf M. pneumoniae-Infektion bei atypischer Pneumonie, Bronchitis, Meningoenzephalitis<br />
oder Otitis media<br />
Probenmaterial: Sputum, BAL, Trachealsekret<br />
28 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Hinweise: –<br />
Neisseria gonorrhoe<br />
3 Molekularbiologie<br />
Methode: PCR<br />
Indikation: Verdacht auf Gonorrhoe<br />
Probenmaterial: 10–20 ml Morgenurin!! (Anfangsstrahl); Abstrich (Spezialabstrichbesteck auf<br />
Anforderung!)<br />
Hinweise: Gleichzeitiger Nachweis von Chlamydia trachomatis aus derselben Probe möglich.<br />
Noroviren<br />
Methode: RT-PCR<br />
Indikation: V. a. Gastroenteritis insbesondere bei Säuglingen, Kleinkindern <strong>und</strong> älteren Menschen.<br />
Probenmaterial: 2 g Stuhl<br />
Hinweise: Gleichzeitiger Nachweis von Norovirus Genotyp I <strong>und</strong> II<br />
Parainfluenza (Typ 1-3; 4a, 4b)<br />
Methode: RT-PCR<br />
Indikation: Kindliche Atemwegsinfektionen, atypische Pneumonien (Säuglinge, auch Kinder <strong>und</strong><br />
Erwachsene), Bronchiolitis, Krupp<br />
Probenmaterial: Nasopharyngealabstrich, 1 ml respiratorisches Sekret<br />
Hinweise: gleichzeitiger Nachweis des humanen Metapneumovirus- <strong>und</strong> des Respiratory Syncytial-<br />
Virus möglich. Keine Kassenleistung!<br />
Parodontitis Erreger-Nachweis<br />
Methode: RT-PCR<br />
Indikation: Kindliche Atemwegsinfektionen, atypische Pneumonien (Säuglinge, auch Kinder <strong>und</strong><br />
Erwachsene), Bronchiolitis, Krupp<br />
Probenmaterial: Nasopharyngealabstrich, 1 ml respiratorisches Sekret<br />
Hinweise: gleichzeitiger Nachweis des humanen Metapneumovirus- <strong>und</strong> des Respiratory Syncytial-<br />
Virus möglich. Keine Kassenleistung!<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 29
3 Molekularbiologie<br />
Parvovirus B19(W)<br />
Methode: PCR<br />
Indikation: Verdacht auf eine akute Infektion mit Parvovirus B19 (vor der Serokonversion) bzw.<br />
Nachweis der Parvovirus B19-Trägerschaft bei unklarer hämolytischer Anämie, Arthritis, Gravidität<br />
(erhöhtes Risiko für intrauterinen Fruchttod bzw. Hydrops fetalis)<br />
Probenmaterial: 3 ml EDTA-Blut, 1 ml Liquor, Fruchtwasser<br />
Hinweise: Bei positiven Proben ist eine quantitative Bestimmung der Virusmenge möglich (bitte<br />
Angabe auf dem Anforderungssschein). Die Durchseuchung der Bevölkerung im Erwachsenenalter<br />
ist hoch. Der Nachweis von Parvovirus B19-DNA ist daher ein Hinweis auf eine akute Infektion oder<br />
eine Parvovirus B19-Trägerschaft<br />
Pneumocystis jirivecii<br />
Methode: PCR<br />
Indikation: Verdacht auf Infektion mit P. jirovecii (insbesondere bei interstitieller Pneumonie bei<br />
immunsupprimierten Patienten (auch bereits bei der Entwicklung von trockenem Husten, Fieber oder<br />
Dyspnoe ohne Korrelat im Röntgenbild)<br />
Probenmaterial: Sputum, BAL, Trachealsekret<br />
Hinweise: keine Kassenleistung!<br />
Respiratorisches Syncytial-Virus (Typ A <strong>und</strong> B)<br />
Methode: RT-PCR<br />
Indikation: Kindliche Atemwegsinfektionen, atypische Pneumonien (Säuglinge, auch Kinder <strong>und</strong><br />
Erwachsene), Bronchiolitis, Krupp<br />
Probenmaterial: Nasopharyngealabstrich, 1 ml respiratorisches Sekret<br />
Hinweise: gleichzeitiger Nachweis des humanen Metapneumo- <strong>und</strong> des humanen Parainfluenza-<br />
Virus möglich. Keine Kassenleistung!<br />
Röteln-Virus(W)<br />
Methode: RT-PCR<br />
Indikation: Verdacht auf Rötelnvirus-Infektion, insbesondere in der Schwangerschaft (pränatale<br />
Diagnostik) <strong>und</strong> bei Verdacht auf konnatale Infektion<br />
Probenmaterial: 3 ml EDTA-Blut, 1 ml Liquor, 5 ml Urin, Fruchtwasser, Nasopharyngealsekret,<br />
Bronchialsekret<br />
Hinweise: Anonyme Meldepflicht einer Rötelnembryopathie; sinnvoll ist eine zusätzliche Röteln-<br />
Virus Serologie; keine Kassenleistung!<br />
30 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Toxoplasma gondii(W)<br />
3 Molekularbiologie<br />
Methode: PCR<br />
Indikation: Verdacht Verdacht auf Primärinfektion mit Toxoplasma gondii <strong>und</strong> auffälliger Ultraschalluntersuchung<br />
(Hydrozephalus, intrazerebrale Verkalkungen); Verdacht auf konnatale Toxoplasmose;<br />
Verdacht auf ZNS-Toxoplasmose bei Immunsuppression<br />
Probenmaterial: je nach Indikation: 1 ml Liquor, 3 ml EDTA-Blut, Bronchialsekret, Fruchtwasser<br />
Hinweise: Für die Toxoplasmose-Embryopathie besteht nach IfSG eine Meldepflicht. Kassenleistung<br />
nur bei Nachweis aus Liquor!<br />
Tropheryma whippelii(W)<br />
Methode: PCR<br />
Indikation: Verdacht auf Morbus Whipple bei Diarrhoe, Steatorrhoe, Malabsorptions-Syndrom,<br />
Abdominalschmerzen, Gewichtsverlust, Enteropathische (seronegative) Arthritis, Enteropathische<br />
(seronegative) Sakroiliitis, Fieber, Polyserositis, mesenteriale, retroperitoneale Lymphknotenvergrößerungen,<br />
ggf. Manifestation kardial (z.B. Endokarditis), ggf. Manifestation im ZNS (z.B. Störung<br />
der Oculomotorik)<br />
Probenmaterial: je nach Indikation: 3 ml EDTA-Blut, 2 g Stuhl, Dünndarmbiopsie (tiefgefroren),<br />
Knochenmarkaspirat, 1 ml Liquor, Synovia<br />
Hinweise: Beim Morbus Whipple handelt es sich um eine bakterielle Infektion mit dem nur sehr<br />
schwer anzüchtbaren Bakterium Tropheryma whippelii. Es werden familiäre Häufungen beoabachtet.<br />
Ca. 26 % der Patienten sind zudem HLA-B27 positiv. Die Infektion wird antibiotisch mit einem<br />
liquorgängigen Antibiotikum behandelt. Die zusätzliche Gabe von Interferonen bei nicht eliminierbarem<br />
Erreger wird im Rahmen von Studien evaluiert.<br />
Kassenleistung nur bei Nachweis aus Liquor!<br />
Varizella Zoster-Virus (VZV)<br />
Methode: PCR<br />
Indikation: V. a. Primärinfektion Rezidiv insbesondere bei Immunsuppression: Pneumonie, Meningitis,<br />
Enzephalitis, Keratokonjunktivitis<br />
Probenmaterial: je nach Indikation: 1 ml Liquor, 5 ml EDTA-Blut, Kammerwasser, Bläscheninhalt<br />
Hinweise: Abstrich ohne Transportmedium; bitte im Versand anfordern. Kassenleistung nur bei<br />
Nachweis aus Liquor!<br />
Verotoxin I <strong>und</strong> II (siehe EHEC)<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 31
3 Molekularbiologie<br />
3.3 Humangenetik<br />
alpha1-Antitrypsin-Genotypisierung(U)<br />
Methode: PCR <strong>und</strong> Sequenzierung<br />
Indikation: Ikterus prolongatus bei Neugeborenen, Differentialdiagnose bei Hepatitis <strong>und</strong> Leberfunktionsstörungen<br />
unklarer Genese bei Säuglingen <strong>und</strong> Kleinkindern, Differentialdiagnose bei<br />
Lungenemphysem oder Asthma bei Erwachsenen, Erwachsene mit auffälligen Leberwerten, Hepatitis<br />
oder Leberzirrhose unklarer Genese, Patienten mit klinisch nachgewiesenen a1?Antitrypsin-Mangel<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Kennziffer 32010 (genetisch bedingte Erkrankungen)<br />
Apolipoprotein B 100-Genotypisierung(U)<br />
Methode: PCR mit anschließender Schmelzkurvenanalyse<br />
Indikation: Hypercholesterinämie, Familien-Untersuchung bei bekanntem Apo-B-100-Defekt,<br />
Atherosklerose, Koronare Herzerkrankung<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Die Apo B 100-Genotypisierung sollte immer zusammen mit der LDL-Rezeptor-<br />
Genotypisierung angefordert werden, da der Phänotyp der familiären Hypercholesterinämie auch<br />
durch Mutationen im LDL Rezeptor-Gen hervorgerufen werden kann. Kennziffer 32010 (genetisch<br />
bedingte Erkrankungen)<br />
Apolipoprotein-E-Genotypisierung(U)<br />
Methode: PCR<br />
Indikation: Hereditäre Fettstoffwechselstörungen, präsenile Altersdemenz im ca. 6. Lebensjahrzehnt<br />
ohne Hinweise auf Familiarität<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Kennziffer 32010 (genetisch bedingte Erkrankungen)<br />
BCR/ABL-Translokation (Philadelphia Chromosom)(U)<br />
Methode: PCR<br />
Indikation: Bei chronisch myeloischer Leukämie (CML) als früh diagnostizierbarer Parameter<br />
geeignet. Quantitative Bestimmung zur Verlaufsbeobachtung oder Remissionskontrolle unter Therapie<br />
(z.B. mit Tyrosinkinasehemmer GLIVEC). Prognostischer Aussagewert auch unter ALL.<br />
Probenmaterial: 10 ml EDTA-Blut, 3 ml Knochenmark-EDTA-Blut (Rücksprache mir dem Labor<br />
bzgl. Probentransport!)<br />
Hinweise: Die Translokation ist nicht erblich; es handelt sich um eine somatische Mutation. Nachweis<br />
der BCR/ABL Translokation beweisend für eine Leukämie. Bei CML über 95% BCR/ABL positiv<br />
mit guter Prognose. Bei V.a. CML zusätzliche Karyotypisierung zur Detektion weiterer Aberrationen<br />
(insbesondere bei V.a. Rezidiv!) zwingend indiziert. Negativer Bef<strong>und</strong> muß bei fortbestehendem<br />
klinischen Verdacht (Erstdiagnose u. Remission) kontrolliert werden. Bei Erstdiagnose bzw. V.a.<br />
32 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Rezidiv sollte parallel eine Karyotypisierung an KM-Heparin-Blut erfolgen!<br />
Cystische Fibrose (Mukoviszidose)(W)<br />
3 Molekularbiologie<br />
Methode: PCR <strong>und</strong> Sequenzierung<br />
Indikation: Verdacht auf Cystische Fibrose, insbesondere bei unklarer Lungen- oder Pankreasfibrose,<br />
Samenleiterfehlbildung, auffälliger Schweißtest; männliche Infertilität, Azoospermie<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Stufendiagnostik; telefonische Rücksprache erbeten!Häufigkeit der Erkrankung: ca.<br />
1:1600, Heterozygotenhäufigkeit: ca. 1:20. Die aufgr<strong>und</strong> der veränderten Osmose (gestörte Funkton<br />
der Chloridionenkanälchen) erhöhte exokrine Viskosität führt zur Fibrosierung der betroffenen<br />
Organe. Hohes Risiko für Lungeninfekt <strong>und</strong> Pankreatitis. Ca. 1/3 der Betroffenen mit erhöhtem<br />
Mortalitätsrisiko, teils invasive Therapie notwendig (Transplantation). Minimale Variante der<br />
Erkrankung mit schwerer Fertilitätsstörung aufgr<strong>und</strong> obstruktiver Hypospermie (Kryptozoospermie).<br />
Ausnahmekennziffer 32017<br />
Dihydropyrimidin-Dehydrogenase-Mutation(W)<br />
(DPD Exon 14-Skipping-Mutation)<br />
Methode: PCR mit anschließender Schmelzkurvenanalyse<br />
Indikation: Screening von Patienten vor Gabe von 5-FU<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Anlageträger zeigen einen herabgesetzten metabolischen Abbau 5-FU haltiger Chemotherapeutika.<br />
Ursache ist eine verminderte Dihydropyrimidindehydrogenase-Aktivität aufgr<strong>und</strong> einer<br />
Splicemutation (Exon 14 Skipping) im DPYD-Gen (Häufigkeit: ca. 1:100). Es besteht ein hohes<br />
Risiko für eine lebensgefährliche Toxizität 5-FU haltiger Medikamente für Anlageträger,<br />
die ansonsten diesbezüglich klinisch unauffällig sind. Bei solchen Mutationsträgern sollten entweder<br />
Alternativen zur 5´-Fluorouracil-Behandlung erwogen, oder zumindest vor Therapie eine<br />
pharmakokinetische Untersuchung durchgeführt werden. Kennziffer 32019 (Erkrankungen unter<br />
systemischer Zytostatika-Therapie)<br />
Faktor V-Leiden<br />
Methode: PCR mit anschließender Schmelzkurvenanalyse<br />
Indikation: Bei APC-Resistenz Abklärung einer homo- oder heterozygoten Genmutation. Prognose<br />
eines Thromboserisikos (z. B. bei Verschrei bung oraler Kontrazeptiva)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: 15–40% der heterozygoten Merkmalsträger der Faktor V-Mutation sind zusätzlich heterozygot<br />
für die Faktor II-Mutation. Durch Kombination der Mutationen steigt das Thromboserisiko<br />
nochmals deutlich an. Kennziffer 32011 (Diagnostik der hereditären Thrombophilie)<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 33
3 Molekularbiologie<br />
Faktor II (Prothrombin-Mutation: G20210A)<br />
Methode: PCR mit anschließender Schmelzkurvenanalyse<br />
Indikation: Abklärung einer homo- oder heterozygoten Genmutation. Prognose eines Thromboserisikos<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: s. Faktor V-Leiden. Kennziffer 32011. (Diagnostik der hereditären Thrombophilie)<br />
Familiäres Mittelmeerfieber(U)<br />
Methode: PCR <strong>und</strong> Sequenzierung aller 10 Exons des Marenostrin-Gens<br />
Indikation: Verdacht auf FMF bei rezidivierenden Fieberschüben ohne Baktierennachweis, peritonitischen<br />
Bauchbescherden, akuter Serositis, meist einseitige Pleuritis, Arthralgien, Sacroileitis,<br />
bei Frauen Menstruationsabhängigkeit, selten auch Myositis, Perikarditis, Vaskulitis mit spontaner<br />
Rückbildung nach wenigen Tagen bei Personen mit Herkunft aus dem Mittelmeerraum (vorwiegend<br />
in Familien armenischen, jüdischen oder arabischen Ursprungs)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: FMF wird durch zumeist autosomal rezessiv vererbte Mutationen im Pyrin-Gen auf dem<br />
kurzen Arm von Chromosom 16 verursacht. In Ländern des Mittelmeerraums wird eine Häufigkeit<br />
von 15 % für die Heterozygotenfrequenz angegeben. Die Häufigkeit der Erkrankung beträgt ca.<br />
1:3000. In ca. 70 % der Fälle kann eine Erstmanifestation vor dem 10. Lebensjahr beoabachtet werden.<br />
Jungen sind etwas häufiger betroffen als Mädchen. Eine unbehandelte Erkrankung führt in ca.<br />
4 von 10 Fällen zur sek<strong>und</strong>ären Amyloidose. In der Differentialdiagnostik sind zu berücksichtigen:<br />
chronische Darmerkrankungen (M. Crohn, Colitis ulcerosa), akute abdominelle Erkrankungen<br />
(Galle, Pankreas), akute intermittierende Porphyrie, akute Appendizitis, Rheumatisches Fieber,<br />
Autoimmunerkrankungen (z.B. Rheumatoide Arthritis); Kennziffer 32010<br />
Fruktose-Intoleranz(U) (hereditär)<br />
Methode: PCR <strong>und</strong> Sequenzierung<br />
Indikation: Hypoglykämie, Darmbeschwerden, Übelkeit Erbrechen, Unverträglichkeit von<br />
fruchtzuckerhaltigen Produkten, Verdacht auf Malabsorption, Kinder mit Abdominalbeschwerden,<br />
familiäre Belastung<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Die Fruktose-Intoleranz ist bedingt durch drei Mutationen im Aldolase-B-Gen: A149P,<br />
A174D <strong>und</strong> N334K. Diese führen zu einem Verlust der Enzymfunktion in Niere <strong>und</strong> Leber. Die<br />
Mutationen sind für ca. 95% aller klinischen Fälle in Europa verantwortlich. Nach Aufnahme von<br />
fruktosehaltigen Nahrungsmitteln tritt die entsprechende Symptomatik erstmals bei Säuglingen beim<br />
Übergang auf Breikost oder auf eine saccharosehaltige Folgenahrung auf. Während Erwachsene ohne<br />
Fruktose-Intoleranz 30 g oder mehr Haushaltszucker gut vertragen können, führt diese Menge bei<br />
Fruktose-Intoleranz zu den Symptomen wie z. B. Übelkeit, Erbrechen, Zittern etc. Die Schwelle der<br />
Verträglichkeit ist individuell unterschiedlich. Kennziffer 32010 (genetisch bedingte Erkrankungen)<br />
34 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Hereditäre Hämochromatose<br />
3 Molekularbiologie<br />
(Hfe-Mutation C282Y / H63D)<br />
Methode: PCR mit anschließender Schmelzkurvenanalyse<br />
Indikation: Diagnostik bei Patienten mit Hämochromatose zur Unterscheidung zwischen primärer<br />
<strong>und</strong> sek<strong>und</strong>ärer Hämochromatose. Patienten mit Frühsymptomen einer Hämochromatose. Blutsverwandten<br />
von Hämochromatose-Patienten. Patienten mit chronischer Virushepatitis oder alkoholtoxischer<br />
Leberschädigung.<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Nach derzeitigem Kenntnisstand kann lediglich die homozygote C282Y-Mutation als<br />
genetische Disposition gewertet werden. Zwar finden sich unter Hämochromatosepatienten auch<br />
häufig ” gemischt bzw compo<strong>und</strong> Heterozygote“ (heterozygote C282Y- <strong>und</strong> H63D-Mutation).<br />
Zuverlässige Daten zur klinischen Relevanz dieser genetischen Konstellation liegen allerdings nicht<br />
vor. Patienten mit einer heterozygoten C282Y-Mutation müssen zudem als potentielle Überträger der<br />
Hämochromatose angesehen werden. Kennziffer 32010 (genetisch bedingte Erkrankungen)<br />
HLA B27-Genotypisierung<br />
Methode: PCR<br />
Indikation: akute vordere Uveitis, Morbus Bechterew, Morbus Reiter, postinfektiöse Arthritis<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Kreuzreaktionen von HLA-B27 mit HLA-B7 führen häufig zu falsch positiven HLA-B27<br />
Ergebnissen in der Durchflusszytometrie (Johnson et. al 1985, Human Immunol. 14:134-135). Eine<br />
gleichzeitige Bestimmung mittels Durchflusszytometrie <strong>und</strong> PCR ist nicht möglich! Kennziffer<br />
32010 (genetisch bedingte Erkrankung)<br />
IL28B (rs12979860–Polymorphismus)<br />
Methode: PCR mit anschließender Schmelzkurvenanalyse<br />
Indikation: Wirksamkeit einer HCV-Therapie mit Peg-Interferon/Ribavirin insbesondere bei HCV –<br />
Genotyp 1<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Neben dem HCV-Genotyp spielen auch genetische Varianten des Wirts (sog. "Host<br />
Factors") eine Rolle für die Wirksamkeit der Therapie. Demnach ist der C/T-Polymorphismus<br />
rs12979860 im menschlichen Genom mit der SVR (sog. "Sustained Virological Response")<br />
assoziiert. Patienten mit dem C/C-Genotyp (zwei C-Allele) sprechen besser auf eine<br />
IFN/RBV-Therapie an als Patienten, die das T-Allel tragen. Zudem zeigen C/C-Allel-Träger eine<br />
höhere Rate an Spontanremission der Erkankung. Diese Zusammenhänge wurden vor allem für<br />
Patienten beobachtet, die mit dem HCV-Genotyp 1 infiziert waren.. Ausnahmekennziffer 32005<br />
(Therapie Hepatitis B+C)<br />
Laktose-Intoleranz (primäre) (T/C (-13910) Polymorphismus)<br />
Methode: PCR mit anschließender Schmelzkurvenanalyse<br />
Indikation: V. a. Laktose-Intoleranz, rezidivierende Bauchschmerzen, Durchfälle, Übelkeit, Verdau-<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 35
3 Molekularbiologie<br />
ungstörungen, Kopfschmerzen etc. nach Verzehr von laktosehaltigen Produkten.<br />
Probenmaterial: 3 ml EDTA-Blut, M<strong>und</strong>schleimhaut-Abstrich (Trockenabstrich ohne Transportmedium!)<br />
Abstriche bitte im Versand anfordern<br />
Hinweise: Differentialdiagnostisch sollte eine Milcheiweiß-Allergie ausgeschlossen sein. Eine<br />
Laktose-Intoleranz kann auch in Folge anderer entzündlicher Darmerkrankungen, wie z. B. Morbus<br />
Crohn, Zöliakie, Colitis ulcerosa auftreten (sek<strong>und</strong>äre Laktose-Intoleranz). Kennziffer 32010<br />
(genetisch bedingte Erkrankungen)<br />
LDL-Rezeptor-Mutationsnachweis(U)<br />
Methode: PCR <strong>und</strong> Sequenzierung<br />
Indikation: familiäre Hypercholesterinämie unklarer Genese<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Die LDL-Rezeptor-Genotypisierung sollte immer zusammen mit der Apo B 100-<br />
Genotypisierung angefordert werden, da der Phänotyp der familiären Hypercholesterinämie auch<br />
durch Mutationen im Apo B 100-Gen hervorgerufen werden kann. Kennziffer 32010 (genetisch<br />
bedingte Erkrankungen)<br />
Methylen-Tetrahydrofolat-Reduktase- (MTHFR-) Genotypisierung (C677T <strong>und</strong><br />
A1298C)<br />
Methode: PCR <strong>und</strong> anschließende reverse Dot Blot-Hybridisierung<br />
Indikation: Risikoabklärung für arterielle <strong>und</strong> venöse Thrombosen, Hyperhomocysteinämie<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Die CAT Transition an Position 677 des MTHFR-Gens resultiert in einer thermolabilen<br />
Variante des Enzyms mit bis zu 70% verminderter Aktivität. Bei Patienten, die zusätzlich die Faktor<br />
V-Leiden- oder die Faktor II-(Prothrombin–) Mutation aufweisen, ist das Risiko für venöse Thrombosen<br />
signifikant erhöht. Die A1298C-Transition geht ebenfalls mit einer reduzierten Enzymaktivität<br />
einher. Die klinische Relevanz zeigt sich vor allem bei Vorliegen einer ” Compo<strong>und</strong>“ -Heterozygotie<br />
(A677C / A1298C) bezüglich vaskulärer Erkrankungen, Spontanaborten <strong>und</strong> Neuralrohrdefekten.<br />
Kennziffer 32010 (genetisch bedingte Erkrankungen)<br />
Pankreatitis (hereditär)(U)<br />
Methode: PCR <strong>und</strong> Sequenzierung<br />
Indikation: Verdacht auf hereditärer Pankreatitis im Rahmen der Familienberatung bei gehäuftem<br />
Vorkommen in Familien bzw. Auftreten einer chronischen Pankreatitis im Kindesalter.<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Die Erkrankung wird autosomal dominant mit reduzierter Penetranz vererbt. Die hereditärer<br />
Pankreatitis ist nach der Cystischen Fibrose die zweithäufigste Ursache einer kindlichen<br />
chronischen Pankreatitis. Ursächlich ist in ca. 75 % der Fälle eine Mutation im Trypsinogen-Gen<br />
PRSS1 auf Chromosom 7 (7q35). Über eine Veränderung der Bindungsstelle kann Trypsinogen nicht<br />
mehr inaktiviert werden mit nachfolgend vermehrter Trypsin-Produktion <strong>und</strong> entsprechender Arrosion<br />
36 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
3 Molekularbiologie<br />
des Pankreasgewebes. Die Beschwerden beginnen zumeist vor dem 20. Lebensjahr mit rezidivierenden<br />
Koliken des Abdomens. Es können Calcium- oder Proteinsteine in den Pankreasgängen detektiert<br />
werden. Es besteht neben der Ausbildung einer chronischen Pankreasinsuffizienz eine Neigung zu<br />
Diabetes mellitus <strong>und</strong> Pankreaskarzinom.<br />
Protein C-Genotypisierung(W)<br />
Methode: PCR<br />
Indikation: Diagnosesicherung eines hereditären Protein C-Mangels<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Ausnahmekennziffer 32011 (Thrombophilie)<br />
Protein S-Genotypisierung(W)<br />
Methode: PCR<br />
Indikation: Diagnosesicherung eines hereditären Protein S-Mangels<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Ausnahmekennziffer 32011 (Thrombophilie)<br />
Thiopurin-S-Methyltransferase (Genotypisierung)(U)<br />
Methode: PCR<br />
Indikation: Geplante oder durchgeführte Therapie mit Thiopurinen (Azathioprin, 6-Mercaptopurin,<br />
6-Thioguanin).<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Thiopurine werden als Immunsuppressiva oder auch als Zytostatika eingesetzt. Die<br />
hepatische Metabolisierung erfolgt durch das Enzym Thiopurin-S-Methyltransferase (TPMT), für<br />
deren Aktivität einer große interindividuelle Variabilität besteht. Die Ursache dieser Unterschiede<br />
besteht in einem genetischen Polymorphismus für das TMPT-Gen. Dabei ist ca. jeder 200. bis<br />
300. Patient vollständig TMPT-defizient (deutlich verminderte Enzymaktivität). 10 % der Patienten<br />
zeigen eine deutlich herabgesetzte Enzymaktivität. Ca. 90 % der Patienten haben eine normale<br />
Metabolisierungsrate. Patienten mit verminderter TPMT-Aktivität zeigen regelmäßig nach Gabe<br />
von Thiopurinen schwerwiegende toxische Nebenwirkungen (erhöhte Knochenmark-Toxizität).<br />
Kennziffer 32019 (Erkrankungen unter systemischer Zytostatika-Therapie)<br />
Vitamin D-Rezeptor-<strong>und</strong> Kollagen 1-alpha-1-Polymorphismus(U)<br />
(genetisch bedingtes Osteoporoserisiko)<br />
Methode: PCR mit anschließender Schmelzkurvenanalyse<br />
Indikation: Untersuchung von Kindern bei positiver Familienanamnese zur frühzeitigen Risikoabschätzung<br />
<strong>und</strong> rechtzeitigen Therapieeinleitung. Rechtzeitige Identifizierung des erhöhten Osteoporoserisikos<br />
insesondere bei Frauen um eine frühzeitige Prävention einzuleiten. Frauen mit bekannter<br />
Thrombophilie, zur frühzeitigen Abwägung einer Hormontherapie.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 37
3 Molekularbiologie<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Hinweise: Vitamin D-Rezeptor (VDR)-Polymorphismus: homozygot bb: unauffällig; heterozygot bB:<br />
erhöhtes Risiko; homozygot BB: stark erhöhtes Risiko<br />
Kollagen 1-alpha-1-(Col 1-alpha-1) Polymorphismus: homozygot SS: unauffällig; heterozygot sS:<br />
erhöhtes Risiko, homozygot ss: stark erhöhtes Risiko<br />
Durch die Kombination der jeweiligen Allele lässt sich das individuelle Osteoporoserisiko bestimmen.<br />
Kennziffer 32010 (genetisch bedingte Erkrankungen)<br />
38 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
4 Funktionsteste<br />
Im Rahmen der Durchführung von Funktionstesten müssen detailliert die Testbedingungen (z.B.<br />
Zeitpunkt der Blutentnahmen) auf dem Überweisungsschein vermerkt <strong>und</strong> die Probenröhrchen<br />
entsprechend gekennzeichnet werden.<br />
Nachfolgend Vorschläge zur Durchführung einiger gebräuchlicher Funktionsteste. Die Teste sollten<br />
unter Beachtung der jeweiligen Kontraindikationen durchgeführt werden. Bezüglich Indikation<br />
<strong>und</strong> Dosierung, v.a. bei Kindern, verweisen wir auch auf die entsprechende Fachliteratur.<br />
39
4 Funktionsteste<br />
4.1 ACTH-Test<br />
ACTH-Test bei V.a. NNR-Insuffizienz<br />
Prinzip<br />
Exogenes ACTH stimuliert die Synthese von Cortisol <strong>und</strong> anderen Nebennierensteroiden.<br />
Vorbereitung<br />
Keine Einnahme von Glukokortikosteroiden am Testtag<br />
Testdurchführung frühestens 4 bis 6 Wochen nach Hypophysen-OP, zerebralen Traumata etc.<br />
Testbeginn 8.00 – 10.00 Uhr, Patient sollte nüchtern sein<br />
Material<br />
Cortisol: Serum<br />
ACTH: EDTA-Plasma, gefroren<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutababnahme - 5 Min. Cortisol (ggf. ACTH)<br />
Injektion 0 Min. Erwachsene:<br />
250 µg ACTH i.v.<br />
Kinder:<br />
s. Fachliteratur<br />
Blutabnahme 30 Min. Cortisol<br />
60 Min. Cortisol<br />
Interpretation<br />
Cortisol nach Stimulation:<br />
< 18 µg/dl: insuffiziente Nebennierenfunktion<br />
18 – 25 µg/dl: Graubereich (ggf. Insulinhypoglykämietest)<br />
> 25 µg/dl: suffiziente Nebennierenfunktion<br />
Cortisol basal, morgens:<br />
< 3 µg/dl: Nebenniereninsuffizienz wahrscheinlich<br />
> 11 µg/dl: Nebenniereninsuffizienz unwahrscheinlich<br />
> 18 µg/dl: Nebenniereninsuffizienz ausgeschlossen<br />
ACTH deutlich erhöht: primäre NNR-Insuffizienz<br />
ACTH niedrig normal bis nicht messbar: sek<strong>und</strong>äre NNR-Insuffizienz<br />
40 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
ACTH-Test bei V.a. late-onset adrenogenitales Syndrom<br />
(21-Hydroxylasemangel)<br />
4 Funktionsteste<br />
Prinzip<br />
Exogenes ACTH stimuliert die Synthese von Cortisol <strong>und</strong> anderen Nebennierensteroiden einschließlich<br />
17-OH-Progesteron.<br />
Indikation<br />
V.a. late-onset adrenogenitales Syndrom<br />
Differentialdiagnostische Abklärung bei Frauen mit Oligo-/Amenorrhoe, Hirsutismus, Virilisierung<br />
Vorbereitung<br />
Absetzen von Hormonpräparaten für mindestens 4 Wochen<br />
Testdurchführung nüchtern zwischen 3. <strong>und</strong> 5. Zyklustag<br />
Testbeginn 7.00 – 10.00Uhr<br />
Material<br />
17-OH-Progesteron: Serum<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme - 5 Min. 17-OH-Progesteron<br />
Injektion 0 Min. Erwachsene:<br />
250 µg ACTH i.v.<br />
Kinder:<br />
s. Fachliteratur<br />
Blutabnahme 60 Min. 17-OH-Progesteron<br />
Interpretation<br />
Normales Testergebnis, wenn die Differenz zwischen basalem <strong>und</strong> stimuliertem 17-OH-Progesteron<br />
< 2,5 ng/ml beträgt.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 41
4 Funktionsteste<br />
4.2 Aldosteron-Suppressionstest<br />
Prinzip<br />
Unter Natriumbelastung kommt es zu einer Verminderung der Aldosteronkonzentration bei ges<strong>und</strong>en<br />
Patienten.<br />
Indikation<br />
V.a. primären Hyperaldosteronismus<br />
Vorbereitung<br />
Aldosteronantagonisten sind 4 Wochen, Schleifendiuretika 1 Woche vor dem Test abzusetzen<br />
Ein Absetzen der übrigen Antihypertensiva sollte erwogen werden<br />
Der Patient sollte ab 24.00 Uhr vor dem Test <strong>und</strong> während des Tests Bettruhe einhalten<br />
Eine Überwachung des Blutdruckes ist während des Tests notwendig<br />
Testbeginn 7.00 – 9.00 Uhr<br />
Material<br />
Renin: EDTA-Plasma<br />
Aldosteron: Serum (schneller Transport ins Labor)<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme - 1 Std. Renin, Aldosteron i.v.-Zugang<br />
Infusion 0 Std. Erwachsene:<br />
2 Liter 0,9% NaCl<br />
über 4 St<strong>und</strong>en i.v.<br />
Blutabnahme nach über 4 St<strong>und</strong>en Renin, Aldosteron<br />
Interpretation<br />
Unauffällige Aldosteronproduktion<br />
Aldosteron < 50% des Ausgangswertes<br />
Primärer Hyperaldosteronismus<br />
Aldosteron >= 50 % des Ausgangswertes<br />
Anmerkungen<br />
Sollte die Reninkonzentration vor Testbeginn bereits supprimiert sein oder nach 4 St<strong>und</strong>en nicht<br />
supprimiert sein, ist mit einem falsch negativen Ergebnis zu rechnen.<br />
Der Test weist eine gute Spezifität, dafür eine unzureichende Sensitivität auf.<br />
Insbesondere Patienten mit bilateraler Nebennierenhyperplasie weisen regelmäßig eine unauffällige<br />
Aldosteronsuppresion auf.<br />
42 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
4.3 Arginin-Stimulationstest<br />
4 Funktionsteste<br />
Prinzip<br />
Arginin bewirkt eine Hemmung der Somatostatin-Sekretion, die physiologischerweise die hGH-<br />
(=STH)-Sekretion hemmt.<br />
Indikation<br />
Überprüfung der somatotropen Achse<br />
Unterscheidung zwischen hypothalamischem <strong>und</strong> hypophysärem hGH-Mangel<br />
Vorbereitung<br />
Testdurchführung am liegenden, nüchternen Patienten, Fasten <strong>und</strong> Ruhephasen beachten<br />
Material<br />
STH: Serum<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
- 8 Std. fasten (über Nacht)<br />
- 1 Std. relative Ruhephase<br />
Blutabnahme - 15 Min. STH absolute Ruhephase<br />
Blutabnahme - 1 Min. STH<br />
Injektion 0 Min. Erwachsene:<br />
0,5 g/kg KG Arginin<br />
in 0,9% NaCl über<br />
30 Min. i.v.<br />
(max. 30 g)<br />
Blutabnahme 15 Min. STH<br />
30 Min. STH<br />
45 Min. STH<br />
60 Min. STH<br />
90 Min. STH<br />
120 Min. STH<br />
Interpretation<br />
normal: STH-Anstieg > 10 ng/ml<br />
V.a. hypophysär bedingten STH-Mangel: kein / subnormaler STH-Anstieg (< 10 ng/ml)<br />
V.a. hypothalmisch bedingten STH-Mangel: überschießender STH-Anstieg (> 40 ng/ml)<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 43
4 Funktionsteste<br />
4.4 Calcium-Stimulationstest<br />
Prinzip<br />
Stimulation der Calcitoninsekretion der parafollikulären C-Zellen der Schilddrüse durch Calcium.<br />
Indikation<br />
Medulläres C-Zell-Karzinom (Diagnose <strong>und</strong> postoperative Verlaufskontrolle)<br />
C-Zell-Hyperplasie<br />
Familien-Screening bei familiärem, medullärem Schilddrüsenkarzinom (FMTC) <strong>und</strong> MEN-II<br />
Überwachung RET-positiver Genträger<br />
Vorbereitung<br />
Patient sollte nüchtern sein<br />
Testdurchführung am liegenden Patienten<br />
Probe muss gekühlt abgenommen werden<br />
Material<br />
Calcitonin: Serum, gekühlt<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme - 5 Min. Calcitonin<br />
Injektion 0 Min. Erwachsene:<br />
2,5 mg/kg KG<br />
Calciumgluconat<br />
über 30 Sek. i.v.<br />
Blutabnahme 2 Min. Calcitonin<br />
5 Min. Calcitonin<br />
10 Min. Calcitonin<br />
Interpretation<br />
V.a. C-Zell-Hyperplasie bei Calcitoninanstieg nach Calciumgluconat auf über 100 pg/ml. Der Anstieg<br />
ist geschlechtsspezifisch unterschiedlich: Frauen zeigen einen geringeren Anstieg als Männer.<br />
44 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
4.5 Captopril-Suppressionstest<br />
4 Funktionsteste<br />
Prinzip<br />
Durch die Einnahme von Captopril (ACE-Hemmer) wird die Umwandlung von Angiotensin I in Angiotensin<br />
II <strong>und</strong> damit die Aldosteronfreisetzung unterdrückt. Die Reninproduktion wird gesteigert,<br />
der Aldosteron-Renin-Quotient sinkt. Bei Patienten mit einem Primären Hyperaldosteronismus sinkt<br />
der Quotient nicht.<br />
Indikation<br />
V. a. Primären Hyperaldosteronismus<br />
Vorbereitung<br />
Aldosteronantagonisten sind 4 Wochen, ACE-Hemmer <strong>und</strong> Schleifendiuretika 1 Woche vor dem Test<br />
abzusetzen<br />
Ein Absetzen der übrigen Antihypertensiva sollte erwogen werden<br />
Keine kochsalzarme Diät<br />
Der Patient sollte ab 24.00 Uhr vor dem Test Bettruhe einhalten<br />
Eine stündliche Messung des Blutdrucks während des Tests ist empfehlenswert<br />
Testbeginn 7.00 – 9.00 Uhr<br />
Material<br />
Renin: EDTA-Plasma<br />
Aldosteron: Serum (schneller Transport ins Labor)<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme - 5 Min. Renin, Aldosteron liegend<br />
Einnahme 0 Min. Erwachsene:<br />
25 mg Captopril p.o.<br />
danach sitzende oder<br />
stehende Haltung<br />
Blutabnahme 120 Min. Renin, Aldosteron sitzend<br />
Interpretation<br />
Primärer Hyperaldosteronismus<br />
Aldosteron nach Captopril > 70 % des Basalwertes<br />
Absolutwerte nach Captopril > 150 ng/l<br />
Aldosteron-Renin-Quotient > 16<br />
Normalbef<strong>und</strong><br />
Aldosteron
4 Funktionsteste<br />
4.6 Clonidin-Test<br />
Prinzip<br />
Clonidin stimuliert zentrale alpha2-Rezeptoren <strong>und</strong> bewirkt eine Hemmung der Noradrenalin- <strong>und</strong><br />
Adrenalinsekretion (Katecholaminsekretion eines Phäochromozytoms wird durch Clonidin nicht<br />
beeinflusst).<br />
Indikation<br />
Bestätigungstest bei V.a. Phäochromozytom, wenn Serum-/Urinkatecholamine oder Metanephrine<br />
erhöht sind<br />
Vorbereitung<br />
1 Woche vor dem Test alle zentral wirkenden Antihypertensiva (z.B. Clonidin, alpha-Methyldopa)<br />
absetzen<br />
Beta-Blocker absetzen<br />
Testdurchführung am liegenden Patienten<br />
Fasten <strong>und</strong> Ruhephasen beachten<br />
Venöser Zugang<br />
Monitorüberwachung empfehlenswert, alternativ RR- <strong>und</strong> Frequenzprotokoll<br />
Material<br />
Adrenalin, Noradrenalin: EDTA-Plasma<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
- 12 Std. Bettruhe, fasten<br />
- 30 Min. i.v.-Zugang<br />
Blutabnahme - 5 Min. Adrenalin,<br />
Noradrenalin<br />
Einnahme 0 Min. Erwachsene:<br />
300 µg Clonidin p.o.<br />
Blutabnahme 3 Std. Adreanlin,<br />
Noradrenalin<br />
Interpretation<br />
Ein Abfall der (erhöhten basalen) Katecholaminkonzentration in den Referenzbereich bzw. um mindestens<br />
50 % spricht gegen das Vorliegen eines Phäochromozytoms.<br />
Ein fehlender Abfall oder ein paradoxer Anstieg ist pathologisch.<br />
46 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
4.7 CRH-Test<br />
4 Funktionsteste<br />
Prinzip<br />
Die bolusartige CRH-Injektion stimuliert die hypophysäre ACTH-Freisetzung. ACTH bewirkt die<br />
Freisetzung von Kortisol aus der Nebennierenrinde.<br />
Indikation<br />
V.a. hypophysär bedingte Nebenniereninsuffizienz<br />
DD zwischen sek<strong>und</strong>ärer <strong>und</strong> tertiärer NNR-Insuffizienz<br />
DD zwischen adrenalem, hypophysärem <strong>und</strong> ektopem Cushing-Syndrom<br />
Vorbereitung<br />
Patient sollte nüchtern sein, Ruhephasen beachten<br />
Pausieren eines Hydrokortisonpräparates am Testtag<br />
Test unter Einnahme von Steroidpräparaten (z.B. Prednisolon) nicht sinnvoll<br />
Material<br />
Cortisol: Serum<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
- 2 Std. körperliche Ruhe<br />
Blutabnahme - 15 Min. ACTH, Cortisol<br />
- 1 Min. ACTH, Cortisol<br />
Injektion 0 Min. Erwachsene:<br />
100 µg CRH i.v.<br />
stark adipöse Erw:<br />
2 µg/kg KG CRH i.v.<br />
Kinder:<br />
1 µg/kg KG CRH i.v.<br />
Blutabnahme 5 Min. ACTH, Cortisol<br />
10 Min. ACTH, Cortisol<br />
15 Min. ACTH, Cortisol<br />
30 Min. ACTH, Cortisol<br />
45 Min. ACTH, Cortisol<br />
60 Min. ACTH, Cortisol<br />
90 Min. ACTH, Cortisol<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 47
4 Funktionsteste<br />
Interpretation<br />
Normbereiche für Cortisol <strong>und</strong> ACTH<br />
Cortisol ACTH<br />
8.00 Uhr 5 – 25 µg/dl 5 – 60 ng/l<br />
24.00 Uhr < 5 µg/dl < 10 ng/l<br />
Anstieg im CRH-Test auf > 20 µg/dl 2- bis 4-fach<br />
Primäre NNR-Insuffizienz:<br />
ACTH basal erhöht, ACTH-Ausschüttung erhöht<br />
Cortisol erniedrigt vor <strong>und</strong> nach CRH-Injektion<br />
Sek<strong>und</strong>äre NNR-Insuffizienz (hypophysärer ACTH-Mangel):<br />
ACTH-Anstieg vermindert, Cortisolanstieg vermindert<br />
Tertiäre NNR-Insuffizienz (hypothalamischer CRH-Mangel):<br />
ACTH- Ausschüttung erhöht, Cortisol-Ausschüttung subnormal<br />
Ektopes ACTH-Syndrom / ACTH-produzierendes Makroadenom der Hypophyse:<br />
ACTH basal erhöht, kein ACTH-Anstieg<br />
M. Cushing bei autonomem NNR-Tumor:<br />
ACTH basal erniedrigt, kein ACTH-Anstieg, kein Cortisol-Anstieg<br />
48 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
4.8 Dexamethason-Hemmtest (niedrig dosiert)<br />
4 Funktionsteste<br />
Prinzip<br />
Suppression der hypophysären ACTH-Sekretion durch Dexamethason (Verwendung von Dexamethason<br />
aufgr<strong>und</strong> fehlender Kreuzreaktivität im Immunoassay mit Cortisol).<br />
Indikation<br />
V.a. Hyperkortisolismus (Cushing-Syndrom)<br />
Vorbereitung<br />
Vor Beginn des Tests sollten Barbiturate, Östrogene, Kortikosteroide, ACTH-Präparate, orale<br />
Kontrazeptiva, Phenytoin, Spironolacton <strong>und</strong> Tetrazykline abgesetzt werden.<br />
Material<br />
Cortisol: Serum<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme 8.00 Uhr (Tag 1) Cortisol<br />
Einnahme 23.00 Uhr (Tag 1) Erwachsene:<br />
2 mg Dexamethason<br />
p.o.<br />
Blutabnahme 8.00 Uhr (Tag 2) Cortisol<br />
Interpretation<br />
Cortisol < 3 µg/dl: Cushing-Syndrom mit größter Wahrscheinlichkeit ausgeschlossen.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 49
4 Funktionsteste<br />
4.9 Dexamethason-Hemmtest (hoch dosiert)<br />
Prinzip<br />
Suppression der hypophysären ACTH-Sekretion durch Dexamethason (Verwendung von Dexamethason<br />
aufgr<strong>und</strong> fehlender Kreuzreaktivität im Immunoassay mit Cortisol). Beim zentralen<br />
Cushing-Syndrom gelingt eine Suppression des Serumcortisols nach pharmakologischen Dosen (8<br />
mg) von Dexamethason. Bei Nebennierentumoren oder beim ektopen Cushing-Syndrom bleibt diese<br />
Suppression aus.<br />
Indikation<br />
Differenzierung zwischen adrenalem / ektopem <strong>und</strong> hypophysärem Hypercortisolismus (Cushing-S.)<br />
Vorbereitung<br />
Vor Beginn des Tests sollten Barbiturate, Östrogene, Kortikosteroide, ACTH-Präparate, orale<br />
Kontrazeptiva, Phenytoin, Spironolacton <strong>und</strong> Tetrazykline abgesetzt werden.<br />
Material<br />
Cortisol: Serum<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme 8.00 Uhr (Tag 1) Cortisol<br />
Einnahme 23.00 Uhr (Tag 1) Erwachsene:<br />
8 mg Dexamethason<br />
p.o.<br />
Blutabnahme 8.00 Uhr (Tag 2) Cortisol<br />
Interpretation<br />
Suppression des Cortisols an Tag 2 um mindestens 50%:<br />
hypophysäre / hypothalamische Genese (= zentrales Cushing-Syndrom)<br />
Suppression des Cortisols an Tag 2 um weniger als 50%:<br />
adrenales Cushing-Syndrom oder ektope ACTH-Produktion<br />
50 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
4.10 Dimaval-Test<br />
4 Funktionsteste<br />
Prinzip<br />
Dimaval (Dimercaptopropansulfonsäure, DMPS) bindet an Metallionen um Chelatkomplexe zu<br />
bilden. Diese Komplexe werden dann renal ausgeschieden.<br />
Indikation<br />
V.a. Schwermetallbelastung (Quecksilber (Hg), Kupfer (Cu) oder andere Schwermetalle)<br />
Material<br />
Urin<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Urinabgabe - 5 Min. z.B. Hg, Cu Spontanurin abgeben,<br />
Blase entleeren<br />
Einnahme 0 Min. Erwachsene:<br />
ca. 4 mg<br />
DMPS / kg KG<br />
mit 150 – 200 ml<br />
Wasser p.o.<br />
(100 mg/Kapsel)<br />
Urinabgabe 2 Std. z.B. Hg, Cu Blase entleeren<br />
Gesammelte Urinmenge bitte angeben.<br />
Interpretation<br />
Ein deutlicher Anstieg der Schwermetallkonzentration über den Referenzbereich ist mit einer<br />
Intoxikation vereinbar.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 51
4 Funktionsteste<br />
4.11 D-Xylose-Test<br />
Prinzip<br />
Überprüfung der Resorptionsfähigkeit des proximalen Dünndarms nach oraler D-Xylose-<br />
Belastung. Bei Patienten mit einer verminderten Kohlenhydratresorption steigt die D-Xylose-<br />
Konzentration im Urin bzw. Blut unzureichend an.<br />
Indikation<br />
V. a. verminderte Kohlenhydratresorption im proximalen Dünndarm<br />
Vorbereitung<br />
Der Patient sollte ab 24.00 Uhr vor dem Test eine Nahrungskarenz einhalten<br />
Material<br />
D-Xylose: Natriumfluorid-Blut oder 5 ml eines 5-St<strong>und</strong>en-Sammelurins<br />
Testdurchführung<br />
D-Xylose-Test im Urin<br />
Ablauf Zeitfolge Meßparameter<br />
- 5 Min. Blase entleeren<br />
Einnahme D-Xylose 0 Min. Erwachsene:<br />
25 g D-Xylose mit<br />
ca. 500 ml Wasser p.o.<br />
Kinder:<br />
15 g D-Xylose / qm<br />
Körperoberfläche mit<br />
ca. 300 ml Wasser p.o<br />
Einnahme Wasser 0 – 120 Min. Erwachsene:<br />
ca. 500 ml trinken<br />
Kinder:<br />
ca. 300 ml Wasser<br />
Sammelperiode 0 – 5 Std. Urin sammeln<br />
Urinabgabe 5 Std. D-Xylose Blase entleeren<br />
Eingenommene D-Xylose-Menge sowie gesammelte Urinmenge bitte angeben.<br />
52 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
D-Xylose-Test im Blut<br />
Ablauf Zeitfolge Meßparameter<br />
4 Funktionsteste<br />
Blutabnahme - 5 Min. D-Xylose<br />
Einnahme 0 Min. D-Xylose <strong>und</strong> Wasser:<br />
s.o.<br />
0 – 120 Min. Wasser: s.o.<br />
Blutabnahme 60 Min. D-Xylose<br />
120 Min. D-Xylose<br />
Interpretation<br />
Eine verminderte Konzentration von D-Xylose im Urin (< 4 g Xylose / 5-St<strong>und</strong>en-Sammelurin bzw.<br />
< 16 % der verabreichten Dosis) oder im NaF-Blut (Erwachsene < 200 mg/l) zwei St<strong>und</strong>en nach oraler<br />
Gabe weist auf eine unzureichende intestinale Resorption der Xylose hin.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 53
4 Funktionsteste<br />
4.12 Eisenresorptionstest<br />
Prinzip<br />
Unter oraler Einnahme einer definierten Eisenmenge steigt nach intestinaler Resorption die<br />
Eisenkonzentration im Blut. Bei Patienten mit einem Eisenmangel infolge einer verminderten<br />
intestinalen Resorption steigt die Eisenkonzentration im Blut unzureichend an.<br />
Indikation<br />
V. a. Eisenmangel infolge einer verminderten intestinalen Resorption<br />
Vorbereitung<br />
Der Patient sollte ab 24.00 Uhr vor dem Test eine Nahrungskarenz einhalten<br />
Material<br />
Eisen: Serum<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme - 5 Min. Eisen<br />
Einnahme 0 Min. Erwachsene:<br />
200 mg Eisen<br />
(zweiwertig) p.o.<br />
0 – 60 Min. Nahrungskarenz<br />
Blutabnahme 2 Std. Eisen<br />
4 Std. Eisen<br />
Interpretation<br />
normal<br />
normale Eisenkonzentration nüchtern <strong>und</strong> Anstieg um 30 – 40 % nach Belastung<br />
Eisenmangel(anämie) bei intakter intestinaler Eisenresorption<br />
niedrige Eisenkonzentration nüchtern mit starkem Anstieg auf > 200 µg/dl binnen 2 – 4 St<strong>und</strong>en nach<br />
Belastung<br />
54 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
4.13 Fructose-Belastungstest<br />
4 Funktionsteste<br />
Prinzip<br />
Unter oraler Einnahme einer definierten Fructosemenge steigt nach der Darmresorption die Fructosekonzentration<br />
im Blut. Bei Patienten mit intestinaler Fructoseintoleranz ist der Fructose-Anstieg<br />
im Blut unter der Norm.<br />
Indikation<br />
V.a. intestinale Fructoseintoleranz<br />
Material<br />
Fructose: Natium-Fluorid-Blut<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme -5 Min. Fructose<br />
Einnahme 0 Min. Erwachsene:<br />
1–1,5 g Fructose<br />
pro kg KG mit<br />
150 – 200 ml<br />
Wasser p.o.<br />
Blutabnahme 30 Min. Fructose<br />
60 Min. Fructose<br />
90 Min. Fructose<br />
120 Min. Fructose<br />
Interpretation<br />
normal<br />
Anstieg des Fructosespiegels nach 30 – 60 Minuten um 6-15 mg/dl<br />
Abfall auf Normalwerte nach 120 Minuten<br />
Intestinale Fructoseintoleranz (Malabsorption)<br />
Anstieg des Fructosespiegels nach 30 – 60 Minuten um < 6 mg/dl<br />
Hepatische Fructoseintoleranz (sehr selten)<br />
Anstieg des Fructosespiegels um > 40 mg/dl<br />
Hinweis<br />
Der Fructosebelastungstest ist zur Diagnose der seltenen hepatischen Fructoseintoleranz (Aldolase-<br />
B-Mangel) nicht geeignet, da massive Hypoglykämien auftreten können. In solchen Fällen empfiehlt<br />
sich der Gentest auf Aldolase-B-Mangel (erfaßt ca. 97% aller Fälle).<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 55
4 Funktionsteste<br />
4.14 GHRH-Test<br />
Prinzip<br />
Exogenes Growth Hormone Releasing Hormone (GHRH) bewirkt die Freisetzung von hGH (=STH)<br />
aus dem Hypophysenvorderlappen.<br />
Indikation (limitierte Bedeutung, nicht zur Diagnose des hGH-Mangels geeignet)<br />
Überprüfung der somatotropen Achse<br />
Unterscheidung zwischen hypothalamischem <strong>und</strong> hypophysärem GH-Mangel<br />
Vorbereitung<br />
Testdurchführung am liegenden, nüchternen Patienten, Fasten <strong>und</strong> Ruhephasen beachten<br />
Material<br />
STH: Serum<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
- 8 Std. fasten (über Nacht)<br />
- 1 Std. i.v.-Zugang<br />
relative Ruhephase<br />
Blutabnahme - 15 Min. STH<br />
- 1 Min. STH<br />
Injektion 0 Min. Erwachsene: 1 µg/kg<br />
KG GHRH langsam<br />
i.v. (max. 100 µg)<br />
Blutabnahme 15 Min. STH<br />
30 Min. STH<br />
45 Min. STH<br />
60 Min. STH<br />
90 Min. STH<br />
120 Min. STH<br />
Interpretation<br />
normal<br />
STH-Anstieg > 10 ng/ml<br />
V.a. hypophysär bedingten STH-Mangel<br />
kein / subnormaler STH-Anstieg (< 10 ng/ml)<br />
V.a. hypothalmisch bedingten STH-Mangel<br />
überschießender STH-Anstieg (> 40 ng/ml)<br />
56 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
4.15 Glucagon-Test<br />
4 Funktionsteste<br />
Prinzip<br />
Nach Gabe einer bestimmten Glucagonmenge steigt die Glucosekonzentration im Blut an. Es entsteht<br />
somit eine Stimulation der Insulin- <strong>und</strong> C-Peptid-Sekretion. Beim Insulinom ist die Sekretion von<br />
Insulin <strong>und</strong> C-Peptid inadäquat hoch.<br />
Indikation<br />
V.a. Insulinom<br />
Vorbereitung<br />
Testdurchführung nüchtern nach Nahrungskarenz von 10 – 14 St<strong>und</strong>en<br />
Absetzen von diabetogenen <strong>und</strong> antidiabetogenen Medikamenten<br />
Der Test sollte nicht perimenstruell erfolgen<br />
Die Ernährung der letzten 3 Tage sollte kohlenhydratreich sein<br />
Keine körperliche Belastung während der Wartephasen<br />
Material<br />
Insulin, C-Peptid: Serum<br />
Glucose: Natrium-Fluorid-Plasma<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme - 5 Min. Insulin, C-Peptid,<br />
Glucose<br />
vormittags<br />
Injektion 0 Min. Erwachsene:<br />
1 mg Glucagon<br />
in 10 ml 0,9% NaCl<br />
als Bolus i.v.<br />
Blutabnahme 5 Min. Insulin, C-Peptid,<br />
Glucose<br />
10 Min. Insulin, C-Peptid,<br />
Glucose<br />
15 Min. Insulin, C-Peptid,<br />
Glucose<br />
30 Min. Insulin, C-Peptid,<br />
Glucose<br />
Interpretation<br />
Anstieg der Insulinkonzentration > 100 µIE/ml oder der C-Peptid-Konzentration > 2,5 ng/ml spricht<br />
mit einer geringen Sensitivität von 50-80% für einen Insulinom.<br />
Hinweis<br />
Aufgr<strong>und</strong> der reduzierten Aussagekraft <strong>und</strong> der geringen Sensitivität wird der Test nur selten<br />
eingesetzt. Der Standardtest für die Insulinomdiagnostik ist der Hungerversuch.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 57
4 Funktionsteste<br />
4.16 Glucose-Suppressionstest<br />
Prinzip<br />
Unter oraler Einnahme einer bestimmten Glucosemenge steigt die Blutglucosekonzentration. Bei<br />
ges<strong>und</strong>en Patienten wird die Sekretion des Somatotropen Hormons (STH, hGH) dadurch inhibiert.<br />
Indikation<br />
V.a. Akromegalie<br />
Vorbereitung<br />
Der Patient sollte ab 24.00 Uhr vor dem Test eine Nahrungskarenz einhalten<br />
3 Tage vor dem Test ist eine kohlenhydratreiche Ernährung einzuhalten<br />
Muskelanstregung oder Rauchen sollte während des Tests vermieden werden<br />
Material<br />
STH: Serum<br />
Glucose: Natrium-Fluorid-Plasma<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme - 5 Min. STH, Glucose vormittags<br />
Einnahme 0 Min. Erwachsene: 75 g Glucose<br />
in 250 – 350 ml<br />
Lösung über 5 Min.<br />
p.o.<br />
Kinder: 1,75 g / kg KG<br />
Glucose (max. 75g) in<br />
250 – 350 ml Lösung<br />
p.o.<br />
Blutabnahme 30 Min. STH, Glucose<br />
60 Min. STH, Glucose<br />
90 Min. STH, Glucose<br />
120 Min. STH, Glucose<br />
Interpretation<br />
normal<br />
STH-Konzentration von höchstens 1 ng/ml innerhalb von 60 Minuten<br />
Akromegalie<br />
STH-Konzentration bei Testbeginn erhöht <strong>und</strong> unzureichende Senkung der STH-Konzentration im<br />
Testverlauf<br />
Anmerkung<br />
Eine unzureichende Senkung der STH-Konzentration kommt auch z.B. bei Niereninsuffizienz,<br />
Cushing-Syndrom, Diabetes mellitus, Stress sowie Lebererkrankungen vor.<br />
58 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
4.17 Helicobacter pylori-Atemtest<br />
4 Funktionsteste<br />
Prinzip<br />
Oral aufgenommener C13-markierter Harnstoff wird durch die Helicobacter pylori-Urease im Magen<br />
zu 13CO2 metabolisiert, wodurch der Anteil an C13-Kohlendioxid in der Ausatemluft steigt.<br />
Indikation<br />
V.a. Helicobacter pylori-Besiedlung<br />
Z.n. Eradikationstherapie (frühestens 4 Wochen nach Therapieende)<br />
Vorbereitung<br />
Der Patient sollte ab 24.00 Uhr vor dem Test eine Nahrungskarenz einhalten<br />
Material<br />
Doppelkammerbeutel<br />
Testdurchführung<br />
Ablauf Zeitfolge<br />
Atemprobe - 5 Minuten vormittags<br />
Einnahme 0 Minuten 75 mg C13-Harnstoff in 200 ml<br />
Orangen-/Apfelsaft über 5 Min.<br />
p.o.<br />
Atemprobe 30 Minuten<br />
Interpretation<br />
negativ<br />
Delta-Wert bis 2,4 Promille<br />
grenzwertig<br />
Delta-Wert 2,5 – 3,9 Promille<br />
positiv<br />
Delta-Wert ab 4,0 Promille<br />
Bei Patienten, die in den letzten 4 Wochen mit H-Blocker, PPI oder Antibiotika behandelt<br />
wurden, sprechen grenzwertige Ergebnisse für eine Helicobacter pylori-Besiedelung.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 59
4 Funktionsteste<br />
4.18 Insulinhypoglykämie-Test<br />
Insulinhypoglykämie-Test bei V.a. adrenocorticotrope Insuffizienz<br />
Prinzip<br />
Die insulininduzierte Hypoglykämie bewirkt ein Freisetzung von Stresshormonen wie ACTH,<br />
Cortisol <strong>und</strong> GH über die hypothalamo-hypophysär-glandotrope Achse.<br />
Vorbereitung<br />
Testdurchführung am nüchternen Patienten<br />
Ärztliche Präsenzpflicht während des gesamten Tests<br />
Venöser Zugang (Anlage zweier Venenverweilkanülen seitengetrennt empfehlenswert)<br />
40%ige Glucoselösung aufgezogen bereitlegen<br />
Engmaschige BZ-Überwachung (alle 5-10 Min.), z.B. mittels Hemocue<br />
Material<br />
Cortisol: Serum<br />
ACTH: EDTA-Plasma, gefroren<br />
Glucose: s.o., ggf. zusätzlich NaF-Blut<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
- 8 Std. fasten<br />
Blutabnahme - 15 Min. ACTH, Cortisol<br />
(Glucose)<br />
i.v.-Zugang<br />
Injektion 0 Min. Erwachsene:<br />
0,1 – 0,15 IE/kg KG<br />
Insulin i.v.,<br />
Kinder:<br />
s. Fachliteratur<br />
Blutabnahme 30 Min. ACTH, Cortisol<br />
(Glucose)<br />
60 Min. ACTH, Cortisol<br />
(Glucose)<br />
90 Min. ACTH, Cortisol<br />
(Glucose)<br />
120 Min. ACTH, Cortisol<br />
(Glucose)<br />
Interpretation<br />
normal:<br />
Cortisol-Anstieg > 20 µg/dl<br />
ACTH-Anstieg > 150 pg/ml<br />
Der Test ist nur bei ausreichendem Hypoglykämie-Stimulus aussagekräftig.<br />
60 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Insulinhypoglykämie-Test bei V.a. somatotrope Insuffizienz<br />
4 Funktionsteste<br />
Prinzip<br />
Die insulininduzierte Hypoglykämie bewirkt ein Freisetzung von Stresshormonen wie ACTH,<br />
Cortisol <strong>und</strong> GH über die hypothalamo-hypophysär-glandotrope Achse.<br />
Vorbereitung<br />
Testdurchführung am nüchternen Patienten<br />
Ärztliche Präsenzpflicht während des gesamten Tests<br />
Venöser Zugang (Anlage zweier Venenverweilkanülen seitengetrennt empfehlenswert)<br />
40%ige Glucoselösung aufgezogen bereitlegen<br />
Engmaschige BZ-Überwachung (alle 5-10 Min.) mittels Hemocue oder anderem<br />
qualitätskontrolliertem BZ-Messgerät<br />
Material<br />
STH: Serum<br />
Glucose: s.o., ggf. zusätzlich NaF-Blut<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
- 8 Std. fasen<br />
Blutabnahme - 15 Min. STH (Glucose) i.v.-Zugang<br />
- 1 Min. STH (Glucose)<br />
Injektion 0 Min. Erwachsene:<br />
0,1 – 0,15 IE/kg KG<br />
Insulin i.v.,<br />
Kinder:<br />
s. Fachliteratur<br />
Blutabnahme 15 Min. STH (Glucose)<br />
30 Min. STH (Glucose)<br />
45 Min. STH (Glucose)<br />
60 Min. STH (Glucose)<br />
90 Min. STH (Glucose)<br />
120 Min. STH (Glucose)<br />
Interpretation<br />
normal: STH-Anstieg > 10 ng/ml nach 30 – 60 Minuten<br />
V.a. hypophysär bedingten STH-Mangel: kein /subnormaler STH-Anstieg (< 10 ng/ml)<br />
V.a. hypothalamisch bedingten STH-Mangel: überschießender STH-Anstieg (> 40 ng/ml)<br />
Der Test ist nur bei ausreichendem Hypoglykämie-Stimulus aussagekräftig. Nach der deutschen<br />
Gesellschaft für Endokrinologie ist die Bestätigung durch mindestens einen weiteren Stimulationstest<br />
mit anderem Stimulus (z.B. Arginin) zu empfehlen.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 61
4 Funktionsteste<br />
4.19 Lactose-Belastungstest<br />
Prinzip<br />
Lactose wird im Dünndarm durch Lactase in Glucose <strong>und</strong> Galactose gespalten. Unter oraler Einnahme<br />
einer definierten Lactosemenge steigt nach Glucoseresorption im Dünndarm die Blutglucosekonzentration<br />
an. Bei Patienten mit Lactoseintoleranz bzw. Lactasemangel wird die Lactose nicht gespalten<br />
<strong>und</strong> nicht aufgenommen.<br />
Indikation<br />
V.a. Lactoseintoleranz<br />
Vorbereitung<br />
Der Patient sollte ab 24.00 Uhr vor dem Test eine Nahrungskarenz einhalten<br />
Material<br />
Glucose: Natrium-Fluorid-Plasma<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme -5 Minuten Glucose vormittags<br />
Einnahme 0 Minuten Erwachsene:<br />
50 g Lactose<br />
in 400 ml Wasser<br />
über 5 Min. p.o.<br />
Kinder ab 2 Jahre:<br />
2 g / kg KG<br />
Lactose p.o.<br />
(max. 100 g)<br />
Blutabnahme 30 Minuten Glucose<br />
60 Minuten Glucose<br />
90 Minuten Glucose<br />
120 Minuten Glucose<br />
Interpretation<br />
normal<br />
Anstieg der Blutglucosekonzentration von mehr als 20 mg/dl über den Nüchternwert<br />
V.a. Lactasemangel, z.B. bei Lactoseintoleranz oder Zöliakie<br />
Geringer Anstieg<br />
62 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
4.20 LHRH-Test (GnRH-Test)<br />
4 Funktionsteste<br />
Prinzip<br />
Die bolusartige Injektion von LHRH stimuliert die Freisetzung von LH <strong>und</strong> FSH aus dem HVL.<br />
Indikation<br />
Differenzierung zwischen hypothalamischem <strong>und</strong> hypophysärem Hypogonadismus<br />
Differenzierung zwischen konstitutioneller Entwicklungsverzögerung <strong>und</strong> hypogonadotropem<br />
Hypogonadismus<br />
Differenzierung zwischen Pubertas praecox vera, Pseudopubertas praecox <strong>und</strong><br />
prämaturer Pub-/Thelarche<br />
Hyperandrogenämische Ovarialinsuffizienz<br />
Abklärung bei Amenorrhoe<br />
Fertilitätsdiagnostik bei unerfülltem Kinderwunsch<br />
Vorbereitung<br />
Männer:<br />
Testosteronpräparat je nach Wirkdauer ausreichend lange absetzen<br />
Frauen:<br />
Hormonpräparat je nach Wirkdauer ausreichend lange absetzen<br />
Optimaler Testzeitpunkt: 3. – 5. Zyklustag<br />
Material<br />
LH, FSH: Serum<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme - 5 Min. LH, FSH i.v.-Zugang<br />
Injektion 0 Min. Erwachsene:<br />
100 µg LHRH i.v.<br />
Kinder:<br />
s. Fachliteratur<br />
(mind. 25 µg,<br />
max. 100 mg LHRH)<br />
Blutabnahme 30 Min. LH, FSH<br />
45 Min. LH, FSH<br />
60 Min. LH, FSH<br />
90 Min. LH, FSH<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 63
4 Funktionsteste<br />
Interpretation<br />
Normalbef<strong>und</strong><br />
Anstieg nach LHRH<br />
Männer: LH > 2- bis 4-fach, FSH > 2-fach<br />
Frauen: LH > 3- bis 4-fach, FSH > 2- bis 3-fach<br />
Hypophysendefekt bzw. hypothalamische Hypophysenstörung, hypogonadotroper Hypogonadismus:<br />
Kein oder verminderter LH-/FSH-Anstieg.<br />
Hyperandrogenämische Ovarialinsuffizienz:<br />
Überschießender LH-Anstieg bei häufig bereits basal erhöhten LH-Werten.<br />
Hinweise<br />
Auf alters- bzw. pubertätsabhängige Referenzbereiche wird explizit hingewiesen.<br />
Sinnvoll kann die zusätzliche Bestimmung von Östradiol bei der Frau <strong>und</strong> von Testosteron beim<br />
Mann sein.<br />
Bei bekannt erhöhten LH- / FSH-Basalwerten ist ein GnRH-Test in der Regel entbehrlich.<br />
Der Test ist bei negativem Ergebnis (kein LH- / FSH-Anstieg) nach einwöchiger pulsatiler<br />
GnRH-Gabe (= Priming) zu wiederholen, um definitiv zwischen hypothalamisch (LH- / FSH-Anstieg<br />
dann nachweisbar) <strong>und</strong> hypophysär (LH- / FSH-Anstieg auch dann nicht nachweisbar) bedingtem<br />
Hypogonadismus zu unterscheiden.<br />
64 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
4.21 Metoclopramid-Test<br />
4 Funktionsteste<br />
Prinzip<br />
Die Regulation der Prolactinsekretion erfolgt v.a. über inhibitorische Einflüsse des Dopamins. Der<br />
Dopamin-Antagonist Metoclopramid bewirkt eine disinhibitorische Prolactin-Ausschüttung.<br />
Indikation<br />
V.a. latente Hyperprolactinämie<br />
Vorbereitung<br />
Testdurchführung zwischen 8.00 <strong>und</strong> 18.00 Uhr (zirkadiane Rhythmik)<br />
Optimaler Testzeitpunk: Mitte der Lutealphase<br />
Patient sollte nüchtern sein<br />
Stressfreie Rahmenbedingungen<br />
Keine Mammapalpation vor Testdurchführung<br />
Einnahme von Medikamenten, die den Prolactinspiegel beeinflussen, überprüfen<br />
Bei Patienten unter Therapie mit hohen Biotin-Dosen (> 5 mg/Tag) sollte die Probenentnahme<br />
mindestens 8 St<strong>und</strong>en nach der letzten Applikation erfolgen<br />
Material<br />
Prolactin: Serum<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme - 5 Min. Prolactin 8.00-18.00 Uhr,<br />
nüchtern<br />
Injektion 0 Min. Erwachsene: 10 mg<br />
Metoclopramid i.v.<br />
Blutabnahme 30 Min. Prolactin<br />
45 Min. Prolactin<br />
60 Min. Prolactin<br />
Interpretation<br />
normal:<br />
Prolactin-Anstieg nach MCP: 4000 – 9000 mIU/l<br />
V.a. latente Hyperprolactinämie:<br />
überschießender Prolactinanstieg bei normalen Basalwerten<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 65
4 Funktionsteste<br />
4.22 Oraler Glucosetoleranztest (OGTT)<br />
Oraler Glucosetoleranztest bei V.a. Diabetes mellitus<br />
Prinzip<br />
Unter oraler Einnahme einer definierten Glucosemenge steigt die Blutglucosekonzentration physiologischerweise<br />
in bestimmten Grenzen an. Bei Patienten mit Diabetes mellitus bzw. seinen Vorstufen<br />
kommt es zu einem überschießenden Glucoseanstieg.<br />
Indikation<br />
V.a. Diabetes mellitus bzw. seine Vorstufen<br />
Vorbereitung nach WHO-Richtlinien<br />
Der Patient sollte ab 24.00 Uhr vor dem Test eine Nahrungskarenz einhalten<br />
3 Tage vor dem Test ist eine kohlenhydratreiche Ernährung einzuhalten<br />
Muskelanstregung oder Rauchen sollte während des Tests vermieden werden<br />
Material<br />
Glucose: Natrium-Fluorid-Plasma<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme - 5 Min. Glucose vormittags<br />
Einnahme 0 Min. 75 g Glucose (Kinder:<br />
1,75 g / kg KG, max<br />
75g) in 250 – 350 ml<br />
Lösung über 5 Min.<br />
p.o.<br />
Blutabnahme 120 Min. Glucose<br />
Interpretation<br />
Stadium Nüchtern-Plasma-Glucose<br />
venös<br />
normal < 100 mg/dl < 140 mg/dl<br />
OGTT 2-St<strong>und</strong>en-Wert<br />
abnorme Nüchtern-Glucose gestörte Glucosetoleranz<br />
100 – 125 mg/dl 140 – 199 mg/dl<br />
Diabetes > 125 mg/dl > 199 mg/dl<br />
66 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Oraler Glucosetoleranztest bei V.a. Gestationsdiabetes<br />
4 Funktionsteste<br />
Prinzip<br />
Unter oraler Einnahme einer definierten Glucosemenge steigt die Blutglucosekonzentration<br />
physiologischerweise in bestimmten Grenzen an. Bei Schwangeren mit Diabetes mellitus bzw.<br />
Gestationsdiabetes kommt es zu einem überschießenden Glucoseanstieg.<br />
Indikation<br />
V.a. Diabetes mellitus bzw. Gestationsdiabetes<br />
Screening auf Gestationsdiabetes in der 24. – 28. SSW.<br />
Vorbereitung nach WHO-Richtlinien<br />
Die Patientin sollte ab 24.00 Uhr vor dem Test eine Nahrungskarenz einhalten<br />
3 Tage vor dem Test ist eine kohlenhydratreiche Ernährung einzuhalten<br />
Muskelanstregung oder Rauchen sollte während des Tests vermieden werden<br />
Material<br />
Glucose: Citrat-NaF-Blut (GlucoEXACT) oder Natrium-Fluorid-Plasma<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme - 5 Min. Glucose vormittags<br />
Einnahme 0 Min. 75 g Glucose in 250 –<br />
350 ml Lösung p.o.<br />
Blutabnahme 60 Min. Glucose<br />
120 Min. Glucose<br />
Interpretation<br />
Gestationsdiabetes<br />
Nüchternglukose > 91mg/dl<br />
oder<br />
1-St<strong>und</strong>en-Glukose > 179 mg/dl<br />
oder<br />
2-St<strong>und</strong>en-Glukose > 152 mg/dl<br />
Diabetes mellitus<br />
Nüchternglukose > 125 mg/dl, eine Zweitmessung ist angezeigt<br />
oder<br />
2-St<strong>und</strong>en-Glukose > 199 mg/dl<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 67
4 Funktionsteste<br />
Oraler Glucosetoleranztest, Vortest bei Schwangeren<br />
Prinzip<br />
Unter oraler Einnahme einer definierten Glucosemenge steigt die Blutglucosekonzentration<br />
physiologischerweise in bestimmten Grenzen an. Bei Schwangeren mit Diabetes mellitus bzw.<br />
Gestationsdiabetes kommt es zu einem überschießenden Glucoseanstieg.<br />
Indikation<br />
Kann als Vortest beim Screening auf Gestationsdiabetes in der 24. – 28. SSW. eingesetzt werden.<br />
Vorbereitung<br />
Keine besondere Vorbereitung<br />
Material<br />
Glucose: Citrat-NaF-Blut (GlucoEXACT) oder Natrium-Fluorid-Plasma<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Einnahme 0 Min. 50 g Glucose in 200 ml<br />
Lösung p.o.<br />
Blutabnahme 60 Min. Glucose<br />
Interpretation<br />
positives Screening<br />
1-St<strong>und</strong>en-Glucose > 134 mg/dl<br />
bei positivem Screening sollte der 75-g oGTT durchgeführt werden<br />
68 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
4.23 Orthostase-Test<br />
4 Funktionsteste<br />
Prinzip<br />
Beim Aufrichten aus der liegenden in die stehende Körperhaltung, kommt es bei ges<strong>und</strong>en Personen<br />
sowie bei Personen mit einem idiopatischen Hyperaldosteronismus zu einer Renin- <strong>und</strong> Aldosteronausschüttung.<br />
Bei Personen mit einem aldosteronproduzierenden Adenom (Conn-Syndrom)<br />
bleibt die Reninsekretion supprimiert.<br />
Indikation<br />
Differentierung zwischen idiopathischem Hyperaldosteronismus <strong>und</strong> anderen Formen des primären<br />
Hyperaldosternoismus<br />
Vorbereitung<br />
Aldosteronantagonisten sind 4 Wochen, Schleifendiuretika 1 Woche vor dem Test abzusetzen<br />
Absetzen der übrigen Antihypertensiva sollte erwogen werden<br />
Eventuell bestehende Hypokaliämie ausgleichen<br />
Der Patient sollte ab 24.00 Uhr vor dem Test Bettruhe einhalten<br />
Material<br />
Renin: EDTA-Plasma<br />
Aldosteron, Cortisol: Serum (schneller Transport ins Labor)<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
- 30 Min. i.v.-Zugang<br />
Blutabnahme - 5 Min. Renin, Aldosteron, 7.00 – 9.00 Uhr,<br />
Cortisol<br />
liegende Position<br />
Orthostase 0 Min. – 120 Min. Spazierengehen,<br />
aufrechte<br />
Körperhaltung<br />
Blutabnahme 120 Min. Renin, Aldosteron,<br />
Cortisol<br />
Interpretation<br />
Aldosteronproduzierendes Adenom (Conn-Syndrom)<br />
Aldosteronkonzentration gleichbleibend / abnehmend<br />
Reninkonzentration zunehmend<br />
Cortisolkonzentration abnehmend<br />
Andere Konstellationen sind nicht eindeutig zuzuordnen<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 69
4 Funktionsteste<br />
4.24 Pentagastrin-Stimulationstest<br />
Prinzip<br />
Stimulation der Calcitoninsekretion der parafollikulären C-Zellen der Schilddrüse durch Pentagastrin<br />
(synthetisches Gastrin-Analogon).<br />
Indikation<br />
Medulläres C-Zell-Karzinom (Diagnose <strong>und</strong> postoperative Verlaufskontrolle)<br />
C-Zell-Hyperplasie<br />
Familien-Screening bei familiärem, medullärem Schilddrüsenkarzinom (FMTC) <strong>und</strong> MEN-II<br />
Vorbereitung<br />
Pentagastrin ist in Deutschland nicht erhältlich (kann über die Auslandsapotheke bezogen werden)<br />
Patient sollte nüchtern sein, Testdurchführung am liegenden Patienten<br />
Kreatininwert des Patienten sollte bekannt sein<br />
Probe muss gekühlt abgenommen werden<br />
Testdurchführung in Anwesenheit eines Arztes <strong>und</strong> einer Notfallausrüstung<br />
Material<br />
Calcitonin: Serum, gekühlt<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme - 5 Min. Calcitonin nüchtern, liegend<br />
Injektion 0 Min. Erwachsene:<br />
0,5 µg/kg KG<br />
Pentagastrin über<br />
5 Min. i.v.<br />
Blutabnahme 2 Min. Calcitonin<br />
5 Min. Calcitonin<br />
10 Min. Calcitonin<br />
Interpretation<br />
normal:<br />
Calcitoninanstieg nach Pentagastrin bei 95% der Normalpersonen auf maximal < 30 pg/ml. Der<br />
Anstieg ist geschlechtsspezifisch unterschiedlich: Frauen zeigen einen geringeren Anstieg als Männer.<br />
Calcitoninanstieg > 100 pg/ml: medulläres Schilddrüsenkarzinom wahrscheinlich<br />
Calcitoninanstieg zwischen 30 <strong>und</strong> 100 pg/ml: häufig bei Patienten mit vorhandener familiärer<br />
RET-Mutation, mit einer C-Zell-Hyperplasie oder einem Mikrokarzinom vereinbar<br />
Der Pentagastrintest wird aufgr<strong>und</strong> seiner unangenehmen Nebenwirkungen <strong>und</strong> der Tatsache,<br />
dass keine zuverlässigen Referenzbereiche für Kinder existieren, zunehmend durch molekulargenetische<br />
Untersuchungs-methoden (Nachweis von Mutationen des RET-Protoonkogens) ersetzt.<br />
70 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
4.25 TRH-Test<br />
TRH-Test bei V.a. latente Hyperprolactinämie<br />
4 Funktionsteste<br />
Prinzip<br />
Exogenes Thyreotropin Releasing Hormone (TRH) bewirkt u.a. eine Prolactin-Sekretion des Hypophysenvorderlappens<br />
Indikation<br />
V.a. latente Hyperprolactinämie<br />
Vorbereitung<br />
Testdurchführung zwischen 8.00 <strong>und</strong> 18.00 Uhr (zirkadiane Rhythmik)<br />
Patient sollte nüchtern sein<br />
Stressfreie Rahmenbedingungen<br />
Keine Mammapalpation vor Testdurchführung<br />
Einnahme von Medikamenten, die den Prolactinspiegel beeinflussen, überprüfen<br />
Bei Patienten unter Therapie mit hohen Biotin-Dosen (> 5 mg/Tag) sollte die Probenentnahme<br />
mindestens 8 St<strong>und</strong>en nach der letzten Applikation erfolgen<br />
Material<br />
Prolactin: Serum<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßparameter<br />
Blutabnahme - 5 Min. Prolactin 8.00-18.00 Uhr,<br />
nüchtern<br />
Injektion 0 Min. Erwachsene:<br />
200 µg TRH i.v.<br />
Blutabnahme 30 Min. Prolactin<br />
45 Min. Prolactin<br />
60 Min. Prolactin<br />
Interpretation<br />
normal:<br />
Prolactin-Anstieg nach TRH: 2000 – 4000 mIU/l<br />
V.a. latente Hyperprolactinämie:<br />
überschießender Prolactin-Anstieg bei normalen Basalwerten<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 71
4 Funktionsteste<br />
TRH-Test bei V.a. sek<strong>und</strong>äre / tertiäre Hypothyreose<br />
Prinzip<br />
Exogenes Thyreotropin Releasing Hormone (TRH) bewirkt bei intaktem Regelkreis einen Anstieg<br />
von TSH aus dem Hypophysenvorderlappen.<br />
Indikation (strenge Indikationsstellung)<br />
V.a. sek<strong>und</strong>äre oder tertiäre Hypothyreose<br />
Vorbereitung<br />
Patient sollte liegen<br />
Material<br />
TSH: Serum<br />
Testdurchführung<br />
Ablauf Zeitfolge Meßgröße<br />
Blutabnahme - 5 Min. TSH liegend<br />
Injektion 0 Min. Erwachsene:<br />
200 µg TRH i.v.<br />
Blutabnahme 30 Min. TSH<br />
Interpretation<br />
TSH-Anstieg nach TRH um<br />
< 2 mIU/l: fehlende TSH-Antwort<br />
wenn fT3/fT4 erniedrigt:<br />
- Hinweis auf sek<strong>und</strong>äre Hypothyreose<br />
wenn fT3/fT4 normal:<br />
- kurz bestehende sek<strong>und</strong>äre Insuffizienz<br />
- Frühform einer immunogenen Hyperthyreose<br />
- beginnende thyreoidale Autonomie<br />
- Therapie mit Schilddrüsen-Hormonen<br />
2 – 25 mIU/l: regelrechte TSH-Antwort<br />
wenn fT3/fT4 erniedrigt:<br />
- V.a. low-T3-Syndrom bei kritisch Kranken<br />
> 25 mIU/l: überschießende TSH-Antwort<br />
wenn fT3/fT4 erniedrigt:<br />
- manifeste Hypothyreose<br />
wenn fT3/fT4 normal:<br />
- latente Hypothyreose<br />
- Jodverwertungsstörung<br />
72 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5 Mikrobiologie<br />
5.1 Allgemeine Gr<strong>und</strong>sätze<br />
Die Qualität mikrobiologischer Untersuchungen wird in entscheidendem Maße von der Qualität<br />
des Untersuchungsgutes beeinflusst, das den mikrobiologischen Laboratorien zur Untersuchung<br />
übermittelt wird. Die Wahl des geeigneten Untersuchungsgutes, die sachgerechte Probenentnahme<br />
sowie die Einhaltung geeigneter Transportbedingungen einschließlich Transportmedien <strong>und</strong> die<br />
kürzest möglichen Transportzeiten sind daher wichtige Vorraussetzungen im Hinblick auf einen<br />
verlässlichen Untersuchungsbef<strong>und</strong> <strong>und</strong> die Diagnosestellung.<br />
Um die Koordination <strong>und</strong> Kooperation zwischen Einsender <strong>und</strong> Mikrobiologischem Labor im Sinne<br />
einer optimalen Patientenversorgung gewährleisten zu können, sind nachfolgend die wichtigsten<br />
organisatorischen Vorgaben zusammengefasst:<br />
Jedem Untersuchungsmaterial wird ein separater Einsendeschein beigefügt, der neben allen<br />
relevanten Patientendaten auch mit der genauen Anschrift <strong>und</strong> Telefonnummer des Einsenders bzw.<br />
des Ansprechpartners versehen sein sollte, um klinisch wichtige Informationen unmittelbar austauschen<br />
zu können. Für die richtige Interpretation des mikrobiologischen Untersuchungsergebnisses<br />
ist ebenfalls die Angabe des Entnahmeortes (z.B. tiefer/oberflächlicher W<strong>und</strong>abstrich etc.) <strong>und</strong>/oder<br />
des Körper-/Organsekretes (z.B. Urin/Liquor/Kniegelenkspunktat etc.) sowie das Datum der<br />
Abnahme (ggf. mit Uhrzeit) der Patientenprobe von Bedeutung. Zusätzliche Angaben zur klinischen<br />
Situation, zu Vorerkrankungen <strong>und</strong> bereits eingeleiteten Therapiemaßnahmen ermöglichen eine<br />
weitere Präzisierung der erhobenen Bef<strong>und</strong>e durch den mikrobiologisch tätigen Laborarzt. Bei eiligen<br />
Proben empfiehlt sich die Angabe einer Rückrufnummer.<br />
Die Zuordnung der Proben erfolgt im Labor anhand der vollständigen Beschriftung des Transportgefäßes<br />
(nicht das Umröhrchen) <strong>und</strong> des dazugehörigen Einsendscheines.<br />
Die Entnahme mikrobiologischer Proben erfolgt idealerweise noch vor Beginn einer Antibiotikatherapie.<br />
Jedoch ist auch die Abnahme zu einem späteren Zeitpunkt indiziert, wenn das klinische Bild<br />
auf infektiologische Komplikationen hindeutet (z.B. Wechsel des Erregerspektrums, Auftreten von<br />
Resistenzmechanismen, mangelnde Penetrationsfähigkeit der Antibiotika etc.).<br />
Es ist darauf zu achten ausreichende Mengen an Untersuchungsmaterial (z.B. 3-5 ml Punktat/Eiter)<br />
einzusenden. Gewebeproben sind gr<strong>und</strong>sätzlich einfachen Abstrichen vorzuziehen, wenn deren<br />
Entnahme technisch möglich erscheint. Details sind dem alphabetischen Teil des Kapitels ” Bakteriologie“<br />
unter den entsprechenden Untersuchungsmaterialien <strong>und</strong>/oder den Erregerbeschreibungen zu<br />
entnehmen.<br />
Mehrere Proben in zeitlichen Abständen hintereinander entnommen oder aus unterschiedlichen<br />
Bereichen der Infektlokalisation stammend erhöhen die Nachweiswahrscheinlichkeit der Erreger<br />
um ein Vielfaches.<br />
Die Einhaltung einer korrekten Lagerungstemperatur ist bei mikrobiologischen Proben sehr<br />
wichtig. Die Mehrzahl der bakteriologischen Untersuchungsmaterialien sollten bei 4°C gelagert<br />
werden. Wichtige Ausnahmen sind u.a. Blutkulturen <strong>und</strong> Liquor, welche bei Raumtemperatur<br />
transportiert werden sollten. Im alphabetischen Teil des Kapitels ” Mikrobiologie“ unter den<br />
entsprechenden Untersuchungsmaterialien <strong>und</strong>/oder den Erregerbeschreibungen werden hierzu<br />
73
5 Mikrobiologie<br />
genaue Angaben gemacht.<br />
Die über das normale Spektrum der Diagnostik hinausgehenden speziellen Untersuchungsanforderungen<br />
(z.B. Antimykogramm/PCR-Diagnostik) müssen auf dem Untersuchungsauftrag<br />
deutlich vermerkt sein (siehe auch unter ” Mikrobiologische Diagnostik-Alphabetisches Register“ ).<br />
Eine schnellstmögliche Überstellung der Proben an das Labor wird durch einen kontinuierlichen<br />
Fahrdienst gewährleistet. Alle für den Probentransport maßgeblichen Kriterien <strong>und</strong> gesetzlichen<br />
Vorgaben finden hierbei selbstverständlich Beachtung <strong>und</strong> schützen so vor Qualitätsverlusten.<br />
Untersuchungsergebnisse von besonderer <strong>Dr</strong>inglichkeit (z.B. positive Blut- <strong>und</strong> Liquorkulturen)<br />
werden umgehend telefonisch mitgeteilt. Ansonsten erfolgt die Bef<strong>und</strong>übermittlung direkt per DFÜ,<br />
auf Anforderung zusätzlich per Fax <strong>und</strong> natürlich über den normalen Post- oder Kurierdienst.<br />
Für Fragen r<strong>und</strong> um den Fahrdienst steht Herr Rensinghoff als Ansprechpartner zur Verfügung:<br />
Tel.: 0251 – 60916 – 292<br />
Nähere Angaben über die unterschiedlichen Transportmedien <strong>und</strong> Versandsysteme entnehmen<br />
Sie bitte dem nachfolgenden Kapitel ” Versandmaterial Mikrobiologie“ .<br />
74 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5.2 Versandmaterial<br />
5 Mikrobiologie<br />
Gr<strong>und</strong>sätzlich entsprechen alle von uns bereitgestellten Proben- <strong>und</strong> Transportgefäße den<br />
gültigen Qualitätsnormen <strong>und</strong> gesetzlichen Bestimmungen. Vom Anwender muss jedoch die<br />
sachgerechte Handhabung, die für einige Produkte angegebene Kontrolle des Verfallsdatums <strong>und</strong><br />
die vorschriftsmäßige Lagerung vor <strong>und</strong> nach der Beschickung mit Untersuchungsgut gewährleistet<br />
werden. Genaue Angaben hierzu finden Sie unter den Beschreibungen zu bestimmten Erregern <strong>und</strong><br />
Untersuchungsverfahren im alphabetischen Register ” Mikrobiologische Diagnostik“ .<br />
Für Rückfragen stehen Ihnen ferner die Mitarbeiterinnen <strong>und</strong> Mitarbeiter der Versandabteilung<br />
sowie des Labors zur Verfügung.<br />
Einsendescheine <strong>und</strong> Versandtüten können ebenfalls über den Versand angefordert werden.<br />
Ihre Bestellung von Probenentnahme- <strong>und</strong> Versandmaterial nehmen wir unter der Rufnummer<br />
Tel.: 0251 – 60916 – 161 oder per Fax: 0251 – 60916 – 164 entgegen.<br />
Allgemeine Transportgefäße<br />
Blutkulturflaschen<br />
Blutkulturmedien eignen sich zur Anzucht aerober oder anaerober Erreger <strong>und</strong> können ohne oder<br />
mit Zusatz antibiotikabindender Substanzen eingesetzt werden. Für Frühgeborene, Säuglinge<br />
<strong>und</strong> Kleinkinder, wo nur geringe Blutvolumina entnommen werden können, stehen spezielle<br />
Kinderblutkulturflaschen zur Verfügung. Zur besseren Unterscheidung sind die Flaschen mit farblich<br />
verschiedenen Kappen versehen. Auf Wunsch kann der Bestellung von Blutkulturflaschen ein<br />
Informationsblatt des Herstellers zur Entnahmetechnik <strong>und</strong> zur Handhabung beigefügt werden.<br />
Blutkultur SA:<br />
Blutkultur SN:<br />
Aerobe <strong>und</strong> anaerobe Standardflaschen. Die Blutkulturflaschen sind ein gutes Transport- <strong>und</strong><br />
Kulturmedium, auch für flüssiges, primär steriles Untersuchungsmaterial anderer Herkunft<br />
(z.B. Gelenkpunktate) besonders zum Anzüchten empfindlicher Keime. Bei unbekanntem Sepsis-<br />
/Infektionserreger ist immer die kombinierte Abnahme einer aeroben <strong>und</strong> anaeroben Blutkulturflasche<br />
zu empfehlen. Bitte das vorgeschriebene Probenvolumen beachten (8-10 ml).<br />
Blutkultur FA:<br />
Blutkultur FN:<br />
Aerobe <strong>und</strong> anaerobe Flasche zur bakteriologischen Untersuchung unter begonnener oder länger<br />
bestehender Antibiotikatherapie. Durch spezielle Zusätze werden antibiotisch wirksame Substanzen<br />
aus dem Patientenmaterial geb<strong>und</strong>en, die andernfalls die Anzucht pathogener Erreger verhindern oder<br />
erschweren könnten. Die Blutkulturflaschen sind ein gutes Transport <strong>und</strong> Kulturmedium, auch für<br />
flüssiges, primär steriles Untersuchungsmaterial anderer Herkunft (z.B. Gelenkpunktate) besonders<br />
zum Anzüchten empfindlicher Keime. Bei unbekanntem Sepsis-/Infektionserreger ist immer die<br />
kombinierte Abnahme einer aeroben <strong>und</strong> anaeroben Blutkulturflasche zu empfehlen. Bitte das<br />
vorgeschriebene Probenvolumen beachten (8-10 ml).<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 75
5 Mikrobiologie<br />
Blutkultur PF:<br />
Pädiatrische Flasche. Die Blutkulturflasche eignet sich für geringe Volumina an Untersuchungsmaterial<br />
(Pädiatrie etc.).<br />
Röhrchen <strong>und</strong> Tupfer<br />
- Röhrchen (Serumröhrchen neutral, steril): Röhrchen mit Schraubdeckel für Urin-, Punktat-,<br />
Liquorproben sowie Exsudat.<br />
- Steriles Röhrchen (Serumröhrchen rot): Röhrchen mit Schraubdeckel <strong>und</strong> EDTA für Punktate<br />
zur Zellzahlbestimmung.<br />
- Urin-Röhrchen (100 ml): Flachbodengefäß mit Schraubdeckel.<br />
- Sputum-Röhrchen (steril): Flachbodengefäß mit Schraubdeckel. Umröhrchen gelb.<br />
- Sputum-Röhrchen mit Phosphatpuffer: Flachbodengefäß mit Schraubdeckel für Magensaft<br />
zur Kultur auf Mykobakterien.<br />
- Stuhl-Röhrchen: Röhrchen mit Schraubdeckel inkl. Löffelchen. Umröhrchendeckel braun.<br />
- Abstrichtupfer mit Medium (dicker Tupfer; blau): Starrer Tupfer mit Universal-Transportmedium.<br />
- Abstrichtupfer mit Medium (dünner Tupfer; orange): Flexibler Tupfer mit Universal-<br />
Transportmedium.<br />
- Abstrichtupfer ohne Medium (dicker Tupfer; violett) für PCR-Untersuchungen: Starrer Tupfer<br />
ohne Universal-Transportmedium.<br />
- Uriculte: Nährbodenträger für Urinkultur (Eintauchmedium).<br />
Spezielle Transportgefäße<br />
- Trachealsaug-Set: Spitzbodenröhrchen mit An- <strong>und</strong> Absaugkanälen (steril verpackt).<br />
- Mycoplasma hominis/Ureaplasma urealyticum: Spezielles Transportmedium mit Abstrichtupfer<br />
(blau). Vorratslagerung: 2-8°C! Merkblatt zur Handhabung wird den Lieferungen beigelegt!<br />
- Spezialabstrichbesteck mit Tupferabstrich: PCR-Untersuchung auf Chlamydia trachomatis/Neisseria<br />
gonorrhoeae. Merkblatt zur Handhabung wird den Lieferungen beigelegt!<br />
- Thermoboxen (Styropor/Kunststoff): Transportboxen für gekühlten Probentransport.<br />
- Zytologie-Set: Objektträger mit Versandhüllen (für mikroskopische Untersuchung z.B. auf<br />
GO, Tumorzellen).<br />
76 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5.3 Alphabetisches Register<br />
Abstriche (allgemein)<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Keimidentifizierung<br />
- Ggf. Antibiogramm<br />
- Ggf. Sonderanforderungen (z.B. Sprosspilze)<br />
5 Mikrobiologie<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Gr<strong>und</strong>sätzlich steril entnehmen <strong>und</strong> Abstrichtupfer in ein Röhrchen mit Transportmedium geben.<br />
Bitte immer die Entnahmestelle <strong>und</strong> klinische Besonderheiten angeben! Möglichst zügiger Transport<br />
ins Labor. Je nach Art des Abstriches ist die kurzfristige Zwischenlagerung bei 4°C (Gefahr des Absterbens<br />
empfindlicher Keime) oder die Lagerung bei Raumtemperatur (Gefahr der Überwucherung<br />
pathogener Keime durch die Standortflora) günstiger. Nähere Angaben hierzu sind unter den<br />
entsprechenden Stichpunkten zu finden, z.B. Konjunktival-, Rachen-, W<strong>und</strong>abstrich usw.<br />
Bemerkungen, Besondere Hinweise:<br />
Da Abstrichtupfer nur eine begrenzte Menge an Untersuchungsmaterial aufnehmen, sollte bei besonderen<br />
klinischen Fragestellungen die mikrobiologische Untersuchung besser aus Gewebestücken<br />
oder aspiriertem Material erfolgen.<br />
Zum Nachweis von Erregern mittels PCR werden gesonderte Tupfer ohne Transportmedium eingesetzt<br />
(siehe Kapitel Molekularbiologie).<br />
Abdomenabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Keimidentifizierung<br />
- Ggf. Antibiogramm<br />
- Bei V.a. Peritonitis darmpathogene Keime (Salmonellen, Shigellen, Yersinien, Campylobacter)<br />
Auf Anforderung: Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
s. u. Abstriche (allgemein).<br />
Ist kein unmittelbarer Transport ins Labor möglich, sollte die Probe bei Raumtemperatur gelagert<br />
werden.<br />
Bemerkungen, Besondere Hinweise:<br />
Wird gleichzeitig eine Untersuchung auf Sprosspilze gewünscht, so muss diese Anforderung auf dem<br />
Begleitschein zusätzlich aufgeführt werden.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 77
5 Mikrobiologie<br />
Absaugkatheter<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Aerobe Kultur<br />
- Identifizierung pathogener Keime<br />
- Ggf. Antibiogramm<br />
Auf Anforderung: Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Katheter in einem sterilen Gefäß einsenden. Lagerung bei 4°C.<br />
Bemerkungen, Besondere Hinweise:<br />
Es ist zu beachten, dass in der Regel Absaugkatheter mit Begleitflora des Abnahmeortes kontaminiert<br />
sind. Wird gleichzeitig eine Untersuchung auf Sprosspilze gewünscht, so muss diese Anforderung<br />
auf dem Begleitschein zusätzlich aufgeführt werden.<br />
Abszessinhalt/Eiter<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Keimidentifizierung<br />
- Ggf. Antibiogramm<br />
- Ggf. Sonderanforderungen<br />
Auf Anforderung: Kultur auf Aktinomyzeten<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Materialgewinnung möglichst vor chirurgischer Abszess-Eröffnung. Nach sorgfältiger Hautdesinfektion<br />
Punktion des Eiterherdes <strong>und</strong> Aspiration in steriler Spritze (möglichst 2-5 ml). Spritze mit<br />
steriler Kappe verschließen <strong>und</strong> einsenden.<br />
Infektionserreger finden sich vor allem in den Randzonen. Daher eignen sich auch Gewebeproben<br />
aus dieser Region gut für den Bakteriennachweis.<br />
Ist ein unmittelbarer Transport ins Labor nicht möglich, wird die Probe bei 4°C zwischengelagert.<br />
Bemerkungen, Besondere Hinweise:<br />
Ein Tupferabstrich ist für die mikrobiologische Untersuchung nur sehr eingeschränkt geeignet. Verdacht<br />
auf Aktinomykose unbedingt mitteilen, da hierfür ein spezielles Kulturverfahren erforderlich ist.<br />
Acinetobacter sp.<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Gramnegatives Stäbchenbakterium aus der Gruppe der Nonfermenter. Vorkommen ubiquitär in der<br />
78 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5 Mikrobiologie<br />
Umwelt. Manchmal auch Erreger nosokomialer Infektionen (z.B. Pneumonie, HWI, etc.). Nachweis<br />
aus den üblichen mikrobiologischen Untersuchungsmaterialien möglich.<br />
Lagerung bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:<br />
Häufig nachgewiesene Spezies:<br />
- Acinetobacter baumannii<br />
- Acinetobacter lwoffii<br />
- Acinetobacter calcoaceticus<br />
Actinobacillus actinomycetemcomitans<br />
s.u. Kapitel Molekularbiologie: Parodontalkeime<br />
Actinomyces israelii, Actinomyces sp.<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Nachweis aus Gewebeproben, Abszessmaterial <strong>und</strong> tiefen Abstrichen möglich (langsames Wachstum<br />
= längere Bebrütungsdauer!).<br />
Ist ein unmittelbarer Transport ins Labor nicht möglich, wird die Probe bei 4°C zwischengelagert.<br />
Bemerkungen, Besondere Hinweise:<br />
Krankheitsbild: Aktinomykose<br />
Typisch für chronisch eitrige, langsam progrediente, abszedierende o. fistelbildende Infektionsprozesse<br />
im oralen oder zervikofazialen Bereich.<br />
Gelegentlich auch thorakale, intraabdominelle, cerebrale oder knöcherne Lokalisation.<br />
Adenoviren<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Ca. 50 unterschiedliche Serotypen, die vor allem zu Infektionen des Respirations- <strong>und</strong> Gastrointestinaltraktes<br />
führen. Ferner sind Adenoviren häufigste Erreger der hoch-kontagiösen Keratoconjunktivitis<br />
epidemica.<br />
Frische Stuhlprobe (mindestens zur Hälfte gefülltes Stuhlröhrchen).<br />
Ist ein unmittelbarer Transport ins Labor nicht möglich, wird die Probe bei 4°C zwischengelagert.<br />
Nachweis von Adenovirus-DNA mittels PCR bei Keratoconjunktivitis nur mit speziellem Abstrichset<br />
<strong>und</strong> Medium möglich!<br />
Bemerkungen, Besondere Hinweise:<br />
Indiziert bei Diarrhöen im Kleinkindesalter. Nachweis des Adenovirus-Antigens im Enzym-Immuno-<br />
Assay (EIA).<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 79
5 Mikrobiologie<br />
Siehe auch Kapitel Molekularbiologie.<br />
Aeromonas sp.<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Aeromonaden sind in der Umwelt weit verbreitet, vor allem in feuchtem <strong>und</strong> wässrigem Milieu.<br />
Sie können Augeninfektionen, Pneumonien, W<strong>und</strong>infektionen <strong>und</strong> Gastroenteritiden verursachen.<br />
Materialentnahme entsprechend der Infektlokalisation. Stuhlproben bei Gastroenteritis, s.u.<br />
Stuhldiagnostik.<br />
Lagerung der Probe je nach Material bei 4°C (z.B. Urin) oder Raumtemperatur (z.B. Blutkulturen).<br />
Bemerkungen, Besondere Hinweise:–<br />
Aktinomykose<br />
s.u. Actinomyces israelii<br />
Amöben<br />
s.u. Amöbiasis<br />
Amöbiasis<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Krankheitsbild: Amöbiasis/Amöbenruhr<br />
Erreger: Entamoeba histolytica<br />
Meist Einschleppung aus Endemiegebieten nach Auslandsaufenthalten.<br />
Diarrhoe, Bauchkrämpfe, Leber-, Lungen- oder Hirnabszesse.<br />
Stuhlproben, Abszessmaterial. Lagerung bei 4°C.<br />
s.u. Stuhldiagnostik<br />
Bemerkungen, Besondere Hinweise:<br />
Parasitäre Erkrankung durch Protozoen.<br />
Amöbenzysten können in frischem Stuhl mikroskopisch nachgewiesen werden. Methode der Wahl<br />
ist jedoch der Nachweis von Entamoeba histolytica durch Enzym-Immuno-Assay (EIA). Zum Ausschluss<br />
extraintestinaler Manifestationen muss eine serologische Untersuchung (ELISA) ergänzend<br />
durchgeführt werden (Patientenserum).<br />
80 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Analabklatschpräparat<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung: Mikroskopischer Nachweis von Oxyuren-Eiern (Enterobius vermicularis).<br />
5 Mikrobiologie<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Tesafilmstreifen morgens vor der Defäkation auf den Anus des Patienten drücken. Anschließend<br />
den Tesafilmstreifen auf einen Objektträger kleben. Objektträger bruchsicher, in einer eigens hierfür<br />
vorgesehenen Kunststoffhülle, einsenden.<br />
Bemerkungen, Besondere Hinweise:<br />
Krankheitsbild: Oxyuriasis, Enterobiasis<br />
Die Untersuchung des Stuhles auf Enterobius vermicularis ist nicht erfolgversprechend, da die<br />
Eiablage am äußeren Analring erfolgt.<br />
Analabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Aerobe Kultur<br />
- Ggf. Antibiogramm<br />
Auf Anforderung: Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Lagerung bei 4°C.<br />
Bemerkungen, Besondere Hinweise:<br />
Es ist zu beachten, dass ein Analabstrich fast immer mit Begleitflora des Abnahmeortes kontaminiert<br />
ist.<br />
Anthrax<br />
s.u. Bacillus anthracis<br />
Aszitespunktat<br />
s.u. Punktate<br />
Astroviren<br />
s.u. Stuhldiagnostik<br />
Bemerkungen, Besondere Hinweise:<br />
Antigen-Nachweis durch EIA (Enzym-Immuno-Essay).<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 81
5 Mikrobiologie<br />
Augenabstrich<br />
s.u. Konjunktivalabstrich<br />
Bacillus anthracis<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Abstriche aus Milzbrandkarbunkel, Bläschenflüssigkeit, Gewebebiopsie, Sputum, Stuhl, – je nach<br />
Manifestationsort. Anzucht, Identifizierung <strong>und</strong> Resistenzbestimmung nur in Speziallaboratorien<br />
möglich! (Sicherheitsstufe 3!). Vor Einsendung bitte telefonisch Rücksprache halten!<br />
Bemerkungen, Besondere Hinweise:<br />
Krankheitsbild: Anthrax (Milzbrand)<br />
- Hautmilzbrand<br />
- Lungenmilzbrand<br />
- Darmmilzbrand<br />
Im Verdachtsfall bitte telefonischen Kontakt aufnehmen.<br />
Bacteroides forsythus<br />
s.u. Kapitel Molekularbiologie: Parodontalkeime<br />
Bacteroides sp.<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Obligat anaerob wachsende gramnegative Stäbchenbakterien. W<strong>und</strong>infektionen, Abszesse, intraabdominelle<br />
Prozesse. Abstriche u. Gewebeproben jeglicher Lokalisation, Punktate, Eiter, Blutkulturen<br />
usw.<br />
Lagerung bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:<br />
Zumeist treten die Bacteroidesarten vergesellschaftet mit anderen Erregern in Mischinfektionen auf.<br />
Bilharziose<br />
Synonym: Schistosomiasis<br />
s.u. Schistosomen<br />
82 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Biopsiematerial – Gewebeproben<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Keimidentifizierung<br />
- Antibiogramm<br />
Auf Anforderung:<br />
- Kultur auf Sprosspilze<br />
- Kultur auf Aktinomyceten<br />
- Kultur auf Mykobakterien (W)<br />
5 Mikrobiologie<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Kleinere Proben zum Schutz vor Sauerstoff <strong>und</strong> Austrocknung in Röhrchen mit Transportmedium<br />
geben. Größere Gewebeproben in sterile physiolog. NaCl-Lösung (nicht in Formalin) überführen.<br />
Lagerung bis zum Transport bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:<br />
Siehe auch ” Magen-, Duodenalbiopsie“<br />
Blasenkatheter<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Aerobe Kultur<br />
- Keimidentifizierung<br />
- Ggf. Antibiogramm<br />
Auf Anforderung: Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Katheter in einem sterilen Gefäß einsenden. Ggf. bei Raumtemperatur lagern.<br />
Bemerkungen, Besondere Hinweise:<br />
Urin ist dem Blasenkatheter vorzuziehen.<br />
Blutkultur<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat (im pos. Fall)<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Keimidentifizierung<br />
- Antibiogramm<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 83
5 Mikrobiologie<br />
1. Vorbereiten der BacT/Alert Blutkulturflaschen<br />
- Blutkulturflaschen auf Raumtemperatur bringen<br />
- Plastikkappen entfernen<br />
- Gummistopfen der Flasche desinfizieren<br />
2. Patientenvorbereitung<br />
- Hautpunktionsstelle desinfizieren (30s)<br />
- Haut trocknen lassen<br />
- Punktionsstelle danach nicht mehr berühren<br />
3. Blutentnahme<br />
- Blut aseptisch entnehmen (z.B. sterile Spritze etc.)<br />
- Kanüle wechseln, um die Blutkulturflaschen zu beimpfen<br />
- Immer mit der anaeroben Flasche beginnen<br />
- Achtung: in der Blutkulturflasche besteht Unterdruck<br />
- Maximal 10 ml einfüllen (Strichmarkierung auf dem Etikett der Flasche beachten)<br />
- Ausnahme: BacT/Alert PF (Pädiatrie), hier maximal 4 ml<br />
4. Lagerung <strong>und</strong> Transport<br />
- Die Blutkulturflaschen unverzüglich ins Labor bringen.<br />
Ist dieses nicht möglich, sollten die Blutkulturen bei Raumtemperatur aufbewahrt werden.<br />
Bemerkungen, Besondere Hinweise:<br />
Typen der BacT/Alert Blutkulturflaschen beachten:<br />
SA Standard aerobe Flasche<br />
SN Standard anaerobe Flasche<br />
PF Pädiatrische Flasche<br />
FA aerobe Flasche unter laufender Antibiotikatherapie<br />
FN anaerobe Flasche unter laufender Antibiotikatherapie<br />
s.u. Allgemeine Transportgefäße<br />
Bordetella pertussis<br />
s.u. Nasopharyngealabstrich<br />
Botulismus<br />
s.u. Clostridium botulinum<br />
Bronchialabsaugkatheter<br />
s.u. Absaugkatheter<br />
Bronchialsekret<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
84 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5 Mikrobiologie<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Bronchoskopische Absaugung; evtl. vor der Abnahme eine geringe Menge steriler isotonischer<br />
NaCl-Lösung (welche keine antibakteriellen Zusätze enthält) instillieren.<br />
Lagerung bei 4°C.<br />
s.u. Sputum<br />
Bemerkungen, Besondere Hinweise:<br />
Gegenüber Sputum <strong>und</strong> Trachealsekret ist die Kontaminationsgefahr vermindert, jedoch nicht ausgeschlossen.<br />
Bei Lungen-Tbc bringt Bronchialsekret meist eine höhere Erregerausbeute als Sputum.<br />
Bronchoalveoläre Lavage (BAL)<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung mittels Verdünnungsprobe:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Kultur auf Nonfermenter<br />
- Kultur auf Sprosspilze <strong>und</strong> Schimmelpilze<br />
Auf Anforderung:<br />
- Kultur auf Mykobakterien (Dauer ca. 50 Tage)<br />
- Nachweis von Pneumocystis jirovecii-DNA mittels PCR<br />
- Nachweis von Legionellen-DNA mittels PCR (keine Kassenleistung!)<br />
- Nachweis von Chlamydia pneumoniae-DNA mittels PCR<br />
- Nachweis von Mycoplasma pneumoniae-DNA mittels PCR<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Nach bronchoskopischer Instillation von bis zu 160 ml isotonischer Kochsalzlösung wird -soweit<br />
möglich- wieder aspiriert, wobei mindestens 50 ml Flüssigkeit wiedergewonnen werden sollten. Das<br />
erste Aspirat muss verworfen werden, das zweite <strong>und</strong> ggf. nachfolgende Aspirate können im Labor<br />
genutzt werden. Es sollte eine Kontamination mit Sekret aus dem M<strong>und</strong>-Rachenraum vermieden<br />
werden.<br />
Lagerung bei 4°C<br />
Bemerkungen, Besondere Hinweise:<br />
s.u. Kapitel Molekularbiologie<br />
Bronchopulmonale Infektionen<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Sputum (kein Speichel), Tracheal- u. Bronchialsekret, Bronchiallavage, Lungenbiopsie, Pleurapunktat.<br />
Weitlumige sterile Gefäße. Lagerung bis zum Transport bei 4°C.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 85
5 Mikrobiologie<br />
Bemerkungen, Besondere Hinweise:–<br />
Bursaabstrich/-punktat<br />
s.u. Punktate<br />
Campylobacter sp.<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Darmpathogener Erreger, akute Gastroenteritis, häufig mit blutig tingierten Durchfällen.<br />
Da Campylobacterarten sehr kälteempfindlich sind, sollte der Transport möglichst schnell erfolgen.<br />
s.u. Stuhldiagnostik<br />
Bemerkungen, Besondere Hinweise:<br />
Eine Differenzierung der verschiedenen nachstehenden Campylobacterspezies ist von epidemiologischer<br />
Bedeutung.<br />
Zu den klinisch bedeutsamen Spezies gehören:<br />
- Campylobacter coli<br />
- Campylobacter jejuni<br />
- Campylobacter lari<br />
Candida<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Kultur auf Sprosspilze<br />
- Keimidentifizierung<br />
Auf Anforderung: Antimykogramm<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Abstriche, Sputum, Urin, Punktate, Stuhl, Hautschuppen etc.<br />
Bei allgemeinen bakteriologischen Untersuchungen bitte die Anforderung auf einen zusätzlichen<br />
Pilznachweis immer ausdrücklich vermerken oder getrennt ein zweites Material gesondert einschicken!<br />
Bemerkungen, Besondere Hinweise:<br />
Falls ein Antimykogramm gewünscht wird (z.B. bei stark immunsupprimierten Patienten) bitte<br />
gezielt anfordern!<br />
86 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Cervixabstrich I Pathogene Keime<br />
5 Mikrobiologie<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Kultur auf Gardnerella vaginalis, Mykoplasma hominis, Ureaplasma urealyticum <strong>und</strong> Sprosspilze<br />
Auf Anforderung: Kultur auf N. gonorrhoeae (Gonokokken)<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Nach Spekulumeinstellung Cervix mit sterilem Tupfer trocken wischen. Dünnen Abstrichtupfer<br />
ca. 1-2 cm in den Cervixkanal einführen. Materialgewinnung mit rotierender Bewegung. Tupfer in<br />
Abstrichmedium stecken. Material bis zur Abholung bei 4°C aufbewahren.<br />
Bemerkungen, Besondere Hinweise:–<br />
Cervixabstrich II Chlamydien/Gonokokken<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Nachweis von Chlamydia trachomatis-DNA mittels PCR<br />
- Nachweis von Neisseria gonorrhoeae-DNA mittels PCR<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Entnahme des Abstrichs: S.u. Cervixabstrich<br />
Bemerkungen, Besondere Hinweise:<br />
s.u. Kapitel Molekularbiologie<br />
Chlamydia pneumoniae<br />
s.u. Kapitel Molekularbiologie<br />
Chlamydia trachomatis<br />
s.u. Kapitel Molekularbiologie<br />
Cholera<br />
s.u. Vibrio cholerae<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 87
5 Mikrobiologie<br />
Citrobacter sp.<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
s.u. Enterobacteriaceae<br />
Bemerkungen, Besondere Hinweise:<br />
Zu den häufig nachgewiesenen Spezies gehören:<br />
- Citrobacter fre<strong>und</strong>ii<br />
- Citrobacter brakii<br />
- Citrobacter koseri<br />
Clostridien<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Obligat anaerob wachsende, grampositive Stäbchenbakterien mit der Fähigkeit Sporen zu bilden.<br />
W<strong>und</strong>infektionen, Eiterungen, Sepsis, Peritonitis u.a., zumeist als Mischinfektion mit anderen<br />
aeroben <strong>und</strong> anaeroben Erregern.<br />
s.u. Gasbrand<br />
s.u. Clostridium difficile<br />
s.u. Clostridium botulinum<br />
s.u. Clostridium tetani<br />
Bemerkungen, Besondere Hinweise:<br />
Die Synthese <strong>und</strong> Freisetzung zahlreicher Toxine ist ein wesentlicher Pathogenitätsfaktor der<br />
Clostridien. Einige Krankheitsbilder beruhen allein auf der schädigenden Toxinwirkung.<br />
Clostridium botulinum (W)<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Obligat anaerob wachsende grampositive Stäbchenbakterien mit der Fähigkeit Sporen zu bilden.<br />
Erreger des Botulismus (Lebensmittelvergiftung). Bei dieser Erkrankung handelt es sich nicht<br />
um eine Infektion, sondern um eine Intoxikation des Nervensystems mit den Neurotoxinen von<br />
Clostridium botulinum. Zum Nachweis des Bakteriums eignen sich nur Proben aus den vermeintlich<br />
kontaminierten Speiseresten, Erbrochenem oder aus Mageninhalt. Lagerung bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:<br />
Beweisend für den Botulismus ist neben den typischen klinischen Erscheinungsbildern nur der<br />
Nachweis der Botulismustoxine.<br />
Zum Toxinnachweis wird Patientenserum benötigt, dass im Tierversuch eingesetzt werden muss.<br />
Deshalb wird diese Untersuchung nur in Speziallaboratorien durchgeführt. Im Verdachtsfall bitte<br />
88 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
telefonischen Kontakt aufnehmen.<br />
Clostridium difficile<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
5 Mikrobiologie<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Verdacht auf pseudomembranöse Kolitis nach längerer Antibiotikagabe. Frische Stuhlprobe, rascher<br />
Transport, Material bis zur Abholung bei 4°C aufbewahren.<br />
s.u. Stuhldiagnostik<br />
Bemerkungen, Besondere Hinweise:<br />
- Antigen (GDH)-Nachweis<br />
- Toxin-Nachweis durch EIA (Enzym-Immuno-Essay) = Kassenleistung<br />
- Toxin-Nachweis mittels PCR<br />
Bei Verdacht auf Ribotyp 027: Untersuchung auf Anforderung möglich. S.u. Kapitel Molekularbiologie<br />
Clostridium histolyticum<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
s.u. Clostridien, s.u. Gasbrand<br />
Bemerkungen, Besondere Hinweise:–<br />
Clostridium novyi<br />
s.u. Clostridien, s.u. Gasbrand<br />
Clostridium perfringens<br />
s.u. Clostridien, s.u. Gasbrand<br />
Clostridium septicum<br />
s.u. Clostridien, s.u. Gasbrand<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 89
5 Mikrobiologie<br />
Clostridium tetani (W)<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Obligat anaerob wachsende grampositive Stäbchenbakterien mit der Fähigkeit Sporen zu bilden.<br />
Erreger des Tetanus (W<strong>und</strong>starrkrampf). Bei dieser Erkrankung handelt es sich nicht um eine Infektion,<br />
sondern um eine Intoxikation des Nervensystems mit den Neurotoxinen von Clostridium tetani.<br />
Zum Nachweis eignen sich nur tiefe Gewebeproben aus dem Bereich der vermuteten Eintrittspforte.<br />
Lagerung bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:<br />
Beweisend für den W<strong>und</strong>starrkrampf ist neben den typischen klinischen Erscheinungsbildern nur<br />
der Nachweis der Tetanustoxine (z.B. Tetanospasmin). Zum Toxinnachweis wird Patientenserum<br />
benötigt, dass im Tierversuch eingesetzt werden muss. Deshalb wird diese Untersuchung nur in<br />
Speziallaboratorien durchgeführt. Im Verdachtsfall bitte telefonischen Kontakt aufnehmen.<br />
Coronaviren (W)<br />
Hämorrhagische Enteritiden, s.u. Stuhldiagnostik<br />
Corynebacterium diphtheriae<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Aerobe Kultur<br />
- Keimidentifizierung<br />
- Ggf. Antibiogramm<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Rachenabstrich (typisch sind pseudomembranöse, leicht blutende Beläge).<br />
Bemerkungen, Besondere Hinweise:<br />
Bei klinischem Verdacht sofortiger Therapiebeginn (Diphtherie-Antitoxin <strong>und</strong> Antibiotika)!<br />
Corynebacterium sp.<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Keime der physiologischen Haut- <strong>und</strong> Schleimhautflora. Daher werden Corynebakterien meist als<br />
Kontaminanten in Untersuchungsproben nachgewiesen. Bef<strong>und</strong>e werden dementsprechend<br />
begutachtet <strong>und</strong> kommentiert.<br />
90 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5 Mikrobiologie<br />
Bemerkungen, Besondere Hinweise:<br />
Selten von pathogener Bedeutung (z.B. bei katheter- oder implantatassoziierten Infektionen).<br />
Dekubitus – Abstrich<br />
s.u. W<strong>und</strong>abstrich<br />
Dermatomykosen<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Mikroskopie<br />
- Kultur<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Haut-, Haar-, Nagelmykosen<br />
Hautschuppen:<br />
Oberflächliche Auflagerungen wie Krusten <strong>und</strong> abgestorbene Hautschuppen mit sterilem Skalpell<br />
entfernen, darunter liegende Schichten mit 70%igem Ethylalkohol desinfizieren. Die abgeschabten<br />
Hautschuppen in einem sterilen Gefäß einsenden.<br />
Haare:<br />
Mit Haarbalg einsenden, keine abgeschnittenen Haare.<br />
Nagelspäne:<br />
Nach gründlicher Reinigung mit 70 %igem Ethanol zunächst alle leicht ablösbaren bröckeligen Teile<br />
entfernen, mit einem sterilen Skalpell aus den befallenen Arealen der Nagelplatte (Rand der Läsion)<br />
ggf. unter Einbeziehung der tiefen Nagelpartien nahe dem Nagelbett ablösen.<br />
Bemerkungen, Besondere Hinweise:<br />
Lange Bebrütungszeiten beachten! Ergebnisse u.U. erst nach 4 Wochen.<br />
Diphtherie<br />
s.u. Corynebacterium diphtheriae<br />
Douglasabstrich/-punktat<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Zusätzliche Untersuchung:<br />
- Kultur auf Gardnerella vaginalis<br />
- Kultur auf Mycoplasma hominis/Ureaplasma urealyticum<br />
- Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
s.u. Punktate<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 91
5 Mikrobiologie<br />
Bemerkungen, Besondere Hinweise:–<br />
Duodenalsaft<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchungen:<br />
- Grampräparat<br />
- Aerobe Kultur<br />
- Keimidentifizierungen<br />
- Anzucht von darmpathogenen Keimen (Salmonella, Shigella, Yersinia, Campylobacter)<br />
- Ggf. Antibiogramm<br />
Auf Anforderung:<br />
- Nachweis von Lamblien (ELISA, Mikroskopie)<br />
- Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Für die kulturelle Untersuchung auf Erreger Duodenalsaft in steriles Röhrchen geben. Da Lamblien-<br />
Trophozoiten sehr empfindlich sind, muss die Untersuchung möglichst sofort nach Entnahme<br />
durchgeführt werden.<br />
Bemerkungen, Besondere Hinweise:<br />
Verdacht auf Giardiasis (Lamblien-Ruhr) bei negativen Stuhlbef<strong>und</strong>en.<br />
Eiter<br />
s.u. Abszessinhalt<br />
Ejakulat<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat/Nativpräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Kultur auf Mykoplasma hominis/Ureaplasma urealyticum<br />
- Keimidentifizierung<br />
- Ggf. Antibiogramm<br />
- Keimzahlbestimmung<br />
Auf Anforderung:<br />
- Nachweis von Chlamydia trachomatis-DNA mittels PCR<br />
- Kultur auf Neisseria gonorrhoeae (Gonokokken) bzw. mittels PCR<br />
- Kultur auf Gardnerella vaginalis<br />
- Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Vor Materialgewinnung Reinigung der Harnröhrenmündung: S.u. Harnröhrenabstrich.<br />
Ejakulat in einem sterilen Gefäß auffangen. Es sollte möglichst bald ins Labor gelangen, um eine<br />
92 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5 Mikrobiologie<br />
stärkere Veränderung der Keimzahlen <strong>und</strong> ein Absterben empfindlicher Erreger zu verhindern.<br />
Lagerung bei 4°C.<br />
Bemerkungen, Besondere Hinweise:<br />
s.u. Kapitel Molekularbiologie.<br />
Ekzemabstrich<br />
s.u. Hautabstrich<br />
Entamoeba histolytica<br />
s.u. Amöbiasis<br />
Enterobacteriaceae<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Zu dieser Bakterienfamilie gehören zahlreiche gramnegative Stäbchenbakterien unterschiedlicher<br />
Gattungen <strong>und</strong> Spezies. Im Darm sind sie meist physiologisch, an anderer Lokalisation häufig<br />
fakultativ pathogen. Als Erreger werden sie vor allem bei folgenden Infektionen nachgewiesen:<br />
Harnwegsinfekte, W<strong>und</strong>infektionen, Abszesse, Pneumonien, Sepsis.<br />
Materialentnahme entsprechend der Infektlokalisation. Zum Nachweis darmpathogener Enterobacteriaceae<br />
werden Stuhlproben untersucht (s.u. Stuhldiagnostik).<br />
Lagerung der Probe je nach Material bei 4°C (z.B. Urin) oder Raumtemperatur (z.B. Blutkulturen).<br />
Bemerkungen, Besondere Hinweise:<br />
Häufig nachgewiesene Spezies aus der Familie der Enterobacteriaceae sind:<br />
fakultativ pathogen<br />
- Escherichia coli<br />
- Klebsiella pneumoniae<br />
- Klebsiella oxytoca<br />
- Proteus mirabilis<br />
- Proteus vulgaris<br />
- Serratia marcescens<br />
- Serratia liquefaciens<br />
- Morganella morganii<br />
- Citrobacter brakii<br />
- Citrobacter koseri<br />
- Citrobacter fre<strong>und</strong>ii<br />
obligat pathogen (Gastroenteritiden)<br />
Meldepflicht nach § 6 <strong>und</strong> 7 IfSG:<br />
- Enteropathogene E.coli (EPEC u.a.)<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 93
5 Mikrobiologie<br />
- Salmonellen<br />
- Shigellen<br />
- Yersinien<br />
- Plesiomonas shigelloides<br />
Vermehrt treten bei den Enterobacteriaceae Resistenzmechanismen auf. Eine Antibiotikatherapie<br />
sollte möglichst nach Antibiogramm erfolgen.<br />
Enterobius vermicularis<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Krankheitsbild: Oxyuriasis, Enterobiasis. S.u. Analabklatschpräparat<br />
Bemerkungen, Besondere Hinweise:–<br />
Enterococcus sp.<br />
s.u. Enterokokken<br />
Enterokokken<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Keimidentifizierung<br />
- Ggf. Antibiogramm<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Keime der physiologischen Dünndarmflora. Enterokokken werden häufig als Kontaminanten in<br />
Untersuchungsproben nachgewiesen. Besondere Bedeutung als möglicher Erreger einer bakteriellen<br />
Endocarditis (Blutkulturdiagnostik/Untersuchungsmaterial von Herzklappen), sonst bei<br />
intraabdominellen Prozessen, tiefen W<strong>und</strong>infektionen oder Harnwegsinfekten. Materialentnahme<br />
entsprechend der Infektlokalisation. Lagerung der Probe je nach Material bei 4°C (z.B. Urin) oder<br />
Raumtemperatur (z.B. Blutkulturen).<br />
Bemerkungen, Besondere Hinweise:<br />
Zu den klinisch relevanten Spezies gehören:<br />
- Enterococcus faecalis<br />
- Enterococcus faecium<br />
- Enterococcus gallinarum<br />
In der Regel weisen Enterokokken eine natürliche breite Antibiotikaresistenz auf (z.B. gegen<br />
Cephalosporine).<br />
Daher sollte eine Behandlung möglichst nach Antibiogramm erfolgen. Von besonderer Bedeutung<br />
94 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5 Mikrobiologie<br />
sind Resistenzen gegen Glykopeptidantibiotika (Vancomycin/Teicoplanin), die als GRE oder VRE<br />
bezeichnet werden <strong>und</strong> deren Nachweis besondere krankenhaushygienische Maßnahmen notwendig<br />
machen.<br />
Escherichia coli<br />
s.u. Enterobacteriaceae<br />
Fistelabstrich<br />
s.u. W<strong>und</strong>abstrich<br />
Follikelabstrich<br />
s.u. W<strong>und</strong>abstrich<br />
Furunkelabstrich<br />
s.u. W<strong>und</strong>abstrich<br />
Gallensekret/-abstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Darmpathogene Keime (Salmonella, Shigella, Yersinia, Campylobacter)<br />
- Ggf. Antibiogramm<br />
Auf Anforderung: Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Unter aseptischen Bedingungen das Sekret abnehmen <strong>und</strong> schnellstmöglich ins Labor transportieren.<br />
Lagerung bei 4°C.<br />
Bemerkungen, Besondere Hinweise:<br />
Sekret ist dem Abstrich vorzuziehen.<br />
Gasbrand<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Schwere Weichteilinfektion mit rasch fortschreitender Muskelnekrose <strong>und</strong> generalisierter Intoxikation.<br />
W<strong>und</strong>abstriche <strong>und</strong> nekrotisches Gewebe, Blutkulturen. Möglichst schneller Probentransport<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 95
5 Mikrobiologie<br />
zur mikroskopischen Absicherung der Diagnose.<br />
Lagerung bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:<br />
Zu den klassischen Gasödemerregern gehören:<br />
- Clostridium perfringens<br />
- Clostridium novyi<br />
- Clostridium septicum<br />
- Clostridium histolyticum<br />
Meist entwickelt sich der Gasbrand schnell zu einer lebensbedrohlichen Mischinfektion mit zahlreichen<br />
aeroben <strong>und</strong> anaeroben Bakterien. Im Verdachtsfall bitte telefonischen Kontakt aufnehmen.<br />
Gehörgangsabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe Kultur<br />
- Keimidentifizierung<br />
- Ggf. Antibiogramm<br />
Auf Anforderung: Kultur auf Sprosspilze/Schimmelpilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Nach Entfernung von Detritus <strong>und</strong> Krusten aus dem Gehörgang mittels angefeuchtetem Tupfer erfolgt<br />
die Materialentnahme unter Sicht (Otoskop) von geröteten oder sekretbedeckten Bereichen; Tupfer,<br />
in Abstrichmedium geben. Berührung unauffälliger Bereiche vermeiden. Bei trockenen Läsionen<br />
Tupfer vorher mit steriler physiol. NaCl-Lösung anfeuchten oder (insbesondere bei Verdacht auf<br />
Otomykose) Entnahme von einigen Hautschuppen mit einem sterilen Spatel.<br />
Lagerung bei 4°C.<br />
Bemerkungen, Besondere Hinweise:<br />
Bitte Diagnose angeben (Otitis externa bzw. Otitis media) – für Bef<strong>und</strong>interpretation wichtig!<br />
Gelenkpunktat<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat/Nativpräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Keimidentifizierung<br />
- Antibiogramm<br />
- Hemmstofftest<br />
Auf Anforderung:<br />
- Zellzahlbestimmung nur aus EDTA-Röhrchen möglich (max. 2h nach Entnahme, da sonst Autolyse)<br />
- Rhagozyten<br />
- Verteilung von Lymphozyten <strong>und</strong> Granulozyten<br />
96 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Probenentnahme <strong>und</strong> Transport: S.u. Punktate<br />
5 Mikrobiologie<br />
Bemerkungen, Besondere Hinweise:<br />
Da häufig nur sehr wenige Erreger in den Punktaten enthalten sind, deren Vermehrung eines längeren<br />
Zeitraums bedarf, werden Gelenkpunktate erst nach 10tägiger Bebrütung endgültig als negativ<br />
bef<strong>und</strong>et.<br />
Genitalabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Keimidentifizierung<br />
- Ggf. Antibiogramm<br />
Auf Anforderung:<br />
- Kultur auf Sprosspilze<br />
- Kultur auf Mykoplasma hominis/Ureaplasma urealyticum<br />
- Kultur auf Neisseria gonorrhoeae (Gonokokken) bzw. mittels PCR<br />
- Humanes Papilloma-Virus (HPV)-DNA-Nachweis im Abstrichmaterial mittels PCR<br />
- Herpes simplex-Virus-DNA-Nachweis mittels PCR im Abstrichmaterial/Bläscheninhalt<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Der Abstrich sollte von makroskopisch verdächtigen Stellen mit einem sterilen Wattetupfer entnommen<br />
<strong>und</strong> in Transportmedium eingesandt werden. Lagerung bei 4°C.<br />
Bemerkungen, Besondere Hinweise:<br />
Siehe auch Kapitel Molekularbiologie.<br />
Giardia lamblia<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Krankheitsbild: Lambliasis/Lamblienruhr<br />
wässrige Diarrhöen, Malabsorptionssyndrom, Gewichtsverlust<br />
Stuhlproben: Lagerung bei 4°C.<br />
s.u. Stuhldiagnostik<br />
Bemerkungen, Besondere Hinweise:<br />
Parasitäre Erkrankung durch Protozoen. Mikroskopischer Nachweis der Trophozoiten ist nur in<br />
frischem Stuhl möglich.<br />
Sonst Untersuchung auf Lamblienzysten <strong>und</strong> Antigennachweis mittels ELISA aus dem Stuhl.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 97
5 Mikrobiologie<br />
Gonokokken<br />
s.u. Neisseria gonorrhoeae<br />
GRE<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Glykopeptidresistente Enterokokken, s.u. Enterokokken. Untersuchung auf GRE ist gr<strong>und</strong>sätzlich aus<br />
allen bakteriologischen Untersuchungsproben möglich.<br />
Bemerkungen, Besondere Hinweise:<br />
Bei Nachweis von GRE sind besondere krankenhaushygienische Maßnahmen zu beachten!<br />
Harnröhrenabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Keimdifferenzierung<br />
- Ggf. Antibiogramm<br />
- Kultur auf Mykoplasma hominis/Ureaplasma urealyticum<br />
Auf Anforderung:<br />
- Kultur auf Gardnerella vaginalis<br />
- Kultur auf Sprosspilze<br />
- Kultur auf Neisseria gonorrhoeae (Abstrich im Medium) bzw. Nachweis von N. gonorrhoeae-DNA<br />
mittels PCR<br />
- Nachweis von Chlamydia trachomatis-DNA mittels PCR<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Abstrich frühestens 3 St<strong>und</strong>en nach der letzten Miktion abnehmen. Bereich um die<br />
Harnröhrenmündung mit Wasser <strong>und</strong> Seife reinigen, gut abspülen <strong>und</strong> mit sterilem Tupfer abtrocknen.<br />
Dünnen Abstrichtupfer ca. 2 cm einführen <strong>und</strong> drehen, dann in Transportmedium<br />
(Abstrich-Röhrchen) überführen. Lagerung bei 4°C.<br />
Chlamydien-Abstrich am besten nach den anderen Abstrichen abnehmen. Tupfer mindestens 2-3 cm<br />
einführen <strong>und</strong> kräftig drehen, um zellhaltiges Material zu gewinnen, anschließend in Chlamydien-<br />
Transportmedium geben (s.u. ” Cervixabstrich“ bzw. Molekularbiologie). Lagerung bei 4°C.<br />
Bemerkungen, Besondere Hinweise:<br />
Entscheidend für den erfolgreichen Erregernachweis ist die Gewinnung einer ausreichend großen<br />
Zellzahl, da Chlamydien sich obligat intrazellulär vermehren. Der Nachweis mittels PCR ist sinnvoll<br />
bei anbehandelten Patienten. Siehe auch Kapitel Molekularbiologie.<br />
98 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Hautabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Keimidentifizierung<br />
- Ggf. Antibiogramm<br />
Auf Anforderung: Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Exzisionsmaterial besser als Abstrichmaterial geeignet.<br />
5 Mikrobiologie<br />
Bemerkungen, Besondere Hinweise:<br />
Die Hautoberfläche ist überwiegend von Mikroorganismen der physiologischen Flora besiedelt.<br />
Diese werden dann meist aus den Abstrichproben kultiviert, ohne von klinischer Bedeutung zu<br />
sein. Daher ist eine Punktion/Exzision aus dem infektiologisch verdächtigen Hautbereich für die<br />
mikrobiologische Diagnostik wesentlich sinnvoller.<br />
Hautschuppen, Nagelspäne <strong>und</strong> Haare<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Mikroskopischer Nachweis von Pilzhyphen<br />
- Kultureller Nachweis <strong>und</strong> Differenzierung von Hefen, Dermatophyten <strong>und</strong> Schimmelpilzen<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Verdächtige Hautstellen mit 70%igem Alkohol reinigen <strong>und</strong> Material (z.B. Hautschuppen) mit<br />
Skalpell vom Rand des Herdes abkratzen. Nagel mit Alkohol reinigen, Teil des betroffenen Bereiches<br />
abschneiden <strong>und</strong> Material von der Nagelunterseite mit Skalpell oder Nagelfeile gewinnen.<br />
Haarstümpfe mit Pinzette herausziehen. Material in Papiertütchen oder trockenem Röhrchen sammeln.<br />
Lagerung bei Raumtemperatur. S.u. Dermatomykosen<br />
Bemerkungen, Besondere Hinweise:–<br />
HUS<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Hämolytisch urämisches Syndrom. Erreger: EHEC (enterohämorrhagischer Escherichia coli).<br />
s.u. Stuhldiagnostik<br />
Bemerkungen, Besondere Hinweise:–<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 99
5 Mikrobiologie<br />
Impetigoabstrich<br />
s.u. Hautabstrich<br />
Bemerkungen, Besondere Hinweise:<br />
Wegen des Erregerspektrums wird hier nur eine aerobe Kultur angelegt.<br />
Influenzavirus A <strong>und</strong> B<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
RNA-Nachweis mittels PCR (Rachenspülwasser oder Nasopharyngealabstrich)<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Die echte Virusgrippe (Influenza) ist, im Gegensatz zu den durch Parainfluenzaviren hervorgerufenen<br />
” grippalen Infekten“ , eine hochkontagiöse <strong>und</strong> häufig schwer verlaufende, fieberhafte Infektion der<br />
Atemwege. Nicht selten treten im Rahmen einer Generalisation weitreichende Komplikationen auf.<br />
Zur Untersuchung eignen sich: Nasenspülflüssigkeit, Nasen- Rachenaspirat, Nasen- Rachenabstriche.<br />
Materialien in steriler physiologischer NaCl-Lösung bzw. Tupfer im Transportmedium möglichst<br />
schnell einsenden. Siehe auch Kapitel Molekularbiologie.<br />
Lagerung bei 4-8°C.<br />
Bemerkungen, Besondere Hinweise:<br />
Vor allem die Influenzaviren des Serotyps A führen in Westeuropa zu epidemischer bzw. pandemischer<br />
Verbreitung. Durch sich verändernde Oberflächenantigene (Hämagglutinine <strong>und</strong> Neuraminidasen)<br />
entstehen ständig neue Virustypen: Gemäß den STIKO (Ständige Impfkommission) – Empfehlungen<br />
wird eine Influenza-Impfung z.B. für alle Patienten mit chronischen Erkrankungen, allen Menschen<br />
ab dem 60.ten Lebensjahr sowie für alle in Praxen, Krankenhäusern <strong>und</strong> Laboratorien mit Patienten<br />
in Kontakt stehenden Personen angeraten. Diese Impfung ist jährlich zu wiederholen, da die Zusammensetzung<br />
des Impfstoffes den aktuellen Virusvarianten angepasst wird.<br />
IUP<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Kultur auf Aktinomyceten<br />
Auf Anforderung: Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Möglichst steril entnehmen <strong>und</strong> in einem sterilen Gefäß einsenden. Lagerung bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:–<br />
100 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Katheterspitzen<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung: Aerobe Kultur<br />
Auf Anforderung: Kultur auf Sprosspilze<br />
5 Mikrobiologie<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Zunächst Alkohol-Desinfektion der Insertionsstelle. Ziehen des Katheters nach Verdunstung des<br />
Alkohols. Ca. 5 cm des distalen Segmentes mit steriler Schere abschneiden, in steriles Röhrchen mit<br />
Schraubverschluss geben. Ist der Transport nicht am selben Tag zu erwarten, sollte die Katheterspitze<br />
zum Schutz vor Austrocknung in einem Transportmedium aufbewahrt werden.<br />
Lagerung bei 4°C.<br />
Bemerkungen, Besondere Hinweise:–<br />
Kieferhöhlenabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Keimidentifizierung<br />
- Ggf. Antibiogramm<br />
Auf Anforderung: Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Möglichst steril abnehmen, d.h. unter Vermeidung von Kontaminationen mit der physiologischen<br />
Flora <strong>und</strong> den Abstrichtupfer in einem sterilen Transportmedium einsenden.<br />
Lagerung bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:–<br />
Klebsiella oxytoca<br />
s.u. Enterobacteriaceae<br />
Klebsiella pneumoniae<br />
s.u. Enterobacteriaceae<br />
Kniegelenkspunktat<br />
s.u. Punktate<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 101
5 Mikrobiologie<br />
Bemerkungen, Besondere Hinweise:<br />
Da häufig nur sehr wenige Erreger in den Punktaten enthalten sind, deren Vermehrung eines längeren<br />
Zeitraums bedarf, werden Gelenkpunktate erst nach 10tägiger Bebrütung endgültig als negativ<br />
bef<strong>und</strong>et.<br />
Konjunktivalabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Keimdifferenzierung<br />
- Ggf. Antibiogramm<br />
Auf Anforderung:<br />
- Kultur auf Sprosspilze<br />
- Kultur auf Neisseria gonorrhoeae (Abstrich im Medium), bzw. PCR auf N. gonorrhoeae<br />
- Kultur auf Mykoplasma hominis/Ureaplasma urealyticum bei Neugeborenen<br />
- Nachweis von Chlamydia trachomatis-DNA mittels PCR<br />
- Nachweis von Adenovirus-DNA mittels PCR (W)<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Antimikrobielle Augentropfen <strong>und</strong> Salben rechtzeitig absetzen. Materialgewinnung mit angefeuchtetem<br />
Tupfer (sterile physiol. NaCl-Lösung) vor Anwendung von Lokalanästhetika. Abstrichtupfer<br />
anschließend in Transportmedium geben.<br />
Abstrichtupfer für Chlamydien mehrmals kräftig drehen, um zellhaltiges Material zu gewinnen.<br />
Tupfer in Chlamydien-Transportmedium eintauchen, überstehendes Ende abschneiden, Röhrchen<br />
verschließen <strong>und</strong> 1x kräftig schütteln. Bis zur Abholung im Kühlschrank aufbewahren (max. 24 h).<br />
Gut geeignet sind auch Konjunktivalschabsel. Lagerung bei 4°C.<br />
Bemerkungen, Besondere Hinweise:<br />
Die Untersuchung auf Chlamydien ist insbesondere sinnvoll, wenn der Verdacht auf eine<br />
Neugeborenen- oder Schwimmbad-Konjunktivitis besteht. Siehe auch Kapitel Molekularbiologie.<br />
Adenoviren sind Erreger der Keratoconjunktivitis epidemica.<br />
Kryptosporidien-Antigen im Stuhl<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Der Nachweis von Cryptosporidium parvum-Antigen im Stuhl weist die Infektion mit Kryptosporidien<br />
nach. Ein negativer Bef<strong>und</strong> schließt die Infektion jedoch nicht aus. Die Infektion tritt gehäuft in<br />
den Sommermonaten nach oraler Aufnahme von Oozysten (kontaminiertes Wasser) auf.<br />
Stuhlprobe nicht in SAF-Röhrchen entnehmen (für diese Untersuchung nicht geeignet), Probe nach<br />
Entnahme kühlen, Lagerung bei 4°C.<br />
Bemerkungen, Besondere Hinweise:–<br />
102 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Lamblien<br />
s.u. Giardia lamblia<br />
Liquordiagnostik<br />
5 Mikrobiologie<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat + Nativpräparat<br />
- Antigen-Screening mittels Latexagglutinationstest auf Meningokokken, Haemophilus influenzae,<br />
Pneumokokken, Streptokokken Gruppe B <strong>und</strong> E. coli K1<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Keimidentifizierung<br />
- Ggf. Antibiogramm<br />
- Hemmstofftest<br />
Auf Anforderung:<br />
- Kultur auf Sprosspilze<br />
- Mykobakterien-Diagnostik: Mikroskopisches Präparat auf ” säurefeste Stäbchen“<br />
- Kultureller Nachweis von Mykobakterien<br />
- M. tuberculosis-DNA mittels PCR<br />
- N. meningitidis-DNA mittels PCR (W)<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Sorgfältige Hautdesinfektion wie für Blutkulturen beschrieben. Nach Verdunstung des Alkohols<br />
Lumbalpunktion mit sterilen Handschuhen. Auffangen des Liquors in 2 Kunststoffröhrchen mit<br />
Schraubverschluss:<br />
1. Für klinisch-chemische Untersuchungen (Zellzahl, Laktat, Zucker, Eiweiß etc.),<br />
2. (Steril) für mikrobiologische Untersuchungen (für Bakteriennachweis mindestens 1-2 ml, für<br />
Pilznachweise möglichst 5 ml). Die Röhrchen gut verschließen.<br />
Die wichtigsten Meningitis-Erreger sind sehr empfindlich. Daher rechtzeitig einen Boten anfordern,<br />
damit der Liquor sofort in einem Wärmebehälter in das Labor transportiert werden kann.<br />
Den Liquor auf keinen Fall kühlen. Sofern ein unmittelbarer Transport ins Labor nicht möglich ist,<br />
Lagerung eines Teiles des Materials bei 37°C. Den zweiten Teil des Liquors in eine vorgewärmte<br />
aerobe Blutkulturflasche (BK-Flasche) spritzen <strong>und</strong> diese bei Raumtemperatur aufbewahren.<br />
Bitte zusätzlich auch immer Nativ-Liquor mitschicken; er wird für das Grampräparat, Antigennachweise<br />
<strong>und</strong> die Kultur benötigt. Für die Mykobakterien-Diagnostik bitte mindestens 5 ml einsenden<br />
(nicht in einer BK-Flasche wegen zu starker Verdünnung).<br />
Bemerkungen, Besondere Hinweise:<br />
Bei Meningitis-Verdacht ist die zusätzliche Abnahme von Blutkulturen zu empfehlen, da nicht<br />
selten der Erregernachweis nur über die Blutkultur gelingt. Bei Verdacht auf Pilzinfektion (z.B.<br />
Kryptokokken-Meningitis bei AIDS-Patienten) bitte unbedingt entsprechenden Hinweis bei der<br />
Einsendung angeben.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 103
5 Mikrobiologie<br />
Listeria monocytogenes<br />
s.u. Listerien<br />
Listerien<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Vorkommen in Nahrungsmitteln, vorwiegend in Milchprodukten. Orale Aufnahme. In der Regel<br />
nur bei immungeschwächten Personen, Erreger von Meningitis <strong>und</strong> Sepsis – vor allem schwere<br />
Erkrankungen des Neugeborenen. Nachweis in Liquor <strong>und</strong> Blutkulturen.<br />
Lagerung s.u. Liquordiagnostik/Blutkulturen.<br />
Bemerkungen, Besondere Hinweise:<br />
Einzige für den Menschen pathogene Spezies ist Listeria monocytogenes. Neugeborenenlisteriose/sepsis:<br />
Übertragung von Listerien diaplazentar möglich (Schwangerenlisteriose) oder Infektion des<br />
Neugeborenen auf dem natürlichen Geburtsweg bei vaginaler Kolonisation mit Listerien. Deshalb vor<br />
allem bei Risikoschwangerschaften Vaginalabstrich zum Ausschluss von Listerien einsenden.<br />
Magenbiopsie (Antrum-, Pylorus-) Duodenalbiopsie<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung: Kultureller Nachweis von Helicobacter pylori <strong>und</strong> Antibiogramm (W)<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Biopsie in vorgekühltes Transportmedium (z.B. Abstrich-Röhrchen oder 1 ml sterile physiol.<br />
NaCl-Lösung) einbringen. (Transportmedium bitte bei uns anfordern). Rascher, gekühlter Transport<br />
zum Labor erforderlich, da die Biopsie innerhalb von 2 h nach Gewinnung weiterverarbeitet werden<br />
muss.<br />
Bemerkungen, Besondere Hinweise:–<br />
Magensaft<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Mikroskopisches Präparat auf ” säurefeste Stäbchen“<br />
- Kultur auf Mykobakterien (Fest- <strong>und</strong> Flüssigkultur)<br />
- Differenzierung von Mykobakterien<br />
- Ggf. Resistenzbestimmung: Tuberkulose-Erreger (W), atypische Mykobakterien (U)<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Der Patient sollte nüchtern sein <strong>und</strong> die Entnahme morgens geschehen. Magensaft in Gefäße mit<br />
gesättigter Natrium-Phosphatlösung füllen. (Versandgefäße für Magensaft bitte anfordern).<br />
Lagerung bei 4°C.<br />
104 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5 Mikrobiologie<br />
Bemerkungen, Besondere Hinweise:<br />
Bei unproduktivem Husten bzw. geringer Erregerausscheidung kann die Untersuchung von Magensaft<br />
zusätzlich zur Sputumuntersuchung die Nachweisrate erhöhen.<br />
Malaria-Diagnostik<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Mikroskopischer Nachweis von Plasmodien im Blutausstrich <strong>und</strong> Dicken Tropfen<br />
- Immunchromatographische Antigentestung mittels Schnelltest<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Für den Direktnachweis wird ein Röhrchen EDTA-Blut (2 ml) benötigt.<br />
Da ein negativer Parasitennachweis eine bestehende Malaria nicht sicher ausschließt, sollten bei<br />
bestehendem klinischem Verdacht weitere Proben in kurzen Abständen untersucht werden. Wegen<br />
der vitalen Bedeutung der Malaria sollte der Transport <strong>und</strong> die Untersuchung noch am Abnahmetag<br />
erfolgen.<br />
Bemerkungen, Besondere Hinweise:<br />
Bei Fieber nach Aufenthalt in den Tropen <strong>und</strong> Subtropen sollte immer auch an Malaria gedacht<br />
werden. Für die Diagnostik bei akut erkrankten Patienten ist nur der Direktnachweis von Plasmodien<br />
geeignet, nicht jedoch die serologische Untersuchung, da Antikörper frühestens eine Woche nach<br />
Krankheitsausbruch festgestellt werden können. Bei anbehandelten Patienten kann die Serologie<br />
jedoch hilfreich sein.<br />
Meningokokken<br />
s.u. Neisseria meningitidis <strong>und</strong> Liquordiagnostik<br />
Mikrosporidien (W)<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Synonym: Microspora<br />
Im Tierreich weit verbreitete obligat intrazellulär lebende Parasiten (Protozoen).<br />
Die Erreger führen vor allem bei schwer immunsupprimierten Patienten zu chronisch, wässrigen<br />
Diarrhoen. Selten kann es auch zur Nieren- oder ZNS-Beteiligung kommen.<br />
Stuhluntersuchung: S.u. Stuhldiagnostik<br />
Bemerkungen, Besondere Hinweise:<br />
Besonders häufig wird die Erkrankung bei AIDS-Patienten beobachtet.<br />
Fluoreszenzmikroskopischer Nachweis<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 105
5 Mikrobiologie<br />
Molekularbiologischer Nachweis<br />
Milzbrand<br />
s.u. Bacillus anthracis<br />
Mittelohrsekret<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Ggf. Antibiogramm<br />
- Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Aus dem Trommelfelldefekt austretendes Sekret mit Tupfer, besser Spritze aufnehmen, dabei<br />
Berührung mit der Gehörgangswand vermeiden. Den Tupfer in ein Transportmedium stecken bzw.<br />
Sekret in ein Abstrichmedium spritzen.<br />
Falls kein Defekt vorhanden, Abstrich unter Sicht vom Tubenausgang im Nasopharynx (Kontaminationsgefahr).<br />
Tympanozentese für diagnostische Zwecke nur bei Neugeborenen <strong>und</strong> chronischen oder<br />
therapieresistenten Fällen erwägenswert. Lagerung bei 4°C.<br />
Bemerkungen, Besondere Hinweise:–<br />
MRSA-Diagnostik<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Screening-Untersuchungen zur Ermittlung des Besiedlungsstatus bei Risikopatienten entsprechend<br />
Risikoeinteilung mit selektivem bakteriologischen Verfahren:<br />
- Kulturell (neg. Bef<strong>und</strong> nach 24 h Verdacht auf MRSA nach 24 h)<br />
- Selektive bakteriologische Untersuchung bei Verdacht auf Infektion mittels PCR (MRSA Schnelltest)<br />
bei Ankunft bis 16 Uhr Bef<strong>und</strong> i.d.R. am gleichen Tag<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Methicillin resistenter Staphylococcus aureus<br />
Synonym: Oxacillin resistenter Staphylococcus aureus (ORSA)<br />
Screening-Untersuchung:<br />
- Nasenabstrich (Vestibulum nasi)<br />
- Rachenabstrich<br />
- Ggf. W<strong>und</strong>abstrich o.ä.<br />
Kultur: Abstriche mit angefeuchtetem Wattetupfer (sterile NaCl 0,9% Lsg.) mit Medium entnehmen.<br />
PCR: Trockener Abstrich ohne Medium, zusätzlich Abstrich von der gleichen Stelle mit Medium, um<br />
ggf. im positiven PCR Nachweis die Kultur mit Resistenzbestimmung anlegen zu können.<br />
Lagerung bei Raumtemperatur.<br />
106 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5 Mikrobiologie<br />
Bemerkungen, Besondere Hinweise:<br />
Bei erstmaligem Nachweis ggf. mit Genotypisierung (spa-Typisierung), um bei Ausbrüchen epidemiologische<br />
Zusammenhänge zu erkennen. Isolierung von mit MRSA infizierten/kolonisierten Patienten<br />
entsprechend RKI – Vorgaben <strong>und</strong> nachfolgende Sanierung.<br />
Siehe auch Kapitel Molekularbiologie.<br />
M<strong>und</strong>abstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Aerobe Kultur<br />
- Ggf. Antibiogramm<br />
- Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Lagerung bei 4°C.<br />
Bemerkungen, Besondere Hinweise:–<br />
MPV (Humanes Metapneumovirus)<br />
s.u. Kapitel Molekularbiologie<br />
Nabelabstrich<br />
s.u. Hautabstrich<br />
Nasenabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Aerobe Kultur<br />
- Ggf. Antibiogramm<br />
Auf Anforderung: Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Ein mit steriler physiol. NaCl-Lösung befeuchteter Tupfer wird etwa 1-2 cm in die Nasenlöcher<br />
eingeführt <strong>und</strong> an der Mukosa gedreht. Lagerung bei 4°C.<br />
Bemerkungen, Besondere Hinweise:<br />
Wegen mangelnder Spezifität ist eine allgemeine Kultur nur dann sinnvoll, wenn der Trägerstatus von<br />
Staphylokokken, Pneumokokken, Meningokokken <strong>und</strong> Haemophilus untersucht werden soll bzw.<br />
wenn nasale Läsionen vorliegen.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 107
5 Mikrobiologie<br />
Nasennebenhöhlensekret<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Ggf. Antibiogramm<br />
Auf Anforderung: Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Punktion der Nebenhöhlen <strong>und</strong> Aspiration von Sekret. Nebenhöhlen-Spülflüssigkeit ist häufig<br />
durch Nasenflora kontaminiert, was die Bewertung erschwert. Falls schneller Transport ins Labor<br />
möglich ist, Material in steriles Röhrchen mit Schraubverschluss geben. Andernfalls in bzw. auf ein<br />
Abstrichmedium spritzen <strong>und</strong> bis zum Transport bei 4°C lagern.<br />
Bemerkungen, Besondere Hinweise:–<br />
Nasopharyngealabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung: Nachweis von Bordetella pertussis-DNA mittels PCR<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Nasopharyngealabstrich im Abstrich ohne Medium, ggf. in Röhrchen mit 1-2 ml physiol. NaCl-<br />
Lösung.<br />
Lagerung bis zum Versand bei 4°C.<br />
Bemerkungen, Besondere Hinweise:<br />
Siehe auch Kapitel Molekularbiologie<br />
Neisseria gonorrhoeae<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Erreger der Gonorrhoe (Tripper). Genital-, Urethralabstriche, Eiter.<br />
Sofortiger Probenversand, da die Keime sehr temperaturempfindlich sind.<br />
Bemerkungen, Besondere Hinweise:<br />
Kulturell (Abstrich im Medium). Siehe auch Kapitel Molekularbiologie.<br />
Neisseria meningitidis<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
108 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5 Mikrobiologie<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Erreger der Meningokokkenmeningitis <strong>und</strong> Sepsis. Untersuchungsmaterial: Liquor/Blutkulturen<br />
sofortiger Probenversand, da die Keime sehr temperaturempfindlich sind.<br />
Lagerung: S.u. Liquordiagnostik<br />
Bemerkungen, Besondere Hinweise:<br />
Es existieren verschiedene Serogruppen von Neisseria meningitidis (A, B, C, W <strong>und</strong> Y), die weltweit<br />
in unterschiedlicher Häufung anzutreffen sind. Aus epidemiologischen Gründen wird gr<strong>und</strong>sätzlich<br />
von kulturell nachgewiesenen Erregern eine Serotypisierung durchgeführt.<br />
Nonfermenter (Oxidase positive gramnegative Stäbchen)<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Zu dieser Bakteriengruppe gehören zahlreiche Arten, die in der Umwelt eine äußerst wichtige Rolle<br />
spielen, aber auch als Erreger nosokomialer Infektionen bedeutsam sein können. Lagerung der Probe<br />
je nach Material bei 4°C (z.B. Urin) oder Raumtemperatur (z.B. Blutkulturen).<br />
Bemerkungen, Besondere Hinweise:<br />
Kulturell (Selektivmedien). Klinisch häufige Nonfermenter: Pseudomonas, Chryseomonas, Flavibacterium,<br />
Achromobacter, Ralstonia.<br />
Noroviren<br />
s.u. Kapitel Molekularbiologie<br />
Oxyuriasis<br />
s.u. Analabklatschpräparat<br />
Panaritium<br />
s.u. W<strong>und</strong>abstrich<br />
Parainfluenzae-Virus<br />
s.u. Kapitel Molekularbiologie<br />
Parodontalkeime<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 109
5 Mikrobiologie<br />
Gruppe von Bakterien, die einzeln oder in wechselnder Gemeinschaft als pathogener Erreger im<br />
Rahmen der Parodontoseentstehung einzustufen sind.<br />
Bemerkungen, Besondere Hinweise:<br />
Molekularbiologischer Nachweis im Rahmen der Parodontose-Diagnostik <strong>und</strong> Therapie.<br />
Siehe Kapitel Molekularbiologie.<br />
Pasteurella sp.<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Natürliches Vorkommen auf den Schleimhäuten verschiedener Haus- <strong>und</strong> Wildtiere. Bedeutendste<br />
humanpathogene Spezies: Pasteurella multocida. W<strong>und</strong>infektionen nach Biss- oder Kratzverletzungen.<br />
W<strong>und</strong>abstriche, W<strong>und</strong>gewebe, ggf. Blutkulturen. Lagerung bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:<br />
Bei immunsupprimierten Patienten auch respiratorische Infekte <strong>und</strong> septische Verläufe möglich.<br />
Penisabstrich<br />
s.u. Genitalabstrich<br />
Plesiomonas shigelloides<br />
s.u. Nonfermenter<br />
Pleurapunktat<br />
s.u. Punktate<br />
Pneumokokken<br />
s.u. Streptococcus pneumoniae<br />
Porphyromonas gingivalis<br />
s.u. Kapitel Molekularbiologie: Parodontalkeime<br />
110 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Prevotella intermedia<br />
s.u. Kapitel Molekularbiologie: Parodontalkeime<br />
Proglottide<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
5 Mikrobiologie<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Teil eines Bandwurmes, der bei Befall makroskopisch sichtbar mit dem Stuhl ausgeschieden wird.<br />
Stuhluntersuchung: S. u. Stuhldiagnostik<br />
Lagerung bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:<br />
Zur Differenzierung der Bandwürmer ist es notwendig solche Proglottiden aufzunehmen <strong>und</strong><br />
einzuschicken.<br />
Propionibacterium sp.<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Anaerob wachsende, grampositive, verzweigte Stäbchenbakterien, meist aus den Talgdrüsen der<br />
Haut hervorgehend. Keime der physiologischen Haut- <strong>und</strong> Schleimhautflora. Daher werden Propionibakterien<br />
meist als Kontaminanten in Untersuchungsproben nachgewiesen. Bef<strong>und</strong>e werden<br />
dementsprechend begutachtet <strong>und</strong> kommentiert.<br />
Bemerkungen, Besondere Hinweise:<br />
Selten von pathogener Bedeutung (z.B. bei katheter- oder implantatassoziierten Infektionen).<br />
Proteus sp.<br />
s.u. Enterobacteriaceae<br />
Bemerkungen, Besondere Hinweise:<br />
Klinisch häufig nachgewiesene Spezies:<br />
- Proteus mirabilis<br />
- Proteus vulgaris<br />
- Proteus penneri<br />
Prostatapunktat<br />
s.u. Punktate<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 111
5 Mikrobiologie<br />
Pseudomenbranöse Kolitis<br />
s.u. Clostridium difficile<br />
Pseudomonas sp.<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Bakterien aus der Familie der Pseudomonaceae, die ubiquitär in der Umwelt vorkommen <strong>und</strong> ein<br />
feuchtes Milieu bevorzugen (Feuchtraumkeime). Erreger von W<strong>und</strong>- <strong>und</strong> Harnwegsinfektionen,<br />
Pneumonie, Peritonitis, Sepsis usw. Materialentnahme entsprechend der Infektlokalisation. Lagerung<br />
der Probe je nach Material bei 4°C (z.B. Urin) oder Raumtemperatur (z.B. Blutkulturen).<br />
Bemerkungen, Besondere Hinweise:<br />
Die medizinisch bedeutsamste Spezies ist Pseudomonas aeruginosa.<br />
Weitere häufig vorkommende Arten sind:<br />
- Pseudomonas putida<br />
- Pseudomonas fluorescens u.a.<br />
Da Pseudomonaden sehr schnell Resistenzen entwickeln, sollte eine Antibiotikatherapie möglichst<br />
nur nach Antibiogramm erfolgen <strong>und</strong> in Abhängigkeit von der Schwere der Infektion mit einer Kombination<br />
aus mindestens zwei, der als sensibel getesteten Antibiotika verschiedener Substanzklassen<br />
durchgeführt werden (z.B. Ceftazidim + Aminoglykosid oder Chinolon + Aminoglykosid).<br />
Punktate aus physiologisch sterilen Körperhöhlen wie Pleura, Aszites<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat/Nativpräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Keimidentifizierung<br />
- Ggf. Antibiogramm<br />
- Bei V.a. Peritonitis: Kultur auf darmpathogene Keime (Salmonalla, Shigella, Yersinia, Campylobacter)<br />
- Hemmstofftest<br />
Auf Anforderung:<br />
- Kultur auf Sprosspilze<br />
- Mikroskopisches Präparat auf ” säurefeste Stäbchen“<br />
- Kultur auf Mykobakterien<br />
- Differenzierung <strong>und</strong> Resistenz-Bestimmung von Tuberkulose-Erregern (W), atypischen Mykobakterien<br />
(U)<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Für die perkutane Probengewinnung wird die Punktionsregion mit alkoholischem Hautdesinfektionsmittel<br />
zweifach gereinigt <strong>und</strong> desinfiziert. Die Einwirkzeit von jeweils mind. 1 Minute ist<br />
dabei einzuhalten. Sofern ein sofortiger Transport zum Labor möglich ist, kann das Material in ein<br />
112 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5 Mikrobiologie<br />
Abstrichmedium injiziert werden. Andernfalls sollte ein Teil des Punktats unter sterilen Kautelen in<br />
eine aerobe <strong>und</strong> eine anaerobe Blutkulturflasche gespritzt werden; bitte zusätzlich aber immer natives<br />
Punktat einschicken (für das Grampräparat). Blutkulturflasche, wenn möglich, in den Brutschrank<br />
stellen, sonst, wie auch das Abstrichmedium bei Raumtemperatur aufbewahren.<br />
Für die Mykobakterien-Diagnostik möglichst 10 ml Flüssigkeit einsenden (im sterilen Röhrchen mit<br />
Schraubverschluss; bitte nicht in einer Blutkulturflasche).<br />
Bemerkungen, Besondere Hinweise:<br />
Für die mikroskopische Untersuchung von Flüssigkeiten aus Pleura-, Peritoneal – <strong>und</strong> anderen<br />
Körperhöhlen ist die Einhaltung streng aseptischer Bedingungen bei der Entnahme zu beachten, um<br />
eine Kontamination des Punktates, aber auch eine Keimeinschleppung in die Räume zu verhindern.<br />
Das Einsenden eines Punktates ist dem eines Abstriches vorzuziehen. Da in einigen Punktaten<br />
(z.B. Gelenkpunktate) häufig nur sehr wenige Erreger enthalten sind, deren Anzucht eines längeren<br />
Zeitraums bedarf, werden solche Untersuchungsmaterialien erst nach 10tägiger Bebrütung endgültig<br />
als negativ bef<strong>und</strong>et.<br />
Rachenabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Aerobe Kultur<br />
- Keimidentifizierung<br />
- Ggf. Antibiogramm<br />
Bei Anforderung ” hämolysierende Streptokokken“ oder ” Scharlach“ erfolgt nur die Kultur auf<br />
ß-hämolysierende Streptokokken<br />
Auf Anforderung: Kultur auf Gonokokken, Kultur auf Meningokokken, Corynebacterium diphtheriae,<br />
Kultur auf Sprosspilze, mikrosk. Angina Plaut-Vincenti<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Zunge mit Spatel herunterdrücken. Abstrich aus entzündeten oder mit Sekret bedeckten Stellen<br />
der Tonsillen, des Gaumenbogens oder der hinteren Rachenwand entnehmen. In Tonsillarkrypten<br />
Material unter <strong>Dr</strong>ehen entnehmen. Membranöse Beläge stets anheben <strong>und</strong> von der Unterseite Material<br />
entnehmen. Tupfer anschließend in Transportmedium geben.<br />
Lagerung bei Raumtemperatur.<br />
Wegen der Empfindlichkeit der Neisserien ist der umgehende Transport des in Medium gegebenen<br />
Tupfers erforderlich.<br />
Pseudo-Membranen bei Diphtherie vorsichtig abheben. Material von der Unterseite <strong>und</strong>/oder vom<br />
Gr<strong>und</strong> der Läsion mit Tupfer entnehmen. Zusätzlich Abstriche von Nasopharyngealraum, tiefer<br />
Nasenhöhle <strong>und</strong> von entzündeten Stellen entnehmen. Wegen der Bedeutung der Erkrankung umgehender<br />
Transport ins Labor erforderlich.<br />
Orale Candidose, häufig bei immunsupprimierten Patienten.<br />
Bemerkungen, Besondere Hinweise:<br />
Verdacht auf Pharynx-GO. Meningokokkenkeimträger. Bei AIDS-Patienten mit oraler Candidose<br />
sollte auch an das mögliche Vorliegen eines Ösophagusbefalls gedacht werden.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 113
5 Mikrobiologie<br />
Redonspitzen<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Aerobe Kultur<br />
- Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Transport in sterilem Röhrchen mit Schraubverschluss. Bei Lagerung bis zu 24 h Material in<br />
Transportmedium geben <strong>und</strong> bei 4°C aufbewahren.<br />
Bemerkungen, Besondere Hinweise:<br />
Wertvolleres Material ist der Inhalt von Redonflaschen <strong>und</strong>/oder <strong>Dr</strong>ainageschläuchen.<br />
Rektalabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Aerobe Kultur<br />
- Kultur auf darmpathogene Keime (Salmonella, Shigella, Yersinia, Campylobacter)<br />
- Ggf. Antibiogramm<br />
Auf Anforderung:<br />
- Kultur auf Sprosspilze<br />
- Kultur auf N. gonorrhoeae (Abstrich im Medium)<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Wegen der Empfindlichkeit von Shigellen Material möglichst umgehend zum Labor schicken,<br />
alternativ bei Raumtemperatur lagern. Tupfer nach Abstrich der Läsion in Transportmedium geben<br />
<strong>und</strong> umgehend ins Labor schicken. Falls das nicht möglich ist, Lagerung bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:<br />
Bei Verdacht auf bakterielle Ruhr oder wenn Gewinnung einer Stuhlprobe nicht möglich ist. Proktitis<br />
<strong>und</strong> Proktokolitis z.B. bei homosexuellen Männern.<br />
RS-Virus (respiratorisch, sekretorisch)<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Antigen- Nachweis (Rachenspülflüssigkeit), Nachweis von RSV-RNA mittels PCR.<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Probentransport möglichst gekühlt (ca. + 2°C – + 8°C). Siehe auch Kapitel Molekularbiologie.<br />
Bemerkungen, Besondere Hinweise:<br />
Kindliche Atemwegsinfektionen, atypische Pneumonien (Säuglinge, auch Kinder <strong>und</strong> Erwachsene),<br />
Bronchiolitis, Krupp.<br />
114 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Ruhr<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Erkrankung durch darmpathogene Erreger (Shigellen/Amöben/Lamblien)<br />
s.u. Enterobacteriaceae (bakterielle Ruhr)<br />
s.u. Amöbiasis (Amöbenruhr)<br />
s.u. Giardia lamblia (Lamblienruhr)<br />
s.u. Stuhldiagnostik<br />
Bemerkungen, Besondere Hinweise:–<br />
Salmonella sp.<br />
s.u. Enterobacteriaceae <strong>und</strong> Stuhldiagnostik<br />
Salmonella typhi/paratyphi<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
5 Mikrobiologie<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Erreger des Typhus. Im Gegensatz zu den in der Regel mild verlaufenden Salmonellenenteritiden<br />
handelt es sich beim Typhus um eine schwere Allgemeininfektion mit teilweise septischem<br />
Krankheitsverlauf.<br />
Stuhlproben, Blutkulturen. Lagerung bei 4°C (Stuhl) Lagerung bei Raumtemperatur (Blutkulturen).<br />
s.u. Stuhldiagnostik<br />
Bemerkungen, Besondere Hinweise:<br />
Typhus kommt in Ländern mit hohem Hygienestandard (Westeuropa/Nordamerika usw.) ausgesprochen<br />
selten vor. Zumeist wird die Erkrankung von Fernreisenden mitgebracht (Reiseanamnese).<br />
Im Verdachtsfall bitte telefonischen Kontakt aufnehmen.<br />
Schistosomen<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Krankheitsbild: Schistosomiasis (Synonym: Bilharziose), Erreger:<br />
- Schistosoma haematobium (Blasenbilharziose)<br />
- Schistosoma mansoni (Darmbilharziose)<br />
- Schistosoma japonicum (asiatische Darmbilharziose)<br />
Nachweis der Eier im Urin <strong>und</strong>/oder Stuhl. S.u. Stuhldiagnostik, s.u. Urin-Diagnostik III, Parasiten.<br />
Bemerkungen, Besondere Hinweise:<br />
Die Schistosomen gehören zur Gruppe der Trematoden (Saugwürmer). Sie durchlaufen einen<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 115
5 Mikrobiologie<br />
komplexen Entwicklungszyklus wobei Süßwasserschnecken als Zwischenwirt <strong>und</strong> der Mensch<br />
als Endwirt fungiert. Durch die Eier dieser Parasiten werden starke Entzündungsprozesse in der<br />
Blasenwand oder im Bereich der Darmschleimhaut ausgelöst, die auch zu Hämaturie, Leukozyturie<br />
<strong>und</strong> blutig schleimigen Diarrhoen führen.<br />
Weltweit endemische Verbreitung in tropischen <strong>und</strong> subtropischen Regionen.<br />
Shigella sp.<br />
s.u. Enterobacteriaceae <strong>und</strong> Stuhldiagnostik<br />
Serratia sp.<br />
s.u. Enterobacteriaceae<br />
Bemerkungen, Besondere Hinweise:<br />
Klinisch häufig nachgewiesene Spezies:<br />
- Serratia marcescens<br />
- Serratia liquefaciens<br />
Sputum I<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe Kultur<br />
- Ggf. Antibiogramm<br />
- Kultur auf Sprosspilze<br />
Auf Anforderung:<br />
- Kultur auf Legionellen<br />
- Kultur auf Nonfermenter<br />
- Chlamydia pneumoniae-DNA mittels PCR<br />
- Nachweis von Legionellen-DNA mittels PCR (Igelleistung!)<br />
- Nachweis von Mycoplasma pneumoniae-DNA mittels PCR<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Ggf. Prothesen entfernen. Kurz vor der Expektoration M<strong>und</strong> mehrmals gründlich mit frischem<br />
Leitungswasser spülen (kein M<strong>und</strong>wasser verwenden!).<br />
Gründlich in ein Sputum-Röhrchen abhusten (30 ml Kunststoffröhrchen mit Schraubverschluss).<br />
Bei erfolgloser Expektoration Provokation durch Inhalation von erwärmtem hypertonen Aerosol (z.B.<br />
wässrige Lösung von 10% Glycerin <strong>und</strong> 15% NaCl) oder Gabe von Mukolytika. Der Patient muss<br />
darüber aufgeklärt werden, dass Sputum kein Speichel ist. Das Sputum sollte bis zur Abholung im<br />
Kühlschrank aufbewahrt werden, um eine Überwucherung durch Keime der M<strong>und</strong>flora zu vermeiden<br />
(jedoch nicht länger als 24 h, da empfindliche Keime sonst absterben).<br />
Bemerkungen, Besondere Hinweise:<br />
116 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5 Mikrobiologie<br />
Am besten geeignet ist das erste Morgensputum. Bei Pneumonie sollte auch an die Entnahme von<br />
Blutkulturen gedacht werden. Insbesondere bei Pneumokokken-Pneumonie erhöht sich dadurch die<br />
Nachweiswahrscheinlichkeit erheblich. Atypische Pneumonie möglich. Die PCR-Untersuchungen<br />
aus BAL sind denen aus Sputum vorzuziehen. Siehe auch Kapitel Molekularbiologie.<br />
Sputum II Nachweis von Mykobakterien<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Mikroskopische Untersuchung auf säurefeste Stäbchen<br />
- Anzüchtung mit drei verschiedenen Tb-Medien<br />
- Differenzierung <strong>und</strong> Resistenzbestimmung von Tuberkulose-Erregern (W), atypischen Mykobakterien<br />
(U)<br />
Auf Anforderung: Nachweis von Mycobacterium tuberculosis-DNA mittels PCR<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Probengewinnung: S.u. ” Sputum I“ .<br />
Wegen der Gefahr der Überwucherung mit Keimen der M<strong>und</strong>flora sollte kein Sammelsputum<br />
eingeschickt werden. Besser ist die getrennte Untersuchung <strong>und</strong> Versendung von mindestens 3, zu<br />
unterschiedlichen Zeiten abgehusteten, nicht zu kleinen Einzelportionen. Lagerung bis zum Transport<br />
im Kühlschrank bei 4°C. Bei erfolgloser Expektoration Provokation von Sputum.<br />
Siehe auch Kapitel Molekularbiologie.<br />
Bemerkungen, Besondere Hinweise:<br />
Geeignet ist nur Material aus den tiefen Luftwegen. Evtl. zusätzlich Untersuchung von Magensaft.<br />
Bronchialsekret bringt meistens eine höhere Erregerausbeute als Sputum.<br />
Für die komplexe Diagnostik der Mycobacteriaceae sind Mindest-Probenvolumina unbedingt zu<br />
beachten:<br />
Sputum (2-10 ml), Bronchialsekret (2-5 ml), BAL (10-30 ml), Pleurapunktat (10-30 ml), Magennüchternsekret<br />
(20-30 ml), Urin (10 ml), Liquor (5 ml). Für eine PCR-Anforderung aus Liquor<br />
werden zusätzlich 2-5 ml benötigt!<br />
Staphylococcus aureus<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Häufigster Erreger eitrig abszedierender Infektionen. Abstriche u. Gewebeproben jeglicher Lokalisation,<br />
Punktate, Eiter, Katheter, Blutkulturen usw. Lagerung bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:<br />
Zur Unterscheidung von Staphylococcus aureus (Koagulase positiv) <strong>und</strong> anderen Koagulase negativen<br />
Staphylokokken dient u.a. das Enzym Plasmakoagulase.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 117
5 Mikrobiologie<br />
Staphylokokken (Koagulase negativ)<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Keime der physiologischen Haut- <strong>und</strong> Schleimhautflora, daher werden Koagulase negative Staphylokokken<br />
meist als Kontaminanten in Untersuchungsproben nachgewiesen.<br />
Bef<strong>und</strong>e werden dementsprechend begutachtet <strong>und</strong> kommentiert.<br />
Bemerkungen, Besondere Hinweise:<br />
Selten von pathogener Bedeutung (z.B. bei katheter- oder implantatassoziierten Infektionen, tiefe<br />
W<strong>und</strong>prozesse).<br />
Stenotrophomonas maltophilia<br />
Frühere Bezeichnung: Pseudomonas maltophilia. s.u. Pseudomonas sp.<br />
Streptococcus agalactiae<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Synonym: Beta-hämolysierende Streptokokken der Gruppe B<br />
W<strong>und</strong>infektionen, Genital- <strong>und</strong> Harnwegsinfektionen, Sepsis – vor allem Neugeborenensepsis<br />
(early-onset/late-onset-Syndrom). Abstriche, Punktate, Gewebeproben, Urin, Blutkulturen. Materialentnahme<br />
entsprechend der Infektlokalisation. Lagerung der Probe je nach Material bei 4°C (z.B.<br />
Urin) oder Raumtemperatur (z.B. Blutkulturen).<br />
Bemerkungen, Besondere Hinweise:<br />
Auf Gr<strong>und</strong> des Risikos einer Neugeborenensepsis sind vor allem bei Risikoschwangerschaften<br />
pränatale Vaginalabstriche zum Nachweis von Streptococcus agalactiae angezeigt.<br />
Streptococcus pneumoniae<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Grampositive Diplokokken aus der Familie der Streptococcaceae. Erreger von bronchopulmonalen<br />
Infekten, schwerer Pneumonie, Sinusitiden, Otitis media, Meningitis <strong>und</strong> Sepsis. Materialentnahme<br />
entsprechend der Infektlokalisation. Lagerung bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:<br />
Gemäß den STIKO (Ständige Impfkommission) – Empfehlungen wird eine Pneumokokken-Impfung<br />
z.B. für alle Patienten mit chronischen Erkrankungen, allen Menschen ab dem 60.ten Lebensjahr<br />
sowie für alle in Praxen, Krankenhäusern <strong>und</strong> Laboratorien mit Patienten in Kontakt stehenden<br />
118 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Personen angeraten.<br />
Streptococcus pyogenes<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
5 Mikrobiologie<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Synonym: Beta-hämolysierende Streptokokken der Gruppe A. Erreger von Infektionen unterschiedlichster<br />
Ätiologie: Tonsillitis (Scharlach), Pharyngitis, Sinusitiden, Otitis media, Phlegmone,<br />
W<strong>und</strong>infektionen, Sepsis, Fasciitis necroticans. Abstriche, Gewebeproben, Punktate, Blutkulturen.<br />
Lagerung bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:<br />
Vor allem bei der Fasciitis necroticans handelt es sich meist um sehr virulente Stämme. Differentialdiagnostisch<br />
ist diese Erkrankung vom klinisch ähnlich imponierenden Gasbrand am schnellsten nur<br />
durch ein mikroskopisches Präparat abzugrenzen.<br />
Stuhldiagnostik<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Eine mindestens haselnußgroße Menge einsenden. Blutige, schleimige oder eitrige Anteile sollten<br />
bevorzugt entnommen werden. Sind zusätzlich parasitologische oder Nachweise mittels ELISA/PCR<br />
vorgesehen sollte das Stuhlgefäß zur Hälfte gefüllt sein. Die Transportzeiten sollten gr<strong>und</strong>sätzlich so<br />
kurz wie möglich gehalten werden.<br />
Bemerkungen, Besondere Hinweise: Für weitere Informationen siehe Kapitel Stuhldiagnostik.<br />
Tonsillenabstrich<br />
s.u. Rachenabstrich<br />
Trachealsekret<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung: S.u. ” Sputum“<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Trachealkanüle bzw. -tubus wechseln; sterilen Katheter einführen, aspiriertes Sekret in steriles<br />
Röhrchen mit Schraubdeckelverschluss übertragen (Gefahr der Aerosolbildung beim Öffnen von<br />
Röhrchen mit Steckverschluss).<br />
Lagerung <strong>und</strong> Transport bei Raumtemperatur.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 119
5 Mikrobiologie<br />
Bemerkungen, Besondere Hinweise:<br />
Trachealsekret ist häufig kontaminiert durch M<strong>und</strong>flora. Bef<strong>und</strong>e werden dementsprechend kommentiert.<br />
Leukozyten im Grampräparat müssen nicht unbedingt auf eine Infektion hinweisen, da auch der<br />
mechanische Reiz durch den Tubus eine Entzündungsreaktion hervorrufen kann.<br />
Treponema denticola<br />
s.u. Kapitel Molekularbiologie: Parodontalkeime<br />
Tuberkulose<br />
s.u. Sputum II/Urin-Diagnostik II Nachweis von Mykobakterien<br />
Tubusspitze<br />
s.u. Absaugkatheter<br />
Typhus<br />
s.u. Salmonella typhi/paratyphi<br />
Ulcusabstrich<br />
s.u. W<strong>und</strong>abstrich<br />
Urin-Diagnostik I ” Urinkultur“<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Aerobe Kultur<br />
- Keimzahlbestimmung<br />
- Hemmstofftest<br />
- Ggf. Antibiogramm<br />
- Urinstatus im amb. Bereich (im stat. Bereich auf Anforderung)<br />
Auf Anforderung: Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Ca. 5-10 ml Urin im sterilen Kunststoffröhrchen mit Schraubverschluss versenden.<br />
Da Bakterien sich bei Zimmertemperatur gut vermehren, muss der Urin bis zum Transport ins Labor<br />
im Kühlschrank aufbewahrt werden (nicht länger als 24 h). Ist dies nicht möglich, sollte für die<br />
Keimzahlbestimmung zusätzlich ein Eintauchnährboden verwendet werden (z.B. MD-Dip-M; bitte<br />
Anleitung beachten).<br />
120 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5 Mikrobiologie<br />
Mittelstrahlurin-Gewinnung:<br />
Bei der Frau: Sorgfältige Reinigung der äußeren Genitalien mit milder Seife, gründliches nachspülen<br />
mit klarem Wasser. Nach Spreizen der Labien Umgebung der Urethramündung mit einem in 0,9%<br />
NaCl oder in Wasser getränkten Tupfer von vorn nach hinten abwischen <strong>und</strong> mit 2. Tupfer trockentupfen.<br />
Einen 3. Tupfer in den Introitus vaginae einlegen, um eine Kontamination durch Vaginalsekret<br />
zu verhindern. Labien weiter gespreizt halten <strong>und</strong> etwa die Hälfte der Blasenfüllung ins WC ablaufen<br />
lassen, dann -ohne den Harnstrahl zu unterbrechen- Urin im sterilen 100 ml Urinbecher auffangen;<br />
die letzte Portion wieder ins WC ablaufen lassen.<br />
Urin aus dem Becher in ein steriles Kunststoffröhrchen umfüllen, ohne den Rand zu berühren <strong>und</strong><br />
dieses dann verschrauben.<br />
Beim Mann: Nach sorgfältigem Händewaschen Vorhaut vollständig zurückziehen, Glans penis<br />
mit einem Tupfer <strong>und</strong> Wasser reinigen, dann mit einem zweiten Tupfer trocknen. Uringewinnung wie<br />
oben beschrieben.<br />
Bemerkungen, Besondere Hinweise:<br />
Morgenurin ist zur bakteriologischen Untersuchung am besten geeignet, da hier die Bakterienzahlen<br />
am höchsten sind, der Abstand zur letzten Miktion sollte mindestens 3 h betragen.<br />
Angabe des Entnahmedatums <strong>und</strong> der Art der Uringewinnung (Mittelstrahlurin, Dauerkatheter etc.)<br />
auf dem Schein erleichtert die Beurteilung.<br />
Bei einwandfreier Gewinnung ist Mittelstrahlurin in der Regel ausreichend. Urinentnahme mittels<br />
Einmal-Katheterisierung ist nur angezeigt, wenn eine einwandfreie Gewinnung von Mittelstrahlurin<br />
nicht möglich ist (Gefahr der Keimeinschleppung).<br />
Bei Dauerkatheter-Trägern darf der Urin nicht aus dem Beutel entnommen werden, sondern muss<br />
durch Punktion des proximalen Abschnitts des Katheters nach Desinfektion der Einstichstelle<br />
gewonnen werden.<br />
Blasenpunktionsurin<br />
Einzige Möglichkeit der Gewinnung einer kontaminationsfreien Urinprobe. Indiziert zur Abklärung<br />
fraglicher Bef<strong>und</strong>e <strong>und</strong> evtl. bei Kleinkindern.<br />
Für die Bef<strong>und</strong>interpretation ist die genaue Bezeichnung der Abnahme wichtig.<br />
Urin-Diagnostik II Nachweis von Mykobakterien<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Mikroskopisches Präparat auf ” säurefeste Stäbchen“<br />
- Anzüchtung mit drei verschiedenen Tb-Medien<br />
- Differenzierung<br />
- Ggf. Resistenzbestimmung von Tuberkulose-Erregern (W), atypischen Mykobakterien (U)<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Am besten geeignet ist frischer, sauber gewonnener Mittelstrahl-Morgenurin; Sammelurin ist<br />
wegen der Überwucherung durch andere Bakterien nicht geeignet. Größere Ausbeute wird durch<br />
Untersuchung von 3 Proben von verschiedenen Tagen (jeweils 50-100 ml im sterilen Becher mit<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 121
5 Mikrobiologie<br />
Schraubverschluss) sowie durch Einschränkung der Flüssigkeitszufuhr am Abend vor der Entnahme<br />
erreicht.<br />
Lagerung maximal 24 h bei 4°C.<br />
Bemerkungen, Besondere Hinweise:<br />
Für die komplexe Diagnostik der Mycobacteriaceae sind Mindest-Probenvolumina unbedingt zu<br />
beachten:<br />
Sputum (2-10 ml), Bronchialsekret (2-5 ml), BAL (10-30 ml), Pleurapunktat (10-30 ml), Magennüchternsekret<br />
(20-30 ml), Urin (10 ml), Liquor (5 ml). Für eine PCR-Anforderung aus Liquor<br />
werden zusätzlich 2-5 ml benötigt!<br />
Urin-Diagnostik III Parasiten<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Schistosomen-Eier (meist S. haematobium): Mikroskopischer Nachweis der Parasiteneier nach<br />
Zentrifugation, Anreicherung mit SAF<br />
- Trichomonaden: Mikroskopischer Nachweis der Trophozoiten<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Die jeweils letzten Urinportionen sollten von 10-14 Uhr gesammelt werden (maximale Eiausscheidung).<br />
Bei negativem Einachweis ggf. mehrfache Wiederholung der Untersuchung empfehlenswert. Da<br />
der Direktnachweis der sehr fragilen Trichomonaden aus dem Urin vitale Organismen erfordert,<br />
empfiehlt sich die Materialgewinnung (erste Urinportion) im Labor.<br />
Bemerkungen, Besondere Hinweise:<br />
Nach mehreren negativen Urin-Untersuchungen ist bei weiterbestehendem Verdacht eine Zystoskopie<br />
mit gezielter Biopsie von Blasenwandläsionen indiziert.<br />
Urin-Diagnostik IV weitere Untersuchungen<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Erythrozytenmorphologie: Bestimmung des quantitativen Anteils glomerulär dysmorpher Erythrozyten<br />
bei Mikrohämaturie, Akanthozyten<br />
- Urinsediment/Urinstatus<br />
- Legionellen-Antigen-Nachweis (N)<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
5-10 ml sauber gewonnener, frischer Mittelstrahlurin, Morgenurin nicht älter als 2 St<strong>und</strong>en. KEIN<br />
Sammelurin!!!<br />
Bei längerem Stehen gehen Leukozyten zugr<strong>und</strong>e, es kommt zu einer Vermehrung der Bakterien <strong>und</strong><br />
zu einer pH-Verschiebung.<br />
Bemerkungen, Besondere Hinweise:–<br />
122 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Vaginalabstrich<br />
5 Mikrobiologie<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Kultur auf Gardnerella vaginalis, Mycoplasma hominis, Ureaplasma urealyticum <strong>und</strong> Sprosspilze<br />
Auf Anforderung:<br />
- Kultur auf N. gonorrhoeae (Abstrich im Medium)<br />
- Nachweis von N. gonorrhoeae-DNA mittels PCR<br />
- Nachweis von Chlamydia trachomatis-DNA mittels PCR<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Entnahme von Sekret unter Sicht unter Verwendung eines Spekulums (ohne Gleitmittel, da diese<br />
antibakterielle Substanzen enthalten können). Tupfer in Transportmedium stecken. Material kann bis<br />
zur Abholung bei 4°C aufbewahrt werden.<br />
s.u. Streptococcus agalactiae, s.u. Listeria monocytogenes, s.u. Kapitel Molekularbiologie.<br />
Bemerkungen, Besondere Hinweise:<br />
Siehe auch Kapitel Molekularbiologie<br />
Venenkatheter/Zentraler Venenkatheter<br />
s.u. Katheterspitzen<br />
Vergrünende Streptokokken<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Alpha-hämolysierende Streptokokken verschiedenster Spezies sind physiologische Besiedler der<br />
menschlichen Haut- <strong>und</strong> Schleimhäute. Nur selten treten sie als Infektionserreger in Erscheinung.<br />
Daher werden vergrünende Streptokokken meist als Kontaminanten in Untersuchungsproben<br />
nachgewiesen. Bef<strong>und</strong>e werden dementsprechend begutachtet <strong>und</strong> kommentiert. Von klinischer Relevanz<br />
ist die Endocarditis durch vergrünende Streptokokken. Blutkulturdiagnostik/Untersuchungsmaterial<br />
von Herzklappen. Lagerung bei Raumtemperatur.<br />
Bemerkungen, Besondere Hinweise:–<br />
Vibrio cholerae<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Erreger der Cholera. Klinik mit heftigsten wässrigen Diarrhoen (Reiswasserstühle) <strong>und</strong> der Gefahr<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 123
5 Mikrobiologie<br />
einer raschen Exsikkose des Patienten mit Kreislaufdekompensation <strong>und</strong>/oder -versagen. Stuhlproben<br />
(extrem dünnflüssig, sog. Reiswasserstühle). Lagerung bei 4°C.<br />
Bemerkungen, Besondere Hinweise:<br />
Cholera kommt in Ländern mit hohem Hygienestandard (Westeuropa/Nordamerika usw.) ausgesprochen<br />
selten vor.<br />
Die Erkrankung könnte von Fernreisenden mitgebracht werden (Reiseanamnese), tritt in Deutschland<br />
insgesamt aber nur sehr selten auf. Im Verdachtsfall bitte telefonischen Kontakt aufnehmen.<br />
Vibrio sp.<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Neben dem Erreger der Cholera (Vibrio cholerae) haben noch andere Vibrionen humanpathogene<br />
Bedeutung als Erreger von Gastroenteritiden, W<strong>und</strong>infektionen <strong>und</strong> Sepsis. Untersuchungsmaterial<br />
je nach Infektlokalisation (Abstriche, Gewebeproben, Blutkulturen, Stuhl).<br />
Lagerung bei Raumtemperatur. S.u. Stuhldiagnostik<br />
Bemerkungen, Besondere Hinweise:<br />
Häufig nachgewiesene Spezies sind:<br />
- Vibrio mimicus<br />
- Vibrio parahaemolyticus<br />
- Vibrio fluvialis<br />
- Vibrio vulnificus<br />
VRE<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Vancomycinresistente Enterokokken. S.u. Enterokokken: Untersuchung auf VRE ist gr<strong>und</strong>sätzlich<br />
aus allen bakteriologischen Untersuchungsproben möglich.<br />
Bemerkungen, Besondere Hinweise:<br />
Bei Nachweis von VRE sind besondere krankenhaushygienische Maßnahmen zu beachten!<br />
Vulvaabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Zusätzliche Untersuchung: Kultur auf Sprosspilze<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
s.u. Genitalabstrich<br />
124 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Bemerkungen, Besondere Hinweise:–<br />
W<strong>und</strong>abstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Grampräparat<br />
- Aerobe <strong>und</strong> anaerobe Kultur<br />
- Ggf. Antibiogramm<br />
Auf Anforderung:<br />
- Kultur auf Sprosspilze<br />
- Kultur auf Aktinomyceten<br />
5 Mikrobiologie<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Oberflächliche Verschmutzungen werden mit einem in steriler physiol. NaCl-Lösung getränkten<br />
Tupfer entfernt. Anschließend wird für die Kultur <strong>und</strong> die mikroskopische Untersuchung Material<br />
vom W<strong>und</strong>gr<strong>und</strong> bzw. W<strong>und</strong>rand entnommen, in ein Transportsystem gegeben <strong>und</strong> bei Raumtemperatur<br />
gelagert.<br />
Bei trockener W<strong>und</strong>e sterile NaCl-Lösung injizieren <strong>und</strong> sofort wieder aspirieren. Allgemein sind<br />
Gewebepartikel <strong>und</strong> aspiriertes Exsudat den üblichen Abstrichproben in der Aussagefähigkeit<br />
überlegen.<br />
Bei Verdacht auf Gasbrand ausschließlich Gewebeproben einsenden <strong>und</strong> das Labor telefonisch<br />
benachrichtigen.<br />
Bei Verdacht auf Aktinomykose sollte neben Eiter immer etwas Gewebe eingesandt <strong>und</strong> dabei auf<br />
<strong>Dr</strong>usen geachtet werden.<br />
Bemerkungen, Besondere Hinweise:<br />
Bei der mikrobiologischen Untersuchung von Abstrichen aus offenen Prozessen, wie W<strong>und</strong>en,<br />
Ulzera <strong>und</strong> Fisteln werden auch ohne vorherige Reinigung vor allem die aus der physiologischen<br />
Standortflora eingewanderten Bakterien angezüchtet.<br />
Die Isolierung, der für die Infektion ursächlichen Keime gelingt daher erst nach Entfernung der<br />
oberflächlichen Sekrete <strong>und</strong> fibrinöser oder nekrotischer Beläge.<br />
Für die Bef<strong>und</strong>interpretation ist es wichtig die genaue Entnahmestelle mitzuteilen, genauso ob es sich<br />
um einen tiefen oder oberflächlichen W<strong>und</strong>abstrich handelt. (S.u. Allgemeine Gr<strong>und</strong>sätze).<br />
Aktinomykose-Verdacht bitte mitteilen, da diese Kultur spezielle Anzuchtmedien erfordert.<br />
Wurm<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung: Makroskopische Untersuchung <strong>und</strong> Differenzierung.<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Stuhlproben Lagerung bei Raumtemperatur. S.u. Stuhldiagnostik<br />
Bemerkungen, Besondere Hinweise:–<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 125
5 Mikrobiologie<br />
Yersinia sp.<br />
s.u. Enterobacteriaceae <strong>und</strong> Stuhldiagnostik<br />
Zahnabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Zusätzliche Untersuchung: Kultur auf Aktinomyceten<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
s.u. W<strong>und</strong>abstrich<br />
Bemerkungen, Besondere Hinweise:–<br />
Zahnhalsabstrich<br />
Untersuchungsmaterial, Erreger, Infektionen:<br />
Untersuchung:<br />
- Kultureller Nachweis von Aktinomyceten<br />
- Nachweis von Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis, Bacteroides<br />
forsythus, Prevotella intermedia, Prevotella nigrescens <strong>und</strong> Trepomena denticola-DNA mittels PCR<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Für die PCR-Analyse sollten subgingivale Proben der jeweils tiefsten parodontalen Taschen erkrankter<br />
Parodontien gepoolt werden. S.u. Kapitel Molekularbiologie: Parodontalkeime<br />
Bemerkungen, Besondere Hinweise:<br />
Parodontitis (marginale Parodontitis, juvenile Parodontitis, therapierefraktale Parodontitis).<br />
Der molekulare Nachweis ist deutlich sensitiver als die Kultur, da die meisten Bakterien nur schwer<br />
bzw. gar nicht anzüchtbar sind.<br />
In Abhängigkeit von den mittels PCR identifizierten Keimen erfolgt die Auswahl geeigneter Antibiotika<br />
für eine Therapieempfehlung.<br />
Zestoden<br />
Untersuchungsmaterial, Erreger, Infektionen:–<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Häufigste Bandwürmer:<br />
- Taenia saginata (Rinderbandwurm)<br />
- Taenia solium (Schweinebandwurm)<br />
- Diphylobotrium latum (Fischbandwurm)<br />
Stuhluntersuchung: S.u. Stuhldiagnostik<br />
Bemerkungen, Besondere Hinweise:<br />
Während der Kopf der Bandwürmer fest in der Darmschleimhaut verankert bleibt, werden die<br />
126 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
5 Mikrobiologie<br />
nachwachsenden Bandwurmglieder (Proglottiden) mit dem Stuhl ausgeschieden. Diese ca. 5 x 10 mm<br />
messenden grauweißen Bestandteile des Wurmes müssen eingeschickt <strong>und</strong> mikroskopisch untersucht<br />
werden, um eine Differenzierung vornehmen zu können.<br />
Zungenabstrich<br />
s.u. M<strong>und</strong>abstrich<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 127
6 Antibiotic Stewardship (ABS)<br />
- Mitwirkung beim Aufbau eines ABS Teams<br />
- Definition der Ziele des ABS Teams<br />
- Mitwirkung bei der Analyse der Resistenz- <strong>und</strong> Verbrauchstatistiken<br />
- Punkt-Prävalenzstudien (PPS) zum Antibiotikaverbrauch<br />
- Mitwirkung bei der Erstellung von KH-spezifischen Leitlinien<br />
- Teilnahme an infektiologischen Visiten<br />
- Teilnahme an Arzeimittelkommissionen<br />
- Controlling des AB-Verbrauchs aus medizinischer <strong>und</strong> ökonomischer Sicht<br />
128
7 Hygiene<br />
Krankenhaus<br />
- Krankenhaushygieniker<br />
- Hygieneaudits<br />
- Hygienekommissionen<br />
- Schriftliche Stellungnahmen<br />
- Begehungen <strong>und</strong> Ortstermine<br />
- Ausbruchsmanagement<br />
- Beratung bei der Erfassung von NI (nosokomiale Infektionen)<br />
- Hilfe bei der Erstellung von SOP’s (Standard operating procedure)<br />
- Bauhygiene<br />
- Kontakt zu Behörden<br />
Praxis<br />
- Beratung bei der Erstellung von Hygieneplänen<br />
- Beratung in allgemeinen Fragen der Praxishygiene<br />
129
8 Stuhldiagnostik<br />
8.1 Allgemeine Diagnostik auf darmpathogene Erreger<br />
8.1.1 Basisprogramm<br />
Kultureller Nachweis aus Stuhl von:<br />
- Salmonella sp.<br />
- Campylobacter sp.<br />
- Shigella sp.<br />
- Yersinia sp.<br />
Fachinformation, Probenentnahme, Lagerung <strong>und</strong> Transport:<br />
Stuhl ohne Urinbeimengungen in sauberes Gefäß absetzen. Das Röhrchen mindestens zu einem<br />
<strong>Dr</strong>ittel füllen. Blutige <strong>und</strong> schleimige Anteile sollten bevorzugt entnommen werden. Am besten<br />
3 Stuhlproben an 3 aufeinanderfolgenden Tagen entnehmen. Da eine schnelle Verarbeitung die<br />
Ausbeute erheblich erhöht, bitte keine Proben von verschiedenen Tagen sammeln, sondern jede Probe<br />
unmittelbar ins Labor schicken.<br />
Bemerkungen, Besondere Hinweise:<br />
Bei Verdacht auf eine septische Verlaufsform der gastrointestinalen Infektion sollten unbedingt<br />
auch Blutkulturen des Patienten eingesandt werden. Dies gilt insbesondere für AIDS-Erkrankte <strong>und</strong><br />
andere, stark immunsupprimierte Patienten sowie bei Verdacht auf Thypus oder Parathypus.<br />
Bei Verdacht auf Ruhr sollte der Stuhl möglichst körperwarm untersucht werden, da Shigellen schnell<br />
absterben.<br />
8.1.2 Stuhldiagnostik bei Vorliegen von klinischen Angaben <strong>und</strong>/oder<br />
flüssigen Stühlen<br />
Indikation <strong>und</strong> empfohlene Untersuchung:<br />
- Nach Auslandaufenthalten: Darmparasiten<br />
- Nach Antibiotika-Therapie, bei klinischem Verdacht auf pseudomembranöse Kolitis: Clostridium<br />
difficile Toxine<br />
- Kinder unter 2 Jahren (im ambulanten Bereich): EPEC<br />
- Kinder unter 2 Jahren (im stationären Bereich): EPEC, Noro-, Rota-, Adeno-, Astroviren<br />
- Bei klinischem Verdacht <strong>und</strong>/oder Diagnose: Hämolytisch urämisches Syndrom (HUS),<br />
Thrombotisch-, Thrombozytopenische Purpura (TTP, Moschkowitz-Syndrom): EHEC<br />
- Diagnose: Appendizitis, Arthritis, Erythema nodosum, pers./rez. Diarrhoe: Yersinia-<br />
Kälteanreicherung<br />
- Diagnose: Rez. Abdominalbeschwerden: Yersinia-Kälteanreicherung, Clostridium difficile Toxine,<br />
130
8 Stuhldiagnostik<br />
Parasiten<br />
- Immunsuppression: Pseudomonas sp., Aweromonas sp., Kryptosporidien, Parasiten<br />
- Diagnose: Chron. Abdominalbeschwerden: EPEC, EHEC<br />
- Lebensmittelvergiftung: S. aureus, Bacillus cereus (ggf. mit nachfolgendem Toxinnachweis)<br />
8.2 Gezielte Anforderungen<br />
Auf Überweisungsschein vermerken:<br />
Adenoviren (EIA) bei Gastroenteritis bei Säuglingen, Kleinkindern, älteren Menschen<br />
Aeromonas sp. (kultureller Nachweis) nach Auslandaufenthalten<br />
Astroviren (EIA), Gastroenteritis bei Säuglingen, Kleinkindern, älteren Menschen<br />
Auslandaufenthalt, vor allem bei flüssigen Stühlen: Parasiten, Vibrionen, EHEC, EIEC<br />
Bacillus cereus (kultureller Nachweis) bei Lebensmittelvergiftung: Toxinnachweis<br />
Clostridium difficile Toxine (EIA) bei pseudomembranöser Kolitis, Antibiotika-assoziierter<br />
Enterokolitis<br />
Coronaviren bei hämorrhagischen Enteritiden. Hinweis: Allgemeiner Nachweis von Enteroviren.<br />
Eine weiterführende genaue Speziesbestimmung aus dem Stuhl erfolgt elektronenmikroskopisch <strong>und</strong><br />
ist keine Kassenleistung.<br />
EHEC (kultureller Nachweis mit Serotypisierung), Toxin-Nachweis mittels EIA bei hämorrhagischer<br />
Kolitis, thrombotisch-thrombozytopenischer Purpura (Moschkowitz-Syndrom), hämolytischurämisches<br />
Syndrom (HUS). Hinweis: Bestätigung durch PCR.<br />
EIEC (kultureller Nachweis mit Serotypisierung) bei mäßig blutigen Diarrhoen, oft nach Auslandaufenthalt.<br />
Enteroviren (z.B. Polio-, Coxsackie- <strong>und</strong> ECHO-Viren), Vermehrung im Intestinaltrakt. Hinweis:<br />
Meist kein Zusammenhang mit gastrointestinalen Symptomen! Allgemeiner Nachweis von<br />
Enteroviren. Eine weiterführende genaue Speziesbestimmung aus dem Stuhl erfolgt elektronenmikroskopisch<br />
<strong>und</strong> ist keine Kassenleistung.<br />
EPEC (kultureller Nachweis mit Serotypisierung) bei Säuglingsenteritis <strong>und</strong> Kindern unter 2<br />
Jahren. Zusätzlich EHEC <strong>und</strong> Clostridium difficile Toxine empfohlen.<br />
ETEC (kultureller Nachweis), häufigste Ursache der Reisediarrhoe.<br />
HAV (Hepatitis-A-Viren), Diagnose von Hepatitis-A-Ausscheidern durch Antigennachweis im<br />
Stuhl. Das Virus wird fäkal-oral übertragen, etwa durch verunreinigte Lebensmittel oder Trinkwasser.<br />
Häufige Infektion nach Auslandaufenthalten. Hinweis: Der Nachweis von Hepatitis-A-Antikörpern<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 131
8 Stuhldiagnostik<br />
im Serum ist dem Antigennachweis im Stuhl vorzuziehen: In der späten Inkubationszeit, also mehrere<br />
Tage vor dem Auftreten klinischer Erscheinungen wird Hepatitis-A-Virus im Stuhl ausgeschieden.<br />
Nur wenig später treten im Serum spezifische Antikörper auf, die gegen Strukturen der Virusoberfläche<br />
gerichtet sind.<br />
Die Diagnose der akuten Infektion erfolgt durch den Nachweis von Anti-HAV-IgM. Spezifische<br />
Antikörper der Klasse IgM sind bereits bei Ausbruch der klinischen Erscheinungen vorhanden <strong>und</strong><br />
verschwinden in der Regel innerhalb von ein bis zwei Monaten.<br />
Kinder unter 2 Jahren (im ambulanten Bereich), vor allem bei flüssigen Stühlen ist die<br />
Untersuchung auf EPEC, EHEC <strong>und</strong> Clostridium diffficile Toxine empfohlen.<br />
Kinder unter 2 Jahren (im ambulanten Bereich), vor allem bei blutig/schleimigen Stühlen<br />
ist die Untersuchung auf EHEC, Aeromonas sp., Kryptosporidien, Noro-, Rota-, Adeno-, Astroviren<br />
empfohlen.<br />
Leitkeimbestimmung, bei allgemeiner Abwehrschwäche, Infektanfälligkeit, chron. Atemwegsinfekten,<br />
chron. Harnwegsinfekten, Hauterkrankungen, Allergien, Mykosen, Meteorismus, Diarrhoe,<br />
Obstipation, Colon irritabile, entzündlichen Darmerkrankungen. Hinweis: Bestimmung der aeroben<br />
<strong>und</strong> anaeroben physiologischen Darmflora einschließlich der Pilzbesiedlung.<br />
Noroviren (EIA) bei Gastroenteritis bei Säuglingen, Kleinkindern, älteren Menschen.<br />
Plesiomonas sp. (kultureller Nachweis) nach Auslandaufenthalten.<br />
Rotaviren (EIA) bei Gastroenteritis bei Säuglingen, Kleinkindern, älteren Menschen.<br />
Staphylococcus aureus (kultureller Nachweis) bei Lebensmittelvergiftung: Toxinnachweis.<br />
Sprosspilze (kultureller Nachweis mit semiquantitativer Mengenangabe) bei imm<strong>und</strong>efizienten<br />
Patienten, nach Zytostatikatherapie, bei rez. Candida-Kolpitis, nach längerer Antibiotikatherapie <strong>und</strong><br />
bei unspez. intestinalen Beschwerden.<br />
Vibrio sp. (kultureller Nachweis) nach Auslandaufenthalten, sehr selten: Cholera (Vibrio cholera,<br />
Reiswasserstuhl).<br />
8.3 Darmparasiten<br />
In der nachstehenden Übersicht wird das Spektrum der intestinalen Parasiten dargestellt. Weitere<br />
Informationen finden Sie im alphabetischen Register Mikrobiologie.<br />
Erreger oder Infektion: Amöben, Amöbiasis<br />
Fachinformation: Synonym: Amöbenruhr, Erreger: Entamoeba histolytica<br />
Bemerkungen: Zum Ausschluss extraintestinaler Manifestationen serologische Untersuchung<br />
(ELISA) ergänzend durchführen (Patientenserum).<br />
132 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Erreger oder Infektion: Ascaris lumbricoides<br />
Fachinformation: Spulwurm (Nematode)<br />
Erreger oder Infektion: Askariasis<br />
Fachinformation: Spulwurmbefall, s.u. Ascaris lumbricoides<br />
Erreger oder Infektion: Bandwürmer<br />
Fachinformation: s.u. Zestoden<br />
Erreger oder Infektion: Bilharziose<br />
Fachinformation: s.u. Schistosomen, Schistosomiasis<br />
Erreger oder Infektion: Entamoeba histolytica<br />
Fachinformation: s.u. Amöben, Amöbiasis<br />
Erreger oder Infektion: Enterobuis vermicularis<br />
Fachinformation: s.u. Oxyuren, Oxyuriasis<br />
8 Stuhldiagnostik<br />
Erreger oder Infektion: Giardia lamblia<br />
Fachinformation: Mikroskopischer Nachweis der Trophozoiten ist nur in frischen Stuhl möglich!<br />
Sonst Untersuchung auf Lamblienzysten <strong>und</strong> Antigennachweis mittels ELISA.<br />
Erreger oder Infektion: Kryptosporidien<br />
Fachinformation: Erreger: Cryptosporidium parvum<br />
Bemerkungen: Schwere Diarrhoen bei immunsupprimierten Patienten, vor allem in Zusammenhang<br />
mit AIDS.<br />
Erreger oder Infektion: Lamblienruhr, Lambliasis<br />
Fachinformation: s.u. Giardia lamblia<br />
Erreger oder Infektion: Mikrosporidien<br />
Fachinformation: Verschiedene Spezies, die im Tierreich verbreitet sind (Protozoen).<br />
Bemerkungen: Schwere Diarrhoen bei immunsupprimierten Patienten, vor allem in Zusammenhang<br />
mit AIDS.<br />
Fremdleistung: Trichromfärbung nach Weber, Molekularbiologischer Nachweis (PCR).<br />
Erreger oder Infektion: Nematoden<br />
Fachinformation: R<strong>und</strong>würmer: Ascaris lumbricoides (Spulwurm), Enterobius vermicularis<br />
(Madenwurm).<br />
Erreger oder Infektion: Oxyuren, Oxyuriasis<br />
Fachinformation: Erreger: Enterobuis vermicularis (Nematode). Gewinnung der Wurmeier mittels<br />
Tesafilmstreifen vom äußeren Analring, s.u. Analabklatschpräparat.<br />
Erreger oder Infektion: Schistosomen, Schistosomiasis<br />
Fachinformation: Trematoden (Saugwürmer): Schistosoma haematobium, Schistosoma mansoni,<br />
Schistosoma japonicum.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 133
8 Stuhldiagnostik<br />
Erreger oder Infektion: Taenia sp.<br />
Fachinformation: s.u. Zestoden<br />
Erreger oder Infektion: Zestoden<br />
Fachinformation: Bandwürmer: Taenia saginata, Taenia solium, Diphyllobothrium latum.<br />
Bemerkungen: Untersuchung der Bandwurmglieder (Proglottiden).<br />
134 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
9 Zusätzliches Informationsmaterial<br />
Abklärung einer Thrombophilie<br />
Abklärung bei Verdacht auf Hepatitis B<br />
Abklärung bei Verdacht auf Hepatitis C<br />
Allergenübersicht (spezifisches IgE sowie IgG)<br />
Antibiotika-Heft 2012<br />
Ausnahmeindikationen (diese Ziffern entlasten Ihr Laborbudget)<br />
Hepatitis B Impfschema<br />
MRSA in der Praxis<br />
Präanalytik-Broschüre<br />
Rheumatologie-Diagnostik<br />
Schilddrüsen-Diagnostik<br />
Syphilis-Diagnostik<br />
Tumormarker-Diagnostik<br />
Untersuchungen vor <strong>und</strong> in der Schwangerschaft (Broschüre)<br />
Eine kostenlose Bestellung kann in unserem Versand unter 0251/60916-161 abgegeben werden<br />
135
10 Alphabetisches <strong>Leistungsverzeichnis</strong><br />
1,25-Dihydroxy-Vitamin D<br />
Synonyme: 1,25-OH-D3, Calcitriol, Vitamin D3 1,25-OH2<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Diagnostik eines Vitamin D-Mangel ist die Blutentnahme in den Monaten<br />
Januar bis April mit verminderter Sonnenlichtexposition besonders geeignet. Zur Vermeidung einer<br />
Hämolyse sollte das Blut umgehend zentrifugiert <strong>und</strong> das Serum/Plasma abpipettiert werden.<br />
Klinische Indikationen: Weitere Diagnostik bei Hyperkalziämie oder Hyperkalziurie sowie von Hypokalziämie<br />
Methode: EIA<br />
Referenzbereiche: 17,0 – 53,0 pg/ml<br />
1-Butanol im Blut (U)<br />
Probenmaterial: Vollblut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Spezielle Abnahmemonovetten können angefordert werden.<br />
Klinische Indikationen: Beurteliung der 1-Butanol-Belastung, Intoxikation<br />
Methode: GC<br />
Referenzbereiche: < 100 µg/l<br />
1-Hydroxypyren im Urin (W)<br />
Probenmaterial: 10 ml Spontanurin<br />
Klinische Indikationen: Beurteilung der Belastung mit polyzyklischen aromatischen Kohlenwasserstoffen<br />
(PAK) durch Bestimmung des Leitmetaboliten 1-Hydroxypyren, Intoxikation<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
1-Propanol (U)<br />
Synonyme: Lösungsmittel<br />
Probenmaterial: 10 ml Spontanurin<br />
Klinische Indikationen: Beurteilung der 1-Propanol-Belastung<br />
Methode: GC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
10-Hydroxy-Carbazepin<br />
Synonyme: 10-OH-Carbazepin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Monitoring der Oxcarbazepin-Therapie<br />
136
Methode: HPLC<br />
Referenzbereiche: 13 – 30 mg/l<br />
11-Desoxycorticosteron im Plasma (U)<br />
11-Desoxycorticosteron im Plasma (U)<br />
Synonyme: DOC<br />
Probenmaterial: 1 ml EDTA-Plasma oder<br />
1 ml Serum<br />
Abnahmehinweise: Tageszeitliche Schwankungen sind zu berücksichtigen<br />
Klinische Indikationen: Nachweis eines Mineralokortikoidexzess-Syndroms,<br />
Adrenogenitales Syndrom,<br />
Ausschluss Hyperaldosteronismus<br />
Hinweis: Die tageszeitlichen Schwankungen sind bei Messung von DOC im 24-St<strong>und</strong>en-Urin weniger<br />
ausgeprägt als bei Plasmaspiegel-Messungen.<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
11-Desoxycorticosteron im Urin (U)<br />
Synonyme: DOC<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: Bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Nachweis eines Mineralokortikoidexzess-Syndroms,<br />
Adrenogenitales Syndrom,<br />
Ausschluss Hyperaldosteronismus<br />
Hinweis: Die tageszeitlichen Schwankungen sind bei Messung von DOC im 24-St<strong>und</strong>en-Urin weniger<br />
ausgeprägt als bei Plasmaspiegel-Messungen.<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
11-Desoxycortisol (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei Verdacht auf 11-ß-Hydroxylase-Mangel bei Verdacht<br />
auf die nicht-klassische Form des adrenogenitalen Syndroms, ggf. im Rahmen eines Stimulationstestes<br />
(ACTH-Stimulationstest)<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
17-Hydroxycorticoide im Urin (U)<br />
Synonyme: 17-OHCS<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (gesammelt über 5-10 ml Eisessig)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Die Untersuchung ist weitestgehend ersetzt worden durch die Bestimmung<br />
von Cortisol im Serum <strong>und</strong> Cortisol frei im Urin.<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 137
25-Hydroxy-Vitamin D<br />
17-Hydroxyprogesteron (W)<br />
Synonyme: 17-OH-Progesteron<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Wegen starker Schwankungen während des Tages <strong>und</strong> Zyklusabhängigkeit sollte<br />
das Blut frühmorgens (ca. 8 Uhr) bzw. in der Follikelphase abgenommen werden.<br />
Klinische Indikationen: Verdacht auf 21-Hydroxylasemangel (Adrenogenitales Syndrom)<br />
Methode: RIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
17-Ketosteroide im Urin (U)<br />
Probenmaterial: 20 ml eines 24-St<strong>und</strong>en-Sammelurins (gesammelt über 5-10 ml Eisessig)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Verdacht auf AGS (adrenogenitales Syndrom), adrenaler Hirsutismus, Virilisierung,<br />
NNR-Tumoren<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
18-Hydroxycorticosteron im Serum (U)<br />
Synonyme: 18-OHB<br />
Probenmaterial: 1 ml Serum oder Plasma<br />
Abnahmehinweise: Blutabnahme nach ausreichender Ruhephase empfohlen<br />
Klinische Indikationen: Weitere Diagnostik bei Verdacht auf isolierten Mineralokortikoidmangel,<br />
Diagnostik des 18-Hydroxylasemangels Typ II,<br />
Verdacht auf primären Hyperaldosteronismus<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
18-Hydroxycorticosteron im Urin (U)<br />
Synonyme: 18-OHB<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: Bitte unbedingt die Sammelmenge <strong>und</strong> ggf. Sammelzeit angeben<br />
Klinische Indikationen: Weitere Diagnostik bei Verdacht auf isolierten Mineralokortikoidmangel,<br />
Diagnostik des 18-Hydroxylasemangels Typ II,<br />
Verdacht auf primären Hyperaldosteronismus<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
25-Hydroxy-Vitamin D<br />
Synonyme: 25(OH)D, 25-Hydroxy-Cholecalciferol, Calcidiol, Vitamin D 25-OH<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Diagnostik eines Vitamin D-Mangel ist die Blutentnahme in den Monaten<br />
Januar bis April mit verminderter Sonnenlichtexposition besonders geeignet.<br />
Klinische Indikationen: Verdacht auf Vitamin D-Mangel bei:<br />
- Sonnenlichtmangel<br />
138 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
- verminderte enterale Aufnahme<br />
- erhöhter Stoffwechsel (Barbiturate u.a.)<br />
- erhöhter Verlust (z.B. Dialyse)<br />
- Störungen des Kalziumstoffwechsels<br />
- verminderte Knochendichte<br />
Methode: CLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
4-Aminosalicylsäure (U)<br />
4-Aminosalicylsäure (U)<br />
Synonyme: Handelsname: Pas-Fatol N ®<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer 4-Aminosalicylsäure-Therapie.<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
4-Hydroxy-Tamoxifen (U)(N)<br />
Synonyme: 4-OH-Tamoxifen<br />
Probenmaterial: 2 ml EDTA-Plasma, lichtgeschützt<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Tamoxifen-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
5-Fluorouracil-Unverträglichkeit (U)<br />
Synonyme: 5-Fu-Unverträglichkeit<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einverständniserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Screening von Patienten vor Gabe von 5-FU<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
5-Hydroxyindolessigsäure<br />
Synonyme: 5-HIES<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
(gesammelt in lichtgeschütztem Gefäß über 10 ml Eisessig)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
3 Tage vor Abnahme folgende Nahrungsmittel<br />
<strong>und</strong> Medikamente absetzen:<br />
Ananas, Auberginen, Avocados, Bananen,<br />
Johannisbeeren, Melonen, Mirabellen,<br />
Stachelbeeren, Tomaten, Walnüsse,<br />
Zwetschgen, Chlorpromazin,<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 139
ACE<br />
Mephenesincarbamat, Methocarbamol. Paracetamol <strong>und</strong> ASS sollten ebenfalls 2 Tage vor der Untersuchung<br />
nicht mehr eingenommen werden.<br />
Klinische Indikationen: Karzinoid-Diagnostik<br />
Methode: HPLC<br />
Referenzbereiche: < 9,0 mg/24 St<strong>und</strong>en<br />
5-S-Cysteinyl-DOPA im Plasma (W)<br />
Synonyme: 5-SCD<br />
Probenmaterial: 2 ml EDTA-Plasma<br />
Abnahmehinweise: Das EDTA-Blut bitte sofort nach der Blutentnahme zentrifugieren, das Plasma<br />
in ein separates Röhrchen (ohne Zusätze) abpipettieren <strong>und</strong> einfrieren (ca. – 20°C). Die Probe lichtgeschützt<br />
aufbewahren.<br />
Spezielle Abnahmemonovetten können angefordert werden.<br />
Medikamente mit Einfluss auf den DOPA-Stoffwechsel sollten einige Tage vor der Bestimmung,<br />
sofern möglich, abgesetzt werden.<br />
Klinische Indikationen: Therapie- <strong>und</strong> Verlaufskontrolle des malignen Melanoms<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
5-S-Cysteinyl-DOPA im Urin (W)<br />
Synonyme: 5-SCD<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (angesäuert, kühl <strong>und</strong> lichtgeschützt gelagert<br />
während der Sammelperiode)<br />
Klinische Indikationen: Therapie- <strong>und</strong> Verlaufskontrolle des malignen Melanoms<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
9-OH-Risperidon (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Bitte beachten Sie, dass bei Verwendung von gelhaltigen Röhrchen die Resultate<br />
niedriger ausfallen können. Wir empfehlen, das Blut 30 min nach Abnahme zu zentrifugieren, das<br />
Serum abzutrennen <strong>und</strong> in ein zweites Neutral-Röhrchen zu überführen.<br />
Klinische Indikationen: Monitoring einer Risperidon-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
ACE<br />
Synonyme: Angiotensin Converting Enzyme<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: ACE-Hemmer sollten ca. 4 Wochen vor der Untersuchung abgesetzt werden. Zur<br />
Vermeidung einer Hämolyse sollte das Blut nach Gerinnung zentrifugiert <strong>und</strong> das Serum abpipettiert<br />
werden<br />
Klinische Indikationen: Verlaufsbeurteilung der Aktivität einer Sarkoidose<br />
Methode: Photometrie<br />
140 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Referenzbereiche: Erwachsene: 20 – 70 U/l<br />
Kinder: 29 – 112 U/l<br />
ACE im Liquor (W)<br />
Synonyme: Angiotensin Converting Enzyme<br />
Probenmaterial: 2 ml Liquor <strong>und</strong><br />
1 ml Serum<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle der Sarkoidose<br />
Methode: REA<br />
Referenzbereiche: < 3,8 U/l<br />
Acetazolamid (U)<br />
Synonyme: Carboanhydrasehemmer<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Monitoring einer Acetazolamid-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: Therapeutischer Bereich: 10 – 20 µg/ml<br />
Toxisch: ab etwa 25 µg/ml<br />
Aceton im Blut (U)<br />
ACE im Liquor (W)<br />
Synonyme: Lösungsmittel<br />
Probenmaterial: 2 ml Serum oder<br />
2 ml Blut (Rollrandröhrchen)<br />
Klinische Indikationen: Beurteilung der Acetonbelastung, Diagnostik der Intoxikation, unklare Ketoazidose<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Aceton im Urin (U)(N)<br />
Synonyme: Lösungsmittel<br />
Probenmaterial: 2 ml Urin<br />
Abnahmehinweise: fest verschlossenes System für Blutentnahme <strong>und</strong> Transport verwenden<br />
Klinische Indikationen: Beurteilung der Acetonbelastung, Diagnostik der Intoxikation, unklare Ketoazidose<br />
Methode: GC/MS<br />
Referenzbereiche: < 5 mg/l<br />
BAT: 80 mg/l<br />
Acetylcholinesterase im Fruchtwasser (W)<br />
Synonyme: ACHE<br />
Probenmaterial: 2 – 5 ml Fruchtwasser<br />
Klinische Indikationen: Verdacht auf Neuroalrohrdefekt bei gleichzeitig erhöhtem AFP-Wert im<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 141
ADAMTS 13 – Konzentration (U)<br />
Fruchtwasser<br />
Methode: PAGE<br />
Referenzbereiche: negativ<br />
Acetylsalizylsäure (W)<br />
Synonyme: Aspirin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Acetylsalizylsäure-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
ACTH<br />
Synonyme: Adrenocorticotropes Hormon<br />
Probenmaterial: 1 ml EDTA-Plasma<br />
Abnahmehinweise: EDTA-Vollblut abnehmen, sofort zentrifugieren, das EDTA-Plasma abnehmen<br />
<strong>und</strong> einfrieren.<br />
Klinische Indikationen: Nebennierenfunktion (M. Addison, M. Cushing)<br />
ektope ACTH-Produktion (z.B. Bronchial-Ca)<br />
Methode: Chemilumineszenz<br />
Referenzbereiche: 4,7 – 48,8 pg/ml<br />
Actinomykose-Antikörper (U)(N)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Zusätzliche Diagnostik bei Verdacht auf Aktinomykose<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
ADAMTS 13 – Aktivität (U)<br />
Synonyme: vWF cleaving protease<br />
Probenmaterial: 2 ml Citratplasma<br />
Klinische Indikationen: Vd auf thrombotisch thrombozytopenische Purpura (TTP), Auftreten großer<br />
vWF-Multimere<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
ADAMTS 13 – Inhibitor (U)<br />
Probenmaterial: 2 ml Citratplasma<br />
Klinische Indikationen: Unterscheidung erworbene/hereditäre TTP, Therapiemonitoring<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
ADAMTS 13 – Konzentration (U)<br />
Probenmaterial: 2 ml Citratplasma<br />
Klinische Indikationen: Vd auf thrombotisch thrombozytopenische Purpura (TTP), Auftreten großer<br />
142 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
vWF-Multimere<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Addis Count (U)(N)<br />
Addis Count (U)(N)<br />
Probenmaterial: 10 ml Morgenurin (Urin-Monovette mit Stabilisator)<br />
Klinische Indikationen: Weitere Diagnostik bei Verdacht auf Harnwegsinfekt oder Glomerulonephritis<br />
Methode: Mikroskopie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Adenoviren-Antikörper (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 2-10 Tage<br />
Klinische Indikationen: Symptomatik: Akute katarrhalische Atemwegserkrankungen mit Pharyngitis,<br />
Infektionen mit Schleimhautbeteiligung. Häufig bei Erkältungskrankheiten (akute febrile Pharyngitis),<br />
seltener bei Keratokonjunktivitis, Gastroenteritis, Pneumonie, Bronchitis <strong>und</strong> Hepatitis.<br />
Methode: EIA<br />
Referenzbereiche: IgG: < 20,0 RE/ml<br />
IgM: < 1,0 Ratio<br />
Adenovirus-Antigen im Stuhl<br />
Synonyme: Gastroenteritis<br />
Probenmaterial: 2 g Stuhl<br />
Klinische Indikationen: Verdacht auf Adenovirus-Infektion, insbesondere bei Gastroenteritis bei<br />
Säuglingen <strong>und</strong> Kleinkindern<br />
Methode: ELISA<br />
Referenzbereiche: negativ<br />
Adenovirus-DNA-Nachweis (W)<br />
Synonyme: Adenovirus-PCR<br />
Probenmaterial: je nach Indikation:<br />
Abstrich (Konjunktiva)<br />
5 g Stuhl<br />
1 ml Liquor<br />
1 ml respiratorisches Material<br />
3 ml EDTA-Blut<br />
Abnahmehinweise: Material in sterilen Gefäßen entnehmen,<br />
Die Inkubationszeit beträgt ca. 2-10 Tage<br />
Klinische Indikationen: Verdacht auf Adenovirus-Infektion<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 143
AFP<br />
Adiponectin (U)<br />
Synonyme: Adiponektin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Parameter zur frühzeitigen Risiko-Erkennung für Arteriosklerose <strong>und</strong> Diabetes<br />
mellitus Typ 2, insbesondere bei Verwandten 1. Grades <strong>und</strong> Übergewichtigen<br />
Methode: EIA<br />
Referenzbereiche: Männer: Median ca. 7,0 mg/l<br />
Frauen: Median ca. 8,5 mg/l<br />
Adrenalin im Plasma (W)<br />
Synonyme: Katecholamine<br />
Probenmaterial: 3 ml EDTA- Plasma<br />
Abnahmehinweise: Vor der Blutentnahme Stress-Situationen vermeiden;<br />
Medikamente, sofern möglich, ca. 1 Woche vorher absetzen;<br />
ab ca. 3 Tage vorher Vermeiden von Kaffee, Tee, Nikotin, Bananen, Käse, Nüsse, Schokolade, Eier;<br />
Blutentnahme nach ca. 30 Minuten Ruhe (Liegen);<br />
Blut direkt nach der Entnahme zentrifugieren <strong>und</strong> das Plasma abpipettieren <strong>und</strong> einfrieren (ca. -20°C)<br />
Klinische Indikationen: Tumoren des sympatho-adrenergen Systems, Neuroblastome, episodenhafte<br />
oder therapieresistente Hypertonie, Inzidentalom, Familienuntersuchung<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Adrenalin im Urin<br />
Synonyme: Katecholamine<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
(gesammelt über 5-10 ml Salzsäure)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Medikamente, sofern möglich, ca. 1 Woche vorher absetzen;<br />
ab ca. 3 Tage vorher Vermeiden von Kaffee, Tee, Nikotin, Bananen, Käse, Nüsse, Schokolade, Eier<br />
Klinische Indikationen: Tumoren des sympatho-adrenergen Systems, Neuroblastome, episodenhafte<br />
oder therapieresistente Hypertonie, Inzidentalom, Familienuntersuchung<br />
Methode: HPLC<br />
Referenzbereiche: < 27,0 µg/24 Std.<br />
AFP<br />
Synonyme: α 1-Fetoprotein, Alpha-1-Fetoprotein<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung des hepatozellulären Karzinoms, von<br />
Keimzelltumoren (Hoden, Ovar, extragonadal) <strong>und</strong> eingeschränkt bei Leberzirrhose<br />
Methode: Chemilumineszenz<br />
Referenzbereiche: < 10 ng/ml<br />
144 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Agomelatin (W)<br />
Synonyme: Handelsname: Valdoxan ®<br />
Probenmaterial: 1 ml Serum<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Ajmalin (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Monitoring einer Ajmalin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 0,2 – 1,0 mg/l<br />
Aktivierte T-Lymphozyten<br />
Agomelatin (W)<br />
Synonyme: CD3+/HLA-DR+-Zellen<br />
Probenmaterial: korrekt gefüllte EDTA-Monovette<br />
Abnahmehinweise: EDTA-Monovette direkt nach der Abnahme durch Schwenken gründlich mischen<br />
Klinische Indikationen: Monitoring der HIV-Infektion, Primäre <strong>und</strong> sek<strong>und</strong>äre Imm<strong>und</strong>efekte<br />
Methode: Durchflusszytometrie (Vollblut-Lyse-Methode, direkte Immunphänotypisierung)<br />
Referenzbereiche: Erwachsene: 30-200 c/µl (2-12%)<br />
Alanin Aminopeptidase (W)<br />
Synonyme: AAP<br />
Probenmaterial: 1 ml Urin<br />
Klinische Indikationen: Verdacht auf renal-tubuläre Schädigung<br />
Verdacht auf Nephrotoxizität durch Medikamenten <strong>und</strong> Xenobiotika<br />
Differenzialdiagnostik bei Störungen des Nierentransplantats<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Albumin im Liquor<br />
Probenmaterial: 1 ml Liquor<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
Klinische Indikationen: Beurteilung der Blut-/Liquor-Schrankenfunktion<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Albumin im Serum<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verlaufsbeurteilung akuter Lebererkrankungen,<br />
Verdacht auf Leberzirrhose <strong>und</strong> deren Verlaufsbeurteilung,<br />
Abklärung von Oedemen,<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 145
Aldosteron im Serum (W)<br />
Prognostische Aussage bei älteren, hospitalisierten Patienten,<br />
Als Index des Ernährungsstatus<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Albumin im Stuhl (W)<br />
Probenmaterial: 1 g Stuhl<br />
Klinische Indikationen: Verlaufskontrolle chronisch-entzündlicher Darmerkrankungen<br />
Methode: Nephelometrie<br />
Referenzbereiche: < 50 µg/g<br />
Albumin im Urin<br />
Synonyme: Mikroalbumin<br />
Probenmaterial: 1 ml Spontanurin oder<br />
1 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung der diabetischen <strong>und</strong> hypertensiven<br />
Nephropathie<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Albumin-Quotient (Liquor/Serum)<br />
Probenmaterial: 1 ml Liquor <strong>und</strong><br />
1 ml Serum<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
Klinische Indikationen: Beurteilung der Blut-/Liquor-Schrankenfuntion<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Aldolase (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Blut zentrifugiert <strong>und</strong> das Serum in<br />
ein separates Röhrchen abpipettiert werden.<br />
Klinische Indikationen: Differentialdiagnose von Muskelerkrankungen<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Aldosteron im Serum (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Ausreichend Ruhezeit vor der Blutentnahme berücksichtigen, wenn möglich Antihypertensiva<br />
8 St<strong>und</strong>en vorher, Aldosteronantagonisten ca. 4 Wochen vorher absetzen,<br />
Blut innerhalb von 30 Minuten zentrifugieren <strong>und</strong> das Serum abpipettieren.<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung eines Hyper- oder Hypoaldosteronismus<br />
146 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: RIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Aldosteron im Urin (W)<br />
Aldosteron im Urin (W)<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins, nicht angesäuert<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge angeben; Urin während der Sammelperiode<br />
kühl lagern, ausreichend Ruhezeit während der Sammelperiode berücksichtigen, wenn möglich Antihypertensiva<br />
8 St<strong>und</strong>en vorher, Aldosteronantagonisten ca. 4 Wochen vorher absetzen.<br />
Klinische Indikationen: Weitere Diagnostik bei Hyperaldosteronismus<br />
Methode: RIA<br />
Referenzbereiche: 0,1 – 0,5 µg/24 Std.<br />
Aldosteron-18-Glucuronid im Urin (U)<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge angeben; Urin während der Sammelperiode<br />
kühl lagern, ausreichend Ruhezeit während der Sammelperiode berücksichtigen, wenn möglich Antihypertensiva<br />
8 St<strong>und</strong>en vorher, Aldosteronantagonisten ca. 4 Wochen vorher absetzen.<br />
Der Urin sollte während der Sammelzeit kühl gelagert werden.<br />
Klinische Indikationen: Diagnostik des Hyperaldosteronismus bzw. eines Mineralokortikoidmangels<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Alkalische Leukozytenphosphatase (U)(N)<br />
Synonyme: ALP, ANP, Alkalische Neutrophilenphosphatase<br />
Probenmaterial: 4 luftgetrocknete Ausstriche aus Nativblut,<br />
30 Sek. fixiert im Gemisch<br />
(9 Teile Methanol/1 Teil 37%iges Formalin)<br />
Abnahmehinweise: Kein EDTA-Blut.<br />
Klinische Indikationen: Differentialdiagnose der CML (chronisch myeloische Leukämie)<br />
Methode: Mikroskopie<br />
Referenzbereiche: Index 20 – 100<br />
Alkalische Phosphatase<br />
Synonyme: AP<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Blutentnahme sollte nüchtern (ca. 12 St<strong>und</strong>en Nahrungskarenz) erfolgen<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilungen von Erkrankungen der Leber, Gallenwege<br />
<strong>und</strong> der Knochen<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 147
α-Galaktosidase (U)<br />
Alkalische Phosphatase-Isoenzyme<br />
Synonyme: AP<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme am nüchternen Patienten (12 h Nahrungskarenz)<br />
Klinische Indikationen: Differenzierung einer erhöhten → Alkalische Phosphatase, Seite 147 bei<br />
unklarem Krankheitsbild<br />
Methode: Elektrophorese<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Allopurinol (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Monitoring einer Allopurinol-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 2 – 20 µg/ml<br />
α-Aminobuttersäure (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das Blut bitte nach der Abnahme zentrifugieren, das Serum in separates<br />
Röhrchen abpipettieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Weitere Diagnostik bei Mangelzuständen der Ernährung<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Alpha-Endosulfan (U)<br />
Probenmaterial: 10 ml EDTA-Blut<br />
Klinische Indikationen: Diagnose <strong>und</strong> Beurteilung einer Belastung mit Alpha-Endosulfan<br />
Methode: GC/ECD<br />
Referenzbereiche: < 0,01 µg/l<br />
Alpha-Fetoprotein (AFP) im Fruchtwasser (W)<br />
Probenmaterial: 2 – 5 ml Fruchtwasser<br />
Abnahmehinweise: bitte unbedingt das Gestationsalter (Schwangerschaftswoche) exakt angeben<br />
Klinische Indikationen: Verdacht auf Neuralrohrdefekt<br />
Methode: ECLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
α-Galaktosidase (U)<br />
Probenmaterial: 1 ml Serum, tiefgefroren<br />
Abnahmehinweise: Das Blut bitte innerhalb von 30 Minuten nach der Abnahme zentrifugieren,<br />
Serum in ein separates Röhrchen abpipettieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Verdacht auf Fabry-Syndrom, Sphingolipidspeicherkrankheit<br />
Methode: Fluorometrie<br />
Referenzbereiche: 3,4 – 13,0 nmol/h/ml<br />
148 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
α-Glucosidase im Sperma (U)<br />
α-Glucosidase im Sperma (U)<br />
Probenmaterial: 1 ml Sperma<br />
Abnahmehinweise: Sperma 1 + 1 mit physiologischer Kochsalzlösung verdünnen <strong>und</strong> in ein Fluoridröhrchen<br />
geben, eine sexuelle Karenz von mindestens 48 St<strong>und</strong>en vor der Untersuchung wird<br />
empfohlen.<br />
Klinische Indikationen: Abklärung der Infertilität beim Mann (Nebenhodenfunktion)<br />
Methode: Photometrie<br />
Referenzbereiche: > 6 U/l<br />
alpha-Linolensäure (U)<br />
Probenmaterial: 5 ml Serum<br />
Klinische Indikationen: Verdacht auf Mangel an Alpha-Linolensäure<br />
Methode: GC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
α 1 Antitrypsin im Stuhl (W)<br />
Probenmaterial: 2 g Stuhl<br />
Abnahmehinweise: Bei der Abnahme bitte Kontamination mit Wasser aus dem WC vermeiden!<br />
Klinische Indikationen: Verdacht auf enterales Eiweißverlustsyndrom, Morbus Crohn, Nekrotisierende<br />
Enterokolitis, Chronische mesenteriale Ischämie, Virale, bakterielle, allergische, autoimmun<br />
verursachte Entzündungen<br />
Methode: LIA<br />
Referenzbereiche: < 268 µg/g Stuhl<br />
α 1-Antitrypsin Genotypisierung (U)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einverständniserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Nachweis von Mangelallelen im α 1-Antitrypsin-Gen bei verminderter<br />
Konzentration im Serum sowie auffälligem Ergebnis in der Phänotypisierung<br />
Methode: PCR <strong>und</strong> Sequenzierung<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
α 1-Antitrypsin im Serum<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verdacht auf hereditären α 1-Antitrypsin-Mangel,<br />
Hepatitis unklarer Genese bei Kindern/Säuglingen,<br />
Lungenemphysem des Erwachsenen,<br />
Hepatitis/Leberzirrhose unklarer Genese bei Erwachsenen<br />
Methode: Nephelometrie<br />
Referenzbereiche: 0,9 – 1,74 g/l<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 149
α 2-Makroglobulin im Liquor (W)<br />
α 1-Antitrypsin Phänotypisierung (U)(N)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Verwendung von Citrat-, Kaliumoxalat-, Natriumfluorid- oder EDTA-<br />
Zusätzen führen zu einer falsch-niedrigen α 1-Antitrypsin-Konzentration <strong>und</strong> können Schwierigkeiten<br />
bei der Phänotypisierung verursachen.<br />
Klinische Indikationen: Ein V.a. einen heriditären α 1-Antitrypsin-Mangel ergibt sich, wenn folgende<br />
Symptome oder Erkrankungen vorliegen: Icterus prolongatus beim Neugeborenen, Hepatitis<br />
unklarer Genese im Säuglings- <strong>und</strong> Kleinkindalter, Lungenemphysem beim Erwachsenen, Hepatitis<br />
oder Leberzirrhose unklarer Genese beim Erwachsenen<br />
Methode: IEF<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
α 1-Mikroglobulin im Serum (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verlaufs- <strong>und</strong> Therapiekontrolle lymphoider Neoplasien (M. Hodgkin, Non-<br />
Hodgkin-Lymphome, Plasmozytom)<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
α 1-Mikroglobulin im Urin<br />
Probenmaterial: 10 ml Spontanurin (2. Morgenurin) oder<br />
10 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: Bitte Sammelmenge <strong>und</strong> Sammelzeit (wenn kleiner als 24 St<strong>und</strong>en) angeben.<br />
Der 2. Morgenurin ist dem 24-St<strong>und</strong>en-Sammelurin gleichwertig, wenn zuvor keine besondere<br />
körperliche Belastung stattgef<strong>und</strong>en hat oder keine polyurische Nierenerkrankung vorliegt.<br />
Klinische Indikationen: Verlaufskontrolle <strong>und</strong> -beurteilung einer tubulären Proteinurie.<br />
Methode: Nephelometrie<br />
Referenzbereiche: < 12,5 mg/l<br />
α 2-Antiplasmin-Aktivität (U)<br />
Synonyme: Antiplasmin<br />
Probenmaterial: 2 ml Citrat-Plasma, gefroren<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Verdacht auf Hyperfibrinolyse, Verbrauchskoagulopathie,<br />
Therapiekontrolle bei Fibrinolyse,<br />
Leberfunktionsstörungen,<br />
Verdacht auf Antiplasmin-Mangel<br />
Methode: chromogen<br />
Referenzbereiche: 80 – 120 %<br />
α 2-Makroglobulin im Liquor (W)<br />
Probenmaterial: 1 ml Liquor<br />
Klinische Indikationen: Weitere Diagnostik bei Verdacht auf Blut-Liquor-<br />
Schrankenfunktionsstörung<br />
150 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: Nephelometrie<br />
Referenzbereiche: < 7 mg/l<br />
α 2-Makroglobulin im Serum (U)<br />
α 2-Makroglobulin im Serum (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Die Untersuchung ist weitgehend durch andere Laborparameter ersetzt worden.<br />
Akute-Phase-Reaktion<br />
Nephrititis<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
α 2-Makroglobulin im Urin (U)<br />
Probenmaterial: 1 ml Spontanurin<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Differenzierung von Proteinurien,<br />
Abgrenzung der postrenalen Proteinurie<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Alprazolam (U)<br />
Synonyme: Benzodiazepine<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Monitoring einer Alprazolam-Therapie, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: 5-50 ng/ml<br />
ALT<br />
Synonyme: Alanin-Aminotransferase, ALAT, GPT<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden.<br />
Klinische Indikationen: Diagnose, Differenzierung, Verlaufs- <strong>und</strong> Therapiekontrolle von Erkrankungen<br />
der Leber <strong>und</strong> der Gallenwege<br />
Methode: Photometrie<br />
Referenzbereiche: Männer: 10 – 50 U/l<br />
Frauen: 10 – 35 U/l<br />
Kinder: altersabhängige Referenzbereiche<br />
Aluminium im Serum (W)(N)<br />
Probenmaterial: 2 ml Serum (unbeschichtete Kunststoffmonovette verwenden, keine Glasmonovetten<br />
oder solche mit Kaolinkügelchen)<br />
Abnahmehinweise: Blutabnahme nüchtern <strong>und</strong> nach Expositionsende. Aluminiumhaltige Medikamente<br />
(Antazida) mindestens 1 Tag vorher absetzen<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 151
Amikacin (U)<br />
Klinische Indikationen: Beurteilung der beruflichen Exposition, Überwachung von Dialysepatienten,<br />
Diagnostik einer Aluminiumintoxikation<br />
Methode: AAS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Aluminium im Urin (W)<br />
Probenmaterial: 10 ml Urin (unbeschichtete Kunststoffmonovette verwenden, keine Glasmonovetten<br />
oder solche mit Kaolinkügelchen)<br />
Abnahmehinweise: Urinentnahme bei nüchternem Patienten, Aluminiumhaltige Medikamente (Antazida)<br />
mindestens 1 Tag vorher absetzen<br />
Klinische Indikationen: Beurteilung der beruflichen Exposition, Überwachung von Dialysepatienten,<br />
Diagnostik einer Aluminiumintoxikation<br />
Methode: ICP-MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
AMA-Subtypen (M2, M4, M9)<br />
Synonyme: AMA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Positiver AMA-Suchtest (→ Auto-Ak gegen Mitochondrien, Seite 181) bei<br />
Vedacht auf PBC,<br />
Verlaufskontrolle<br />
Methode: Immunoblot<br />
Referenzbereiche: negativ<br />
Amantadin (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Monitoring einer Amantadin-Therapie<br />
Methode: GC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Ameisensäure im Urin (U)<br />
Synonyme: Formiat<br />
Probenmaterial: 10 ml Urin mit 3-5 Tropfen Eisessig ansäuern<br />
Klinische Indikationen: Humanbiomonitoring einer erhöhten Exposition durch Formaldehyd<br />
Methode: Photometrie (UV)<br />
Referenzbereiche: < 15 mg/g Krea<br />
Amikacin (U)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bestimmung des max. Spiegels:<br />
ca. 5-30 Minuten nach Beendigung der Infusion bzw. ca. 45-75 Minuten nach i.m.-Injektion.<br />
Bestimmung des Tal-Spiegels:<br />
152 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
vor erneuter Amikacin-Gabe<br />
Klinische Indikationen: Monitoring der Amikacin-Therapie<br />
Methode: enzymatisch<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Aminosäuren-Differenzierung im Serum (W)<br />
Aminosäuren-Differenzierung im Serum (W)<br />
Probenmaterial: 1 ml Serum oder EDTA-Plasma<br />
Abnahmehinweise: Blut direkt nach der Abnahme zentrifugieren <strong>und</strong> Plasma abpipettieren, Plasma<br />
nach der Gewinnung einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Diagnostik von Stoffwechselerkrankungen mit Verdacht auf Störungen im<br />
Aminosäurestoffwechsel<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Aminosäuren-Differenzierung im Urin (U)<br />
Probenmaterial: 5 ml eines 24-St<strong>und</strong>en-Sammelurins (gesammelt über 5 – 10 ml Eisessig)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Genetisch bedingte Störungen des Aminosäurestoffwechsels, der<br />
Aminosäurespeicherun oder des Aminosäuretransportes, z.F. Fanoni-Syndrom, Hartnup-Krankheit<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Amiodaron im Serum<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: (Hinweis: bitte KEINE Gelröhrchen für die<br />
Blutentnahme verwenden!)<br />
Bestimmung des max. Spiegels:<br />
ca. 5-7 St<strong>und</strong>en nach Medikamenteneinnahme<br />
Bestimmung des Talspiegels:<br />
vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring der Amiodaron-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 0,7 – 2,5 mg/l<br />
Amisulprid (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Monitoring einer Amilsuprid-Therapie<br />
Methode: LC/MS<br />
Referenzbereiche: 100 – 320 µg/l<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 153
Amylase im Serum<br />
Amitriptylin im Serum<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Amitriptylintherapie<br />
Methode: HPLC<br />
Referenzbereiche: 50 – 300 µg/l<br />
Ammoniak im Plasma<br />
Probenmaterial: 2 ml EDTA-Plasma, tiefgefroren<br />
Abnahmehinweise: EDTA-Blut innerhalb von 30 Minuten nach Blutentnahme bei +4°C zentrifugieren<br />
(Hämolyse, Ammoniakanstieg nach Blutentnahme)<br />
Klinische Indikationen: Abklärung neuromuskulärer <strong>und</strong> zerebraler Störungen bei:<br />
Hepatopathie (Leberzirrhose, massiver Leberzellschaden), Chemotherapie, Valproinsäure-Therapie,<br />
Abklärung eines unklaren Krampfanfalles oder Komas<br />
Methode: Photometrie<br />
Referenzbereiche: Männer: < 102 µg/dl<br />
Frauen: < 87 µg/dl<br />
Kinder: s. Bef<strong>und</strong>bericht<br />
Amphetamin im Serum (N)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Suchtest zum Nachweis des Gebrauchs von Amphetaminen<br />
Methode: EIA<br />
Referenzbereiche: negativ<br />
Amphetamin im Urin<br />
Probenmaterial: 10 ml Urin<br />
Abnahmehinweise: ggf. Probennahme überwachen<br />
Klinische Indikationen: Suchtest zum Nachweis des Gebrauchs von Amphetaminen<br />
Methode: EIA<br />
Referenzbereiche: negativ<br />
Amphotericin B (U)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: lichtgeschützt (Röhrchen mit Alufolie umwickeln)<br />
Klinische Indikationen: Monitoring einer Amphotericin B-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Amylase im Serum<br />
Synonyme: α-Amylase, Gesamt-Amylase<br />
Probenmaterial: 1 ml Serum<br />
154 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Amylase im Urin<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle einer Pankreatitis oder einer Parotitis,<br />
Abklärung akuter Oberbauchbeschwerden,<br />
Pankreaskarzinom,<br />
Kontrolle nach ERCP<br />
Methode: Photometrie<br />
Referenzbereiche: 28 – 100 U/l<br />
Amylase im Urin<br />
Synonyme: α-Amylase, Gesamt-Amylase<br />
Probenmaterial: 2 ml Spontanurin oder<br />
2 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Hinweis: Der Urin darf NICHT eingefroren werden!<br />
Klinische Indikationen: Chronische Hyperamylasämie,<br />
Verdacht auf Makroamylasämie,<br />
Niereninsuffizienz,<br />
Verdacht auf diabetische Nephropathie<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Amylase-Isoenzyme (U)<br />
Synonyme: α-Amylase<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Differenzierung der Amylasen bei unklarer Amylasenerhöhung<br />
(Makroamylase, Verdacht auf Parotitis)<br />
Methode: Photometrie<br />
Referenzbereiche: Gesamt: < 100 U/l<br />
Pankreas: < 53 U/l<br />
Speichel: < 47 U/l<br />
Amyloid A-Protein im Serum (W)<br />
Synonyme: Serum Amyloid A, SAA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von Infektionserkrankungen, Erkennen<br />
von Transplantatabstoßung, Diagnostik der Amyloidose<br />
Methode: Nephelometrie<br />
Referenzbereiche: < 10 mg/l<br />
Amyloid β 1-42 im Liquor<br />
Probenmaterial: 1 ml Liquor in Polypropylen-Röhrchen<br />
Abnahmehinweise: Abnahme in anderen Probengefäßen kann zur Adsorption an der Gefäßwand<br />
führen (falsch-niedrige Messwerte)<br />
Klinische Indikationen: Differentialdiagnostik der dementiellen ZNS-Erkrankungen, insbesondere<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 155
Angiotensin II (W)<br />
des M. Alzheimer<br />
Methode: EIA<br />
Referenzbereiche: > 500 pg/ml<br />
Analgetika im Urin (W)<br />
Probenmaterial: 10 ml Urin<br />
Abnahmehinweise: ggf. Probennahme überwachen<br />
Klinische Indikationen: Suchtest zum Nachweis des Gebrauchs von Analgetika<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
ANCA-Zielantigene<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Untersuchung bei positivem Nachweis von → Auto-Ak gegen<br />
Granulozyten-Zytoplasma, Seite 180 im IFT,<br />
Verlaufskontrolle<br />
Methode: ELISA<br />
Referenzbereiche: negativ<br />
Androstandiol-Glucuronid (W)<br />
Synonyme: 3-α-diol G<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Blut nach der Abnahme zentrifugiert<br />
<strong>und</strong> das Serum in ein separates Röhrchen abpittetiert werden.<br />
Klinische Indikationen: Weitere Diagnostik bei Hirsutismus oder PCO (Polycystisches Ovar-<br />
Syndrom)<br />
Methode: RIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Androstendion im Serum (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bei Frauen Blutentnahme ca. 1 Woche vor oder nach der Menstruationsperiode<br />
Klinische Indikationen: Nebennierenrindentumor, Adrenogenitales Syndrom, adrenaler Hirsutismus,<br />
Virilisierung<br />
Methode: CLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Angiotensin II (W)<br />
Probenmaterial: 2 ml EDTA-Plasma<br />
Abnahmehinweise: Abnahme nach 30minütigem Liegen zu empfehlen. Das Blut bitte unmittelbar<br />
nach der Abnahme zentrifugieren, das EDTA-Plasma in ein separates Röhrchen (ohne Zusätze)<br />
abpipettieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Differentialdiagnose des Hyperaldosteronismus,<br />
156 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Anti-Faktor Xa-Aktivität<br />
die Untersuchung wurde weitgehend durch andere Verfahren sowie Funktionsteste ersetzt<br />
Methode: RIA<br />
Referenzbereiche: 20 – 40 ng/l<br />
Anti-Faktor Xa-Aktivität<br />
Synonyme: Fragmin ® , Heparin-Wirkung<br />
Probenmaterial: 3 ml Citrat-Plasma<br />
Abnahmehinweise: Die Blutentnahme sollte 2 – 4 h nach letzter Gabe des Heparins erfolgen (bitte<br />
das verwendete Präparat angeben!).<br />
Für längeren Transport Citrat-Blut nach der Abnahme zentrifugieren, das Plasma in ein separates<br />
Röhrchen (ohne Zusätze) abpipetieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Unzureichende Verlängerung der aPTT unter Heparin-Behandlung<br />
Therapiekontrolle/Monitoring der Therapie mit unfraktioniertem Heparin, insbesondere bei<br />
- schweren Leber- oder Nierenschädigungen<br />
- hohem Körpergewicht (> 150 kg)<br />
- niedrigem Körpeergewicht (< 40 kg)<br />
- bei Schwangerschaft<br />
- bei Kindern <strong>und</strong> Neugeborenen<br />
Methode: chromogen<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Anti-HAV (IgG/IgM)<br />
Synonyme: Hepatitis A<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 12-40 Tage (Mittel: 21)<br />
Klinische Indikationen: Diagnostik einer Hepatitis A, Überprüfung des Impferfolges nach Hepatitis<br />
A-Impfung<br />
Methode: CMIA<br />
Referenzbereiche: negativ<br />
Anti-HAV-IgM<br />
Synonyme: Hepatitis A<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik einer akuten Hepatitis A<br />
Methode: CMIA<br />
Referenzbereiche: negativ<br />
Anti-HBc (IgG/IgM)<br />
Synonyme: Hepatitis B<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Screeningparameter bei Verdacht auf Hepatitis B oder Abklärung einer<br />
durchgemachten Hepatitis B (z.B. vor geplanter Impfung)<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 157
Anti-HCV-Immunoblot<br />
Methode: CMIA<br />
Referenzbereiche: negativ<br />
Anti-HBc-IgM<br />
Synonyme: Hepatitis B<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei Nachweis von → Anti-HBc (IgG/IgM), Seite 157.<br />
Methode: CMIA<br />
Referenzbereiche: negativ<br />
Anti-HBe<br />
Synonyme: Hepatitis B<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik einer akuten <strong>und</strong> chronischen Hepatitis B-Infektion<br />
Methode: CMIA<br />
Referenzbereiche: negativ<br />
Anti-HBs<br />
Synonyme: Hepatitis B<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle der Hepatitis B<br />
Überprüfung des Impferfolges nach Impfung<br />
Methode: CMIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Anti-HCV<br />
Synonyme: Hepatitis C, HCV-Suchtest<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 7-140 Tage (Mittel: 50).<br />
Klinische Indikationen: Suchtest bei Verdacht auf eine Hepatitis C-Infektion<br />
Methode: CMIA<br />
Referenzbereiche: negativ<br />
Anti-HCV-Immunoblot<br />
Synonyme: Hepatitis C-Bestätigungstest<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bestätigung eines reaktiven HCV-Suchtestes<br />
Methode: Immunoblot<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
158 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Anti-HDV (IgG/IgM) (W)<br />
Anti-HDV (IgG/IgM) (W)<br />
Synonyme: Hepatitis D<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Anti-HDV (IgG/IgM) ist ca. 4-6 Wochen nach Erkrankungsbeginn nachweisbar.<br />
Klinische Indikationen: Verdacht auf Koinfektion oder Superinfektion einer bestehenden Hepatitis<br />
B. Die Bestimmung ist nur sinnvoll bei Nachweis von → HBs-Antigen, Seite 260.<br />
Methode: EIA<br />
Referenzbereiche: negativ<br />
Anti-HEV (IgG) (W)<br />
Synonyme: Hepatitis E<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 10-60 Tage.<br />
Klinische Indikationen: Verdacht auf eine Hepatitis E bei Reisenden aus Endemiegebieten (z.B.<br />
Südostasien), insbesonderer nach Ausschluss einer Hepatitis A <strong>und</strong> anderer Ursachen einer akuten<br />
Hepatitis.<br />
Methode: ELISA<br />
Referenzbereiche: negativ<br />
Anti-Müller-Hormon (W)<br />
Synonyme: Müllerian-Inhibiting-Substance; MIS; AMH<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Abschätzung der Sertolizell-Funktion<br />
Gonadendysgenesie<br />
Intersexualität<br />
AMH-Mangelsyndrom (Müller-Gang-Persistenzsyndrom)<br />
Polycystisches Ovar-Syndrom (PCO)<br />
Ovarantwort bei In-vitro-Fertilisation<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Anti-Staphylolysin (W)<br />
Synonyme: ASTA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Serologischer Nachweis von Staphylokokkeninfektionen, insbesondere bei<br />
niedrigen Titern der → Streptokokken-Antikörpernachweis.<br />
Methode: Indirekter Agglutinationstest<br />
Referenzbereiche: < 2,0 U/ml<br />
Anti-Streptokokken DNAse B<br />
Synonyme: Anti-Streptodornase B, ADNAse B, Anti-DNAse B<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle von Infektionen mit Streptokokken der<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 159
Antikörper (IgA) gegen Gliadin<br />
Gruppe A, insbesondere bei sek<strong>und</strong>ären Folgeerkrankungen wie rheumatisches Fieber, Superinfektionen<br />
der Haut <strong>und</strong> ggf. Glomerulonephritis<br />
Methode: Nephelometrie<br />
Referenzbereiche: < 200 U/ml<br />
Anti-Streptokokken-Hyaluronidase (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle von Infektionen mit Streptokokken der<br />
Gruppe A, insbesondere bei sek<strong>und</strong>ären Folgeerkrankungen wie rheumatisches Fieber, Superinfektionen<br />
der Haut <strong>und</strong> ggf. Glomerulonephritis<br />
Methode: IHA<br />
Referenzbereiche: < 300 U/ml<br />
Anti-Streptolysin O<br />
Synonyme: ASL, ASLO<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle von Infektionen mit Streptokokken der<br />
Gruppe A, insbesondere bei sek<strong>und</strong>ären Folgeerkrankungen wie rheumatisches Fieber, Superinfektionen<br />
der Haut <strong>und</strong> ggf. Glomerulonephritis<br />
Methode: Immunturbidimetrie<br />
Referenzbereiche: Erwachsene: < 200 IU/ml<br />
Kinder: < 150 IU/ml<br />
Antidiuretisches Hormon (W)<br />
Synonyme: ADH, Vasopressin<br />
Probenmaterial: 2 ml EDTA-Plasma <strong>und</strong> 2 ml Serum<br />
10 ml Urin<br />
Abnahmehinweise: Wegen starker zirkadianer Schwankungen parallel Osmolalität im Serum <strong>und</strong><br />
Urin bestimmen.<br />
EDTA-Blut sofort nach der Blutentnahme zentrifugieren.<br />
Vor der Blutentnahme keinen Kaffee oder Tee, kein Nikotin, ggf. Medikamente 48 Std. vorher absetzen.<br />
Bei Schwangeren im Abnahmeröhrchen Peptidasehemmer (Trasylol) vorlegen.<br />
Klinische Indikationen: Verdacht auf Diabetes insipidus als weitere Diagnostik bei Polyurie <strong>und</strong><br />
Polydipsie nach Ausschluss eines Diabetes mellitus<br />
Methode: RIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bereicht<br />
(Normwerte abhängig von Osmolalität)<br />
Antikörper (IgA) gegen Gliadin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik der Zöliakie,<br />
Verlaufskontrolle/Diätüberwachung bei Zöliakie,<br />
Serologische Abklärung bei Erkrankungen mit erhöhtem Risiko der Entwicklung einer Zöliakie,<br />
160 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Serologische Abklärung bei Zottenatrophie unklarer Genese<br />
Methode: FEIA<br />
Referenzbereiche: < 7,0 U/ml<br />
Antikörper (IgG) gegen Gliadin<br />
Antikörper (IgG) gegen Gliadin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik der Zöliakie,<br />
Serologische Abklärung bei Erkrankungen mit erhöhtem Risiko für die Entwicklung einer Zöliakie,<br />
Serologische Abklärung bei Zottenatrophie unklarer Genese<br />
(auch bei nachgewiesenem IgA-Mangel)<br />
Methode: FEIA<br />
Referenzbereiche: < 7,0 U/ml<br />
Antikörper gegen Cardiolipin (IgG <strong>und</strong> IgM)<br />
Synonyme: Phospolipid-Antikörper<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Venöse bzw. arterielle Gefässverschlüsse (Antiphospholipid-Syndrom),<br />
Thrombozytopenie,<br />
rezidivierende Aborte<br />
Methode: FEIA<br />
Referenzbereiche: < 10 U/ml<br />
Antikörper gegen Erythropoietin (W)<br />
Synonyme: Auto-Ak gegen EPO<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Erythroblastopenie, “Pure red cell aplasia“ (PRCA) unter Gabe von Erythropoietin<br />
Methode: RIP<br />
Referenzbereiche: negativ<br />
Antikörper gegen mutiertes citrulliniertes Vimentin (W)<br />
Synonyme: Anti-MCV<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik der rheumatoiden Arthritis<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Antikörper gegen p53 (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Untersuchung bei verschiedenen Tumorerkrankungen (Colon, Ovar,<br />
Leber)<br />
Methode: EIA<br />
Referenzbereiche: negativ: < 60 U/ml<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 161
Antioxidative Kapazität (W)<br />
grenzwertig: 60 – 120 U/ml<br />
positiv: > 120 U/ml<br />
Antikörper gegen ß2-Glykoprotein I<br />
Synonyme: Phospholipid-Antikörper<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Venöse bzw. arterielle Gefässverschlüsse (Antiphospholipid-Syndrom),<br />
Thrombozytopenie, rezidivierende Aborte<br />
Methode: FEIA<br />
Referenzbereiche: negativ: < 7,0 U/ml<br />
grenzwertig: 7,0 – 10,0 U/ml<br />
positiv: > 10,0 U/ml<br />
Antikörper-Suchtest<br />
Synonyme: Blutgruppenbestimmung, indirekter AHG-Test, indirekter Coombstest<br />
Probenmaterial: 9 ml EDTA-Blut<br />
Abnahmehinweise: Für die Blutguppen-Serologie ist eine NUR für diesen Zweck bestimmte Blutprobe<br />
(separate Monovette) erforderlich. Auf eine eindeutige Kennzeichnung (z.B. mit Namen, Vornamen<br />
<strong>und</strong> Geburtsdatum) ist zu achten.<br />
Klinische Indikationen: Vorbereitung einer Operation, Vorbereitung einer Transfusion, Vorbereitung<br />
einer Transplantation, Mutterschaftsvorsorge, Ausstellung eines Blutgruppen-Ausweises<br />
Methode: Säulenagglutination<br />
Referenzbereiche: negativ<br />
Antimon im Serum (U)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme nach Expositionsende<br />
Klinische Indikationen: Beurteilung der Antimonbelastung<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Antimon im Urin (U)<br />
Probenmaterial: 2 ml Urin<br />
Abnahmehinweise: Probennahme nach Expositionsende<br />
Klinische Indikationen: Beurteilung der Antimonbelastung<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Antioxidative Kapazität (W)<br />
Synonyme: TAS, totaler oxidativer Status<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das Blut bitte direkt nach der Abnahme <strong>und</strong> Gerinnung zentrifugieren, das<br />
Serum in ein separates Röhrchen ohne Zusätze abpipettieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
162 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Antithrombin-Aktivität<br />
Klinische Indikationen: Weitere Untersuchung bei chronischen Erkrankungen mit Verdacht auf<br />
eine gestörte antioxidative Kapazität, insbesondere bei verminderter Bestimmung antioxidativer Substanzen<br />
Methode: Photochemolumineszenz<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Antithrombin-Aktivität<br />
Synonyme: früher: AT III<br />
Probenmaterial: 2 ml Citrat-Plasma<br />
korrekt gefüllte Citratblut-Monovette<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Verdacht auf Antithrombin-Mangel,<br />
DD bei thromboembolischen Erkrankungen,<br />
Diagnostik/Monitoring bei DIC,<br />
Monitoring einer Antithrombin-Therapie,<br />
Leberfunktionsstörungen<br />
Nephrotisches Syndrom<br />
HELLP-Syndrom<br />
Methode: Koagulometrie<br />
Referenzbereiche: 83 – 128 %<br />
Antithrombin-Konzentration (U)<br />
Synonyme: früher: AT III<br />
Probenmaterial: 2 ml Citrat-Plasma<br />
korrekt gefüllte Citratblut-Monovette<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Klassifizierung eines angeborenen Antithrombin-Mangels<br />
Methode: Nephelometrie<br />
Referenzbereiche: 19 – 31 mg/dl<br />
APC-Resistenz<br />
Synonyme: Aktivierte Protein C-Resistenz<br />
Probenmaterial: 1 ml Citrat-Plasma,<br />
korrekt gefüllte Citratblut-Monovette<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Heparin, Lupusantikoagulans <strong>und</strong> Vitamin K-Antagonisten können die Bestimmung stören.<br />
Klinische Indikationen: Abklärung einer angeborenen Thrombophilie,<br />
Abklärung der Ursache einer Thromboembolie,<br />
Frauen mit positiver Familienanamnese vor Einnahme oraler Kontrazeptiva,<br />
Abklärung der Ursachen rez. Aborte,<br />
Familienangehörige bereits bekannter Patienten mit APC-Resistenz<br />
Methode: Koagulometrie<br />
Referenzbereiche: > 2,4 Ratio<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 163
aPTT<br />
Apolipoprotein A1<br />
Synonyme: APO A1<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nach einer Nahrungskarenz von ca. 10-14 St<strong>und</strong>en<br />
Klinische Indikationen: Familiäre Hyperlipoproteinämie, Risikoabschätzung für die Entwicklung<br />
einer Arteriosklerose<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Apolipoprotein B<br />
Synonyme: APO B<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nach einer Nahrungskarenz von ca. 10-14 St<strong>und</strong>en<br />
Klinische Indikationen: Familiäre Hyperlipoproteinämie,<br />
Riskoabschätzung für die Entwicklung einer Arterioklerose<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Apolipoprotein B100-Genotypisierung (U)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einverständniserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Hypercholesterinämie,<br />
Familien-Untersuchung bei bekanntem Apo-B-100-Defekt<br />
Atherosklerose,<br />
Koron. Herzerkrankung<br />
Methode: PCR <strong>und</strong> Schmelzpunktanalyse<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Apolipoprotein E-Genotypisierung (U)<br />
Synonyme: Fettstoffwechsel, Alzheimer Typ-2 (APOE4, OMIM104310)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einverständniserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Hereditäre Fettstoffwechselstörungen<br />
Präsenile Altersdemenz im ca. 6. Lebensjahrzehnt ohne Hinweise auf Familiarität<br />
Methode: PCR <strong>und</strong> Schmelzpunktanalyse<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
aPTT<br />
Synonyme: aktivierte partielle Thromboplastinzeit<br />
Probenmaterial: 1 ml Citrat-Plasma<br />
korrekt gefüllte Citratblut-Monovette<br />
164 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Arachidonsäure (U)<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Globaler Suchtest für erworbene oder angeborene Blutgerinnungsstörungen<br />
(insbesondere Hämophilie A <strong>und</strong> B),<br />
Kontrolle einer Heparin-bzw. Hirudintherapie,<br />
Suchtest für Lupusantikoagulanzien bzw. Inhibitoren gegen Gerinnungsfaktoren, Fibrinolysetherapie,<br />
Bei Verdacht auf DIC bzw. Hyperfibrinolyse<br />
Methode: Photometrie<br />
Referenzbereiche: 25,1 – 36,5 Sek<strong>und</strong>en<br />
Arachidonsäure (U)<br />
Probenmaterial: 1 ml Serum<br />
Methode: GC/MS<br />
Referenzbereiche: 97 – 257 mg/l<br />
Aripiprazol (U)<br />
Synonyme: Handelsname: Abilify ®<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Aripiprazoltherapie<br />
Methode: HPLC<br />
Referenzbereiche: therapeutischer Bereich<br />
bei Gabe von 5 mg/Tag: 50-100 ng/ml<br />
bei Gabe von 15 mg/Tag: 150-250 ng/ml<br />
bei Gabe von 30 mg/Tag: 300-450 ng/ml<br />
Arsen im Haar (U)<br />
Probenmaterial: 500 mg Haare<br />
Klinische Indikationen: Beurteilung der Arsenbelastung, Diagnose der Intoxikation<br />
Methode: AAS<br />
Referenzbereiche: < 0,5 µg/g<br />
Arsen im Serum (W)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Beurteilung der Arsenbelastung, Diagnose der Intoxikation<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Arsen im Urin (W)<br />
Probenmaterial: 10 ml Urin<br />
Abnahmehinweise: Probennahme nach Expositonsende<br />
Klinische Indikationen: Beurteilung der Arsenbelastung, Diagnose der Intoxikation<br />
Methode: ICP/MS<br />
Referenzbereiche: < 31 µg/l<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 165
Astrovirus-Antigennachweis<br />
Arylsulfatase A (U)<br />
Synonyme: Sulfatase A, Cerebrosidsulfat-Sulfohydrolase<br />
Probenmaterial: 2 ml Serum oder 10 ml Urin<br />
Abnahmehinweise: Für die Uringewinnung bitte Urisog-Spezialröhrchen anfordern.<br />
Klinische Indikationen: Verdacht auf Arylsulfatase A-Mangel bei Verdacht auf MLD (metachromatische<br />
Leukodystrophie)<br />
Methode: Photometrie<br />
Referenzbereiche: Serum: 3,6 – 9,4 nmol/h/ml<br />
Urin: 41 – 178 nmol/h/ml<br />
Aspergillus-Antigen (W)<br />
Probenmaterial: 3 ml Serum<br />
Klinische Indikationen: Verdacht auf Aspergillus-Mykose (Aspergillose), insbesondere bei immunsupprimierten<br />
Patienten mit Veracht auf allergische bronchopulmonale Aspergillose oder Aspergillom<br />
der Lunge oder invasive/systemische Aspergillose<br />
Methode: ELISA<br />
Referenzbereiche: negativ<br />
Aspergillus-Antikörper (W)<br />
Probenmaterial: 1 ml Serum (Hämolyse vermeiden!)<br />
Klinische Indikationen: Verdacht auf Aspergillus-Mykose (Aspergillose), insbesondere bei immunsupprimierten<br />
Patienten mit Veracht auf allergische bronchopulmonale Aspergillose oder Aspergillom<br />
der Lunge oder invasive/systemische Aspergillose<br />
Methode: IHA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
AST<br />
Synonyme: Aspartat-Aminotransferase, ASAT, GOT<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden.<br />
Klinische Indikationen: Diagnose, Differenzierung, Verlaufs- <strong>und</strong> Therapiekontrolle von Erkrankungen<br />
der Leber <strong>und</strong> der Gallenwege, von Muskelerkrankungen <strong>und</strong> bei Herzinfarkt<br />
Methode: Photometrie<br />
Referenzbereiche: Männer: 10 – 50 U/l<br />
Frauen: 10 – 35 U/l<br />
Kinder: altersabhängige Referenzbereiche<br />
Astrovirus-Antigennachweis<br />
Probenmaterial: 2 g Stuhl<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 1 – 3 Tage.<br />
Klinische Indikationen: Akute Gastroenteritis, vor allem bei Kleinkindern<br />
Methode: EIA<br />
Referenzbereiche: negativ<br />
166 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Asymmetrisches Dimethylarginin (W)<br />
Asymmetrisches Dimethylarginin (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das Blut bitte nach der Abnahme zentrifugieren, das Serum in ein separates<br />
Röhrchen pipettieren <strong>und</strong> dann einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Abschätzung des kardiovaskulären Risikos<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Atenolol (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Atenolol-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: Therapeutischer Bereich: 100 – 1000 µg/l<br />
Toxischer Bereich: > 2000 µg/l<br />
Atypische Cholinesterasen (U)<br />
Synonyme: Dibucain-Zahl, Fluorid-Zahl<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden.<br />
Klinische Indikationen: Abklärung einer verlängerten Apnoe im Rahmen einer Narkose bei<br />
Verabreichung von Succinylcholin oder Mivacurium zur Muskelrelaxation<br />
Familienuntersuchung bei Patienten mit atypischen Cholinesterase-Verianten<br />
Methode: Photometrie<br />
Referenzbereiche: Dibucain-Nummer<br />
normal: > 70 %<br />
intermediär: 30-70 %<br />
atypisch: < 30 %<br />
Fluorid-Nummer<br />
normal: > 55 %<br />
intermediär: 40 – 55 %<br />
atypisch: < 40 %<br />
Auto-Ak gegen Acetylcholinrezeptor (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Myastenia gravis<br />
Individuelle Verlaufskontrolle<br />
Methode: RIA<br />
Referenzbereiche: < 0,25 nmol/l<br />
Auto-Ak (IgA) gegen Endomysium<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik der Zöliakie,<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 167
Auto-Ak (IgA, IgG, IgM) gegen MAG (W)<br />
Verlaufskontrolle/Diätüberwachung bei Zöliakie,<br />
Serologische Abklärung bei Erkrankungen mit erhöhtem Risiko der Entwicklung einer Zöliakie,<br />
Serologische Abklärung bei Zottenatrophie unklarer Genese<br />
Methode: IFT<br />
Referenzbereiche: negativ (< 1:10)<br />
Auto-Ak (IgA) gegen Transglutaminase<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik der Zöliakie,<br />
Verlaufskontrolle/Diätüberwachung bei Zöliakie,<br />
Serologische Abklärung bei Erkrankungen mit erhöhtem Risiko der Entwicklung einer Zöliakie,<br />
Serologische Abklärung bei Zottenatrophie unklarer Genese<br />
Methode: FEIA<br />
Referenzbereiche: < 7 U/ml<br />
Auto-Ak (IgA, IgG) gegen Becherzellen (U)(N)<br />
Synonyme: Colitis ulcerosa<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei chronisch-entzündlichen Darmerkrankungen, insbesondere<br />
bei Verdacht auf Colitis ulcerosa<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak (IgA, IgG) gegen exokrines Pankreas<br />
Synonyme: Morbus Crohn<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei chronisch-entzündlichen Darmerkrankungen, insbesondere<br />
bei Verdacht auf Morbus Crohn<br />
Methode: IFT<br />
Referenzbereiche: negativ (Titer < 1:10)<br />
Auto-Ak (IgA, IgG, IgM) gegen MAG (W)<br />
Synonyme: Myelin-Assoziiertes-Glykoprotein<br />
Probenmaterial: 1 ml Serum<br />
1 ml Liquor<br />
Klinische Indikationen: Chronische demyelinisierende sensomotorische Polyneuropathie, insbesondere<br />
bei bestehender monoklonaler IgM-Gammopathie (MGUS)<br />
Methode: ELISA<br />
Referenzbereiche: Serum: < 1000 U/ml<br />
Liquor: < 100 U/ml<br />
168 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Auto-Ak (IgG) gegen alveoläre Basalmembranen<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Goodpasture-Syndrom,<br />
idiopathische Lungenblutungen<br />
Auto-Ak (IgG) gegen Aquaporin 4 (W)<br />
Auto-Ak (IgG) gegen alveoläre Basalmembranen<br />
Synonyme: AQP-4<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Neuromyelitis optica (NMO, opticospinale Enzephalomyelitis, Devic-<br />
Syndrom)<br />
Differenzialdiagnose der Multiplen Sklerose<br />
Methode: RIP<br />
Referenzbereiche: < 10 Ak-Ratio<br />
Auto-Ak (IgG) gegen Asialoglycoprotein-Rezeptor (U)(N)<br />
Synonyme: ASGPR-Ak<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Autoimmune Lebererkrankungen (AIH, PBC, PSC),<br />
besonders autoimmune Hepatitis (AIH)<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak (IgG) gegen BPI (U)(N)<br />
Synonyme: bactericidal permeability increasing protein, ANCA<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Weitere Untersuchung bei positivem Nachweis von → Auto-Ak gegen<br />
Granulozyten-Zytoplasma, Seite 180 im IFT,<br />
chronisch-entzündliche Darmerkrankungen,<br />
autoimmune Lebererkrankungen,<br />
Wegenersche Granulomatose, Churg-Strauss-Syndrom, rheumatoide Arthritis,<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak (IgG) gegen Cathepsin G (U)(N)<br />
Synonyme: ANCA<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Weitere Untersuchung bei positivem Nachweis von → Auto-Ak gegen<br />
Granulozyten-Zytoplasma, Seite 180 im IFT,<br />
Wegenersche Granulomatose,<br />
rheumatoide Arthritis,<br />
mikroskopische Polyarteriitis,<br />
Kollagenosen,<br />
chronisch-entzündliche Darmerkrankungen<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 169
Auto-Ak (IgG) gegen Elastase (U)(N)<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak (IgG) gegen CCP<br />
Synonyme: Cyclische citrullinierte Peptide<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik der rheumatoiden Arthritis (RA), Differentialdiagnostik von<br />
Kollagenosen mit Begleitarthritis (SLE, Sjögren-Syndrom) <strong>und</strong> RA, DD der erosiven Form SLE –<br />
RA<br />
Methode: FEIA<br />
Referenzbereiche: negativ: < 7 U/ml<br />
grenzwertig: 7 – 10 U/ml<br />
positiv: > 10 U/ml<br />
Auto-Ak (IgG) gegen CV2<br />
Synonyme: Auto-Ak (IgG) gegen CRMP5<br />
Probenmaterial: 1 ml Serum <strong>und</strong>/oder<br />
1 ml Liquor<br />
Klinische Indikationen: Periphere Neuropathie, Kleinhirnataxie bei paraneoplastischem Syndrom,<br />
insbesondere bei Bronchialkarzinom (kleinzelligen), Uterussarkom, malignes lymphoepitheliales<br />
Thymom, Porstatakrazinom<br />
Methode: IFT<br />
Referenzbereiche: Serum: negativ (< 1:100)<br />
Liquor: negativ<br />
Auto-Ak (IgG) gegen dsDNS<br />
Synonyme: Doppelstrang-DNA, nDNS<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei positivem Suchtest (→ Auto-Ak (IgG) gegen Zellkernantigene,<br />
Seite 178),<br />
Lupus erythematodes<br />
Therapie-/Verlaufskontrolle des SLE<br />
Methode: FEIA<br />
Referenzbereiche: negativ: < 10 IU/ml<br />
grenzwertig: 10 – 15 IU/ml<br />
positiv: > 15 IU/ml<br />
Auto-Ak (IgG) gegen Elastase (U)(N)<br />
Synonyme: ANCA<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Weitere Untersuchung bei positivem Nachweis von → Auto-Ak gegen<br />
Granulozyten-Zytoplasma, Seite 180 im IFT,<br />
Wegenersche Granulomatose,<br />
Mikroskopische Polyarteriitis,<br />
170 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
heumatoide Arthritis,<br />
Kollagenosen,<br />
Rapid progressive Glomerulonephritis,<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak (IgG) gegen ENA-Gruppentest<br />
Auto-Ak (IgG) gegen ENA-Gruppentest<br />
Synonyme: Extrahierbare nukleäre Antigene<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Kollagenosen: SLE, Sjögren-Syndrom, Polymyositits, Dermatomyositis,<br />
Skerodermie, Mischkollagenosen,<br />
Durchführung auch bei negativem ANA-IFT sinnvoll.<br />
Methode: EIA<br />
Referenzbereiche: negativ: < 20 RE/ml<br />
positiv: > 20 RE/ml<br />
Auto-Ak (IgG) gegen glomeruläre Basalmembran<br />
Synonyme: GBM<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Goodpasture-Syndrom,<br />
Anti-GBM-Glomerulonephritis,<br />
rapid-progressive Glomerulonephritis<br />
Methode: IFT<br />
Referenzbereiche: negativ (< 1:5)<br />
Auto-Ak (IgG) gegen Herzmuskel<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Postkardiotomie-Syndrom<br />
Post-Myokardinfarkt-Syndrom<br />
Myokarditis<br />
Kardiomyopathien<br />
Methode: IFT<br />
Referenzbereiche: negativ (< 1:100)<br />
Auto-Ak (IgG) gegen Histone (U)(N)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Bestätigungstest bei positivem Suchtest (→ Auto-Ak (IgG) gegen Zellkernantigene,<br />
Seite 178),<br />
Lupus erythematodes, insbesondere durch Medikamente induziert,<br />
Rheumatoide Arthritis,<br />
Methode: ELISA<br />
Referenzbereiche: < 20 E/ml<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 171
Auto-Ak (IgG) gegen Ma<br />
Auto-Ak (IgG) gegen Hu<br />
Synonyme: Neuronenkerne, ANNA-1<br />
Probenmaterial: 1 ml Serum <strong>und</strong>/oder<br />
1 ml Liquor<br />
Klinische Indikationen: Paraneoplastisches Syndrom, insbesondere bei Bronchialkarzinom<br />
Methode: IFT<br />
Referenzbereiche: Serum: negativ (< 1:100)<br />
Liquor: negativ<br />
Auto-Ak (IgG) gegen Jo-1<br />
Synonyme: ENA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bestätigung eines positiven Suchtestes (→ Auto-Ak (IgG) gegen Zellkernantigene,<br />
Seite 178, → Auto-Ak (IgG) gegen ENA-Gruppentest, Seite 171),<br />
Verlaufskontrolle,<br />
Polymyositis,<br />
Dermatomyositis<br />
Methode: Immunoblot<br />
Referenzbereiche: negativ<br />
Auto-Ak (IgG) gegen Ku (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Progressive Sklerodermie, Dermatomyositis,<br />
SLE, Polymyositis/Dermatoymyosisitis<br />
Methode: RIP<br />
Referenzbereiche: < 10 Ak-Ratio<br />
Auto-Ak (IgG) gegen Laktoferrin (U)(N)<br />
Synonyme: ANCA<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Weitere Untersuchung bei positivem Nachweis von → Auto-Ak gegen<br />
Granulozyten-Zytoplasma, Seite 180 im IFT,<br />
Kollagenosen,<br />
rheumatoide Arthritis<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak (IgG) gegen Ma<br />
Synonyme: Anti-Ta<br />
Probenmaterial: 1 ml Serum <strong>und</strong>/oder<br />
1 ml Liquor<br />
Klinische Indikationen: Kleinhirn- , oder Stammhirndysfunktion, Rhombenzephalitis bei paraneoplastischem<br />
Syndrom, v.a. bei Mamma-, Colon-, Parotis-Karzinomen<br />
172 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: IFT<br />
Referenzbereiche: Serum: negativ (< 1:100)<br />
Liquor: negativ<br />
Auto-Ak (IgG) gegen Myeloperoxidase<br />
Auto-Ak (IgG) gegen Myeloperoxidase<br />
Synonyme: MPO, ANCA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Untersuchung zusammen mit → Auto-Ak gegen Granulozyten-<br />
Zytoplasma, Seite 180 im IFT,<br />
Rapid progressive Glomerulonephritis (RPGN),<br />
verschiedene Vaskulitiden,<br />
chronisch-entzündliche Darmerkrankungen,<br />
Autoimmune Lebererkrankungen,<br />
rheumatoide Arthritis,<br />
Wegenersche Granulomatose<br />
Methode: EIA<br />
Referenzbereiche: < 20 RU/ml<br />
Auto-Ak (IgG) gegen Neuronenkerne Typ 3 (W)<br />
Synonyme: ANNA-3; anti-neuronukleäre Antikörper Typ 3<br />
Probenmaterial: 1 ml Serum <strong>und</strong>/oder<br />
1 ml Liquor<br />
Klinische Indikationen: Paraneoplastische neurologische Symptome (Neuropathie, Kleinhirndegeneration,<br />
limbische Enzephalitis, fokale Epilepsie, Opsoklonus-Myoklonus-Ataxie, Polyneuropathie<br />
(autonom, sensibel, sensomotorisch), extrapyramidal motorische Syndrome) bei Tumoren der oberen<br />
Luftwege <strong>und</strong> des Ösophagus<br />
Methode: IIFT (Serum)<br />
Westernblot (Liquor)<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak (IgG) gegen NMDA-Rezeptoren (W)<br />
Synonyme: Autoantikörper gegen Glutamatrezeptoren vom Typ NMDA<br />
Probenmaterial: 1 ml Serum <strong>und</strong>/oder<br />
1 ml Liquor<br />
Klinische Indikationen: Diagnostik der autoimmunen Enzephalitis (Anti-NMDA-Rezeptor-<br />
Enzephalitis)<br />
Methode: IIFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak (IgG) gegen nRNP<br />
Synonyme: U1-nRNP, ENA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bestätigung eines positiven Suchtestes (→ Auto-Ak (IgG) gegen Zellkernantigene,<br />
Seite 178, → Auto-Ak (IgG) gegen ENA-Gruppentest, Seite 171),<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 173
Auto-Ak (IgG) gegen Ri<br />
Verlaufskontrolle,<br />
Mixed connective tissue disease (MCTD, Sharp-Syndrom),<br />
SLE<br />
Methode: Immunoblot<br />
Referenzbereiche: negativ<br />
Auto-Ak (IgG) gegen Nukleosomen (W)<br />
Synonyme: Auto-Ak (IgG) gegen Nucleosomen<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Systemischer Lupus erythematodes (SLE)<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak (IgG) gegen PM-Scl<br />
Synonyme: PM-1<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Kollagenosen, insbesondere Polymyositis, Dermatomyositis<br />
Methode: Immunoblot<br />
Referenzbereiche: negativ<br />
Auto-Ak (IgG) gegen Proteinase 3<br />
Synonyme: PR3, ANCA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Untersuchung zusammen mit → Auto-Ak gegen Granulozyten-<br />
Zytoplasma, Seite 180 im IFT,<br />
Wegenersche Granulomatose,<br />
Rapid progressive Glomerulonephritis (RPGN),<br />
Kawasaki-Syndrom,<br />
Verschiedene Vaskulitiden,<br />
Uveitis<br />
Methode: EIA<br />
Referenzbereiche: < 20 RU/ml<br />
Auto-Ak (IgG) gegen Ri<br />
Synonyme: Neuronenkerne, ANNA-2<br />
Probenmaterial: 1 ml Serum <strong>und</strong>/oder<br />
1 ml Liquor<br />
Klinische Indikationen: Paraneoplastisches Syndrom, insbesondere bei Bronchial- <strong>und</strong> Mammakarzinom<br />
Methode: IFT<br />
Referenzbereiche: Serum: negativ (< 1:100)<br />
Liquor: negativ<br />
174 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Auto-Ak (IgG) gegen ribosomales P-Protein (U)<br />
Synonyme: RNS, Ribosomen<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Kollagenosen, insbesondere Lupus erythematodes<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak (IgG) gegen Scl 70<br />
Auto-Ak (IgG) gegen ribosomales P-Protein (U)<br />
Synonyme: DNS-Topoisomerase I, ENA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bestätigung eines positiven Suchtestes (→ Auto-Ak (IgG) gegen Zellkernantigene,<br />
Seite 178, → Auto-Ak (IgG) gegen ENA-Gruppentest, Seite 171),<br />
Verlaufskontrolle<br />
Progressive Systemsklerose/Sklerodermie<br />
Methode: Immunoblot<br />
Referenzbereiche: negativ<br />
Auto-Ak (IgG) gegen Skelettmuskulatur<br />
Synonyme: quergestreifte Muskulatur<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Myasthenia gravis,<br />
Polymyositis,<br />
Thymom<br />
Methode: IFT<br />
Referenzbereiche: negativ (< 1:100)<br />
Auto-Ak (IgG) gegen SLA/LP<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Autoimmune Hepatitis<br />
Methode: Immunoblot<br />
Referenzbereiche: negativ<br />
Auto-Ak (IgG) gegen Sm<br />
Synonyme: ENA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bestätigung eines positiven Suchtestes (→ Auto-Ak (IgG) gegen Zellkernantigene,<br />
Seite 178, → Auto-Ak (IgG) gegen ENA-Gruppentest, Seite 171),<br />
Verlaufskontrolle,<br />
Lupus erythematodes (SLE)<br />
Methode: Immunoblot<br />
Referenzbereiche: negativ<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 175
Auto-Ak (IgG) gegen Thyreoglobulin<br />
Auto-Ak (IgG) gegen SS-A<br />
Synonyme: Ro, ENA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bestätigung eines positiven Suchtestes (→ Auto-Ak (IgG) gegen Zellkernantigene,<br />
Seite 178, → Auto-Ak (IgG) gegen ENA-Gruppentest, Seite 171),<br />
Verlaufskontrolle,<br />
Sjögren-Syndrom,<br />
Lupus erythematodes<br />
Methode: Immunoblot<br />
Referenzbereiche: negativ<br />
Auto-Ak (IgG) gegen SS-B<br />
Synonyme: La, ENA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bestätigung eines positiven Suchtestes (→ Auto-Ak (IgG) gegen Zellkernantigene,<br />
Seite 178, → Auto-Ak (IgG) gegen ENA-Gruppentest, Seite 171),<br />
Verlaufskontrolle,<br />
Sjögren-Syndrom,<br />
Lupus erythematodes<br />
Methode: Immunoblot<br />
Referenzbereiche: negativ<br />
Auto-Ak (IgG) gegen ssDNS (W)(N)<br />
Synonyme: DNS-Autoantikörper<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei positivem Suchtest (Auto-Ak (IgG) gegen Zellkernantigene),<br />
Lupus erythematodes<br />
Therapie-/Verlaufskontrolle des SLE<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak (IgG) gegen Thyreoglobulin<br />
Synonyme: TAK<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Anforderung bei negativem Bef<strong>und</strong> für → Auto-Ak (IgG) gegen TPO, Seite<br />
177 <strong>und</strong><br />
Autoimmunthyreoiditis Typ Hashimoto<br />
Hypothyreose unklarer Ursache,<br />
Struma unklarer Ursache,<br />
Abklärung einer polyglandulären Autoimmunerkrankung,<br />
Familiäre Untersuchung bei bekannter autoimmuner Schilddrüsenerkrankung,<br />
Verdacht auf postpartale oder Schwangerschaftsthyreoiditis,<br />
Differentialdiagnostik der Hyperthyreose unbekannter Ätiologie.<br />
176 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Gestörte Wiederfindung bei Bestimmung von Thyreoglobulin<br />
Methode: CMIA<br />
Referenzbereiche: < 4,11 IE/ml<br />
Auto-Ak (IgG) gegen TPO<br />
Synonyme: Thyreoidale Peroxidase, MAK<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Autoimmunthyreoiditis Typ Hashimoto,<br />
Hypothyreose unklarer Ursache,<br />
Struma unklarer Ursache,<br />
Abklärung einer polyglandulären Autoimmunerkrankung,<br />
Familiäre Untersuchung bei bekannter autoimmuner Schilddrüsenerkrankung,<br />
Verdacht auf postpartale oder Schwangerschaftsthyreoiditis,<br />
Differentialdiagnostik der Hyperthyreose unbekannter Ätiologie.<br />
Methode: ECLIA<br />
Referenzbereiche: < 34 IU/ml<br />
Auto-Ak (IgG) gegen Tr<br />
Auto-Ak (IgG) gegen TPO<br />
Synonyme: PCA-Tr<br />
Probenmaterial: 1 ml Serum <strong>und</strong>/oder<br />
1 ml Liquor<br />
Klinische Indikationen: Kleinhirndegeneration als Symptom eines paraneoplastischen Syndroms v.a.<br />
beim Morbus Hodgkin<br />
Methode: IFT<br />
Referenzbereiche: Serum: negativ (< 1:100)<br />
Liquor: negativ<br />
Auto-Ak (IgG) gegen tubuläre Basalmembran<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Interstitielle Nierenerkrankungen,<br />
Glomerulonephritis<br />
Methode: IFT<br />
Referenzbereiche: negativ (< 1:5)<br />
Auto-Ak (IgG) gegen Yo<br />
Synonyme: Purkinjezellen<br />
Probenmaterial: 1 ml Serum <strong>und</strong>/oder<br />
1 ml Liquor<br />
Klinische Indikationen: Paraneoplastische Syndrome (ZNS-Symptomatik),<br />
subakute zerebrale/zerebelläre Degeneration<br />
Methode: IFT<br />
Referenzbereiche: Serum: negativ (< 1:100)<br />
Liquor: negativ<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 177
Auto-Ak gegen Carboanhydrase II (W)<br />
Auto-Ak (IgG) gegen Zellkernantigene<br />
Synonyme: ANA, ANF, Antinukleäre Faktoren<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Kollagenosen,<br />
Rheumtoide Arthritis,<br />
Autoimmune Hepatitis,<br />
Primäre Biliäre Zirrhose,<br />
Verdacht auf Autoimmunerkrankung<br />
Methode: IFT<br />
Referenzbereiche: negativ<br />
Auto-Ak (IgG) gegen Zentromere<br />
Synonyme: CENP-B, Centromere<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Sklerodermie<br />
CREST-Syndrom<br />
Methode: IFT<br />
Referenzbereiche: negativ (Titer < 1:80)<br />
Auto-Ak (IgG, IgM) gegen Ganglioside (W)<br />
Probenmaterial: 1 ml Serum <strong>und</strong>/oder<br />
1 ml Liquor<br />
Klinische Indikationen: Motoneuron-Erkrankungen, Amyotrophe Lateralsklerose, Guillain-Barré-<br />
Syndrom, CIDP<br />
Methode: ELISA<br />
Referenzbereiche: Serum: < 10 Ak-Ratio<br />
Liquor: < 10 Ak-Ratio<br />
Auto-Ak gegen Amphiphysin<br />
Probenmaterial: 1 ml Serum <strong>und</strong>/oder<br />
1 ml Liquor<br />
Klinische Indikationen: Weitere Untersuchung bei Verdacht auf Paraneoplastische Neuropathie,<br />
besonders bei Mamma- bzw. Bronchial-Tumor<br />
Methode: IFT<br />
Referenzbereiche: Serum: negativ (< 1:100)<br />
Liquor: negativ<br />
Auto-Ak gegen Carboanhydrase II (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei negativem ANA-Suchtest bei: Lupus erythematodes,<br />
Polymyositis, Dermatmyositis, Sklerodermie<br />
Der Parameter hat jedoch nur eine geringe Krankheitsspezifität.<br />
Methode: Westernblot<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
178 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Auto-Ak gegen Desmoglein 1 (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik von Pemphigus<br />
Methode: RIP<br />
Referenzbereiche: < 10 Ak-Ratio<br />
Auto-Ak gegen Desmoglein 3 (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik von Pemphigus<br />
Methode: RIP<br />
Referenzbereiche: < 10 Ak-Ratio<br />
Auto-Ak gegen epidermale Basalmembranen (W)<br />
Synonyme: Pemphigoid-Antikörper<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bullöses Pemphigoid,<br />
Herpes gestationis,<br />
IgA-Pemphigoid<br />
Methode: IFT<br />
Referenzbereiche: negativ (Titer < 1:10)<br />
Auto-Ak gegen Gallengangsepithel<br />
Auto-Ak gegen Desmoglein 1 (W)<br />
Synonyme: Gallencanaliculi<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diese Untersuchung hat nur eine geringe klinische Bedeutung<br />
Autoimmune Hepatitis<br />
Methode: IFT<br />
Referenzbereiche: negativ (< 1:100)<br />
Auto-Ak gegen Gefäßendothel<br />
Synonyme: AECA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Vaskulitis, Kawasaki-Syndrom<br />
Methode: IFT<br />
Referenzbereiche: negativ (< 1:100)<br />
Auto-Ak gegen glatte Muskulatur<br />
Synonyme: SMA, ASMA, Aktin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Autoimmune Hepatitis,<br />
Leberzirrhose,<br />
PBC,<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 179
Auto-Ak gegen Insulin (W)<br />
chronische Virus-Hepatitis,<br />
Rheumatoide Arthritis<br />
Viruserkrankungen,<br />
Lupus erythematodes,<br />
Methode: IFT<br />
Referenzbereiche: negativ (< 1:100)<br />
Auto-Ak gegen Glutamat-Decarboxylase<br />
Synonyme: GAD-Antikörper<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diabetes mellitus Typ I, auch Prädisposition <strong>und</strong> Verwandte 1. Grades von<br />
Patienten,<br />
Stiff man-Syndrom<br />
Methode: EIA<br />
Referenzbereiche: < 5,0 IU/ml<br />
Auto-Ak gegen Granulozyten-Zytoplasma<br />
Synonyme: ANCA, ACPA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Wegenersche Granulomatose,<br />
rapid progressive Glomerulonephritis,<br />
Vaskulitiden (Panarteriitis, mikroskopische Polyarteriitis, Churg-Strauss-Syndrom u.a.),<br />
Rheumatoide Arthritis,<br />
Colitits ulcerosa,<br />
M. Crohn,<br />
Primär sklerosierende Cholangitis (PSC),<br />
Autoimmune Lebererkrankungen,<br />
Methode: IFT<br />
Referenzbereiche: negativ (< 1:20)<br />
Auto-Ak gegen Inselzellen<br />
Synonyme: ICA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diabetes mellitus Typ I<br />
Methode: IFT<br />
Referenzbereiche: negativ (< 1:10)<br />
Auto-Ak gegen Insulin (W)<br />
Synonyme: IAA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diabetes mellitus Typ I,<br />
auch zur Abschätzung der Prädisposition <strong>und</strong> bei Verwandten I. Grades<br />
Methode: RIA<br />
Referenzbereiche: < 0,4 U/ml<br />
180 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Auto-Ak gegen Intrinsic Faktor (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Perniziöse Anämie,<br />
Chronisch-atrophische Gastritis Typ A<br />
Vitiligo,<br />
Autoimmune Endokrinopathien<br />
Methode: CLIA<br />
Referenzbereiche: < 1,5 U/ml<br />
Auto-Ak gegen LC-1 (U)(N)<br />
Synonyme: Liver Cytosol Antikörper Typ 1<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Autoimmunhepatitis Typ 2<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak gegen Leber-Nieren-Mikrosomen<br />
Synonyme: LKM<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Autoimmune Lebererkrankungen (AIH, PBC, PSC),<br />
besonders autoimmune Hepatitis (AIH)<br />
Methode: IFT<br />
Referenzbereiche: negativ (< 1:100)<br />
Auto-Ak gegen Mitochondrien<br />
Synonyme: AMA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Autoimmune Lebererkrankungen (AIH, PBC, PSC)<br />
Autoimmune Hepatitis<br />
Primär biliäre Zirrhose<br />
Primär sklerosierende Cholangitis<br />
Kollagenosen<br />
Lupus erythematodes<br />
Methode: IFT<br />
Referenzbereiche: negativ (< 1:100)<br />
Auto-Ak gegen Nebennierenrinde (W)<br />
Synonyme: 21-Hydroxylase<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Morbus Addison,<br />
Unklare Nebenniereninsuffizienz<br />
Methode: RIP<br />
Referenzbereiche: < 10 Ak-Ratio<br />
Auto-Ak gegen Intrinsic Faktor (W)<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 181
Auto-Ak gegen präsynaptischen P/Q-Calcium-Kanal (W)<br />
Auto-Ak gegen Ovar (U)(N)<br />
Synonyme: Steroidzellen<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Infertilität<br />
Autoimmune Polyendokrinopathie<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak gegen Parietalzellen<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Perniziöse Anämie<br />
Chronisch-atrophische Gastritis Typ A<br />
Autoimmune Polyendokrinopathien<br />
Methode: IFT<br />
Referenzbereiche: negativ (Titer < 1:100)<br />
Auto-Ak gegen Parotisgangepithel (U)(N)<br />
Synonyme: Speicheldrüsenausführungsgang<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Sjögren-Syndrom<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak gegen PCNA<br />
Synonyme: Proliferating Cell Nuclear Antigen, Cyclin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Systemischer Lupus erythematodes (SLE)<br />
Methode: IFT<br />
Auto-Ak gegen Phospholipase A2-Rezeptor (W)<br />
Synonyme: Anti-PLA2R<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Nachweis <strong>und</strong> Verlaufskontrolle der idiopathischen membranösen Glomerulonephritis<br />
(IMN)<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak gegen präsynaptischen P/Q-Calcium-Kanal (W)<br />
Probenmaterial: 1 ml Serum <strong>und</strong>/oder<br />
1 ml Liquor<br />
Klinische Indikationen: Lambert-Eaton-Syndrom<br />
Methode: RRA<br />
182 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Referenzbereiche: P/Q-Typ: < 25 pmol/l<br />
N-Typ: < 10 Ak-Ratio<br />
Auto-Ak gegen Ribosomen (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei Lupus erythematodes<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak gegen RNA-Polymerase I (W)<br />
Auto-Ak gegen Ribosomen (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bestätigung eines positiven Suchtestes (→ Auto-Ak (IgG) gegen Zellkernantigene,<br />
Seite 178) mit typischem Muster im Rahmen der Diagnostik von systemischem Lupus<br />
eryhematodes (SLE) oder Sklerodermie<br />
Methode: RZM-RIP/AUR<br />
Referenzbereiche: negativ<br />
Auto-Ak gegen Stachelzelldesmosomen (W)<br />
Synonyme: Epidermale Interzellularsubstanz, Pemphigus-Ak, ICS<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik von Pemphigus<br />
Methode: IIFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak gegen Thyroxin (U)(N)<br />
Synonyme: T4-Ak<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei autoimmunen Schilddrüsenerkrankungen:<br />
- Morbus Basedow<br />
- Autoimmunthyreoiditis (Hashimoto)<br />
Fehlende Plausibilität zwischen Messwerten für TSH <strong>und</strong> Thyroxin.<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak gegen Titin (W)<br />
Synonyme: MGT-30<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Myasthenia gravis<br />
Thymom<br />
Methode: EIA<br />
Referenzbereiche: negativ<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 183
Autoantikörper gegen Spermien (U)(N)<br />
Auto-Ak gegen Topoisomerase II (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bestätigung eines positiven Suchtestes (→ Auto-Ak (IgG) gegen Zellkernantigene,<br />
Seite 178, → Auto-Ak (IgG) gegen ENA-Gruppentest, Seite 171),<br />
Verlaufskontrolle<br />
Progressive Systemsklerose/Sklerodermie<br />
Methode: ELISA<br />
Referenzbereiche: negativ<br />
Auto-Ak gegen Trijodthyronin (U)(N)<br />
Synonyme: T3-Ak<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei autoimmunen Schilddrüsenerkrankungen:<br />
- Morbus Basedow<br />
- Autoimmunthyreoiditis (Hashimoto)<br />
Fehlende Plausibilität zwischen Messwerten für TSH <strong>und</strong><br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Auto-Ak gegen TSH-Rezeptor<br />
Synonyme: TRAK<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Hyperthyreose unklarer Ursache<br />
Verdacht auf M. Basedow<br />
Methode: EIA<br />
Referenzbereiche: negativ: < 1,8 IE/l<br />
grenzwertig: 1,8 – 1,9 IE/l<br />
positiv: > 2,0 IE/l<br />
Auto-Ak gegen Tyrosinphosphatase (U)<br />
Synonyme: IA-2<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diabetes mellitus Typ I, auch Prädisposition <strong>und</strong> Verwandte I. Grades von<br />
Patienten<br />
Methode: RIA<br />
Referenzbereiche: < 0,75 U/ml<br />
Autoantikörper gegen Spermien (U)(N)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Unerfüllter Kinderwunsch<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
184 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Azathioprin als 6-Mercaptopurin (U)<br />
Azathioprin als 6-Mercaptopurin (U)<br />
Probenmaterial: 3 ml Serum, gefroren<br />
Abnahmehinweise: Das Blut bitte nach der Abnahme zentrifugieren, das Serum in ein separates<br />
Röhrchen abpipettieren <strong>und</strong> einfrieren (ca. – 20°C), lichtgeschützt lagern!<br />
Klinische Indikationen: Therapiekontrolle/Monitoring der Azathioprin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
B-Lymphozyten<br />
Synonyme: CD19-Zellen<br />
Probenmaterial: korrekt gefüllte EDTA-Monovette<br />
Abnahmehinweise: EDTA-Monovette direkt nach der Abnahme durch Schwenken gründlich mischen<br />
Klinische Indikationen: Primäre <strong>und</strong> sek<strong>und</strong>äre Imm<strong>und</strong>efekte, Monitoring der HIV-Infektion,<br />
hämatologische Systemerkrankungen<br />
Methode: Durchflusszytometrie (Vollblut-Lyse-Methode, direkte Immunphänotypisierung)<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Babesia microti-Serologie (W)<br />
Synonyme: Babesiose<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 1 bis 4 Wochen.<br />
Klinische Indikationen: Die Babesiose ist eine duch Zecken der Arten Ixodes übertragene Infektionserkrankung,<br />
die durch B. divergens (Europa) bzw. B. microti (Amerika) verursacht werden.<br />
Sek<strong>und</strong>äre Infektionen durch Bluttransfusionen wurden beschrieben. Eine Parasitämie über<br />
Monate/Jahre ist auch nach klinischer Ausheilung möglich.<br />
Klinische Symptomatik: Fieber, Kopfschmerz, Übelkeit, Gewichstabnahme, Anämie sowie Spenomegalie,<br />
Zeckenstich-Anamnese. Bei schweren Verläufen finden sich zudem Ikterus <strong>und</strong> auch Nierenversagen.<br />
Methode: IFT<br />
Referenzbereiche: negativ<br />
Baclofen (U)(N)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Baclofen-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 0,1 – 0,6 µg/ml<br />
Barbiturate im Serum<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Suchtest zum Nachweis des Gebrauchs von Barbituraten<br />
Methode: EIA<br />
Referenzbereiche: negativ<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 185
BCR/ABL Translokation (U)<br />
Barbiturate im Urin<br />
Probenmaterial: 1 ml Urin<br />
Abnahmehinweise: ggf. Probennahme überwachen<br />
Klinische Indikationen: Suchtest zum Nachweis des Gebrauchs von Barbituraten<br />
Methode: EIA<br />
Referenzbereiche: negativ<br />
Barium (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme nach Expositonsende<br />
Klinische Indikationen: Beurteilung der Bariumbelastung, Diagnose der Intoxikation<br />
Methode: ICP/MS<br />
Referenzbereiche: < 2,9 µg/l<br />
Barium im Urin (W)<br />
Probenmaterial: 2 ml Urin<br />
Klinische Indikationen: Beurteilung der Bariumbelastung, Diagnose der Intoxikation<br />
Methode: ICP/MS<br />
Referenzbereiche: < 5,7 µg/l<br />
Bartonella quintana-Serologie (W)<br />
Synonyme: Fünf-Tage-Fieber (Wolhynisches Fieber)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 2-4 Wochen<br />
Klinische Indikationen: Das Wolhynsche Fieber ist eine sehr seltene Erkrankung mit plötzlich einsetzenden<br />
Fieberschüben über 3-5 Tagen Dauer, Arthralgien <strong>und</strong> Kopfschmerzen<br />
Methode: IFT<br />
Referenzbereiche: IgG < 1:64; IgM < 1:20<br />
Basophilen Degranulationstest (U)(N)<br />
Probenmaterial: 1 korrekt gefüllte EDTA-Monovette pro Allergen<br />
Abnahmehinweise: Vor der Untersuchung sollte durch Rücksprache mit dem Labor die Verfügbarkeit<br />
der Untersuchung für das jeweilige Allergen geklärt werden.<br />
Klinische Indikationen: Weitere Untersuchung im Rahmen der Allergie-Diagnostik, insbesondere<br />
bei Medikamenten <strong>und</strong> bei Verdacht auf Pseudoallergien<br />
Referenzbereiche: < 20%<br />
BCR/ABL Translokation (U)<br />
Synonyme: Philadelphia-Chromosom, Leukämie mit BCR/ABL Translokation Chr.9;22<br />
(MIM*151410) bei CML (MIM#608232) oder ALL (MIM%613065)<br />
Probenmaterial: 10 ml EDTA-Blut<br />
3 ml Knochenmark-EDTA-Blut<br />
186 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Bence-Jones-Proteine (qualitativ) im Urin<br />
Abnahmehinweise: Das Probenmaterial sollte in PAXgene-Röhrchen abgenommen werden.<br />
Klinische Indikationen: Bei chronisch myeloischer Leukämie (CML) als früh diagnostizierbarer<br />
Parameter geeignet. Quantitative Bestimmung zur Verlaufsbeobachtung/Remissionskontrolle unter<br />
Therapie (z.B. mit Tyrosinkinasehemmer GLIVEC). Prognostischer Aussagewert auch unter ALL.<br />
Methode: RT-PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Bence-Jones-Proteine (qualitativ) im Urin<br />
Probenmaterial: 1 ml Urin<br />
Klinische Indikationen: Nachweis eine Bence-Jones-Proteinurie bei Plasmozytom, Immunozytom<br />
oder CLL<br />
Methode: Immunfixation<br />
Referenzbereiche: negativ<br />
Benperidol (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Abnahmezeit: ca. 2 h nach oraler Gabe von 6 mg<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Benperidol-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: < 30 µg/l<br />
Benzodiazepine im Serum (N)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Suchtest zum Nachweis des Gebrauchs von Benzodiazepinen<br />
Methode: EIA<br />
Referenzbereiche: negativ<br />
Benzodiazepine im Urin<br />
Probenmaterial: 1 ml Urin<br />
Abnahmehinweise: ggf. Probennahme überwachen<br />
Klinische Indikationen: Suchtest zum Nachweis des Gebrauchs von Benzodiazepinen<br />
Referenzbereiche: negativ<br />
Benzol im Blut (U)<br />
Probenmaterial: 2 ml EDTA-Blut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Bitte Rollrändröhrchen anfordern.<br />
Klinische Indikationen: Kontrolle der Belastung mit aromatischen Kohlenwasserstoffen am Arbeitsplatz,<br />
Vergiftungsausschluss<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 187
β-hCG<br />
Beryllium im Serum (U)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme nach Expositionsende<br />
Klinische Indikationen: Beurteilung der Berylliumbelastung, Diagnose der Intoxikation<br />
Methode: ICP/MS<br />
Referenzbereiche: < 0,2 µg/l<br />
Beryllium im Urin (U)<br />
Probenmaterial: 2 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
Klinische Indikationen: Beurteilung der Berylliumbelastung, Diagnose der Intoxikation<br />
Methode: ICP/MS<br />
Referenzbereiche: < 0,2 µg/l<br />
β-Carotin im Serum (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nüchtern.<br />
Zur Vermeidung einer Hämolyse das Blut zentrifugieren <strong>und</strong> das Serum abpipettieren. Lagerung<br />
gekühlt (+2°C – +8°C) <strong>und</strong> lichtgeschützt (Röhrchen mit Alufolie umwickeln).<br />
Mindestens 12 St<strong>und</strong>en vor der Blutentnahme Nahrungskarenz für Karotten, Pfirsiche, Früchte,<br />
“grünes Gemüse“ (Spinat, Fenchel, Grünkohl).<br />
Klinische Indikationen: Suchtest bei Steatorrhoe, Verdacht auf Malassimilation von Fett, Verdacht<br />
auf β-Carotin-Mangel, Oxidativer Stress, Umwelterkrankungen<br />
Methode: HPLC<br />
Referenzbereiche: 150 – 1250 µg/l<br />
β-Galaktosidase (U)<br />
Probenmaterial: 1 ml Serum, tiefgefroren<br />
Abnahmehinweise: Das Blut bitte innerhalb von 30 Minuten nach der Abnahme zentrifugieren,<br />
Serum in ein separates Röhrchen abpipettieren <strong>und</strong> einfrieren (ca. – 20°C).<br />
Klinische Indikationen: Sphingolipidspeicherkrankheit<br />
Methode: Fluorometrie<br />
Referenzbereiche: 2,8 – 25,0 nmol/h/ml<br />
β-hCG<br />
Synonyme: humanes Choriongonadotropin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung der Frühschwangerschaft (Extrauteringravidität,<br />
Abort),<br />
Diagnose <strong>und</strong> Verlaufsbeurteilung von Trophoblastentumoren (z.B. Hodentumor)<br />
Methode: ECLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
188 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
β-HCH im Blut (U)<br />
Synonyme: β-Hexachlorcyclohexan<br />
Probenmaterial: Vollblut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Spezielle Abnahmemonovetten können angefordert werden.<br />
Klinische Indikationen: Beurteilung der β-HCH-Belastung<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
β-Trace-Protein (U)(N)<br />
Probenmaterial: 0,5 ml Sekret/Exsudat (Nase, Ohr, Fistel)<br />
Klinische Indikationen: Nachweis der Liquorrhoe<br />
Methode: Nephelometrie<br />
Referenzbereiche: Sekret: < 0,5 mg/l<br />
Liquor: > 10 mg/l<br />
β 2-Mikroglobulin im Liquor (W)<br />
β-HCH im Blut (U)<br />
Probenmaterial: 1 ml Liquor<br />
Klinische Indikationen: Beurteilung der Aktivierung des Makrophagen-Systems im ZNS, insbesondere<br />
bei der HIV-Infektion<br />
Methode: MEIA<br />
Referenzbereiche: < 1,7 mg/l<br />
β 2-Mikroglobulin im Serum<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verlaufsbeurteilung von Non-Hodgkin-Lymphomen, Hodgkin-<br />
Lymphomen, Plasmozytomen,<br />
Beurteilung der glomerulären Filtrationsrate, tubulo-interstitielle Nierenerkrankungen, Verlaufsbeurteilung<br />
nach Nierentransplantation, Abstoßungsreaktion nach Knochenmarktransplantation<br />
Methode: Nephelometrie<br />
Referenzbereiche: 20 – 50 Jahre: 1,2 – 2,5 mg/l<br />
> 50 Jahre: 1,4 – 3,2 mg/l<br />
β 2-Mikroglobulin im Urin<br />
Probenmaterial: 10 ml Spontanurin (2. Morgenurin) oder<br />
10 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: Bitte Sammelmenge <strong>und</strong> ggf. Sammelzeit (wenn < 24 St<strong>und</strong>en) angeben.<br />
Der 2. Morgenurin ist dem Sammelurin gleichwertig, wenn zuvor keine besondere körperliche Belastung<br />
stattgef<strong>und</strong>en hat oder keine polyurische Nephropathie besteht.<br />
Klinische Indikationen: Verlaufsbeurteilung <strong>und</strong> -kontrolle einer tubulären Proteinurie<br />
Methode: Nephelometrie<br />
Referenzbereiche: < 0,5 mg/l<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 189
Biperiden (U)(N)<br />
Bilirubin (direkt)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden.<br />
Klinische Indikationen: Diagnose, Differentialdiagnose <strong>und</strong> Verlaufsbeurteilung des Ikterus (bei<br />
Werten für Bilirubin gesamt > 1,1 mg/dl)<br />
Methode: Photometrie<br />
Referenzbereiche: < 0,25 mg/dl<br />
Bilirubin (gesamt)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden.<br />
Klinische Indikationen: Diagnose, Differentialdiagnose <strong>und</strong> Verlaufsbeurteilung des Ikterus<br />
Methode: Photometrie<br />
Referenzbereiche: Erwachsene: < 1,2 mg/dl<br />
Kinder: s. Bef<strong>und</strong>bericht<br />
Bilirubin (indirekt)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden.<br />
Klinische Indikationen: Diagnose, Differentialdiagnose <strong>und</strong> Verlaufsbeurteilung des Ikterus (bei<br />
Werten für Bilirubin gesamt > 1,1 mg/dl)<br />
Methode: Photometrie<br />
Referenzbereiche: < 0,75 mg/dl<br />
Bilirubin im Fruchtwasser (N)<br />
Synonyme: Liley-Test<br />
Probenmaterial: 3 ml Fruchtwasser<br />
Abnahmehinweise: Die Proben nach der Entnahme lichtgeschützt lagern (mit Alufolie umwickeln)<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufsbeurteilung einer Erythroblasosis fetalis bei Rhesusbzw.<br />
ABO-Unverträglichkeit <strong>und</strong> Abschätzung des Schweregrades<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Biperiden (U)(N)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Biperiden-Theapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: 10 – 100 µg/l<br />
190 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Bisoprolol (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Bisoprolol-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 10 – 100 µg/l<br />
BK-(Polyoma)-Virus-DNA-Nachweis<br />
Bisoprolol (U)<br />
Synonyme: BK-Virus-PCR<br />
Probenmaterial: 10 ml Urin<br />
3 ml EDTA-Blut<br />
Klinische Indikationen: Weitere Diagnostik bei hämorrhagischer Zystitis, insbesondere bei Patienten<br />
mit Immunsuppression<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Blei im Blut (U)(N)<br />
Probenmaterial: 4 ml EDTA-Blut<br />
Klinische Indikationen: Bestimmung der aktuellen Bleibelastung, Diagnostik der Bleiintoxikation<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Blei im Urin (W)<br />
Probenmaterial: 10 ml Urin<br />
Klinische Indikationen: Bestimmung der aktuellen Bleibelastung, Diagnostik der Bleiintoxikation<br />
Methode: ICP/MS<br />
Referenzbereiche: < 50 µg/l<br />
Blutbild mit/ohne Differentialblutbild<br />
Probenmaterial: korrekt gefüllte EDTA-Monovette, ggf. zur Thrombozytenzählung Citrat-Blut, bei<br />
Postversand ggf. bitte einen Blutausstrich mitschicken<br />
Abnahmehinweise: EDTA-Monovette direkt nach der Abnahme durch Schwenken gründlich mischen<br />
Lagerung bei Raumtemperatur<br />
Klinische Indikationen: Anämien, Infektionen, Intoxikationen, Kollagenosen, Leukämien <strong>und</strong> andere<br />
hämatologische Systemerkrankungen, maligne Tumoren, Kontrolle von Therapien, Knochenmarkdepression<br />
(Bestrahlung, Chemotherapie, Immunsuppression)<br />
Methode: siehe Einzelparameter<br />
Referenzbereiche: siehe Einzelparameter<br />
Blutgruppen-Serologie<br />
Probenmaterial: 9 ml korrekt gefüllte EDTA-Monovette<br />
Name, Vorname sowie Geburtsdatum des Patienten müssen auf der Monovette stehen <strong>und</strong> mit dem<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 191
Bordetella pertussis-DNA-Nachweis<br />
Anforderungsschein übereinstimmen (eindeutige Zuordnung).<br />
Abnahmehinweise: Für die Blutguppen-Serologie ist eine NUR für diesen Zweck bestimmte Blutprobe<br />
(separate Monovette) erforderlich. Auf eine eindeutige Kennzeichnung (z.B. mit Namen, Vornamen<br />
<strong>und</strong> Geburtsdatum) ist zu achten. Für die Erstellung eines Blutgruppen-Ausweises ist nach den<br />
Richtlinien die Unterschrift der abnehmenden Person zur Identitätssicherung erforderlich.<br />
Klinische Indikationen: Vorbereitung einer Operation, Vorbereitung einer Transfusion, Vorbereitung<br />
einer Transplantation, Mutterschaftsvorsorge, Ausstellung eines Blutgruppen-Ausweises<br />
Methode: Agglutination<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
BNP<br />
Synonyme: NT-pro-BNP, brain natriuretic peptide, N-terminales pro-BNP<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise:<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung der Herzinsuffizienz<br />
Methode: ECLIA<br />
Referenzbereiche: < 125 pg/ml<br />
Bordetella parapertussis-Antikörper (IgA) (U)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 7 – 14 Tage.<br />
Klinische Indikationen: Verdacht auf Parapertussis, der Erreger verursacht ein Pertussis-ähnliches<br />
Krankheitsbild mit meist leichterem Verlauf: Tracheitis, Bronchitis, pertussiformer Husten, meist ohne<br />
Fieber.<br />
Methode: IFT<br />
Referenzbereiche: < 1:100<br />
Bordetella parapertussis-Antikörper (IgG) (U)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 7 – 14 Tage.<br />
Klinische Indikationen: Verdacht auf Parapertussis, der Erreger verursacht ein Pertussis-ähnliches<br />
Krankheitsbild mit meist leichterem Verlauf: Tracheitis, Bronchitis, pertussiformer Husten, meist ohne<br />
Fieber<br />
Methode: IFT<br />
Referenzbereiche: < 1:100<br />
Bordetella pertussis-DNA-Nachweis<br />
Synonyme: Bordetella-PCR, Keuchhusten<br />
Probenmaterial: tiefer Nasen- oder Rachenabstrich<br />
(Abstriche bitte ohne Transportmedium)<br />
Abnahmehinweise: Die Untersuchung kann auch in der Inkubationszeit der Erkrankung (ca. 7-21<br />
Tage) durchgeführt werden. Zu Beginn der Erkrankung ist die höchste Positivrate zu erwarten.<br />
Klinische Indikationen: Verdacht auf B. pertussis-Infektion (Keuchhusten) bei Tracheitis, Bronchitis,<br />
pertussiformer Husten,<br />
192 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Umgebungsuntersuchung<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Bordetella pertussis-Serologie<br />
Synonyme: Keuchhusten, Pertussis<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 10-14 Tage<br />
Klinische Indikationen: Verdacht auf Keuchhusten/Pertussis.<br />
Überprüfung der Immunitätslage<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Bordetella pertussis/parapertussis DNA Nachweis<br />
Bordetella pertussis-Serologie<br />
Synonyme: Bordetella-PCR, Keuchhusten<br />
Probenmaterial: tiefer Nasen- oder Rachenabstrich<br />
(Abstriche bitte ohne Transportmedium)<br />
Abnahmehinweise: Die Untersuchung kann auch in der Inkubationszeit der Erkrankung (ca. 7-21<br />
Tage) durchgeführt werden. Zu Beginn der Erkrankung ist die höchste Positivrate zu erwarten.<br />
Klinische Indikationen: V.a. Keuchhusten, akute Bronchitis, Umgebungsuntersuchung<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Borrelien-Antikörper (IgG)<br />
Synonyme: Borrelien-Suchtest, Lyme disease<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung einer Borrelien-Infektion in verschiedenen<br />
Erkrankungsstadien:<br />
Stadium I (nach Tagen bis Wochen):<br />
Erythema migrans, Fazialisparese<br />
Stadium II (nach Wochen bis Monaten):<br />
multiple Erytheme, Lymphozytom, Karditis, Meningitis, Meningoenzephalitis oder -radikulitis<br />
Stadium III (nach Jahren):<br />
Arthritis, Akrodermatitis chronica atrophicans, chron. Enzephalomyelitis<br />
Methode: EIA<br />
Referenzbereiche: negativ (< 0,9 Ratio)<br />
Borrelien-Antikörper (IgG, Liquor/Serum)<br />
Synonyme: Borrelien-IgG-AI<br />
Probenmaterial: 1 ml Liquor <strong>und</strong> 1 ml Serum<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
Klinische Indikationen: Nachweis einer intrathekalen IgG-Synthese gegen Borrelien bei Verdacht<br />
auf Neuroborreliose<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 193
Borrelien-Antikörper (IgM-Westernblot)<br />
Methode: EIA<br />
Referenzbereiche: 0,6 – 1,5 Index<br />
Borrelien-Antikörper (IgG-Westernblot)<br />
Synonyme: Borrelien-Bestätigungstest, Lyme disease<br />
Probenmaterial: 1 Serum<br />
Klinische Indikationen: Bestätigung eines positiven → Borrelien-Antikörper (IgG), Seite 193 bei der<br />
Diagnose <strong>und</strong> Verlaufsbeurteilung einer Borrelien-Infektion in verschiedenen Erkrankungsstadien:<br />
Stadium I (nach Tagen bis Wochen):<br />
Erythema migrans, Fazialisparese<br />
Stadium II (nach Wochen bis Monaten):<br />
multiple Erytheme, Lymphozytom, Karditis, Meningitis, Meningoenzephalitis oder -radikulitis<br />
Stadium III (nach Jahren):<br />
Arthritis, Akrodermatitis chronica atrophicans, chron. Enzephalomyelitis<br />
Methode: Immunoblot<br />
Referenzbereiche: negativ<br />
Borrelien-Antikörper (IgM)<br />
Synonyme: Borrelien-Suchtest, Lyme disease<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung einer Borrelien-Infektion in verschiedenen<br />
Erkrankungsstadien:<br />
Stadium I (nach Tagen bis Wochen):<br />
Erythema migrans, Fazialisparese<br />
Stadium II (nach Wochen bis Monaten):<br />
multiple Erytheme, Lymphozytom, Karditis, Meningitis, Meningoenzephalitis oder -radikulitis<br />
Stadium III (nach Jahren):<br />
Arthritis, Akrodermatitis chronica atrophicans, chron. Enzephalomyelitis<br />
Methode: EIA<br />
Referenzbereiche: negativ (Ratio < 0,8)<br />
Borrelien-Antikörper (IgM, Liquor/Serum<br />
Synonyme: Borrelien-IgM-AI<br />
Probenmaterial: 1 ml Serum <strong>und</strong> 1 ml Liquor<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
Klinische Indikationen: Nachweis einer intrathekalen IgM-Synthese gegen Borrelien bei Verdacht<br />
auf Neuroborreliose, insbesondere bei fehlender IgG-Synthese<br />
Methode: EIA<br />
Referenzbereiche: 0,6 – 1,5 Index<br />
Borrelien-Antikörper (IgM-Westernblot)<br />
Synonyme: Borrelien-Bestätigungstest, Lyme disease<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bestätigung eines positiven → Borrelien-Antikörper (IgM), Seite 194 bei der<br />
194 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Borrelien-DNA-Nachweis<br />
Diagnose <strong>und</strong> Verlaufsbeurteilung einer Borrelien-Infektion in verschiedenen Erkrankungsstadien.<br />
Stadium I (nach Tagen bis Wochen):<br />
Erythema migrans, Fazialisparese<br />
Stadium II (nach Wochen bis Monaten):<br />
multiple Erytheme, Lymphozytom, Karditis, Meningitis, Meningoenzephalitis oder -radikulitis<br />
Stadium III (nach Jahren):<br />
Arthritis, Akrodermatitis chronica atrophicans, chron. Enzephalomyelitis<br />
Methode: Immunoblot<br />
Referenzbereiche: negativ<br />
Borrelien-DNA-Nachweis<br />
Synonyme: Borrelien-PCR<br />
Probenmaterial: 1 ml Liquor<br />
Hautbiopsie<br />
1 ml Gelenkpunktat<br />
Abnahmehinweise: Bitte sterile Abnahme bzw. sterile Gefäße benutzen<br />
Klinische Indikationen: Verdacht auf Borrelien-Infektion<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Borrelien-Serologie (Stufendiagnostik)<br />
Synonyme: Lyme disease<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung einer Borrelien-Infektion in verschiedenen<br />
Erkrankungsstadien.<br />
Stadium I (nach Tagen bis Wochen):<br />
Erythema migrans, Fazialisparese<br />
Stadium II (nach Wochen bis Monaten):<br />
multiple Erytheme, Lymphozytom, Karditis, Meningitis, Meningoenzephalitis oder -radikulitis<br />
Stadium III (nach Jahren):<br />
Arthritis, Akrodermatitis chronica atrophicans, chron. Enzephalomyelitis<br />
Methode: siehe Einzelparameter<br />
Bromazepam (U)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme unmittelbar vor erneuter Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Bromazepam-Therapie, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: 50 – 200 ng/ml (toxisch ab 300)<br />
Bromid im Serum (W)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Monitoring einer Bromid-Therapie<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 195
C-Peptid im Serum<br />
Methode: ICP/MS<br />
Referenzbereiche: < 12 mg/l<br />
Bromid im Urin (W)(N)<br />
Probenmaterial: 20 ml Urin<br />
Klinische Indikationen: Monitoring einer Bromid-Therapie<br />
Methode: Photometrie<br />
Referenzbereiche: < 5 mg/24h<br />
Brucella-Antikörper (U)<br />
Synonyme: Morbus Bang, Maltafieber<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit variiert sehr stark <strong>und</strong> beträgt im Mittel 2-3 Wochen<br />
Klinische Indikationen: Verdacht auf M. Bang bei entsprechender Anamnese (Reise, Genuss von<br />
rohem Käse oder Milch, berufliche Exposition) bzw. klinischer Symptomatik: trockener Husten,<br />
Nachtschweß, Arthralgien, Gewichtsverlust, Muskelschmerzen, Fieber (<strong>und</strong>ulierend).<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
BSG (N)<br />
Synonyme: Blutsenkungsgeschwindigkeit<br />
Probenmaterial: korrekt gefühlte BSG-Monovette<br />
Abnahmehinweise: Monovette nach der Entnahme durch Schwenken gründlich mischen<br />
Klinische Indikationen: Infektionen, Entzündungen, Kollagenosen, Verlaufskontrolle<br />
Methode: Sedimentation in normierter Säule<br />
Referenzbereiche: < 10/20 mm<br />
Buprenorphin (W)<br />
Probenmaterial: 2 ml Urin<br />
Klinische Indikationen: Überwachung der Buprenorphin-Substitutions-Therapie<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Bupropion (W)(N)<br />
Synonyme: Handelsnamen: Elontril ® Zyban ®<br />
Probenmaterial: 1 ml Serum<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
C-Peptid im Serum<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nüchtern (ca. 12 St<strong>und</strong>en Nahrungskarenz); zur Vermeidung einer<br />
Hämolyse sollte das Serum bei längerem Probentransport abzentrifugiert werden.<br />
196 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
C-reaktives Protein (CRP)<br />
Klinische Indikationen: Verdacht auf Insulinom, DD der Hypoglykämie (Hypoglycaemia factitia),<br />
Methode: ECLIA<br />
Referenzbereiche: 1,1 – 4,4 ng/ml<br />
C-reaktives Protein (CRP)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle entzündlicher Prozesse (Akute-Phase-<br />
Reaktion)<br />
Methode: Immunturbidimetrie<br />
Referenzbereiche: < 5,0 mg/l<br />
C1-Esterase-Inhibitor-Aktivität (W)<br />
Synonyme: C1-INH, C1-Inaktivator<br />
Probenmaterial: 1 ml Citrat-Blut<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Hereditäres (HAE) <strong>und</strong> erworbenes Angioödem (AAE)<br />
Methode: Photometrie<br />
Referenzbereiche: 70 – 130 %<br />
C1-Esterase-Inhibitor-Konzentration (W)<br />
Synonyme: C1-INH, C1-Inaktivator<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Hereditäres Angioödem (HAE) oder erworbenes Angioödem (AAE)<br />
Methode: Nephelometrie<br />
Referenzbereiche: 25 – 50 mg/dl<br />
C1q-Komplementfaktor (W)(N)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verdacht auf Komplemtentmangel,<br />
Immunkomplexerkrankungen,<br />
Vaskulitis,<br />
Lupus erythematodes (SLE)<br />
Methode: RID<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
C2-Komplementfaktor (W)<br />
Synonyme: C2<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verdacht auf C2-Komplementfaktormangel, ungeklärte Abwehrschwäche,<br />
Immunkomplexerkrankungen, hereditäres angioneurotisches Ödem<br />
Methode: RID<br />
Referenzbereiche: 10 – 30 mg/l<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 197
CA 125<br />
C3-Komplementfaktor<br />
Synonyme: C3<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verdacht auf C3-Komplement-Mangel, rezidivierende Infekte (besonders<br />
Kindesalter), Glomerulonephritis, SLE<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
C3-Nephritisfaktor (W)(N)<br />
Synonyme: C3-NEF<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Untersuchung bei nachgewiesenem Mangel an → C3-<br />
Komplementfaktor, Seite 198 <strong>und</strong>:<br />
- Glomerulonephritis<br />
- rapid progressive Glomerulonephritis<br />
- membranoproliferative Glomerulonephritis vom Typ II<br />
- Poststreptokokken-Glomerulonephritis<br />
- Persistierender C3-Mangel<br />
- Lipodystrophie<br />
Referenzbereiche: negativ<br />
C4-Komplementfaktor<br />
Synonyme: C4<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verdacht auf C4-Komplement-Mangel, Immunkomplexerkrankungen, Autoimmunerkrankungen<br />
(SLE, Sjögren-Syndrom), rezidivierende Infektionen, Glomerulonephritis,<br />
angeborenes angioneurotisches Ödem, autoimmunhämolytische Anämie<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
C5-Komplementfaktor (W)<br />
Synonyme: C5<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei Komplementdefekten, Verdacht auf C5-Mangel, unklare<br />
Abwehrschwäche, Immunkomplexerkrankungen, Leiner-Syndrom<br />
Methode: RID<br />
Referenzbereiche: 80 – 120%<br />
CA 125<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle bei Ovarialkarzinom<br />
Methode: ECLIA<br />
Referenzbereiche: < 35 U/ml<br />
198 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
CA 15-3<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapie- <strong>und</strong> Verlaufskontrolle bei Mammakarzinom<br />
Methode: CMIA<br />
Referenzbereiche: < 32 U/ml<br />
CA 19-9<br />
CA 15-3<br />
Synonyme: Gastrointestinal cancer antigen<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle bei Karzinomen des Pankreas, der Leber,<br />
der Gallenwege <strong>und</strong> des Magens<br />
Methode: ECLIA<br />
Referenzbereiche: < 37 U/ml<br />
CA 50 (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapie- <strong>und</strong> Verlaufskontrolle bei Pankreaskarzinom, Kolorektalem<br />
Karzinom <strong>und</strong> Gallengangskarzinom<br />
Methode: IRMA<br />
Referenzbereiche: < 30 kU/l<br />
CA 72-4<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapie- <strong>und</strong> Verlaufskontrolle bei Magenkarzinom (Erstmarker)<br />
Methode: ECLIA<br />
Referenzbereiche: < 6,7 U/ml<br />
Cadmium im Blut (W)<br />
Probenmaterial: 2 ml EDTA- oder Ammonium-Heparin-Vollblut<br />
Klinische Indikationen: Bestimmung der aktuellen Cadmiumbelastung, Diagnostik der Cadmiumintoxikation<br />
Methode: AAS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Cadmium im Haar (W)<br />
Probenmaterial: 1 g Haar vom Haaransatz (Hinterkopf)<br />
Klinische Indikationen: Beurteilung der Cadmium-Belastung<br />
Methode: ICP/MS<br />
Referenzbereiche: < 0,03 – 0,15 mg/kg<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 199
Calcium im Dialysat (N)<br />
Cadmium im Urin (W)<br />
Probenmaterial: 5 ml Urin<br />
Klinische Indikationen: Bestimmung der aktuellen Cadmiumbelastung, Diagnostik der Cadmiumintoxikation<br />
Methode: ICP-MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Calcitonin<br />
Synonyme: hCT, Thyreocalcitonin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung des medullären Schilddrüsenkarzinoms,<br />
Familienangehörige von Patienten mit medullärem Schilddrüsenkarzinom, familiäres<br />
Phäochromozytom, MEN II,<br />
Methode: CLIA<br />
Referenzbereiche: Frauen: 1 – 4,8 pg/ml<br />
Männer: 1 – 11,8 pg/ml<br />
Calcium gesamt im Serum<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nüchtern (ca. 12 St<strong>und</strong>en Nahrungskarenz)<br />
Klinische Indikationen: Tetanisches Syndrom, Adynamie,<br />
Knochenerkrankungen (Spontanfrakturen, Osteoporose, Wachstumsstörungen),<br />
Nierenerkranungen (Urolithiasis, Polyurie, chronische Niereninsuffizienz),<br />
Verdacht auf Hypo- oder Hyperparathyreoidismus,<br />
M. Boeck, Tuberkulose, Tumoren,<br />
Medikamenteneinnahme (Vitamin D, Antiepileptika, Kortikosteroide, Thiazide, Digitalis)<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Calcium gesamt im Urin<br />
Probenmaterial: 5 ml Spontanurin oder<br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Weitere Untersuchung im Rahmen der Calcium-Stoffwechseldiagnostik<br />
Methode: Photometrie<br />
Referenzbereiche: 0,5 – 6,0 mmol/l<br />
2,5 – 7,5 mmol/24h<br />
Calcium im Dialysat (N)<br />
Probenmaterial: 2 ml Dialysat<br />
Klinische Indikationen: Qualitätskontrolle von Dialysat<br />
Methode: Photometrie<br />
Referenzbereiche: < 0,9 mmol/l<br />
200 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Calprotectin im Stuhl<br />
Calprotectin im Stuhl<br />
Probenmaterial: 1 g Stuhl<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle bei chronisch-entzündlichen<br />
Darmerkrankungen (M. Crohn, Colitis ulcerosa),<br />
Abgrenzung vom Colon irritabile<br />
Früherkennung des kolorektalen Karzinoms<br />
Methode: ELISA<br />
Referenzbereiche: < 50 mg/kg Stuhl<br />
Campylobacter-Antikörper (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 7-21 Tage. Bei der akuten Erkrankung ist<br />
der Erregernachweis (z.B. aus Stuhlprobe) die Untersuchung der Wahl<br />
Klinische Indikationen: Verdacht auf Campylobacter-Infektion bei reaktiver Arthritis, Enteritis<br />
Symptomatik: Diarrhoe, häufig blutiger Stuhl<br />
periumbilikale Bauchschmerzen, kolikartige Krämpfe, Erbrechen, Fieber, Kopfschmerzen<br />
Methode: EIA<br />
Referenzbereiche: < 20 U/ml<br />
Candida albicans DNA-Nachweis (W)<br />
Synonyme: Candida-PCR<br />
Probenmaterial: 3 ml EDTA-Vollblut<br />
1 ml Liquor<br />
Abstrich<br />
Klinische Indikationen: Verdacht auf systemische Candidose<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Candida-Antigen im Serum (U)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Serum nicht hitzeinaktivieren<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung einer systemischen Candidiasis (Endomykose)<br />
Methode: Latexagglutination<br />
Referenzbereiche: < 1,15 U/ml<br />
Candida-Antikörper<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 7-14 Tage<br />
Klinische Indikationen: Diagnose <strong>und</strong> ggf. Verlaufsbeurteilung von Candida-Infektionen wie systemische<br />
Candidiasis, mukokutane Candidiasis, M<strong>und</strong>soor, Vaginitis, Balanitis, Überwachung von<br />
Intensivpatienten.<br />
Methode: ELISA<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 201
Carnitin im Sperma (U)<br />
Cannabis im Urin<br />
Synonyme: THC<br />
Probenmaterial: 5 ml Urin<br />
Abnahmehinweise: ggf. Probennahme überwachen<br />
Klinische Indikationen: Suchtest zum Nachweis des Gebrauchs von Cannabis<br />
Methode: EIA<br />
Referenzbereiche: negativ<br />
Carbamazepin<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Bestimmung des max. Spiegels: ca. 6-18 St<strong>und</strong>en nach Medikamenteneinnahme<br />
Bestimmung des Talspiegels: vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring der Carbamazepin-Therapie<br />
Methode: MEIA<br />
Referenzbereiche: 4 – 12 µg/ml<br />
Carbamazepin-Epoxid<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring<br />
Methode: HPLC<br />
Referenzbereiche: 0,4 – 2,0 mg/l<br />
Carnitin (frei) im Serum (W)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Mangel- <strong>und</strong> Fehlernährung, chronische Hämodialyse, Gravidität,<br />
Antikonvulsiva-Therapie, Gedeihstörungen, Muskelschwäche unklarer Genese<br />
Methode: enzymatisch<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Carnitin gesamt (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Verdacht auf Carnitin-Mangel<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Carnitin im Sperma (U)<br />
Probenmaterial: 1 ml Sperma<br />
Abnahmehinweise: Sperma 1 + 1 mit physiologischer Kochsalzlösung verdünnen <strong>und</strong> in ein Fluoridröhrchen<br />
geben, eine sexuelle Karenz von mindestens 48 St<strong>und</strong>en vor der Untersuchung wird<br />
empfohlen.<br />
Klinische Indikationen: Abklärung der Infertilität beim Mann (Nebenhodenfunktion)<br />
Methode: LC/MS<br />
Referenzbereiche: > 4,0 mg/dl<br />
202 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
CASA (W)<br />
Synonyme: Cancer associated serum antigen<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle bei Mamma- <strong>und</strong> Ovarialkarzinom<br />
Methode: EIA<br />
Referenzbereiche: < 4,0 U/ml<br />
Caspofungin (W)<br />
Synonyme: Handelsname: Cancidas ®<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Caspofungin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: 1 – 12 mg/l<br />
CDT – Carbohydrate Deficient Transferrin<br />
Synonyme: A-, Mono- <strong>und</strong> Disialo-Transferrin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Monitoring des Alkoholkonsums<br />
Methode: HPLC<br />
Referenzbereiche: normal: < 1,2 %<br />
Graubereich: 1,3 – 2,5 %<br />
erhöht: > 2,6 %<br />
CEA<br />
CASA (W)<br />
Synonyme: Carcinoembryonales Antigen<br />
Probenmaterial: 1 Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle gastrointestinaler Karzinome, Differentialdiagnose<br />
von Lebertumoren<br />
Methode: ECLIA<br />
Referenzbereiche: < 4,7 ng/ml<br />
CEA im Liquor (W)(N)<br />
Probenmaterial: 1 ml Liquor<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
Klinische Indikationen: → CEA-Quotient (Liquor/Serum)<br />
Methode: ECLIA<br />
Referenzbereiche: < 1 ng/ml<br />
Ceftazidim (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Ceftazidim-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 203
Chlamydia trachomatis-DNA-Nachweis<br />
CH 100 (U)<br />
Synonyme: Gesamthämolytische Komplementaktivität<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Screeningtest bei Verdacht auf Störungen im Komplementsystem (angeborener<br />
<strong>und</strong> erworbener Komplementmangel)<br />
Referenzbereiche: 40 – 200 U/ml<br />
Chinidin im Serum (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bestimmung des max. Spiegels: ca. 1-3 St<strong>und</strong>en nach Medikamenteneinnahme<br />
Bestimmung des Talspiegels: vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring der Chinidin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: 1 – 5 mg/l<br />
Chlamydia trachomatis-Antikörper (IgA)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 2-25 Tage.<br />
Klinische Indikationen: Verdacht auf Chlamydien-Infektion, insbesondere bei: urogenitale Infektionen<br />
wie Urethritis, Adnexitis, Prostatitis, Cervicitis, Salpingitis, reaktive Arthritis, atypische Pneumonie,<br />
Trachom, Konjunktivitis, M. Reiter<br />
Methode: EIA<br />
Referenzbereiche: < 22 AU/ml<br />
Chlamydia trachomatis-Antikörper (IgG)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 2-25 Tage.<br />
Klinische Indikationen: Verdacht auf Chlamydien-Infektion, insbesondere bei:<br />
urogenitale Infektionen wie Urethritis, Adnexitis, Prostatitis, Cervicitis, Salpingitis, reaktive Arthritis,<br />
atypische Pneumonie, Trachom, Konjunktivitis, M. Reiter<br />
Methode: EIA<br />
Referenzbereiche: < 22 AU/ml<br />
Chlamydia trachomatis-DNA-Nachweis<br />
Synonyme: Chlamydia trachomatis-PCR<br />
Probenmaterial: 10 ml Morgenurin (Anfangsstrahl)<br />
Abstrich (Spezialabstrichbesteck auf Anforderung)<br />
1 ml Ejakulat<br />
Abnahmehinweise: Sterile Abnahme <strong>und</strong> Lagerung gekühlt (+2°C – +8°C), Material unbehandelt<br />
einsenden oder Tupfer-/Abstrichbürsten trocken in sterilem Röhrchen einsenden.<br />
Klinische Indikationen: Nachweis einer Chlamydieninfektion bei Zervicitis, Urethritis, Adnexitis,<br />
Konjunktivitis, im Rahmen der Mutterschaftsvorsorge, Fertilitätsuntersuchungen<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
204 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Chlamydophila pneumoniae-Antikörper (IgA)<br />
Chlamydophila pneumoniae-Antikörper (IgA)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 30 Tage, gelegentlich kürzer.<br />
Klinische Indikationen: Verdacht auf C. pneumoniae-Infektion, insbesondere bei:<br />
atypische Pneumonie (insbesonder im Jugendalter), Sinusitis, Pharyngitis, Otitis media. Eine kardiale<br />
Beteiligung ist möglich. Ca. 50 % der Erkrankungen verlaufen subklinisch<br />
Methode: EIA<br />
Referenzbereiche: < 22 AU/ml<br />
Chlamydophila pneumoniae-Antikörper (IgG)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 30 Tage, gelegentlich kürzer.<br />
Klinische Indikationen: Verdacht auf C. pneumoniae-Infektion, insbesondere bei:<br />
atypische Pneumonie (insbesonder im Jugendalter), Sinusitis, Pharyngitis, Otitis media. Eine kardiale<br />
Beteiligung ist möglich. Ca. 50 % der Erkrankungen verlaufen subklinisch.<br />
Methode: EIA<br />
Referenzbereiche: < 22 AU/ml<br />
Chlamydophila pneumoniae-Antikörper (IgM)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 30 Tage, gelegentlich kürzer.<br />
Klinische Indikationen: Verdacht auf C. pneumoniae-Infektion, insbesondere bei:<br />
atypische Pneumonie (insbesonder im Jugendalter), Sinusitis, Pharyngitis, Otitis media. Eine kardiale<br />
Beteiligung ist möglich. Ca. 50 % der Erkrankungen verlaufen subklinisch.<br />
Methode: EIA<br />
Referenzbereiche: < 0,9 Index<br />
Chlamydophila pneumoniae-DNA-Nachweis<br />
Synonyme: Chlamydophila pneumoniae-PCR<br />
Probenmaterial: Sputum<br />
BAL<br />
Trachealsekret<br />
Abnahmehinweise: Sterile Abnahme <strong>und</strong> Lagerung gekühlt (+2°C – +8°C), Material unbehandelt<br />
einsenden oder Tupfer-/Abstrichbürsten trocken in sterilem Röhrchen einsenden.<br />
Klinische Indikationen: Verdacht auf C. pneumoniae-Infektion bei atypischer Pneumonie<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Chlamydophila psittaci-Antikörper (W)(N)<br />
Synonyme: Ornithose, Psittakose<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 7-14 Tage.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 205
Chlorid im Urin (N)<br />
Klinische Indikationen: Verdacht auf Papageienkrankheit (Psittakose) oder Vogelkrankheit (Ornithose)<br />
bei atypischer Pneumonie <strong>und</strong> entsprechendem Risikokontakt in der Anamnese.<br />
Methode: IIFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Chloramphenicol (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bestimmung des Talspiegels: direkt vor der nächsten Gabe<br />
Bestimmung des Spitzenspiegels: ca. 2-3 St<strong>und</strong>en nach der letzten Dosis<br />
Klinische Indikationen: Monitoring einer Chloramphenicol-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Chlordiazepoxid (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Chlordiazepoxid-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Chlorid im Dialysat (N)<br />
Probenmaterial: 2 ml Dialysat<br />
Klinische Indikationen: Qualitätskontrolle von Dialysat<br />
Methode: ISE<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Chlorid im Serum<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Störungen des Säure-Basen-Haushaltes,<br />
Störungen der Natrium- <strong>und</strong> Wasser-Bilanz<br />
Methode: ISE<br />
Referenzbereiche: 98 – 107 mval/l<br />
Chlorid im Urin (N)<br />
Probenmaterial: 10 ml Spontanurin oder<br />
10 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Weitere Diagnostik bei Abklärung pathologischer Chloridwerte im Serum<br />
Methode: Photometrie<br />
Referenzbereiche: 46 – 168 mmol/l<br />
120 – 250 mmol/24h<br />
206 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Chloroquin (U)<br />
Chloroquin (U)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Das Röhrchen nach der Blutentnahme lichtgeschützt (mit Alufolie umwickeln)<br />
lagern<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Chloroquin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Chlorpromazin (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Chlorpromazin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 30 – 250 ng/ml<br />
toxisch > 500 ng/ml<br />
Chlorpropamid (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Chlorpropamid-Therapie<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Chlorprothixen (U)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Das Röhrchen nach der Blutentnahme lichtgeschützt (mit Alufolie umwickeln)<br />
lagern<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Chlorprothixen-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 40 – 200 ng/ml<br />
Cholesterin (gesamt)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nüchtern (ca. 12 St<strong>und</strong>en Nahrungskarenz), langes Stauen vermeiden<br />
Klinische Indikationen: Screening eines Atherosklerose-Risikos,<br />
Verdacht auf Fettstoffwechselstörung<br />
Methode: Photometrie<br />
Referenzbereiche: Orientierungsgrenze: < 200 mg/dl<br />
Entscheidend für das koronare Risiko ist das LDL-Cholesterin. Ziel für das Gesamtcholesterin <strong>und</strong><br />
das LDL-Cholesterin orientiert sich am koronaren Gesamtrisiko.<br />
Cholinesterase<br />
Synonyme: CHE<br />
Probenmaterial: 1 ml Serum<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 207
Chromogranin A<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden.<br />
Blutentnahme nüchtern (ca. 12 St<strong>und</strong>en Nahrungskarenz)<br />
Klinische Indikationen: Diagnose/Verlaufsbeurteilung der Leberzellfunktionsleistung bei:<br />
- schwerem Leberzellschaden (Zirrhose)<br />
- akuter/chronischer Hepatitis<br />
- vor Gabe von Muskelrelaxantien bei Verdacht auf eine CHE-Variante<br />
- verlängerte Apnoe nach Narkosen<br />
- Vergiftung mit Pestiziden<br />
Methode: Photometrie<br />
Referenzbereiche: 5,3 – 12,9 kU/l<br />
Chrom im Blut (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Ermittlung der Chrombelastung<br />
Methode: AAS<br />
Referenzbereiche: < 2 µg/l<br />
Chrom im Serum (U)(N)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Ermittlung der Chrombelastung als zusätzliche Untersuchung zur Bestimmung<br />
von Chrom im Urin<br />
Methode: AAS<br />
Referenzbereiche: < 2 µg/l<br />
Chrom im Urin (U)(N)<br />
Probenmaterial: 10 ml Urin<br />
Abnahmehinweise: bei arbeitsmedizinischer Untersuchung zum Schichtende bzw. direkt vor Beginn<br />
der nächsten Schicht abnehmen<br />
Klinische Indikationen: Methode der Wahl zur Diagnostik der erhöhten Chrombelastung<br />
Methode: AAS<br />
Referenzbereiche: < 0,6 µg/l<br />
Chrom in Erythrozyten (U)<br />
Probenmaterial: 2 ml Heparin-Blut<br />
Klinische Indikationen: Ermittlung der Chrombelastung als zusätzliche Untersuchung zur Bestimmung<br />
von Chrom im Urin<br />
Methode: ICP/MS<br />
Referenzbereiche: < 0,9 µg/l Ery<br />
Chromogranin A<br />
Synonyme: CgA, CGA<br />
Probenmaterial: 1 ml Serum<br />
208 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Chromosomenanalyse von Abort- <strong>und</strong> Gewebematerial (Fibroblastenkultur) (W)<br />
Abnahmehinweise: Blutentnahme morgens nach ausreichender Nahrungskarenz (ca. 12 St<strong>und</strong>en)<br />
Klinische Indikationen: Verdacht auf Phäochromozytom, Ganglioneurinom, Neuroblastom, neuroendokriner<br />
Tumor, kleinzelliges Bronchialkarzinom<br />
Methode: ELISA<br />
Referenzbereiche: 27 – 94 ng/ml<br />
Chromosomenanalyse von Abort- <strong>und</strong> Gewebematerial<br />
(Fibroblastenkultur) (W)<br />
Probenmaterial: auf Anfrage<br />
Abnahmehinweise: Entnahme- <strong>und</strong> Versandmaterial wird auf Anfrage zugesandt.<br />
Klinische Indikationen: Auschluß numerischer <strong>und</strong> struktureller Chromosomenaberrationen<br />
Methode: Zellkultur, Bänderung <strong>und</strong> Färbung<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Ciprofloxacin (U)<br />
Synonyme: Handelsname: mehrere z.B. Ciprobay ®<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Ciprofloxacin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 0,5 – 4 µg/ml<br />
Citalopram (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme direkt vor der nächsten Medikamenteneinnnahme<br />
Klinische Indikationen: Monitoring einer Citalopram-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Citrat im Sperma (W)(N)<br />
Probenmaterial: 1 ml Sperma<br />
Abnahmehinweise: Sperma 1 + 1 mit physiologischer Kochsalzlösung verdünnen <strong>und</strong> in ein Fluoridröhrchen<br />
geben, eine sexuelle Karenz von mindestens 48 St<strong>und</strong>en vor der Untersuchung wird<br />
empfohlen.<br />
Klinische Indikationen: Abklärung der Infertilität beim Mann<br />
Methode: Photometrie<br />
Referenzbereiche: 250 – 800 mg/dl<br />
Citrat im Urin (W)<br />
Probenmaterial: 5 ml eine 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: Bitte unbedingt die Sammelmenge <strong>und</strong> die Sammelzeit angeben (wenn nicht 24<br />
St<strong>und</strong>en)<br />
Klinische Indikationen: Weitere Untersuchung bei Nephrolithiasis<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 209
Clobazam (W)<br />
Methode: Photometrie<br />
Referenzbereiche: 450 – 900 mg/d<br />
CK gesamt<br />
Synonyme: Creatinkinase, CK-NAC, CPK<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden.<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von Herzmuskel- <strong>und</strong> Skelettmuskelerkrankungen,<br />
Therapiekontrolle bei Myokardinfarkt<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
CK-Isoenzyme<br />
Synonyme: Creatinkinase-Isoenzyme, Makro-CK<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden.<br />
Klinische Indikationen: Differenzierung einer erhöhten → CK gesamt, Seite 210.<br />
Methode: Elektrophorese<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
CK-MB-Aktivität/Anteil<br />
Synonyme: Creatinkinase-Isoenzym MB<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden.<br />
Klinische Indikationen: Differenzierung einer erhöhten → CK gesamt, Seite 210 bei akuter<br />
Myokardschädigung<br />
Methode: Photometrie<br />
Referenzbereiche: < 25 U/l<br />
Clindamycin (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Clindamycin-Therapie.<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Clobazam (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Monitoring der Clobazam-Therapie<br />
210 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: HPLC<br />
Referenzbereiche: 100 – 400 ng/ml<br />
Clomethiazol (U)<br />
Probenmaterial: 2 ml Serum<br />
20 ml Urin<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Clomethiazol-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 0,5 – 3,0 mg/l<br />
Clomipramin<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring der Clomipramin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: Clomipramin: 90 – 250 ng/ml<br />
Desmethylclomipramin: 150 – 300 ng/ml<br />
Clonazepam (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme unmittelbar vor erneuter Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Clonazepam-Therapie, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: 10 – 60 ng/ml<br />
Clostridium difficile-Toxin A/B<br />
Clomethiazol (U)<br />
Probenmaterial: 2 g Stuhl<br />
Klinische Indikationen: Verdacht auf antibiotikaassoziierte Colitis (AAC), insbesondere bei Diarrhoe<br />
bzw. pseudomembranöser Colitis während oder bis zu 4 Wochen nach antibiotischer Therapie<br />
Methode: EIA<br />
PCR<br />
Referenzbereiche: negativ<br />
Clozapin im Serum<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Clozapin-Therapie, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: 50 – 700 µg/l<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 211
Coffein (W)<br />
CO-Hämoglobin (U)<br />
Synonyme: Co-Hb, Carboxyhämoglobin, Kohlenmonoxid-Hämoglobin<br />
Probenmaterial: 1 ml EDTA-Blut<br />
Klinische Indikationen: Kohlenmonoxidvergiftung<br />
Methode: Photometrie<br />
Referenzbereiche: < 5 % des Gesamt-Hb<br />
Raucher: < 10 % des Gesamt-Hb<br />
Nichtraucher: < 1 % des Gesamt-Hb<br />
Kinder: < 1 % des Gesamt-Hb<br />
Cocain im Urin<br />
Probenmaterial: 5 ml Urin<br />
Abnahmehinweise: ggf. Probennahme überwachen<br />
Klinische Indikationen: Suchtest zum Nachweis des Gebrauchs von Cocain<br />
Methode: EIA<br />
Referenzbereiche: negativ<br />
Coenzym Q10 (U)<br />
Synonyme: Ubichinon<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bestimmung der oxidativen Kapazität des Organismus <strong>und</strong> Monitoring der<br />
Ubichinon-Substitution<br />
Methode: HPLC<br />
Referenzbereiche: 0,4 – 1,2 mg/l<br />
Coeruloplasmin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verdacht auf Morbus Wilson,<br />
Abklärung einer Leberfunktionsstörung,<br />
Hypochrome, mikrozytäre Eisenrefraktäre Anämie,<br />
Verdacht auf nutritiven Kupfermangel,<br />
Neurodegenerative Symptome einer<br />
Bindegewebserkrankung bei Säuglingen <strong>und</strong> Kleinkindern (Verdacht auf Menkes-Erkrankung)<br />
Methode: Nephelometrie<br />
Referenzbereiche: 0,2 – 0,6 g/l<br />
Coffein (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bestimmung des max. Spiegels: ca. 1 St<strong>und</strong>e nach i.v.-Ladedosis<br />
Bestimmung des Talspiegels: vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Frühgeborenen-Monitoring bei Therapie des Bradykardie-Apnoe-Syndroms<br />
mit Coffein,<br />
Verdacht auf Coffein-Intoxikation<br />
212 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: HPLC<br />
Referenzbereiche: Therapeutischer Bereich: 2 – 10 mg/l<br />
Frühgeborene: 7,4 – 19,4 mg/l<br />
Collagen Typ I A1-Gen-Polymorphismus (U)<br />
Collagen Typ I A1-Gen-Polymorphismus (U)<br />
Synonyme: COL 1A1 (MIM 120150.0051)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einverständniserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Bestimmung des individuellen Risikos für Osteoporose.<br />
Methode: PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Collagen-Bindungsaktivität (W)<br />
Probenmaterial: korrekt gefüllte Citratblutmonovette<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Weitere Untersuchung zur Klassifizierung des von-Willebrand-Syndroms<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Cortisol im Serum<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Wegen der starken tageszeitlichen Abhängigkeit bitte die Entnahme-Uhrzeit immer<br />
mit angeben. Stress-Situationen vermeiden.<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von Hyper- <strong>und</strong> Hypokortisolismus.<br />
Methode: CMIA<br />
Referenzbereiche: vor 10 Uhr: 3,7 – 19,4 µg/dl<br />
nach 17 Uhr: 2,9 – 17,3 µg/dl<br />
Cortisol im Speichel (W)<br />
Probenmaterial: 1 ml Speichel (Salivette)<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von Hyper- <strong>und</strong> Hypokortisolismus.<br />
Methode: ECLIA<br />
Referenzbereiche: 8.00 – 10.00 Uhr: < 9,8 µg/l<br />
14.30 – 15.30 Uhr: < 5,4 µg/l<br />
24 Uhr: < 2 µg/l<br />
Cortisol, freies im Urin<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Diagnose des Hyperkortisolismus (M. Cushing)<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 213
CRP hochsensitiv<br />
Methode: CMIA<br />
Referenzbereiche: 4,3 – 176 µg/d<br />
Cotinin im Serum (W)<br />
Synonyme: Nikotin-Metabolit<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Nachweis der passiven <strong>und</strong> aktiven Aufnahme von Tabakrauch (Cotinin ist<br />
ein stabiler Metabolit des Nikotins)<br />
Methode: LC-MS/MS<br />
Referenzbereiche: Nichtraucher: < 10 µg/l<br />
Raucher: > 50 µg/l<br />
Cotinin im Urin (W)<br />
Synonyme: Nikotin-Metabolit<br />
Probenmaterial: 1 ml Urin<br />
Klinische Indikationen: Nachweis der passiven <strong>und</strong> aktiven Aufnahme von Tabakrauch (Cotinin ist<br />
ein stabiler Metabolit des Nikotins)<br />
Methode: CLIA<br />
Referenzbereiche: Nichtraucher: < 500 µg/l<br />
Raucher: > 500 µg/l<br />
Coxiella burnetii-Antikörper (W)<br />
Synonyme: Q-Fieber, Rickettsien<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 2-4 Wochen.<br />
Klinische Indikationen: Verdacht auf Q-Fieber, besonders bei atypischer Pneumonie <strong>und</strong><br />
anamnestisch Kontakt mit infizierten Tieren (z.B. Schaf, Ziege, Rind)<br />
Übertragungsmodus: aerogen, durch tierische Exkremente von infizierten Haustieren<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Coxsackie Virus-Antikörper<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 6-14 Tage<br />
Klinische Indikationen: Abklärung bei Myo-/Perikarditis, virale Meningitis, Fieber, Pseudoparesen,<br />
Myalgie, Enteritis, Orchitis, Hepatitis, Hand-FußM<strong>und</strong>-Krankheit (Typ A9)<br />
Methode: ELISA<br />
Referenzbereiche: IgG: < 11 U/ml<br />
IgA: < 10 U/ml<br />
CRP hochsensitiv<br />
Synonyme: hs-CRP<br />
Probenmaterial: 1 ml Serum<br />
214 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Cryptococcus neoformans-Antigennachweis (W)<br />
Klinische Indikationen: Erstdiagnostik bei Patienten mit Verdacht auf Atherosklerose/koronare<br />
Herzkrankheit (KHK),<br />
Primär-Prävention im Zusammenhang mit der Bestimmung klassischer Risikofaktoren wie Rauchen,<br />
Hypertonuns, Diabetes mellitus, Fettstoffwechselstörungen,<br />
Verlaufskontrolle bei KHK-Patienten<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Cryptococcus neoformans-Antigennachweis (W)<br />
Probenmaterial: 2 ml Serum oder 2 ml Liquor<br />
Klinische Indikationen: Diagnose einer Cryptococcus-Infektion, insbesondere bei Lungeninfektion<br />
<strong>und</strong> Meningitis bei Patienten mit Immunsuppression (HIV, Chemotherapie, Transplantation).<br />
Nach Eintritt (meist aerogen) in den Organismus kann fast jedes Organsystem befallen werden.<br />
Methode: Agglutination<br />
Referenzbereiche: negativ<br />
CT-Pro-Arginin-Vasopressin (W)<br />
Synonyme: Copeptin, CT-pro-AVP<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme sollte morgens nüchtern nach 8 St<strong>und</strong>en Flüssigkeitskarenz erfolgen.<br />
Wegen starker zirkadianer Schwankungen parallel Osmolalität im Serum bestimmen.<br />
Vor der Blutentnahme keinen Kaffee, Tee, kein Nikotin, ggf. Medikamente 48 St<strong>und</strong>en vorher absetzten.<br />
Die Bestimmung von CT-Pro-Arginin-Vasopressin hat gegenüber ADH den Vorteil, dass anstatt<br />
von EDTA-Plasma gefroren Serum verwendet werden kann.<br />
Klinische Indikationen: wie ADH – Verdacht auf Diabetes insipidus als weitere Diagnostik bei<br />
Polyurie <strong>und</strong> Polydipsie nach Ausschluss eines Diabetes mellitus<br />
Methode: ILMA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
CTX (U)<br />
Synonyme: Crosslaps, β-Crosslaps<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nüchtern (12 St<strong>und</strong>en Nahrungskarenz) <strong>und</strong> morgens zwischen<br />
7.30 Uhr <strong>und</strong> 08.30 Uhr (circadiane Rhythmik).<br />
Klinische Indikationen: Beurteilung des Knochenstoffwechsels, Osteoporosediagnostik <strong>und</strong><br />
-screening<br />
Methode: ECL<br />
Referenzbereiche: Frauen<br />
prämenopausal: < 0,59 ng/ml<br />
postmenopausal: < 1,0 ng/ml<br />
Männer<br />
30 – 50 Jahre: < 0,58 ng/ml<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 215
Cystatin C<br />
51 – 70 Jahre: < 0,7 ng/ml<br />
> 70 Jahre: < 0,85 ng/ml<br />
Cyanid im Blut (U)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Hämolyse vermeiden!<br />
Klinische Indikationen: Verdacht auf Intoxikation, Ingestion bzw. Inhalation (bei Verbrennung von<br />
Polyurethan), Monitoring der beruflichen Exposition (chemische Industrie)<br />
Referenzbereiche: Nichtraucher: < 0,1 mg/l<br />
Toxisch: > 0,6 mg/l<br />
Cyclobarbital (W)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Cyclobarbital-Therapie<br />
Referenzbereiche: 2 – 10 mg/l<br />
Cyclosporin A monoklonal<br />
Synonyme: CyA, Ciclosporin A<br />
Probenmaterial: 2 ml EDTA-Blut<br />
Klinische Indikationen: Monitoring der Cyclosporin-Therapie<br />
Methode: CMIA<br />
Referenzbereiche: Therapeutischer Bereich nach Absprache mit dem Transplantationszentrum<br />
CYFRA 21-1<br />
Synonyme: Cytokeratin-19-Fragmente<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung des Bronchialkarzinoms, Verlaufskontrolle<br />
des Harnblasenkarzinoms<br />
Methode: ECLIA<br />
Referenzbereiche: < 3,3 ng/ml<br />
Cystatin C<br />
Synonyme: GFR<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verdacht auf Einschränkung der Glomerulären Filtrationsrate (GFR),<br />
Therapiemonitoring,<br />
Monitoring nach Nierentransplantation<br />
Methode: Turbidimetrie<br />
Referenzbereiche: 1 Tag – 5 Tage: 0,99 – 1,91 mg/l<br />
6 Tage – 1 Monat: 1,11 – 2,15 mg/l<br />
1 Monat, 1 Tag – 1 Jahr: 0,51 – 1,39 mg/l<br />
> 1 Jahr: 0,50 – 0,95 mg/l<br />
> 50 Jahre: > 0,95 mg/dl<br />
216 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Cysticercus cellulosae-Antikörper (U)<br />
Cysticercus cellulosae-Antikörper (U)<br />
Synonyme: Zystizerkose-Serologie, Schweinebandwurm<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verdacht auf Zystizerkose, insbesondere bei unklaren Abdominalschmerzen,<br />
Gewichtsverlust, Proglottiden im Stuhl, Aufnahme von ungenügend gegartem Fleisch<br />
Referenzbereiche: < 9 Units<br />
Cystin im Urin (U)<br />
Probenmaterial: 5 ml eines 24-St<strong>und</strong>en-Sammelurins (über Eisessig gesammelt)oder<br />
5 ml Spontanurin<br />
Abnahmehinweise: Bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben, Urin gekühlt (+ 2°C – + 8°C) sammeln.<br />
Klinische Indikationen: Weitere Untersuchung bei Urolithiasis bzw. bei Nachweis von Cystinhaltigen<br />
Nieren- <strong>und</strong> Harnsteinen, Fanconi-Syndrom, Cystinurie<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Cystin-Aminopeptidase (W)(N)<br />
Synonyme: Oxytokinase<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Überwachung der Schwangerschaft<br />
Referenzbereiche: < 5,0 U/l<br />
Cystische Fibrose (W)<br />
Synonyme: CF, Mukoviszidose<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Stufendiagnostik; telefonische Rücksprache erbeten<br />
Einverständniserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Verdacht auf Cystische Fibrose, insbesondere bei unklarer Lungen- oder<br />
Pankreasfibrose, Samenleiterfehlbildung, auffälligem Schweißtest, männlicher Infertilität, Azoospermie<br />
Methode: PCR <strong>und</strong> Sequenzierung<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Cytomegalie-Virus pp65-Antigen-Nachweis (W)<br />
Synonyme: CMV pp65-Antigen<br />
Probenmaterial: 2 ml EDTA-Blut<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 3-12 Wochen.<br />
Klinische Indikationen: Verdacht auf Reaktivierung einer CMV-Infektion unter immunsuppressiver<br />
Therapie (nach Transplantationen) oder bei Imm<strong>und</strong>efekt<br />
Methode: IFT<br />
Referenzbereiche: negativ<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 217
Cytomegalie-Virus-Serologie<br />
Cytomegalie-Virus-Antikörper (IgG-Avidität) (W)<br />
Synonyme: CMV-IgG-Avidität<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 20-30 Tage<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle der CMV-Infektion (Primärinfektion) <strong>und</strong><br />
der Reaktivierung, insbesondere bei Immunsuppression.<br />
Erfassung des CMV-Serostatus im Rahmen von Transplantationen.<br />
Mit der CMV-Aviditäts-Bestimmung ist die Eingrenzung des Infektionszeitpunktes möglich<br />
Methode: Aviditätstest<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Cytomegalie-Virus-Antiörper (IgG, Liquor/Serum)<br />
Synonyme: CMV-AI<br />
Probenmaterial: 1 ml Serum <strong>und</strong> 1 ml Liquor<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
Klinische Indikationen: Nachweis einer intrathekalen IgG-Synthese gegen Cytomegalie-Virus bei<br />
akuten <strong>und</strong> auch chronischen ZNS-Erkrankungen.<br />
Methode: EIA<br />
Referenzbereiche: 0,6 – 1,5 Index<br />
Cytomegalie-Virus-DNA-Nachweis<br />
Synonyme: CMV-PCR<br />
Probenmaterial: je nach Indikation:<br />
Chorionbiopsie<br />
1 ml Fruchtwasser<br />
0,5 ml fetales EDTA-Blut<br />
1 ml Liquor<br />
10 ml Urin<br />
1 ml respiratorisches Material<br />
3 ml EDTA-Blut<br />
Kammerwasser<br />
Abnahmehinweise: Bitte für diese Untersuchung eine separate Monovette abnehmen. Das Blut nach<br />
der Abnahme kühl (+2°C – +8°C) lagern.<br />
Die Inkubationszeit beträgt ca. 3-12 Wochen.<br />
Klinische Indikationen: Nachweis einer CMV-Primärinfektion (besonders in der Gravidität <strong>und</strong> bei<br />
Neugeborenen) oder einer CMV-Reaktivierung (besonders bei Immunsupprimierten) bei Retinitis,<br />
Hepatitis, Pneumonie, Therapiemonitoring einer CMV-Infektion<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Cytomegalie-Virus-Serologie<br />
Synonyme: CMV<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 20-30 Tage<br />
218 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: EIA<br />
Referenzbereiche: IgG: negativ (< 25 U/ml)<br />
IgM: negativ(< 10 U/ml)<br />
D-Dimere<br />
D-Dimere<br />
Probenmaterial: 1 ml Citrat-Plasma<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Akut-Diagnostik bei Verdacht auf frische Venen-Thrombose (CITO-<br />
Untersuchung),<br />
Verlaufskontrolle unter Lyse-Therapie,<br />
DIC, Hyperfibrinolyse,<br />
Indikator der Hyperkoagulabilität,<br />
Risikoschwangerschaft<br />
Methode: Koagulometrie<br />
Referenzbereiche: < 500 ng/ml<br />
Daptomycin (W)<br />
Synonyme: Handelsname: Cubicin ®<br />
Probenmaterial: 1 ml Serum, tiefgefroren<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Daptomycin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Delta-Aminolävulinsäure im Urin (W)<br />
Synonyme: ALS, D-ALAS, Porphyrie-Diagnostik<br />
Probenmaterial: 20 ml Spontanurin oder<br />
20 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: Urin lichtgeschützt sammeln.<br />
Klinische Indikationen: Verdacht auf Bleivergiftung, akute hepatische Porphyrien, andere Schwermetallvergiftungen,<br />
Bleiexposition, Alkoholismus, Arzneimittelschädigung der Leber, chronische<br />
hepatische Porphyrien<br />
Methode: Photometrie<br />
ITC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Demoxepam (W)(N)<br />
Probenmaterial: 1 ml Serum<br />
Methode: LC-MS/MS<br />
Referenzbereiche: 5 – 50 µg/l<br />
toxisch: > 100 µg/l<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 219
Desmethylclozapin (W)<br />
Dengue-Virus-Antikörper (U)<br />
Synonyme: 7-Tage-Fieber, Pokalfieber<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 3-6 Tage<br />
Klinische Indikationen: Verdacht auf Dengue-Fieber (klassisches Dengue-Fieber, Denguehämorrhagisches<br />
Fieber) bei entsprechender Reiseanamnese (Südostasien, Karibik, Südamerika, Australien)<br />
sowie insbesondere bei Fieber, Gelenk- <strong>und</strong> Muskelschmerzen, flüchtiges Exanthem, retrobulbäre<br />
Schmerzen<br />
Methode: EIT<br />
Referenzbereiche: negativ (< 0,9)<br />
Desethylamiodaron im Serum<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Bitte keine Gelröhrchen für die<br />
Blutentnahme verwenden.<br />
Bestimmung des max. Spiegels: ca. 5-7 St<strong>und</strong>en nach Medikamenteneinnahme<br />
Bestimmung des Talspiegels: vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Erfassung des aktiven Metaboliten beim Monitoring der Amiodaron-<br />
Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 0,4 – 1,5 mg/l<br />
Desipramin<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Desipramin-Therapie, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: 30 – 300 µg/l<br />
Desmethylclobazam (W)<br />
Synonyme: Norclobazam<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Clobazam-Therapie, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: 1000 – 4000 ng/ml<br />
Desmethylclozapin (W)<br />
Synonyme: Norclozapin<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Clozapin-Therapie, Missbrauchskontrolle<br />
Methode: LC-MS/MS<br />
Referenzbereiche: 100 – 300 µg/l<br />
220 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Desmethyldiazepam (W)<br />
Desmethyldiazepam (W)<br />
Synonyme: Nordiazepam<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme unmittelbar vor erneuter Medikamenteneinnahme<br />
Klinische Indikationen: Therapiekontrolle/Monitoring bei Gabe von Clorazepam, Diazepam,<br />
Medazepam oder Prazepam, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: 600 – 1500 ng/ml<br />
Desmethylmethsuximid (U)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer entsprechenden Antikonvulsiva-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 10 – 40 mg/l<br />
toxisch > 60 mg/l<br />
Desoxypyridinolin im Urin (W)(N)<br />
Synonyme: DPD-Crosslinks<br />
Probenmaterial: 10 ml Spontan- oder Morgenurin<br />
Abnahmehinweise: Wegen der ausgeprägten Tagesrhythmik Urin bis 9.00 Uhr abnehmen; Urin direkt<br />
nach der Abnahme gekühlt (ca. + 2°C – + 8 °C) <strong>und</strong> lichtgeschützt (Röhrchen mit Alufolie umwickeln)<br />
lagern.<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle, Therapiemonitoring bei erhöhter Knochenresorption<br />
(Osteoporose)<br />
Methode: HPLC<br />
Referenzbereiche: 3 – 14 Jahre: 50 – 100 µmol/m.K.<br />
> 14 Jahre: 5 – 15 µmol/m.K.<br />
DHEA (W)<br />
Synonyme: Dehydroandrosteron<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: aufgr<strong>und</strong> der geringeren Stabilität sollte besser DHEAS bestimmt werden.<br />
Klinische Indikationen: Hirsutismus / Virilisierung bei der Frau,<br />
Verdacht auf androgen-bedingte Ovariainsuffizienz,<br />
NNR-Tumoren, Adrenogenitales Syndrom<br />
Methode: RIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
DHEAS<br />
Synonyme: Dehydroepiandrosteron-Sulfat<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Hirsutismus / Virilisierung bei der Frau, Verdacht auf androgen-bedingte<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 221
Dibucain-Zahl (U)<br />
Ovariainsuffizienz, NNR-Tumoren, Adrenogenitales Syndrom<br />
Methode: CLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Diaminooxidase (W)<br />
Synonyme: DAO<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Eine Bestimmung der DAO-Aktivität in Serum oder Plasma ist ein<br />
geeigneter Marker für die Diagnostik der Histamin-Intoleranz <strong>und</strong> damit assoziierter Krankheitsbilder.<br />
Methode: REA<br />
Referenzbereiche: > 10 U/ml<br />
Diaphorase in Erythrozyten (U)(N)<br />
Synonyme: Met-Hb-Reduktase<br />
Probenmaterial: 2 ml EDTA-Blut<br />
Abnahmehinweise: Blut nach der Abnahme kühl (+ 2°C – + 8°C) lagern, NICHT einfrieren<br />
Klinische Indikationen: Weitere Diagnostik bei Met-Hämoglobinurie (Met-Hb > 10%)<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Diazepam (W)<br />
Synonyme: Benzodiazepine<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme unmittelbar vor erneuter Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Diazepam-Therapie, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: 200 – 1000 ng/ml<br />
toxisch ab 1500 ng/ml<br />
Dibenzepin (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Dibenzepin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 25 – 250 µg/l<br />
Dibucain-Zahl (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Abklärung einer verlängerten Apnoe im Rahmen einer Narkose bei Verabreichung<br />
von Succinylcholin oder Mivacurium zur Muskelrelaxation<br />
Familienuntersuchung bei Patienten mit atypischen Cholinesterase-Verianten<br />
Methode: Photometrie<br />
Referenzbereiche: normal: > 70 %<br />
222 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
intermediär: 30 – 70%<br />
atypisch: < 30 %<br />
Dichlormethan im Blut (U)<br />
Probenmaterial: 2 ml Blut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Bitte Rollrändröhrchen anfordern.<br />
Klinische Indikationen: Verdacht auf Intoxikation (akute bzw. chronische Vergiftung)<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Didanosin (W)<br />
Dichlormethan im Blut (U)<br />
Synonyme: Handelsname: Vidox ®<br />
Probenmaterial: 1 ml Serum oder 1 ml EDTA-Plasma, tiefgefroren<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer antiretroviralen Therapie bei Patienten mit einer HIV-<br />
Infektion<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Diethylenglykol (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Beurteilung einer Diethylenglykol-Belastung, Intoxikation<br />
Methode: GC<br />
Referenzbereiche: < 5 mg/l<br />
Differentialblutbild<br />
Probenmaterial: 1 ml EDTA-Blut<br />
Abnahmehinweise: EDTA-Monovette direkt nach der Abnahme durch Schwenken gründlich mischen<br />
Klinische Indikationen: Leukozytose, Leukozytopenie, Infektionen, Intoxikationen, Malignome,<br />
Leukämien <strong>und</strong> andere hämatologische Systemerkrankungen, Therapiekontrolle<br />
Methode: FC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Digitoxin<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme ca. 8-24 St<strong>und</strong>en nach der letzten Einnahme<br />
Klinische Indikationen: Verlaufskontrolle <strong>und</strong> -beurteilung einer Therapie mit Digitoxin<br />
Methode: ECLIA<br />
Referenzbereiche: 10 – 25 ng/ml<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 223
Direkter Coombstest<br />
Digoxin<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme ca. 8-24 St<strong>und</strong>en nach der letzten Einnahme<br />
Klinische Indikationen: Verlaufskontrolle <strong>und</strong> -beurteilung einer Therapie mit Digoxin<br />
Methode: ECLIA<br />
Referenzbereiche: 0,8 – 2 ng/ml<br />
Dihydrotestosteron im Serum (W)<br />
Synonyme: DHT<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Hodenfunktionsstörungen, Androgenmangel, Kontrolle der Testosteronsubstitution<br />
Methode: RIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Diphenhydramin (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Diphenhydramin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 30 – 300 ng/ml<br />
Diphtherie Toxoid-Antikörper im Serum<br />
Synonyme: Diphtherie-Antitoxin<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Untersuchung ist NUR zur Überprüfung der Immunitätslage geeignet.<br />
Klinische Indikationen: Überprüfung der Immunitätslage nach Diphtherie-Impfung.<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Direkter Coombstest<br />
Synonyme: Blutgruppenbestimmung, AHG-Test<br />
Probenmaterial: 9 ml EDTA-Blut<br />
Abnahmehinweise: Für die Blutguppen-Serologie ist eine NUR für diesen Zweck bestimmte Blutprobe<br />
(separate Monovette) erforderlich. Auf eine eindeutige Kennzeichnung (z.B. mit Namen, Vornamen<br />
<strong>und</strong> Geburtsdatum) ist zu achten.<br />
Klinische Indikationen: Abklärung von Tranfusionsreaktionen (akute, verzögerte hämolytische<br />
Reaktionen), Autoimmunhämolysen, Morbus haemolyticus neonatorum, Medikamenten-induzierte<br />
Immunhämolysen<br />
Methode: Agglutination<br />
Referenzbereiche: negativ<br />
224 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Disopyramid (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Disopyramid-Therapie<br />
Methode: LC/MS<br />
Referenzbereiche: 2 – 5 mg/l<br />
Donepezil (U)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise:<br />
Klinische Indikationen: Monitoring einer Therapie mit Donepezil<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Dopamin im Urin<br />
Disopyramid (W)<br />
Synonyme: Katecholamine<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
(gesammelt über 10 ml Salzsäure)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Medikamente, sofern möglich, ca. 1 Woche vorher absetzen;<br />
ab ca. 3 Tage vorher Vermeiden von Kaffee, Tee, Nikotin, Bananen, Käse, Nüsse, Schokolade, Eier<br />
Klinische Indikationen: Tumoren des sympatho-adrenergen Systems, Neuroblastome, episodenhafte<br />
oder therapieresistente Hypertonie, Inzidentalom, Familienuntersuchung<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Doxepin<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Monitoring einer Doxepin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: Doxepin: 50 – 250 µg/l<br />
Nordoxepin: < 300 µg/l<br />
Doxycyclin (U)<br />
Synonyme: Doxicyclin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Doxycyclin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 1 – 5 µg/ml<br />
Doxylamin (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Doxylamin-Therapie<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 225
Duloxetin (W)<br />
Methode: HPLC<br />
Referenzbereiche: 50 – 200 ng/ml<br />
<strong>Dr</strong>ogen-Nachweis im Haar (U)<br />
Probenmaterial: 1 g Haar (bleistiftdicker Haarstrang, ca. 6 cm lang)<br />
Abnahmehinweise: ca. 1 cm Haar ab Kopfhaut entspricht einem Wachstum von ca. 1 Monat<br />
Klinische Indikationen: Nachweis des Gebrauchs einer der erfassten Wirkstoffe<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
<strong>Dr</strong>ogen-Screening im Serum (N)<br />
Probenmaterial: 5 ml Serum<br />
Klinische Indikationen: Suchtest zum Nachweis des Gebrauchs einer der aufgeführten Substanzen<br />
Methode: CMIA<br />
Referenzbereiche: negativ<br />
<strong>Dr</strong>ogen-Screening im Urin<br />
Probenmaterial: 10 ml Urin<br />
Abnahmehinweise: ggf. Probennahme überwachen<br />
Klinische Indikationen: Suchteste zum Nachweis des Gebrauchs einer der untersuchten Substanzgruppen.<br />
Methode: CMIA<br />
Referenzbereiche: negativ<br />
<strong>Dr</strong>onedaron (W)<br />
Synonyme: Handelsname: Multaq ®<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme 3-6 St<strong>und</strong>en nach Einnahme<br />
Methode: LC-MS/MS<br />
Referenzbereiche: 80 – 150 µg/l<br />
Duloxetin (W)<br />
Synonyme: Cymbalta ®<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bitte beachten Sie, dass bei Verwendung von gelhaltigen Röhrchen die Resultate<br />
niedriger ausfallen können. Wir empfehlen, das Blut 30 min nach Abnahme zu zentrifugieren, das<br />
Serum abzutrennen <strong>und</strong> in ein zweites Neutral-Röhrchen zu überführen.<br />
Klinische Indikationen: Therapiekontrolle bzw. Monitoring einer Duloxetin-Therapie.<br />
Methode: LC-MS/MS<br />
Referenzbereiche: 20 – 80 µg/l<br />
226 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Echinokokken-Serologie (U)<br />
Echinokokken-Serologie (U)<br />
Synonyme: H<strong>und</strong>e-/Fuchsbandwurm<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Verdacht auf Echinokokkose bei Zysten in Leber <strong>und</strong> Lunge, selten im<br />
Gehirn.<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
ECHO-Virus-Antikörper (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 3-6 (-35) Tage.<br />
Klinische Indikationen: Verdacht auf ECHO-Virus-Infektion bei: Exanthem, Meningitis, Myokarditis,<br />
Fazialisparese, Gastroenteritis, Myalgien<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
ECP (W)<br />
Synonyme: Eosinophiles kationisches Protein<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blut 1 St<strong>und</strong>e bei Raumtemperatur gerinnen lassen, dann zentrifugieren <strong>und</strong><br />
Serum einsenden.<br />
Klinische Indikationen: Verdacht auf allergische Diathese im allergenfreien Intervall, besonders<br />
wenn → IgE im Serum (gesamt), Seite 275 nicht erhöht ist;<br />
Verlaufskontrolle von Allergien (Typ I)<br />
Methode: FEIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Ehrlichien-Antikörper (IgG) (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 7 (1 – 21) Tage.<br />
Klinische Indikationen: Verdacht auf HGE (humane granuozytäre Ehrlichiose) bzw. HME (humane<br />
monozytäre Ehrlichiose), insbesondere nach Zeckenstich (ohne Erythema migrans) mit Kopfschmerzen,<br />
Muskelschmerzen, Übelkeit, Leukozytopenie, Thrombozytopenie sowie Transaminasenerhöhung<br />
im Serum<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Ehrlichien-Antikörper (IgM) (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 7 (1 – 21) Tage.<br />
Klinische Indikationen: Verdacht auf HGE (humane granuozytäre Ehrlichiose) bzw. HME (humane<br />
monozytäre Ehrlichiose), insbesondere nach Zeckenstich (ohne Erythema migrans) mit Kopfschmerzen,<br />
Muskelschmerzen, Übelkeit, Leukozytopenie, Thrombozytopenie sowie Transaminasenerhöhung<br />
im Serum<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 227
Eiweiß (gesamt) im Serum<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Eisen im Serum<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Da bereits eine Mikrohämolyse den Messwert für Eisen beeinflussen kann, sollte<br />
das Vollblut innerhalb von 30 Minuten nach der Blutentnahme zentrifugiert <strong>und</strong> nur das Serum<br />
(hämolysefrei) eingeschickt werden<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Therapiekontrolle bei Eisenmangel <strong>und</strong> Eisenüberladung,<br />
Prüfung der Eisenresorption<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Eisen im Urin (Eisenstoffwechsel) (U)<br />
Probenmaterial: 5 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Die Untersuchung ist für die Beurteilung des Eisenstoffwechsels nicht<br />
geeignet.<br />
Methode: AAS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Eiweiß (gesamt) im Liquor<br />
Synonyme: Gesamteiweiß im Liquor<br />
Probenmaterial: 1 ml Liquor<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle von akuten/chronischen ZNS-<br />
Erkrankungen.<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Eiweiß (gesamt) im Serum<br />
Synonyme: Gesamteiweiß im Serum<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bei der Blutentnahme sind langer Venenstau <strong>und</strong> Hämolyse zu vermeiden<br />
Klinische Indikationen: Suchtest zur weiteren Abklärung folgender Symptome, Zustände oder<br />
Erkrankungen: Erhöhte Blutsenkungsreaktion, Proteinurie, Ödeme, Polyurie, chronische Nierenerkrankungen,<br />
Lebererkrankungen, chronische Durchfälle, maligner Tumor, Infektanfälligkeit,<br />
Knochenschmerz, unbestimmt lokalisierbarer Rheumatismus, Lymphome, äußere <strong>und</strong> innere Blutungen,<br />
Schwangerschaft, prä-<strong>und</strong> postoperativ, schweres Trauma, Schockzustand, Verbrennungen, Unterernährung<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
228 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Eiweiß (gesamt, quantitativ) im Punktat (N)<br />
Probenmaterial: 5 ml Punktat<br />
Klinische Indikationen: Differenzierung zwischen Exsudat <strong>und</strong> Transsudat<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Eiweiß (gesamt, quantitativ) im Urin<br />
Eiweiß (gesamt, quantitativ) im Punktat (N)<br />
Probenmaterial: 5 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze) oder<br />
5 ml Spontanurin<br />
Abnahmehinweise: Bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Der 2. Morgenurin ist dem 24-St<strong>und</strong>en-Sammelurin gleichwertig, wenn zuvor keine besondere<br />
körperliche Belastung stattgef<strong>und</strong>en hat bzw. keine polyurische Nierenerkrankung besteht.<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von Nierenerkrankungen mit einer<br />
erhöhten Proteinausscheidung,<br />
Nachuntersuchung eines positiven Screeningtestes (Urin-Teststreifen)<br />
Methode: Photometrie<br />
Referenzbereiche: Sammelurin: < 0,3 g/24 St<strong>und</strong>en<br />
Spontanurin: < 0,15 g/l<br />
Eiweiß im Dialysat (N)<br />
Probenmaterial: 2 ml Dialysat<br />
Klinische Indikationen: Qualitätskontrolle von Dialysat<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Eiweißelektrophorese im Serum<br />
Synonyme: Serum-Elektrophorese<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlauf von:<br />
Monoklonaler Gammopathie<br />
Akuten <strong>und</strong> chronischen Entzündungsreaktionen,<br />
Malignen Tumoren,<br />
Lebererkrankungen<br />
Proteinverlust (z.B. Nephrotisches Syndrom),<br />
Antikörpermangel,<br />
Eiweißmangelernährung,<br />
Pathologischer Ausfall von z.B. → BSG, Seite 196, → Eiweiß (gesamt) im Serum, Seite 228<br />
Methode: Elektrophorese<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Elektrolyte im Serum<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Proben-<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 229
Enteroviren-Nachweis (W)<br />
transport abzentrifugiert werden.<br />
Methode: ISE<br />
Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Entamoeba histolytica-Antikörper (U)<br />
Synonyme: Amöben-Antikörper<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster kann bis zu einem Jahr betragen<br />
Klinische Indikationen: Verdacht auf Amöbeninfektion, insbesondere bei entsprechender Anamnese<br />
sowie gastrointestinalen Beschwerden, Diarrhoe (himbeergeleeartig), Koliken, Obstipation, Leberabszess,<br />
Lungenbeteiligung<br />
Methode: IHA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Enterohämorrhagischer E.coli im Stuhl<br />
Synonyme: EHEC, Enteritis, HUS<br />
Probenmaterial: 2 g Stuhl<br />
Klinische Indikationen: Verdacht auf EHEC-Infektion, inbesondere bei Verdacht auf HUS<br />
(hämolytisch-urämisches Syndrom) <strong>und</strong> bei blutig-schleimiger Enterokolitis im Kleinkindalter<br />
Methode: EIA<br />
PCR<br />
Referenzbereiche: negativ<br />
Enteroviren-Antikörper<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca 3 – 6 (2 – 35 Tage)<br />
Klinische Indikationen: Verdacht auf Enteroviren-Infektion bei unspezfischer fieberhafter<br />
Erkrankung der oberen Luftwege mit Kopf- <strong>und</strong> Muskelschmerzen, Pharyngitis, Tonsilitis, Laryngitis,<br />
Lymphadenopathie <strong>und</strong> Bronchitis, Gastroenterale Beschwerden mit Brechdurchfall, Myokarditis.<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Enteroviren-Nachweis (W)<br />
Probenmaterial: je nach Indikation:<br />
3 ml EDTA-Blut<br />
1 ml Liquor<br />
Biopsie<br />
Nasopharyngealabstrich<br />
Klinische Indikationen: seröse Meningitis, unklare Peri-, Myokarditis, akute/chronische Kardiomyopatie,<br />
Enteritis<br />
Methode: RT-PCR<br />
Referenzbereiche: negativ<br />
230 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Epstein-Barr-Virus-Antikörper (Liquor/Serum)<br />
Epstein-Barr-Virus-Antikörper (Liquor/Serum)<br />
Synonyme: EBV-AI<br />
Probenmaterial: 1 ml Liquor <strong>und</strong><br />
1 ml Serum<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum immer gleichzeitig abnehmen.<br />
Bei akuten ZNS-Erkrankungen beträgt das diagnostische Fenster für den intrathekalen IgG-Nachweis<br />
ca. 7-14 Tage.<br />
Klinische Indikationen: Nachweis einer intrathekalen Antikörper-Synthese gegen Epstein-Barr-<br />
Virus bei akuten <strong>und</strong> auch chronischen ZNS-Erkrankungen.<br />
Methode: EIA<br />
Referenzbereiche: negativ (0,6 – 1,5 Index)<br />
Epstein-Barr-Virus-DNA-Nachweis<br />
Synonyme: EBV-PCR<br />
Probenmaterial: je nach Indikation:<br />
3 ml EDTA-Blut<br />
1 ml Liquor<br />
Trockenabstrich<br />
Biopsie<br />
Klinische Indikationen: Nachweis von EBV-DNA bei Verdacht auf Reaktivierung einer EBV-<br />
Primärinfektion (z.B. bei schwerer Immunsuppression)<br />
Methode: PCR<br />
qualitativ<br />
quantitativ<br />
Referenzbereiche: negativ<br />
Epstein-Barr-Virus-Serologie<br />
Synonyme: EBV, Pfeiffersches <strong>Dr</strong>üsenfieber<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt zwischen 7-10 Tagen <strong>und</strong> 4-7 Wochen<br />
Klinische Indikationen: Abklärung bei Fieberhafter Infekt mit Angina oder katarrhalischer Pharyngitis,<br />
Lymphadenitis, Hepatitis, seltener Exanthem, selten bei Nasopharyngealkarzinom<br />
Reaktivierungen kommen vor bei Immunsuppression.<br />
Methode: CLIA<br />
Immunoblot<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Erythropoietin (W)<br />
Synonyme: EPO<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Wegen tageszeitlicher Schwankungen Blutentnahme morgens (08.00 Uhr – 10.00<br />
Uhr)<br />
Klinische Indikationen: Unklare normozytäre Anämie, Verdacht auf renale Anämie, Therapiemonitoring<br />
einer EPO-Behandlung<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 231
Ethylbenzol im Blut (U)(N)<br />
Methode: CLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Escitalopram (U)<br />
Synonyme: Handelsname: Cipralex ®<br />
Probenmaterial: 1 ml Serum<br />
Methode: LC-MS/MS<br />
Referenzbereiche: 15 – 80 ng/ml<br />
Ethambutol (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutabnahme ca. 2 – 4 St<strong>und</strong>en nach oraler Gabe von 20 mg Ethambutol/kg<br />
Körpergewicht<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Ethambutol-Therapie<br />
Methode: LC/MS-MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Ethanol im Blut<br />
Synonyme: Alkohol im Blut<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Alkohol-Desinfektion bei der Blutentnahme kann die Bestimmung stören (zu<br />
hoher Messwert), fest verschlossenes System für Entnahme <strong>und</strong> Transport verwenden, Monovette<br />
vollständig füllen<br />
Klinische Indikationen: Feststellung der Alkoholkonzentration für medizinische Zwecke (Keine<br />
forensische Validität!), Überwachung des Alkoholentzugs oder einer Ethanol-Therapie<br />
Methode: Spektralphotometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Ethosuximid<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring der Ethosuximid-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 30 – 100 µg/ml<br />
Ethylbenzol im Blut (U)(N)<br />
Probenmaterial: 2 ml EDTA-Blut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Bitte Rollrändröhrchen anfordern.<br />
Klinische Indikationen: Kontrolle der Belastung mit aromatischen Kohlenwasserstoffen am Arbeitsplatz,<br />
Vergiftungsausschluss<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
232 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Ethylenglykol (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Beurteilung einer Ethylenglykol-Belastung, Intoxikation<br />
Methode: GC<br />
Referenzbereiche: toxisch: > 200 mg/l<br />
Ethylglucuronid im Urin (W)<br />
Ethylenglykol (U)<br />
Probenmaterial: 10 ml Urin<br />
Abnahmehinweise: Unser Partnerlabor ist nach DIN EN ISO / IEC 17025 für die<br />
Betäubungsmittelanalytik im Rahmen der Fahreignungsdiagnostik forensisch akkreditiert <strong>und</strong> erfüllt<br />
somit die Vorgaben der GTFCh (Gesellschaft für Toxikologie <strong>und</strong> Forensische Chemie).<br />
Klinische Indikationen: Mittelfristiger Nachweis von Alkoholkonsum<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Everolimus (W)<br />
Synonyme: Certican ®<br />
Probenmaterial: 1 ml EDTA-Blut<br />
Abnahmehinweise: Das Blut bitte unmittelbar nach der Abnahme einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Monitoring/Überwachung einer Everolimus-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Faktor II-Aktivität (U)<br />
Probenmaterial: korrekt gefüllte Citratblut-Monovette<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Verdacht auf Faktor II-Mangel (z.B. bei Leberfunktionsstörungen, Vitamin<br />
K-Mangel, pathologischem Ausfall von Quick bzw. aPTT),<br />
Thrombophilie-Diagnostik<br />
Methode: Einphasengerinnungstest<br />
Referenzbereiche: Kinder: s. Bef<strong>und</strong>bericht<br />
Erwachsene: 70 – 130 %<br />
Faktor II-Gen-Mutation<br />
Synonyme: Prothrombin-Gen-Mutation, Thrombophilie<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32011 (Thrombophilie)<br />
Klinische Indikationen: Thrombophilie-Diagnostik bei – positiver Familienanamnese – rezidivierenden<br />
Thrombosen – gleichzeitiger Hormontherapie – erhöhter Faktor II-Aktivität – rezidivierenden<br />
Aborten<br />
Methode: PCR <strong>und</strong> Schmelzkurvenanalyse<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 233
Faktor VII-Aktivität (U)<br />
Faktor IX-Aktivität (U)<br />
Synonyme: Gerinnung<br />
Probenmaterial: korrekt gefüllte Citratblut-Monovette<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Abklärung einer verlängerten aPTT,<br />
Verdacht auf Hämophilie B,<br />
Verlaufskontrolle unter Substitutionstherapie,<br />
Verdacht auf erworbenen Faktor IX-Mangel (z.B. bei Leberfunktionsstörungen, Vitamin K-Mangel,<br />
sehr selten Inhibitoren)<br />
Methode: Einphasengerinnungstest<br />
Referenzbereiche: Kinder: s. Bef<strong>und</strong>bericht<br />
Erwachsene: 65 – 150 %<br />
Faktor V-Aktivität (U)<br />
Synonyme: Gerinnung<br />
Probenmaterial: korrekt gefüllte Citratblut-Monovette<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Verdacht auf Faktor V-Mangel,<br />
Abklärung eines pathologischen Suchtests (Quick, aPTT)<br />
Methode: Einphasengerinnungstest<br />
Referenzbereiche: Kinder: s. Bef<strong>und</strong>bericht<br />
Erwachsene: 60 – 140 %<br />
Faktor V-Gen-Mutation<br />
Synonyme: Leiden-Mutation, Thrombophilie<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32011 (Thrombophilie)<br />
Klinische Indikationen: Thrombophilie-Diagnostik bei<br />
- pathologischer APC-Resistenz<br />
- positiver Familienanamnese<br />
- rezidivierenden Thrombosen<br />
- Thrombosen bei jungen Patienten (< 45 Jahre)<br />
- gleichzeitiger Hormontherapie<br />
- rezidivierenden Aborten<br />
Methode: PCR <strong>und</strong> Schmelzkurvenanalyse<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Faktor VII-Aktivität (U)<br />
Probenmaterial: korrekt gefüllte Citratblut-Monovette<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Verdacht auf einen Faktor VII-Mangel,<br />
Abklärung pathologischer Suchteste (Quick, aPTT),<br />
Leberfunktionsstörungen,<br />
234 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Vitamin K-Mangel<br />
Methode: Einphasengerinnungstest<br />
Referenzbereiche: Kinder: s. Bef<strong>und</strong>bericht<br />
Erwachsene: 52 – 120 %<br />
Faktor VIII-Aktivität<br />
Synonyme: Faktor VIII:C<br />
Probenmaterial: korrekt gefüllte Citratblut-Monovette<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Abklärung einer verlängerten aPTT,<br />
Verdacht auf Hämophilie A,<br />
Thrombophilie-Diagnostik,<br />
Hemmkörper-Diagnostik,<br />
von-Willebrand-Syndrom,<br />
Verlaufskontrolle unter Subsitutionstherapie<br />
Methode: Koagulometrie<br />
Referenzbereiche: 50 – 150 %<br />
Faktor X-Aktivität (U)<br />
Probenmaterial: korrekt gefüllte Citratblut-Monovette<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Unklare Blutungsneigung nach Ausschluss anderer Ursachen,<br />
Leberfunktionsstörungen,<br />
Abklärung eines vermindertes Quickwertes,<br />
Vitamin K-Mangel,<br />
Amyloidose<br />
Methode: Einphasengerinnungstest<br />
Referenzbereiche: Kinder: s. Bef<strong>und</strong>bericht<br />
Erwachsene: 70 – 140 %<br />
Faktor XI-Aktivität (U)<br />
Faktor VIII-Aktivität<br />
Probenmaterial: korrekt gefüllte Citratblut-Monovette<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Klärung einer Blutungsneigung bzw. einer Verlängerung der aPTT nach<br />
Ausschluss anderer häufiger Ursachen<br />
Methode: Einphasengerinnungstest<br />
Referenzbereiche: Kinder: s. Bef<strong>und</strong>bericht<br />
Erwachsene: 65 – 130 %<br />
Faktor XII-Aktivität (U)<br />
Probenmaterial: korrekt gefüllte Citratblut-Monovette<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Unklare aPTT-Verlängerung<br />
Methode: Einphasengerinnungstest<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 235
Felbamat (U)<br />
Referenzbereiche: Kinder: s. Bef<strong>und</strong>bericht<br />
Erwachsene: 50 – 150 %<br />
Faktor XIII-Aktivität (U)<br />
Probenmaterial: korrekt gefüllte Citratblut-Monovette<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Unklare postoperative Blutung,<br />
W<strong>und</strong>heilungsstörung mit Narbenbildung<br />
Methode: kinetisch<br />
Referenzbereiche: 70 – 140 %<br />
Familiäres Mittelmeerfieber (U)<br />
Synonyme: MEFV, FMF<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Stufendiagnostik<br />
Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Verdacht auf FMF bei rezidivierenden Fieberschüben ohne Baktierennachweis,<br />
peritonitischen Bauchbescherden, akuter Serositis, meist einseitige Pleuritis, Arthralgien,<br />
Sacroileitis, bei Frauen Menstruationsabhängigkeit, selten auch Myositis, Perikarditis, Vaskulitis mit<br />
spontaner Rückbildung nach wenigen Tagen bei Personen mit Herkunft aus dem Mittelmeerraum (vorwiegend<br />
in Familien armenischen, jüdischen oder arabischen Ursprungs)<br />
Methode: PCR <strong>und</strong> Sequenzierung aller 10 Exons des<br />
Marenostrin-Gens<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Fasciolosis-Antikörper (U)<br />
Synonyme: Großer Leberegel<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Verdacht auf Infektion mit Fasciola hepatica (großer Leberegel) bei unklarer<br />
chronischer Cholangitis, Cholestase, Ikterus, nach Aufenthalt in (sub-)tropischen Ländern<br />
Methode: Indirekter Haemagglutinationstest<br />
Referenzbereiche: < 1 : 160 Titer<br />
Felbamat (U)<br />
Synonyme: Handelsname: Taloxa ®<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Methode: HPLC<br />
Referenzbereiche: therap. Bereich: 30 – 60 mg/l<br />
236 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Ferritin<br />
Ferritin<br />
Probenmaterial: 1 ml Serum oder<br />
1 ml Liquor<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle von Eisenstoffwechselerkrankungen<br />
(Eisenmangel, Eisenüberladung, Hämochromatose)<br />
Methode: Immunturbidimetrie<br />
Referenzbereiche: Frauen<br />
praemenopausal: 15 – 150 ng/ml<br />
postmenopausal: 30 – 400 ng/ml<br />
Männer: 30 – 400 ng/ml<br />
Kinder: s. Bef<strong>und</strong>bericht<br />
Liquor: < 15 ng/ml<br />
Fetale Erythrozyten (U)<br />
Synonyme: HbF-Zellen<br />
Probenmaterial: 4 ml EDTA-Blut<br />
Klinische Indikationen: Nachweis fetaler Erythrozyten im mütterlichen Blut bei<br />
- vaginalen Blutungen in der Gravidität<br />
- Diagnose/Kontrolle fetomaternaler Transfusion<br />
Methode: Mikroskopie<br />
Referenzbereiche: < 0,1 Promille<br />
Fette im Stuhl (W)<br />
Synonyme: Stuhlfette<br />
Probenmaterial: 1 g Stuhl<br />
Klinische Indikationen: Verdacht auf Malabsorption <strong>und</strong> Maldigestion, Störungen der exokrinen<br />
Pankreasfunktions<br />
Methode: Photometrie<br />
Referenzbereiche: < 2 Gew.-%<br />
Fettsäuren, langkettige (C14-C20) (U)<br />
Synonyme: LCFA = long chain fatty acids<br />
Probenmaterial: 3 ml Serum<br />
Klinische Indikationen: Verdacht auf Störung in der Verstoffwechselung von Fettsäuren (Mitochondropathien)<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Fettsäuren, sehr langkettige (C22-C26) (U)<br />
Synonyme: VLCFA = very long chain fatty acids<br />
Probenmaterial: 3 ml Serum<br />
Klinische Indikationen: Verdacht auf Zellweger-Syndrom, Adrenoleukodystrophie (X-ALD)<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 237
Fibronectin (W)<br />
Fetuin (alpha2-HS-Glykoprotein, Calcium-bindendes Glykoprotein) (W)<br />
Synonyme: Alpha2-Heremans-Schmid-Glycoprotein<br />
Probenmaterial: 2 ml Serum oder 2 ml EDTA-Plasma, tiefgefroren<br />
Klinische Indikationen: Evaluierung des kardiovaskulären Risikos, insbesondere bei Dialysepatienten<br />
sowie Abklärung extraossärer Verkalkungen<br />
Methode: ELISA<br />
Referenzbereiche: 0,2 – 0,77 g/l<br />
FGF-23, C-terminal (W)<br />
Synonyme: Fibroblast growth factor 23<br />
Probenmaterial: 1 ml EDTA-Plasma<br />
Abnahmehinweise: Bitte das EDTA-Blut unmittelbar nach der Abnahme zentrifugieren, das Plasma<br />
in ein separates Röhrchen pipettieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
Klinische Indikationen: tumorinduzierte Osteomalazie<br />
X-chromosomale Hypophosphatämie<br />
autosomal dominante Hypophosphatämie<br />
(beide Formen als Vitamin-D-resistente Rachitis bezeichnet)<br />
Methode: ELISA<br />
Referenzbereiche: 26 – 110 kRU/l<br />
Fibrinogen<br />
Synonyme: Fibrinogen funktionell<br />
Probenmaterial: korrekt gefüllte Citratblut-Monovette<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: DIC (Verbrauchskoagulopathie),<br />
Diagnostik der Hyperfibrinolyse,<br />
Differenzierung zwischen Hypo-/Dysfibrinogenämie,<br />
Verdünnungskoagulopathie<br />
Methode: Photometrie<br />
Referenzbereiche: 238 – 498 mg/dl<br />
Fibrinspaltprodukte<br />
Probenmaterial: korrekt gefüllte Citratblut-Monovette<br />
Methode: Immunoassay<br />
Referenzbereiche: < 500 ng/ml<br />
Fibronectin (W)<br />
Probenmaterial: 2 ml EDTA-Plasma<br />
Abnahmehinweise: EDTA-Blut unmittelbar nach der Abnahme zentrifugieren, das Plasma in ein separates<br />
Röhrchen (ohne Zusätze) abpipettieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Für die Bestimmung von Fibronectin im Plasma gibt es derzeit keine<br />
gesicherte Indikation<br />
Methode: Nephelometrie<br />
Referenzbereiche: 25 – 40 mg/dl<br />
238 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Fibronectin im Aszites (W)<br />
Probenmaterial: 2 ml Aszites<br />
Klinische Indikationen: Differenzierung zwischen benignem <strong>und</strong> malignem Aszites<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
FK 506<br />
Fibronectin im Aszites (W)<br />
Synonyme: Tacrolimus, Prograf<br />
Probenmaterial: 2 ml EDTA-Blut<br />
Abnahmehinweise:<br />
Klinische Indikationen: Therapiekontrolle der Immunsuppression nach Organtransplantation<br />
Methode: CMIA<br />
Referenzbereiche: 4 – 20 ng/ml<br />
Flecainid (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Flecainid-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Fluconazol (U)(N)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Fluconazol-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 0,5 – 50,0 µg/l<br />
Flucytosin (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Flucytosin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Flunitrazepam (W)<br />
Probenmaterial: 2 ml Serum<br />
20 ml Urin<br />
20 ml Magensaft<br />
Abnahmehinweise: Blutentnahme unmittelbar vor erneuter Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Flunitrazepam-Therapie, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 239
Flupentixol (W)<br />
Fluorid im Serum (W)<br />
Probenmaterial: 3 ml Serum<br />
Klinische Indikationen: Verdacht auf Überdosierung, Intoxikation in der Aluminium-, Glas- <strong>und</strong><br />
Metallindustrie<br />
Methode: ISE<br />
Referenzbereiche: < 30 ng/ml<br />
Fluorid im Urin (W)<br />
Probenmaterial: 20 ml Urin<br />
Klinische Indikationen: Diagnostik der Fluorwasserstoff- <strong>und</strong> Fluorid-Belastung bei beruflich Exponierten<br />
<strong>und</strong> bei Fluorid-Medikation<br />
Methode: ISE<br />
Referenzbereiche: < 2 mg/g Krea<br />
Fluorid-Zahl (U)(N)<br />
Synonyme: Atypische Cholinesterasen<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden.<br />
Klinische Indikationen: Abklärung einer verlängerten Apnoe im Rahmen einer Narkose bei Verabreichung<br />
von Succinylcholin oder Mivacurium zur Muskelrelaxation<br />
Familienuntersuchung bei Patienten mit atypischen Cholinesterase-Verianten<br />
Methode: Photometrie<br />
Referenzbereiche: > 55 %<br />
Fluoxetin (W)<br />
Synonyme: Norfluoxetin<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Fluoxetin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: Fluoxetin: 100 – 500 µg/l<br />
Norfluoxetin: 150 – 500 µg/l<br />
Flupentixol (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Bitte beachten Sie, dass bei Verwendung von gelhaltigen Röhrchen die Resultate<br />
niedriger ausfallen können. Wir empfehlen, das Blut 30 min nach Abnahme zu zentrifugieren, das<br />
Serum abzutrennen <strong>und</strong> in ein zweites Neutral-Röhrchen zu überführen.<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Flupentixol-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: 1 – 15 µg/l<br />
240 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Fluphenacin (W)<br />
Fluphenacin (W)<br />
Probenmaterial: 5 ml Serum<br />
Abnahmehinweise: Probe lichtgeschützt aufbewahren.<br />
Bitte beachten Sie, dass bei Verwendung von gelhaltigen Röhrchen die Resultate niedriger ausfallen<br />
können. Wir empfehlen, das Blut 30 min nach Abnahme zu zentrifugieren, das Serum abzutrennen<br />
<strong>und</strong> in ein zweites Neutral-Röhrchen zu überführen.<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Fluphenazin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: 1 – 10 µg/l<br />
Toxischer Bereich: > 50 µg/l<br />
Flurazepam (W)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Flurazepam-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 2,0 – 20,0 ng/ml<br />
Fluvoxamin (W)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Fluvoxamin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 30 – 300 ng/ml<br />
Folsäure<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer artefiziellen Freisetzung von Folsäure aus Erythrozyten<br />
muss das Serum/Plasma bis spätestens 30-45 Minuten nach der Blutentnahme (nüchtern!) abgetrennt<br />
werden.<br />
Klinische Indikationen: Megaloblastäre Anämie,<br />
Mangelernährung,<br />
Malabsorptionssyndrom (Zöliakie, Sprue),<br />
Jejunumsresektion,<br />
Langzeitmedikation mit Phenytoin, Phenobarbital, Daraprim,<br />
Langfristige Sulfonamideinnahme,<br />
Mulitpara,<br />
systemische hämatologische Erkrankungen,<br />
gesteigerte Erythropoese (chronische Hämolyse),<br />
Dialysepatienten,<br />
Psoriasis, exfoliative Dermatitis,<br />
nachgewiesener Vitamin C-Mangel,<br />
Hyperhomocysteinämie,<br />
Vitamin B12-Mangel<br />
Methode: ECLIA<br />
Referenzbereiche: 3,1 – 17,5 ng/ml<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 241
Freie Leichtketten im Serum<br />
Folsäure in Erythrozyten (W)<br />
Probenmaterial: 5 ml EDTA-Vollblut<br />
Klinische Indikationen: Megaloblastäre Anämie,<br />
Mangelernährung,<br />
Malabsorptionssyndrom (Zöliakie, Sprue),<br />
Jejunumsresektion,<br />
Langzeitmedikation mit Phenytoin, Phenobarbital, Daraprim,<br />
Langfristige Sulfonamideinnahme,<br />
Mulitpara,<br />
systemische hämatologische Erkrankungen<br />
Gesteigerter Erythropoese (chronische Hämolyse),<br />
Dialysepatienten,<br />
Psoriasis, exfoliativer Dermatitis,<br />
Nachgewiesenem Vitamin C-Mangel,<br />
Hyperhomocysteinämie,<br />
Vitamin B12-Mangel<br />
Methode: ECLIA<br />
Referenzbereiche: 180 – 590 ng/mlEry<br />
Francisella tularensis-Antikörper (U)<br />
Synonyme: Hasenpest, Tularämie<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 1-5 Tage; das diagnostische Fenster beträgt ca.<br />
10 Tage<br />
Klinische Indikationen: Verdacht auf Tularämie (Infektion beim Menschen erfolgt durch Kontakt<br />
mit lebenden/toten infizierten Tieren (Wildbretzubereitung), seltener durch Inhalation) bei ulzeroglanduösem<br />
bzw. okuloglandulärem Bild, selten Pneumonie<br />
Methode: Agglutination<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Freie Fettsäuren (U)<br />
Synonyme: FFA, Unveresterte Fettsäuren, NEFA<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Das Blut bitte nach der Abnahme <strong>und</strong> Gerinnung zentrifugieren, das Serum in<br />
ein separates Röhrchen pipettieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Weitere Untersuchung zur Fettstoffwechsel-Beurteilung<br />
Methode: Photometrie<br />
Referenzbereiche: < 0,7 mmol/l<br />
Freie Leichtketten im Serum<br />
Synonyme: FLC<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle/Monitoring bei:<br />
- Bence Jones Myelom (BJP, LCMM)<br />
242 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
- Nonsekretorisches Myleom (NSM)<br />
- Leichtketten-Amyloidose (AL)<br />
- Multiples Myelom mit Leichtkettenbeteiligung (MM)<br />
- Monoklonale Gammopathie unbekannter Spezifität (MGUS)<br />
- Weitere Diagnostik bei nachgewiesener monoklonale Gammopathie<br />
Methode: Turbidimetrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Freie Leichtketten im Urin (W)<br />
Probenmaterial: 10 ml Spontanurin oder<br />
10 ml eines 24-St<strong>und</strong>en-Urins (ohne Zusätze)<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Freie Leichtketten Typ Kappa im Serum<br />
Synonyme: FLC<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle/Monitoring bei:<br />
- Bence Jones Myelom (BJP, LCMM)<br />
- Nonsekretorisches Myleom (NSM)<br />
- Leichtketten-Amyloidose (AL)<br />
- Multiples Myelom mit Leichtkettenbeteiligung (MM)<br />
- Monoklonale Gammopathie unbekannter Spezifität (MGUS)<br />
- Weitere Diagnostik bei nachgewiesener monoklonale Gammopathie<br />
Methode: Turbidimetrie<br />
Referenzbereiche: 3,3 – 19,4 mg/l<br />
Freie Leichtketten Typ Kappa im Urin (W)<br />
Freie Leichtketten im Urin (W)<br />
Probenmaterial: 5 ml Spontanurin oder<br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: Bitte unbedingt die Sammelzeit angeben (wenn sie nicht 24 St<strong>und</strong>en beträgt)<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle/Monitoring bei:<br />
- Bence Jones Myelom<br />
- Nonsekretorisches Myleom<br />
- Leichtketten-Amyloidose<br />
- Multiples Myelom mit Leichtkettenbeteiligung<br />
- Monoklonale Gammopathie unbekannter Spezifität (MGUS)<br />
- Weitere Diagnostik bei nachgewiesener monoklonale Gammopathie<br />
Methode: Nephelometrie<br />
Referenzbereiche: 1,4 – 24,2 mg/l<br />
Freie Leichtketten Typ Lambda im Serum<br />
Synonyme: FLC<br />
Probenmaterial: 1 ml Serum<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 243
Freies β-HCG (U)<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle/Monitoring bei:<br />
- Bence Jones Myelom (BJP, LCMM)<br />
- Nonsekretorisches Myleom (NSM)<br />
- Leichtketten-Amyloidose (AL)<br />
- Multiples Myelom mit Leichtkettenbeteiligung (MM)<br />
- Monoklonale Gammopathie unbekannter Spezifität (MGUS)<br />
- Weitere Diagnostik bei nachgewiesener monoklonale Gammopathie<br />
Methode: Turbidimetrie<br />
Referenzbereiche: 5,7 – 26,3 mg/l<br />
Freie Leichtketten Typ Lambda im Urin (W)<br />
Probenmaterial: 5 ml Spontanurin oder<br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: Bitte unbedingt die Sammelmenge angeben (wenn nicht 24 St<strong>und</strong>en)<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle/Monitoring bei:<br />
- Bence Jones Myelom<br />
- Nonsekretorisches Myleom<br />
- Leichtketten-Amyloidose<br />
- Multiples Myelom mit Leichtkettenbeteiligung<br />
- Monoklonale Gammopathie unbekannter Spezifität (MGUS)<br />
- Weitere Diagnostik bei nachgewiesener monoklonale Gammopathie<br />
Methode: Nephelometrie<br />
Referenzbereiche: 0,24 – 6,7 mg/l<br />
Freier Androgen-Index<br />
Synonyme: FAI, Testosteron/SHBG-Quotient<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Männer: Hypogonadismus, Kryptorchismus, erektile Dysfunktion, Hodentumoren,<br />
Therapiemonitoring<br />
Frauen: Ovarialtumoren, Virilisierung<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Freies β-HCG (U)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Das entnommene Vollblut gerinnen lassen <strong>und</strong> anschließend die Probe innerhalb<br />
einer St<strong>und</strong>e zentrifugieren. Serum abpipettieren <strong>und</strong> in einem Probenröhrchen gekühlt / gefroren<br />
versenden.<br />
Haltbarkeit im Serum: 7 Tage bei 2-8°C, länger bei -20°C<br />
Falls diese Bedingungen nicht eingehalten werden können, bitte angeben.<br />
Bitte Schwangerschaftswoche exakt angeben.<br />
Klinische Indikationen: Erst-Trimester-Screening im Zusammenhang mit der Bestimmung von<br />
freiem β-HCG <strong>und</strong> der Messung der Nackenfalte mittels Ultraschall<br />
Methode: LIEMA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
244 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Freies Carbamazepin (U)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Bestimmung des max. Spiegels:<br />
ca. 6-18 St<strong>und</strong>en nach Medikamenteneinnahme<br />
Klinische Indikationen: Therapiekontrolle/Monitoring<br />
Methode: HPLC<br />
Referenzbereiche: 1,0 – 2,5 µg/ml<br />
Freies Hämoglobin (W)<br />
Freies Carbamazepin (U)<br />
Probenmaterial: 2 ml EDTA-Plasma oder 2 ml Serum<br />
Abnahmehinweise: Bei der Blutabnahme sollte jede Hämolyse vermieden werden. Daher ist eine<br />
Entnahme aus einer ungestauten Vene <strong>und</strong> die Verwerfung der ersten ca. 5 ml Blut zu empfehlen.<br />
Klinische Indikationen: Verdacht auf intravasale Hämolyse<br />
Qualitätskontrolle von Erythrozytenkonzentraten<br />
Weitere Diagnostik bei Transfusionszwischenfällen<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Fruktosamin im Serum (W)<br />
Synonyme: Fructosamin<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Retrospektive Langzeitkontrolle des Kohlenhydratstoffwechsels bei Diabetes<br />
mellitus, insbesondere bei Störungen in der Bestimmung von → HbA1c, Seite 259<br />
Methode: Photometrie<br />
Referenzbereiche: < 280 µmol/l<br />
Fruktose im Blut (U)<br />
Probenmaterial: 2 ml Natriumfluorid-Blut (NaF-Röhrchen)<br />
Klinische Indikationen: Verdacht auf<br />
- Fruktoseintoleranz,<br />
- Galaktoseintoleranz<br />
bei kindlichen Gedeihstörungen, gelegentlicher Hypoglykämie<br />
Methode: Photometrie<br />
Referenzbereiche: < 5 mg/dl<br />
Fruktose im Seminalplasma (U)<br />
Synonyme: Fruktose im Ejakulat, Fructose im Sperma<br />
Probenmaterial: 0,5 ml Ejakulat/Sperma mit Na-Fluorid (10mg/ml), bitte ggf. Spezialröhrchen anfordern<br />
Abnahmehinweise: das Ejakulat sollte unmittelbar nach der Gewinnung in ein Fluoridröhrchen (BZ-<br />
Röhrchen) gefüllt werden. Es wird das zentrifugierte Seminalplasma untersucht.<br />
Eine sexuelle Karenz von mindestens 4 Tagen vor der Untersuchung wird empfohlen.<br />
Klinische Indikationen: Diagnostik von Fertilitätsstörungen/Azoospermie,<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 245
FSME-Virus-Antikörper (IgG) (W)<br />
Entzündungen der Bläschendrüsen<br />
Methode: Photometrie<br />
Referenzbereiche: > 1200 µg/ml<br />
FSH<br />
Synonyme: Follikelstimulierendes Hormon<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von Störungen der Ovarfunktion (Zyklusstörungen,<br />
Sterilitätsdiagnostik, Hormonersatztherapie) bzw. der Hodenfunktion (pathologischer<br />
Testosteronspiegel)<br />
Methode: ECLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
FSME-Antikörper (IgG, Liquor/Serum) (W)<br />
Synonyme: FSME-AI, Liquordiagnostik<br />
Probenmaterial: 1 ml Serum <strong>und</strong> 1 ml Liquor<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
Klinische Indikationen: Nachweis einer intrathekalen IgG-Synthese gegen FSME-Virus bei akuten<br />
<strong>und</strong> auch chronischen ZNS-Erkrankungen.<br />
Methode: EIA<br />
Referenzbereiche: < 1,5 Index<br />
FSME-Serologie (W)<br />
Synonyme: Frühsommer-Meningoenzephalitis<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 7-14 Tage.<br />
Klinische Indikationen: Die FSME-Virus-Infektion wird durch Zecken übertragen (Hochendemiegebiete<br />
in Deutschland sind: Schwarzwald, Bayerischer Wald, Niederbayern, Odenwald)<br />
Ca. 90 % der Infektionen verlaufen subklinisch, sonst Sommergrippe, Meningoenzephalitis<br />
Methode: ELISA<br />
Referenzbereiche: s. Einzelparameter<br />
FSME-Virus-Antikörper (IgG) (W)<br />
Synonyme: Frühsommer-Meningoenzephalitis<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 7-14 Tage.<br />
Klinische Indikationen: Die FSME-Virus-Infektion wird durch Zecken übertragen (Hochendemiegebiete<br />
in Deutschland sind: Schwarzwald, Bayerischer Wald, Niederbayern, Odenwald)<br />
Ca. 90 % der Infektionen verlaufen subklinisch, sonst Sommergrippe, Meningoenzephalitis<br />
Methode: EIA<br />
Referenzbereiche: < 20 RU/ml<br />
246 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
FSME-Virus-Antikörper (IgM) (W)<br />
FSME-Virus-Antikörper (IgM) (W)<br />
Synonyme: Frühsommer-Meningoenzephalitis<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 7-14 Tage.<br />
Klinische Indikationen: Die FSME-Virus-Infektion wird durch Zecken übertragen (Hochendemiegebiete<br />
in Deutschland sind: Schwarzwald, Bayerischer Wald, Niederbayern, Odenwald)<br />
Ca. 90 % der Infektionen verlaufen subklinisch, sonst Sommergrippe, Meningoenzephalitis<br />
Methode: EIA<br />
Referenzbereiche: < 1,0 Ratio<br />
FSME-Virus-RNA-Nachweis (W)<br />
Synonyme: FSME-PCR<br />
Probenmaterial: 1 ml Liquor<br />
3 ml EDTA-Blut<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 7 – 14 Tage.<br />
Klinische Indikationen: Die FSME-Virus-Infektion wird durch Zecken übertragen (Hochendemiegebiete<br />
in Deutschland sind: Schwarzwald, Bayerischer Wald, Niederbayern, Odenwald)<br />
Ca. 90 % der Infektionen verlaufen subklinisch, sonst Sommergrippe, Meningoenzephalitis<br />
Methode: RT-PCR<br />
Referenzbereiche: negativ<br />
fT3<br />
Synonyme: freies Trijodthyronin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei Verdacht auf eine Schilddrüsenfunktionsstörung,<br />
insbesondere bei pathologischem → TSH basal, Seite 367.<br />
Methode: ECLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
fT4<br />
Synonyme: freies Thyroxin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei Verdacht auf eine Schilddrüsenfunktionsstörung,<br />
insbesondere bei pathologischem → TSH basal, Seite 367<br />
Methode: ECLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
FTA-ABS-19s-IgM (W)<br />
Synonyme: Fluoreszenz-Treponema-Antikörper-Absorptions-Test, Syphilis, Lues<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bestätigung eines reaktiven Lues-Suchtestes (IgG/IgM), in Einzelfällen alternativ<br />
zu → Treponema pallidum-Antikörper (IgM-Westernblot), Seite 363<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 247
Galaktose-1-Phosphat (U)<br />
FTA-ABS-IgG (W)<br />
Synonyme: Fluoreszenz-Treponema-Antikörper-Absorptions-Test, Syphilis, Lues<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bestätigung eines reaktiven Lues-Suchtestes (IgG/IgM), in Einzelfällen alternativ<br />
zu → Treponema pallidum-Antikörper (IgG-Westernblot)<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Gabapentin (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Gabapentin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 2 – 10 mg/l<br />
Galaktokinase in Erythrozyten (U)<br />
Probenmaterial: 2 ml EDTA-Blut<br />
Abnahmehinweise: Das Blut bitte direkt nach der Entnahme kühl lagern (+ 2°C – + 8 °C)<br />
Klinische Indikationen: Weitere Untersuchung bei Verdacht auf angeborene Enzymdefekte bei nicht<br />
sphärozytären hämolytischen Anämien, insbesondere bei Entwicklung eines Kataraktes im Kindesalter<br />
oder bei jungen Erwachsenen<br />
Methode: RIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Galaktose im Blut (U)(N)<br />
Probenmaterial: 1 ml Natriumfluorid-Blut (NaF-Röhrchen) oder<br />
1 ml Serum<br />
Abnahmehinweise: Bei Verdacht auf partielle Galaktosämie sollte das Blut etwa 30-60 Minuten nach<br />
Aufnahme eines Galaktose-reichen Nahrungsmittels (z.B. Milch) abgenommen werden.<br />
Klinische Indikationen: Verdacht auf Galaktosemangel, klassische Galaktosämie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Galaktose im Urin (W)<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (Zusatz von Natriumazid)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben, vor dem Abfüllen des Aliquots für die Diagnostik den Urin gründlich mischen.<br />
Klinische Indikationen: Verdacht auf Galaktokinasemangel, klassische Galaktosämie<br />
Methode: enzymatisch<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Galaktose-1-Phosphat (U)<br />
Synonyme: GALT<br />
Probenmaterial: 2 ml EDTA-Blut<br />
248 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Klinische Indikationen: Verdacht auf klassiscche Galaktösämie bei:<br />
- schwerer akuter Leberschädigung<br />
- schwerer akuter tubulärer Nierenschädidung<br />
- schwerer akuter ZNS-Schädigung<br />
- Erbrechen, Diarrhoe, Gedeihstörung<br />
- bei Milchzufütterung Ikterus, Hepatomegalie<br />
Methode: Fluorometrie<br />
Referenzbereiche: 7 – 22 µmol/l Ery<br />
Galaktose-1-Phosphat-Uridyl-Transferase in Erythrozyten (U)<br />
Galaktose-1-Phosphat-Uridyl-Transferase in Erythrozyten (U)<br />
Synonyme: Gal-1-PUT<br />
Probenmaterial: 2 ml EDTA-Blut<br />
Abnahmehinweise: Blut nach der Abnahme kühl (+ 2°C – + 8°C) lagern, NICHT einfrieren<br />
Klinische Indikationen: Verdacht auf Enzymdefekt bei nicht sphärozytären hämolytischen Anämien<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Gallensäuren im Serum (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nüchtern (ca. 12 St<strong>und</strong>en Nahrungskarenz), Lagerung gekühlt (+<br />
2°C – + 8°C), ggf. auch postprandial (bitte vermerken)<br />
Klinische Indikationen: Beurteilung der hepatobiliären Funktion; Diagnostik einer intrahepatischen<br />
Schwangerschafts-Cholestase<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Gallensäuren im Stuhl (U)<br />
Probenmaterial: 2 g Stuhl<br />
Klinische Indikationen: Verdacht auf gestörte Rückresorption bei Erkrankungen des Ileums<br />
Methode: Photometrie<br />
Referenzbereiche: 200 – 900 µmol/100 g<br />
γ-GT<br />
Synonyme: γ-Glutamyl-Transferase, GGT<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden.<br />
Blutentnahme nach > 12 St<strong>und</strong>en Alkoholkarenz<br />
Klinische Indikationen: Diagnose, Beurteilung <strong>und</strong> Verlaufskontrolle von Erkrankungen der Leber<br />
<strong>und</strong> der Gallenwege<br />
Methode: enzymatisch<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 249
Gentamicin im Serum<br />
γ-HCH im Blut (U)<br />
Synonyme: Lindan, γ-Hexachlorcyclohexan, Gamma-HCH, Pestizid<br />
Probenmaterial: EDTA-Blut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Spezielle Abnahmemonovetten können angefordert werden.<br />
Klinische Indikationen: Beurteilung der Lindanbelastung<br />
Methode: GC/MS<br />
Referenzbereiche: < 0,1 µg/l<br />
Gamma-Linolensäure (U)(N)<br />
Probenmaterial: 5 ml Serum<br />
Klinische Indikationen: Verdacht auf Mangel an Gamma-Linolensäure, insbesondere bei unruhiger,<br />
rissiger Haut, Juckreiz <strong>und</strong> Hautrötungen, Haarausfall, Schuppenbildung <strong>und</strong> W<strong>und</strong>heilungstörungen<br />
Methode: GC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Gastrin im Serum (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme morgens nüchtern (ca. 12 St<strong>und</strong>en Nahrungskarenz), 24 St<strong>und</strong>en<br />
vorher keine Antazida, H2-Blocker, Anticholinergika einnehmen, kein Kaffeegenuss, Blut direkt nach<br />
der Gerinnung zentrifugieren, Serum abpipettieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Schweres peptisches Ulcusleiden, Rezidivulcera nach Magenteilresektion,<br />
Zollinger-Ellison-Syndrom, schwere Refluxösophagitis, massive gastrale Hypersekretion, weiter Diagnostik<br />
bei Abklärung eines MEN<br />
Methode: RIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Gelbfieber-Antikörper (U)<br />
Synonyme: Arboviren<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 3-6 Tage.<br />
VOR DER BLUTABNAHME telefonische Anmeldung, ggf. Referenzzentrum konsultieren<br />
Klinische Indikationen: Verdacht auf Gelbfieberinfektion bei Symptomatik: hämorrhagisches Fieber<br />
mit biphasischem Verlauf, Übertragungsmodus: durch Moskitos<br />
Methode: IIFT<br />
Referenzbereiche: negativ (< 1:20)<br />
Gentamicin im Serum<br />
Synonyme: Gentamycin<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bestimmung des Talspiegels: Entnahme direkt vor nächster Gabe<br />
Bestimmung des Spitzenspiegels: ca. 30 Minuten nach i.v.-Gabe<br />
Klinische Indikationen: Monitoring einer Gentamicin-Therapie<br />
Methode: PETNIA<br />
250 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Referenzbereiche: Talwert: 0,3 – 2 mg/l<br />
Spitzenwert: 5 – 10 mg/l<br />
Talspiegel > 2 mg/l <strong>und</strong> Spitzenspiegel > 10 mg/l sind potentiell nephrotoxisch.<br />
Gerinnungsuntersuchungen<br />
Gerinnungsuntersuchungen<br />
Probenmaterial: korrekt gefüllte Citratblut-Monovette (je Parameter ca. 0,4 ml)<br />
Abnahmehinweise: Gerinnungsanalysen sind besonders störanfällig auf Fehler in der Präanalytik<br />
(Blutentnahme, Probentransport). Blutabnahme unter möglichst stressarmen Bedingungen, kurze<br />
Stauzeiten, möglichst großvolumige Kanülen verwenden, Citratblut nicht zuerst abnehmen, bei der<br />
Abnahme auf das korrekte Füllvolumen (bis zur vorgeschriebenen Markierung auf dem Röhrchen)<br />
achten, Röhrchen direkt nach der Abnahme durch vorsichtiges Schwenken gründlich mischen.<br />
Klinische Indikationen: Abklärung einer erhöhten Blutungs- oder Thromboseneigung, Verlaufskontrolle<br />
einer bekannten Gerinnungsstörung<br />
Methode: siehe Einzelparameter<br />
Referenzbereiche: siehe Einzelparameter<br />
GFR nach CKD-Epi Formel<br />
Synonyme: CKD-Epi, CKD GFR, Chronical-Kidney-Disease-Epidemy-<br />
Collaboration<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Für die Berechnung sind zusätzlich folgende Angaben<br />
notwendig:<br />
- Alter<br />
- Geschlecht<br />
- Hinweis auf schwarze Hautfarbe<br />
GHB im Serum (W)(N)<br />
Synonyme: Gamma-Hydroxy-Buttersäure, “K.O.-Tropfen“<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Aufklärung einer vermuteten Beimengung von GHB<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
GHB im Urin (W)(N)<br />
Synonyme: Gamma-Hydroxy-Buttersäure, “K.O.-Tropfen“<br />
Probenmaterial: 5 ml Urin (ohne Zusätze)<br />
Klinische Indikationen: Aufklärung einer vermuteten Beimengung von GHB<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
GLDH<br />
Synonyme: Glutamat-Dehydrogenase<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum bei längerem Probentransport<br />
abzentrifugiert werden.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 251
Glucagon (U)<br />
Klinische Indikationen: Diagnose <strong>und</strong> Beurteilung der Schwere einer Leberparenchymschädigung,<br />
Differentialdiagnose der Lebererkrankungen<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Gliadin-Antikörper im Stuhl (IgA) (W)<br />
Synonyme: Gliadin-scIgA-Ak<br />
Probenmaterial: 1 g Stuhl<br />
Klinische Indikationen: Screening-Untersuchung bei Verdacht auf Zöliakie bei erschwerter Blutentnahme<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Glibenclamid (U)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme 1 – 2 St<strong>und</strong>en nach oraler Gabe<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Glibenclamid-Therapie<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Glibornurid (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Glibornurid-Therapie<br />
Methode: LC/MS<br />
Referenzbereiche: 1,6 – 3,4 mg/l<br />
Glimepirid (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle bzw. Monitoring einer Glimepiridtherapie<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Glucagon (U)<br />
Synonyme: Glukagon<br />
Probenmaterial: 1 ml mit Trasylol stabilisiertes EDTA-Plasma<br />
Abnahmehinweise: Die Blutentnahme sollte morgens am nüchternen Patienten erfolgen.<br />
4 ml EDTA-Blut abnehmen, sofort in ein mit Trasylol präpariertes Glasröhrchen überführen <strong>und</strong> zentrifugieren.<br />
Anschließend Plasma in ein Glasröhrchen ohne Zusatz umfüllen. Probe tiefgefroren einsenden.<br />
Klinische Indikationen: Diagnostik des Glukagonoms<br />
Methode: RIA DA PEG<br />
Referenzbereiche: < 100 pg/ml<br />
252 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Glukose im Blut<br />
Glukose im Blut<br />
Synonyme: Blutzucker<br />
Probenmaterial: 1 ml Natriumfluorid-Blut oder<br />
1 ml Citrat-NaF-Blut (GlucoEXACT) oder<br />
1 ml Serum<br />
Abnahmehinweise: Zur Bestimmung der Nüchtern-Glukose ist eine Nahrungskarenz von mindestens<br />
8 St<strong>und</strong>en erforderlich<br />
Klinische Indikationen: Diagnose, Verlaufskontrolle <strong>und</strong> Therapiebeurteilung bei Diabetes mellitus,<br />
Abklärung einer Hypoglykämie bei unklarem Koma, Pankreatitis, Endokrinopathien, Inselzelltumoren,<br />
Morbus Addison<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Glukose im Dialysat (N)<br />
Synonyme: Glucose im Dialysat<br />
Probenmaterial: 2 ml Dialysat<br />
Klinische Indikationen: Qualitätskontrolle von Dialysat<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Glukose im Liquor<br />
Synonyme: Glucose im Liquor<br />
Probenmaterial: 1 ml Liquor <strong>und</strong><br />
1 ml Serum oder NaF-Blut<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum/NaF gleichzeitig abnehmen<br />
Klinische Indikationen: Gr<strong>und</strong>programm der Liquordiagnostik bei Verdacht auf akute ZNS-<br />
Infektion.<br />
Methode: Photometrie<br />
Referenzbereiche: > 50% des Serumwertes<br />
Glukose im Urin<br />
Synonyme: Glucose<br />
Probenmaterial: 5 ml Spontanurin (Mittelstrahl) oder<br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins (gesammelt über 5 ml Eisessig)<br />
Abnahmehinweise: Haltbarkeit bei nicht stabilisiertem Urin maximal 2 St<strong>und</strong>en.<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle bei Diabetes mellitus <strong>und</strong> des renalen Diabetes,<br />
toxische Nierenschädigung, Schwangerschaftsglukosurie<br />
Methode: Photometrie<br />
Referenzbereiche: Spontanurin: 1 – 15 mg/dl<br />
24-St<strong>und</strong>en-Sammelurin: < 0,5 g/24 Std.<br />
Glukose-6-Phosphat-Dehydrogenase in Erythrozyten (W)<br />
Synonyme: Favismus, G-6-PDH, G6P-DH<br />
Probenmaterial: 4 ml EDTA-Vollblut<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 253
Glutathion-Reduktase in Erythrozyten (U)<br />
Abnahmehinweise: Blut nach der Abnahme kühl (+ 2°C – + 8°C) lagern, NICHT einfrieren<br />
Klinische Indikationen: Verdacht auf G-6-PDH-Mangel bei hämolytischer Anämie, die insbesondere<br />
durch Infekte, Aufnahme von Nahrungsmitteln (Favabohnen) oder nach Medikamentengabe (Chinin,<br />
Primaquin, Chloroquin, Sulfonamide, ASS u.a.) verstärkt wird<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Glutarsäure (U)<br />
Probenmaterial: 5 ml Urin<br />
Klinische Indikationen: Verdacht auf Glutaracidurie Typ I mit<br />
- geringgradige Muskelhypotonie<br />
- Irritabilität, Zittrigkeit<br />
- Makrozephalie<br />
- progrediente Choreoathethose mit Dystonie<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Glutathion gesamt im Vollblut (W)<br />
Probenmaterial: 1 ml EDTA-Blut, tiefgefroren<br />
Abnahmehinweise: Vollblut direkt nach der Abnahme einfrieren (ca. – 20°C) <strong>und</strong> gefroren lagern<br />
Klinische Indikationen: Beurteilung der körpereigenen Entgiftungsfunktion<br />
Methode: LC/MS<br />
Referenzbereiche: 760 – 1200 µmol/l<br />
Glutathion, reduziert im Vollblut (W)<br />
Probenmaterial: 1 ml EDTA-Blut, tiefgefroren<br />
Abnahmehinweise: Vollblut direkt nach der Abnahme einfrieren (ca. – 20°C) <strong>und</strong> gefroren lagern<br />
Klinische Indikationen: Beurteilung der körpereigenen Entgiftungsfunktion<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Glutathion-Peroxidase (W)<br />
Synonyme: GPX<br />
Probenmaterial: 2 ml EDTA-Blut<br />
Klinische Indikationen: Beurteilung oxidativer Stress<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Glutathion-Reduktase in Erythrozyten (U)<br />
Probenmaterial: 1 ml EDTA-Blut<br />
Abnahmehinweise: Blut nach der Abnahme kühl (+ 2°C – + 8°C) lagern, NICHT einfrieren<br />
Klinische Indikationen: Weitere Untersuchung bei angeborener nicht sphärozytärer hämolytischer<br />
Anämie bzw. bei hämolytischen Krisen nach Einnahme oxidierender Substanzen (z.B. Favabohnen)<br />
254 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: Photometrie<br />
Referenzbereiche: 5 – 11 U/g Hb<br />
Gold im Serum (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Bestimmung des max. Spiegels:<br />
ca. 30 Minuten nach Applikation<br />
Bestimmung des Talspiegels:<br />
vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Gold-Therapie<br />
Methode: ICP/MS<br />
Referenzbereiche: 380 – 5000 µg/l<br />
GOT<br />
Synonyme: Glutamat-Oxalacetat-Transaminase, AST<br />
Probenmaterial: 1 ml Serum<br />
Methode: Photometrie<br />
Referenzbereiche: Männer: 10 – 50 U/l<br />
Frauen: 10 – 35 U/l<br />
Kinder: altersabhängige Referenzbereiche<br />
GPT<br />
Synonyme: Glutamat-Pyruvat-Transaminase, ALT<br />
Probenmaterial: 1 ml Serum<br />
Methode: Photometrie<br />
Referenzbereiche: Männer: 10 – 50 U/l<br />
Frauen: 10 – 35 U/l<br />
Kinder: altersabhängige Referenzbereiche<br />
Haemophilus influenzae Typ b-IgG-Antikörper (W)<br />
Gold im Serum (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bei klinischem Verdacht auf eine Infektion ist der Erregernachweis die Methode<br />
der Wahl<br />
Klinische Indikationen: Überprüfung des Immunstatus vor oder nach Impfung<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Haloperidol (Haldol) (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Monitoring einer Haloperidol-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 255
Hämopexin (W)<br />
HAMA (W)<br />
Synonyme: humane Anti-Maus-Antikörper, heterophile Antikörper<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik zur Aufklärung nicht plausibler Ergebnisse immunologischer<br />
Untersuchungen (Tumormarker, Hormone), bei denen in den Laborverfahren monoklonale<br />
Maus-Antikörper verwendet werden<br />
Therapie-Monitoring nach diagnostischer oder therapeutische Applikation monoklonaler Maus-<br />
Antikörper<br />
Methode: ELISA<br />
Referenzbereiche: < 40 µg/l<br />
Hämochromatose, hereditär<br />
Synonyme: HFE<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Weitere Diagnostik bei Verdacht auf hereditäre Hämochromatose, insbesondere<br />
bei erhöhter Transferrinsättigung <strong>und</strong>/oder erhöhter Ferritinkonzentration<br />
Methode: PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hämoglobin / Hämoglobin-Haptoglobin-Komplex im Stuhl (W)<br />
Synonyme: Blut im Stuhl immunologisch / Haemimmun ®<br />
Probenmaterial: 2 Stuhlproben à 1g, gefroren<br />
Abnahmehinweise: Empfohlen werden 2 erbsgroße Proben aus einem Stuhlgang<br />
Klinische Indikationen: Vorsorge des Dickdarmkarzinoms<br />
Methode: ELISA<br />
Referenzbereiche: Hämoglobin: < 2,0 µg/g Stuhl<br />
Hämoglobin/Haptoglobin-Komplex: < 2,0 µg/g Stuhl<br />
Hämoglobin-Mutationsnachweis (W)<br />
Synonyme: Hämoglobinopathie<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Weitere Untersuchung zum Nachweis anormaler Hämoglobine bei unklarem<br />
Ausfall anderer Untersuchungsmethoden (Hb-Elektrophorese), insbesondere bei schweren Verläufen<br />
oder im Rahmen einer pränatalen Diagnostik bei Verdacht auf Thalassämie<br />
Methode: PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hämopexin (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Abschätzung des Grades der intravasalen Hämolyse bei nicht messbarem →<br />
256 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Haptoglobin, Seite 257.<br />
Methode: RID<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hämosiderin (U)(N)<br />
Probenmaterial: 10 ml Spontanurin<br />
Klinische Indikationen: Verdacht auf Eisenüberladung<br />
Methode: Mikroskopie<br />
Referenzbereiche: negativ<br />
Hantavirus-Antikörper (IgG-Immunoblot, Bestätigung) (W)<br />
Hämosiderin (U)(N)<br />
Synonyme: Hämorrhagisches Fieber<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 10-30 Tage<br />
Klinische Indikationen: Bestätigungstest bei positivem Suchtest für Hantaan-Virus-IgG bzw.<br />
Puumala-Virus-IgG<br />
Verdacht auf Dobrava-Virus-Infektion<br />
Methode: Immunoblot<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hantavirus-Antikörper (IgM-Immunoblot, Bestätigung) (W)<br />
Synonyme: Hämorrhagisches Fieber<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 10-30 Tage<br />
Klinische Indikationen: Bestätigungstest bei positivem Suchtest für Hantaan-Virus-IgG bzw.<br />
Puumala-Virus-IgG<br />
Verdacht auf Dobrava-Virus-Infektion<br />
Methode: Immunoblot<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hantavirus-Serologie (W)<br />
Synonyme: Hämorrhagisches Fieber<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 10-30 Tage<br />
Klinische Indikationen: Verdacht auf Hantavirus-Infektion bei Nephropathia endemica bzw. haemorrhagischem<br />
Fieber mit renalen Symptomen, Nierenversagen, Pneumonie, Hämoptysis<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Haptoglobin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufsbeurteilung hämolytischer Erkrankungen<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 257
Harnstoff im Urin<br />
Methode: Nephelometrie<br />
Referenzbereiche: 0,3 – 2,0 g/l<br />
Harnsäure im Punktat (N)<br />
Probenmaterial: 1 ml Punktat<br />
Klinische Indikationen: Weitere Diagnostik bei Verdacht auf Arthritis urica (Gicht)<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Harnsäure im Serum<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Screeninguntersuchung bei Stoffwechseldiagnostik,<br />
Diagnose <strong>und</strong> Verlaufsbeurteilung der Gicht,<br />
Verdacht auf sek<strong>und</strong>äre Hyperurikämie<br />
Methode: Photometrie<br />
Referenzbereiche: < 15 Jahre: 1,0 – 6,4 mg/dl<br />
> 15 Jahre (Männer): < 7,0 mg/dl<br />
> 15 Jahre (Frauen): < 5,7 mg/dl<br />
Harnsäure im Urin<br />
Probenmaterial: 5 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusatz) oder<br />
5 ml Spontanurin<br />
Abnahmehinweise: Bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Weitere Diagnostik bei pathologischen Harnsäurewerten im Serum, bei<br />
Nephro- <strong>und</strong> Urolithiasis<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Harnstoff im Serum<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose der prärenalen <strong>und</strong> postrenalen Azotämie, Verlaufskontrolle der<br />
chronischen Niereninsuffizienz <strong>und</strong> bei Dialysepatienten<br />
Methode: Photometrie<br />
Referenzbereiche: 16,6 – 48,5 mg/dl<br />
Harnstoff im Urin<br />
Probenmaterial: 5 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusatz) oder<br />
5 ml Spontanurin<br />
Abnahmehinweise: Bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung der Niereninsuffizienz<br />
258 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hb-Elektrophorese (W)<br />
Synonyme: Hämoglobin-Elektrophorese<br />
Probenmaterial: 2 x 3 ml EDTA-Blut<br />
Klinische Indikationen: Verdacht auf eine Hämoglobinopathie,<br />
Hypochrome Erythrozyten (mit/ohne Anämie) nach Ausschluss eines Eisenmangels,<br />
chronisch-hämolytische Anämien,<br />
Gefäßverschlusskrisen unbekannter Ursache,<br />
Hydrops fetalis unklarer Ursache,<br />
Familienuntersuchung bei bekannter Hämoglobinopathie<br />
Methode: Kapillarelektrophorese<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
HbA1c<br />
Hb-Elektrophorese (W)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Klinische Indikationen: Retrospektive Langzeitkontrolle des Kohlenhydratstoffwechsels bei Diabetes<br />
mellitus<br />
Methode: HPLC<br />
Referenzbereiche: 4,3 – 5,9 %<br />
23 – 42 mmol/mol<br />
HBDH<br />
Synonyme: α-Hydroxybutyrat-Dehydrogenase, LDH 1<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse Serum/Plasma bei längerem Probentransport<br />
abzentrifugieren<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von Erkrankungen mit erhöhtem LDH<br />
1-Isoenzym (Herzmuskel, Erythrozyten, Niere)<br />
Differenzierung einer erhöhte LDH<br />
Methode: Photometrie<br />
Referenzbereiche: 72 – 182 U/l<br />
HBe-Antigen<br />
Synonyme: Hepatitis B e-Antigen<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Zusätzlicher Parameter bei der Diagnostik <strong>und</strong> Verlaufsbeurteilung der<br />
akuten <strong>und</strong> chronischen Hepatitis B<br />
Methode: CMIA<br />
Referenzbereiche: negativ<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 259
Helicobacter pylori-Nachweis im Atemtest<br />
HBs-Antigen<br />
Synonyme: Australia-Antigen, Hepatitis B<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufsbeurteilung der akuten <strong>und</strong> chronischen Hepatitis B<br />
Methode: CMIA<br />
Referenzbereiche: negativ<br />
HDL-Cholesterin<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nüchtern (ca. 12 St<strong>und</strong>en Nahrungskarenz), langes Stauen vermeiden<br />
Klinische Indikationen: Diagnose, Differentialdiagnose <strong>und</strong> Verlaufsbeurteilung von Fettstoffwechselstörungen,<br />
Verlaufskontrolle unter lipidsenkender Therapie<br />
Methode: Photometrie<br />
Referenzbereiche: Frauen: > 45 mg/dl<br />
Männer: > 35 mg/dl<br />
Helicobacter pylori-Antikörper (IgA-EIA)<br />
Synonyme: H. pylori-Suchtest<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Abklärung chronische Gastritis Typ B,<br />
Ulcus ventriculi, Ulcus duodeni<br />
Bei chronischer Infektion kann sich in der Folge ein MALT-Lymphom entwickeln.<br />
Methode: EIA<br />
Referenzbereiche: negativ (< 0,8 Ratio)<br />
Helicobacter pylori-Antikörper (IgG-EIA)<br />
Synonyme: H. pylori-Suchtest<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Abklärung chronische Gastritis Typ B,<br />
Ulcus ventriculi, Ulcus duodeni<br />
Bei chronischer Infektion kann sich in der Folge ein MALT-Lymphom entwickeln.<br />
Methode: EIA<br />
Referenzbereiche: negativ (< 16 E/ml)<br />
Helicobacter pylori-Nachweis im Atemtest<br />
Synonyme: C13-Atemtest<br />
Probenmaterial: je 1 Atembeutel<br />
Abnahmehinweise: Atembeutel bitte exakt kennzeichnen<br />
(vor bzw. nach Gabe von C13)<br />
Klinische Indikationen: Diagnose <strong>und</strong> Therapiekontrolle einer Helicobacter pylori-Infektion<br />
Methode: Infrarot-Spektrometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
260 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Helicobacter pylori-Serologie<br />
Helicobacter pylori-Serologie<br />
Synonyme: H. pylori<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Abklärung bei chronischer Gastritis Typ B, Ulcus ventriculi, Ulcus duodeni.<br />
Bei chronischer Infektion kann sich in der Folge ein MALT-Lymphom entwickeln.<br />
Methode: EIA<br />
Immunoblot<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Heparin-induzierte Thrombozytopenie<br />
Synonyme: HIT II, HAT<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Bitte Angaben zum verabreichten Heparin einschließlich Behandlungsdauer <strong>und</strong><br />
Heparinanamnese machen.<br />
Klinische Indikationen: Thrombozytenabfall um mehr als 50% vom Ausgangswert bzw. Thrombozytopenie<br />
im Rahmen einer Heparin-Therapie<br />
Thrombose (arteriell, venös) unter Heparin-Therapie<br />
Nicht ausreichende Heparin-Wirkung (Heparin-Resistenz)<br />
Hinweis:<br />
Auftreten ca. ab dem 5. Tag nach erstmaliger Heparingabe, bei anamnestisch bekannter Heparin-<br />
Gabe auch frühzeitiger; HIT II ist auch bei normaler Thrombozytenzahl möglich, ab der 3. Behandlungswoche<br />
mit Heparin sinkt das Risiko für eine HIT II wieder.<br />
Wegen der Lebensbedrohlichkeit der mit einer HIT II verb<strong>und</strong>enen Komplikationen sollte bei Verdacht<br />
auf HIT II die Diagnostik unmittelbar eingeleitet werden.<br />
Methode: ELISA<br />
Referenzbereiche: negativ<br />
Hepatitis A-Serologie<br />
Synonyme: HAV<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 12-40 Tage (Mittel: 21).<br />
Klinische Indikationen: Akute Hepatitis A, Überprüfung des Impfschutzes nach Hepatitis A-<br />
Impfung<br />
Methode: CMIA<br />
Referenzbereiche: negativ<br />
Hepatitis A-Virus-PCR (W)<br />
Synonyme: HAV-PCR<br />
Probenmaterial: 3 ml EDTA-Blut<br />
5 g Stuhl<br />
Leberbiopsie, tiefgefroren (-20°C)<br />
Klinische Indikationen: Verdacht auf akute Hepatitis A, Nachweis der Hepatitis A-Virämie, Umgebungsuntersuchungen<br />
bei Hepatitis A-Ausbrüchen<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 261
Hepatitis C-RNA-Nachweis quantitativ<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Hepatitis B-DNA-Nachweis quantitativ<br />
Synonyme: HBV-PCR quantitativ<br />
Probenmaterial: 9 ml EDTA-Blut<br />
Abnahmehinweise: Bitte für diese Untersuchung eine separate Monovette abnehmen. Das Blut nach<br />
der Abnahme kühl (+2°C – +8°C) lagern.<br />
Ausnahmekennziffer 32005 (Therapie Hepatitis B+C) oder<br />
32006 (Verdacht auf meldepflichtige Erkrankung)<br />
Klinische Indikationen: Bestimmung der Virusmenge bzw. Virusbeladung (“viral load“) des Patienten<br />
zur Beurteilung des Infektionstatus <strong>und</strong> zur Therapiekontrolle<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Hepatitis B-Serologie<br />
Probenmaterial: 3 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 40-160 Tage (Mittel: 65).<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufsbeurteilung einer akuten oder chronischen Hepatitis<br />
B. Die Infektiosität besteht gr<strong>und</strong>sätzlich für die Zeit des Nachweises von HBs-Antigen; die bessere<br />
Beurteilung gelingt mit Bestimmung der Hepatitis B-Viruslast.<br />
Methode: CMIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hepatitis B-Virus-Resistenzbestimmung (genotypisch, Pol-Gen) (W)<br />
Synonyme: Lamivudin-Resistenz, Adefovir-Resistenz<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Ausnahmekennziffer 32005 (Therapie Hepatitis B+C)<br />
Klinische Indikationen: Verdacht auf Resistenz gegenüber den eingesetzten Medikamenten zur Therapie<br />
einer HBV-Infektion (Lamivudine, ggf. Adefovir oder andere) bei:<br />
- Therapieversagen (HBV-Viruslast-Anstieg unter Therapie)<br />
- Primärinfektion mit ggf. resistenten HBV-Stämmen<br />
- Beginn einer HBV-Therapie<br />
Methode: PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hepatitis C-RNA-Nachweis quantitativ<br />
Synonyme: HCV-PCR-quantitativ<br />
Probenmaterial: 9 ml EDTA-Blut<br />
Abnahmehinweise: Bitte für diese Untersuchung eine separate Monovette abnehmen. Das Blut nach<br />
der Abnahme kühl (+2°C – +8°C) lagern.<br />
Ausnahmekennziffer 32005 (Therapie Hepatitis B+C) oder 32006 (Verdacht auf meldepflichtige<br />
Erkrankung)<br />
262 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Hepatitis C-Serologie<br />
Klinische Indikationen: Bestimmung der Virusmenge bzw. Virusbeladung (“viral load“) des Patienten<br />
zur Beurteilung des Infektionstatus <strong>und</strong> zur Therapiekontrolle<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Hepatitis C-Serologie<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 7-140 Tage (Mittel: 50).<br />
Klinische Indikationen: Verdacht auf eine Hepatitis C-Infektion<br />
Methode: CMIA<br />
Immunoblot<br />
Referenzbereiche: negativ<br />
Hepatitis C-Virus-Genotypisierung<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Ausnahmekennziffer 32005 (Therapie Hepatitis B+C)<br />
Klinische Indikationen: Therapie einer HCV-Infektion mit Interferon/Ribaverin<br />
Methode: PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hepatitis D-Diagnostik (W)<br />
Probenmaterial: 1 ml Serum (Antikörpernachweis)<br />
ggf. 10 ml EDTA-Blut (PCR)<br />
Abnahmehinweise: Das diagnostische Fenster beträgt für die HDV-Superinfekion ca. 7-50 Tage; bei<br />
der HDV-Koinfektion wie bei der Hepatitis B ca. 40-160 Tage (Mittel: 65).<br />
Klinische Indikationen: Verdacht auf eine Koinfektion oder Superinfektion einer bestehenden Hepatitis<br />
B mit HDV.<br />
Methode: EIA<br />
PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hepatitis D-RNA-Nachweis (W)<br />
Synonyme: HDV-PCR<br />
Probenmaterial: 10 ml EDTA-Blut<br />
Abnahmehinweise: Bitte für diese Untersuchung eine separate Monovette abnehmen. Das Blut nach<br />
der Abnahme kühl (+2°C – +8°C) lagern.<br />
Ausnahmekennziffer 32006 (Verdacht auf meldepflichtige Erkrankung)<br />
Klinische Indikationen: Verdacht auf Superinfektion einer chronischen Hepatitis B-Infektion<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 263
Herpes simplex-Virus Typ 1/2-Antikörper (IgG, Liquor/Serum)<br />
Hepatotrope Erreger<br />
Synonyme: Hepatitis-Erreger<br />
Probenmaterial: Serum<br />
HER-2/neu-Protein im Serum (W)<br />
Synonyme: human epidermal growth factor receptor-2/neuroblastoma<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring sowie Prognoseabschätzung beim Mammakarzinom<br />
Fehlender Tumorgewebestatus zur HER-2/neu-Protein-Expressioin<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hereditäre Fruktose-Intoleranz (U)<br />
Synonyme: HFI, (MIM 229600)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Verdacht auf hereditäre Fruktose-Intoleranz bei unklarer Hypoglykämie<br />
bzw. Schweißausbruch, Tremor, Erbrechen <strong>und</strong> Krämpfen nach Fruktose-Aufnahme sowie weitere<br />
Untersuchung bei Azidose, Aminoazidurie <strong>und</strong> Nierenschaden.<br />
Methode: PCR <strong>und</strong> Sequenzierung<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hereditäre Pankreatitis (U)<br />
Synonyme: Trypsinogen-Gen (MIM 167800)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Verdacht auf hereditärer Pankreatitis im Rahmen der Familienberatung bei<br />
gehäuftem Vorkommen in Familien bzw. Auftreten einer chronischen Pankreatitis im Kindesalter<br />
Methode: PCR <strong>und</strong> Sequenzierung<br />
Referenzbereiche: negativ<br />
Herpes simplex-Virus Typ 1/2-Antikörper (IgG, Liquor/Serum)<br />
Synonyme: HSV-AI<br />
Probenmaterial: 1 ml Liquor <strong>und</strong><br />
1 ml Serum<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum immer gleichzeitig abnehmen.<br />
Bei akuten ZNS-Erkrankungen beträgt das diagnostische Fenster für den intrathekalen IgG-Nachweis<br />
ca. 7-14 Tage.<br />
Klinische Indikationen: Nachweis einer intrathekalen IgG-Synthese gegen HSV, insbesondere in der<br />
zweiten Erkrankungswoche einer akuten ZNS-Erkrankung<br />
264 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: EIA<br />
Referenzbereiche: 0,6 – 1,5 Index<br />
Herpes simplex-Virus Typ 1/2-DNA-Nachweis<br />
Herpes simplex-Virus Typ 1/2-DNA-Nachweis<br />
Synonyme: HSV 1/2-PCR<br />
Probenmaterial: je nach Indikation:<br />
1 ml Liquor<br />
3 ml EDTA-Blut<br />
Bläscheninhalt (Trockenabstrich)<br />
Kammerwasser<br />
1 ml respiratorisches Material<br />
Klinische Indikationen: Nachweis einer HSV-Infektion, insbesondere bei akuter ZNS-Erkrankung<br />
Methode: PCR mit Schmelzkurvenanalyse<br />
Referenzbereiche: negativ<br />
Herpes simplex-Virus Typ 1/2-Serologie<br />
Synonyme: HSV Typ 1/2<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 3-7 Tage.<br />
Klinische Indikationen: Herpes labialis, Herpes genitalis, bei Kleinkindern <strong>und</strong> Säuglingen auch<br />
Enzephalitis, Krampfanfälle, Hepatitis, Herpes neonatorum.<br />
Methode: EIA<br />
Referenzbereiche: negativ<br />
Hexachlorbenzol im Blut (U)<br />
Probenmaterial: 10 ml EDTA-Blut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Spezielle Abnahmemonovetten können angefordert werden.<br />
Klinische Indikationen: Beurteilung der Belastung mit Hexachlorbenzol<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hippursäure im Urin (U)<br />
Synonyme: Hippurat<br />
Probenmaterial: 5 ml Spontanurin<br />
Abnahmehinweise: Probennahme nach Expositionszeit (Schichtende)<br />
Klinische Indikationen: Beurteilung der Toluolbelastung<br />
Methode: GC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Histamin im Blut (U)<br />
Probenmaterial: 5 ml Heparin-Blut<br />
Abnahmehinweise: Vor der Blutentnahme histaminreiche Nahrungsmittel wie Käse, Rotwein oder<br />
Sauerkraut vermeiden.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 265
HIV-1-RNA-Nachweis quantitativ<br />
Klinische Indikationen: Suchtest für Typ 1-Überempfindlichkeitsreaktionen, Mastozytose, Mastozytom,<br />
CML, Polyzythämie vera, Urtikaria<br />
Methode: RIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Histamin im Plasma (U)<br />
Probenmaterial: 2 ml EDTA-Plasma, gefroren<br />
Abnahmehinweise: Das Blut bitte direkt nach der Entnahme zentrifugieren, das Plasma in ein<br />
separates Röhrchen überführen <strong>und</strong> einfrieren (ca. – 20°C). Vor der Blutentnahme histaminreiche<br />
Nahrungsmittel wie Käse, Rotwein oder Sauerkraut vermeiden.<br />
Klinische Indikationen: Suchtest für Typ 1-Überempfindlichkeitsreaktionen, Mastozytose, Mastozytom,<br />
CML, Polyzythämie vera, Urtikaria<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Histamin im Urin (U)<br />
Probenmaterial: 5 ml eines 24-St<strong>und</strong>en-Sammelurins (gesammelt über 5 ml Eisessig)<br />
Abnahmehinweise: Den Urin nach der Gewinnung direkt einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Weitere Untersuchung bei Typ 1-Überempfindlichkeitsreaktionen, Mastozytose,<br />
Mastozytom, CML, Polyzythämie vera, Urtikaria<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Histoplasma capsulatum-Antikörper (U)<br />
Synonyme: Histoplasmose<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Die Inkubationzeit beträgt ca. 5-18 Tage, das diagnostische Fenster beträgt ca.<br />
2-4 Wochen.<br />
Klinische Indikationen: Verdacht auf Histoplasmose bei Reiseanamnese (USA, mittlerer<br />
Westen) <strong>und</strong> Pneumonie, Lymphadenopathie, gastrointestinale Symptome, Hepatosplenomegalie,<br />
Tuberkulose-ähnliche Symptomatik<br />
Methode: RID<br />
Referenzbereiche: negativ<br />
HIV-1-RNA-Nachweis quantitativ<br />
Synonyme: HIV-1-PCR quantitativ, HIV-1-Viruslast<br />
Probenmaterial: 10 ml EDTA-Blut<br />
Abnahmehinweise: Therapie der HIV-Infektion<br />
Ausnahmekennziffer 32021<br />
Klinische Indikationen: Diagnose einer HIV-Infektion<br />
Verlaufskontrolle, Therapiemonitoring bei HIV-Infektion<br />
Methode: RT-PCR<br />
Referenzbereiche: negativ<br />
266 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
HIV-Antikörper (Bestätigung)<br />
HIV-Antikörper (Bestätigung)<br />
Synonyme: Westernblot, HIV-1, HIV-2<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster bis zum Nachweis von HIV-Antikörpern beträgt ca. 4<br />
bis 7 Wochen, in seltenen Einzelfällen auch bis zu 12-26 Wochen.<br />
Klinische Indikationen: Untersuchung von Seren, die im Suchtest reaktiv ausfallen. Aufgr<strong>und</strong> der<br />
epidemiologischen Situation in Deutschland wird zunächst der HIV-1-Westernblot durchgeführt. Eine<br />
Indikation für den HIV-2-Westernblot besteht bei entsprechender Anamnese.<br />
Methode: Immunoblot<br />
Referenzbereiche: negativ<br />
HIV-Antikörper (Suchtest)<br />
Synonyme: HIV-1, HIV-2, HIV-Subtyp O<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster bis zum Nachweis von HIV-Antikörpern beträgt ca. 4<br />
bis 7 Wochen, in seltenen Einzelfällen auch bis zu 12-26 Wochen.<br />
Klinische Indikationen: Verdacht auf eine HIV-Infektion.<br />
In der Frühphase der Infektion kann der HIV-Antikörpertest noch negativ ausfallen. In diesen Fällen<br />
sollte der direkte Erregernachweis durchgeführt werden (HIV-RNA-Nachweis qualitativ).<br />
Methode: CMIA<br />
Referenzbereiche: negativ<br />
HLA-A-,B-,C-Typisierung (U)<br />
Synonyme: Human Leucocyte Antigene, HLA-Klasse I<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Typisierung zur Abklärung der Gewebeverträglichkeit bei Transplantationen<br />
oder zur Beurteilung von Krankheitsassoziationen<br />
Methode: PCR-SSP<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
HLA-B*5701-Gentest (U)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Abacavir-Medikation ist bei HLA-B*5701 positiven Patienten aufgr<strong>und</strong> des<br />
hohen Risikos einer Hypersensitivitäts Reaktion (HSR) kontraindiziert<br />
Methode: PCR-SSP<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
HLA-B27<br />
Probenmaterial: 2 ml NH4-Heparin-Blut<br />
Klinische Indikationen: Abklärung des relativen Erkrankungsrisikos von Erkrankungen des rheuma-<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 267
Holo-Transcobalamin (W)<br />
tischen Formenkreises<br />
Methode: Durchflusszytometrie<br />
Referenzbereiche: negativ<br />
HLA-DR-, DP-, DQ-Typisierung (U)<br />
Synonyme: Human Leucocyte Antigene, HLA-Klasse II<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Für diese Untersuchung ist ein separates Röhrchen abzunehmen.<br />
Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Typisierung zur Abklärung der Gewebeverträglichkeit bei Transplantationen<br />
oder zur Beurteilung von Krankheitsassoziationen<br />
Methode: PCR-SSP<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
HLA-Typisierung (U)<br />
Synonyme: HLA-Klasse I, HLA-Klasse II<br />
Probenmaterial: 10 ml EDTA-Blut<br />
Abnahmehinweise: Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Zur Vermeidung einer Kontamination der Probe bitte ein separates Probenröhrchen einsenden.<br />
Falls Vorbereitung einer Stammzelltransplantation erfolgt, Probenröhrchen mit Namen, Vornamen <strong>und</strong><br />
Geburtsdatum beschriften <strong>und</strong> einen entsprechenden Vermerk auf dem Untersuchungsauftrag machen<br />
(Einsendung der Probe an ein EFI-akkreditiertes Labor erforderlich)<br />
Klinische Indikationen: Typisierung zur Abklärung der Gewebeverträglichkeit bei Transplantationen<br />
oder zur Beurteilung von Krankheitsassoziationen<br />
Methode: HLA-Klasse I-Antigene:<br />
serologische Typisierung<br />
HLA-Klasse II-Antigene:<br />
molekularbiologisch (PCR)<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Holo-Transcobalamin (W)<br />
Synonyme: Holo-TC<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Frühmarker zur Labordiagnose eines Vitamin B12-Mangels,<br />
insbesondere bei<br />
- Risikopatienten (ältere Menschen, Vegetarier, Alkoholiker)<br />
- Patienten mit gastrointestinalen Erkrankungen<br />
- Patienten mit neuropsychiatrischen Erkrankungen<br />
- Patienten mit makrozytärer Anämie<br />
Methode: MEIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
268 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Homocystein<br />
Homocystein<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme am nüchternen Patienten.<br />
Wird kein Stabilisator-Röhrchen verwendet, so sollte das Serum zur Vermeidung einer artifiziellen<br />
Freisetzung von Homocystein aus Erythrozyten bis spätestens 45 Minuten nach der Blutentnahme<br />
abgetrennt werden.<br />
Klinische Indikationen: Weitere Untersuchung bei Mangel an Vitamin B12, Vitamin B6 oder<br />
Folsäure, Abklärung des Arteriosklerose-Risikos, Thrombophilie-Diagnostik<br />
Methode: CMIA<br />
Referenzbereiche: Männer: 5,46 – 16,2 µmol/l<br />
Frauen: 4,44 – 13,56 µmol/l<br />
Homogentisinsäure im Urin (U)(N)<br />
Probenmaterial: 10 ml Spontanurin<br />
Abnahmehinweise: In Gegenwart von Luftsauerstoff färbt sich der Urin dunkel bis schwarz (bei<br />
basischem pH)<br />
Klinische Indikationen: Diagnostik der Alkaptonurie / Ochronose (Defekt der Homogentisinsäure-<br />
1-2-Dioxygenase)<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Homovanillinsäure im Urin<br />
Synonyme: HVMS, Katecholamie<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
(gesammelt in lichtgeschütztem Gefäß über 10 ml Salzsäure oder Eisessig)<br />
Abnahmehinweise: Bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Medikamente, sofern möglich, ca. 1 Woche vorher absetzen.<br />
Ab ca. 3 Tage vorher Vermeiden von Kaffee, Tee, Nikotin, Bananen, Käse, Nüssen, Schokolade, Eiern.<br />
Klinische Indikationen: Tumoren des sympatho-adrenergen Systems, Neuroblastome, episodenhafte<br />
oder therapieresistente Hypertonie, Inzidentalom, Familienuntersuchung<br />
Methode: HPLC<br />
Referenzbereiche: < 6,9 mg/24 St<strong>und</strong>en<br />
hPLAP (W)<br />
Synonyme: humane Alkalische Plazenta-Phosphatase<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle bei:<br />
Hodentumoren,<br />
Ovarialtumoren<br />
hPLAP-produzierende Tumoren<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 269
Humanes Herpes-Virus Typ 8-IgG-Antikörper (W)<br />
Humane granulozytäre Ehrlichiose-Antikörper (IgG) (W)<br />
Synonyme: HGE<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 7 (1 – 21) Tage.<br />
Klinische Indikationen: Verdacht auf HGE (humane granuozytäre Ehrlichiose), insbesondere nach<br />
Zeckenstich (ohne Erythema migrans) mit Kopfschmerzen, Muskelschmerzen, Übelkeit, Leukozytopenie,<br />
Thrombozytopenie sowie Transaminasenerhöhung im Serum<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Humane granulozytäre Ehrlichiose-Antikörper (IgM) (W)<br />
Synonyme: HGE<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 7 (1 – 21) Tage.<br />
Klinische Indikationen: Verdacht auf HGE (humane granuozytäre Ehrlichiose), insbesondere nach<br />
Zeckenstich (ohne Erythema migrans) mit Kopfschmerzen, Muskelschmerzen, Übelkeit, Leukozytopenie,<br />
Thrombozytopenie sowie Transaminasenerhöhung im Serum<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Humanes Herpes-Virus Typ 6-Antikörper<br />
Synonyme: HHV 6<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 5-15 Tage.<br />
Klinische Indikationen: Verdacht auf Exanthema subitum (3-Tage-Fiebe, hohe Durchseuchungsrate<br />
im Kleinkindesalter) bei Hepatitis, Roseola sine eruptione, Otitis, mononukleoseähnliche Symptome<br />
oder Meningoenzephalitis bei Kindern unter 4 Jahren.<br />
Methode: IFT<br />
Referenzbereiche: negativ<br />
Humanes Herpes-Virus Typ 7-Antikörper (W)<br />
Synonyme: HHV 7<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verdacht auf HHV 7-Infektion bei negativem HHV 6-Bef<strong>und</strong> (hohe<br />
Übereinstimmung beider Krankheitsbilder), zusätzlich bei Pityriasis rosea<br />
Methode: IFT<br />
Referenzbereiche: negativ (< 1:16 Titer)<br />
Humanes Herpes-Virus Typ 8-IgG-Antikörper (W)<br />
Synonyme: HHV 8<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verdacht auf HHV 8-Assoziation bei Auftreten von Kaposi-Sarkom, B-Zell-<br />
Lymphom oder Castleman-Erkrankung, insbesondere bei immunsupprimierten Patienten<br />
270 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: IFT<br />
Referenzbereiche: < 1:100 Titer<br />
Humanes Papilloma-Virus-DNA-Nachweis<br />
Humanes Papilloma-Virus-DNA-Nachweis<br />
Synonyme: HPV-PCR, High Risk HPV, Low Risk HPV<br />
Probenmaterial: Abstrich<br />
Abnahmehinweise: Spezialabstrichbesteck auf Anforderung<br />
Bei der Entnahme ausreichend zellhaltiges Material entnehmen.<br />
Abstrichtupfer in das Transportröhrchen geben.<br />
Klinische Indikationen: Weitere Untersuchung bei auffälligem zytologischen Zervix-<br />
Abstrichbef<strong>und</strong>, Ausschluss einer genitalen HPV-Infektion bei sonstigen unklaren Bef<strong>und</strong>en,<br />
Verlaufskontrolle nach Therapie, Partneruntersuchung bei nachgewiesener genitaler HPV-Infektion<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Humanes placentares Lactogen (U)(N)<br />
Synonyme: HPL<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bitte zusätzlich die Schwangerschaftswoche angeben<br />
Klinische Indikationen: Beurteilung der Plazentafunktion in der zweiten Schwangerschaftshälfte,<br />
insbesondere bei Risiko-Schwangerschaften<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hydrochlorothiazid (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Hydrochlorothiazid-Therapie<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hydroxybutyrat (U)<br />
Synonyme: β-Hydroxybuttersäure<br />
Probenmaterial: 1 ml Serum, gefroren<br />
Klinische Indikationen: Weitere Untersuchung (selektives Screening) bei Verdacht auf eine angeborene<br />
Stoffwechselerkrankung, insbesondere bei folgender<br />
Symptomatik von Neugeborenen <strong>und</strong> Säuglingen:<br />
Trinkunlust, Erbrechen, Gedeihstörung, Verschlechterung bei Nahrungszufuhr, sepsisähnliches<br />
Bild, Muskelhypotonie, Apathie, Somnolenz, Apnoen, Krampfanfälle, Koma oder auch<br />
Hirn/Ventrikelblutung beim Reifgeborenen.<br />
Symptomatik von Kleinkindern:<br />
Entwicklungsretardierung, Verlust erworbener Fähigkeiten, intermittierende Bewußtseinsveränderungen,<br />
neurologische Auffälligkeiten (Hypo/Hypertonie), Dysmorphien,<br />
Makrozephalus, Hepatosplenomegalie, Gedeihstörung, Wachstumsretardierung, Knochen-, Nieren-,<br />
Haut- oder Augenveränderungen.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 271
Hyperhomocysteinämie, hereditär<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hydroxyprolin im Urin (U)<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: Bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Urin gekühlt (+ 2°C – + 8°C) sammeln, gründlich mischen <strong>und</strong> dann ca. 10 ml entnehmen.<br />
Gelatinehaltige Nahrungsmittel wie Fleisch, Kraftbrühe, Pudding, Joghurt usw. bis zu 48 St<strong>und</strong>en<br />
vorher vermeiden.<br />
Klinische Indikationen: Störungen des Knochenstoffwechsels, Hyperparathyreoidismus, M. Paget,<br />
Akromegalie<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hydroxyprolin, frei (U)<br />
Probenmaterial: 1 ml EDTA-Plasma oder<br />
1 ml Liquor oder<br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins (gesammelt über 5 ml Eisessig)<br />
Abnahmehinweise: Urin: Bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht<br />
24 St<strong>und</strong>en) angeben.<br />
Urin gekühlt (+ 2°C – + 8°C) sammeln, gründlich mischen <strong>und</strong> dann ca. 10 ml entnehmen.<br />
Gelatinehaltige Nahrungsmittel wie Fleisch, Kraftbrühe, Pudding, Joghurt usw. bis zu 48 St<strong>und</strong>en<br />
vorher vermeiden.<br />
Klinische Indikationen: Weitere Diagnostik bei angeborenen Störungen des Stoffwechsels von Hydroxyprolin<br />
bei<br />
Iminoglcinurie<br />
klinisch symptomfrei<br />
Hyperprolinämie Typ I<br />
Nephropathie, Taubheit, photosensible Epilepsie, Demenz<br />
Hyperprolinämie Typ II<br />
Krämpfe, geistige Retardierung<br />
Hydroxyprolinämie<br />
bei Hyperparathyreoidismus, Osteodystrophia deformans, Knochenmetastasen<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Hyperhomocysteinämie, hereditär<br />
Synonyme: MTHFR<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Weitere Untersuchung im Rahmen der Thrombophilie-Diagnostik bzw. bei<br />
erhöhtem Homocysteinspiegel bzw. Folsäure-Mangel<br />
272 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: PCR<br />
Referenzbereiche: negativ<br />
Hypochrome Erythrozyten<br />
Synonyme: %HYPO<br />
Probenmaterial: korrekt gefüllte EDTA-Monovette<br />
Klinische Indikationen: Diagnose <strong>und</strong> Therapiemonitoring des Eisenmangels<br />
Referenzbereiche: < 5 % der Erythrozyten<br />
Ibuprofen (U)<br />
Synonyme: Handelsnamen: verschiedene z.B. Dolormin ® , Neuralgin ®<br />
Probenmaterial: 2 ml Serum<br />
Methode: HPLC<br />
Referenzbereiche: 15 – 30 mg/l<br />
IgA (sekretorisch) (U)<br />
Hypochrome Erythrozyten<br />
Probenmaterial: 1 ml Speichel<br />
Klinische Indikationen: Weitere Diagnostik bei IgA-Mangel oder bei rezidivierenden Infekten,<br />
Atopie oder auch Autoimmunerkrankungen<br />
Methode: RID<br />
Referenzbereiche: 8,7 – 47,0 mg/dl<br />
IgA im Liquor<br />
Probenmaterial: 1 ml Liquor<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen (Nachweis einer intrathekalen IgA-<br />
Synthese).<br />
Klinische Indikationen: Nachweis <strong>und</strong> Verlaufsbeurteilung einer intrathekalen IgA-Synthese<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
IgA im Serum<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: IgA-Mangel, IgA-Plasmozytom, Verdacht auf Imm<strong>und</strong>efekt<br />
Methode: Turbidimetrie / Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
IgA im Serum (allergenspezifisches) (W)<br />
Synonyme: RAST, spezifisches IgA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Spezielle Untersuchung im Rahmen der erweiterten Diagnostik<br />
Methode: FEIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 273
IgD im Serum (W)<br />
IgA im Stuhl (W)<br />
Probenmaterial: 2 g Stuhl<br />
Abnahmehinweise: Proben nach der Entnahme kühl (+ 2°C – + 8°C) lagern<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufsbeurteilung chronisch-entzündlicher<br />
Darmerkrankungen<br />
Methode: LIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
IgA im Urin (W)(N)<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
Abnahmehinweise: bitte Sammelmenge <strong>und</strong> Sammelzeit (wenn kleiner als 24 St<strong>und</strong>en) angeben.<br />
Der 2. Morgenurin ist dem 24-St<strong>und</strong>en-Sammelurin gleichwertig, wenn zuvor keine besondere<br />
körperliche Belastung stattgef<strong>und</strong>en hat oder keine polyurische Nierenerkrankung vorliegt.<br />
Klinische Indikationen: Monitoring eines IgA-Myeloms bei erhöhter Ausscheidung im Urin<br />
Methode: Nephelometrie<br />
Referenzbereiche: < 5.0 mg/d<br />
IgAκ (W)<br />
Synonyme: IgA-kappa<br />
Hevylite™<br />
Probenmaterial: 1 ml Serum<br />
Methode: Nephelometrie<br />
Referenzbereiche: 0,48 – 2,82 g/l<br />
IgAλ (W)<br />
Synonyme: IgA-lambda<br />
Hevylite™<br />
Probenmaterial: 1 ml Serum<br />
Methode: Nephelometrie<br />
Referenzbereiche: 0,36 – 1,98 g/l<br />
IgA-Subklassen (U)<br />
Synonyme: IgA 1, IgA 2<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Infektneigung (sinopulmonal, besonders Haemophilus spezies)<br />
Weitere Untersuchung bei niedrigem IgA im Serum<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
IgD im Serum (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufsbeurteilung einer monoklonalen Gammopathie Typ<br />
274 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
IgD; Hyper-IgD-Syndrom<br />
Methode: RID<br />
Referenzbereiche: < 140 mg/l<br />
IgE im Serum (allergenspezifisches)<br />
IgE im Serum (allergenspezifisches)<br />
Synonyme: RAST, spezifisches IgE<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Allergiediagnostik bei Kindern <strong>und</strong> Säuglingen,<br />
Belastbarkeit des Patienten für in-vivo-Teste vermindert (z.B. Verdacht auf hochgradige Sensibilisierung),<br />
Hautveränderungen im Bereich für Hautteste,<br />
bei Arzneimitteltherapie (z.B. Antihistaminika),<br />
Allergen im Hauttest nicht verfügbar,<br />
Verlaufskontrolle unter Immuntherapie<br />
Methode: FEIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
IgE im Serum (gesamt)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Allergiediagnostik <strong>und</strong> -verlaufskontrolle (Atopie-assoziierte Erkrankungen:<br />
Urtikaria, Quincke-Ödem, eosinophile Gastroenteritis, unklare Exantheme, Verdacht auf<br />
Arzneimittelallergien), Interpretationshilfe für allergenspezifisches IgE, bei eosinophilen Lungeninfiltraten,<br />
allergischer Alveolitits, Wegnersche Granulomatose, Churg-Strauss-Syndrom, Lymphome,<br />
Myelom, Aspergillose, Parasitosen (z.B. Filariose, Trichinose, Toxocariasis, Capillaria philipensis,<br />
tropische Eosinophilie), Imm<strong>und</strong>efekte, T-Zelldefekte, Hyper-IgE-Syndrom<br />
Methode: FEIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
IGFBP-3 (W)(N)<br />
Synonyme: Insulin Like Growth Factor Binding Protein-3<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise:<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Differentialdiagnostik von Wachstumsstörungen, insbesondere<br />
kindlicher Minderwuchs sowie Akromegalie<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
IgG 1<br />
Synonyme: IgG-Subklassen<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: → IgG-Subklassen, Seite 277<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 275
IgG im Serum (allergenspezifisches)<br />
IgG 2<br />
Synonyme: IgG-Subklassen<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: → IgG-Subklassen, Seite 277<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
IgG 3<br />
Synonyme: IgG-Subklassen<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: → IgG-Subklassen, Seite 277<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
IgG 4<br />
Synonyme: IgG-Subklassen<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: → IgG-Subklassen, Seite 277<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
IgG im Liquor<br />
Probenmaterial: 1 ml Liquor<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen (Nachweis einer intrathekalen IgG-<br />
Synthese).<br />
Klinische Indikationen: Nachweis <strong>und</strong> Verlaufsbeurteilung einer intrathekalen IgG-Synthese<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>berich<br />
IgG im Serum<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: IgG-Mangel, Monoklonale Gammopathie, Verdacht auf Imm<strong>und</strong>efekt,<br />
zusätzlich zur Bestimmung der → IgG-Subklassen, Seite 277<br />
Methode: Turbidimetrie / Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
IgG im Serum (allergenspezifisches)<br />
Synonyme: RAST, spezifisches IgG<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Weitere Untersuchung im Rahmen der Diagnostik<br />
Methode: FEIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
276 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
IgG im Urin<br />
IgG im Urin<br />
Probenmaterial: 5 ml Urin oder<br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: bitte Sammelmenge <strong>und</strong> Sammelzeit (wenn kleiner als 24 St<strong>und</strong>en) angeben.<br />
Der 2. Morgenurin ist dem 24-St<strong>und</strong>en-Sammelurin gleichwertig, wenn zuvor keine besondere<br />
körperliche Belastung stattgef<strong>und</strong>en hat oder keine polyurische Nierenerkrankung vorliegt.<br />
Klinische Indikationen: Differenzierung einer Proteinurie, Verlaufskontrolle <strong>und</strong> Beurteilung einer<br />
glomerulären Proteinurie<br />
Methode: Nephelometrie<br />
Referenzbereiche: < 8 mg/l<br />
IgGλ (W)<br />
Synonyme: IgG-lambda<br />
Hevylite™<br />
Probenmaterial: 1 ml Serum<br />
Methode: Nephelometrie<br />
Referenzbereiche: 1,97 – 5,71 g/l<br />
IgG, oligoklonal (Liquor/Serum)<br />
Synonyme: Oligoklonale Banden<br />
Probenmaterial: 1 ml Liquor <strong>und</strong><br />
1 ml Serum<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
Klinische Indikationen: → IgG-Quotient (Liquor/Serum)<br />
Methode: IEF<br />
Referenzbereiche: negativ<br />
IgG-Subklassen<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Abklärung gehäufter bakterieller Infekte bei Otitis, Pneumonie, sinubronchiales<br />
Syndrom, Meningitis,<br />
Bronchiektasen, Intrinsic Asthma bronchiale, Therapieresistentes Asthma bronchiale, IgA-Mangel,<br />
chronische Darmerkrankungen, Autoimmunerkrankungen<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Einzelparameter<br />
IgM im Liquor<br />
Probenmaterial: 1 ml Liquor<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen (Nachweis einer intrathekalen IgM-<br />
Synthese).<br />
Klinische Indikationen: Nachweis <strong>und</strong> Verlaufsbeurteilung einer intrathekalen IgM-Synthese<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 277
Immunfixationselektrophorese im Serum<br />
IgM im Serum<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: IgM-Mangel, monoklonale Gammopathie, M. Waldenström, Infektionen,<br />
Verdacht auf Imm<strong>und</strong>efekt, Autoimmunerkrankungen der Leber<br />
Methode: Turbidimetrie / Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
IgMκ (W)<br />
Synonyme: IgM-kappa<br />
Hevylite™<br />
Probenmaterial: 1 ml Serum<br />
Methode: Nephelometrie<br />
Referenzbereiche: 0,29 – 1,82 g/l<br />
IgMλ (W)<br />
Synonyme: IgM-lambda<br />
Hevylite™<br />
Probenmaterial: 1 ml Serum<br />
Methode: Nephelometrie<br />
Referenzbereiche: 0,17 – 0,94 g/l<br />
Imatinib (W)(N)<br />
Synonyme: Handelsname: Glivec ®<br />
Probenmaterial: 1 ml Serum<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Imipramin<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Imipramin-Therapie, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: 50 – 150 µg/l<br />
Immunfixationselektrophorese im Serum<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle (qualitativ) der monoklonalen Gammopathie<br />
bei<br />
Plasmozytom (Multiples Myelom),<br />
Monoklonale Gammopathie unbekannter Spezifität (MGUS),<br />
Lymphome (M. Waldenström u.a.),<br />
Leichtkettenkrankheit,<br />
278 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Schwerkettenkrankheit,<br />
Autoimmunerkrankungen<br />
mit/ohne auffälligem Bef<strong>und</strong> in der Eiweißelektrophorese im Serum<br />
Methode: IF<br />
Referenzbereiche: negativ<br />
Immunfixationselektrophorese im Urin<br />
Immunfixationselektrophorese im Urin<br />
Probenmaterial: 5 ml Urin<br />
Klinische Indikationen: Verdacht auf Bence-Jones-Proteinurie,<br />
Verdacht auf Paraproteinurie (bei monoklonaler Gammopathie, z.B. Plasmozytom),<br />
Abklärung einer unklaren Proteinurie<br />
Methode: IF<br />
Referenzbereiche: negativ<br />
Indometacin (W)<br />
Synonyme: NSAR<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Indometacin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 300 – 2500 ng/ml<br />
Influenza A-Virus-RNA-Nachweis<br />
Synonyme: Influenza A-PCR<br />
Probenmaterial: Rachenspülwasser<br />
Nasopharyngealabstrich<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 2 – 3 Tage<br />
Klinische Indikationen: Verdacht auf eine Influenza-Infektion, insbesondere bei entsprechender<br />
Anamnese, plötzlich einsetzendem hohen Fieber, Kopf- <strong>und</strong> Gliederschmerzen, ggf. auch Pneumonie<br />
<strong>und</strong> selten Meningoenzephalitits<br />
Methode: RT-PCR<br />
Referenzbereiche: negativ<br />
Influenza A/B-Virus-Serologie<br />
Synonyme: Virusgrippe<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 2-3 Tage; das diagnostische Fenster bis zum serologischen<br />
Nachweis ca. 7-14 Tage.<br />
Klinische Indikationen: Verdacht auf Virusgrippe<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 279
Interferon-Antikörper (W)<br />
Influenza B-Virus-RNA-Nachweis<br />
Synonyme: Influenza B-PCR<br />
Probenmaterial: Rachenspülwasser<br />
Nasopharyngealabstrich<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 2 – 3 Tage<br />
Klinische Indikationen: Verdacht auf eine Influenza-Infektion, insbesondere bei entsprechender<br />
Anamnese, plötzlich einsetzendem hohen Fieber, Kopf- <strong>und</strong> Gliederschmerzen, ggf. auch Pneumonie<br />
<strong>und</strong> selten Meningoenzephalitits<br />
Methode: RT-PCR<br />
Referenzbereiche: negativ<br />
Inhibin B (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Frauen: Abklärung der ovariellen Restfunktion im Rahmen einer Fertilitätstherapie,<br />
Tumormarker für Granulosazelltumoren des Ovars.<br />
Männer: Funktionsmarker der Sertolizellen, Weitere Diagnostik bei Störungen der FSH-Sekretion<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
INR<br />
Synonyme: International Normalisierte Ratio, Quick<br />
Probenmaterial: 1 ml Citratblut<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Beurteilung einer oralen Antikoagulanzien-Therapie mit Vitamin K-<br />
Antagonisten in der stabilen Phase<br />
Methode: Koagulometrie<br />
Referenzbereiche: 2,0 – 3,5<br />
Insulin<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nüchtern (12 St<strong>und</strong>en Nahrungskarenz)oder im Rahmen einer<br />
Funktonsdiagnostik (Entnahmezeit angeben), zur Vermeidung einer Hämolyse Vollblut innerhalb von<br />
30 Minuten nach Entnahme zentrifugieren <strong>und</strong> Serum abpipettieren<br />
Klinische Indikationen: Insulinom, Hypoglycaemia factitia, Diabetes mellitus<br />
Methode: CLIA<br />
Referenzbereiche: 3,2 – 16,3 µIE/ml<br />
Interferon-Antikörper (W)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Weitere Untersuchung im Verlauf einer Interferon-Therapie (z.B. bei chronischer<br />
Hepatitis B oder chronischer Hepatitis C)<br />
Methode: EIA<br />
Referenzbereiche: < 0,25 U/ml<br />
280 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Interleukin 1 (W)<br />
Interleukin 1 (W)<br />
Synonyme: IL-1-beta<br />
Probenmaterial: 1 ml Serum, tiefgefroren<br />
Abnahmehinweise: Wegen der geringen Stabilität das Blut bitte nach der Abnahme zentrifugieren,<br />
das Serum in ein separates Röhrchen ohne Zusätze abpipettieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von<br />
- Transplantatabstoßung<br />
- chronische Entzündungen<br />
- Imm<strong>und</strong>efekte<br />
Methode: CLIA<br />
Referenzbereiche: < 5 pg/ml<br />
Interleukin 28B Genotypisierung (IL28B) OMIM #609532 (N)<br />
Synonyme: IL28B<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32005<br />
Klinische Indikationen: Abschätzung der Therapie-Prognose einer Hepatitis C-Infektion bei Patienten<br />
mit HCV-Genotyp 1<br />
Methode: PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Interleukin 6 (U)<br />
Synonyme: IL-6<br />
Probenmaterial: 1 ml Serum, tiefgefroren<br />
Abnahmehinweise: Wegen der geringen Stabilität das Blut bitte nach der Abnahme zentrifugieren,<br />
das Serum in ein separates Röhrchen ohne Zusätze abpipettieren <strong>und</strong> einfrieren (ca. – 20°C).<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von Akute-Phase-Reaktionen, insbesondere<br />
Prognoseparameter bei Sepsis, Trauma <strong>und</strong> Herzoperationen<br />
Methode: CBA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Interleukin 8 (W)<br />
Synonyme: IL-8<br />
Probenmaterial: 1 ml Serum, tiefgefroren<br />
Abnahmehinweise: Wegen der geringen Stabilität das Blut bitte nach der Abnahme zentrifugieren,<br />
das Serum in ein separates Röhrchen ohne Zusätze abpipettieren <strong>und</strong> einfrieren (ca. – 20°C).<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von Akute-Phase-Reaktionen, insbesondere<br />
Prognoseparameter bei Sepsis, Trauma <strong>und</strong> Herzoperationen<br />
Methode: LIA<br />
Referenzbereiche: < 62 pg/ml<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 281
Jod im Urin (W)<br />
Isoniazid (W)<br />
Synonyme: INH<br />
Probenmaterial: 1 ml Serum, lichtgeschützt, tiefgefroren<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Isoniazid-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: 1 – 8 mg/l<br />
Isopropanol im Blut (U)<br />
Synonyme: 2-Propanol<br />
Probenmaterial: 2 ml EDTA-Blut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Bitte Rollrändröhrchen anfordern.<br />
Klinische Indikationen: Beurteilung der Belastung mit Isopropanol<br />
Methode: GC/FID<br />
Referenzbereiche: < 0,5 mg/l<br />
Itraconazol (W)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Itraconazol-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
JC-(Polyoma)-Virus-DNA-Nachweis<br />
Synonyme: JC-Virus-PCR<br />
Probenmaterial: 3 ml EDTA-Blut<br />
1 ml Liquor<br />
Klinische Indikationen: Weitere Diagnostik bei PML (progressive multifokale Leukenzephalopathie),<br />
insbesondere bei Patienten mit Immunsuppression<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Jod im Serum (W)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Beurteilung von Jodintoxikation bzw. Jodmangel<br />
Methode: ICP/MS<br />
Referenzbereiche: 40 – 80 µg/l<br />
Jod im Urin (W)<br />
Probenmaterial: 5 ml Spontanurin oder<br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Diagnose <strong>und</strong> Beurteilung von Jodintoxikation bzw. Jodmangel<br />
282 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Kalium im Dialysat<br />
Probenmaterial: 1 ml Dialysat<br />
Klinische Indikationen: Qualitätskontrolle von Dialysat<br />
Methode: ISE<br />
Kalium im Serum<br />
Kalium im Dialysat<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum bei längerem Probentransport<br />
abzentrifugiert werden.<br />
Klinische Indikationen: Hypertonie, Herzrhythmusstörungen, Einnahme von Diuretika <strong>und</strong> Laxantien,<br />
Niereninsuffizienz, Durchfälle, Erbrechen, Störungen im Säure-Basen-Haushalt, Hypo- <strong>und</strong><br />
Hyperaldosteronismus<br />
Methode: ISE<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Kalium im Urin<br />
Probenmaterial: 5 ml Spontanurin oder<br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Weitere Diagnostik bei Hyper- <strong>und</strong> Hypokaliämie<br />
Methode: ISE<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Kälte-Agglutinine<br />
Synonyme: Kälte-Autoantikörper<br />
Probenmaterial: 9 ml EDTA-Blut, das warm (bei 37°C) bebrütet <strong>und</strong> zentrifugiert wird. Der<br />
Überstand sollte dann abpippetiert werden. Bitte sowohl Überstand als auch Blutkuchen im eigenen<br />
Röhrchen einsenden.<br />
Abnahmehinweise: Blutproben von der Entnahme bis zum Eintreffen ins Labor warm (ca. +37°C)<br />
halten oder das Serum/Plasma warm gewinnen <strong>und</strong> íns Labor transportieren<br />
Klinische Indikationen: V.a. akut-passagere oder chronische Kälteagglutininkrankheit, hämolytische<br />
Anämie, hyperchrome Anämie, lymphoproliferative Erkrankungen, Infektionen,<br />
Methode: Agglutination<br />
Referenzbereiche: negativ<br />
Kappa-/Lambda-Quotient im Serum<br />
Synonyme: FLC<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle/Monitoring bei:<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 283
Katzenkratzkrankheit-Serologie (W)<br />
- Bence Jones Myelom (BJP, LCMM)<br />
- Nonsekretorisches Myleom (NSM)<br />
- Leichtketten-Amyloidose (AL)<br />
- Multiples Myelom mit Leichtkettenbeteiligung (MM)<br />
- Monoklonale Gammopathie unbekannter Spezifität (MGUS)<br />
- Weitere Diagnostik bei nachgewiesener monoklonale Gammopathie<br />
Methode: Turbidimetrie<br />
Referenzbereiche: 0,26 – 1,65<br />
Katecholamine im Plasma (W)<br />
Probenmaterial: 3 ml EDTA-Plasma<br />
Abnahmehinweise: Vor der Blutentnahme Stress-Situationen vermeiden;<br />
Medikamente, sofern möglich, ca. 1 Woche vorher absetzen;<br />
ab ca. 3 Tage vorher Vermeiden von Kaffee, Tee, Nikotin, Bananen, Käse, Nüsse, Schokolade, Eier;<br />
Blutentnahme nach ca. 30 Minuten Ruhe (Liegen);<br />
Blut direkt nach der Entnahme zentrifugieren <strong>und</strong> das Plasma abpipettieren <strong>und</strong> einfrieren (ca. -20°C)<br />
Klinische Indikationen: Tumoren des sympatho-adrenergen Systems, Neuroblastome, episodenhafte<br />
oder therapieresistente Hypertonie, Inzidentalom, Familienuntersuchung<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Katecholamine im Urin<br />
Synonyme: Katecholamine<br />
Probenmaterial: 20 ml eines 24-St<strong>und</strong>en-Sammelurins (gesammelt über 5-10 ml Salzsäure)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Medikamente, sofern möglich, ca. 1 Woche vorher absetzen;<br />
ab ca. 3 Tage vorher Vermeiden von Kaffee, Tee, Nikotin, Bananen, Käse, Nüsse, Schokolade, Eier<br />
Klinische Indikationen: Tumoren des sympatho-adrenergen Systems, Neuroblastome, episodenhafte<br />
oder therapieresistente Hypertonie, Inzidentalom, Familienuntersuchung<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Katzenkratzkrankheit-Serologie (W)<br />
Synonyme: bazilläre Angiomatose<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 2-4 Wochen<br />
Klinische Indikationen: Verdacht auf Katzenkratzkrankheit nach Verletzung durch eine Katze<br />
<strong>und</strong> Auftreten von regiönärer Lymphadenitis, Kopfschmerzen, Gliederschmerzen, Appetitlosigkeit,<br />
Übelkeit, Arthralgien, Exanthem, Thrombopenie, Parotisschwellung<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
284 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Kobalt im Blut (U)<br />
Synonyme: Cobalt<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Beurteilung <strong>und</strong> Abschätzung der Cobalt-Belastung<br />
Methode: ICP/MS<br />
Referenzbereiche: < 0,4 µg/l<br />
Kobalt im Haar (W)<br />
Synonyme: Cobalt<br />
Probenmaterial: 1 g Haar vom Haaransatz (Hinterkopf)<br />
Klinische Indikationen: Beurteilung <strong>und</strong> Abschätzung der Cobalt-Belastung<br />
Methode: ICP/MS<br />
Referenzbereiche: 0,006 – 0,044 µg/g<br />
Kobalt im Urin (U)<br />
Synonyme: Cobalt<br />
Probenmaterial: 5 ml Urin<br />
Klinische Indikationen: Beurteilung <strong>und</strong> Abschätzung der Cobalt-Belastung<br />
Methode: ICP/MS<br />
Referenzbereiche: < 1,0 µg/l<br />
Konkrementanalyse (W)<br />
Kobalt im Blut (U)<br />
Synonyme: Gallensteine, Harnsteine, Nierensteine<br />
Probenmaterial: Konkremente in sterilen Röhrchen<br />
Abnahmehinweise: Bei Verdacht auf Nephrolithiasis ggf. Urin bei der Miktion sieben <strong>und</strong> aufgefangene<br />
Konkremente einschicken<br />
Klinische Indikationen: Weitere Diagnostik zur Ursachenabklärung bei Nephrolithiasis bzw.<br />
Cholelithiasis.<br />
Methode: IR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Kreatinin im Serum<br />
Synonyme: Creatinin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose der eingeschränkten glomerulären Filtrationsrate (GFR) bei:<br />
Hypertonie, akute/chronische Nierenerkrankung, Screening, Diabetes mellitus, Hyperurikämie, Enteritis,<br />
akuter Flüssigkeitsverlust, Schwangerschaft<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Kreatinin im Urin<br />
Synonyme: Creatinin<br />
Probenmaterial: 5 ml Spontanurin oder<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 285
Kryptosporidien-Antigen im Stuhl<br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Diagnose der eingeschränkten glomerulären Filtrationsrate (GFR) bei:<br />
Hypertonie, akute/chronische Nierenerkrankung, Screening, Diabetes mellitus, Hyperurikämie, Enteritis,<br />
akuter Flüssigkeitsverlust, Schwangerschaft<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Kreatinin-Clearance (N)<br />
Probenmaterial: 1 ml Serum <strong>und</strong><br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Beurteilung der glomerulären Filtrationsrate bzw. Verlaufskontrolle unter<br />
potentiell nephrotoxischer Medikation<br />
Methode: Photometrie<br />
Referenzbereiche: 90 – 170 ml/min<br />
Kryoglobuline<br />
Probenmaterial: 9 ml Vollblut <strong>und</strong> ggf. 9 ml Citrat-Blut, das warm (bei 37°C) bebrütet <strong>und</strong> zentrifugiert<br />
wird. Der Überstand sollte dann abpippetiert werden. Bitte den Überstand in eigenem<br />
Röhrchen einsenden.<br />
Abnahmehinweise: Blutentnahme mit vorgewärmter (37 °C) Kanüle <strong>und</strong> Monovette. Blutproben von<br />
der Entnahme bis zum Eintreffen ins Labor warm (ca. +37°C) halten oder das Serum/Plasma warm<br />
gewinnen (Blut im Brutschrank gerinnen bzw. sedimentieren lassen, Serum/Plasma dann abpipettieren),<br />
Serum/Plasma kann dann gekühlt (+2°C – +8°C) ins Labor transportiert werden<br />
Klinische Indikationen: - Systemischer Lupus erythematodes<br />
- Sjögren-Syndrom, Sicca-Syndrom<br />
- Raynaud-Phänomen<br />
- Plasmozytom / M. Waldenström <strong>und</strong> andere lymphoproliferative Erkrankungen<br />
- chronische Hepatitis C-Infektion<br />
- Purpura<br />
- Arthralgien, Arthritis<br />
- Glomerulonephritis<br />
- vaskulitische Neuromyopathie<br />
- andere Autoimmunerkrankungen<br />
Methode: Agglutination<br />
Referenzbereiche: negativ<br />
Kryptosporidien-Antigen im Stuhl<br />
Synonyme: Cryptosporidien, Gastroenteritis<br />
Probenmaterial: 2 g Stuhl<br />
Klinische Indikationen: Verdacht auf Infektion mit Kryptosporidien, insbesondere bei Kleinkindern<br />
<strong>und</strong> Immunsupprimierten (HIV-Patienten, Transplantation, Chemotherapie) mit Diarrhoe<br />
286 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: EIA<br />
Referenzbereiche: negativ<br />
Kupfer im Serum<br />
Kupfer im Serum<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bei der Blutentnahme nur kurz Stauen. Zur Vermeidung einer Hämolyse sollte<br />
das Blut nach der Gerinnung zentrifugiert <strong>und</strong> das Serum abpipettiert werden.<br />
Klinische Indikationen: Verdachf auf M. Wilson, Menkes-Synsdrom, Kupfermangel (bei eisenrefraktärer<br />
Anämie)<br />
Methode: Photometrie<br />
Referenzbereiche: Männer: 70 – 140 µg/dl<br />
Frauen: 80 – 155 µg/dl<br />
Kupfer im Urin (W)(N)<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Verdacht auf M. Wilson, Menkes-Syndrom, Kupfermangel (bei eisenrefraktärer<br />
Anämie)<br />
Methode: AAS<br />
Referenzbereiche: < 40 µg/24h<br />
Lacosamid (W)<br />
Synonyme: Handelsname: Vimpat ®<br />
Probenmaterial: 1 ml Serum<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Lactat im Liquor (W)<br />
Probenmaterial: 1 ml Liquor<br />
Abnahmehinweise: bei Probentransport > 3 St<strong>und</strong>en Abnahme in NaF-Röhrchen<br />
Klinische Indikationen: Entzündliche, vaskuläre, metabolische <strong>und</strong><br />
neoplasmatische ZNS-Erkrankungen<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Lactat im Plasma (W)<br />
Synonyme: Laktat im Plasma<br />
Probenmaterial: 3 ml NaF-Plasma<br />
Abnahmehinweise: Blutentnahme möglichst aus ungestauter Vene, zur Vermeidung von Hämolyse<br />
<strong>und</strong> iatrogenem Lactatanstieg in der Probe muss das Blut unmittelbar nach der Blutentnahme zentrifugiert<br />
<strong>und</strong> das Plasma abpipettiert werden.<br />
Klinische Indikationen: Laktatazidose, Leistungsdiagnostik im Sport<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 287
Lamivudin (U)(N)<br />
Methode: EIA<br />
Referenzbereiche: 0,63 – 2,44 mmol/l<br />
Lactat im Punktat (W)(N)<br />
Synonyme: Laktat im Punktat<br />
Probenmaterial: 1 ml Punktat<br />
Klinische Indikationen: Differenzierung entzündlicher Erkrankungen<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Laktoferrin im Stuhl (W)<br />
Synonyme: Lactoferrin<br />
Probenmaterial: 1 g Stuhl<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle entzündlicher Darmerkrankungen<br />
Methode: EIA<br />
Referenzbereiche: < 7 µg/g Stuhl<br />
Laktoseintoleranz-Polymorphismus (MCM6-Gen)<br />
Synonyme: Hereditäre adulte Laktoseintoleranz (OMIM223100)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Molekulargenetische Diagnostik der Laktose-intoleranz bei klinischem Verdacht:<br />
- gastrointestinale Symptomatik nach Genuss von Kuhmilch-Produkten<br />
- Colon irritabile<br />
- länger anhaltenter gastrointestinaler Symptomatik unklarer Genese<br />
- chronische Diarrhoe unklarer Genese<br />
- familiär bekannte Laktose-Intoleranz<br />
- fraglicher Bef<strong>und</strong> des Laktose-Toleranztestes<br />
- fraglicher Bef<strong>und</strong> des H2-Atemtestes<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Lamivudin (U)(N)<br />
Synonyme: Handelsname: Zeffix ®<br />
Probenmaterial: 2 ml Serum oder EDTA-Plasma<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Lamivudin-Therapie der chronischen Hepatitis B<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
288 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Lamotrigin<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme direkt vor der nächsten Medikamenteinnahme<br />
Klinische Indikationen: Monitoring einer Lamotrigin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 3,0 – 14,0 mg/l<br />
LBP (W)<br />
Lamotrigin<br />
Synonyme: Lipopolysaccharid-Bindeprotein<br />
Probenmaterial: 2 ml Serum, EDTA- oder Heparin-Plasma<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle von Akute-Phase-Reaktionen wie Infektionen,<br />
SIRS, Sepsis<br />
Methode: CLIA<br />
Referenzbereiche: < 8,4 µg/ml<br />
LDH<br />
Synonyme: Laktat-Dehydrogenase<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse das Serum/Plasma bei längerem Probentransport<br />
abzentrifugieren<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung des Myokardinfarktes <strong>und</strong> von Lebererkrankungen<br />
sowie bei Lungenembolie, Hämolyse, Tumoren<br />
Methode: UV-Test<br />
Referenzbereiche: Erwachsene: < 250 U/l<br />
LDH im Punktat (N)<br />
Probenmaterial: 1 ml Punktat<br />
Klinische Indikationen: Differenzierung zwischen Exsudat <strong>und</strong> Transsudat<br />
Methode: UV-Test<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LDH-Isoenzyme (U)<br />
Synonyme: Laktat-Dehydrogenase-Isoenzyme<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse das Serum/Plasma bei längerem Probentransport<br />
abzentrifugieren<br />
Klinische Indikationen: Differenzierung einer LDH-Erhöhung<br />
Methode: Elektrophorese<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LDL-Cholesterin<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nüchtern (ca. 12 St<strong>und</strong>en Nahrungskarenz), langes Stauen vermei-<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 289
Leishmania donovani-Antikörper (W)(N)<br />
den<br />
Klinische Indikationen: Diagnose, Differentialdiagnose <strong>und</strong> Verlaufsbeurteilung von Fettstoffwechselstörungen,<br />
Verlaufskontrolle unter lipidsenkender Therapie<br />
Methode: Enzymatischer Farbtest<br />
Referenzbereiche: < 100 mg/dl<br />
LDL-Cholesterin-Subfraktionen (W)(N)<br />
Synonyme: LipoPrint-Lipoproteinprofil<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: individuelle Risikoeinschätzung für kardiovaskuläre Ereignisse (z.B. Herzinfarkt,<br />
Schlaganfall), Prävention koronarer Herzerkrankung, Therapiekontrolle<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Legionella pneumophilia-DNA-Nachweis<br />
Synonyme: Legionellen-PCR<br />
Probenmaterial: Sputum<br />
BAL<br />
Trachealsekret<br />
Klinische Indikationen: Verdacht auf Legionellose, insbesondere bei Pneumonie<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Legionellen-Serologie<br />
Synonyme: Legionärskrankheit<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 2-10 Tage. Das diagnostische Fenster für die<br />
serologische Diagnostik kann mehrere Wochen betragen.<br />
Klinische Indikationen: Verdacht auf Legionellen-Infektion, insbesondere bei grippeähnlichen<br />
Symptomen <strong>und</strong> atypischer Pneumonie oder bei nosokomialer Pneumonie<br />
Methode: IFT<br />
Referenzbereiche: negativ (< 1:100)<br />
Leishmania donovani-Antikörper (W)(N)<br />
Synonyme: Kala Azar<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit kann 10 Tage bis zu 2 Jahre betragen<br />
Klinische Indikationen: Verdacht auf Kala Azar (viszerale Leishmaniose) nach Aufenthalt in<br />
Endemiegebieten (Südeuropa, Russland, Mittelmeerraum, Naher Osten, Ost- <strong>und</strong> Zentralafrika,<br />
Südamerika, China, Indien). Die Erreger werden durch Sandmücken übertragen.<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
290 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Leptin (U)<br />
Leptin (U)<br />
Probenmaterial: 2 ml Serum, EDTA- oder Heparin-Plasma<br />
Klinische Indikationen: Weitere Untersuchung im Rahmen der Betreuung von Patienten mit<br />
Übergewicht (Adipositas)<br />
Methode: EIA<br />
Referenzbereiche: Frauen: 3,6 – 11,1 ng/ml<br />
Männer: 2,05 – 5,63 ng/ml<br />
Leptospiren-Antikörper (U)<br />
Synonyme: Morbus Weil<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. (2) 7-13 (26) Tage, das diagnostische Fenster beträgt<br />
ca. 10-14 Tage.<br />
Bei klinischem Verdacht auf Leptospirose ist der direkte Erregernachweis die Methode der Wahl.<br />
Klinische Indikationen: Verdacht auf Lepotospirose bei Veterinären, Kanalarbeitern, Landwirten,<br />
Fischern, Wassersportlern, Campern, sowie Risikoanamnese (Kontakt mit infizierten Tieren) <strong>und</strong> klinischen<br />
Symptomen wie: Fieber, Kopfschmerz, Schüttelfrost, Muskelschmerzen, Wadenschmerzen,<br />
Hepatitis, Nephritis, Meningitis, hohes Bilirubin, mäßig erhöhte Transaminasen.<br />
Methode: EIA<br />
Referenzbereiche: IgG: < 10 U/ml<br />
IgM: < 15 U/ml<br />
Leukämie- <strong>und</strong> Lymphom-Diagnostik (U)<br />
Synonyme: Immunphänotypisierung<br />
Probenmaterial: 8 ml EDTA-Blut<br />
Klinische Indikationen: Immunologische Charakterisierung von Zellen des peripheren Blutes bzw.<br />
Knochenmarkes bei bzw. im Rahmen von:<br />
- unklarer Lymphozytose<br />
- Charakterisierung der Lymphomzellen<br />
- Charekterisierung der Non-Hodgkin-Lymphomzellen<br />
- Monitoring lymphatischer Neoplasien<br />
- Charakterisierung myeloischer Hämoblastosen (Leukämien)<br />
- Rezidiverkennung<br />
- Therapiemonitoring<br />
Methode: Durchflusszytometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Levetiracetam<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme direkt vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Levetiracetam-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 10 – 37 µg/ml<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 291
Lipidelektrophorese (W)<br />
Levodopa (W)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Monitoring einer Levodopa-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 0,2 – 4,0 mg/l<br />
Levomepromazin (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Levomepromazin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LH<br />
Synonyme: Luteinisierendes Hormon, ICSH<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von Störungen der Ovarfunktion (Zyklusstörungen,<br />
Sterilitätsdiagnostik, Hormonersatztherapie) bzw. der Hodenfunktion (pathologischer<br />
Testosteronspiegel)<br />
Methode: ECLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Lidocain (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme während der laufenden Infusion empfohlen<br />
Klinische Indikationen: Monitoring einer Lidocain-Therapie<br />
Methode: FPIA<br />
Referenzbereiche: 1,5 – 5,0 mg/l<br />
Lipase<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle einer Pankreatitis oder einer Parotitis,<br />
Abklärung akuter Oberbauchbeschwerden,<br />
Pankreaskarzinom,<br />
Kontrolle nach ERCP<br />
Methode: Enzymatischer Farbtest<br />
Referenzbereiche: 13 – 60 U/l<br />
Lipidelektrophorese (W)<br />
Synonyme: Lipoprotein-Elektrophorese<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nüchtern (nach ca. 12 St<strong>und</strong>en Nahrungskarenz)<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Differenzierung von Störungen des Fettstoffwechsels<br />
292 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: Elektrophorese<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LipoDens-Lipoproteinprofil<br />
LipoDens-Lipoproteinprofil<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Auf eine ausreichende Nüchternphase vor der Blutentnahme (ca.12 St<strong>und</strong>en) ist<br />
zu achten<br />
Klinische Indikationen: Verdacht auf Lipidstoffwechselstörungen<br />
Referenzbereiche: LDL/HDL: < 3,0<br />
Lipoprotein X (U)(N)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Weitere Untersuchung bei Primär biliärer Zirrhose (PBC) <strong>und</strong> Verdacht auf<br />
Cholestase<br />
Methode: Elektrophorese<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Lipoprotein(a)<br />
Synonyme: Lp(a)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik von Risikofaktoren für die Entwicklung einer Arteriosklerose/KHK.<br />
Therapiekontrolle bei Vollblut-Apherese (Absenkung von Lp(a) um mindestens<br />
50% pro Behandlung)<br />
Methode: Nephelometrie<br />
Referenzbereiche: < 25 mg/dl<br />
Lipoprotein-assoziierte Phospholipase A2 (W)(N)<br />
Synonyme: Lp-PLA2, PLAC ® -Test<br />
Probenmaterial: 2 ml Serum<br />
Referenzbereiche: < 200 mg/dl<br />
Listeria monocytogenes DNA-Nachweis (W)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
3 ml Liquor<br />
Klinische Indikationen: V.a. Infektion (z.B. bei Immunsupprimmierten, gelegentlich in Gravidität)<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Listerien-Antikörper (W)(N)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Inkubationszeit <strong>und</strong> diagnostisches Fenster können Tage bis Wochen betragen.<br />
Der direkte Erregernachweis ist die Methode der Wahl.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 293
Löslicher Interleukin 2-Rezeptor (W)<br />
Klinische Indikationen: Verdacht auf Listerose, insbesondere bei Immungeschwächten <strong>und</strong> Schwangeren<br />
mit Risikokontakt (kontaminierte Lebensmittel) <strong>und</strong> Symptomen wie grippeähnliche Beschwerden,<br />
Schüttelfrost sowie ZNS-Syndrom;<br />
Eine Listerieninfektion in der Gravidität kann zu Abort, Totgeburt oder einer fetalen Schädigung<br />
führen.<br />
Methode: KBR<br />
Referenzbereiche: < 1 : 8 Titer<br />
Lithium<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme ca. 12 St<strong>und</strong>en nach der letzten Lithiumeinnahme<br />
Klinische Indikationen: Therapiekontrolle <strong>und</strong> -beurteilung bei Lithiumtherapie,<br />
Abklärung toxischer Lithiumwirkungen bei Muskelzucken, Ataxie, Schläfrigkeit, Krämpfen, Dehydratation<br />
Methode: Photometrie<br />
Referenzbereiche: 0,6 – 1,2 mmol/l<br />
Lorazepam (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Lorazepam-Therapie, Missbrauchskontrolle<br />
Methode: LC/MS<br />
Referenzbereiche: 20 – 250 µg/l<br />
Lormetazepam (U)(N)<br />
Synonyme: Handelsname: Noctamid ®<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Lormetazepam-Therapie, Missbrauchskontrolle<br />
Referenzbereiche: bis 25 ng/ml<br />
Löslicher Interleukin 2-Rezeptor (W)<br />
Synonyme: sIL-2-R<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse Vollblut zentrifugieren <strong>und</strong> Serum abpipettieren<br />
vor dem Versand.<br />
Klinische Indikationen: Verlaufskontrollen nach Organtransplantation,<br />
Verlaufsbeurteilung der Sarkoidose<br />
Methode: CLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
294 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Löslicher Transferrin-Rezeptor (W)<br />
Löslicher Transferrin-Rezeptor (W)<br />
Synonyme: sTfR<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Verdacht auf Funktionseisenmangel, Abklärung niedrig-normaler Ferrinwerte,<br />
Differentialdiagnostik der Anämien, Frühzeitige Abschätzung des Eisenbedarfs bei Risikogruppen<br />
für einen Eisenmangel, Diagnostik des Eisenmangels bei Schwangerschaft, chronischen<br />
Erkrankungen<br />
Methode: Nephelometrie<br />
Referenzbereiche: 0,83 – 1,76 mg/l<br />
LSD im Urin (W)<br />
Synonyme: Lysergsäurediethylamid<br />
Probenmaterial: 5 ml Urin (ohne Zusätze)<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle des Konsums/Missbrauchs von LSD<br />
Methode: CEDIA<br />
Referenzbereiche: negativ<br />
Lues-Serologie (Stufendiagnostik)<br />
Synonyme: Treponema pallidum, Syphilis<br />
Probenmaterial: 4 ml Serum<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle sowie Therapiebeurteilung einer Lues-<br />
Infektion (Syphilis)<br />
Methode: s. Einzelparameter<br />
Referenzbereiche: s. Einzelparameter<br />
Lupusantikoagulanz<br />
Synonyme: LA<br />
Probenmaterial: 3 ml Citrat-Blut<br />
Abnahmehinweise: Citrat-Blut per Botendienst gleichtägig ins Labor.<br />
Haltbarkeit: 4 St<strong>und</strong>en.<br />
Bei längeren Transportzeiten sollte das Citrat-Blut möglichst 1 St<strong>und</strong>e nach der Blutabnahme zentrifugiert<br />
werden (2000 g, 10 min.). Überstand (Citrat-Plasma) ohne Verletzung der Leukozytenschicht<br />
zwischen Plasma <strong>und</strong> Erythrozyten abheben <strong>und</strong> in ein neues Probenröhrchen ohne Zusätze<br />
überführen. Vor dem Einfrieren sollte das Plasma ein zweites Mal zentrifugiert <strong>und</strong> der Überstand in<br />
ein neues Röhrchen abgefüllt werden.<br />
Das Plasma bei ca. – 20 °C einfrieren <strong>und</strong> im Kühlbehälter versenden.<br />
Beim Einfrieren des Citrat-Plasmas werden Phospholipide aus den Rest-Thrombozyten freigesetzt,<br />
die zu einer Verkürzung der Gerinnungszeit <strong>und</strong> somit zu fasch negativen Ergebnissen führen können.<br />
Klinische Indikationen: Antiphospholipid-Antikörper-Syndrom<br />
Abklärung einer unklaren aPTT-Verlängerung,<br />
Thrombophilie-Diagnostik,<br />
Autoimmunerkrankungen (Lupus erythematodes),<br />
Abklärung rez. Aborte,<br />
Thrombozytopenie unklarer Ursache<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 295
Lysozym im Urin (U)<br />
Methode: Koagulometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Lycopene (W)<br />
Synonyme: Antioxidantien<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Wegen der geringen Stabilität bitte das Vollblut nach der Abnahme <strong>und</strong> Gerinnung<br />
zentrifugieren, das Serum in ein separates Röhrchen ohne Zusätze abpipettieren <strong>und</strong> einfrieren<br />
(ca. – 20°C)<br />
Klinische Indikationen: Verdacht auf Antioxidantien-Mangel<br />
Methode: HPLC<br />
Referenzbereiche: 100 – 800 µg/l<br />
Lymphotrope Erreger<br />
Lymphozytendifferenzierung<br />
Synonyme: Immunstatus<br />
Probenmaterial: korrekt gefüllte EDTA-Monovette<br />
Abnahmehinweise: EDTA-Monovette direkt nach der Abnahme durch Schwenken gründlich mischen<br />
Klinische Indikationen: Primäre <strong>und</strong> sek<strong>und</strong>äre Imm<strong>und</strong>efekte, Monitoring der HIV-Infektion<br />
Methode: Durchflußzytometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Lysozym im Liquor (W)<br />
Probenmaterial: 1 ml Liquor<br />
Abnahmehinweise: Liquor steril abnehmen <strong>und</strong> gekühlt (+ 2°C – + 8°C) lagern<br />
Klinische Indikationen: Weitere Diagnostik bei Verdacht auf bakterielle Meningitis. Die Untersuchung<br />
hat aktuell keine wesentliche Bedeutung mehr.<br />
Methode: RID<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Lysozym im Serum (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blut nach der Entnahme gekühlt (+ 2°C – + 8°C) lagern<br />
Klinische Indikationen: Differentialdiagnostik <strong>und</strong> Verlaufsbeurteilung von Leukosen,<br />
Neugeborenen-Sepsis<br />
Methode: RID<br />
Referenzbereiche: 10 – 17 mg/l<br />
Lysozym im Urin (U)<br />
Probenmaterial: 10 ml Urin<br />
Abnahmehinweise: Urin nach der Entnahme gekühlt lagern (+ 2°C – + 8°C)<br />
296 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Klinische Indikationen: Monitoring bei Leukosen/Leukämien,<br />
Diagnostik tubulärer Nierenschädigungen,<br />
Diagnostik/Monitoring von Transplantat-Abstoßungsreaktionen<br />
Methode: Turbidimetrie<br />
Referenzbereiche: < 0,3 mg/l<br />
Magnesium im Serum<br />
Magnesium im Serum<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Neuromuskuläre Übererregbarkeit (Tremor, Muskelzucken, Tetanie),<br />
gastrointestinale <strong>und</strong> kardiale Beschwerden (Rhythmusstörungen,<br />
Kontrolle einer Diuretikatherapie<br />
Methode: Photometrie<br />
Referenzbereiche: Erwachsene: 0,7 – 1,07 mmol/l<br />
Kinder: s. Bef<strong>und</strong>bericht<br />
Magnesium im Urin<br />
Probenmaterial: 1 ml Spontanurin oder<br />
1 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Beurteilung der Magnesiumausscheidung bei Hypo- oder Hypermagnesiämie<br />
Methode: Photometrie<br />
Referenzbereiche: Spontanurin: 41 – 138 mg/l<br />
Sammelurin: 73 – 122 mg/24h<br />
Malaria-Antikörper (U)<br />
Synonyme: Plasmodien-Antikörper<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Diagnostik nach Tropenaufenthalt, Ausschluss eines Plasmodienkontaktes<br />
bei Verdacht auf latente Malaria<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Malondialdehyd (U)(N)<br />
Synonyme: MDA<br />
Probenmaterial: 2 ml EDTA-Plasma<br />
Abnahmehinweise: Blut unmittelbar nach der Blutentnahme zentrifugieren, Plasma abpipettieren <strong>und</strong><br />
einfrieren (- 20°C <strong>und</strong> tiefer), Blutentnahme im Labor empfohlen.<br />
Klinische Indikationen: Beurteilung der Lipidoxidation im Rahmen der Einwirkung des oxidativen<br />
Stresses<br />
Methode: HPLC<br />
Referenzbereiche: < 2,0 µmol/l<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 297
Masern-Virus-Antikörper (IgG, Liquor/Serum)<br />
Mandelsäure im Urin (U)<br />
Probenmaterial: 10 ml Spontanurin<br />
Klinische Indikationen: Beurteilung der Belastung mit Ethylbenzol bzw. Styrol<br />
Methode: HPLC<br />
Referenzbereiche: < 10 mg/g Krea<br />
Mangan im Blut (U)<br />
Probenmaterial: 2 ml EDTA- oder Vollblut<br />
Abnahmehinweise: Blutentnahme nach Expositions- bzw. Schichtende<br />
Klinische Indikationen: Beurteilung der Manganbelastung<br />
Methode: AAS<br />
Referenzbereiche: 0,3 – 0,9 µg/l<br />
Mangan im Urin (U)<br />
Probenmaterial: 5 ml Urin<br />
Abnahmehinweise: Entnahme nach Expositions- bzw. Schichtende<br />
Klinische Indikationen: Beurteilung der Manganbelastung<br />
Methode: AAS<br />
Referenzbereiche: < 1,9 µg/l<br />
Maprotilin<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Maprotilin-Therapie, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: 100 – 250 µg/l<br />
Masern-Serologie<br />
Synonyme: Morbilli, SSPE<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 9-12 Tage.<br />
Klinische Indikationen: Diagnose einer Masern-Virus-Infektion, besonders bei Fieber mit trockenem<br />
Husten sowie Konjunktivitis, Kopliksche Flecken <strong>und</strong> makulopapulöses Exanthem,<br />
Überprüfung der Immunität nach Impfung (IgG-Ak)<br />
Methode: ELISA<br />
Referenzbereiche: IgG: negativ (< 150 mIU/ml)<br />
IgM: negativ (< 10 U/ml)<br />
Masern-Virus-Antikörper (IgG, Liquor/Serum)<br />
Synonyme: Masern-AI, MRZ-Reaktion<br />
Probenmaterial: 1 ml Liquor <strong>und</strong> 1 ml Serum<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
298 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
MDRD-Clearance<br />
Klinische Indikationen: Nachweis einer intrathekalen IgG-Synthese gegen Masern-Virus bei akuten<br />
<strong>und</strong> auch chronischen ZNS-Erkrankungen.<br />
Methode: EIA<br />
Referenzbereiche: 0,6 – 1,5 Index<br />
MDRD-Clearance<br />
Synonyme: Modification of Diet Renal Disease, GFR<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Für die Berechnung sind zusätzlich folgende Angaben notwendig:<br />
- Alter<br />
- Geschlecht<br />
- Hinweis auf schwarze Hautfarbe<br />
Klinische Indikationen: Berechnung der glomerulären Filtrationsrate aus Serum-Parametern nach<br />
den Europäischen Guidelines zur Bestimmung der GFR bei Patienten mit Niereninsuffizienz.<br />
Referenzbereiche: GFR: 80 – 140 ml/m/1,73<br />
Mebendazol (U)(N)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Monitoring einer Mebendazol-Therapie.<br />
Methode: HPLC<br />
Referenzbereiche: < 150 ng/ml<br />
Medikamentennachweis im Urin (U)<br />
Synonyme: qualitativ<br />
Probenmaterial: 10 ml Urin<br />
Abnahmehinweise: ggf. Probennahme überwachen<br />
Klinische Indikationen: Suchtest zum Nachweis des Gebrauchs einer der genannten Substanzen<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Medroxyprogesteron (U)<br />
Synonyme: MPA<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer MPA-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 100 – 500 ng/ml<br />
Melanin im Urin (U)(N)<br />
Synonyme: Melanogen im Urin<br />
Probenmaterial: 10 ml Urin<br />
Klinische Indikationen: Verdacht auf erhöhte Ausscheidung von Melanin<br />
Methode: Photometrie<br />
Referenzbereiche: negativ<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 299
Metanephrin im Urin (W)<br />
Melatonin (W)<br />
Probenmaterial: 2 ml Serum, EDTA- oder Heparin-Plasma<br />
Abnahmehinweise: Das Blut bitte innerhalb von 30 Minuten nach der Abnahme zentrifugieren, das<br />
Serum in ein separates Röhrchen abpipettieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Die klinische Wertigkeit der Bestimmung von Melatonin wird kontrovers<br />
diskutiert.<br />
Methode: RIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Melperon (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Melperon-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: Therapeutischer Bereich: 100 – 200 µg/l<br />
Met-Hämoglobin (W)<br />
Synonyme: Met-Hb, Methämoglobin, Hämiglobin, Hi<br />
Probenmaterial: 2 ml EDTA-Vollblut oder<br />
6,5 ml Hämolysat (0,5 ml EDTA-Blut mit 6 ml bidest)<br />
Abnahmehinweise: Hämolysat (0,5 ml EDTA-Blut mit 6 ml H2O bidest., gut schütteln)<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung der hereditären oder toxischen Met-<br />
Hämoglobinämie<br />
Methode: Photometrie<br />
Referenzbereiche: < 1 % des Gesamt-Hb<br />
Metanephrin im Plasma (W)<br />
Synonyme: Katecholamine<br />
Probenmaterial: 3 ml EDTA-Plasma<br />
Abnahmehinweise: Vor der Blutentnahme Stress-Situationen vermeiden;<br />
Medikamente, sofern möglich, ca. 1 Woche vorher absetzen;<br />
ab ca. 3 Tage vorher Vermeiden von Kaffee, Tee, Nikotin, Bananen, Käse, Nüsse, Schokolade, Eier;<br />
Blutentnahme nach ca. 30 Minuten Ruhe (Liegen);<br />
Blut direkt nach der Entnahme zentrifugieren <strong>und</strong> das Plasma abpipettieren <strong>und</strong> einfrieren (ca. -20°C)<br />
Klinische Indikationen: Tumoren des sympatho-adrenergen Systems, Neuroblastome, episodenhafte<br />
oder therapieresistente Hypertonie, Inzidentalom, Familienuntersuchung<br />
Methode: RIA<br />
Referenzbereiche: < 90 ng/l<br />
Metanephrin im Urin (W)<br />
Synonyme: Katecholamine<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (gesammelt über 5-10 ml Salzsäure)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
300 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methadon im Urin<br />
Medikamente, sofern möglich, ca. 1 Woche vorher absetzen;<br />
ab ca. 3 Tage vorher Vermeiden von Kaffee, Tee, Nikotin, Bananen, Käse, Nüsse, Schokolade, Eier<br />
Klinische Indikationen: Tumoren des sympatho-adrenergen Systems, Neuroblastome, episodenhafte<br />
oder therapieresistente Hypertonie, Inzidentalom, Familienuntersuchung<br />
Methode: HPLC<br />
Referenzbereiche: < 350 µg/24h<br />
Methadon im Urin<br />
Probenmaterial: 10 ml Urin<br />
Abnahmehinweise: ggf. Probennahme überwachen<br />
Klinische Indikationen: Suchtest zum Nachweis des Gebrauchs von Methadon<br />
Methode: EIA<br />
Referenzbereiche: < 300 ng/ml<br />
Methanol im Blut (U)<br />
Probenmaterial: 2 ml Vollblut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Bitte Rollrändröhrchen anfordern.<br />
Klinische Indikationen: Beurteilung der Methanolbelastung<br />
Methode: GC/MS<br />
Referenzbereiche: < 1,5 mg/l<br />
Methanol im Urin (W)<br />
Probenmaterial: 10 ml Spontanurin<br />
Klinische Indikationen: Beurteilung der Methanolbelastung<br />
Methode: GC<br />
Referenzbereiche: < 10 mg/l<br />
Methotrexat<br />
Synonyme: MTX<br />
Probenmaterial: 1 ml Serum<br />
Material lichtgeschützt einsenden<br />
Abnahmehinweise: Blutentnahme 24, 48 oder 72 St<strong>und</strong>en nach Infusionsbeginn (Gabe), bei<br />
verzögerter Elimination ggf. weitere Abnahmen<br />
Klinische Indikationen: Monitoring einer Methotrexat-Therapie<br />
Methode: FPIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Methsuximid (U)<br />
Synonyme: Mesuximid<br />
Probenmaterial: 2 ml Serum<br />
Methode: HPLC<br />
Referenzbereiche: 10 – 40 mg/l<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 301
Mexiletin (U)<br />
Methylhippursäure gesamt im Urin (W)<br />
Probenmaterial: 2 ml Urin<br />
Abnahmehinweise: Probennahme am Ende der Exposition (Schichtende)<br />
Klinische Indikationen: Beurteilung der Methylhippursäurebelastung im Rahmen der Beurteilung<br />
der Xylolbelastung<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Methylhistamin (U)<br />
Synonyme: N-Methylhistamin<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (gesammelt über 5 ml Eisessig)<br />
Abnahmehinweise: Histaminreiche Nahrungsmittel sollten vermieden werden: bestimmte Käse- <strong>und</strong><br />
Wurst-Sorten (Salami, Schinken), Sauerkraut, Spinat, Tomaten, Rot-/Weißwein, Sekt, Bier <strong>und</strong> verschiedene<br />
Fischarten (Thunfisch, Sardinen, Makrelen)<br />
Klinische Indikationen: Mastozytose, Flush-Symptomatik, allergische Reaktionen<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Methylmalonsäure (W)<br />
Synonyme: MMS<br />
Probenmaterial: 4 ml Serum<br />
Abnahmehinweise: Das Blut nach der Abnahme <strong>und</strong> ggf. Gerinnung zentrifugieren, das<br />
Serum/Plasma in ein separates Röhrchen (ohne Zusätze) abpipettieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Weitere Untersuchung bei grenzwertig vermindertem Vitamin B12-Bef<strong>und</strong><br />
(latenter Vitamin B12-Mangel) oder bei nicht ansprechender Therapie<br />
Kinder mit Verdacht auf Methylmalonazidurie bei Trinkschwäche, Gedeihstörungen, Erbrechen,<br />
Kampfanfällen im Neugeborenenalter<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Methylphenidat (U)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme ca. 2 – 3 St<strong>und</strong>en nach oraler Gabe.<br />
Probe bitte lichtgeschützt lagern.<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Methylphenidat-Therapie. Die Bestimmung<br />
des unwirksamen Metaboliten Ritalinsäure kann zur Plausibiltätskontrolle herangezogen werden.<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Mexiletin (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Mexiletin-Therapie<br />
302 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Mianserin (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Mianserin-Therapie<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Micropolyspora faeni-Antikörper (IgG)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Serologische Diagnostik bei exogen-allergischer Alveolitis:<br />
- Farmerlunge<br />
- Befeuchterlunge<br />
- Holzstaublunge<br />
- Pilzzüchterlunge<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Midazolam (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Midazolam-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Mikrosomale Antikörper<br />
Synonyme: MAK<br />
Probenmaterial: 1 ml Serum, EDTA-Plasma<br />
Methode: ECLIA<br />
Referenzbereiche: < 34 IU/ml<br />
Mirtazapin (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise:<br />
Klinische Indikationen: Monitoring einer Mirtazapin-Therapie<br />
Methode: LC/MS<br />
Referenzbereiche: 30 – 80 µg/l<br />
Moclobemid (U)(N)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Moclobemid-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Mianserin (U)<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 303
Mumps-Virus-Antikörper (IgG, Liquor/Serum)<br />
Molybdän im Serum (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Verdacht auf Molybdän-Mangel bei Malabsortion, nach Darmresektion oder<br />
langer parenteraler Ernährung, Beurteilung der Molybdän-Belastung<br />
Methode: ICP/MS<br />
Referenzbereiche: 0,3 – 1,2 µg/l<br />
Molybdän im Urin (U)<br />
Probenmaterial: 10 ml Urin<br />
Klinische Indikationen: Verdacht auf Molybdän-Mangel bei Malabsortion, nach Darmresektion oder<br />
langer parenteraler Ernährung, Beurteilung der Molybdän-Belastung<br />
Methode: ICP/MS<br />
Referenzbereiche: 7 – 94 µg/l<br />
MRSA-Schnelltest<br />
Synonyme: Methicillinresistenter Staphylococcus aureus-Schnelltest<br />
Probenmaterial: Hautabstriche von Nasenvorhof, Rachen, perianal, Achsel, Leiste, Haaransatz, Decubitus,<br />
W<strong>und</strong>en (ggf. auch als Poolabstriche von mehreren Stellen)<br />
Abnahmehinweise: Abstrichtupfer ohne Transportmedium für PCR-Nachweis<br />
Nachfolgend zusätzlich Abstrichtupfer mit Transportmedium verwenden (ggf. Resistenztestung <strong>und</strong><br />
Typisierung bei positivem Bef<strong>und</strong><br />
Klinische Indikationen: Ermittlung einer Besiedlung mit MRSA in Krankenhäusern, operativen Einrichtungen,<br />
Alters- <strong>und</strong> Pflegeheimen, insbesondere bei Neuaufnahmen<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Mumps-Serologie<br />
Synonyme: Parotis epidemica, Ziegenpeter<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit bzw. das diagnostische Fenster beträgt ca. 16-18 Tage<br />
Klinische Indikationen: Diagnose einer Mumps-Virus-Infekton, besonders bei Parotitis, Orchitis,<br />
Salpingitis, Meningitis bzw.<br />
Überprüfung der Immunitätslage nach Impfung (IgG-Ak).<br />
Methode: EIA<br />
Referenzbereiche: IgG: negativ (< 70 U/ml)<br />
IgM: negativ (< 10 U/ml)<br />
Mumps-Virus-Antikörper (IgG, Liquor/Serum)<br />
Synonyme: Mumps-AI<br />
Probenmaterial: 1 ml Liquor <strong>und</strong> 1 ml Serum<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
Klinische Indikationen: Nachweis einer intrathekalen IgG-Synthese gegen Mumps-Virus bei akuten<br />
<strong>und</strong> auch chronischen ZNS-Erkrankungen.<br />
304 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: EIA<br />
Referenzbereiche: 0,6 – 1,5 Index<br />
Mutterschaftsvorsorge<br />
Mutterschaftsvorsorge<br />
Synonyme: Mutterschaftsrichtlinien, Schwangerenvorsorge<br />
Probenmaterial: siehe Einzelparameter<br />
Abnahmehinweise: Für die Blutguppen-Serologie ist eine NUR für diesen Zweck bestimmte Blutprobe<br />
(separate Monovette) erforderlich. Auf eine eindeutige Kennzeichnung (z.B. mit Namen, Vornamen<br />
<strong>und</strong> Geburtsdatum) ist zu achten.<br />
Klinische Indikationen:<br />
Mycobacterium tuberculosis-Komplex-DNA-Nachweis<br />
Synonyme: Tbc-PCR, Tuberkulose<br />
Probenmaterial: je nach Indikation:<br />
Sputum<br />
BAL<br />
Biopsie<br />
Urin<br />
Liquor<br />
Magensaft<br />
Klinische Indikationen: Verdacht auf Tuberkulose, Abklärung eines positiven mikroskopischen Bef<strong>und</strong>es.<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Mycophenolat Mofetil (W)<br />
Synonyme: MMF, Mycophenolsäure, MPA, CellCept ®<br />
Probenmaterial: 2 ml Serum oder EDTA-Plasma<br />
Abnahmehinweise: Das Blut bitte unmittelbar nach der Abnnahme (<strong>und</strong> ggf. Gerinnung des Vollblutes)<br />
zenrifugieren, das Serum bzw. Plasma in ein separates Röhrchen ohne Zusätze abpipettieren<br />
<strong>und</strong> einfrieren (ca. – 20°C) Zur Bestimmung einer AUC (Area <strong>und</strong>er Curve)-Kinetik benötigen wir je<br />
eine Blutentnahme vor der nächsten Gabe <strong>und</strong> 20, 40, 75 <strong>und</strong> 120 Minuten nach der Einnahme.<br />
Klinische Indikationen: Monitoring der Therapie mit Mycophenolat mofetil<br />
Methode: LC-MS/MS<br />
Referenzbereiche: Talspiegel: 1,0 – 3,5 mg/l<br />
Mycoplasma pneumoniae-DNA-Nachweis<br />
Synonyme: M. pneumoniae-PCR<br />
Probenmaterial: Sputum<br />
BAL<br />
Trachealsekret<br />
Klinische Indikationen: Verdacht auf M. pneumoniae-Infektion bei atypischer Pneumonie, Bronchitis,<br />
Meningoenzephalitis oder Otitis media<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 305
Myoglobin im Urin (W)<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Mycoplasmen-Antikörper<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 10-14 Tage.<br />
Klinische Indikationen: Verdacht auf Infektion mit Mycoplasma pneumoniae, insbesondere bei atypischer<br />
Pneumonie <strong>und</strong> bei akuten Erkrankungen des Respirationstraktes, auch bei Otitis media, Exanthem,<br />
Myokarditis, Perikarditis<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Mykobakterium tuberculosis-spezifische T-Lymphozyten<br />
Synonyme: T-SPOT.TB, TB-Elispot, Interferon-gamma-release-assay (IGRA)<br />
Probenmaterial: 9 ml Lithium-Heparinblut<br />
Kinder: 3 – 5 ml Lithium-Heparinblut<br />
Abnahmehinweise: Blut tagesgleich ins Labor.<br />
Lagerung bei Raumtemperatur.<br />
Klinische Indikationen: Der T-SPOT.TB ergänzt bzw. ersetzt den Tuberkulin-Hauttest.<br />
Er ist ein Test zum Ausschluss einer Tuberkulose bei<br />
- Verdacht auf eine aktive oder latente Tuberkulose<br />
- Verdacht auf extrapulmonale Tuberkulose<br />
- Umgebungsuntersuchung von Kontaktpersonen<br />
- Screening von Risikopatienten für eine Tuberkulose<br />
- Screening von Personen im Ges<strong>und</strong>heitswesen<br />
- vor Beginn einer immunsuppressiven Therapie (z.B. Biologicals)<br />
Methode: Eli-Spot<br />
Referenzbereiche: negativ<br />
Myoglobin im Serum (W)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung des Myokardinfarktes, von<br />
Skelettmuskelerkrankungen, Leistungsbeurteilung von Sportlern<br />
Methode: Nephelometrie<br />
Referenzbereiche: 10 – 85 ng/ml<br />
Myoglobin im Urin (W)<br />
Probenmaterial: 5 ml Spontanurin<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufsbeurteilung von Skelettmuskelerkrankungen sowie<br />
im Bereich der Leistungsdiagnostik in der Sportmedizin<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
306 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
N-Acetylglucosaminidase (W)<br />
N-Acetylglucosaminidase (W)<br />
Synonyme: β-NAG<br />
Probenmaterial: 2 ml Urin<br />
Klinische Indikationen: Verdacht auf tubuläre Nierenschädigung, Tay-Sachs-Syndrom, Sandhoff-<br />
Syndrom<br />
Methode: Photometrie<br />
Referenzbereiche: < 5 U/g Krea<br />
N-Desmethyl-Tamoxifen (U)<br />
Probenmaterial: 1 ml Serum, lichtgeschützt<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Tamoxifen-Therapie<br />
Methode: LC/MS<br />
Referenzbereiche: 120 – 240 µg/l<br />
Naproxen (U)(N)<br />
Synonyme: NSAR<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Naproxen-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 25 – 75 µg/ml<br />
Natrium im Dialysat (N)<br />
Probenmaterial: 1 ml Dialysat<br />
Klinische Indikationen: Qualitätskontrolle von Dialysat<br />
Methode: ISE<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Natrium im Serum/Plasma<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden, langes Stauen vermeiden<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von Störungen im Flüssigkeits- <strong>und</strong> Elektrolythaushalt<br />
oder des Säure-Basen-Haushaltes, Polyurie <strong>und</strong> Polydypsie, Nierenerkrankungen, Hypertonie,<br />
Hyper- <strong>und</strong> Hypoaldosteronismus<br />
Methode: ISE<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Natrium im Urin (N)<br />
Probenmaterial: 1 ml Spontanurin oder<br />
1 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 307
Neopterin im Urin (W)<br />
Klinische Indikationen: Verlaufskontrolle bei Diuretikatherapie, Abklärung einer Hypo- <strong>und</strong> Hypernatriämie<br />
(Hyper- <strong>und</strong> Hypoaldosteronismus), Niereninsuffizienz<br />
Methode: ISE<br />
Referenzbereiche: Sammelurin: 40 – 220 mmol/24h<br />
Spontanurin: 54-150 mmol/l<br />
Natürliche Killerzellen<br />
Synonyme: NK-Zellen<br />
Probenmaterial: 1 ml EDTA-Blut<br />
Abnahmehinweise: EDTA-Monovette direkt nach der Abnahme durch Schwenken gründlich mischen<br />
Klinische Indikationen: Primäre <strong>und</strong> sek<strong>und</strong>äre Imm<strong>und</strong>efekte<br />
Methode: FC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Neisseria gonorrhoeae-DNA-Nachweis<br />
Synonyme: Go-PCR, Gonokokken-PCR<br />
Probenmaterial: 10 ml Morgenurin (Anfangsstrahl)<br />
Abstrich<br />
Abnahmehinweise: Spezialabstrichbesteck auf Anforderung<br />
Klinische Indikationen: Verdacht auf N. gonorrhoeae-Infektion bei Urethritis (Männer), Zervizitis,<br />
Adnexitis, Lymphadenitis inguinale<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Neopterin (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von Erkrankungen mit erhöhter zellulärer<br />
Aktivität: Infektionen, Autoimmunerkrankungen, maligne Erkrankungen, Abstoßungsreaktionen nach<br />
Transplantation<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Neopterin im Urin (W)<br />
Probenmaterial: 5 ml Urin<br />
Abnahmehinweise: Den Urin lichtgeschützt <strong>und</strong> tiefgefroren (ca. – 20°C) lagern.<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von Erkrankungen mit erhöhter zellulärer<br />
Aktivität: Infektionen, Autoimmunekrankungen, maligne Erkrankungen, Abstoßungsreaktionen nach<br />
Transplantation<br />
Methode: EIA<br />
Referenzbereiche: < 220 µmol/mol Kreatinin<br />
308 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Netilmicin (W)<br />
Synonyme: Netilmycin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Netilmicin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Nicht-tuberkulöse Mykobakterien, NTM-DNA-Nachweis<br />
Netilmicin (W)<br />
Synonyme: NTM-PCR, Tuberkulose<br />
Probenmaterial: je nach Indikation:<br />
Sputum<br />
BAL<br />
Biopsie<br />
Urin<br />
Liquor<br />
Magensaft<br />
Klinische Indikationen: Verdacht auf Infektion mit nichttuberkulösen Mykobakterien (NTM), insbesonder<br />
bei Patienten mit Immunsuppression<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Nickel im Blut (W)(N)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Probennahme nach Expositionszeit (Schichtende)<br />
Klinische Indikationen: Beurteilung der Nickelbelastung, Intoxikation<br />
Methode: AAS<br />
Referenzbereiche: < 1,0 µg/l<br />
Nickel im Urin (U)(N)<br />
Probenmaterial: 5 ml Urin<br />
Abnahmehinweise: Probennahme nach Expositionsende (Schichtende)<br />
Klinische Indikationen: Beurteilung der Nickelbelastung, Intoxikation<br />
Methode: AAS<br />
Referenzbereiche: < 5 µg/l<br />
Nicotinamid (W)<br />
Synonyme: Niacin, Vitamin PP, Vitamin B3<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Probe nach der Abnahme lichtgeschützt (mit Alufolie umwickeln) lagern<br />
Klinische Indikationen: Verdacht auf Niacinmangel (Pellagra)<br />
Methode: LC-MS/MS<br />
Referenzbereiche: 8 – 52 µg/l<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 309
Noradrenalin im Urin<br />
Nitrazepam (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Monitoring einer Nitrazepam-Therapie, Diagnostik von Missbrauch <strong>und</strong><br />
Abhängigkeit<br />
Methode: HPLC<br />
Referenzbereiche: 40 – 120 µg/l<br />
NMP22 (W)<br />
Synonyme: Nuclear matrix protein 22<br />
Probenmaterial: Urin (spezielles Stabilisatorgefäß)<br />
Abnahmehinweise: Die Verweildauer des Urins in der Blase sollte mindestens 2 St<strong>und</strong>en betragen.<br />
Die Untersuchung sollte NICHT durchgeführt werden bei Harnwegsinfektionen, vorhandenen Steinen<br />
sowie Fremdkörpern wie Dauerkatheter<br />
Klinische Indikationen: Verlaufskontrolle bei Harnblasenkarzinom,<br />
Sreening von Personen mit hohem Risiko für die Entwicklung eines Harnblasenkarzinoms (Raucher,<br />
Arbeiter in chemischen Betrieben<br />
Methode: EIA<br />
Referenzbereiche: < 10 U/ml<br />
Noradrenalin im Plasma (W)<br />
Synonyme: Katecholamine<br />
Probenmaterial: 3 ml EDTA-Plasma<br />
Abnahmehinweise: Vor der Blutentnahme Stress-Situationen vermeiden; Medikamente, sofern<br />
möglich, ca. 1 Woche vorher absetzen; ab ca. 3 Tage vorher Vermeiden von Kaffee, Tee, Nikotin,<br />
Bananen, Käse, Nüsse, Schokolade, Eier; Blutentnahme nach ca. 30 Minuten Ruhe (Liegen); Blut direkt<br />
nach der Entnahme zentrifugieren <strong>und</strong> das Plasma abpipettieren <strong>und</strong> einfrieren (ca. -20°C)<br />
Klinische Indikationen: Tumoren des sympatho-adrenergen Systems, Neuroblastome, episodenhafte<br />
oder therapieresistente Hypertonie, Inzidentalom, Familienuntersuchung<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Noradrenalin im Urin<br />
Synonyme: Katecholamine<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (gesammelt über 5-10 ml Salzsäure)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Medikamente, sofern möglich, ca. 1 Woche vorher absetzen;<br />
ab ca. 3 Tage vorher Vermeiden von Kaffee, Tee, Nikotin, Bananen, Käse, Nüsse, Schokolade, Eier<br />
Klinische Indikationen: Tumoren des sympatho-adrenergen Systems, Neuroblastome, episodenhafte<br />
oder therapieresistente Hypertonie, Inzidentalom, Familienuntersuchung<br />
Methode: HPLC<br />
Referenzbereiche: < 97 µg/24 Std.<br />
310 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Normetanephrin im Plasma (W)<br />
Normetanephrin im Plasma (W)<br />
Synonyme: Katecholamine<br />
Probenmaterial: 2 ml EDTA-Plasma, tiefgefroren<br />
Abnahmehinweise: Vor der Blutentnahme Stress-Situationen vermeiden;<br />
Medikamente, sofern möglich, ca. 1 Woche vorher absetzen;<br />
ab ca. 3 Tage vorher Vermeiden von Kaffee, Tee, Nikotin, Bananen, Käse, Nüsse, Schokolade, Eier;<br />
Blutentnahme nach ca. 30 Minuten Ruhe (Liegen);<br />
Blut direkt nach der Entnahme zentrifugieren <strong>und</strong> das Plasma abpipettieren <strong>und</strong> einfrieren (ca. -20°C)<br />
Klinische Indikationen: Tumoren des sympatho-adrenergen Systems, Neuroblastome, episodenhafte<br />
oder therapieresistente Hypertonie, Inzidentalom, Familienuntersuchung<br />
Methode: RIA<br />
Referenzbereiche: < 180 ng/l<br />
Normetanephrin im Urin (W)<br />
Synonyme: Katecholamine<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (gesammelt über 5-10 ml Salzsäure)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Medikamente, sofern möglich, ca. 1 Woche vorher absetzen;<br />
ab ca. 3 Tage vorher Vermeiden von Kaffee, Tee, Nikotin, Bananen, Käse, Nüsse, Schokolade, Eier<br />
Klinische Indikationen: Tumoren des sympatho-adrenergen Systems, Neuroblastome, episodenhafte<br />
oder therapieresistente Hypertonie, Inzidentalom, Familienuntersuchung<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Noro-Virus-RNA-Nachweis im Stuhl<br />
Synonyme: Noro-Virus-PCR, Norwalk-like-Virus, Enteritis<br />
Probenmaterial: 2 g Stuhl<br />
Klinische Indikationen: Verdacht auf Noro-Virus-Infektion, insbesondere bei Diarrhoe, Gastroenteritis<br />
<strong>und</strong> Enteritis<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Nortriptylin im Serum<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Beurteilung einer Nortriptylintherapie<br />
Methode: HPLC<br />
Referenzbereiche: 50 – 250 µg/l<br />
NSE<br />
Synonyme: Neuronenspezifische Enolase<br />
Probenmaterial: 1 ml Serum<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 311
Ortho-Kresol (W)<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Blut nach der Gerinnung zentrifugiert<br />
<strong>und</strong> das Serum abpipettiert werden.<br />
Klinische Indikationen: Therapie <strong>und</strong> Verlaufskontrolle neuroendokriner Tumoren <strong>und</strong> APUDOMen<br />
Methode: EIA<br />
Referenzbereiche: < 16,3 ng/ml<br />
NSE im Liquor (N)<br />
Probenmaterial: 1 ml Liquor<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung von<br />
- hypxischen Hirnschäden (Hirninfarkt)<br />
- Creutzfeldt-Jakob-Erkrankung<br />
Methode: EIA<br />
Referenzbereiche: < 5 – 20 ng/ml<br />
O-Desmethyl-Venlafaxin (W)<br />
Synonyme: SNRI, O-DMV<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Bitte beachten Sie, dass bei Verwendung von gelhaltigen Röhrchen die Resultate<br />
niedriger ausfallen können. Wir empfehlen, das Blut 30 min nach Abnahme zu zentrifugieren, das<br />
Serum abzutrennen <strong>und</strong> in ein zweites Neutral-Röhrchen zu überführen.<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Venlafaxin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: 60 – 325 µg/l<br />
Olanzapin (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Monitoring einer Olanzapin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: 20 – 80 ng/ml<br />
Opiate im Urin<br />
Probenmaterial: 5 ml Urin<br />
Abnahmehinweise: ggf. Probennahme überwachen<br />
Klinische Indikationen: Suchtest zum Nachweis des Gebrauchs von Opiaten<br />
Methode: EIA<br />
Referenzbereiche: negativ<br />
Ortho-Kresol (W)<br />
Synonyme: o-Kresol<br />
Probenmaterial: 5 ml Spontanurin oder<br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
Klinische Indikationen: Beurteilung der Toluol-/Kresol-Belastung, Intoxikation<br />
312 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Osmolalität im Serum<br />
Osmolalität im Serum<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bei Funktionstest (Durstversuch) Entnahmezeit mit angeben<br />
Klinische Indikationen: Weitere Untersuchung zur Beurteilung des Natrium- <strong>und</strong> Wasserhaushaltes,<br />
Diabetes insipidus, Ermittlung der osmotischen Lücke<br />
Methode: Gefrierpunktmessung<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Osmolalität im Urin<br />
Probenmaterial: 5 ml Urin<br />
Abnahmehinweise: Bei Funktionstest (Durstversuch) Entnahmezeit mit angeben<br />
Klinische Indikationen: Weitere Untersuchung zur Beurteilung des Natrium- <strong>und</strong> Wasserhaushaltes,<br />
Diabetes insipidus,<br />
Abklärung einer Polyurie unklarer Genese<br />
Methode: Gefrierpunktmessung<br />
Referenzbereiche: 50 – 1200 mOsm./kg<br />
Osmotische Resistenz der Erythrozyten (N)<br />
Probenmaterial: 4 ml Heparin-Blut<br />
Blutentnahme im Labor mit Voranmeldung erforderlich<br />
Abnahmehinweise: Bitte Untersuchung anmelden!<br />
Klinische Indikationen: Differenzierung hämolytischer Anämien<br />
Methode: Hämolysetest<br />
Referenzbereiche: Beginnende Hämolyse 0,46 – 0,42 % NaCl<br />
Vollständige Hämolyse 0,34 – 0,30 % NaCl<br />
Ostase (W)(N)<br />
Synonyme: Alkalische Phosphatase-Knochen-Isoenzym, BAP<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nüchten (ca. 12 St<strong>und</strong>en Nahrungskarenz)<br />
Klinische Indikationen: Beurteilung des Knochenstoffwechsels bei Verdacht auf erhöhten<br />
Knochenumsatz (Osteoporose), Tumorpatienten, Dialysepatienten<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Osteocalcin (U)<br />
Synonyme: BGP<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme morgens zwischen 08.00 Uhr <strong>und</strong> 09.00 Uhr, das Blut innerhalb<br />
von 2 St<strong>und</strong>en zentrifugieren, Serum abpipettieren <strong>und</strong> einfrieren (ca. – 20 °C)<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 313
Oxalsäure im Urin (W)<br />
Klinische Indikationen: Verdacht auf Osteoporose, Karzinome mit Knochenmetastasen, primärer<br />
Hyperparathyreoidismus, renale Osteopathie<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Östradiol im Serum<br />
Synonyme: 17-β-Östradiol, Estradiol, E2<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verlaufskontrolle bei hormoneller Sterlitätstherapie, Beurteilung der Ovarialfunktion,<br />
Tumordiagnostik, Therapiekontrolle<br />
Methode: ECLIA<br />
Referenzbereiche: Erwachsene<br />
Männer: 7,6 – 42,6 pg/ml<br />
Frauen<br />
Follikelphase: 12,5 – 166 pg/ml<br />
Ovulationsphase: 85,8 – 498 pg/ml<br />
Lutealphase: 43,8 – 211 pg/ml<br />
Östriol, frei im Serum (W)<br />
Synonyme: E3<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Überwachung der Schwangerschaft<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Östron im Serum (W)<br />
Synonyme: Estron, E1<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Ausschluss eines Östrogenmangels in der Menopause, Kontrolle der Hormontherapie<br />
bei Mammakarzinom<br />
Methode: RIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Oxalsäure im Urin (W)<br />
Probenmaterial: 5 ml Spontanurin oder<br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Weitere Diagnostik bei Nephro- <strong>und</strong> Urolithiasis<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
314 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Oxazepam (W)<br />
Oxazepam (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Diagnose von Oxazepam-Missbrauch <strong>und</strong> -Abhängigkeit, ggf. Monitoring<br />
einer Oxazepamtherapie<br />
Methode: HPLC<br />
Referenzbereiche: 500 – 2000 ng/ml<br />
Oxcarbazepin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Monitoring der Oxcarbazepin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: < 3,0 mg/l<br />
13 – 30 mg/l (10-OH-Metabolit)<br />
Oxidativer Burst (W)<br />
Synonyme: Sauerstoffradikalbildung in Granulozyten<br />
Probenmaterial: 10 ml Heparin-Blut<br />
Klinische Indikationen:<br />
Methode: FC<br />
Referenzbereiche: fMLP: 1 – 30 %<br />
Bakterien: > 70 %<br />
Oxidiertes LDL-Cholesterin (W)(N)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: oxidative Belastung, Antioxidantienstatus<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Oxypurinol (U)(N)<br />
Synonyme: Oxipurinol<br />
Probenmaterial: 1 ml Serum<br />
Methode: HPLC<br />
Referenzbereiche: 2 – 20 µg/ml<br />
Palladium (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Beurteilung der Palladium-Belastung<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 315
Pankreatisches Polypeptid (W)<br />
Palladium im Urin (U)<br />
Probenmaterial: 5 ml Urin<br />
Klinische Indikationen: Beurteilung der Palladium-Belastung<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Pankreas-Amylase im Serum (U)<br />
Synonyme: pankreatische α-Amylase<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle einer Pankreatitis oder einer Parotitis,<br />
Abklärung akuter Oberbauchbeschwerden,<br />
Pankreaskarzinom,<br />
Kontrolle nach ERCP<br />
Methode: Photometrie<br />
Referenzbereiche: < 53 U/l<br />
Pankreas-Elastase 1 im Serum (W)<br />
Synonyme: E1, Elastase 1<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Akute <strong>und</strong> chronische Pankreatitis<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Pankreas-Elastase 1 im Stuhl<br />
Synonyme: E1, Elastase 1<br />
Probenmaterial: 2 g Stuhl<br />
Abnahmehinweise: Stuhlprobe in entsprechende Transportröhrchen überführen. Die Untersuchung<br />
ist bei sehr weichen <strong>und</strong> flüssigen Stuhlproben nicht geeignet.<br />
Klinische Indikationen: Beurteilung der exokrinen Pankreasfunktion, auch unter Substitutionstherapie<br />
Methode: ELISA<br />
Referenzbereiche: > 200 µg/g Stuhl<br />
Pankreatisches Polypeptid (W)<br />
Synonyme: PP<br />
Probenmaterial: 2 ml EDTA-Plasma<br />
Abnahmehinweise: Das EDTA-Blut bitte unmittelbar nach der Blutentnahme zentrifugieren, das<br />
Plasma in ein separates Röhrchen (ohne Zusätze) pipettieren <strong>und</strong> einfrieren (ca. – 20°C).<br />
Die Blutentnahme sollte morgens am nüchternen Patienten erfolgen.<br />
Medikamente mit parasympathomimetischer Wirkung sind ausreichend vorher, soweit vertretbar,<br />
abzusetzen: z.B. Metoclopramid, ß-Blocker<br />
Klinische Indikationen: Verlaufskontrolle <strong>und</strong> Verdacht bei/au PPom (PP-uzierender Tumor, APU-<br />
Dom), auch im Zusammenhang mit anderen endokrinen Tumoren (VIPom, Insulinom, Gastrinom,<br />
316 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
insbesondere bei sekretorischer Diarrhoe<br />
Methode: RIA<br />
Referenzbereiche: < 100 pmol/l<br />
Pantothensäure (U)<br />
Pantothensäure (U)<br />
Synonyme: Vitamin B5<br />
Probenmaterial: 1 ml Serum oder<br />
10 ml Urin eines 24-St<strong>und</strong>en-Sammelurins<br />
Abnahmehinweise: Wegen der geringen Stabilität das Blut bitte unmittelbar nach der Entnahme <strong>und</strong><br />
Gerinnung zentrifugieren, das Serum in separates Röhrchen ohne Zusätze abpipettieren <strong>und</strong> einfrieren<br />
(ca. – 20°C)<br />
Klinische Indikationen: Verdacht auf eine Unterversorgung mit Pantothensäure<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
PAPP-A (U)<br />
Synonyme: Pregnancy Associated Plasma Protein A<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das entnommene Vollblut gerinnen lassen <strong>und</strong> anschließend die Probe innerhalb<br />
einer St<strong>und</strong>e zentrifugieren. Serum abpipettieren <strong>und</strong> in einem Probenröhrchen gekühlt / gefroren<br />
versenden.<br />
Haltbarkeit im Serum: 24 St<strong>und</strong>en bei 2-8°C, 2 Monate bei -20°C<br />
Falls diese Bedingungen nicht eingehalten werden können, bitte angeben.<br />
Bitte Schwangerschaftswoche exakt angeben.<br />
Klinische Indikationen: Erst-Trimester-Screening im Zusammenhang mit der Bestimmung von<br />
freiem β-HCG <strong>und</strong> der Messung der Nackenfalte mittels Ultraschall<br />
Methode: LIEMA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Paracetamol<br />
Synonyme: Acetaminophen<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Monitoring einer Paracetamol-Therapie, Diagnose <strong>und</strong> Kontrolle von Missbrauch<br />
Methode: Photometrie<br />
Referenzbereiche: therapeutischer Bereich: 10 – 30 mg/l<br />
Parainfluenza-Virus-Serologie (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 2-6 Tage; das diagnostische Fenster bis zum serologischen<br />
Nachweis ca. 7-14 Tage.<br />
Klinische Indikationen: Infektionen des oberen <strong>und</strong> unteren Respirationstraktes, Bronchitis, Pseudokrupp<br />
(bei Kindern), atpyische Pneumonie<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 317
Parvovirus B19-Antikörper (IgM)<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Parathormon intakt<br />
Synonyme: iPTH<br />
Probenmaterial: 1 ml EDTA-Plasma oder<br />
1 ml Serum<br />
Abnahmehinweise: Wegen zirkadianer Schwankungen Blutentnahme morgens nüchtern<br />
(ca. 12 St<strong>und</strong>en Nahrungskarenz).<br />
Blut tagesgleich ins Labor.<br />
Alternativ Blut innerhalb von 30 Minuten zentrifugieren, Serum bzw. Plasma abpipettieren. Das<br />
EDTA-Plasma kühl (+ 2°C – +8°C), das Serum sofort eingefroren (ca. – 20°C) lagern.<br />
Klinische Indikationen: Weitere Diagnostik bei Osteopathie, Störungen des Kalziumstoffwechsels,<br />
Verdacht auf Hyper- oder Hypoparathyreoidismus, Niereninsuffiziens, Nephro- <strong>und</strong> Urolithiasis, Malabsorptionssyndrom<br />
Methode: CMIA<br />
Referenzbereiche: 15,0 – 68,3 pg/ml<br />
Paroxetin (W)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Paroxetin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Parvovirus B19-Antikörper (IgG)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 8-14 Tage; das diagnostische Fenster beträgt ca.<br />
10-15 Tage.<br />
Klinische Indikationen: Ringelröteln (Erythema infectiosum), hämolytische Anämie (transiente<br />
aplastische Krise), Lymphadenitis, akute/chronische Arthritis, Kontakt während der Gravidität<br />
(erhöhtes Risiko für fetale Anämie sowie fetalen Hydrops bzw. intrauterinen Fruchttod), Myokarditis.<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Parvovirus B19-Antikörper (IgM)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 8-14 Tage; das diagnostische Fenster beträgt ca.<br />
10-15 Tage.<br />
Klinische Indikationen: Ringelröteln (Erythema infectiosum), hämolytische Anämie (transiente<br />
aplastische Krise), Lymphadenitis, akute/chronische Arthritis, Kontakt während der Gravidität<br />
(erhöhtes Risiko für fetale Anämie sowie fetalen Hydrops bzw. intrauterinen Fruchttod), Myokarditis.<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
318 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Parvovirus B19-DNA-Nachweis (W)<br />
Parvovirus B19-DNA-Nachweis (W)<br />
Synonyme: Parvovirus B19-PCR<br />
Probenmaterial: 3 ml EDTA-Blut<br />
1 ml Liquor<br />
Fruchtwasser<br />
Abnahmehinweise: Bitte für diese Untersuchung eine separate Monovette abnehmen. Das Blut nach<br />
der Abnahme kühl (+2°C – +8°C) lagern.<br />
Klinische Indikationen: Verdacht auf eine akute Infektion mit Parvovirus B19 (vor der Serokonversion)<br />
bzw. Nachweis der Parvovirus B19-Trägerschaft bei unklarer hämolytischer Anämie, Arthritis,<br />
Gravidität (erhöhtes Risiko für intrauterinen Fruchttod bzw. Hydrops fetalis)<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
PCP im Serum (U)<br />
Synonyme: Pentachlorphenol<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Beurteilung der PCP-Belastung <strong>und</strong> -Intoxikation<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
PCP im Urin (U)<br />
Synonyme: Pentachlorphenol<br />
Probenmaterial: 10 ml Urin<br />
Klinische Indikationen: Beurteilung der PCP-Belastung <strong>und</strong> -Intoxikation<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Perazin (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Perazin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Perphenazin (U)<br />
Probenmaterial: 1 ml Serum, lichtgeschützt<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Perphenazin-Therapie<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
pH-Wert im Stuhl<br />
Probenmaterial: 2 g Stuhl<br />
Klinische Indikationen: Verdacht auf Fehlbesiedlung des Colons<br />
Referenzbereiche: 4,5 – 7,5<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 319
Phenylalanin im Plasma (U)<br />
Phenacetin (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring<br />
Methode: GC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Phencyclidin (U)<br />
Synonyme: “Angel Dust“, PCP<br />
Probenmaterial: 15 ml Urin<br />
Klinische Indikationen: Missbrauchskontrolle<br />
Methode: GC/MS<br />
Referenzbereiche: negativ<br />
Phenobarbital<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme oder während des<br />
Dosierungsintervalls<br />
Klinische Indikationen: Monitoring einer Phenobarbital-Therapie<br />
Methode: CMIA<br />
Referenzbereiche: 15 – 40 µg/ml<br />
Phenol im Urin (U)(N)<br />
Probenmaterial: 5 ml Urin<br />
Abnahmehinweise: Probennahme am Ende der Expositionszeit (Schichtende)<br />
Klinische Indikationen: Beurteilung der Phenol-Belastung <strong>und</strong> -Intoxikation im Zusammenhang mit<br />
Benzol (Phenol ist Metabolit von Benzol)<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Phenprocoumon (U)<br />
Synonyme: Marcumar ® , Vitamin K-Antagonist<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Beurteilung einer Antikoagulation mit Phenprocoumon<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Phenylalanin im Plasma (U)<br />
Synonyme: Phenylketonurie, Hartnup-Krankheit<br />
Probenmaterial: 0,5 ml EDTA-Plasma<br />
Klinische Indikationen: Verdacht auf Hyperphenylalaninämie bzw. Phenylketonurie, insbesondere<br />
bei Beeinträchtigung der kindlichen Hirnfunktion, Hyperaktivität, Krämpfen, “Mäusegeruch“ (Haar,<br />
Haut, Urin), Neigung zu Hypopigmentierung bzw. Ekzemen, Pellagra<br />
320 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Phenylbutazon (U)<br />
Synonyme: NSAR<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Phenylbutazon-Therapie<br />
Methode: GC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Phenylglyoxylsäure im Urin (U)<br />
Synonyme: PGS im Urin<br />
Probenmaterial: 1 ml Spontanurin<br />
Klinische Indikationen: Beurteilung der Belastung mit Styrol, Intoxikation<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Phenytoin<br />
Phenylbutazon (U)<br />
Synonyme: Diphenylhydantoin<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme während des Dosierungsintervalls bzw. vor der nächsten Medikamenteneinnahme<br />
(standardisierte Entnahmezeit)<br />
Klinische Indikationen: Monitoring einer Phenytoin-Therapie<br />
Methode: CMIA<br />
Referenzbereiche: 10 – 20 µg/ml<br />
Phosphat im Serum<br />
Synonyme: anorganisches Phosphat<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme möglichst nüchtern (ca. 12 St<strong>und</strong>en Nahrungskarenz); langes<br />
Stauen vermeiden. Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden<br />
Klinische Indikationen: Knochenerkrankungen, Osteoporose, Nierenerkrankungen, nach Schilddrüsenoperationen,<br />
Hyper- <strong>und</strong> Hypoparathyreoidismus, Nephro- <strong>und</strong> Urolithiasis, Verdacht auf Vitamin<br />
D-Mangel<br />
Methode: Photometrie<br />
Referenzbereiche: Erwachsene: 2,5 – 4,5 mg/dl<br />
Kinder: s. Bef<strong>und</strong>bericht<br />
Phosphat im Urin<br />
Synonyme: anorganisches Phosphat<br />
Probenmaterial: 5 ml Spontanurin oder<br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 321
Phospholipid-Antikörper<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Bestimmung in Zusammenhang mit → Phosphat im Serum, Seite 321<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Phospho-Tau (W)<br />
Synonyme: Phospho-Tau(181p)<br />
Probenmaterial: 1 ml Liquor in Polypropylen-Röhrchen<br />
Abnahmehinweise: Zur Materialentnahme <strong>und</strong> Transport müssen Polypropylenröhrchen verwendet<br />
werden, da es sonst durch Absorption zu Verlusten kommt.<br />
Klinische Indikationen: Differenzierung zwischen Morbus Alzheimer <strong>und</strong> Lewy-Körper-Demenz<br />
Marker für Creutzfeldt-Jacob-Krankheit<br />
Methode: ELISA<br />
Referenzbereiche: < 61 pg/ml<br />
Phosphohexose-Isomerase im Liquor (W)(N)<br />
Synonyme: PHI<br />
Probenmaterial: 1 ml Liquor<br />
Abnahmehinweise: Der Liquor sollte frei von Erythrozyten sein. Es darf für die Untersuchung kein<br />
Liquor mit lysierten Erythrozyten verwendet werden, da Erythrozyten eine hohe Menge an PHI enthalten<br />
Klinische Indikationen: Therapie- <strong>und</strong> Verlaufskontrolle für ZNS-Tumoren (primäre <strong>und</strong> sek<strong>und</strong>äre<br />
Hirntumore)<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Phosphohexose-Isomerase im Serum (U)<br />
Synonyme: PHI<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Blut zentrifugiert <strong>und</strong> das Serum in<br />
separates Röhrchen abpipettiert werden.<br />
Klinische Indikationen: Verlaufskontrolle bei Tumoren (PHI besitzt KEINE Tumorspezifität)<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Phospholipid-Antikörper<br />
Probenmaterial: 3 ml Citrat-Blut <strong>und</strong><br />
1 ml Serum<br />
Abnahmehinweise: Citratblut per Botendienst gleichtägig ins Labor.<br />
Haltbarkeit: 4 St<strong>und</strong>en.<br />
Bei längeren Transportzeiten sollte das Citratblut möglichst 1 St<strong>und</strong>e nach der Blutabnahme zentrifugiert<br />
werden (2000 g, 10 min.). Überstand (Citratplasma) ohne Verletzung der Leukozytenschicht<br />
zwischen Plasma <strong>und</strong> Erythrozyten abheben <strong>und</strong> in ein neues Probenröhrchen ohne Zusätze<br />
überführen. Vor dem Einfrieren sollte das Plasma ein zweites Mal zentrifugiert <strong>und</strong> den Überstand in<br />
322 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Phytansäure (U)<br />
einem neuen Röhrchen abgefüllt werden.<br />
Das Plasma bei ca. – 20 °C einfrieren <strong>und</strong> im Kühlbehälter versenden.<br />
Beim Einfrieren des Citratplasmas werden Phospholipide aus den Rest-Thrombozyten freigesetzt, die<br />
zu einer Verkürzung der Gerinnungszeit <strong>und</strong> somit zu fasch negativen Ergebnissen führen können.<br />
Methode: Koagulometrie<br />
FEIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Phytansäure (U)<br />
Synonyme: Morbus Refsum<br />
Probenmaterial: 3 ml Serum<br />
Klinische Indikationen: Diagnose eines Refsum-Syndroms (Morbus Refsum, u.a. Defekt der<br />
Phytanoyl-CoA-Hydroxylase)<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Pimozid (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Pimozid-Therapie<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Pipamperon (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Pipamperon-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Plasminogen-Aktivator-Inhibitor (U)<br />
Synonyme: PAI-1<br />
Probenmaterial: 2 ml Citrat-Plasma<br />
Abnahmehinweise: Wegen der geringen Stabilität bitte das Blut nach der Abnahme zentrifugieren<br />
<strong>und</strong> das Plasma in ein separates Röhrchen (ohne Zusätze) abpipettieren <strong>und</strong> kühl (+ 2°C – + 8°C) oder<br />
gefroren (ca. – 20°C) lagern.<br />
Wegen der ausgeprägten tageszeitlichen Schwankungen sollte eine Blutentnahme gr<strong>und</strong>sätzlich morgens<br />
(bis 08.00 Uhr) erfolgen.<br />
Klinische Indikationen: Diagnose bzw. Verlaufskontrolle von<br />
- Hemmung der Fibrinolyse<br />
- PAI-1-Mangel bei erhöhter Blutungsneigung<br />
- Abklärung eines erhöhten Thrombose-Risikos<br />
Methode: chromogen<br />
Referenzbereiche: 2 – 7 U/ml<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 323
Pneumokokken-Antikörper (W)<br />
Plasminogen-Aktivität (W)<br />
Probenmaterial: 1 ml Citrat-Plasma<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Differentialdiagnostik bei Thrombophilie,<br />
Diagnostik bei Hyperfibrinolyse <strong>und</strong> DIC,<br />
Therapiemonitoring bei Fibrinolyse<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Plasminogen-Konzentration (W)<br />
Probenmaterial: 1 ml Citrat-Plasma<br />
Klinische Indikationen: Weitere Untersuchung bei Verminderung der Plasminogen-AktivitätE<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Platin im Serum (U)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme am Ende der Expositionszeit (Schichtende)<br />
Klinische Indikationen: Beurteilung der Platinbelastung, Intoxikation<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
PMN-Elastase im Stuhl (W)<br />
Probenmaterial: 1 g Stuhl<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle entzündlicher Darmerkrankungen<br />
Methode: ILMA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Pneumocystis jiroveci DNA-Nachweis<br />
Synonyme: Pneumocystis-PCR, PcP<br />
Probenmaterial: Sputum<br />
BAL<br />
Trachealsekret<br />
Klinische Indikationen: Verdacht auf Infektion mit P. jiroveci (früher P. carinii), insbesondere bei<br />
interstitieller Pneumonie bei immunsupprimierten Patienten (auch bereits bei der Entwicklung von<br />
trockenem Husten, Fieber oder Dyspnoe ohne Korrelat im Röntgenbild)<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Pneumokokken-Antikörper (W)<br />
Synonyme: Pneumokokken-Vacc-Ag-Ak<br />
Probenmaterial: 1 ml Serum<br />
324 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
PNH-Diagnostik (W)<br />
Abnahmehinweise: Blutentnahme ab ca. 4 Wochen nach erfolgter Impfung. Bei Verdacht auf<br />
Pneumokokkeninfektion ist der Erregernachweis die Methode der Wahl.<br />
Klinische Indikationen: Der Test ist geeignet zur Überprüfung der Immunitätslage vor <strong>und</strong> nach<br />
Impfung. Erfahrungen zur Diagnostik von Erkrankungen liegen nicht vor.<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
PNH-Diagnostik (W)<br />
Synonyme: Paroxysmale nächtliche Hämoglobinurie, Marchiafava-Anämie<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Probenmaterial nicht kühlen.<br />
Klinische Indikationen: Verdacht auf paroxysmale nächtliche Hämoglobinurie (PNH), insbesondere<br />
bei<br />
- Hämoylsezeichen nach Stress, Infekten, Medikamenteneinahme u.a.<br />
- unklaren Abdominalschmerzen<br />
- unklaren Rückenschmerzen<br />
- unklaren Kopfschmerzen<br />
- gehäuften thromboembolischen Ereignissen<br />
- unklarer chronisch hämolytischer Anämie<br />
- unklarer Eisenmangel<br />
- Hepatosplenomegalie<br />
Methode: FC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Poliovirus-Antikörper (W)<br />
Synonyme: Poliomyelitis-Antikörper, Polio-NT<br />
Probenmaterial: 5 ml Serum<br />
Klinische Indikationen: Überprüfung der Immunitätslage nach Impfung, Beurteilung der Indikation<br />
zur Wiederauffrischung der Impfung<br />
Methode: Neutralisationstest<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Polychlorierte Biphenyle (U)<br />
Synonyme: PCB<br />
Probenmaterial: 10 ml EDTA-Blut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Blutentnahme nüchtern (12 St<strong>und</strong>en Nahrungskarenz).<br />
Spezielle Abnahmemonovetten können angefordert werden.<br />
Klinische Indikationen: Beurteilung der PCB-Belastung <strong>und</strong> -Intoxikation<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Porphobilinogen im Urin (W)<br />
Synonyme: PBG, Porphyrie-Diagnostik<br />
Probenmaterial: 20 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze) oder<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 325
Porphyrine im Urin (W)<br />
20 ml Spontanurin<br />
Abnahmehinweise: Bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben. Urin lichtgeschützt <strong>und</strong> gekühlt (+2°C – +8°C) sammeln.<br />
Klinische Indikationen: Verdacht auf Bleivergiftung, akute hepatische Porphyrien, andere Schwermetallvergiftungen,<br />
Bleiexposition, Alkoholismus, Arzneimittelschädigung der Leber, chronische<br />
hepatische Porphyrien<br />
Methode: ITC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Porphyrie-Diagnostik (W)<br />
Probenmaterial: je nach Anforderung:<br />
20 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze) oder<br />
20 ml Spontanurin,<br />
5 g Stuhl,<br />
2 ml Heparin-Blut,<br />
3 ml EDTA-Blut<br />
Abnahmehinweise: Proben lichtgeschützt versenden.<br />
Klinische Indikationen: Verdacht auf Bleivergiftung, akute hepatische Porphyrien, andere Schwermetallvergiftungen,<br />
Bleiexposition, Alkoholismus, Arzneimittelschädigung der Leber, chronische<br />
hepatische Porphyrien<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Porphyrine im Stuhl (W)<br />
Probenmaterial: 5 g Stuhl<br />
Klinische Indikationen: Weitere Untersuchung zur Abgrenzung der Porphyria variegata oder der<br />
hereditären Koproporphyrie von der akuten intermittierenden Porphyrie bei unklarer Bef<strong>und</strong>konstellation<br />
der Urin-Diagnostik.<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Porphyrine im Urin (W)<br />
Synonyme: Porphyrie-Diagnostik<br />
Probenmaterial: 20 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze) oder<br />
20 ml Spontanurin<br />
Abnahmehinweise: Bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben. Urin lichtgeschützt <strong>und</strong> gekühlt (+2°C – +8°C) sammeln.<br />
Klinische Indikationen: Verdacht auf Bleivergiftung, akute hepatische Porphyrien, andere Schwermetallvergiftungen,<br />
Bleiexposition, Alkoholismus, Arzneimittelschädigung der Leber, chronische<br />
hepatische Porphyrien<br />
Methode: Photometrie<br />
HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
326 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Porphyrine in Erythrozyten (W)<br />
Synonyme: freie Erythrozytenporphyrine<br />
Probenmaterial: 3 ml Heparin- oder EDTA-Blut<br />
Klinische Indikationen: Differenzierung der Porphyrien bei Porphyrieverdacht<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Präalbumin (U)<br />
Porphyrine in Erythrozyten (W)<br />
Synonyme: Prealbumin, Transthyretin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Beurteilung des Ernährungszustandes <strong>und</strong> der Lebersynthese-Leistung,<br />
Kachexie, parenterale Ernährung<br />
Methode: Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Prajmalin (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Monitoring einer Prajmalin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Prednisolon (U)(N)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Prednisolon-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Pregabalin (U)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Das Blut bitte nach der Abnahme <strong>und</strong> ggf. Gerinnung zentrifugieren, das<br />
Serum/Plasma in ein separates Röhrchen (ohne Zusätze) abpipettieren <strong>und</strong> kühl (+ 4°C – + 8°C)<br />
<strong>und</strong> lichtgeschützt (mit Alufolie umwickeln) lagern.<br />
Klinische Indikationen: Monitoring einer Pregabalin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Pregnandiol (U)(N)<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (gesammelt über 5 – 10 ml Eisessig)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Weitere Diagnostik bei Pubertätsentwicklungsstörungen, Ovarialtumoren.<br />
Methode: GC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 327
Progesteron im Serum<br />
Pregnantriol (U)(N)<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (gesammelt über 5 – 10 ml Eisessig)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben. Vor <strong>und</strong> während der Sammelzeit sind besondere Muskelanstrengungen zu vemeiden<br />
(erhöhte Werte von Pregnantriol im Urin)<br />
Klinische Indikationen: Verdacht auf hereditäres Adrenogenitales Syndrom (21-Hydroxylase-<br />
Mangel)<br />
Methode: GC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Primidon<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme ca. 2-4 St<strong>und</strong>en nach der letzten Dosis (Maximalspiegel) oder<br />
direkt vor der nächsten Medikamenteneinnahme.<br />
Klinische Indikationen: Monitoring einer Primidon-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 4,0 – 12,0 µg/ml<br />
pro Gastrin Releasing Peptide (U)<br />
Synonyme: ProGRP<br />
Probenmaterial: 1 ml EDTA-Plasma<br />
Abnahmehinweise: Bevorzugtes Material ist Plasma (EDTA-, Na- oder Lithium Heparinat), das maximal<br />
8 St<strong>und</strong>en bei Raumtemperatur oder 24 St<strong>und</strong>en bei 2-8°C gelagert werden kann, danach sollte<br />
es eingefroren werden.<br />
Serum hingegen kann nach der sofortigen Trennung von Blutkuchen nur 3 St<strong>und</strong>en bei 2-8°C gelagert<br />
werden. Danach bitte einfrieren.<br />
Klinische Indikationen: Biomarker für das kleinzellige Lungenkarzinom (SCLC). Differenzialdiagnose<br />
bei Lungenr<strong>und</strong>herden.<br />
Methode: CMIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Procalcitonin<br />
Synonyme: PCT<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Proben, die nicht innerhalb von 24 St<strong>und</strong>en nach der Blutentnahme für einen Test<br />
verwendet werden, müssen gefroren <strong>und</strong> bei -20°C gelagert werden.<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle bakteriell-entzündlicher Erkrankungen<br />
Methode: ELFA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Progesteron im Serum<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Beurteilung der Corpus luteum-Funktion, Nachweis einer Ovulation, V.a.<br />
328 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Blasenmole, Chorionepitheliom, Thekazell-Tumor<br />
Methode: ECLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Proinsulin intakt (W)<br />
Proinsulin intakt (W)<br />
Probenmaterial: 1 ml EDTA-Plasma oder Serum<br />
Abnahmehinweise: Wegen der besseren Stabilität sollte EDTA-Blut bevorzugt abgenommen werden.<br />
Bei längerer Lagerungszeit (> 24 St<strong>und</strong>en) sollte das EDTA-Blut zentrifugiert <strong>und</strong> das Plasma in ein<br />
separates Röhrchen (ohne Zusatz) abpipettiert werden. Die Probe ist dann gekühlt (+ 2°C – + 8°C) zu<br />
lagern. Bei Abnahme von Vollblut muss dieses nach der Abnahme direkt zentrifugiert <strong>und</strong> das Serum<br />
in ein separates Röhrchen abpipettiert <strong>und</strong> tiefgefroren werden (ca. – 20°C).<br />
Klinische Indikationen: Diabetes mellitus Typ 2 zur – Klassifizierung der Insulinresistenz – Therapiefindung<br />
– Therapieverlaufskontrolle – Identifikation von Hochrisikopatienten (KHK)<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Prokollagen-I, N-terminales Propeptid (W)<br />
Synonyme: PINP<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Stabilität: 24 St<strong>und</strong>en bei 15-25°C; 5 Tage bei 2-8°C<br />
Klinische Indikationen: Die enge Korrelation von PINP mit der Geschwindigkeit der Knochenneubildung<br />
prädestiniert diesen Marker zum Monitoring von Erkrankungen die mit einer Aktivierung<br />
der Knochenformation einhergehen (z.B. Hyperparathyreoidismus, Paget-Disease, postmeno-pausale<br />
Osteoporose). Bei Patienten mit malignen Tumoren, insbesondere bei Prostatakarzinomen <strong>und</strong> bei<br />
Mammakarzinomen, geben erhöhte PINP-Konzentrationen frühzeitig Hinweise auf eine ossäre Metastasierung.<br />
PINP ist weiterhin gut geeignet zum Follow-up einer anti-resorptiven Knochen-Therapie<br />
(z.B. Bisphosphonate).<br />
Methode: ECLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Prokollagen-III-Peptid (W)<br />
Synonyme: P III P<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle von Lebererkrankungen sowie Abschätzung<br />
des fibrotischen Leberumbaus<br />
Methode: RIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Prolaktin<br />
Synonyme: Prolactin<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Stress-Situation vor oder bei der Blutentnahme vermeiden, wegen zirkadianer<br />
Schwankungen Blutentnahme morgens (ca. 8 Uhr) empfohlen<br />
Klinische Indikationen: Frauen: Zyklusstörungen, Galaktorrhoe, Mastopathie, Virilisierung,<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 329
Protein C-Aktivität<br />
Abklärung einer Sterilität Männer: Libido- <strong>und</strong> Potenzstörungen, Hypogonadismus, Galaktorrhoe<br />
Methode: ECLIA<br />
Referenzbereiche: Frauen: 102 – 496 mlE/l<br />
Männer: 86 – 324 mlE/l<br />
Promethazin (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Die Probe nach der Blutabnahme lichtgeschützt (mit Alufolie umwickeln) lagern.<br />
Bitte beachten Sie, dass bei Verwendung von gelhaltigen Röhrchen die Resultate niedriger ausfallen<br />
können. Wir empfehlen, das Blut 30 min nach Abnahme zu zentrifugieren, das Serum abzutrennen<br />
<strong>und</strong> in ein zweites Neutral-Röhrchen zu überführen.<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Promethazin-Therapie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Propafenon (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme unmittelbar vor der nächsten Medikamenteneinnahme.<br />
Bitte beachten Sie, dass bei Verwendung von gelhaltigen Röhrchen die Resultate niedriger ausfallen<br />
können. Wir empfehlen, das Blut 30 min nach Abnahme zu zentrifugieren, das Serum abzutrennen<br />
<strong>und</strong> in ein zweites Neutral-Röhrchen zu überführen.<br />
Klinische Indikationen: Monitoring einer Propafenon-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Propranolol (U)<br />
Synonyme: Obsidan ®<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Propranolol-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Protein 14-3-3 im Liquor (W)(N)<br />
Probenmaterial: 2 ml Liquor<br />
Klinische Indikationen: Differentialdiagnostik Creutzfeldt-Jakob-Krankheit, insbesondere bei sehr<br />
stark erhöhten Werten für Tau-Protein im Liquor<br />
Methode: Westernblot<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Protein C-Aktivität<br />
Probenmaterial: 1 ml Citrat-Plasma<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251 Die Bestimmung wird gestört durch<br />
hohe Heparinkonzentrationen, Lupusantikagulans, Vitamin K-Antagonisten, APC-Resistenz. Die gilt<br />
für den sog. “funktionellen Test“, nicht jedoch für den “chromogenen Test“.<br />
330 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Protein C-Antigen (U)<br />
Klinische Indikationen: Abklärung einer Thrombophilie, Verdacht auf angeborenen/erworbenen<br />
Protein C-Mangel, Vor oraler Antikoagulation mit Vitamin K-Antagonisten, Purpura fulminans,<br />
Marcumar-Nekrosen<br />
Methode: Koagulometrie<br />
Referenzbereiche: 70 – 140 %<br />
Protein C-Antigen (U)<br />
Probenmaterial: 2 ml Citrat-Plasma<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Folgeuntersuchung bei verminderter → Protein C-Aktivität, Seite 330 zur<br />
Klassifizierung eines hereditären Protein-C-Mangels.<br />
Methode: ELFA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Protein C-Genotypisierung (W)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32011 (Thrombophilie)<br />
Klinische Indikationen: Diagnosesicherung eines hereditären Protein C-Mangels<br />
Methode: PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Protein S-100 im Liquor<br />
Synonyme: S-100B<br />
Probenmaterial: 1 ml Liquor<br />
Abnahmehinweise: Wegen der geringen Halbwertszeit sollte der Liquor innerhalb von 30 Minuten<br />
eingefroren (ca. – 20°C) werden.<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufsbeurteilung degenerativer <strong>und</strong> entzündlicher ZNS-<br />
Erkrankungen<br />
Methode: CLIA<br />
Referenzbereiche: < 2,7 µg/l<br />
Protein S-100 im Serum<br />
Synonyme: S-100B<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle beim Malignen Melanom<br />
Methode: CLIA<br />
Referenzbereiche: < 0,15 µg/l<br />
Protein S-Aktivität<br />
Probenmaterial: 1 ml Citrat-Plasma<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Abklärung einer Thrombophilie,<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 331
Protein Z-Konzentration (W)<br />
Verdacht auf angeborenen/erworbenen Protein S-Mangel,<br />
Vor oraler Antikoagulation mit Vitamin K-Antagonisten,<br />
Purpura fulminans<br />
Methode: Koagulometrie<br />
Referenzbereiche: Frauen: 52 – 136 %<br />
Männer: 60 – 148 %<br />
Protein S-Antigen, frei<br />
Probenmaterial: 1 ml Citrat-Plasma<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Diagnose eines Protein S-Mangels,<br />
Leberfunktionsstörungen,<br />
Vitamin K-Mangel,<br />
Methode: EIA<br />
Referenzbereiche: Männer: 74 – 146 %<br />
Frauen: 55 – 124 %<br />
Protein S-Genotypisierung (W)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einwilligungserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32011 (Thrombophilie)<br />
Klinische Indikationen: Diagnosesicherung eines hereditären Protein S-Mangels<br />
Methode: PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Protein S-gesamt (U)<br />
Probenmaterial: 2 ml Citrat-Blut<br />
Klinische Indikationen: Klassifizierung eines angeborenen Protein S-Mangel<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Protein Z-Konzentration (W)<br />
Probenmaterial: 1 ml Citrat-Plasma<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Hinweis: Protein Z ist NICHT stabil, das Blut muss daher unmittelbar nach der Abnahme zentrifugiert,<br />
das Plasma in ein separates Röhrchen (ohne Zusatz!) abpipettiert <strong>und</strong> gekühlt (+2 °C –<br />
+8 °C) transportiert werden.<br />
Klinische Indikationen: Unklare Blutungsneigung, rez. Aborte<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
332 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Prothrombin-Fragmente F 1+2 (W)<br />
Prothrombin-Fragmente F 1+2 (W)<br />
Probenmaterial: 1 ml Citrat-Plasma<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Verbrauchskoagulagulopathie (DIC), arterielle Verschlußkrankheit, fibrinolytische<br />
Therapie<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
PSA frei<br />
Synonyme: fPSA, Prostata-Spezifisches Antigen<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bei der Blutentnahme werden folgende zeitlichen Abstände empfohlen:<br />
Prostatamassage: ca. 3-4 Tage<br />
rektaler Ultraschall: ca. 1-2 Tage<br />
rektale digitale Unt.: ca. 1-2 Tage<br />
Prostata-Nadelbiopsie: ca. 2 Wochen<br />
nach Ejakulation: ca. 1-2 Tage<br />
Radfahren: ca. 1-2 Tage<br />
Klinische Indikationen: Verbesserung der Differentialdiagnostik zwischen Prostatakarzinom <strong>und</strong><br />
BPH (benigne Prostatahyperplasie)<br />
Methode: ECLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
PSA gesamt<br />
Synonyme: Prostata-Spezifisches Antigen, tPSA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung des Prostatakarzioms<br />
Methode: ECLIA<br />
Referenzbereiche: < 4,0 ng/ml<br />
PSA komplexiert (W)<br />
Synonyme: cPSA<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung des Prostatakarzioms<br />
Methode: CLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Pseudomonas aeruginosa-Antikörper (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei Infektonen mit Pseudomonas aeruginosa<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 333
Pyrimethamin (U)(N)<br />
PTHrP (U)<br />
Synonyme: Parathormon-related Protein<br />
Probenmaterial: 1 ml EDTA-Plasma<br />
Abnahmehinweise: EDTA-Blut abnehmen <strong>und</strong> sofort kühl zentrifugieren, EDTA-Plasma abtrennen.<br />
Anschließend sofort tiefgefrieren <strong>und</strong> in gefrorener Kühlbox unserem Fahrdienst übergeben.<br />
Klinische Indikationen: - Differentialdiagnose der Hyperkalziämie, insbesondere bei Verdacht auf<br />
Tumorleiden<br />
- Verlaufskontrolle der Tumor-Hyperkalziämie (Mamma-, Nieren-, Prostata, <strong>und</strong> kleinzelliges<br />
Bronchialkarzinom)<br />
Methode: RIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
PTT<br />
Synonyme: partielle Thromboplastinzeit<br />
Probenmaterial: 1 ml Citrat-Plasma<br />
Methode: Photometrie<br />
Referenzbereiche: 25,1 – 36,5 Sek<strong>und</strong>en<br />
Pyrazinamid (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Pyrazinamid-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Pyridinolin im Urin (W)<br />
Synonyme: PYD-Crosslinks<br />
Probenmaterial: 10 ml des 1. Morgenurins<br />
Abnahmehinweise: Wegen der ausgeprägten Tagesrhythmik Urin bis ca. 09.00 Uhr abnehmen; Urin<br />
direkt nach der Abnahme gekühlt (ca. + 2°C – + 8 °C) <strong>und</strong> lichtgeschützt (Röhrchen mit Alufolie<br />
umwickeln) lagern.<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle, Therapiemonitoring bei erhöhter Knochenresorption<br />
(Osteoporose) <strong>und</strong> verstärkterm Knorpelabbau<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Pyrimethamin (U)(N)<br />
Synonyme: Handelsname: Daraprim ®<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Pyimethamintherapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
334 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Pyruvat im Plasma (W)<br />
Pyruvat im Plasma (W)<br />
Probenmaterial: 2 ml NaF-Blut<br />
Abnahmehinweise: Blut direkt nach der Entnahme aus möglichst ungestauter Vene zentrifugieren,<br />
Plasma abpipettieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Abklärung einer Gewebehypoxie, Laktatazidose oder vermuteter mitochondrialer<br />
Stoffwechselstörungen<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Pyruvatkinase in Erythrozyten (U)<br />
Probenmaterial: 5 ml EDTA-Blut<br />
Abnahmehinweise: Blut nach der Abnahme kühl (+ 2°C – + 8°C) lagern, nicht einfrieren<br />
Klinische Indikationen: Verdacht auf Pyruvatkinase-Mangel bei Splenomegalie, hämolytischer<br />
Anämie, Cholelithiasis<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Q-Fieber (W)<br />
Probenmaterial: 2 ml Serum<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Quecksilber im Blut (W)<br />
Probenmaterial: 2 ml EDTA-Plasma oder Serum<br />
Klinische Indikationen: Beurteilung der Quecksilberbelastung<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Quecksilber im Haar (U)<br />
Probenmaterial: 500 mg Haar vom Haaransatz (kopfnah)<br />
Klinische Indikationen: Zusätzliche Beurteilung der Quecksilber-Belastung<br />
Methode: AAS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Quecksilber im Speichel (W)<br />
Probenmaterial: 5 ml Speichel<br />
Abnahmehinweise: Bei Anwendung des Kaugummitestes bitte Entnahmezeitpunkt angeben<br />
Klinische Indikationen: Beurteilung der Quecksilberbelastung<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 335
Reboxetin (U)<br />
Quecksilber im Urin (W)<br />
Probenmaterial: 5 ml Spontanurin oder<br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
Abnahmehinweise: Bei Durchführung des Mobilisierungstestes (DMPS-Test) bitte die Entnahmezeit<br />
angeben, bitte die Urinsammelmenge angeben<br />
Klinische Indikationen: Beurteilung der Quecksilberbelastung<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Quetiapin (W)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Quetiapin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Quick-Wert<br />
Synonyme: TPZ, INR<br />
Probenmaterial: 1 ml Citrat-Blut<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Suchtest für erworbene oder angeborene Gerinnungsstörungen,<br />
Kontrolle der Therapie mit Vitamin K-Antagonisten (oralen Antikoagulantien),<br />
Verlaufskontrolle bei Vitamin K-Mangelzuständen,<br />
Beurteilung der Syntheseleistung der Leber,<br />
Hyperfibrinolyse<br />
Methode: Koagulometrie<br />
Referenzbereiche: 70 – 130 %<br />
Quotient APO B/APO A1<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nach einer Nahrungskarenz von ca. 10-14 St<strong>und</strong>en<br />
Klinische Indikationen: Ermittlung des Arterioklerose-Risikos<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Reboxetin (U)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutabnahme ca. 1 – 4 h nach Gabe von 4 mg Reboxetin,<br />
Fließgleichgewicht wird nach ca. 5 Tagen erreicht.<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Reboxetin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
336 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Reiber Schema<br />
Reiber Schema<br />
Probenmaterial: 2 ml Liquor <strong>und</strong> 2 ml Serum<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufsbeurteilung akuter <strong>und</strong> chronischer ZNS-<br />
Erkrankungen<br />
Methode: Nephelometrie, Quotientenberechnung <strong>und</strong> Darstellung als Quotientendiagramm<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Renin direkt<br />
Probenmaterial: 1 ml EDTA-Plasma<br />
Abnahmehinweise: Blutentnahme nach 30 Minuten liegen oder normaler körperlicher Aktivität.<br />
Medikamente mit Einfluss auf das Renin, wenn möglich, absetzen.<br />
Zur Vermeidung einer Hämolyse Blut direkt nach der Entnahme zentrifugieren, Plasma abpipettieren<br />
<strong>und</strong> einfrieren (ca. -20°C).<br />
Klinische Indikationen: Diagnose des Hyper- <strong>und</strong> Hypoaldosteronismus, Verdacht auf ektope Reninproduktion,<br />
Abklärung einer Hypertonie<br />
Methode: CLIA<br />
Referenzbereiche: Erwachsene<br />
aufrechte Position: 4,4 – 46,1 µIU/ml<br />
liegende Position: 2,8 – 39,9 µIU/ml<br />
Reptilase-Zeit (U)<br />
Probenmaterial: 2 ml Citrat-Blut<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Nicht messbare (ungerinnbare) Thrombinzeit-Bestimmung<br />
Nachweis einer Heparintherapie,<br />
Hypo-/Dysfibrinogenämie<br />
Methode: Einphasengerinnungstest<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Retikulozyten<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Proben werden bis zur tagesgleichen Abarbeitung bei Raumtemperatur aufbewahrt.<br />
Klinische Indikationen: Differenzierung der hypo- normo- <strong>und</strong> hyperregenerativen Anämien, Ermittlung<br />
der Knochenmarkaktivität bei normzytärer Anämie, Therapiekontrolle bei Mangelanmämien<br />
Methode: Streulicht-Methode<br />
Referenzbereiche: 7 – 15 Promille<br />
Retikulozyten-Hb<br />
Synonyme: CHr, RET-Y, RET-HE<br />
Probenmaterial: 3 ml EDTA-Blut<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 337
Rickettsien-Antikörper (IgM) (U)<br />
Abnahmehinweise: Proben werden bis zur tagesgleichen Abarbeitung bei Raumtemperatur aufbewahrt.<br />
Klinische Indikationen: Diagnose <strong>und</strong> Therapiemonitoring des Eisenmangels<br />
Methode: Streulicht-Methode<br />
Referenzbereiche: 28 – 35 pg<br />
Retinol-bindendes Protein (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Differentialdiagnostik der Proteinurien.<br />
Methode: Nephelometrie<br />
Referenzbereiche: 3,0 – 6,0 mg/dl<br />
Rhagozyten im Punktat<br />
Synonyme: Rhagozyten<br />
Probenmaterial: 1 ml Synovialflüssigkeit (Gelenkpunktat)<br />
Klinische Indikationen: Weitere Untersuchung bei der Synovialanalyse<br />
Methode: Mikroskopie<br />
Referenzbereiche: negativ<br />
Rhesusfaktor<br />
Methode: Agglutination<br />
Rheumafaktor<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle bei Erkrankungen des rheumatischen Formenkreises<br />
wie rheumatoide Arthritis (RA), Kollagenosen, Kryoglobulinämie<br />
Methode: Immunturbidimetrie<br />
Referenzbereiche: < 14 IU/ml<br />
Rickettsien-Antikörper (IgG) (U)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 7-21 Tage<br />
Klinische Indikationen: Verdacht auf Rickettsiose bei entsprechender Reiseanamnese sowie Fieber,<br />
makulopapulöses Exanthem (Fleckfieber), Kopfschmerz, Konjunktivitis, Hepatitis, selten schwere Organmanisfestationen<br />
wie Pneumonie, Meningitis, Sepsis <strong>und</strong> Myokarditis<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Rickettsien-Antikörper (IgM) (U)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 7-21 Tage<br />
Klinische Indikationen: Verdacht auf Rickettsiose bei entsprechender Reiseanamnese sowie Fieber,<br />
338 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Rifabutin (W)<br />
makulopapulöses Exanthem (Fleckfieber), Kopfschmerz, Konjunktivitis, Hepatitis, selten schwere Organmanisfestationen<br />
wie Pneumonie, Meningitis, Sepsis <strong>und</strong> Myokarditis<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Rifabutin (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Rifabutin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Rifampicin (U)<br />
Probenmaterial: 1 ml Serum, lichtgeschützt<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Rifampicin-Therapie<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Risperidon (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bitte beachten Sie, dass bei Verwendung von gelhaltigen Röhrchen die Resultate<br />
niedriger ausfallen können. Wir empfehlen, das Blut 30 min nach Abnahme zu zentrifugieren, das<br />
Serum abzutrennen <strong>und</strong> in ein zweites Neutral-Röhrchen zu überführen.<br />
Klinische Indikationen: Monitoring einer Risperidon-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Ristocetin-Cofaktor (U)<br />
Synonyme: vWF:RCo, von-Willebrand-Faktor-Aktiviät<br />
Probenmaterial: 2 ml Citrat-Blut<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Abklärung einer unklaren Blutungsneigung,<br />
Diagnostik des von-Willebrand-Syndroms als Eingangstest<br />
Methode: Agglutination<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Ritalinsäure (U)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme ca. 2 – 3 St<strong>und</strong>en nach oraler Gabe.<br />
Die Probe bitte lichtgeschützt aufbewahren.<br />
Klinische Indikationen: Plausibilitätskontrolle für die Einnahme von Methylphenidat<br />
Methode: LC-MS/MS<br />
Referenzbereiche: < 250 ng/ml<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 339
Rötelnvirus-Antikörper (IgG-Suchtest)<br />
Rotavirus-Antigen im Stuhl<br />
Synonyme: Gastroenteritis<br />
Probenmaterial: 2 g Stuhl<br />
Klinische Indikationen: Verdacht auf Rotavirus-Infektion, insbesondere bei akuter Diarrhoe <strong>und</strong><br />
Gastroenteritis bei Säuglingen, <strong>und</strong> Kindern<br />
Methode: EIA<br />
Referenzbereiche: negativ<br />
Rotavirus-Antikörper (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit ist ca. 1-3 Tage.<br />
Klinische Indikationen: Verdacht auf RotavirusInfektion bei akuter Gastroenteritis, insbesondere bei<br />
Säuglingen <strong>und</strong> Kleinkindern, selten bei Erwachsenen<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Rötelnvirus-Antikörper (IgG, Liquor/Serum)<br />
Synonyme: Röteln-AI, MRZ-Reaktion<br />
Probenmaterial: 1 ml Liquor <strong>und</strong><br />
1 ml Serum<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
Klinische Indikationen: Nachweis einer intrathekalen IgG-Synthese gegen Rötelnvirus bei akuten<br />
<strong>und</strong> auch chronischen ZNS-Erkrankungen.<br />
Methode: ELISA<br />
Referenzbereiche: 0,6 – 1,5 Index<br />
Rötelnvirus-Antikörper (IgG-Avidität) (W)<br />
Synonyme: Röteln-Avidität, Rubella, Rubeolen<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Untersuchung im Rahmen der Diagnostik einer Rötelnvirus-<br />
Infektion zur Eingrenzung des Infektionszeitpunktes<br />
Methode: Aviditätstest<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Rötelnvirus-Antikörper (IgG-Suchtest)<br />
Synonyme: Rubella, Rubeolen<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkuabtionszeit/das diagnostische Fenster beträgt ca. 14-21 Tage.<br />
Klinische Indikationen: Bestimmung der Immunitätslage nach Impfung bzw. nach durchgemachter<br />
Infektion oder Rötelnviruskontakt. Symptomatik: kleinfleckiges Rötelnexanthem, Lymphadenopathie,<br />
Arthralgie, Splenomegalie, Rötelnembryopathie (z.B. Mißbildungen von Herz <strong>und</strong> Augen, Taubheit,<br />
Hirndefekte, bei Infektion der Mutter im 1. Trimenon) Infektiosität: bereits 5-7 Tage vor Exanthemausbruch.<br />
Wichtig ist der Hinweis auf eine bestehende Schwangerschaft, bitt auch Anamnese,<br />
340 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Rötelnkontakt, vorangegangene Schutzimpfung <strong>und</strong> evtl. Vorbef<strong>und</strong>e mitteilen.<br />
Methode: CMIA<br />
Referenzbereiche: negativ: < 10 IE/ml (keine Immunität)<br />
positiv: >= 10 IE/ml (Immunität)<br />
Rötelnvirus-Antikörper (IgM-Suchtest)<br />
Rötelnvirus-Antikörper (IgM-Suchtest)<br />
Synonyme: Rubella, Rubeolen<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkuabtionszeit/das diagnostische Fenster beträgt ca. 14-21 Tage.<br />
Klinische Indikationen: Verdacht auf akute Rötelnvirusinfektion, insbesondere nach Kontakt.<br />
Symptomatik: kleinfleckiges Rötelnexanthem,<br />
Lymphadenopathie, Arthralgie, Splenomegalie,<br />
Rötelnembryopathie (z.B. Mißbildungen von Herz <strong>und</strong> Augen, Taubheit, Hirndefekte, bei Infektion<br />
der Mutter im 1. Trimenon)<br />
Infektiosität: bereits 5-7 Tage vor Exanthemausbruch.<br />
Wichtig ist der Hinweis auf eine bestehende Schwangerschaft, bitt auch Anamnese, Rötelnkontakt,<br />
vorangegangene Schutzimpfung <strong>und</strong> evtl. Vorbef<strong>und</strong>e mitteilen.<br />
Methode: CMIA<br />
Referenzbereiche: negativ (Index < 1,2)<br />
Rötelnvirus-RNA-Nachweis (W)<br />
Synonyme: Röteln-PCR, Rubella, Rubeolen<br />
Probenmaterial: 3 ml EDTA-Blut<br />
1 ml Liquor<br />
5 ml Urin<br />
Fruchtwasser<br />
Nasopharyngealsekret<br />
Bronchialsekret<br />
Klinische Indikationen: Verdacht auf Rötelnvirus-Infektion, insbesondere in der Schwangerschaft<br />
(pränatale Diagnostik) <strong>und</strong> bei Verdacht auf konnatale Infektion<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
RSV-Antigen-Nachweis<br />
Synonyme: Respiratory Syncytial-Virus-Schnelltest<br />
Probenmaterial: Tracheal-Sekret<br />
Nasopharyngeal-Sekret<br />
Abstrichmaterial<br />
Abnahmehinweise: Die Inkubationzeit beträgt ca. 3-6 Tage<br />
Klinische Indikationen: Kindliche Atemwegsinfektionen, atypische Pneumonien (Säuglinge, auch<br />
Kinder <strong>und</strong> Erwachsene), Bronchiolitis, Krupp<br />
Methode: EIA<br />
Referenzbereiche: negativ<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 341
Saccharomyces cerevisiae-Antikörper (W)<br />
RSV-Antikörper (IgA) (W)<br />
Synonyme: Respiratory Syncytial-Virus<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationzeit beträgt ca. 3-6 Tage; das diagnostische Fenster bis zum serologischen<br />
Nachweis beträgt ca. 10-14 Tage.<br />
Klinische Indikationen: Kindliche Atemwegsinfektionen, atypische Pneumonien (Säuglinge, auch<br />
Kinder <strong>und</strong> Erwachsene), Bronchiolitis, Krupp<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
RSV-Antikörper (IgG) (W)<br />
Synonyme: Respiratory Syncytial-Virus<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationzeit beträgt ca. 3-6 Tage; das diagnostische Fenster bis zum serologischen<br />
Nachweis beträgt ca. 10-14 Tage.<br />
Klinische Indikationen: Kindliche Atemwegsinfektionen, atypische Pneumonien (Säuglinge, auch<br />
Kinder <strong>und</strong> Erwachsene), Bronchiolitis, Krupp<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
RSV-RNA-Nachweis<br />
Synonyme: RSV-PCR, Respiratory Syncytial-Virus<br />
Probenmaterial: Nasopharyngealabstrich<br />
1 ml respiratorisches Material<br />
Abnahmehinweise: Die Inkubationzeit beträgt ca. 3-6 Tage<br />
Klinische Indikationen: Kindliche Atemwegsinfektionen, atypische Pneumonien (Säuglinge, auch<br />
Kinder <strong>und</strong> Erwachsene), Bronchiolitis, Krupp<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Rufinamid (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Monitoring einer Rufinamid-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Saccharomyces cerevisiae-Antikörper (W)<br />
Synonyme: ASCA, Morbus Crohn<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei chronisch-entzündlichen Darmerkrankungen, insbesondere<br />
bei Verdacht auf Morbus Crohn<br />
Methode: ELISA<br />
Referenzbereiche: < 25 U/ml<br />
342 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Salicylate (W)<br />
Synonyme: ASS<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamentengabe<br />
Klinische Indikationen: Monitoring einer Salicylat-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Salmonella paratyphi B-Antikörper (U)(N)<br />
Salicylate (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 7-14 Tage. Bei der akuten Erkrankung ist<br />
der Erregernachweis(z.B. aus Stuhlprobe) die Untersuchung der Wahl<br />
Klinische Indikationen: Diagnose einer Salmonellen-Infektion (Brechdurchfall, Enteritis, Arthritis<br />
Methode: Widal-Agglutination<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Salmonella typhi-Antikörper (H-Antigene) (U)(N)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 7-14 Tage. Bei der akuten Erkrankung ist<br />
der Erregernachweis(z.B. aus Stuhlprobe) die Untersuchung der Wahl<br />
Klinische Indikationen: Diagnose einer Salmonellen-Infektion (Brechdurchfall, Enteritis, Arthritis,<br />
Untersuchung nach Impfung gegen Typhus.<br />
Methode: Widal-Agglutination<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Salmonellen-Antikörper<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 7-14 Tage. Bei der akuten Erkrankung ist<br />
der Erregernachweis(z.B. aus Stuhlprobe) die Untersuchung der Wahl<br />
Klinische Indikationen: Diagnose einer Salmonellen-Infektion (Brechdurchfall, Enteritis, Arthritis,<br />
Untersuchung nach Impfung gegen Typhus oder Paratyphus.<br />
Methode: EIA<br />
Referenzbereiche: negativ (< 1,0 Ratio)<br />
Sandfliegen-Fieber-Virus-Antikörper (W)<br />
Synonyme: Sandfly Fever, Sandmückenfieber, Pappataci-Fieber, <strong>Dr</strong>ei-Tage-Fieber<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 3 – 5 Tage<br />
Klinische Indikationen: Verdacht auf Sandfliegen-Fieber bei entsprechender Reiseanamnese (Mittelmeerraum<br />
bis Pakistan) sowie klinischer Symptomatik: hohes Fieber, Kopfschmerzen, Konjunktivitis,<br />
Arthralgien, aseptische Meningitis.<br />
Als Erregerreservoir gelten Nutztiere <strong>und</strong> Mäuse. Die Übertragung erfolgt durch Stiche von Sandfliegen.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 343
Schistosomen-Antikörper (U)<br />
Methode: Immunoblot<br />
Referenzbereiche: negativ<br />
Saure Phosphatase<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Serum/Plasma bei längerem Probentransport<br />
abzentrifugiert werden.<br />
Klinische Indikationen: Verdacht auf Knochentumoren sowie Knochenmetastasen, Morbus Gaucher<br />
Methode: Photometrie<br />
Referenzbereiche: Frauen: < 6,5 U/l<br />
Männer: < 6,6 U/l<br />
Saure Prostata-Phosphatase<br />
Synonyme: PAP<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Die Bestimmung ist zur Diagnose des Prostatakarzinoms nicht ausreichend<br />
sensitiv<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Saures α-1-Glycoprotein (U)<br />
Synonyme: Orosomucoid<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufsbeurteilung akuter <strong>und</strong> chronischer Akute-Phase-<br />
Reaktionen bzw. Entzündungen sowie von Zellnekrosen <strong>und</strong> Tumoren<br />
Methode: Nephelometrie<br />
Referenzbereiche: 0,5 – 1,2 g/l<br />
SCC<br />
Synonyme: Squamous cell carcinoma antigen<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapie- <strong>und</strong> Verlaufskontrolle bei Plattenepithelkarzinomen von Zervix,<br />
Lunge, Ösophagus, Analkanal, HNO-Bereich<br />
Methode: CMIA<br />
Referenzbereiche: < 2,5 ng/ml<br />
Schilddrüsen-Autoantikörper<br />
Schistosomen-Antikörper (U)<br />
Synonyme: Bilharziose<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Serologie ist bedeutsam in den ersten drei Monaten der Infektion bis zum<br />
Ausscheiden der Schistosomen-Eier im Stuhl oder Urin (Präpatenz).<br />
344 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Schwefel (U)<br />
Klinische Indikationen: Verdacht auf Bilharziose, insbesondere bei entsprechender Reiseanamnese<br />
(z.B. Afrika, Ägypten, Zypern, Indien) bzw. klinischen Symptomen wie: Hämaturie, Zystitis, blutige<br />
Stühle, Hepatosplenomegalie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Schwefel (U)<br />
Probenmaterial: 2 ml Serum oder<br />
5 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
Klinische Indikationen: Verdacht auf Schwefelintoxikation<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
SDS-PAGE-Elektrophorese<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze) oder<br />
10 ml eines 2. Morgenurins<br />
Methode: PAGE<br />
Nephelometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Selen im Blut (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verdacht auf Selenmangel oder Selen-Intoxikation, Monitoring einer Selen-<br />
Therapie<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Selen im Urin (U)<br />
Probenmaterial: 10 ml Spontanurin<br />
Klinische Indikationen: Verdacht auf Selenmangel oder Selen-Intoxikation, Monitoring einer Selen-<br />
Therapie<br />
Methode: AAS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Septin9 (W)(N)<br />
Synonyme: Epi proColon; SEPT9; mSEPT9<br />
Probenmaterial: 2 x S-Monovette CPDA 8,5 ml<br />
Klinische Indikationen: Früherkennung eines Darmkrebs<br />
Methode: PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 345
Shigellen-Antikörper (W)<br />
Serotonin (W)<br />
Probenmaterial: 1 ml Serum oder 1 ml EDTA-Plasma<br />
Abnahmehinweise: Vollblut unmittelbar nach der Gerinnung sowie EDTA-Blut innerhalb von 30<br />
Minuten zentrifugieren, Plasma/Serum abpipettieren <strong>und</strong> einfrieren (ca. -20°C).<br />
3 Tage vor Abnahme folgende Nahrungsmittel <strong>und</strong> Medikamente absetzen:<br />
Ananas, Auberginen, Avocados, Bananen, Johannisbeeren, Melonen, Mirabellen, Stachelbeeren, Tomaten,<br />
Walnüsse, Zwetschgen, Chlorpromazin, Mephenesincarbamat, Methocarbamol.<br />
Paracetamol <strong>und</strong> ASS sollten ebenfalls 2 Tage vor der Untersuchung nicht mehr eingenommen werden.<br />
Klinische Indikationen: Karzinoid-Diagnostik<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Serotonin im Urin (W)<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (gesammelt über 5-10 ml Salzsäure oder<br />
Eisessig)<br />
Abnahmehinweise: Bitte Sammelmenge <strong>und</strong> Sammelzeit (falls geringer als 24 St<strong>und</strong>en) angeben,<br />
den Urin kühl sammeln <strong>und</strong> anschließend die Probe einfrieren (ca. – 20°C).<br />
Klinische Indikationen: Verdacht auf Karzinoid<br />
Methode: EIA<br />
Referenzbereiche: 50 – 250 µg/24 Std.<br />
Sertralin (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutabnahme gegebenenfalls vor der nächsten Tablettenabnahme<br />
Klinische Indikationen: Therapiekontolle/Monitoring einer Sertralin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
SHBG<br />
Synonyme: Sexualhormon-bindendes Globulin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei verminderter oder erhöhter Testosteronkonzentration<br />
Methode: CMIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Shigellen-Antikörper (W)<br />
Synonyme: Ruhr<br />
Probenmaterial: 3 ml Serum<br />
Abnahmehinweise: Das diagnostische Fenster beträgt ca. 7-14 Tage. Bei der akuten Erkrankung ist<br />
der Erregernachweis(z.B. aus Stuhlprobe) die Untersuchung der Wahl<br />
Klinische Indikationen: Die Diagnose der akuten Shigellose erfolgt ausschließlich durch den direkten<br />
Erregernachweis.<br />
346 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Sialinsäure (U)(N)<br />
Die serologische Diagnostik hat ihre Bedeutung bei retrospektiven epidemiologischen Untersuchungen<br />
oder der Abklärung einer parainfektiösen bzw. postenteritischen Arthritis<br />
Methode: Widal-Agglutination<br />
Referenzbereiche: < 1:50 Titer<br />
Sialinsäure (U)(N)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verdacht auf Sialinsäure-Speicherkrankheit (Salla-Syndrom, SSD) mit:<br />
- Hydrops fetalis, Ascites<br />
- Muskelhypotonie<br />
- Hepatosplenomegalie<br />
- vergröberte Gesichtszüge<br />
- Knochenfehlbildungen<br />
- schwere Bewegungsstörung<br />
- geistige Retardierung<br />
- Krämpfe<br />
Methode: HPLC<br />
Referenzbereiche: < 2,6 mmol/l<br />
Silber im Blut/Serum (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Beurteilung einer Silber-Belastung<br />
Methode: ICP/MS<br />
Referenzbereiche: < 0,3 µg/l<br />
Silber im Speichel (U)<br />
Probenmaterial: 2 ml Speichel<br />
Abnahmehinweise: Bei Durchführung des Kaugummitestes Entnahmezeit angeben<br />
Klinische Indikationen: Beurteilung einer Silber-Belastung<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Silber im Urin (U)<br />
Probenmaterial: 10 ml Spontanurin<br />
Klinische Indikationen: Beurteilung einer Silber-Belastung<br />
Methode: ICP/MS<br />
Referenzbereiche: < 0,9 µg/l<br />
Silicium (U)<br />
Synonyme: Silizium<br />
Probenmaterial: 2 ml Serum (Neutralmonovetten verwenden)<br />
Abnahmehinweise: Neutralmonovetten ohne jegliche Zusätze verwenden. Kein Gel. Keine<br />
Kügelchen. Keine Glasröhrchen.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 347
Sotalol (U)<br />
Klinische Indikationen: Beurteilung einer Silicium-Belastung, Intoxikation<br />
Methode: AAS<br />
Referenzbereiche: < 230 µg/l<br />
Sirolimus (W)<br />
Synonyme: SRL, Rapamycin, Rapamune ®<br />
Probenmaterial: 1 ml EDTA-Blut<br />
Abnahmehinweise: Zur Bestimmung des Talspiegels Blutentnahme direkt vor der nächsten Medikamentengabe.<br />
Das EDTA-Blut nach Abnahme direkt lichtgeschützt <strong>und</strong> gekühlt (+ 2°C – + 8°C) aufbewahren.<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Sirolimus-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Somatomedin C im Serum<br />
Synonyme: Insulin Like Growth Factor I, IGF-I<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Vollblut direkt nach der Gerinnung zentrifugieren, Serum abpipettieren <strong>und</strong> einfrieren<br />
(ca. -20°C)<br />
Klinische Indikationen: Diagnostik von Wachstumsstörungen im Kindesalter sowie von Akromegalie<br />
Methode: CLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Somatotropes Hormon<br />
Synonyme: STH, hGH, human Growth Hormon, Wachstumshormon<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bei der Blutentnahme Stress-Situationen vermeiden, Nüchternentnahme morgens<br />
um 08.00 Uhr (ca. 12 St<strong>und</strong>en Nahrungskarenz), Medikamente mit Einfluss auf STH möglichst<br />
3-4 Tage vorher absetzen<br />
Klinische Indikationen: Differentialdiagnostik von Wachstumsstörungen, Störungen der Hypophysenvorderlappenfunktion<br />
(Tumor, Insuffizienz)<br />
Methode: CLIA<br />
Referenzbereiche: Frauen: < 6,9 ng/ml<br />
Männer: < 1,2 ng/ml<br />
Sotalol (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Sotalol-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 1 – 3 mg/l<br />
348 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Sterinämie-Screening (W)<br />
Sterinämie-Screening (W)<br />
Synonyme: Smith-Lemli-Opitz-Syndrom<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Das Blut bitte nach der Abnahme zentrifugieren, das Serum bzw. Plasma in ein<br />
separates Röhrchen ohne Zusätze abpipettieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Verdacht auf Smith-Lemli-Opitz-Syndrom bei:<br />
- geistige Retardierung<br />
- Wachstumsprobleme<br />
- Entwicklungsstörungen<br />
- Dysmorphe Gesichtsveränderungen<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Stiripentol (U)<br />
Synonyme: Handelsname: Diacomit ®<br />
Probenmaterial: 1 ml Serum<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Strongyloides stercoralis-Antikörper (U)<br />
Synonyme: Nematoden<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Serologische Diagnostik bei unklaren Abdominalschmerzen, Übelkeit,<br />
Nüchternerbrechen, Eosinophilie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Strontium (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Beurteilung der Strontium-Belastung<br />
Methode: ICP/MS<br />
Referenzbereiche: 10 – 70 µg/l<br />
Styrol im Blut (U)<br />
Probenmaterial: Vollblut, spezielle Abnahmemonovetten (Rollrandröhrchen) verwenden<br />
Abnahmehinweise: Spezielle Abnahmemonovetten können angefordert werden.<br />
Klinische Indikationen: Beurteilung der Styrolbelastung, Intoxikation<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Sulpirid (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Sulpirid-Therapie<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 349
T3 gesamt<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Sultiam<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Sultiam-Therapie, Intoxikation<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Superoxiddismutase-Aktivität (W)<br />
Synonyme: SOD<br />
Probenmaterial: 2 ml EDTA-Blut<br />
Klinische Indikationen: Beurteilung der antioxidativen Kapazität<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
t,t-Muconsäure (U)<br />
Probenmaterial: 1 ml Urin<br />
Klinische Indikationen: Beurteilung der Benzolbelastung<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
T-Lymphozyten<br />
Synonyme: CD3-Zellen<br />
Probenmaterial: 3 ml EDTA-Vollblut<br />
Abnahmehinweise: EDTA-Monovette direkt nach der Abnahme durch Schwenken gründlich mischen.<br />
Klinische Indikationen: Primäre <strong>und</strong> sek<strong>und</strong>äre Imm<strong>und</strong>efekte, Monitoring der HIV-Infektion,<br />
hämatologische Systemerkrankungen<br />
Methode: Durchflusszytometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
T3 gesamt<br />
Synonyme: Trijodthyronin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei Verdacht auf eine Schilddrüsenfunktionsstörung,<br />
insbesondere bei pathologischem TSH basal.<br />
Die Untersuchung ist weitgehend zugunsten der Bestimmung des biologisch aktiven → fT3, Seite 247<br />
verlassen worden.<br />
Methode: ECLIA<br />
Referenzbereiche: Erwachsene: 0,8 – 2,0 ng/ml<br />
350 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
T4 gesamt<br />
T4 gesamt<br />
Synonyme: Thyroxin gesamt<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Weitere Diagnostik bei Verdacht auf eine Schilddrüsenfunktionsstörung,<br />
insbesondere bei pathologischem → TSH basal, Seite 367.<br />
Die Untersuchung ist weitgehend zugunsten der Bestimmung des biologisch aktiven → fT4, Seite 247<br />
verlassen worden.<br />
Methode: ECLIA<br />
Referenzbereiche: Erwachsene: 5,1 – 14,1 µg/dl<br />
Tamoxifen (U)<br />
Synonyme: Antiestrogen<br />
Probenmaterial: 2 ml EDTA-Plasma, lichtgeschützt<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Tamoxifen-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Tau-Protein im Liquor<br />
Probenmaterial: 1 ml Liquor in Polypropylen-Röhrchen<br />
Abnahmehinweise: Abnahme in anderen Probengefäßen kann zur Adsorption an der Gefäßwand<br />
führen (falsch-niedrige Messwerte)<br />
Klinische Indikationen: DD des M. Alzheimer, der CJD (Creutzfeldt-Jakob-Erkrankung, weiterer<br />
Demenzformen<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Tb-Interferon-Test (N)<br />
Synonyme: Interferon-gamma-release-assay (IGRA), Quantiferon<br />
Probenmaterial: 9 ml Lithium-Heparinblut<br />
Kinder: 5 ml Lithium-Heparinblut<br />
Abnahmehinweise: Blut tagesgleich ins Labor.<br />
Lagerung bei Raumtemperatur.<br />
Klinische Indikationen: - Verdacht auf eine aktive oder latente Tuberkulose<br />
- Umgebungsuntersuchung von Kontaktpersonen<br />
- Screening von Risikopatienten für eine Tuberkulose<br />
- Screening von Personen im Ges<strong>und</strong>heitswesen<br />
- Nachweis einer latenten Infektion vor immunsuppressiver Therapie<br />
Der Test ist NICHT geeignet zur:<br />
- Therapiekontrolle bei bestehender Tuberkulose<br />
- Tuberkulose-Diagnostik bei bereits anbehandelten Patienten<br />
Methode: ELISA<br />
Referenzbereiche: negativ<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 351
Testosteron, frei (W)<br />
TBG (W)<br />
Synonyme: Thyroxin-bindendes Globulin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Abklärung von T4-<strong>und</strong> T3-Konzentrationen, die nicht mit der TSH-<br />
Konzentration oder dem klinischen Bild in Einklang zu bringen sind,<br />
nicht erklärbare Diskrepanz zwischen T4 <strong>und</strong> FT4,<br />
stark erhöhtes oder erniedrigtes T4,<br />
Verdacht auf kongenitalen TBG-Mangel.<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Teicoplanin (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Teicoplanin-Therapie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Temazepam (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Temazepam-Therapie, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: therapeutischer Bereich: 200 – 800 ng/ml<br />
toxisch ab: > 1000 ng/ml<br />
Testosteron<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Wegen starker zirkadianer Schwankungen Blutentnahme morgens (ca. 8 Uhr)<br />
empfohlen<br />
Klinische Indikationen: Männer: Hypogonadismus, Kryptorchismus, erektile Dysfunktion, Hodentumoren,<br />
Therapiemonitoring<br />
Frauen: Ovarialtumoren, Virilisierung<br />
Methode: ECLIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Testosteron, frei (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Wegen starker zirkadianer Schwankungen Blutentnahme morgens (ca. 8 Uhr)<br />
empfohlen<br />
Klinische Indikationen: Männer: Hypogonadismus, Kryptorchismus, erektile Dysfunktion, Hodentumoren,<br />
Therapiemonitoring,<br />
insbesondere bei gestörter Eiweißbindung<br />
Methode: RIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
352 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Tetanus-Toxoid-Antikörper im Serum<br />
Tetanus-Toxoid-Antikörper im Serum<br />
Synonyme: Tetanus-Antitoxin, Tetanustoxin-Ak<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Der Test ist NUR zur Überprüfung der Immunitätslage geeignet.<br />
Klinische Indikationen: Überprüfung der Immunitätslage<br />
Methode: EIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Tetrachlorethen (U)<br />
Synonyme: PER, Perchlorethylen<br />
Probenmaterial: Vollblut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Spezielle Abnahmemonovetten können angefordert werden.<br />
Klinische Indikationen: Beurteilung der Tetrachlorethen-Belastung, Intoxikation<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Tetrachlormethan (U)(N)<br />
Synonyme: Tetrachlorkohlenstoff<br />
Probenmaterial: Vollblut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Spezielle Abnahmemonovetten können angefordert werden.<br />
Klinische Indikationen: Beurteilung einer Tetrachlormethan-Belastung, Intoxikation<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Tetrahydro-Aldosteron im Urin (U)<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: Bitte unbedingt die Sammelmenge angeben; Urin<br />
während der Sammelperiode kühl lagern.<br />
Ausreichend Ruhezeit während der Sammelperiode berücksichtigen.<br />
Wenn möglich Antihypertensiva 8 St<strong>und</strong>en vorher, Aldosteronantagonisten ca. 4 Wochen vorher absetzen.<br />
Klinische Indikationen: Weitere Diagnostik bei Verdacht auf primären Hyperaldosteronismus<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Tetrahydrofuran (U)<br />
Probenmaterial: 2 ml Serum oder<br />
10 ml Urin<br />
Klinische Indikationen: Beurteilung einer Tetrahydrofuran-Belastung, Intoxikation<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 353
Thiocyanat im Blut (U)<br />
Tetrazepam (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Tetrazepam-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: therapeutischer Bereich: 100 – 600 ng/ml<br />
Thallium im Blut/Serum (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme am Ende der Expositonszeit (Schichtende)<br />
Klinische Indikationen: Beurteilung der Thallium-Belastung, Intoxikation<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Thallium im Urin (W)<br />
Probenmaterial: 5 ml Urin<br />
Abnahmehinweise: Probennahme am Ende der Exposition (Schichtende)<br />
Klinische Indikationen: Beurteilung der Thallium-Belastung, Intoxikation<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Theophyllin<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bestimmung des Talspiegels: Entnahme direkt vor nächster Gabe Bestimmung<br />
des Spitzenspiegels: ca. 60 Minuten nach Gabe, bei Retardpräparaten nach ca. 4 St<strong>und</strong>en<br />
Klinische Indikationen: Monitoring einer Theopyllin-Therapie<br />
Methode: EIA<br />
Referenzbereiche: therapeutischer Bereich: 10 – 20 µg/ml<br />
Thiamazol (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Thiamazol-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Thiocyanat im Blut (U)<br />
Synonyme: Rhodanid<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse sollte das Blut nach dr Abnahme zentrifugiert<br />
<strong>und</strong> das Serum in ein separates Röhrchen ohne Zusätze abpipettiert werden.<br />
Klinische Indikationen: Verdacht auf Intoxikation, Ingestion bzw. Inhalation<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
354 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Thiopental (W)(N)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Thiopental-Therapie<br />
Methode: GC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Thiopurin-S-Methyltransferase (W)<br />
Thiopental (W)(N)<br />
Synonyme: TPMT-Phänotypisierung<br />
Probenmaterial: 2 ml EDTA-Blut<br />
Abnahmehinweise: Das EDTA-Blut NICHT einfrieren!<br />
Einflussfaktoren:<br />
Bei Bluttransfusionen bis zu 3 Monaten vor der<br />
Blutentnahme kann es zu einer Erhöhung der TPMT-Aktivität durch patientenfremde Erythrozyten<br />
kommen.<br />
Als Begleitmedikation verabreichte Medikamente<br />
können die TPMT-Aktivität beeinflussen. Eine<br />
Steigerung wird durch Thiopurine, eine Hemmung wird durch Sulfasalazin <strong>und</strong> Mesalazin verursacht.<br />
Klinische Indikationen: Im Rahmen einer geplanten oder durchgeführten Therapie mit Thiopurinen<br />
(Azathioprin, 6-Mercaptopurin, 6-Thioguanin).<br />
Methode: HPLC<br />
Referenzbereiche: normal: > 20 nmol/gHb*h<br />
heterozygote Schädigung: 10 – 20 nmol/gHb*h<br />
homozygote Schädigung: < 10 nmol/gHb*h<br />
Thiopurin-S-Methyltransferase Genotypisierung (U)(N)<br />
Synonyme: TPMT-Genotypisierung<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Zur Vermeidung einer Kontamination der Probe bitte ein separates<br />
Probenröhrchen einsenden !<br />
Klinische Indikationen: Im Rahmen einer geplanten oder durchgeführten Therapie mit Thiopurinen<br />
(Azathioprin, 6-Mercaptopurin, 6-Thioguanin).<br />
Methode: PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Thioridazin (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Thioridazin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Thrombin-Antithrombin-Komplex (W)<br />
Synonyme: TAT-Komplex<br />
Probenmaterial: 1 ml Citrat-Plasma<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 355
Thrombozyten-Antikörper (U)<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Verbrauchskoagulagulopathie (DIC), arterielle Verschlusskrankheit<br />
fibrinolytische Therapie<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Thrombinzeit<br />
Synonyme: TZ, Plasmathrombinzeit<br />
Probenmaterial: 1 ml Citrat-Plasma<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Fibrinpolymerisationsstörungen (Dysfibrinogenämie, Fibrin(ogen)-<br />
Spaltprodukte),<br />
Fibrinogenmangel,<br />
Heparin-oder Hirudintherapie,<br />
Verbrauchskoagulopathie<br />
Methode: Koagulometrie<br />
Referenzbereiche: 10,3 – 16,6 Sek.<br />
Thromboplastinzeit<br />
Synonyme: TPZ, Prothrombinzeit, Quick, INR<br />
Referenzbereiche: 70 – 130 %<br />
Thrombozyten<br />
Probenmaterial: Korrekt gefüllte EDTA-Monovette.<br />
Bei EDTA-induzierter Pseudothrombozytopenie Abnahme<br />
einer Citratblut-Monovette.<br />
Abnahmehinweise: Monovette direkt nach der Abnahme durch Schwenken gründlich mischen<br />
Klinische Indikationen: Unklare Blutungen, Abklärung einer Blutungsneigung, Therapiekontrolle<br />
bei Bestrahlung, Chemotherapie u.a., Verdacht auf Knochenmarkerkrankung, Therapiekontrolle bei<br />
Medikemanten<br />
Methode: maschinelle Zellzählung<br />
Referenzbereiche: Erwachsene: 150 – 351 /nl<br />
Thrombozyten-Antikörper (U)<br />
Probenmaterial: 1 ml Serum (freie Thrombozyten-Antikörper)<br />
2 ml EDTA-Blut (geb<strong>und</strong>ene Thrombozyten-Antikörper)<br />
Klinische Indikationen: Weitere Untersuchung bei unklarer Thrombozytopenie oder Verdacht auf<br />
Autoimmun-Thrombozytopenie<br />
Methode: EIA (freie Thrombozyten-Antikörper)<br />
Durchflusszytometrie (geb<strong>und</strong>ene Thrombozyten-Antikörper)<br />
Referenzbereiche: negativ<br />
356 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Thymidin-Kinase<br />
Thymidin-Kinase<br />
Synonyme: TK, Thymidinkinase<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Monitoring bei Tumoren mit hoher Zellumsatzrate (Proliferationsrate), insbesondere<br />
bei hämatoonkologischen Erkrankungen (Leukämien, Lymphome)<br />
Methode: CLIA<br />
Referenzbereiche: 2,0 – 7,5 U/l<br />
Thyreoglobulin<br />
Synonyme: hTG, TG<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verlaufskontrolle des differenzierten Schilddrüsenkarzinoms, destruierende<br />
Thyreoiditis (Thryeoiditis de Quervain), Thyreotoxicosis factitia<br />
Methode: CMIA<br />
Referenzbereiche: < 4,11 IE/ml<br />
Tiagabin (U)<br />
Synonyme: Gabitril ®<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Tiagabin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Tiaprid (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Tiaprid-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 1,0 – 2,0 mg/l<br />
Tilidin (U)<br />
Synonyme: Handelsname: Valoron ®<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Tilidin-Therapie, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Tilidin im Urin, qualitativ (U)<br />
Probenmaterial: 10 ml Spontanurin<br />
Klinische Indikationen: Nachweis von Tilidin-Missbrauch.<br />
Methode: GC/MS<br />
Referenzbereiche: negativ<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 357
Toxic-schock-syndrome-Toxin-Nachweis (U)<br />
tissue-Plasminogen-Aktivator (t-PA) (U)<br />
Synonyme: t-PA immunologisch<br />
Probenmaterial: 2 ml Citrat-Plasma<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Beurteilung des fibrinolytischen Potenzials bei speziellen, meist wissenschaftlichen<br />
Fragestellungen<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Tobramycin<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bestimmung des Talspiegels: Entnahme direkt vor nächster Gabe<br />
Bestimmung des Spitzenspiegels: ca. 60 Minuten nach i.v.-Gabe<br />
Klinische Indikationen: Monitoring der Tobramycin-Therapie<br />
Methode: PETNIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Tollwut-Antikörper (U)<br />
Synonyme: Rabies, Lyssa<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Kontaktaufnahme mit dem Nationalen Tollwutreferenzlabor in Wusterhausen<br />
(Tel.: 033979-80186) wird dringend empfohlen<br />
Klinische Indikationen: Feststellung des Immunstatus<br />
Methode: Neutralisationstest<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Toluol im Blut (W)<br />
Probenmaterial: 8 ml NaF-Blut<br />
Klinische Indikationen: Kontrolle der Belastung mit aromatischen Kohlenwasserstoffen am Arbeitsplatz,<br />
Vergiftungsausschluss<br />
Methode: GC<br />
Referenzbereiche: < 20 µg/l<br />
Topiramat (W)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Monitoring einer Topiramat-Therapie<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Toxic-schock-syndrome-Toxin-Nachweis (U)<br />
Synonyme: TSST-1-PCR, Toxisches Schock-Syndrom, Mikrobiologie<br />
Probenmaterial: Vaginal-, Cervixsekret<br />
Tampons<br />
358 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Toxocara canis-Antikörper (U)<br />
W<strong>und</strong>abstriche mit Transportmedium<br />
Klinische Indikationen: Verdacht auf Toxisches Schock-Syndrom bei Risikopatienten mit folgenden<br />
Symptomen:<br />
- Fieber > 39°C<br />
- diffuses makulöses Exanthem<br />
- Hypotonie<br />
- ggf. Multiorganversagen<br />
- Erbrechen, Übelkeit, Diarrhoe<br />
- ausgeprägte Myalgien (Kreatininerhöhung im Serum)<br />
- Hyperämie der Schleimhäute<br />
- Pyurie ohne Nachweis einer Harnwegsinfektion<br />
- Erhöhung von Transaminasen, Bilirubin, AP<br />
- Desorientiertheit, Bewusstseinsstörung<br />
Methode: PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Toxocara canis-Antikörper (U)<br />
Synonyme: H<strong>und</strong>espulwurm<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit kann Wochen bis Monate betragen<br />
Klinische Indikationen: Verdacht auf H<strong>und</strong>espulwurm-Infektion bei möglichem Risikokontakt<br />
(Tierkontakt, Sandkasten) bzw. klinischer Symptomatik: Eosinophilie, Hepatomegalie, Asthma, einseitige<br />
Augeninfektion, Abdominalschmerzen, Chorioretinitis.<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Toxoplasma gondii-Antikörper (IgG-Avidität) (W)<br />
Synonyme: Toxoplasmose<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkukubationszeit beträgt ca. 2-4 Wochen, das diagnostische Fenster beträgt<br />
ca. 7-21 Tage.<br />
Klinische Indikationen: Bei reaktivem T. gondii-Suchtest sowie Verdacht auf Toxoplasmose nach<br />
Kontakt (z.B. kontaminierte bzw. nicht ausreichend gegarte oder gesäuberte Nahrungsmittel, Katzen,<br />
Katzenkot)<br />
bei grippeähnlichen Symptomen, Lymphadenitis,<br />
bei Immunsupprimierten mit Myokarditis, Enzephalitis, Pneumonie,<br />
in der Schwangerschaft (Gefahr der konnatalen Toxoplasmose mit Hydrozephalus, intrazerebralen<br />
Verkalkungen, Retinochorioiditis)<br />
Methode: Aviditätstest<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Toxoplasma gondii-Antikörper (IgG-Suchtest)<br />
Synonyme: Toxoplasmose<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkukubationszeit beträgt ca. 2-4 Wochen, das diagnostische Fenster beträgt<br />
ca. 7-21 Tage.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 359
Toxoplasmose-Antikörper (Liquor/Serum) (W)<br />
Klinische Indikationen: Verdacht auf Toxoplasmose nach Kontakt (z.B. kontaminierte bzw. nicht<br />
ausreichend gegarte oder gesäuberte Nahrungsmittel, Katzen, Katzenkot)<br />
bei grippeähnlichen Symptomen, Lymphadenitis,<br />
bei Immunsupprimierten mit Myokarditis, Enzephalitis, Pneumonie,<br />
in der Schwangerschaft (Gefahr der konnatalen Toxoplasmose mit Hydrozephalus, intrazerebralen<br />
Verkalkungen, Retinochorioiditis)<br />
Methode: CMIA<br />
Referenzbereiche: nicht reaktiv: < 1,6 IE/ml<br />
Grauzone: 1,6 – 2,9 IE/ml<br />
reaktiv: >= 3,0 IE/ml<br />
Toxoplasma gondii-Antikörper (IgM-Suchtest)<br />
Synonyme: Toxoplasmose<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkukubationszeit beträgt ca. 2-4 Wochen, das diagnostische Fenster beträgt<br />
ca. 7-21 Tage.<br />
Klinische Indikationen: Verdacht auf Toxoplasmose nach Kontakt (z.B. kontaminierte bzw. nicht<br />
ausreichend gegarte oder gesäuberte Nahrungsmittel, Katzen, Katzenkot) bei grippeähnlichen Symptomen,<br />
Lymphadenitis, bei Immunsupprimierten mit Myokarditis, Enzephalitis, Pneumonie, in<br />
der Schwangerschaft (Gefahr der konnatalen Toxoplasmose mit Hydrozephalus, intrazerebralen<br />
Verkalkungen, Retinochorioiditis)<br />
Methode: CMIA<br />
Referenzbereiche: nicht reaktiv: < 0,5 Index<br />
Grauzone: 0,5 – 0,6 Index<br />
reaktiv: > 0,6 Index<br />
Toxoplasma gondii-DNA-Nachweis (W)<br />
Synonyme: Toxoplasma gondii-PCR<br />
Probenmaterial: je nach Indikation:<br />
1 ml Liquor<br />
3 ml EDTA-Blut<br />
Bronchialsekret<br />
Fruchtwasser<br />
Abnahmehinweise: Für diese Untersuchung ist ein separates Röhrchen zu entnehmen.<br />
Klinische Indikationen: Verdacht auf Primärinfektion mit Toxoplasma gondii <strong>und</strong> auffälliger Ultraschalluntersuchung<br />
(Hydrozephalus, intrazerebrale Verkalkungen) in der Schwangerschaft,<br />
Verdacht auf konnatale Toxoplasmose,<br />
Verdacht auf ZNS-Toxoplasmose bei Immunsuppression<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Toxoplasmose-Antikörper (Liquor/Serum) (W)<br />
Synonyme: Toxoplasmose-AI<br />
Probenmaterial: 1 ml Serum <strong>und</strong> 1 ml Liquor<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
360 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Toxoplasmose-Serologie<br />
Klinische Indikationen: Nachweis einer intrathekalen Synthese von Antikörpern gegen Toxoplasma<br />
gondii bei Verdacht auf eine Enzephalitis durch Toxoplasma gondii.<br />
Methode: IFT<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Toxoplasmose-Serologie<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Die Inkukubationszeit beträgt ca. 2-4 Wochen, das diagnostische Fenster beträgt<br />
ca. 7-21 Tage.<br />
Klinische Indikationen: Diagnose, Bestätigung oder Eingrenzung des Infektionszeitpunktes bei<br />
Verdacht auf Toxoplasmose nach Kontakt (z.B. kontaminierte bzw. nicht ausreichend gegarte oder<br />
gesäuberte Nahrungsmittel, Katzen, Katzenkot)<br />
bei grippeähnlichen Symptomen, Lymphadenitis,<br />
bei Immunsupprimierten mit Myokarditis, Enzephalitis, Pneumonie,<br />
in der Schwangerschaft (Gefahr der konnatalen Toxoplasmose mit Hydrozephalus, intrazerebralen<br />
Verkalkungen, Retinochorioiditis)<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
TPA<br />
Synonyme: Tissue Polypeptide Antigen<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise:<br />
Klinische Indikationen: Aufgr<strong>und</strong> verminderter Spezifität wurde die Untersuchung weitgehend verlassen<br />
Methode: CLIA<br />
Referenzbereiche: < 75 U/l<br />
TPPA (Lues-Suchreaktion)<br />
Synonyme: Treponema-pallidum-Partikel-Assay, Syphilis<br />
Probenmaterial: 1 ml Serum <strong>und</strong>/oder<br />
1 ml Liquor<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 14 (3-90) Tage. Das diagnostische Fenster beträgt<br />
ca. 3-5 Wochen.<br />
Klinische Indikationen: Verdacht auf eine Treponema pallidum-Infektion (Lues, Syphilis), insbesondere<br />
bei unklarem Exanthem, Schwangerschaftsvorsorge<br />
Methode: Partikelagglutination<br />
Referenzbereiche: negativ<br />
Tramadol (U)(N)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Tramadol-Therapie, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: therapeutischer Bereich: 100 – 800 ng/ml<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 361
TRAP 5b (W)<br />
Transferrin<br />
Probenmaterial: 1 ml Serum <strong>und</strong>/oder<br />
10 ml Spontanurin<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Therapiekontrolle von Eisenmangel <strong>und</strong> Eisenüberladung<br />
sowie von Eisenverteilungsstörungen<br />
Referenzbereiche: Serum: 2,0 – 3,6 g/l<br />
Urin: < 2,0 mg/l<br />
Transferrinsättigung<br />
Synonyme: TfS%<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Da bereits eine Mikrohämolyse den Messwert für Eisen beeinflussen kann, sollte<br />
das Vollblut innerhalb von 30 Minuten nach der Blutentnahme zentrifugiert <strong>und</strong> nur das Serum<br />
(hämolysefrei) eingeschickt werden<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufsbeurteilung von Eisenmangel, Eisenüberladung <strong>und</strong><br />
Eisenverteilungsstörungen<br />
Referenzbereiche: Erwachsene: 16 – 45 %<br />
Transglutaminase-Antikörper im Stuhl (IgA) (W)(N)<br />
Probenmaterial: 1 g Stuhl<br />
Klinische Indikationen: Screening-Untersuchung bei Verdacht auf Zöliakie bei erschwerter Blutentnahme<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Tranylcypromin (U)<br />
Synonyme: Handelsname: Jatrosom ®<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Tranylcypromintherapie, Missbrauchskontrolle<br />
Methode: HPLC<br />
Referenzbereiche: therapeutischer Bereich: 20 – 50 ng/ml<br />
toxisch ab: > 500 ng/ml<br />
TRAP 5b (W)<br />
Synonyme: Tartrat-resistente Saure Phosphatase<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Wegen der kurzen Haltbarkeit <strong>und</strong> zur Vermeidung einer die Analyse störenden<br />
Hämolyse sollte das Blut innerhalb von 2 St<strong>und</strong>en nach der Blutentnahme zentrifugiert, das Serum in<br />
ein separates Röhrchen abpipettiert <strong>und</strong> dann eingefroren werden (ca. – 20°C)<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle bei Verdacht auf erhöhten Knochenabbau,<br />
insbesondere bei Dialyse-Patienten oder sehr niedriger Kreatinin-Clearance (< 50 ml/min.)<br />
Methode: ELISA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
362 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Trazodon (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Trazodon-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Treponema pallidum Antikörper in Liquor/Serum<br />
Trazodon (U)<br />
Synonyme: Lues-AI, Neurosyphilis<br />
Probenmaterial: 1 ml Liquor <strong>und</strong> 1 ml Serum<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
Klinische Indikationen: Nachweis einer intrathekalen IgG-Synthese gegen Treponema pallidum bei<br />
Verdacht auf Neurolues<br />
Methode: Partikelagglutination<br />
Referenzbereiche: < 4,0 Index<br />
Treponema pallidum-Antikörper (IgG/IgM)<br />
Synonyme: Lues-Suchreaktion, Lues, Syphilis<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 14 (3-90) Tage. Das diagnostische Fenster beträgt<br />
ca. 3-5 Wochen.<br />
Klinische Indikationen: Verdacht auf eine Treponema pallidum-Infektion (Lues, Syphilis), insbesondere<br />
bei unklarem Exanthem, Schwangerschaftsvorsorge<br />
Methode: CMIA<br />
Referenzbereiche: negativ<br />
Treponema pallidum-Antikörper (IgM-Westernblot) (U)<br />
Synonyme: Lues-Bestätigung, Syphilis<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Bestätigung eines reaktiven Lues-Suchtestes (IgG/IgM)<br />
Methode: Immunoblot<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Trichinella spiralis-Antikörper (U)<br />
Synonyme: Trichinen-Infektion<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 7 Tage; das diagnostische Fenster beträgt ca. 10-<br />
14 Tage.<br />
Klinische Indikationen: Verdacht auf Infektion mit Trichinella spiralis (Nematode) bei blutiger Diarrhoe,<br />
Muskelschmerzen, Augenödemen <strong>und</strong> Risikokontakt (nicht ausreichend gegartes Fleisch, meist<br />
Schweinefleisch)<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 363
Trichlorethen (U)(N)<br />
Trichloressigsäure im Urin (U)<br />
Synonyme: TCE, TCA<br />
Probenmaterial: 10 ml Urin<br />
Abnahmehinweise: Urin am Schichtende bzw. nach mehreren vorangegangenen Schichten gewinnen.<br />
Klinische Indikationen: Beurteilung einer Trichloressigsäure-Belastung, Intoxikation<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Trichlorethan im Blut (U)(N)<br />
Synonyme: 1,1,1-Trichlorethan<br />
Probenmaterial: Vollblut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Spezielle Abnahmemonovetten können angefordert werden.<br />
Abnahme möglichst unmittelbar nach der Exposition.<br />
Klinische Indikationen: Beurteilung der Trichlorethanbelastung<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Trichlorethanol im Blut (U)<br />
Probenmaterial: Vollblut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Spezielle Abnahmemonovetten können angefordert<br />
werden.<br />
Klinische Indikationen: Beurteilung einer Trichlorethanol-Belastung, Intoxikation<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Trichlorethanol im Urin (U)<br />
Synonyme: TCÄ<br />
Probenmaterial: 10 ml Urin<br />
Klinische Indikationen: Beurteilung einer Trichlorethanol-Belastung, Intoxikation<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Trichlorethen (U)(N)<br />
Synonyme: Trichlorethylen, TRI<br />
Probenmaterial: Vollblut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Spezielle Abnahmemonovetten können angefordert<br />
werden.<br />
Abnahme möglichst unmittelbar nach der Exposition.<br />
Klinische Indikationen: Beurteilung der Trichlorethylen-Belastung, Intoxikation<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
364 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Trichlormethan im Blut (U)(N)<br />
Trichlormethan im Blut (U)(N)<br />
Synonyme: Chloroform<br />
Probenmaterial: Vollblut, spezielle Abnahmemonovetten verwenden<br />
Abnahmehinweise: Spezielle Abnahmemonovetten können angefordert<br />
werden.<br />
Klinische Indikationen: Verdacht auf Intoxikation bei entsprechender Anamnese <strong>und</strong> Symptomen<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Triglyceride<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutentnahme nüchtern (ca. 12 St<strong>und</strong>en Nahrungskarenz), langes Stauen vermeiden<br />
Klinische Indikationen: Screening eines Atherosklerose-Risikos,<br />
Diagnose <strong>und</strong> Verlaufsbeurteilung einer Fettstoffwechselstörung<br />
Methode: enzymatisch<br />
Referenzbereiche: < 200 mg/dl<br />
Trimipramin<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Trimipramin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: 20 – 200 µg/l<br />
Triple-Test (U)<br />
Probenmaterial: 2 ml Serum<br />
Trizyklische Antidepressiva im Urin (U)<br />
Synonyme: qualitativer Medikamentennachweis<br />
Probenmaterial: 10 ml Urin<br />
Abnahmehinweise: ggf. Probennahme überwachen<br />
Klinische Indikationen: Suchtest zum Nachweis des Gebrauchs von trizyklischen Antidepressiva<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Tropheryma whippelii-DNA-Nachweis (W)<br />
Synonyme: T. whippelii-PCR, Morbus Whipple<br />
Probenmaterial: je nach Indikation:<br />
3 ml EDTA-Blut<br />
2 g Stuhl<br />
Dünndarmbiopsie (tiefgefroren)<br />
Knochenmarkaspirat<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 365
Trypsin (U)<br />
1 ml Liquor<br />
Synovia<br />
Klinische Indikationen: Verdacht auf Morbus Whipple bei<br />
- Diarrhoe, Steatorrhoe<br />
- Malabsorptions-Syndrom<br />
- Abdominalschmerzen, Gewichtsverlust<br />
- Enteropathische (seronegative) Arthritis<br />
- Enteropathische (seronegative) Sakroiliitis<br />
- Fieber, Polyserositis<br />
- mesenteriale, retroperitoneale Lymphknotenvergrößerungen<br />
- ggf. Manifestation kardial (z.B. Endokarditis)<br />
- ggf. Manifestation im ZNS (z.B. Störung der Oculomotorik)<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Troponin I (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verdacht auf Myokardzellschädigung (akutes Koronar-Syndrom,<br />
Myokardinfarkt, Angina pectoris,<br />
Myokarditis, postoperativ nach Herzoperationen)<br />
Methode: CMIA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Troponin T-Schnelltest (N)<br />
Probenmaterial: 1 ml EDTA-Blut<br />
Klinische Indikationen: Verdacht auf Myokardzellschädigung (akutes Koronar-Syndrom,<br />
Myokardinfarkt, Angina pectoris,<br />
Myokarditis, postoperativ nach Herzoperationen)<br />
Methode: IA<br />
Referenzbereiche: negativ<br />
Trypanosoma cruzi-Antikörper (U)<br />
Synonyme: Chagas-Krankheit<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 1-4 Wochen.<br />
Klinische Indikationen: Verdacht auf südamerikanische Trypanosomiasis (Chagas-Krankheit) bei<br />
entsprechender Reiseanamnese <strong>und</strong> klinischer Symptomatik: Fieber, Lymphadenopathie, Hepatosplenomegalie,<br />
später Herzrhythmusstörungen <strong>und</strong> gastrointestinale Symptome<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Trypsin (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufsbeurteilung der Pankreatitis, Pankreasfibrose,<br />
Pankreaskarzinom, Neugeborenen-Screening (5. Lebenstag)<br />
366 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: RIA<br />
Referenzbereiche: Erwachsene: 10 – 57 µg/l<br />
Tryptase<br />
Tryptase<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Blutabnahme sollte ca. 15 Minuten bis 3 St<strong>und</strong>en nach einer fraglichen anaphylaktischen<br />
Reaktion erfolgen, im Einzelfall auch später.<br />
Klinische Indikationen: Nachweis der Mastzellbeteiligung bei allergischen Reaktionen (besonders<br />
nach Insektenstich, Nahrungsmittelkontakt, Pharmakagabe),<br />
Differentialdiagnostik einer unklaren Schockreaktion,<br />
Verdacht auf Mastozytose<br />
Methode: FEIA<br />
Referenzbereiche: < 11,4 µg/l<br />
TSH basal<br />
Synonyme: Thyreoidea stimulierendes Hormon, Thyreotropin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Screeninguntersuchung zur Diagnose einer Hypothyreose oder Hyperthyreose,<br />
Verlaufskontrolle unter Therapie von Schilddrüsenfunktionsstörungen,<br />
Abklärung einer Hypoprolaktinämie<br />
Abklärung einer Hypercholesterinämie<br />
Methode: ECLIA<br />
Referenzbereiche: Erwachsene: 0,27 – 4,2 µlU/ml<br />
Tumor M2-PK (U)(N)<br />
Synonyme: M2-PK<br />
Probenmaterial: 1 ml EDTA-Plasma<br />
Abnahmehinweise: EDTA-Blut direkt nach der Abnahme zentrifugieren <strong>und</strong> das Plasma abpipettieren<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufskontrolle von Karzinomen von Niere, Pankreas,<br />
Magen<br />
Methode: EIA<br />
Referenzbereiche: < 15,0 U/ml<br />
Tumor M2-PK im Stuhl (W)<br />
Synonyme: M2-PK<br />
Probenmaterial: 1 g Stuhl<br />
Abnahmehinweise: Die Probe bitte unmittelbar nach der Gewinnung einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Weitere Untersuchung bei Verdacht auf kolorektales Karzinom<br />
Methode: EIA<br />
Referenzbereiche: < 4,0 U/ml<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 367
Valproinsäure<br />
Tumor Nekrose Faktor (U)<br />
Synonyme: TNF α, Kachektin, Lymphotoxin<br />
Probenmaterial: 1 ml EDTA-Plasma oder Serum<br />
1 ml Liquor<br />
Abnahmehinweise: Das Blut innerhalb von 2 St<strong>und</strong>en nach der Abnahme zentrifugieren, Plasma<br />
bzw. Serum abpipettieren <strong>und</strong> einfrieren (ca. – 20°C)<br />
Klinische Indikationen: Diagnostik <strong>und</strong> Verlaufsbeurteilung von SIRS <strong>und</strong> Sepsis<br />
Methode: Flowzytometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
UDP-Galaktose-Epimerase (U)(N)<br />
Probenmaterial: 2 ml EDTA-Blut<br />
Klinische Indikationen: Verdacht auf Galaktosämie<br />
Referenzbereiche: 19 – 35 µmol/h/gHb<br />
Urinsediment<br />
Probenmaterial: 10 ml Urin<br />
(Spontan-, Mittelstrahl-, Katheter-, Punktionsurin)<br />
Klinische Indikationen: Diagnostik von Erkrankungen der Niere <strong>und</strong> der ableitenden Harnwege<br />
Methode: Mikroskopie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Urinstatus<br />
Probenmaterial: 10 ml Urin<br />
(Spontan-, Mittelstrahl-, Katheter-, Punktionsurin)<br />
Klinische Indikationen: Diagnostik von Erkrankungen der Niere <strong>und</strong> der ableitenden Harnwege<br />
Methode: Teststreifen<br />
Referenzbereiche: Leukozyten: negativ / +<br />
Nitrit: negativ<br />
pH-Wert: 4,8 – 7,5<br />
Eiweiss: negativ / +<br />
Glukose: normal<br />
Keton: negativ<br />
Urobilinogen: normal / +<br />
Bilirubin: negativ<br />
Erythrozyten/Hb: negativ / +<br />
Hämoglobin: negativ / +<br />
Spez. Gewicht: 1,015 – 1,025<br />
Valproinsäure<br />
Synonyme: Valproinat, Dipropylacetat<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Bestimmung des max. Spiegels: ca. 1-4 (-8) St<strong>und</strong>en nach<br />
368 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Medikamenteneinnahme<br />
Bestimmung des Talspiegels: vor der nächsten Medikamenteneinnahme<br />
Klinische Indikationen: Monitoring einer Valproinat-Therapie<br />
Methode: PETNIA<br />
Referenzbereiche: bis 13 Jahre: s. Bef<strong>und</strong>bericht<br />
> 13 Jahre: 50 – 100 µg/ml<br />
Vanadium im Serum (U)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme am Ende der Expositionszeit (Schichtende)<br />
Klinische Indikationen: Beurteilung der Vanadium-Belastung, Intoxikation<br />
Methode: AAS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Vanadium im Urin (U)<br />
Probenmaterial: 10 ml Urin<br />
Abnahmehinweise: Probennahme am Ende der Expositonszeit (Schichtende)<br />
Klinische Indikationen: Beurteilung der Vanadium-Belastung, Intoxikation<br />
Methode: AAS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Vancomycin<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Bestimmung des Talspiegels: Entnahme direkt vor nächster Gabe<br />
Bestimmung des Spitzenspiegels: ca. 60 Minuten nach i.v.-Gabe<br />
Klinische Indikationen: Monitoring einer Vancomycin-Therapie<br />
Methode: CMIA<br />
Referenzbereiche: Talspiegel: 5 – 10 mg/l<br />
Spitzenspiegel: 30 – 40 mg/l<br />
Vanillinmandelsäure im Urin<br />
Vanadium im Serum (U)<br />
Synonyme: VMS, Katecholamine<br />
Probenmaterial: 20 ml eines 24-St<strong>und</strong>en-Sammelurins<br />
(gesammelt in lichtgeschütztem Gefäß über 5-10 ml Salzsäure oder Eisessig)<br />
Abnahmehinweise: Bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die<br />
Sammelzeit (wenn nicht 24 St<strong>und</strong>en) angeben.<br />
Medikamente, sofern möglich, ca. 1 Woche vorher absetzen.<br />
Ca. 3 Tage vorher Vermeiden von Kaffee, Tee,<br />
Nikotin, Bananen, Käse, Nüssen, Schokolade, Eiern.<br />
Klinische Indikationen: Tumoren des sympatho-adrenergen Systems, Neuroblastome, episodenhafte<br />
oder therapieresistente Hypertonie, Inzidentalom, Familienuntersuchung<br />
Methode: HPLC<br />
Referenzbereiche: < 6,6 mg/24 Std.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 369
Varizella-Zoster-Virus-Antikörper (IgG, Liquor/Serum)<br />
Varizella-Zoster Virus-DNA-Nachweis<br />
Synonyme: VZV-PCR<br />
Probenmaterial: je nach Indikation:<br />
1 ml Liquor<br />
3 ml EDTA-Blut<br />
Bläscheninhalt (Trockenabstrich)<br />
Kammerwasser<br />
Abnahmehinweise: Die Inkubationszeit beträgt ca. 8-21 Tage<br />
Klinische Indikationen: Nachweis von VZV bei unklarem Exanthem <strong>und</strong> Verdacht auf VZV-<br />
Infektion<br />
Methode: PCR<br />
Referenzbereiche: negativ<br />
Varizella-Zoster-Virus-Antikörper (IgA)<br />
Synonyme: VZV<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit/das diagnostische Fenster beträgt ca. 8-21 Tage.<br />
Klinische Indikationen: Verdacht auf VZV-Primärinfektion, insbesondere in der Schwangerschaft<br />
(Gefahr des kongenitalen VZV-Syndrom) bei typischem Exanthem <strong>und</strong> bei Verdacht auf reaktivierte<br />
Infektion (Herpes zoster, Fazialisparese, Neuritis, ZNS-Erkrankung)<br />
Methode: EIA<br />
Referenzbereiche: negativ: < 35 U/ml<br />
grenzwertig: 35 – 50 U/ml<br />
positiv: > 50 U/ml<br />
Varizella-Zoster-Virus-Antikörper (IgG)<br />
Synonyme: VZV<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit/das diagnostische Fenster beträgt ca. 8-21 Tage.<br />
Klinische Indikationen: Bestimmung der Immunitätslage bei Verdacht auf VZV-Primärinfektion,<br />
insbesondere in der Schwangerschaft (Gefahr des kongenitalen VZV-Syndrom) bei typischem Exanthem<br />
<strong>und</strong> bei Verdacht auf reaktivierter Infektion (Herpes zoster, Fazialisparese, Neuritis, ZNS-<br />
Erkrankung)<br />
Methode: EIA<br />
Referenzbereiche: negativ: < 50 mIU/ml<br />
grenzwertig: 50 – 100 mIU/ml<br />
positiv: > 100 mIU/ml<br />
Varizella-Zoster-Virus-Antikörper (IgG, Liquor/Serum)<br />
Synonyme: VZV-AI, MRZ-Reaktion<br />
Probenmaterial: 1 ml Liquor <strong>und</strong> 1 ml Serum<br />
Abnahmehinweise: Liquor <strong>und</strong> Serum gleichzeitig abnehmen.<br />
Klinische Indikationen: Nachweis einer intrathekalen IgG-Synthese gegen VZV bei akuten <strong>und</strong> auch<br />
chronischen ZNS-Erkrankungen.<br />
370 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Methode: EIA<br />
Referenzbereiche: 0,6 – 1,5 Index<br />
Varizella-Zoster-Virus-Antikörper (IgM)<br />
Varizella-Zoster-Virus-Antikörper (IgM)<br />
Synonyme: VZV<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit/das diagnostische Fenster beträgt ca. 8-21 Tage.<br />
Klinische Indikationen: Verdacht auf VZV-Primärinfektion, insbesondere in der Schwangerschaft<br />
(Gefahr des kongenitalen VZV-Syndrom) bei typischem Exanthem.<br />
Methode: EIA<br />
Referenzbereiche: negativ: < 10 U/ml<br />
grenzwertig: 10 – 15 U/ml<br />
positiv: > 15 U/ml<br />
Varizella-Zoster-Virus-Serologie<br />
Synonyme: VZV, Zoster-Antikörper<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Inkubationszeit/das diagnostische Fenster beträgt ca. 8-21 Tage.<br />
Klinische Indikationen: Bei Verdacht auf VZV-Primärinfektion (Windpocken), insbesondere in der<br />
Schwangerschaft, sollte die Bestimmung der Immunitätslage im Vordergr<strong>und</strong> stehen. Bei den übrigen<br />
Fällen <strong>und</strong> insbesondere bei der VZV-Reaktivierung (Herpes zoster, Gürtelrose) hat die serologische<br />
Diagnostik eine nur eingeschränkte Bedeutung.<br />
Methode: EIA<br />
Referenzbereiche: siehe Einzelparameter<br />
VDRL<br />
Synonyme: Veneral Disease Research Laboratory Test, Lues, Syphilis<br />
Probenmaterial: 1 ml Serum <strong>und</strong>/oder<br />
1 ml Liquor<br />
Klinische Indikationen: Beurteilung der Erkrankungsaktivität bei Verdacht auf eine T. pallidum-<br />
Infektion (Lues)<br />
Methode: Agglutination<br />
Referenzbereiche: negativ<br />
Venlafaxin (W)<br />
Synonyme: SNRI<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Bitte beachten Sie, dass bei Verwendung von gelhaltigen Röhrchen die Resultate<br />
niedriger ausfallen können. Wir empfehlen, das Blut 30 min nach Abnahme zu zentrifugieren, das<br />
Serum abzutrennen <strong>und</strong> in ein zweites Neutral-Röhrchen zu überführen.<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Venlafaxin-Therapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 371
Vitamin A<br />
Verapamil (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Verapamil-Therapie<br />
Methode: LC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Verotoxin I <strong>und</strong> II-DNA-Nachweis<br />
Synonyme: VTEC, Verotoxin bildende E. coli, EHEC<br />
Probenmaterial: 1 g Stuhl<br />
Klinische Indikationen: Verdach auf EHEC-Infektion, inbesondere bei Verdacht auf HUS<br />
(hämolytisch-urämisches Syndrom) <strong>und</strong> bei blutig-schleimiger Enterokolitis im Kleinkindalter<br />
Methode: PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Vigabatrin (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutabnahme ca. 2 – 4 St<strong>und</strong>en nach oraler Gabe<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Vigabatrin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
VIP (U)<br />
Synonyme: Vasoaktives Intestinales Peptid<br />
Probenmaterial: 1 ml mit Trasylol stabilisiertes EDTA-Plasma<br />
Abnahmehinweise: Die Blutentnahme sollte morgens am nüchternen Patienten erfolgen.<br />
4 ml EDTA-Blut abnehmen, sofort in ein mit Trasylol präpariertes Glasröhrchen überführen <strong>und</strong> zentrifugieren.<br />
Anschließend Plasma in ein Glasröhrchen ohne Zusatz umfüllen. Probe tiefgefroren einsenden.<br />
Klinische Indikationen: Verlaufskontrolle <strong>und</strong> Verdacht bei/auf VIPom (VIP-produzierender Tumor,<br />
APUDom), Verner-Morrison-Syndrom mit anhaltenden, schweren wässrigen Durchfällen, ausgeprägte<br />
Hypokaliämie, Achlorhydrie<br />
Methode: RIA DA PEG<br />
Referenzbereiche: < 63 pg/ml<br />
Vitamin A<br />
Synonyme: Retinol<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Nach der Blutentnahme die Probe lichtgeschützt <strong>und</strong> gekühlt (+2°C – +8°C)<br />
lagern<br />
Klinische Indikationen: Verdacht auf Vitamin A-Mangel bei Maldigestion <strong>und</strong> Malabsorption, insbesondere<br />
bei Störungen der Dunkeladaptation, Hyperkeratosen, Haarausfall oder Schleimhautatrophie,<br />
Abklärung einer Hyperkalziämie<br />
Methode: HPLC<br />
Referenzbereiche: Erwachsene: 0,3 – 0,7 mg/l<br />
372 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Vitamin B1<br />
Vitamin B1<br />
Synonyme: Thiamin, Aneurin<br />
Probenmaterial: 2 ml EDTA-Blut<br />
Abnahmehinweise: Das Blut bitte direkt nach der Entnahme gekühlt (+2°C – +8°C) <strong>und</strong> lichtgeschützt<br />
lagern<br />
Klinische Indikationen: Verdacht auf Vitamin B1-Mangel bei unklaren neurologischen Symptomen<br />
(Neuritis, Areflexie, Parese) <strong>und</strong> Herzkreislaufsymptomen<br />
Methode: HPLC<br />
Referenzbereiche: 28 – 85 µg/l<br />
Vitamin B12<br />
Synonyme: Cobalamin<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Bestimmung ist nur sinnvoll, wenn zuvor über einige Wochen bis Monate<br />
KEINE Vitamin B12-Substitution erfolgte.<br />
Bei V.a. Vitamin B12-Mangel ggf. Bestimmung von Holotranscobalamin <strong>und</strong> Methylmalonsäure.<br />
Klinische Indikationen: Verdacht auf Cobalamin-Mangel bei:<br />
chronisch-atrophische Gastritis,<br />
nach Magen(teil)resektion,<br />
neuro-psychiatrische Symptomatik,<br />
Erkrankungen am terminalen Ilium (M. Crohn, Colitis, Resektion, Infektion, Zöliakie/Sprue),<br />
Makrozytäre Anämie,<br />
Langjährige vegetarische Ernährung,<br />
Methode: ECLIA<br />
Referenzbereiche: bis 18 Jahre: s. Bef<strong>und</strong>bericht<br />
Erwachsene: 191 – 663 pg/ml<br />
Vitamin B2 (FAD) (W)<br />
Synonyme: FAD, Riboflavin<br />
Probenmaterial: 5 ml EDTA-Blut<br />
Abnahmehinweise: Das Blut bitte direkt nach der Entnahme gekühlt (+2°C – +8°C) <strong>und</strong> lichtgeschützt<br />
lagern<br />
Klinische Indikationen: Verdacht auf Vitamin B2-Mangel bei Rhagaden, Pruritus, Haut-<br />
/Schleimhautentzündungen, Thrombosen, Arteriosklerosen<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Vitamin B6<br />
Synonyme: Pyridoxal-5-Phosphat<br />
Probenmaterial: 1 ml EDTA-Plasma<br />
Abnahmehinweise: EDTA-Vollblut bitte lichtgeschützt lagern. Für eine Bestimmung aus Plasma Blut<br />
bitte direkt nach der Entnahme zentrifugieren, Plasma abpipettieren <strong>und</strong> einfrieren (ca.-20°C) <strong>und</strong><br />
lichtgeschützt lagern.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 373
Vitamin K (W)<br />
Klinische Indikationen: Verdacht auf Vitamin B6-Mangel bei unklaren Haut- <strong>und</strong> Schleimhautentzündungen,<br />
Depression, Reizbarkeit, Neuritis, verminderte enterale Eisenaufnahme<br />
Methode: HPLC<br />
Referenzbereiche: 3,6 – 18,0 µg/l<br />
Vitamin C (W)<br />
Synonyme: Ascorbinsäure<br />
Probenmaterial: 4 ml Serum<br />
Klinische Indikationen: Verdacht auf Vitamin C-Mangel<br />
Methode: HPLC<br />
Referenzbereiche: 5 – 15 mg/l<br />
Vitamin D-Rezeptor-Polymorphismus (U)<br />
Synonyme: VDR-Gen (MIM 601769)<br />
Probenmaterial: 3 ml EDTA-Blut<br />
Abnahmehinweise: Einverständniserklärung des Patienten (§ 8 GenDG)<br />
Ausnahmekennziffer 32010<br />
Klinische Indikationen: Bestimmung des individuellen Risikos für Osteoporose<br />
Methode: PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Vitamin E<br />
Synonyme: Tocopherol<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Blutentnahme nüchtern (ca. 12 St<strong>und</strong>en Nahrungskarenz); nach der Blutentnahme<br />
die Probe lichtgeschützt <strong>und</strong> gekühlt (+2°C – +8°C) lagern<br />
Klinische Indikationen: Verdacht auf Vitamin E-Mangel bei chronisch-entzündlichen<br />
Darmerkrankungen, Störungen des oxidativen Stress<br />
Methode: HPLC<br />
Referenzbereiche: 5 – 20 mg/l<br />
Vitamin H (W)<br />
Synonyme: Biotin<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Verdacht auf Biotinmangel bei Haarausfall, Dermatitis, Anorexia, Übelkeit,<br />
Depression<br />
Referenzbereiche: > 200 pg/ml<br />
Vitamin K (W)<br />
Synonyme: Phyllochinone<br />
Probenmaterial: 2 ml Serum oder EDTA-Plasma,<br />
lichtgeschützt <strong>und</strong> tiefgefroren<br />
374 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Vitamin-D-Bindungsprotein (W)(N)<br />
Abnahmehinweise: Das Blut direkt nach der Blutentnahme zentrifugieren, abpipettieren <strong>und</strong> einfrieren<br />
(ca. -20°C), lichtgeschützt (mit Alufolie umwickelt!) lagern<br />
Klinische Indikationen: Verdacht auf Vitamin K-Mangel bei:<br />
- zystischer Fibrose<br />
- Malabsorption<br />
- Maldigestion<br />
- extrahepatische biliäre Abfluss-Störung<br />
- Zöliakie (einheimische Sprue)<br />
- Änderung der Darmflora unter Antibiose<br />
- totale parenterale Ernährung<br />
- unter Therapie mit Vitamin K-Antagonisten<br />
Methode: HPLC<br />
Referenzbereiche: nüchtern: 0,17 – 0,68 µg/l<br />
nicht nüchtern: 0,15 – 1,55 µg/l<br />
Vitamin-D-Bindungsprotein (W)(N)<br />
Synonyme: VDBP, DBP<br />
Probenmaterial: 1 ml Serum<br />
1 ml Spontanurin<br />
1 ml Dialysat<br />
Klinische Indikationen: Weitere Untersuchung bei erhöhtem Bedarf an Vitamin D-Subsititution bei<br />
Patienten mit hohem Proteinverlust (Nephrotisches Syndrom, Peritonealdialyse)<br />
Methode: ILMA<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Von Willebrand Faktor (vWF) – Multimerenanalyse (W)(N)<br />
Synonyme: Multimere<br />
Probenmaterial: 3 ml Citrat-Plasma (bei Raumtemperatur 48 h stabil)<br />
3 ml Citrat-Plasma, tiefgefroren (wenn kein bei Raumtemperatur gelagertes Plasma zur Verfügung<br />
steht)<br />
Klinische Indikationen: Verdacht auf von Willebrand Syndrom (vWS, erworben oder heriditär),<br />
thrombotische Mikroangiopathien<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
von-Willebrand-Faktor-Antigen (U)(N)<br />
Synonyme: vWF:Ag, früher Faktor VIII-assoziiertes Antigen<br />
Probenmaterial: 1 ml Citrat-Plasma, gefroren<br />
Abnahmehinweise: → Gerinnungsuntersuchungen, Seite 251<br />
Klinische Indikationen: Diagnostik des von-Willebrand-Jürgens-Syndroms (vWS),<br />
Differentialdiagnose des Faktor VIII C-Mangels,<br />
Diagnostik unerklärter Blutungen,<br />
Differentialdiagnostik einer verlängerten Blutungszeit bei fehlender Einnahme von Medikamenten<br />
wie z.B. ASS<br />
Methode: Photometrie<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 375
Xylol im Blut (U)(N)<br />
Referenzbereiche: 50 – 160 %<br />
40 – 160 % bei Blutgruppe 0<br />
Wismut im Blut (U)(N)<br />
Synonyme: Bi<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Beurteilung einer Wismut-Belastung, Intoxikation<br />
bei Wismut-haltigem Dentalmaterial oder bei langdauernder Behandlung mit Wismut-Präparaten<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Wismut im Urin (U)(N)<br />
Synonyme: Bi<br />
Probenmaterial: 5 ml Spontanurin<br />
Klinische Indikationen: Beurteilung einer Wismut-Belastung, Intoxikation<br />
bei Wismut-haltigem Dentalmaterial oder bei langdauernder Behandlung mit Wismut-Präparaten<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Xanthin (U)(N)<br />
Synonyme: Purin/Pyrimidin-Screening<br />
Probenmaterial: 10 ml eines 24-St<strong>und</strong>en-Sammelurins <strong>und</strong>/oder<br />
1 ml Serum<br />
Abnahmehinweise: Das Blut nach der Abnahme direkt zentrifugieren, das Serum bzw. Plasma in ein<br />
separates Röhrchen (ohne Zusätze)<br />
abpipettieren <strong>und</strong> einfrieren (ca. – 20°C).<br />
Urin direkt nach der Entnahme einfrieren (ca. – 20°C).<br />
Mindestens 24 St<strong>und</strong>en vor der Probennahme Vermeiden von Kakao, schwarzem Tee, Kaffee, Lakritz.<br />
Klinische Indikationen: Verdacht auf (angeborene) Störung des Purin <strong>und</strong> Pyrimidin-Stoffwechsels<br />
mit den Leitsymptomen<br />
- des ZNS<br />
variable psychomotorische Retardierung, Krampfanfälle, autistisches oder hyperaktives Verhalten,<br />
Spastik, Ataxie, Dysarthrie<br />
- der Niere<br />
gehäufte Harnwegsinfekte, Nephrolithiasis, Gicht, Niereninsuffizienz<br />
- des Knochenmarks<br />
Anämie, Infektanfälligkeit, Immunschwäche<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Xylol im Blut (U)(N)<br />
Synonyme: o-, m-, p-Xylol<br />
Probenmaterial: 2 ml EDTA-Blut<br />
Abnahmehinweise: EDTA-Blut in Glasröhrchen<br />
376 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Xylose im Blut (W)<br />
Klinische Indikationen: Kontrolle der Belastung mit aromatischen Kohlenwasserstoffen am Arbeitsplatz,<br />
Vergiftungsausschluss<br />
Methode: GC-Headspace-MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Xylose im Blut (W)<br />
Probenmaterial: 1 ml Natriumfluorid-Blut<br />
Klinische Indikationen: Verdacht auf Kohlenhydratmalaborption<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Xylose im Urin (W)<br />
Probenmaterial: 5 ml eines 5-St<strong>und</strong>en-Sammelurins<br />
Klinische Indikationen: Verdacht auf Kohlenhydratmalaborption, Prüfung der Resorptiosleistung<br />
des Dündarms (z.B. bei entzündlichen Darmerkrankungen)<br />
Methode: Photometrie<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Yersinien-Antikörper (IgA)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik der postinfektiösen/postenteritischen Arthritis, Erythema nodosum<br />
(insbesondere bei HLA B27-positiven Patienten), akute Glomerulonephritis, Myokarditis.<br />
Bei der akuten Yersinien-Enteritis sollte der direkte Erregernachweis aus einer Stuhlprobe erfolgen.<br />
Methode: EIA<br />
Referenzbereiche: negativ: < 9 Ratio<br />
grenzwertig: 9 – 11 Ratio<br />
positiv: > 11 Ratio<br />
Yersinien-Antikörper (IgG)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik der postinfektiösen/postenteritischen Arthritis, Erythema nodosum<br />
(insbesondere bei HLA B27-positiven Patienten).<br />
Bei der akuten Yersinien-Enteritis sollte der direkte Erregernachweis aus einer Stuhlprobe erfolgen.<br />
Methode: EIA<br />
Referenzbereiche: negativ: < 9 Ratio<br />
grenzwertig: 9 – 11 Ratio<br />
positiv: > 11 Ratio<br />
Yersinien-Serologie<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Diagnostik der postinfektiösen/postenteritischen Arthritis, Erythema nodosum<br />
(insbesondere bei HLA B27-positiven Patienten).<br />
Bei der akuten Yersinien-Enteritis sollte der direkte Erregernachweis aus einer Stuhlprobe erfolgen.<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 377
Zink im Urin (W)<br />
Methode: EIA<br />
Referenzbereiche: negativ: < 9 Ratio<br />
grenzwertig: 9 – 11 Ratio<br />
positiv: > 11 Ratio<br />
Zahnpathogene Keime, DNA-Nachweis<br />
Synonyme: parodontopathogene Keime, Zahnkeime<br />
Probenmaterial: subgingivale Plaqueproben<br />
Abnahmehinweise: Probenentnahme-Sets <strong>und</strong> Anforderungsscheine auf Anforderung<br />
Klinische Indikationen: Verdacht auf Infektion mit parodontopathogenen Keimen (RPP = Rapid<br />
progressive parodontitis oder juvenile progressive Parodontitis), ggf. auch vor einem geplanten Einsatz<br />
von Zahnimplantaten<br />
Methode: PCR<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Zink im Blut (W)<br />
Probenmaterial: 2 ml Serum<br />
Abnahmehinweise: Zur Vermeidung einer Hämolyse das Blut nach der Abnahme <strong>und</strong> Gerinnung<br />
zentrifugieren <strong>und</strong> das Serum abpipettieren<br />
Klinische Indikationen: Diagnostik des Zinkstoffwechsels, insbesondere des Zinkmangels (bei<br />
verzögerter W<strong>und</strong>heilung, Acrodermatitis enteropathica, unklare Immunschwäche)<br />
Methode: AAS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Zink im Sperma (U)<br />
Probenmaterial: 1 ml Sperma<br />
Abnahmehinweise: Sperma 1 + 1 mit physiologischer Kochsalzlösung verdünnen <strong>und</strong> in ein Fluoridröhrchen<br />
geben, eine sexuelle Karenz von mindestens 48 St<strong>und</strong>en vor der Untersuchung wird<br />
empfohlen.<br />
Klinische Indikationen: Abklärung der Infertilität beim Mann<br />
Methode: AAS<br />
Referenzbereiche: 80 – 230 µg/ml<br />
Zink im Urin (W)<br />
Probenmaterial: 10 ml Spontanurin oder<br />
10 ml eines 24-St<strong>und</strong>en-Sammelurins (ohne Zusätze)<br />
Abnahmehinweise: bitte unbedingt die Sammelmenge <strong>und</strong> ggf. die Sammelzeit (wenn nicht 24 St<strong>und</strong>en)<br />
angeben.<br />
Klinische Indikationen: Verdacht auf erhöhte Zinkbelastung (Galvanik, Glasindustrie, zinkhaltige<br />
Insektizide oder Fungizide) bei: Anämie, Nieren- <strong>und</strong> Leberschädigung, “Metalldampf-Fieber“,<br />
Lethargie, Temperaturerhöhung.<br />
Methode: ICP/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
378 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Zinkprotoporphyrin (W)(N)<br />
Synonyme: ZnPP, Eisenstoffwechsel<br />
Probenmaterial: 2 ml EDTA-Blut<br />
Klinische Indikationen: Differentialdiagnostik des Eisenmangels<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Zinn im Serum (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Beurteilung der Zinnbelastung<br />
Methode: ICP/MS<br />
Referenzbereiche: < 2,0 µg/l<br />
Zinn im Urin (U)<br />
Probenmaterial: 10 ml Spontanurin<br />
Klinische Indikationen: Beurteilung der Zinnbelastung<br />
Methode: ICP/MS<br />
Referenzbereiche: < 2,0 µg/l<br />
Ziprasidon (U)<br />
Synonyme: Handelsname: Zeldox ®<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Ziprasidon-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Zirkulierende Immunkomplexe (W)<br />
Zinkprotoporphyrin (W)(N)<br />
Synonyme: CIC<br />
Probenmaterial: 2 ml Serum, gefroren<br />
Klinische Indikationen: Diagnose <strong>und</strong> Verlaufskontrolle bei Erkrankungen mit hoher pathogenetischer<br />
Bedeutung der Immunkomplexe:<br />
- Vaskulitiden<br />
- Lupus erythematodes<br />
- rheumatoide Arthritis (RA)<br />
- Polyarthritis<br />
- Purpura Schoenlein-Henoch<br />
- post-/parainfektiöse Immunkomplexkrankheiten<br />
- HIV-Infektion/AIDS<br />
- Typ III-Allergien<br />
- Tumorerkrankungen<br />
Methode: EIA (C1q-Komplement, C3-Fragmente, IgA)<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 379
Zuclopenthixol (U)<br />
Zolpidem (U)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Blutabnahme ca. 1 h nach oraler Gabe von 10 mg Zolpidem<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Zolpiden-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Zonisamid (W)<br />
Probenmaterial: 1 ml Serum<br />
Abnahmehinweise: Die Blutentnahme sollte vor der nächsten Einnahme erfolgen (standardisierte<br />
Entnahmezeit, maximale Plasmakonzentration<br />
Klinische Indikationen: Therapiekontrolle bzw. Monitoring einer Zinosamidtherapie<br />
Methode: LC-MS/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Zopiclon (U)<br />
Probenmaterial: 1 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Zopiclon-Therapie<br />
Methode: LC/MS<br />
Referenzbereiche: therapeutischer Bereich: 10 – 50 µg/l<br />
Zotepin (U)(N)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Zotepin-Therapie<br />
Methode: HPLC<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
Zuclopenthixol (U)<br />
Probenmaterial: 2 ml Serum<br />
Klinische Indikationen: Therapiekontrolle/Monitoring einer Zuclopenthixol-Therapie<br />
Methode: GC/MS<br />
Referenzbereiche: s. Bef<strong>und</strong>bericht<br />
380 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Index<br />
Symbole<br />
α 1 Antitrypsin im Stuhl (W) . . . . . . . . . . . . .149<br />
α 1-Antitrypsin Genotypisierung (U) . . . . . 149<br />
α 1-Antitrypsin Phänotypisierung (U)(N) . . 150<br />
α 1-Antitrypsin im Serum . . . . . . . . . . . . . . 149<br />
α 1-Mikroglobulin im Serum (U) . . . . . . . . . 150<br />
α 1-Mikroglobulin im Urin . . . . . . . . . . . . . 150<br />
α 2-Antiplasmin-Aktivität (U) . . . . . . . . . . . 150<br />
α 2-Makroglobulin im Liquor (W) . . . . . . . . 150<br />
α 2-Makroglobulin im Serum (U) . . . . . . . . 151<br />
α 2-Makroglobulin im Urin (U) . . . . . . . . . . 151<br />
α-Aminobuttersäure (W) . . . . . . . . . . . . . . . . 148<br />
α-Galaktosidase (U) . . . . . . . . . . . . . . . . . . . . 148<br />
α-Glucosidase im Sperma (U) . . . . . . . . . . . .149<br />
β 2-Mikroglobulin im Liquor (W) . . . . . . . . 189<br />
β 2-Mikroglobulin im Serum . . . . . . . . . . . 189<br />
β 2-Mikroglobulin im Urin . . . . . . . . . . . . . 189<br />
β-Carotin im Serum (W) . . . . . . . . . . . . . . . . .188<br />
β-Galaktosidase (U) . . . . . . . . . . . . . . . . . . . . 188<br />
β-HCH im Blut (U) . . . . . . . . . . . . . . . . . . . . . 189<br />
β-Trace-Protein (U)(N) . . . . . . . . . . . . . . . . . . .189<br />
β-hCG . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 188<br />
γ-GT. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .249<br />
γ-HCH im Blut (U) . . . . . . . . . . . . . . . . . . . . . 250<br />
Östradiol im Serum . . . . . . . . . . . . . . . . . . . . 314<br />
Östriol, frei im Serum (W) . . . . . . . . . . . . . . . 314<br />
Östron im Serum (W) . . . . . . . . . . . . . . . . . . . 314<br />
1,25-Dihydroxy-Vitamin D . . . . . . . . . . . . . 136<br />
1-Butanol im Blut (U) . . . . . . . . . . . . . . . . . . . 136<br />
1-Hydroxypyren im Urin (W) . . . . . . . . . . . . 136<br />
1-Propanol (U) . . . . . . . . . . . . . . . . . . . . . . . . . 136<br />
10-Hydroxy-Carbazepin . . . . . . . . . . . . . . . 136<br />
11-Desoxycorticosteron im Plasma (U) . . . 137<br />
11-Desoxycorticosteron im Urin (U) . . . . . . 137<br />
11-Desoxycortisol (U) . . . . . . . . . . . . . . . . . . . 137<br />
17-Hydroxycorticoide im Urin (U) . . . . . . . .137<br />
17-Hydroxyprogesteron (W) . . . . . . . . . . . . . 138<br />
17-Ketosteroide im Urin (U) . . . . . . . . . . . . . 138<br />
18-Hydroxycorticosteron im Serum (U) . . . 138<br />
18-Hydroxycorticosteron im Urin (U) . . . . . 138<br />
25-Hydroxy-Vitamin D . . . . . . . . . . . . . . . . 138<br />
4-Aminosalicylsäure (U) . . . . . . . . . . . . . . . . .139<br />
4-Hydroxy-Tamoxifen (U)(N) . . . . . . . . . . . . . 139<br />
5-Fluorouracil-Unverträglichkeit (U) . . . . . . 139<br />
5-Hydroxyindolessigsäure . . . . . . . . . . . . . . 139<br />
5-S-Cysteinyl-DOPA im Plasma (W) . . . . . . 140<br />
5-S-Cysteinyl-DOPA im Urin (W) . . . . . . . . 140<br />
9-OH-Risperidon (W) . . . . . . . . . . . . . . . . . . . 140<br />
A<br />
ACE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 140<br />
ACE im Liquor (W) . . . . . . . . . . . . . . . . . . . . . 141<br />
Acetazolamid (U) . . . . . . . . . . . . . . . . . . . . . . . 141<br />
Aceton im Blut (U) . . . . . . . . . . . . . . . . . . . . . 141<br />
Aceton im Urin (U)(N) . . . . . . . . . . . . . . . . . . . 141<br />
Acetylcholinesterase im Fruchtwasser (W) .141<br />
Acetylsalizylsäure (W) . . . . . . . . . . . . . . . . . . 142<br />
ACTH. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .142<br />
Actinomykose-Antikörper (U)(N) . . . . . . . . . 142<br />
ADAMTS 13 – Aktivität (U) . . . . . . . . . . . . . 142<br />
ADAMTS 13 – Inhibitor (U) . . . . . . . . . . . . . 142<br />
ADAMTS 13 – Konzentration (U) . . . . . . . . 142<br />
Addis Count (U)(N) . . . . . . . . . . . . . . . . . . . . . . 143<br />
Adenoviren-Antikörper (W) . . . . . . . . . . . . . . 143<br />
Adenovirus-Antigen im Stuhl . . . . . . . . . . . 143<br />
Adenovirus-DNA-Nachweis (W) . . . . . . . . . 143<br />
Adiponectin (U) . . . . . . . . . . . . . . . . . . . . . . . . 144<br />
Adrenalin im Plasma (W) . . . . . . . . . . . . . . . . 144<br />
Adrenalin im Urin . . . . . . . . . . . . . . . . . . . . . 144<br />
AFP . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 144<br />
Agomelatin (W) . . . . . . . . . . . . . . . . . . . . . . . . 145<br />
Ajmalin (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 145<br />
Aktivierte T-Lymphozyten . . . . . . . . . . . . . 145<br />
Alanin Aminopeptidase (W) . . . . . . . . . . . . . 145<br />
Albumin im Liquor . . . . . . . . . . . . . . . . . . . . 145<br />
Albumin im Serum . . . . . . . . . . . . . . . . . . . . 145<br />
Albumin im Stuhl (W) . . . . . . . . . . . . . . . . . . . 146<br />
Albumin im Urin . . . . . . . . . . . . . . . . . . . . . . 146<br />
381
Index<br />
Albumin-Quotient (Liquor/Serum) . . . . . . 146<br />
Aldolase (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . 146<br />
Aldosteron im Serum (W) . . . . . . . . . . . . . . . .146<br />
Aldosteron im Urin (W) . . . . . . . . . . . . . . . . . 147<br />
Aldosteron-18-Glucuronid im Urin (U) . . . 147<br />
Alkalische Leukozytenphosphatase (U)(N) . 147<br />
Alkalische Phosphatase . . . . . . . . . . . . . . . . 147<br />
Alkalische Phosphatase-Isoenzyme. . . . . .148<br />
Allopurinol (U) . . . . . . . . . . . . . . . . . . . . . . . . . 148<br />
Alpha-Endosulfan (U) . . . . . . . . . . . . . . . . . . . 148<br />
Alpha-Fetoprotein (AFP) im Fruchtwasser (W)<br />
148<br />
alpha-Linolensäure (U) . . . . . . . . . . . . . . . . . . 149<br />
Alprazolam (U) . . . . . . . . . . . . . . . . . . . . . . . . . 151<br />
ALT . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 151<br />
Aluminium im Serum (W)(N) . . . . . . . . . . . . . 151<br />
Aluminium im Urin (W) . . . . . . . . . . . . . . . . . 152<br />
AMA-Subtypen (M2, M4, M9) . . . . . . . . . 152<br />
Amantadin (U) . . . . . . . . . . . . . . . . . . . . . . . . . 152<br />
Ameisensäure im Urin (U) . . . . . . . . . . . . . . . 152<br />
Amikacin (U) . . . . . . . . . . . . . . . . . . . . . . . . . . 152<br />
Aminosäuren-Differenzierung im Serum (W)<br />
153<br />
Aminosäuren-Differenzierung im Urin (U) 153<br />
Amiodaron im Serum . . . . . . . . . . . . . . . . . . 153<br />
Amisulprid (U) . . . . . . . . . . . . . . . . . . . . . . . . . 153<br />
Amitriptylin im Serum . . . . . . . . . . . . . . . . . 154<br />
Ammoniak im Plasma . . . . . . . . . . . . . . . . . 154<br />
Amphetamin im Serum (N) . . . . . . . . . . . . . . 154<br />
Amphetamin im Urin . . . . . . . . . . . . . . . . . . 154<br />
Amphotericin B (U) . . . . . . . . . . . . . . . . . . . . . 154<br />
Amylase im Serum . . . . . . . . . . . . . . . . . . . . 154<br />
Amylase im Urin . . . . . . . . . . . . . . . . . . . . . . 155<br />
Amylase-Isoenzyme (U) . . . . . . . . . . . . . . . . . 155<br />
Amyloid β 1-42 im Liquor . . . . . . . . . . . . . 155<br />
Amyloid A-Protein im Serum (W) . . . . . . . . 155<br />
Analgetika im Urin (W) . . . . . . . . . . . . . . . . . 156<br />
ANCA-Zielantigene . . . . . . . . . . . . . . . . . . . 156<br />
Androstandiol-Glucuronid (W) . . . . . . . . . . . 156<br />
Androstendion im Serum (W) . . . . . . . . . . . . 156<br />
Angiotensin II (W) . . . . . . . . . . . . . . . . . . . . . . 156<br />
Anti-Faktor Xa-Aktivität . . . . . . . . . . . . . . . 157<br />
Anti-HAV (IgG/IgM) . . . . . . . . . . . . . . . . . . 157<br />
Anti-HAV-IgM . . . . . . . . . . . . . . . . . . . . . . . . 157<br />
Anti-HBc (IgG/IgM). . . . . . . . . . . . . . . . . . .157<br />
Anti-HBc-IgM . . . . . . . . . . . . . . . . . . . . . . . . 158<br />
Anti-HBe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 158<br />
Anti-HBs . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 158<br />
Anti-HCV . . . . . . . . . . . . . . . . . . . . . . . . . . . . 158<br />
Anti-HCV-Immunoblot . . . . . . . . . . . . . . . . 158<br />
Anti-HDV (IgG/IgM) (W) . . . . . . . . . . . . . . . 159<br />
Anti-HEV (IgG) (W) . . . . . . . . . . . . . . . . . . . . 159<br />
Anti-Müller-Hormon (W) . . . . . . . . . . . . . . . . 159<br />
Anti-Staphylolysin (W) . . . . . . . . . . . . . . . . . . 159<br />
Anti-Streptokokken DNAse B . . . . . . . . . . 159<br />
Anti-Streptokokken-Hyaluronidase (W) . . . 160<br />
Anti-Streptolysin O . . . . . . . . . . . . . . . . . . . . 160<br />
Antidiuretisches Hormon (W) . . . . . . . . . . . . 160<br />
Antikörper (IgA) gegen Gliadin . . . . . . . . . 160<br />
Antikörper (IgG) gegen Gliadin . . . . . . . . . 161<br />
Antikörper gegen ß2-Glykoprotein I . . . . . 162<br />
Antikörper gegen Cardiolipin (IgG <strong>und</strong> IgM)<br />
161<br />
Antikörper gegen Erythropoietin (W) . . . . . 161<br />
Antikörper gegen mutiertes citrulliniertes<br />
Vimentin (W) . . . . . . . . . . . . . . . . .161<br />
Antikörper gegen p53 (U) . . . . . . . . . . . . . . . .161<br />
Antikörper-Suchtest . . . . . . . . . . . . . . . . . . . 162<br />
Antimon im Serum (U) . . . . . . . . . . . . . . . . . . 162<br />
Antimon im Urin (U) . . . . . . . . . . . . . . . . . . . . 162<br />
Antioxidative Kapazität (W) . . . . . . . . . . . . . 162<br />
Antithrombin-Aktivität . . . . . . . . . . . . . . . . 163<br />
Antithrombin-Konzentration (U) . . . . . . . . . 163<br />
APC-Resistenz . . . . . . . . . . . . . . . . . . . . . . . . 163<br />
Apolipoprotein A1 . . . . . . . . . . . . . . . . . . . . 164<br />
Apolipoprotein B . . . . . . . . . . . . . . . . . . . . . . 164<br />
Apolipoprotein B100-Genotypisierung (U) 164<br />
Apolipoprotein E-Genotypisierung (U) . . . . 164<br />
aPTT. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .164<br />
Arachidonsäure (U) . . . . . . . . . . . . . . . . . . . . . 165<br />
Aripiprazol (U) . . . . . . . . . . . . . . . . . . . . . . . . . 165<br />
Arsen im Haar (U) . . . . . . . . . . . . . . . . . . . . . . 165<br />
Arsen im Serum (W) . . . . . . . . . . . . . . . . . . . . 165<br />
Arsen im Urin (W) . . . . . . . . . . . . . . . . . . . . . . 165<br />
Arylsulfatase A (U) . . . . . . . . . . . . . . . . . . . . . 166<br />
Aspergillus-Antigen (W) . . . . . . . . . . . . . . . . .166<br />
Aspergillus-Antikörper (W) . . . . . . . . . . . . . . 166<br />
AST . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 166<br />
Astrovirus-Antigennachweis. . . . . . . . . . . .166<br />
Asymmetrisches Dimethylarginin (W) . . . . 167<br />
Atenolol (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . 167<br />
Atypische Cholinesterasen (U) . . . . . . . . . . . 167<br />
Auto-Ak gegen Acetylcholinrezeptor (W) . 167<br />
Auto-Ak (IgA) gegen Endomysium . . . . . 167<br />
382 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Auto-Ak (IgA) gegen Transglutaminase . 168<br />
Auto-Ak (IgA, IgG) gegen Becherzellen (U)(N)<br />
168<br />
Auto-Ak (IgA, IgG) gegen exokrines<br />
Pankreas . . . . . . . . . . . . . . . . . . . 168<br />
Auto-Ak (IgA, IgG, IgM) gegen MAG (W) 168<br />
Auto-Ak (IgG) gegen alveoläre Basalmembranen<br />
. . . . . . . . . . . . . . . . . . . . . 169<br />
Auto-Ak (IgG) gegen Aquaporin 4 (W) . . . 169<br />
Auto-Ak (IgG) gegen Asialoglycoprotein-<br />
Rezeptor (U)(N) . . . . . . . . . . . . . . . 169<br />
Auto-Ak (IgG) gegen BPI (U)(N) . . . . . . . . . 169<br />
Auto-Ak (IgG) gegen Cathepsin G (U)(N) . . 169<br />
Auto-Ak (IgG) gegen CCP . . . . . . . . . . . . . 170<br />
Auto-Ak (IgG) gegen CV2 . . . . . . . . . . . . . 170<br />
Auto-Ak (IgG) gegen dsDNS . . . . . . . . . . . 170<br />
Auto-Ak (IgG) gegen Elastase (U)(N) . . . . . .170<br />
Auto-Ak (IgG) gegen ENA-Gruppentest . 171<br />
Auto-Ak (IgG) gegen glomeruläre<br />
Basalmembran . . . . . . . . . . . . . . 171<br />
Auto-Ak (IgG) gegen Herzmuskel . . . . . . 171<br />
Auto-Ak (IgG) gegen Histone (U)(N) . . . . . . 171<br />
Auto-Ak (IgG) gegen Hu . . . . . . . . . . . . . . . 172<br />
Auto-Ak (IgG) gegen Jo-1. . . . . . . . . . . . . .172<br />
Auto-Ak (IgG) gegen Ku (W) . . . . . . . . . . . . 172<br />
Auto-Ak (IgG) gegen Laktoferrin (U)(N) . . .172<br />
Auto-Ak (IgG) gegen Ma . . . . . . . . . . . . . . 172<br />
Auto-Ak (IgG) gegen Myeloperoxidase . . 173<br />
Auto-Ak (IgG) gegen Neuronenkerne Typ<br />
3 (W) . . . . . . . . . . . . . . . . . . . . . . . . 173<br />
Auto-Ak (IgG) gegen NMDA-Rezeptoren (W)<br />
173<br />
Auto-Ak (IgG) gegen nRNP . . . . . . . . . . . . 173<br />
Auto-Ak (IgG) gegen Nukleosomen (W) . . 174<br />
Auto-Ak (IgG) gegen PM-Scl . . . . . . . . . . 174<br />
Auto-Ak (IgG) gegen Proteinase 3 . . . . . . 174<br />
Auto-Ak (IgG) gegen Ri . . . . . . . . . . . . . . . 174<br />
Auto-Ak (IgG) gegen ribosomales P-<br />
Protein (U) . . . . . . . . . . . . . . . . . . . 175<br />
Auto-Ak (IgG) gegen Scl 70 . . . . . . . . . . . . 175<br />
Auto-Ak (IgG) gegen Skelettmuskulatur . 175<br />
Auto-Ak (IgG) gegen SLA/LP . . . . . . . . . . 175<br />
Auto-Ak (IgG) gegen Sm . . . . . . . . . . . . . . 175<br />
Auto-Ak (IgG) gegen SS-A. . . . . . . . . . . . .176<br />
Auto-Ak (IgG) gegen SS-B. . . . . . . . . . . . .176<br />
Auto-Ak (IgG) gegen ssDNS (W)(N) . . . . . . 176<br />
Auto-Ak (IgG) gegen Thyreoglobulin . . . 176<br />
Index<br />
Auto-Ak (IgG) gegen TPO . . . . . . . . . . . . . 177<br />
Auto-Ak (IgG) gegen Tr . . . . . . . . . . . . . . . 177<br />
Auto-Ak (IgG) gegen tubuläre Basalmembran<br />
177<br />
Auto-Ak (IgG) gegen Yo . . . . . . . . . . . . . . . 177<br />
Auto-Ak (IgG) gegen Zellkernantigene . . 178<br />
Auto-Ak (IgG) gegen Zentromere . . . . . . . 178<br />
Auto-Ak (IgG, IgM) gegen Ganglioside (W)<br />
178<br />
Auto-Ak gegen Amphiphysin . . . . . . . . . . . 178<br />
Auto-Ak gegen Carboanhydrase II (W) . . . . 178<br />
Auto-Ak gegen Desmoglein 1 (W) . . . . . . . . 179<br />
Auto-Ak gegen Desmoglein 3 (W) . . . . . . . . 179<br />
Auto-Ak gegen epidermale<br />
Basalmembranen (W) . . . . . . . . . 179<br />
Auto-Ak gegen Gallengangsepithel. . . . . .179<br />
Auto-Ak gegen Gefäßendothel . . . . . . . . . . 179<br />
Auto-Ak gegen glatte Muskulatur . . . . . . . 179<br />
Auto-Ak gegen Glutamat-Decarboxylase 180<br />
Auto-Ak gegen Granulozyten-Zytoplasma<br />
180<br />
Auto-Ak gegen Inselzellen . . . . . . . . . . . . . 180<br />
Auto-Ak gegen Insulin (W) . . . . . . . . . . . . . . 180<br />
Auto-Ak gegen Intrinsic Faktor (W) . . . . . . 181<br />
Auto-Ak gegen LC-1 (U)(N) . . . . . . . . . . . . . . 181<br />
Auto-Ak gegen Leber-Nieren-Mikrosomen<br />
181<br />
Auto-Ak gegen Mitochondrien. . . . . . . . . .181<br />
Auto-Ak gegen Nebennierenrinde (W) . . . . 181<br />
Auto-Ak gegen Ovar (U)(N) . . . . . . . . . . . . . . 182<br />
Auto-Ak gegen Parietalzellen . . . . . . . . . . . 182<br />
Auto-Ak gegen Parotisgangepithel (U)(N) . . 182<br />
Auto-Ak gegen PCNA . . . . . . . . . . . . . . . . . 182<br />
Auto-Ak gegen Phospholipase A2-<br />
Rezeptor (W) . . . . . . . . . . . . . . . . . 182<br />
Auto-Ak gegen präsynaptischen P/Q-<br />
Calcium-Kanal (W) . . . . . . . . . . . 182<br />
Auto-Ak gegen Ribosomen (U) . . . . . . . . . . 183<br />
Auto-Ak gegen RNA-Polymerase I (W) . . . 183<br />
Auto-Ak gegen Stachelzelldesmosomen (W)<br />
183<br />
Auto-Ak gegen Thyroxin (U)(N) . . . . . . . . . . 183<br />
Auto-Ak gegen Titin (W) . . . . . . . . . . . . . . . . 183<br />
Auto-Ak gegen Topoisomerase II (W) . . . . . 184<br />
Auto-Ak gegen Trijodthyronin (U)(N) . . . . . 184<br />
Auto-Ak gegen TSH-Rezeptor . . . . . . . . . . 184<br />
Auto-Ak gegen Tyrosinphosphatase (U) . . . 184<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 383
Index<br />
Autoantikörper gegen Spermien (U)(N) . . . . 184<br />
Azathioprin als 6-Mercaptopurin (U) . . . . . .185<br />
B<br />
B-Lymphozyten . . . . . . . . . . . . . . . . . . . . . . . 185<br />
Babesia microti-Serologie (W) . . . . . . . . . . . 185<br />
Baclofen (U)(N) . . . . . . . . . . . . . . . . . . . . . . . . . 185<br />
Barbiturate im Serum . . . . . . . . . . . . . . . . . . 185<br />
Barbiturate im Urin . . . . . . . . . . . . . . . . . . . . 186<br />
Barium im Urin (W) . . . . . . . . . . . . . . . . . . . . .186<br />
Barium (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 186<br />
Bartonella quintana-Serologie (W) . . . . . . . . 186<br />
Basophilen Degranulationstest (U)(N) . . . . . 186<br />
BCR/ABL Translokation (U) . . . . . . . . . . . . .186<br />
Bence-Jones-Proteine (qualitativ) im Urin187<br />
Benperidol (W) . . . . . . . . . . . . . . . . . . . . . . . . . 187<br />
Benzodiazepine im Serum (N) . . . . . . . . . . . 187<br />
Benzodiazepine im Urin . . . . . . . . . . . . . . . 187<br />
Benzol im Blut (U) . . . . . . . . . . . . . . . . . . . . . .187<br />
Beryllium im Serum (U) . . . . . . . . . . . . . . . . . 188<br />
Beryllium im Urin (U) . . . . . . . . . . . . . . . . . . .188<br />
Bilirubin (direkt) . . . . . . . . . . . . . . . . . . . . . . 190<br />
Bilirubin (gesamt) . . . . . . . . . . . . . . . . . . . . . 190<br />
Bilirubin (indirekt) . . . . . . . . . . . . . . . . . . . . 190<br />
Bilirubin im Fruchtwasser (N) . . . . . . . . . . . .190<br />
Biperiden (U)(N) . . . . . . . . . . . . . . . . . . . . . . . . 190<br />
Bisoprolol (U) . . . . . . . . . . . . . . . . . . . . . . . . . . 191<br />
BK-(Polyoma)-Virus-DNA-Nachweis . . . 191<br />
Blei im Blut (U)(N) . . . . . . . . . . . . . . . . . . . . . . 191<br />
Blei im Urin (W) . . . . . . . . . . . . . . . . . . . . . . . .191<br />
Blutbild mit/ohne Differentialblutbild . . . 191<br />
Blutgruppen-Serologie . . . . . . . . . . . . . . . . . 191<br />
BNP . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 192<br />
Bordetella parapertussis-Antikörper (IgA) (U)<br />
192<br />
Bordetella parapertussis-Antikörper (IgG) (U)<br />
192<br />
Bordetella pertussis-DNA-Nachweis . . . . 192<br />
Bordetella pertussis-Serologie . . . . . . . . . . 193<br />
Bordetella pertussis/parapertussis DNA<br />
Nachweis. . . . . . . . . . . . . . . . . . .193<br />
Borrelien-Antikörper (IgG) . . . . . . . . . . . . . 193<br />
Borrelien-Antikörper (IgG, Liquor/Serum)<br />
193<br />
Borrelien-Antikörper (IgG-Westernblot) . 194<br />
Borrelien-Antikörper (IgM) . . . . . . . . . . . . 194<br />
Borrelien-Antikörper (IgM, Liquor/Serum<br />
194<br />
Borrelien-Antikörper (IgM-Westernblot) . 194<br />
Borrelien-DNA-Nachweis . . . . . . . . . . . . . . 195<br />
Borrelien-Serologie (Stufendiagnostik) . . 195<br />
Bromazepam (U) . . . . . . . . . . . . . . . . . . . . . . . 195<br />
Bromid im Serum (W) . . . . . . . . . . . . . . . . . . . 195<br />
Bromid im Urin (W)(N) . . . . . . . . . . . . . . . . . . 196<br />
Brucella-Antikörper (U) . . . . . . . . . . . . . . . . . 196<br />
BSG (N) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 196<br />
Buprenorphin (W) . . . . . . . . . . . . . . . . . . . . . . 196<br />
Bupropion (W)(N) . . . . . . . . . . . . . . . . . . . . . . . 196<br />
C<br />
C-Peptid im Serum . . . . . . . . . . . . . . . . . . . . 196<br />
C-reaktives Protein (CRP) . . . . . . . . . . . . . . 197<br />
C1-Esterase-Inhibitor-Aktivität (W) . . . . . . . 197<br />
C1-Esterase-Inhibitor-Konzentration (W) . . 197<br />
C1q-Komplementfaktor (W)(N) . . . . . . . . . . . 197<br />
C2-Komplementfaktor (W) . . . . . . . . . . . . . . 197<br />
C3-Komplementfaktor . . . . . . . . . . . . . . . . . 198<br />
C3-Nephritisfaktor (W)(N) . . . . . . . . . . . . . . . .198<br />
C4-Komplementfaktor . . . . . . . . . . . . . . . . . 198<br />
C5-Komplementfaktor (W) . . . . . . . . . . . . . . 198<br />
CA 125. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .198<br />
CA 15-3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 199<br />
CA 19-9 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 199<br />
CA 50 (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 199<br />
CA 72-4 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 199<br />
Cadmium im Blut (W) . . . . . . . . . . . . . . . . . . . 199<br />
Cadmium im Haar (W) . . . . . . . . . . . . . . . . . . 199<br />
Cadmium im Urin (W) . . . . . . . . . . . . . . . . . . 200<br />
Calcitonin . . . . . . . . . . . . . . . . . . . . . . . . . . . . 200<br />
Calcium gesamt im Serum . . . . . . . . . . . . . 200<br />
Calcium gesamt im Urin . . . . . . . . . . . . . . . 200<br />
Calcium im Dialysat (N) . . . . . . . . . . . . . . . . .200<br />
Calprotectin im Stuhl . . . . . . . . . . . . . . . . . . 201<br />
Campylobacter-Antikörper (W) . . . . . . . . . . .201<br />
Candida albicans DNA-Nachweis (W) . . . . 201<br />
Candida-Antigen im Serum (U) . . . . . . . . . . 201<br />
Candida-Antikörper . . . . . . . . . . . . . . . . . . . 201<br />
Cannabis im Urin . . . . . . . . . . . . . . . . . . . . . 202<br />
Carbamazepin. . . . . . . . . . . . . . . . . . . . . . . . .202<br />
Carbamazepin-Epoxid . . . . . . . . . . . . . . . . . 202<br />
Carnitin (frei) im Serum (W) . . . . . . . . . . . . . 202<br />
Carnitin gesamt (U) . . . . . . . . . . . . . . . . . . . . . 202<br />
Carnitin im Sperma (U) . . . . . . . . . . . . . . . . . 202<br />
384 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
CASA (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 203<br />
Caspofungin (W) . . . . . . . . . . . . . . . . . . . . . . . 203<br />
CDT – Carbohydrate Deficient Transferrin<br />
203<br />
CEA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 203<br />
CEA im Liquor (W)(N) . . . . . . . . . . . . . . . . . . .203<br />
Ceftazidim (W) . . . . . . . . . . . . . . . . . . . . . . . . . 203<br />
CH 100 (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 204<br />
Chinidin im Serum (W) . . . . . . . . . . . . . . . . . . 204<br />
Chlamydia trachomatis-Antikörper (IgA) 204<br />
Chlamydia trachomatis-Antikörper (IgG) 204<br />
Chlamydia trachomatis-DNA-Nachweis . 204<br />
Chlamydophila pneumoniae-Antikörper<br />
(IgA). . . . . . . . . . . . . . . . . . . . . . .205<br />
Chlamydophila pneumoniae-Antikörper<br />
(IgG). . . . . . . . . . . . . . . . . . . . . . .205<br />
Chlamydophila pneumoniae-Antikörper<br />
(IgM) . . . . . . . . . . . . . . . . . . . . . . 205<br />
Chlamydophila pneumoniae-DNA-Nachweis<br />
205<br />
Chlamydophila psittaci-Antikörper (W)(N) . 205<br />
Chloramphenicol (W) . . . . . . . . . . . . . . . . . . . 206<br />
Chlordiazepoxid (W) . . . . . . . . . . . . . . . . . . . . 206<br />
Chlorid im Dialysat (N) . . . . . . . . . . . . . . . . . 206<br />
Chlorid im Serum . . . . . . . . . . . . . . . . . . . . . 206<br />
Chlorid im Urin (N) . . . . . . . . . . . . . . . . . . . . . 206<br />
Chloroquin (U) . . . . . . . . . . . . . . . . . . . . . . . . . 207<br />
Chlorpromazin (U) . . . . . . . . . . . . . . . . . . . . . . 207<br />
Chlorpropamid (U) . . . . . . . . . . . . . . . . . . . . . .207<br />
Chlorprothixen (U) . . . . . . . . . . . . . . . . . . . . . .207<br />
Cholesterin (gesamt) . . . . . . . . . . . . . . . . . . . 207<br />
Cholinesterase . . . . . . . . . . . . . . . . . . . . . . . . 207<br />
Chrom im Blut (U) . . . . . . . . . . . . . . . . . . . . . . 208<br />
Chrom im Serum (U)(N) . . . . . . . . . . . . . . . . . 208<br />
Chrom im Urin (U)(N) . . . . . . . . . . . . . . . . . . . 208<br />
Chrom in Erythrozyten (U) . . . . . . . . . . . . . . 208<br />
Chromogranin A . . . . . . . . . . . . . . . . . . . . . . 208<br />
Chromosomenanalyse von Abort<strong>und</strong><br />
Gewebematerial<br />
(Fibroblastenkultur) (W) . . . . . . . 209<br />
Ciprofloxacin (U) . . . . . . . . . . . . . . . . . . . . . . . 209<br />
Citalopram (W) . . . . . . . . . . . . . . . . . . . . . . . . . 209<br />
Citrat im Sperma (W)(N) . . . . . . . . . . . . . . . . . 209<br />
Citrat im Urin (W) . . . . . . . . . . . . . . . . . . . . . . 209<br />
CK gesamt . . . . . . . . . . . . . . . . . . . . . . . . . . . 210<br />
CK-Isoenzyme . . . . . . . . . . . . . . . . . . . . . . . . 210<br />
CK-MB-Aktivität/Anteil . . . . . . . . . . . . . . . 210<br />
Index<br />
Clindamycin (U) . . . . . . . . . . . . . . . . . . . . . . . . 210<br />
Clobazam (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 210<br />
Clomethiazol (U) . . . . . . . . . . . . . . . . . . . . . . . 211<br />
Clomipramin. . . . . . . . . . . . . . . . . . . . . . . . . .211<br />
Clonazepam (W) . . . . . . . . . . . . . . . . . . . . . . . . 211<br />
Clostridium difficile-Toxin A/B . . . . . . . . . 211<br />
Clozapin im Serum . . . . . . . . . . . . . . . . . . . . 211<br />
CO-Hämoglobin (U) . . . . . . . . . . . . . . . . . . . . 212<br />
Cocain im Urin. . . . . . . . . . . . . . . . . . . . . . . .212<br />
Coenzym Q10 (U) . . . . . . . . . . . . . . . . . . . . . . 212<br />
Coeruloplasmin . . . . . . . . . . . . . . . . . . . . . . . 212<br />
Coffein (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 212<br />
Collagen Typ I A1-Gen-Polymorphismus (U)<br />
213<br />
Collagen-Bindungsaktivität (W) . . . . . . . . . . 213<br />
Cortisol im Serum . . . . . . . . . . . . . . . . . . . . . 213<br />
Cortisol im Speichel (W) . . . . . . . . . . . . . . . . 213<br />
Cortisol, freies im Urin . . . . . . . . . . . . . . . . 213<br />
Cotinin im Serum (W) . . . . . . . . . . . . . . . . . . . 214<br />
Cotinin im Urin (W) . . . . . . . . . . . . . . . . . . . . .214<br />
Coxiella burnetii-Antikörper (W) . . . . . . . . . 214<br />
Coxsackie Virus-Antikörper . . . . . . . . . . . . 214<br />
CRP hochsensitiv . . . . . . . . . . . . . . . . . . . . . 214<br />
Cryptococcus neoformans-<br />
Antigennachweis (W) . . . . . . . . . 215<br />
CT-Pro-Arginin-Vasopressin (W) . . . . . . . . . 215<br />
CTX (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 215<br />
Cyanid im Blut (U) . . . . . . . . . . . . . . . . . . . . . 216<br />
Cyclobarbital (W) . . . . . . . . . . . . . . . . . . . . . . . 216<br />
Cyclosporin A monoklonal . . . . . . . . . . . . . 216<br />
CYFRA 21-1 . . . . . . . . . . . . . . . . . . . . . . . . . 216<br />
Cystatin C . . . . . . . . . . . . . . . . . . . . . . . . . . . . 216<br />
Cysticercus cellulosae-Antikörper (U) . . . . 217<br />
Cystin im Urin (U) . . . . . . . . . . . . . . . . . . . . . . 217<br />
Cystin-Aminopeptidase (W)(N) . . . . . . . . . . . 217<br />
Cystische Fibrose (W) . . . . . . . . . . . . . . . . . . . 217<br />
Cytomegalie-Virus pp65-Antigen-<br />
Nachweis (W) . . . . . . . . . . . . . . . . 217<br />
Cytomegalie-Virus-Antiörper (IgG,<br />
Liquor/Serum) . . . . . . . . . . . . . . 218<br />
Cytomegalie-Virus-Antikörper (IgG-<br />
Avidität) (W) . . . . . . . . . . . . . . . . . 218<br />
Cytomegalie-Virus-DNA-Nachweis . . . . . 218<br />
Cytomegalie-Virus-Serologie . . . . . . . . . . . 218<br />
D<br />
D-Dimere . . . . . . . . . . . . . . . . . . . . . . . . . . . . 219<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 385
Index<br />
Daptomycin (W) . . . . . . . . . . . . . . . . . . . . . . . . 219<br />
Delta-Aminolävulinsäure im Urin (W) . . . . 219<br />
Demoxepam (W)(N) . . . . . . . . . . . . . . . . . . . . . 219<br />
Dengue-Virus-Antikörper (U) . . . . . . . . . . . . 220<br />
Desethylamiodaron im Serum . . . . . . . . . . 220<br />
Desipramin . . . . . . . . . . . . . . . . . . . . . . . . . . . 220<br />
Desmethylclobazam (W) . . . . . . . . . . . . . . . . .220<br />
Desmethylclozapin (W) . . . . . . . . . . . . . . . . . .220<br />
Desmethyldiazepam (W) . . . . . . . . . . . . . . . . .221<br />
Desmethylmethsuximid (U) . . . . . . . . . . . . . . 221<br />
Desoxypyridinolin im Urin (W)(N) . . . . . . . . 221<br />
DHEA (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 221<br />
DHEAS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 221<br />
Diaminooxidase (W) . . . . . . . . . . . . . . . . . . . . 222<br />
Diaphorase in Erythrozyten (U)(N) . . . . . . . . 222<br />
Diazepam (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 222<br />
Dibenzepin (U) . . . . . . . . . . . . . . . . . . . . . . . . . 222<br />
Dibucain-Zahl (U) . . . . . . . . . . . . . . . . . . . . . . 222<br />
Dichlormethan im Blut (U) . . . . . . . . . . . . . . 223<br />
Didanosin (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 223<br />
Diethylenglykol (U) . . . . . . . . . . . . . . . . . . . . . 223<br />
Differentialblutbild . . . . . . . . . . . . . . . . . . . . 223<br />
Digitoxin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 223<br />
Digoxin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 224<br />
Dihydrotestosteron im Serum (W) . . . . . . . . 224<br />
Diphenhydramin (U) . . . . . . . . . . . . . . . . . . . . 224<br />
Diphtherie Toxoid-Antikörper im Serum . 224<br />
Direkter Coombstest . . . . . . . . . . . . . . . . . . . 224<br />
Disopyramid (W) . . . . . . . . . . . . . . . . . . . . . . . 225<br />
Donepezil (U) . . . . . . . . . . . . . . . . . . . . . . . . . . 225<br />
Dopamin im Urin . . . . . . . . . . . . . . . . . . . . . 225<br />
Doxepin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 225<br />
Doxycyclin (U) . . . . . . . . . . . . . . . . . . . . . . . . . 225<br />
Doxylamin (U) . . . . . . . . . . . . . . . . . . . . . . . . . 225<br />
<strong>Dr</strong>ogen-Nachweis im Haar (U) . . . . . . . . . . . 226<br />
<strong>Dr</strong>ogen-Screening im Serum (N) . . . . . . . . . 226<br />
<strong>Dr</strong>ogen-Screening im Urin . . . . . . . . . . . . . 226<br />
<strong>Dr</strong>onedaron (W) . . . . . . . . . . . . . . . . . . . . . . . . 226<br />
Duloxetin (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 226<br />
E<br />
Echinokokken-Serologie (U) . . . . . . . . . . . . . 227<br />
ECHO-Virus-Antikörper (W) . . . . . . . . . . . . .227<br />
ECP (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 227<br />
Ehrlichien-Antikörper (IgG) (W) . . . . . . . . . 227<br />
Ehrlichien-Antikörper (IgM) (W) . . . . . . . . . 227<br />
Eisen im Serum . . . . . . . . . . . . . . . . . . . . . . . 228<br />
Eisen im Urin (Eisenstoffwechsel) (U) . . . . 228<br />
Eiweiß (gesamt) im Liquor . . . . . . . . . . . . . 228<br />
Eiweiß (gesamt) im Serum . . . . . . . . . . . . . 228<br />
Eiweiß (gesamt, quantitativ) im Punktat (N) 229<br />
Eiweiß (gesamt, quantitativ) im Urin . . . . 229<br />
Eiweiß im Dialysat (N) . . . . . . . . . . . . . . . . . . 229<br />
Eiweißelektrophorese im Serum . . . . . . . . 229<br />
Elektrolyte im Serum . . . . . . . . . . . . . . . . . . 229<br />
Entamoeba histolytica-Antikörper (U) . . . . 230<br />
Enterohämorrhagischer E.coli im Stuhl . . 230<br />
Enteroviren-Antikörper . . . . . . . . . . . . . . . . 230<br />
Enteroviren-Nachweis (W) . . . . . . . . . . . . . . . 230<br />
Epstein-Barr-Virus-Antikörper<br />
(Liquor/Serum) . . . . . . . . . . . . . 231<br />
Epstein-Barr-Virus-DNA-Nachweis . . . . . 231<br />
Epstein-Barr-Virus-Serologie . . . . . . . . . . . 231<br />
Erythropoietin (W) . . . . . . . . . . . . . . . . . . . . . . 231<br />
Escitalopram (U) . . . . . . . . . . . . . . . . . . . . . . . 232<br />
Ethambutol (W) . . . . . . . . . . . . . . . . . . . . . . . . .232<br />
Ethanol im Blut . . . . . . . . . . . . . . . . . . . . . . . 232<br />
Ethosuximid . . . . . . . . . . . . . . . . . . . . . . . . . . 232<br />
Ethylbenzol im Blut (U)(N) . . . . . . . . . . . . . . . 232<br />
Ethylenglykol (U) . . . . . . . . . . . . . . . . . . . . . . .233<br />
Ethylglucuronid im Urin (W) . . . . . . . . . . . . .233<br />
Everolimus (W) . . . . . . . . . . . . . . . . . . . . . . . . . 233<br />
F<br />
Faktor II-Aktivität (U) . . . . . . . . . . . . . . . . . . . 233<br />
Faktor II-Gen-Mutation . . . . . . . . . . . . . . . . 233<br />
Faktor IX-Aktivität (U) . . . . . . . . . . . . . . . . . . 234<br />
Faktor V-Aktivität (U) . . . . . . . . . . . . . . . . . . . 234<br />
Faktor V-Gen-Mutation . . . . . . . . . . . . . . . . 234<br />
Faktor VII-Aktivität (U) . . . . . . . . . . . . . . . . . 234<br />
Faktor VIII-Aktivität . . . . . . . . . . . . . . . . . . 235<br />
Faktor X-Aktivität (U) . . . . . . . . . . . . . . . . . . .235<br />
Faktor XI-Aktivität (U) . . . . . . . . . . . . . . . . . . 235<br />
Faktor XII-Aktivität (U) . . . . . . . . . . . . . . . . . 235<br />
Faktor XIII-Aktivität (U) . . . . . . . . . . . . . . . . 236<br />
Familiäres Mittelmeerfieber (U) . . . . . . . . . . 236<br />
Fasciolosis-Antikörper (U) . . . . . . . . . . . . . . .236<br />
Felbamat (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . 236<br />
Ferritin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 237<br />
Fetale Erythrozyten (U) . . . . . . . . . . . . . . . . . 237<br />
Fette im Stuhl (W) . . . . . . . . . . . . . . . . . . . . . . 237<br />
Fettsäuren, langkettige (C14-C20) (U) . . . . 237<br />
Fettsäuren, sehr langkettige (C22-C26) (U) 237<br />
386 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Fetuin (alpha2-HS-Glykoprotein, Calciumbindendes<br />
Glykoprotein) (W) . . 238<br />
FGF-23, C-terminal (W) . . . . . . . . . . . . . . . . . 238<br />
Fibrinogen . . . . . . . . . . . . . . . . . . . . . . . . . . . . 238<br />
Fibrinspaltprodukte . . . . . . . . . . . . . . . . . . . . 238<br />
Fibronectin im Aszites (W) . . . . . . . . . . . . . . 239<br />
Fibronectin (W) . . . . . . . . . . . . . . . . . . . . . . . . .238<br />
FK 506 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 239<br />
Flecainid (W) . . . . . . . . . . . . . . . . . . . . . . . . . . .239<br />
Fluconazol (U)(N) . . . . . . . . . . . . . . . . . . . . . . . 239<br />
Flucytosin (U) . . . . . . . . . . . . . . . . . . . . . . . . . . 239<br />
Flunitrazepam (W) . . . . . . . . . . . . . . . . . . . . . . 239<br />
Fluorid im Serum (W) . . . . . . . . . . . . . . . . . . . 240<br />
Fluorid im Urin (W) . . . . . . . . . . . . . . . . . . . . . 240<br />
Fluorid-Zahl (U)(N) . . . . . . . . . . . . . . . . . . . . . .240<br />
Fluoxetin (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 240<br />
Flupentixol (W) . . . . . . . . . . . . . . . . . . . . . . . . .240<br />
Fluphenacin (W) . . . . . . . . . . . . . . . . . . . . . . . . 241<br />
Flurazepam (W) . . . . . . . . . . . . . . . . . . . . . . . . 241<br />
Fluvoxamin (W) . . . . . . . . . . . . . . . . . . . . . . . . 241<br />
Folsäure . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 241<br />
Folsäure in Erythrozyten (W) . . . . . . . . . . . . .242<br />
Francisella tularensis-Antikörper (U) . . . . . 242<br />
Freie Fettsäuren (U) . . . . . . . . . . . . . . . . . . . . . 242<br />
Freie Leichtketten im Serum. . . . . . . . . . . .242<br />
Freie Leichtketten im Urin (W) . . . . . . . . . . . 243<br />
Freie Leichtketten Typ Kappa im Serum . 243<br />
Freie Leichtketten Typ Kappa im Urin (W) 243<br />
Freie Leichtketten Typ Lambda im Serum243<br />
Freie Leichtketten Typ Lambda im Urin (W)<br />
244<br />
Freier Androgen-Index . . . . . . . . . . . . . . . . . 244<br />
Freies β-HCG (U) . . . . . . . . . . . . . . . . . . . . . . 244<br />
Freies Carbamazepin (U) . . . . . . . . . . . . . . . . 245<br />
Freies Hämoglobin (W) . . . . . . . . . . . . . . . . . .245<br />
Fruktosamin im Serum (W) . . . . . . . . . . . . . . 245<br />
Fruktose im Blut (U) . . . . . . . . . . . . . . . . . . . . 245<br />
Fruktose im Seminalplasma (U) . . . . . . . . . . 245<br />
FSH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 246<br />
FSME-Antikörper (IgG, Liquor/Serum) (W)<br />
246<br />
FSME-Serologie (W) . . . . . . . . . . . . . . . . . . . . 246<br />
FSME-Virus-Antikörper (IgG) (W) . . . . . . . 246<br />
FSME-Virus-Antikörper (IgM) (W) . . . . . . . 247<br />
FSME-Virus-RNA-Nachweis (W) . . . . . . . . 247<br />
fT3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 247<br />
fT4 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 247<br />
Index<br />
FTA-ABS-19s-IgM (W) . . . . . . . . . . . . . . . . . 247<br />
FTA-ABS-IgG (W) . . . . . . . . . . . . . . . . . . . . . .248<br />
G<br />
Gabapentin (W) . . . . . . . . . . . . . . . . . . . . . . . . .248<br />
Galaktokinase in Erythrozyten (U) . . . . . . . . 248<br />
Galaktose im Blut (U)(N) . . . . . . . . . . . . . . . . . 248<br />
Galaktose im Urin (W) . . . . . . . . . . . . . . . . . . 248<br />
Galaktose-1-Phosphat (U) . . . . . . . . . . . . . . . 248<br />
Galaktose-1-Phosphat-Uridyl-Transferase in<br />
Erythrozyten (U) . . . . . . . . . . . . . 249<br />
Gallensäuren im Serum (W) . . . . . . . . . . . . . .249<br />
Gallensäuren im Stuhl (U) . . . . . . . . . . . . . . . 249<br />
Gamma-Linolensäure (U)(N) . . . . . . . . . . . . . 250<br />
Gastrin im Serum (W) . . . . . . . . . . . . . . . . . . . 250<br />
Gelbfieber-Antikörper (U) . . . . . . . . . . . . . . . 250<br />
Gentamicin im Serum. . . . . . . . . . . . . . . . . .250<br />
Gerinnungsuntersuchungen . . . . . . . . . . . . . 251<br />
GFR nach CKD-Epi Formel . . . . . . . . . . . . 251<br />
GHB im Serum (W)(N) . . . . . . . . . . . . . . . . . . .251<br />
GHB im Urin (W)(N) . . . . . . . . . . . . . . . . . . . . 251<br />
GLDH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 251<br />
Gliadin-Antikörper im Stuhl (IgA) (W) . . . .252<br />
Glibenclamid (U) . . . . . . . . . . . . . . . . . . . . . . . 252<br />
Glibornurid (U) . . . . . . . . . . . . . . . . . . . . . . . . . 252<br />
Glimepirid (U) . . . . . . . . . . . . . . . . . . . . . . . . . 252<br />
Glucagon (U) . . . . . . . . . . . . . . . . . . . . . . . . . . .252<br />
Glukose im Blut . . . . . . . . . . . . . . . . . . . . . . . 253<br />
Glukose im Dialysat (N) . . . . . . . . . . . . . . . . . 253<br />
Glukose im Liquor . . . . . . . . . . . . . . . . . . . . 253<br />
Glukose im Urin . . . . . . . . . . . . . . . . . . . . . . 253<br />
Glukose-6-Phosphat-Dehydrogenase in<br />
Erythrozyten (W) . . . . . . . . . . . . . 253<br />
Glutarsäure (U) . . . . . . . . . . . . . . . . . . . . . . . . . 254<br />
Glutathion gesamt im Vollblut (W) . . . . . . . .254<br />
Glutathion, reduziert im Vollblut (W) . . . . . 254<br />
Glutathion-Peroxidase (W) . . . . . . . . . . . . . . .254<br />
Glutathion-Reduktase in Erythrozyten (U) . 254<br />
Gold im Serum (W) . . . . . . . . . . . . . . . . . . . . . 255<br />
GOT . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 255<br />
GPT . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 255<br />
H<br />
Hämochromatose, hereditär . . . . . . . . . . . . 256<br />
Hämoglobin / Hämoglobin-Haptoglobin-<br />
Komplex im Stuhl (W) . . . . . . . . 256<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 387
Index<br />
Hämoglobin-Mutationsnachweis (W) . . . . . 256<br />
Hämopexin (W) . . . . . . . . . . . . . . . . . . . . . . . . .256<br />
Hämosiderin (U)(N) . . . . . . . . . . . . . . . . . . . . . 257<br />
Haemophilus influenzae Typ b-IgG-<br />
Antikörper (W) . . . . . . . . . . . . . . . 255<br />
Haloperidol (Haldol) (W) . . . . . . . . . . . . . . . . 255<br />
HAMA (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 256<br />
Hantavirus-Antikörper (IgG-Immunoblot,<br />
Bestätigung) (W) . . . . . . . . . . . . . 257<br />
Hantavirus-Antikörper (IgM-Immunoblot,<br />
Bestätigung) (W) . . . . . . . . . . . . . 257<br />
Hantavirus-Serologie (W) . . . . . . . . . . . . . . . . 257<br />
Haptoglobin . . . . . . . . . . . . . . . . . . . . . . . . . . 257<br />
Harnsäure im Punktat (N) . . . . . . . . . . . . . . . .258<br />
Harnsäure im Serum . . . . . . . . . . . . . . . . . . . 258<br />
Harnsäure im Urin. . . . . . . . . . . . . . . . . . . . .258<br />
Harnstoff im Serum. . . . . . . . . . . . . . . . . . . .258<br />
Harnstoff im Urin . . . . . . . . . . . . . . . . . . . . . 258<br />
Hb-Elektrophorese (W) . . . . . . . . . . . . . . . . . . 259<br />
HbA1c . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 259<br />
HBDH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 259<br />
HBe-Antigen . . . . . . . . . . . . . . . . . . . . . . . . . 259<br />
HBs-Antigen. . . . . . . . . . . . . . . . . . . . . . . . . .260<br />
HDL-Cholesterin . . . . . . . . . . . . . . . . . . . . . . 260<br />
Helicobacter pylori-Antikörper (IgA-EIA)<br />
260<br />
Helicobacter pylori-Antikörper (IgG-EIA)<br />
260<br />
Helicobacter pylori-Nachweis im Atemtest<br />
260<br />
Helicobacter pylori-Serologie. . . . . . . . . . .261<br />
Heparin-induzierte Thrombozytopenie. . .261<br />
Hepatitis A-Serologie . . . . . . . . . . . . . . . . . . 261<br />
Hepatitis A-Virus-PCR (W) . . . . . . . . . . . . . . 261<br />
Hepatitis B-DNA-Nachweis quantitativ . . 262<br />
Hepatitis B-Serologie . . . . . . . . . . . . . . . . . . 262<br />
Hepatitis B-Virus-Resistenzbestimmung<br />
(genotypisch, Pol-Gen) (W) . . . . 262<br />
Hepatitis C-RNA-Nachweis quantitativ . . 262<br />
Hepatitis C-Serologie . . . . . . . . . . . . . . . . . . 263<br />
Hepatitis C-Virus-Genotypisierung . . . . . . 263<br />
Hepatitis D-Diagnostik (W) . . . . . . . . . . . . . . 263<br />
Hepatitis D-RNA-Nachweis (W) . . . . . . . . . 263<br />
Hepatotrope Erreger . . . . . . . . . . . . . . . . . . . 264<br />
HER-2/neu-Protein im Serum (W) . . . . . . . . 264<br />
Hereditäre Fruktose-Intoleranz (U) . . . . . . . 264<br />
Hereditäre Pankreatitis (U) . . . . . . . . . . . . . . .264<br />
Herpes simplex-Virus Typ 1/2-Antikörper<br />
(IgG, Liquor/Serum). . . . . . . . .264<br />
Herpes simplex-Virus Typ 1/2-DNA-<br />
Nachweis. . . . . . . . . . . . . . . . . . .265<br />
Herpes simplex-Virus Typ 1/2-Serologie . 265<br />
Hexachlorbenzol im Blut (U) . . . . . . . . . . . . 265<br />
Hippursäure im Urin (U) . . . . . . . . . . . . . . . . 265<br />
Histamin im Blut (U) . . . . . . . . . . . . . . . . . . . . 265<br />
Histamin im Plasma (U) . . . . . . . . . . . . . . . . . 266<br />
Histamin im Urin (U) . . . . . . . . . . . . . . . . . . . 266<br />
Histoplasma capsulatum-Antikörper (U) . . 266<br />
HIV-1-RNA-Nachweis quantitativ. . . . . . .266<br />
HIV-Antikörper (Bestätigung) . . . . . . . . . . 267<br />
HIV-Antikörper (Suchtest) . . . . . . . . . . . . . 267<br />
HLA-A-,B-,C-Typisierung (U) . . . . . . . . . . . 267<br />
HLA-B*5701-Gentest (U) . . . . . . . . . . . . . . . 267<br />
HLA-B27 . . . . . . . . . . . . . . . . . . . . . . . . . . . . 267<br />
HLA-DR-, DP-, DQ-Typisierung (U) . . . . . 268<br />
HLA-Typisierung (U) . . . . . . . . . . . . . . . . . . . 268<br />
Holo-Transcobalamin (W) . . . . . . . . . . . . . . . 268<br />
Homocystein. . . . . . . . . . . . . . . . . . . . . . . . . .269<br />
Homogentisinsäure im Urin (U)(N) . . . . . . . . 269<br />
Homovanillinsäure im Urin. . . . . . . . . . . . .269<br />
hPLAP (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 269<br />
Humane granulozytäre Ehrlichiose-<br />
Antikörper (IgG) (W) . . . . . . . . . 270<br />
Humane granulozytäre Ehrlichiose-<br />
Antikörper (IgM) (W) . . . . . . . . . 270<br />
Humanes Herpes-Virus Typ 6-Antikörper 270<br />
Humanes Herpes-Virus Typ 7-Antikörper (W)<br />
270<br />
Humanes Herpes-Virus Typ 8-IgG-<br />
Antikörper (W) . . . . . . . . . . . . . . . 270<br />
Humanes Papilloma-Virus-DNA-Nachweis<br />
271<br />
Humanes placentares Lactogen (U)(N) . . . . . 271<br />
Hydrochlorothiazid (U) . . . . . . . . . . . . . . . . . .271<br />
Hydroxybutyrat (U) . . . . . . . . . . . . . . . . . . . . . 271<br />
Hydroxyprolin im Urin (U) . . . . . . . . . . . . . . 272<br />
Hydroxyprolin, frei (U) . . . . . . . . . . . . . . . . . .272<br />
Hyperhomocysteinämie, hereditär . . . . . . . 272<br />
Hypochrome Erythrozyten . . . . . . . . . . . . . 273<br />
I<br />
Ibuprofen (U) . . . . . . . . . . . . . . . . . . . . . . . . . . .273<br />
IgA (sekretorisch) (U) . . . . . . . . . . . . . . . . . . . 273<br />
IgA im Liquor . . . . . . . . . . . . . . . . . . . . . . . . 273<br />
388 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
IgA im Serum . . . . . . . . . . . . . . . . . . . . . . . . . 273<br />
IgA im Serum (allergenspezifisches) (W) . . 273<br />
IgA im Stuhl (W) . . . . . . . . . . . . . . . . . . . . . . . 274<br />
IgA im Urin (W)(N) . . . . . . . . . . . . . . . . . . . . . .274<br />
IgA-Subklassen (U) . . . . . . . . . . . . . . . . . . . . . 274<br />
IgAκ (W) . . . . . . . . . . . . . . . . . . . . . . . . 274<br />
IgAλ (W) . . . . . . . . . . . . . . . . . . . . . . 274<br />
IgD im Serum (W) . . . . . . . . . . . . . . . . . . . . . . 274<br />
IgE im Serum (allergenspezifisches) . . . . . 275<br />
IgE im Serum (gesamt) . . . . . . . . . . . . . . . . 275<br />
IGFBP-3 (W)(N) . . . . . . . . . . . . . . . . . . . . . . . . .275<br />
IgG 1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 275<br />
IgG 2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 276<br />
IgG 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 276<br />
IgG 4 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 276<br />
IgG im Liquor . . . . . . . . . . . . . . . . . . . . . . . . 276<br />
IgG im Serum . . . . . . . . . . . . . . . . . . . . . . . . . 276<br />
IgG im Serum (allergenspezifisches) . . . . 276<br />
IgG im Urin . . . . . . . . . . . . . . . . . . . . . . . . . . 277<br />
IgG, oligoklonal (Liquor/Serum) . . . . . . . . 277<br />
IgG-Subklassen . . . . . . . . . . . . . . . . . . . . . . . 277<br />
IgGλ (W) . . . . . . . . . . . . . . . . . . . . . . 277<br />
IgM im Liquor . . . . . . . . . . . . . . . . . . . . . . . . 277<br />
IgM im Serum . . . . . . . . . . . . . . . . . . . . . . . . 278<br />
IgMκ (W) . . . . . . . . . . . . . . . . . . . . . . . 278<br />
IgMλ (W) . . . . . . . . . . . . . . . . . . . . . . 278<br />
Imatinib (W)(N) . . . . . . . . . . . . . . . . . . . . . . . . . 278<br />
Imipramin . . . . . . . . . . . . . . . . . . . . . . . . . . . . 278<br />
Immunfixationselektrophorese im Serum 278<br />
Immunfixationselektrophorese im Urin . . 279<br />
Indometacin (W) . . . . . . . . . . . . . . . . . . . . . . . . 279<br />
Influenza A-Virus-RNA-Nachweis . . . . . . 279<br />
Influenza A/B-Virus-Serologie . . . . . . . . . . 279<br />
Influenza B-Virus-RNA-Nachweis . . . . . . 280<br />
Inhibin B (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 280<br />
INR . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 280<br />
Insulin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 280<br />
Interferon-Antikörper (W) . . . . . . . . . . . . . . . 280<br />
Interleukin 1 (W) . . . . . . . . . . . . . . . . . . . . . . . 281<br />
Interleukin 28B Genotypisierung (IL28B)<br />
OMIM #609532 (N) . . . . . . . . . . 281<br />
Interleukin 6 (U) . . . . . . . . . . . . . . . . . . . . . . . . 281<br />
Interleukin 8 (W) . . . . . . . . . . . . . . . . . . . . . . . 281<br />
Isoniazid (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . 282<br />
Isopropanol im Blut (U) . . . . . . . . . . . . . . . . . 282<br />
Itraconazol (W) . . . . . . . . . . . . . . . . . . . . . . . . . 282<br />
J<br />
Index<br />
JC-(Polyoma)-Virus-DNA-Nachweis . . . . 282<br />
Jod im Serum (W) . . . . . . . . . . . . . . . . . . . . . . 282<br />
Jod im Urin (W) . . . . . . . . . . . . . . . . . . . . . . . . 282<br />
K<br />
Kälte-Agglutinine . . . . . . . . . . . . . . . . . . . . . 283<br />
Kalium im Dialysat . . . . . . . . . . . . . . . . . . . . 283<br />
Kalium im Serum . . . . . . . . . . . . . . . . . . . . . 283<br />
Kalium im Urin . . . . . . . . . . . . . . . . . . . . . . . 283<br />
Kappa-/Lambda-Quotient im Serum . . . . . 283<br />
Katecholamine im Plasma (W) . . . . . . . . . . . 284<br />
Katecholamine im Urin . . . . . . . . . . . . . . . . 284<br />
Katzenkratzkrankheit-Serologie (W) . . . . . . 284<br />
Kobalt im Blut (U) . . . . . . . . . . . . . . . . . . . . . . 285<br />
Kobalt im Haar (W) . . . . . . . . . . . . . . . . . . . . . 285<br />
Kobalt im Urin (U) . . . . . . . . . . . . . . . . . . . . . .285<br />
Konkrementanalyse (W) . . . . . . . . . . . . . . . . . 285<br />
Kreatinin im Serum. . . . . . . . . . . . . . . . . . . .285<br />
Kreatinin im Urin . . . . . . . . . . . . . . . . . . . . . 285<br />
Kreatinin-Clearance (N) . . . . . . . . . . . . . . . . . 286<br />
Kryoglobuline . . . . . . . . . . . . . . . . . . . . . . . . 286<br />
Kryptosporidien-Antigen im Stuhl . . . . . . 286<br />
Kupfer im Serum . . . . . . . . . . . . . . . . . . . . . . 287<br />
Kupfer im Urin (W)(N) . . . . . . . . . . . . . . . . . . . 287<br />
L<br />
Löslicher Interleukin 2-Rezeptor (W) . . . . . 294<br />
Löslicher Transferrin-Rezeptor (W) . . . . . . . 295<br />
Lacosamid (W) . . . . . . . . . . . . . . . . . . . . . . . . . 287<br />
Lactat im Liquor (W) . . . . . . . . . . . . . . . . . . . . 287<br />
Lactat im Plasma (W) . . . . . . . . . . . . . . . . . . . 287<br />
Lactat im Punktat (W)(N) . . . . . . . . . . . . . . . . . 288<br />
Laktoferrin im Stuhl (W) . . . . . . . . . . . . . . . . 288<br />
Laktoseintoleranz-Polymorphismus (MCM6-<br />
Gen) . . . . . . . . . . . . . . . . . . . . . . . 288<br />
Lamivudin (U)(N) . . . . . . . . . . . . . . . . . . . . . . . 288<br />
Lamotrigin . . . . . . . . . . . . . . . . . . . . . . . . . . . 289<br />
LBP (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 289<br />
LDH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 289<br />
LDH im Punktat (N) . . . . . . . . . . . . . . . . . . . . 289<br />
LDH-Isoenzyme (U) . . . . . . . . . . . . . . . . . . . . 289<br />
LDL-Cholesterin . . . . . . . . . . . . . . . . . . . . . . 289<br />
LDL-Cholesterin-Subfraktionen (W)(N) . . . .290<br />
Legionella pneumophilia-DNA-Nachweis290<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 389
Index<br />
Legionellen-Serologie . . . . . . . . . . . . . . . . . 290<br />
Leishmania donovani-Antikörper (W)(N) . . .290<br />
Leptin (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 291<br />
Leptospiren-Antikörper (U) . . . . . . . . . . . . . . 291<br />
Leukämie- <strong>und</strong> Lymphom-Diagnostik (U) . 291<br />
Levetiracetam . . . . . . . . . . . . . . . . . . . . . . . . . 291<br />
Levodopa (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 292<br />
Levomepromazin (U) . . . . . . . . . . . . . . . . . . . 292<br />
LH. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .292<br />
Lidocain (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . 292<br />
Lipase. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .292<br />
Lipidelektrophorese (W) . . . . . . . . . . . . . . . . . 292<br />
LipoDens-Lipoproteinprofil . . . . . . . . . . . . 293<br />
Lipoprotein X (U)(N) . . . . . . . . . . . . . . . . . . . . 293<br />
Lipoprotein(a) . . . . . . . . . . . . . . . . . . . . . . . . 293<br />
Lipoprotein-assoziierte Phospholipase<br />
A2 (W)(N) . . . . . . . . . . . . . . . . . . . . 293<br />
Listeria monocytogenes DNA-Nachweis (W)<br />
293<br />
Listerien-Antikörper (W)(N) . . . . . . . . . . . . . . 293<br />
Lithium . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 294<br />
Lorazepam (W) . . . . . . . . . . . . . . . . . . . . . . . . . 294<br />
Lormetazepam (U)(N) . . . . . . . . . . . . . . . . . . . .294<br />
LSD im Urin (W) . . . . . . . . . . . . . . . . . . . . . . . 295<br />
Lues-Serologie (Stufendiagnostik) . . . . . . 295<br />
Lupusantikoagulanz . . . . . . . . . . . . . . . . . . . 295<br />
Lycopene (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 296<br />
Lymphotrope Erreger . . . . . . . . . . . . . . . . . . 296<br />
Lymphozytendifferenzierung . . . . . . . . . . . 296<br />
Lysozym im Liquor (W) . . . . . . . . . . . . . . . . . 296<br />
Lysozym im Serum (W) . . . . . . . . . . . . . . . . . 296<br />
Lysozym im Urin (U) . . . . . . . . . . . . . . . . . . . 296<br />
M<br />
Magnesium im Serum . . . . . . . . . . . . . . . . . 297<br />
Magnesium im Urin . . . . . . . . . . . . . . . . . . . 297<br />
Malaria-Antikörper (U) . . . . . . . . . . . . . . . . . .297<br />
Malondialdehyd (U)(N) . . . . . . . . . . . . . . . . . . 297<br />
Mandelsäure im Urin (U) . . . . . . . . . . . . . . . . 298<br />
Mangan im Blut (U) . . . . . . . . . . . . . . . . . . . . .298<br />
Mangan im Urin (U) . . . . . . . . . . . . . . . . . . . . 298<br />
Maprotilin . . . . . . . . . . . . . . . . . . . . . . . . . . . . 298<br />
Masern-Serologie . . . . . . . . . . . . . . . . . . . . . 298<br />
Masern-Virus-Antikörper (IgG,<br />
Liquor/Serum) . . . . . . . . . . . . . . 298<br />
MDRD-Clearance . . . . . . . . . . . . . . . . . . . . . 299<br />
Mebendazol (U)(N) . . . . . . . . . . . . . . . . . . . . . . 299<br />
Medikamentennachweis im Urin (U) . . . . . .299<br />
Medroxyprogesteron (U) . . . . . . . . . . . . . . . . 299<br />
Melanin im Urin (U)(N) . . . . . . . . . . . . . . . . . . 299<br />
Melatonin (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 300<br />
Melperon (U) . . . . . . . . . . . . . . . . . . . . . . . . . . .300<br />
Met-Hämoglobin (W) . . . . . . . . . . . . . . . . . . . 300<br />
Metanephrin im Plasma (W) . . . . . . . . . . . . . 300<br />
Metanephrin im Urin (W) . . . . . . . . . . . . . . . . 300<br />
Methadon im Urin . . . . . . . . . . . . . . . . . . . . . 301<br />
Methanol im Blut (U) . . . . . . . . . . . . . . . . . . . 301<br />
Methanol im Urin (W) . . . . . . . . . . . . . . . . . . . 301<br />
Methotrexat. . . . . . . . . . . . . . . . . . . . . . . . . . .301<br />
Methsuximid (U) . . . . . . . . . . . . . . . . . . . . . . . 301<br />
Methylhippursäure gesamt im Urin (W) . . . 302<br />
Methylhistamin (U) . . . . . . . . . . . . . . . . . . . . . 302<br />
Methylmalonsäure (W) . . . . . . . . . . . . . . . . . . 302<br />
Methylphenidat (U) . . . . . . . . . . . . . . . . . . . . . 302<br />
Mexiletin (U) . . . . . . . . . . . . . . . . . . . . . . . . . . .302<br />
Mianserin (U) . . . . . . . . . . . . . . . . . . . . . . . . . . 303<br />
Micropolyspora faeni-Antikörper (IgG) . . 303<br />
Midazolam (U) . . . . . . . . . . . . . . . . . . . . . . . . . 303<br />
Mikrosomale Antikörper . . . . . . . . . . . . . . . 303<br />
Mirtazapin (W) . . . . . . . . . . . . . . . . . . . . . . . . . 303<br />
Moclobemid (U)(N) . . . . . . . . . . . . . . . . . . . . . .303<br />
Molybdän im Serum (U) . . . . . . . . . . . . . . . . .304<br />
Molybdän im Urin (U) . . . . . . . . . . . . . . . . . . 304<br />
MRSA-Schnelltest . . . . . . . . . . . . . . . . . . . . 304<br />
Mumps-Serologie . . . . . . . . . . . . . . . . . . . . . 304<br />
Mumps-Virus-Antikörper (IgG,<br />
Liquor/Serum) . . . . . . . . . . . . . . 304<br />
Mutterschaftsvorsorge . . . . . . . . . . . . . . . . . 305<br />
Mycobacterium tuberculosis-Komplex-DNA-<br />
Nachweis. . . . . . . . . . . . . . . . . . .305<br />
Mycophenolat Mofetil (W) . . . . . . . . . . . . . . .305<br />
Mycoplasma pneumoniae-DNA-Nachweis<br />
305<br />
Mycoplasmen-Antikörper . . . . . . . . . . . . . . 306<br />
Mykobakterium tuberculosis-spezifische T-<br />
Lymphozyten . . . . . . . . . . . . . . . 306<br />
Myoglobin im Serum (W) . . . . . . . . . . . . . . . .306<br />
Myoglobin im Urin (W) . . . . . . . . . . . . . . . . . 306<br />
N<br />
N-Acetylglucosaminidase (W) . . . . . . . . . . . 307<br />
N-Desmethyl-Tamoxifen (U) . . . . . . . . . . . . . 307<br />
Naproxen (U)(N) . . . . . . . . . . . . . . . . . . . . . . . . 307<br />
Natürliche Killerzellen . . . . . . . . . . . . . . . . . 308<br />
390 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Natrium im Dialysat (N) . . . . . . . . . . . . . . . . . 307<br />
Natrium im Serum/Plasma . . . . . . . . . . . . . 307<br />
Natrium im Urin (N) . . . . . . . . . . . . . . . . . . . . 307<br />
Neisseria gonorrhoeae-DNA-Nachweis . . 308<br />
Neopterin im Urin (W) . . . . . . . . . . . . . . . . . . 308<br />
Neopterin (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 308<br />
Netilmicin (W) . . . . . . . . . . . . . . . . . . . . . . . . . 309<br />
Nicht-tuberkulöse Mykobakterien, NTM-<br />
DNA-Nachweis . . . . . . . . . . . . . 309<br />
Nickel im Blut (W)(N) . . . . . . . . . . . . . . . . . . . 309<br />
Nickel im Urin (U)(N) . . . . . . . . . . . . . . . . . . . 309<br />
Nicotinamid (W) . . . . . . . . . . . . . . . . . . . . . . . . 309<br />
Nitrazepam (U) . . . . . . . . . . . . . . . . . . . . . . . . . 310<br />
NMP22 (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 310<br />
Noradrenalin im Plasma (W) . . . . . . . . . . . . . 310<br />
Noradrenalin im Urin . . . . . . . . . . . . . . . . . . 310<br />
Normetanephrin im Plasma (W) . . . . . . . . . . 311<br />
Normetanephrin im Urin (W) . . . . . . . . . . . . 311<br />
Noro-Virus-RNA-Nachweis im Stuhl . . . . 311<br />
Nortriptylin im Serum . . . . . . . . . . . . . . . . . 311<br />
NSE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 311<br />
NSE im Liquor (N) . . . . . . . . . . . . . . . . . . . . . 312<br />
O<br />
O-Desmethyl-Venlafaxin (W) . . . . . . . . . . . . 312<br />
Olanzapin (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 312<br />
Opiate im Urin . . . . . . . . . . . . . . . . . . . . . . . . 312<br />
Ortho-Kresol (W) . . . . . . . . . . . . . . . . . . . . . . . 312<br />
Osmolalität im Serum. . . . . . . . . . . . . . . . . .313<br />
Osmolalität im Urin . . . . . . . . . . . . . . . . . . . 313<br />
Osmotische Resistenz der Erythrozyten (N) 313<br />
Ostase (W)(N) . . . . . . . . . . . . . . . . . . . . . . . . . . . 313<br />
Osteocalcin (U) . . . . . . . . . . . . . . . . . . . . . . . . . 313<br />
Oxalsäure im Urin (W) . . . . . . . . . . . . . . . . . . 314<br />
Oxazepam (W) . . . . . . . . . . . . . . . . . . . . . . . . . 315<br />
Oxcarbazepin . . . . . . . . . . . . . . . . . . . . . . . . . 315<br />
Oxidativer Burst (W) . . . . . . . . . . . . . . . . . . . . 315<br />
Oxidiertes LDL-Cholesterin (W)(N) . . . . . . . 315<br />
Oxypurinol (U)(N) . . . . . . . . . . . . . . . . . . . . . . . 315<br />
P<br />
Palladium im Urin (U) . . . . . . . . . . . . . . . . . . .316<br />
Palladium (U) . . . . . . . . . . . . . . . . . . . . . . . . . . 315<br />
Pankreas-Amylase im Serum (U) . . . . . . . . . 316<br />
Pankreas-Elastase 1 im Serum (W) . . . . . . . .316<br />
Pankreas-Elastase 1 im Stuhl . . . . . . . . . . . 316<br />
Index<br />
Pankreatisches Polypeptid (W) . . . . . . . . . . . 316<br />
Pantothensäure (U) . . . . . . . . . . . . . . . . . . . . . .317<br />
PAPP-A (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 317<br />
Paracetamol . . . . . . . . . . . . . . . . . . . . . . . . . . 317<br />
Parainfluenza-Virus-Serologie (W) . . . . . . . .317<br />
Parathormon intakt . . . . . . . . . . . . . . . . . . . . 318<br />
Paroxetin (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 318<br />
Parvovirus B19-Antikörper (IgG) . . . . . . . 318<br />
Parvovirus B19-Antikörper (IgM) . . . . . . . 318<br />
Parvovirus B19-DNA-Nachweis (W) . . . . . . 319<br />
PCP im Serum (U) . . . . . . . . . . . . . . . . . . . . . . 319<br />
PCP im Urin (U) . . . . . . . . . . . . . . . . . . . . . . . . 319<br />
Perazin (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 319<br />
Perphenazin (U) . . . . . . . . . . . . . . . . . . . . . . . . 319<br />
pH-Wert im Stuhl . . . . . . . . . . . . . . . . . . . . . 319<br />
Phenacetin (U) . . . . . . . . . . . . . . . . . . . . . . . . . 320<br />
Phencyclidin (U) . . . . . . . . . . . . . . . . . . . . . . . .320<br />
Phenobarbital . . . . . . . . . . . . . . . . . . . . . . . . . 320<br />
Phenol im Urin (U)(N) . . . . . . . . . . . . . . . . . . . 320<br />
Phenprocoumon (U) . . . . . . . . . . . . . . . . . . . . .320<br />
Phenylalanin im Plasma (U) . . . . . . . . . . . . . 320<br />
Phenylbutazon (U) . . . . . . . . . . . . . . . . . . . . . . 321<br />
Phenylglyoxylsäure im Urin (U) . . . . . . . . . . 321<br />
Phenytoin . . . . . . . . . . . . . . . . . . . . . . . . . . . . 321<br />
Phosphat im Serum . . . . . . . . . . . . . . . . . . . . 321<br />
Phosphat im Urin. . . . . . . . . . . . . . . . . . . . . .321<br />
Phospho-Tau (W) . . . . . . . . . . . . . . . . . . . . . . . 322<br />
Phosphohexose-Isomerase im Liquor (W)(N)<br />
322<br />
Phosphohexose-Isomerase im Serum (U) . . 322<br />
Phospholipid-Antikörper . . . . . . . . . . . . . . . 322<br />
Phytansäure (U) . . . . . . . . . . . . . . . . . . . . . . . . 323<br />
Pimozid (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 323<br />
Pipamperon (U) . . . . . . . . . . . . . . . . . . . . . . . . 323<br />
Plasminogen-Aktivator-Inhibitor (U) . . . . . . 323<br />
Plasminogen-Aktivität (W) . . . . . . . . . . . . . . .324<br />
Plasminogen-Konzentration (W) . . . . . . . . . . 324<br />
Platin im Serum (U) . . . . . . . . . . . . . . . . . . . . . 324<br />
PMN-Elastase im Stuhl (W) . . . . . . . . . . . . . .324<br />
Pneumocystis jiroveci DNA-Nachweis . . 324<br />
Pneumokokken-Antikörper (W) . . . . . . . . . . 324<br />
PNH-Diagnostik (W) . . . . . . . . . . . . . . . . . . . . 325<br />
Poliovirus-Antikörper (W) . . . . . . . . . . . . . . . 325<br />
Polychlorierte Biphenyle (U) . . . . . . . . . . . . . 325<br />
Porphobilinogen im Urin (W) . . . . . . . . . . . . 325<br />
Porphyrie-Diagnostik (W) . . . . . . . . . . . . . . . 326<br />
Porphyrine im Stuhl (W) . . . . . . . . . . . . . . . . . 326<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 391
Index<br />
Porphyrine im Urin (W) . . . . . . . . . . . . . . . . . 326<br />
Porphyrine in Erythrozyten (W) . . . . . . . . . . 327<br />
Präalbumin (U) . . . . . . . . . . . . . . . . . . . . . . . . . 327<br />
Prajmalin (U) . . . . . . . . . . . . . . . . . . . . . . . . . . .327<br />
Prednisolon (U)(N) . . . . . . . . . . . . . . . . . . . . . . 327<br />
Pregabalin (U) . . . . . . . . . . . . . . . . . . . . . . . . . . 327<br />
Pregnandiol (U)(N) . . . . . . . . . . . . . . . . . . . . . . 327<br />
Pregnantriol (U)(N) . . . . . . . . . . . . . . . . . . . . . . 328<br />
Primidon . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 328<br />
pro Gastrin Releasing Peptide (U) . . . . . . . . 328<br />
Procalcitonin. . . . . . . . . . . . . . . . . . . . . . . . . .328<br />
Progesteron im Serum . . . . . . . . . . . . . . . . . 328<br />
Proinsulin intakt (W) . . . . . . . . . . . . . . . . . . . . 329<br />
Prokollagen-I, N-terminales Propeptid (W) 329<br />
Prokollagen-III-Peptid (W) . . . . . . . . . . . . . . .329<br />
Prolaktin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 329<br />
Promethazin (W) . . . . . . . . . . . . . . . . . . . . . . . .330<br />
Propafenon (W) . . . . . . . . . . . . . . . . . . . . . . . . .330<br />
Propranolol (U) . . . . . . . . . . . . . . . . . . . . . . . . . 330<br />
Protein 14-3-3 im Liquor (W)(N) . . . . . . . . . . 330<br />
Protein C-Aktivität . . . . . . . . . . . . . . . . . . . . 330<br />
Protein C-Antigen (U) . . . . . . . . . . . . . . . . . . . 331<br />
Protein C-Genotypisierung (W) . . . . . . . . . . .331<br />
Protein S-100 im Liquor . . . . . . . . . . . . . . . 331<br />
Protein S-100 im Serum. . . . . . . . . . . . . . . .331<br />
Protein S-Aktivität . . . . . . . . . . . . . . . . . . . . 331<br />
Protein S-Antigen, frei . . . . . . . . . . . . . . . . . 332<br />
Protein S-Genotypisierung (W) . . . . . . . . . . . 332<br />
Protein S-gesamt (U) . . . . . . . . . . . . . . . . . . . . 332<br />
Protein Z-Konzentration (W) . . . . . . . . . . . . . 332<br />
Prothrombin-Fragmente F 12 (W) . . . . . . . . 333<br />
PSA frei . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 333<br />
PSA gesamt . . . . . . . . . . . . . . . . . . . . . . . . . . 333<br />
PSA komplexiert (W) . . . . . . . . . . . . . . . . . . . 333<br />
Pseudomonas aeruginosa-Antikörper (W) . 333<br />
PTHrP (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 334<br />
PTT. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .334<br />
Pyrazinamid (U) . . . . . . . . . . . . . . . . . . . . . . . . 334<br />
Pyridinolin im Urin (W) . . . . . . . . . . . . . . . . . 334<br />
Pyrimethamin (U)(N) . . . . . . . . . . . . . . . . . . . . 334<br />
Pyruvat im Plasma (W) . . . . . . . . . . . . . . . . . . 335<br />
Pyruvatkinase in Erythrozyten (U) . . . . . . . . 335<br />
Q<br />
Q-Fieber (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . 335<br />
Quecksilber im Blut (W) . . . . . . . . . . . . . . . . . 335<br />
Quecksilber im Haar (U) . . . . . . . . . . . . . . . . 335<br />
Quecksilber im Speichel (W) . . . . . . . . . . . . . 335<br />
Quecksilber im Urin (W) . . . . . . . . . . . . . . . . 336<br />
Quetiapin (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 336<br />
Quick-Wert . . . . . . . . . . . . . . . . . . . . . . . . . . . 336<br />
Quotient APO B/APO A1 . . . . . . . . . . . . . . 336<br />
R<br />
Rötelnvirus-Antikörper (IgG, Liquor/Serum)<br />
340<br />
Rötelnvirus-Antikörper (IgG-Avidität) (W) 340<br />
Rötelnvirus-Antikörper (IgG-Suchtest) . . 340<br />
Rötelnvirus-Antikörper (IgM-Suchtest) . . 341<br />
Rötelnvirus-RNA-Nachweis (W) . . . . . . . . . 341<br />
Reboxetin (U) . . . . . . . . . . . . . . . . . . . . . . . . . . 336<br />
Reiber Schema . . . . . . . . . . . . . . . . . . . . . . . . 337<br />
Renin direkt . . . . . . . . . . . . . . . . . . . . . . . . . . 337<br />
Reptilase-Zeit (U) . . . . . . . . . . . . . . . . . . . . . . .337<br />
Retikulozyten . . . . . . . . . . . . . . . . . . . . . . . . . 337<br />
Retikulozyten-Hb . . . . . . . . . . . . . . . . . . . . . 337<br />
Retinol-bindendes Protein (U) . . . . . . . . . . . .338<br />
Rhagozyten im Punktat . . . . . . . . . . . . . . . . 338<br />
Rhesusfaktor . . . . . . . . . . . . . . . . . . . . . . . . . . 338<br />
Rheumafaktor . . . . . . . . . . . . . . . . . . . . . . . . . 338<br />
Rickettsien-Antikörper (IgG) (U) . . . . . . . . . 338<br />
Rickettsien-Antikörper (IgM) (U) . . . . . . . . 338<br />
Rifabutin (W) . . . . . . . . . . . . . . . . . . . . . . . . . . .339<br />
Rifampicin (U) . . . . . . . . . . . . . . . . . . . . . . . . . 339<br />
Risperidon (W) . . . . . . . . . . . . . . . . . . . . . . . . . 339<br />
Ristocetin-Cofaktor (U) . . . . . . . . . . . . . . . . . 339<br />
Ritalinsäure (U) . . . . . . . . . . . . . . . . . . . . . . . . 339<br />
Rotavirus-Antigen im Stuhl . . . . . . . . . . . . 340<br />
Rotavirus-Antikörper (W) . . . . . . . . . . . . . . . .340<br />
RSV-Antigen-Nachweis . . . . . . . . . . . . . . . . 341<br />
RSV-Antikörper (IgA) (W) . . . . . . . . . . . . . . .342<br />
RSV-Antikörper (IgG) (W) . . . . . . . . . . . . . . .342<br />
RSV-RNA-Nachweis . . . . . . . . . . . . . . . . . . 342<br />
Rufinamid (W) . . . . . . . . . . . . . . . . . . . . . . . . . 342<br />
S<br />
Saccharomyces cerevisiae-Antikörper (W) .342<br />
Salicylate (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 343<br />
Salmonella paratyphi B-Antikörper (U)(N) . 343<br />
Salmonella typhi-Antikörper (H-<br />
Antigene) (U)(N) . . . . . . . . . . . . . . 343<br />
Salmonellen-Antikörper. . . . . . . . . . . . . . . .343<br />
Sandfliegen-Fieber-Virus-Antikörper (W) . 343<br />
392 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Saure Phosphatase . . . . . . . . . . . . . . . . . . . . . 344<br />
Saure Prostata-Phosphatase. . . . . . . . . . . . .344<br />
Saures α-1-Glycoprotein (U) . . . . . . . . . . . . . 344<br />
SCC . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 344<br />
Schilddrüsen-Autoantikörper . . . . . . . . . . . 344<br />
Schistosomen-Antikörper (U) . . . . . . . . . . . . 344<br />
Schwefel (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . 345<br />
SDS-PAGE-Elektrophorese. . . . . . . . . . . . .345<br />
Selen im Blut (W) . . . . . . . . . . . . . . . . . . . . . . .345<br />
Selen im Urin (U) . . . . . . . . . . . . . . . . . . . . . . . 345<br />
Septin9 (W)(N) . . . . . . . . . . . . . . . . . . . . . . . . . . 345<br />
Serotonin im Urin (W) . . . . . . . . . . . . . . . . . . .346<br />
Serotonin (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 346<br />
Sertralin (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . 346<br />
SHBG. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .346<br />
Shigellen-Antikörper (W) . . . . . . . . . . . . . . . . 346<br />
Sialinsäure (U)(N) . . . . . . . . . . . . . . . . . . . . . . . 347<br />
Silber im Blut/Serum (U) . . . . . . . . . . . . . . . . 347<br />
Silber im Speichel (U) . . . . . . . . . . . . . . . . . . .347<br />
Silber im Urin (U) . . . . . . . . . . . . . . . . . . . . . . 347<br />
Silicium (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 347<br />
Sirolimus (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 348<br />
Somatomedin C im Serum . . . . . . . . . . . . . 348<br />
Somatotropes Hormon . . . . . . . . . . . . . . . . . 348<br />
Sotalol (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 348<br />
Sterinämie-Screening (W) . . . . . . . . . . . . . . . 349<br />
Stiripentol (U) . . . . . . . . . . . . . . . . . . . . . . . . . . 349<br />
Strongyloides stercoralis-Antikörper (U) . . 349<br />
Strontium (U) . . . . . . . . . . . . . . . . . . . . . . . . . . 349<br />
Styrol im Blut (U) . . . . . . . . . . . . . . . . . . . . . . 349<br />
Sulpirid (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 349<br />
Sultiam. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .350<br />
Superoxiddismutase-Aktivität (W) . . . . . . . . 350<br />
T<br />
t,t-Muconsäure (U) . . . . . . . . . . . . . . . . . . . . . .350<br />
T-Lymphozyten . . . . . . . . . . . . . . . . . . . . . . . 350<br />
T3 gesamt . . . . . . . . . . . . . . . . . . . . . . . . . . . . 350<br />
T4 gesamt . . . . . . . . . . . . . . . . . . . . . . . . . . . . 351<br />
Tamoxifen (U) . . . . . . . . . . . . . . . . . . . . . . . . . . 351<br />
Tau-Protein im Liquor . . . . . . . . . . . . . . . . . 351<br />
Tb-Interferon-Test (N) . . . . . . . . . . . . . . . . . . .351<br />
TBG (W) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .352<br />
Teicoplanin (U) . . . . . . . . . . . . . . . . . . . . . . . . . 352<br />
Temazepam (U) . . . . . . . . . . . . . . . . . . . . . . . . 352<br />
Testosteron . . . . . . . . . . . . . . . . . . . . . . . . . . . 352<br />
Testosteron, frei (W) . . . . . . . . . . . . . . . . . . . . 352<br />
Index<br />
Tetanus-Toxoid-Antikörper im Serum . . . 353<br />
Tetrachlorethen (U) . . . . . . . . . . . . . . . . . . . . . 353<br />
Tetrachlormethan (U)(N) . . . . . . . . . . . . . . . . . 353<br />
Tetrahydro-Aldosteron im Urin (U) . . . . . . . 353<br />
Tetrahydrofuran (U) . . . . . . . . . . . . . . . . . . . . . 353<br />
Tetrazepam (U) . . . . . . . . . . . . . . . . . . . . . . . . . 354<br />
Thallium im Blut/Serum (W) . . . . . . . . . . . . . 354<br />
Thallium im Urin (W) . . . . . . . . . . . . . . . . . . . 354<br />
Theophyllin. . . . . . . . . . . . . . . . . . . . . . . . . . .354<br />
Thiamazol (U) . . . . . . . . . . . . . . . . . . . . . . . . . . 354<br />
Thiocyanat im Blut (U) . . . . . . . . . . . . . . . . . . 354<br />
Thiopental (W)(N) . . . . . . . . . . . . . . . . . . . . . . . 355<br />
Thiopurin-S-Methyltransferase<br />
Genotypisierung (U)(N) . . . . . . . . 355<br />
Thiopurin-S-Methyltransferase (W) . . . . . . . 355<br />
Thioridazin (U) . . . . . . . . . . . . . . . . . . . . . . . . . 355<br />
Thrombin-Antithrombin-Komplex (W) . . . . 355<br />
Thrombinzeit . . . . . . . . . . . . . . . . . . . . . . . . . 356<br />
Thromboplastinzeit . . . . . . . . . . . . . . . . . . . . 356<br />
Thrombozyten . . . . . . . . . . . . . . . . . . . . . . . . 356<br />
Thrombozyten-Antikörper (U) . . . . . . . . . . . 356<br />
Thymidin-Kinase. . . . . . . . . . . . . . . . . . . . . .357<br />
Thyreoglobulin. . . . . . . . . . . . . . . . . . . . . . . .357<br />
Tiagabin (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . 357<br />
Tiaprid (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 357<br />
Tilidin im Urin, qualitativ (U) . . . . . . . . . . . . 357<br />
Tilidin (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 357<br />
tissue-Plasminogen-Aktivator (t-PA) (U) . . 358<br />
Tobramycin . . . . . . . . . . . . . . . . . . . . . . . . . . . 358<br />
Tollwut-Antikörper (U) . . . . . . . . . . . . . . . . . . 358<br />
Toluol im Blut (W) . . . . . . . . . . . . . . . . . . . . . . 358<br />
Topiramat (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 358<br />
Toxic-schock-syndrome-Toxin-Nachweis (U)<br />
358<br />
Toxocara canis-Antikörper (U) . . . . . . . . . . . 359<br />
Toxoplasma gondii-Antikörper (IgG-<br />
Avidität) (W) . . . . . . . . . . . . . . . . . 359<br />
Toxoplasma gondii-Antikörper (IgG-<br />
Suchtest) . . . . . . . . . . . . . . . . . . . 359<br />
Toxoplasma gondii-Antikörper (IgM-<br />
Suchtest) . . . . . . . . . . . . . . . . . . . 360<br />
Toxoplasma gondii-DNA-Nachweis (W) . . 360<br />
Toxoplasmose-Antikörper (Liquor/Serum) (W)<br />
360<br />
Toxoplasmose-Serologie . . . . . . . . . . . . . . . 361<br />
TPA. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .361<br />
TPPA (Lues-Suchreaktion) . . . . . . . . . . . . . 361<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 393
Index<br />
Tramadol (U)(N) . . . . . . . . . . . . . . . . . . . . . . . . 361<br />
Transferrin. . . . . . . . . . . . . . . . . . . . . . . . . . . .362<br />
Transferrinsättigung . . . . . . . . . . . . . . . . . . . 362<br />
Transglutaminase-Antikörper im Stuhl<br />
(IgA) (W)(N) . . . . . . . . . . . . . . . . . . 362<br />
Tranylcypromin (U) . . . . . . . . . . . . . . . . . . . . . 362<br />
TRAP 5b (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 362<br />
Trazodon (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . 363<br />
Treponema pallidum Antikörper in<br />
Liquor/Serum . . . . . . . . . . . . . . . 363<br />
Treponema pallidum-Antikörper (IgG/IgM)<br />
363<br />
Treponema pallidum-Antikörper (IgM-<br />
Westernblot) (U) . . . . . . . . . . . . . . 363<br />
Trichinella spiralis-Antikörper (U) . . . . . . . . 363<br />
Trichloressigsäure im Urin (U) . . . . . . . . . . . 364<br />
Trichlorethan im Blut (U)(N) . . . . . . . . . . . . . 364<br />
Trichlorethanol im Blut (U) . . . . . . . . . . . . . . 364<br />
Trichlorethanol im Urin (U) . . . . . . . . . . . . . . 364<br />
Trichlorethen (U)(N) . . . . . . . . . . . . . . . . . . . . . 364<br />
Trichlormethan im Blut (U)(N) . . . . . . . . . . . . 365<br />
Triglyceride. . . . . . . . . . . . . . . . . . . . . . . . . . .365<br />
Trimipramin . . . . . . . . . . . . . . . . . . . . . . . . . . 365<br />
Triple-Test (U) . . . . . . . . . . . . . . . . . . . . . . . . . 365<br />
Trizyklische Antidepressiva im Urin (U) . . 365<br />
Tropheryma whippelii-DNA-Nachweis (W) 365<br />
Troponin I (U) . . . . . . . . . . . . . . . . . . . . . . . . . . 366<br />
Troponin T-Schnelltest (N) . . . . . . . . . . . . . . .366<br />
Trypanosoma cruzi-Antikörper (U) . . . . . . . 366<br />
Trypsin (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 366<br />
Tryptase . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 367<br />
TSH basal . . . . . . . . . . . . . . . . . . . . . . . . . . . . 367<br />
Tumor M2-PK im Stuhl (W) . . . . . . . . . . . . . 367<br />
Tumor M2-PK (U)(N) . . . . . . . . . . . . . . . . . . . . 367<br />
Tumor Nekrose Faktor (U) . . . . . . . . . . . . . . . 368<br />
U<br />
UDP-Galaktose-Epimerase (U)(N) . . . . . . . . 368<br />
Urinsediment . . . . . . . . . . . . . . . . . . . . . . . . . 368<br />
Urinstatus . . . . . . . . . . . . . . . . . . . . . . . . . . . . 368<br />
V<br />
Valproinsäure . . . . . . . . . . . . . . . . . . . . . . . . . 368<br />
Vanadium im Serum (U) . . . . . . . . . . . . . . . . . 369<br />
Vanadium im Urin (U) . . . . . . . . . . . . . . . . . . .369<br />
Vancomycin . . . . . . . . . . . . . . . . . . . . . . . . . . 369<br />
Vanillinmandelsäure im Urin . . . . . . . . . . . 369<br />
Varizella-Zoster Virus-DNA-Nachweis . . 370<br />
Varizella-Zoster-Virus-Antikörper (IgA) . 370<br />
Varizella-Zoster-Virus-Antikörper (IgG) . 370<br />
Varizella-Zoster-Virus-Antikörper (IgG,<br />
Liquor/Serum) . . . . . . . . . . . . . . 370<br />
Varizella-Zoster-Virus-Antikörper (IgM) . 371<br />
Varizella-Zoster-Virus-Serologie . . . . . . . . 371<br />
VDRL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 371<br />
Venlafaxin (W) . . . . . . . . . . . . . . . . . . . . . . . . . 371<br />
Verapamil (U) . . . . . . . . . . . . . . . . . . . . . . . . . . 372<br />
Verotoxin I <strong>und</strong> II-DNA-Nachweis . . . . . . 372<br />
Vigabatrin (W) . . . . . . . . . . . . . . . . . . . . . . . . . .372<br />
VIP (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 372<br />
Vitamin A . . . . . . . . . . . . . . . . . . . . . . . . . . . . 372<br />
Vitamin B1 . . . . . . . . . . . . . . . . . . . . . . . . . . . 373<br />
Vitamin B12 . . . . . . . . . . . . . . . . . . . . . . . . . . 373<br />
Vitamin B2 (FAD) (W) . . . . . . . . . . . . . . . . . . 373<br />
Vitamin B6 . . . . . . . . . . . . . . . . . . . . . . . . . . . 373<br />
Vitamin C (W) . . . . . . . . . . . . . . . . . . . . . . . . . . 374<br />
Vitamin D-Rezeptor-Polymorphismus (U) . 374<br />
Vitamin E . . . . . . . . . . . . . . . . . . . . . . . . . . . . 374<br />
Vitamin H (W) . . . . . . . . . . . . . . . . . . . . . . . . . .374<br />
Vitamin K (W) . . . . . . . . . . . . . . . . . . . . . . . . . .374<br />
Vitamin-D-Bindungsprotein (W)(N) . . . . . . . 375<br />
Von Willebrand Faktor (vWF) –<br />
Multimerenanalyse (W)(N) . . . . . 375<br />
von-Willebrand-Faktor-Antigen (U)(N) . . . . 375<br />
W<br />
Wismut im Blut (U)(N) . . . . . . . . . . . . . . . . . . .376<br />
Wismut im Urin (U)(N) . . . . . . . . . . . . . . . . . . 376<br />
X<br />
Xanthin (U)(N) . . . . . . . . . . . . . . . . . . . . . . . . . . 376<br />
Xylol im Blut (U)(N) . . . . . . . . . . . . . . . . . . . . .376<br />
Xylose im Blut (W) . . . . . . . . . . . . . . . . . . . . . 377<br />
Xylose im Urin (W) . . . . . . . . . . . . . . . . . . . . . 377<br />
Y<br />
Yersinien-Antikörper (IgA) . . . . . . . . . . . . . 377<br />
Yersinien-Antikörper (IgG) . . . . . . . . . . . . . 377<br />
Yersinien-Serologie. . . . . . . . . . . . . . . . . . . .377<br />
394 LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN
Z<br />
Zahnpathogene Keime, DNA-Nachweis . 378<br />
Zink im Blut (W) . . . . . . . . . . . . . . . . . . . . . . . 378<br />
Zink im Sperma (U) . . . . . . . . . . . . . . . . . . . . . 378<br />
Zink im Urin (W) . . . . . . . . . . . . . . . . . . . . . . . 378<br />
Zinkprotoporphyrin (W)(N) . . . . . . . . . . . . . . . 379<br />
Zinn im Serum (U) . . . . . . . . . . . . . . . . . . . . . . 379<br />
Zinn im Urin (U) . . . . . . . . . . . . . . . . . . . . . . . 379<br />
Ziprasidon (U) . . . . . . . . . . . . . . . . . . . . . . . . . .379<br />
Zirkulierende Immunkomplexe (W) . . . . . . . 379<br />
Zolpidem (U) . . . . . . . . . . . . . . . . . . . . . . . . . . .380<br />
Zonisamid (W) . . . . . . . . . . . . . . . . . . . . . . . . . 380<br />
Zopiclon (U) . . . . . . . . . . . . . . . . . . . . . . . . . . . 380<br />
Zotepin (U)(N) . . . . . . . . . . . . . . . . . . . . . . . . . . 380<br />
Zuclopenthixol (U) . . . . . . . . . . . . . . . . . . . . . .380<br />
Index<br />
LABOR MÜNSTER – DR. LÖER, DR. TREDER UND KOLLEGEN 395