1.5.1: 3-Bromcyclohexen
1.5.1: 3-Bromcyclohexen
1.5.1: 3-Bromcyclohexen
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
1. Substitutionsreaktionen www.ioc-praktikum.de<br />
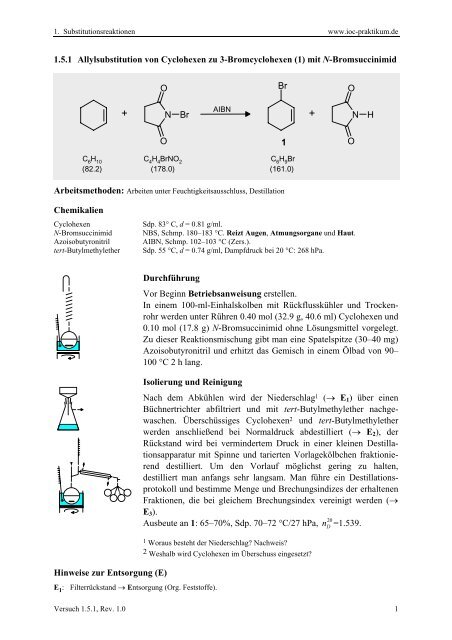
<strong>1.5.1</strong> Allylsubstitution von Cyclohexen zu 3-<strong>Bromcyclohexen</strong> (1) mit N-Bromsuccinimid<br />
C 6 H 10<br />
(82.2)<br />
+<br />
O<br />
O<br />
N Br<br />
C 4 H 4 BrNO 2<br />
(178.0)<br />
AIBN<br />
Versuch <strong>1.5.1</strong>, Rev. 1.0 1<br />
Br<br />
1<br />
C 6 H 9 Br<br />
(161.0)<br />
Arbeitsmethoden: Arbeiten unter Feuchtigkeitsausschluss, Destillation<br />
Chemikalien<br />
Cyclohexen Sdp. 83° C, d = 0.81 g/ml.<br />
N-Bromsuccinimid NBS, Schmp. 180–183 °C. Reizt Augen, Atmungsorgane und Haut.<br />
Azoisobutyronitril AIBN, Schmp. 102–103 °C (Zers.).<br />
tert-Butylmethylether Sdp. 55 °C, d = 0.74 g/ml, Dampfdruck bei 20 °C: 268 hPa.<br />
Hinweise zur Entsorgung (E)<br />
+<br />
O<br />
O<br />
N H<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einem 100-ml-Einhalskolben mit Rückflusskühler und Trockenrohr<br />
werden unter Rühren 0.40 mol (32.9 g, 40.6 ml) Cyclohexen und<br />
0.10 mol (17.8 g) N-Bromsuccinimid ohne Lösungsmittel vorgelegt.<br />
Zu dieser Reaktionsmischung gibt man eine Spatelspitze (30–40 mg)<br />
Azoisobutyronitril und erhitzt das Gemisch in einem Ölbad von 90–<br />
100 °C 2 h lang.<br />
Isolierung und Reinigung<br />
E 1 : Filterrückstand → Entsorgung (Org. Feststoffe).<br />
Nach dem Abkühlen wird der Niederschlag 1 (→ E1) über einen<br />
Büchnertrichter abfiltriert und mit tert-Butylmethylether nachgewaschen.<br />
Überschüssiges Cyclohexen 2 und tert-Butylmethylether<br />
werden anschließend bei Normaldruck abdestilliert (→ E2), der<br />
Rückstand wird bei vermindertem Druck in einer kleinen Destillationsapparatur<br />
mit Spinne und tarierten Vorlagekölbchen fraktionierend<br />
destilliert. Um den Vorlauf möglichst gering zu halten,<br />
destilliert man anfangs sehr langsam. Man führe ein Destillationsprotokoll<br />
und bestimme Menge und Brechungsindizes der erhaltenen<br />
Fraktionen, die bei gleichem Brechungsindex vereinigt werden (→<br />
E3).<br />
20<br />
Ausbeute an 1: 65–70%, Sdp. 70–72 °C/27 hPa, nD =1.539.<br />
1 Woraus besteht der Niederschlag? Nachweis?<br />
2 Weshalb wird Cyclohexen im Überschuss eingesetzt?
1. Substitutionsreaktionen www.ioc-praktikum.de<br />
E2 : Abdestilliertes Lösungsmittelgemisch → Entsorgung (RH).<br />
E3 : Destillationsrückstand und verunreinigte Fraktionen in wenig Aceton lösen → Entsorgung (RHal).<br />
Auswertung des Versuchs<br />
1<br />
H-NMR-Spektrum von 1 (300 MHz, CDCl3): δ = 1.60–1.75 (1 H), 1.84–2.32 (5 H), 4.84 (1 H), 5.81 (1 H),<br />
5.91 (1 H).<br />
7.0<br />
6.0 5.0<br />
4.0<br />
3.0 2.0 1.0 [ppm] 0.0<br />
13<br />
C-NMR-Spektrum (75.5 MHz, CDCl3) von 1: δ = 18.55 (CH2), 24.67 (CH2), 32.72 (CH2), 48.96 (CH),<br />
128.91 (CH), 131.05 (CH).<br />
140 120<br />
IR-Spektrum von 1 (Film):<br />
100<br />
T [%]<br />
50<br />
3030<br />
2943<br />
100 80<br />
60 40 20 [ppm] 0<br />
2835<br />
2870<br />
1640<br />
0<br />
4000 3000 2000 1500 1000 ν [cm -1 ~ ]<br />
* Formulieren Sie den zu 1 führenden Reaktionsmechanismus.<br />
Versuch <strong>1.5.1</strong>, Rev. 1.0 2
1. Substitutionsreaktionen www.ioc-praktikum.de<br />
Weitere denkbare Reaktionsprodukte:<br />
Br<br />
Br<br />
Br H<br />
H<br />
A B C<br />
D<br />
Br<br />
Br<br />
H<br />
H<br />
* Mit welchen spektroskopischen Daten und einfachen Versuchen lassen sich A – D ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen.<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
N-Bromsuccinimid eignet sich generell zur radikalischen Substitution allylischer und benzylischer Wasserstoffatome.<br />
In letzterem Fall hat sich zur Aktivierung sichtbares Licht am besten bewährt. [1,2]<br />
[1] Sh. Futamura, Z.-M. Zong, Bull. Chem. Soc. Jpn. 1992, 65, 345–348.<br />
[2] J.G. Traynham, Y.-S. Lee, J. Am. Chem. Soc. 1974, 96, 3590–3594.<br />
Versuch <strong>1.5.1</strong>, Rev. 1.0 3<br />
Br<br />
Br