BCG-medac Basisdokumentation - medac GmbH
BCG-medac Basisdokumentation - medac GmbH
BCG-medac Basisdokumentation - medac GmbH
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>BCG</strong>-<strong>medac</strong><br />
<strong>Basisdokumentation</strong><br />
Die nachhaltige Immuntherapie zur<br />
einfachen und sicheren Instillation.
Pharmazeutischer Unternehmer:<br />
Gesellschaft für klinische<br />
Spezialpräparate mbH<br />
Fehlandtstraße 3<br />
D-20354 Hamburg<br />
Stand der Information:<br />
November 2007
Inhaltsverzeichnis<br />
1 Produktbeschreibung . . . . . . . . . . . . . . . . . . . . . . . . . . 4<br />
1 .1 Zusammensetzung . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4<br />
1 .2 Anwendungsgebiete . . . . . . . . . . . . . . . . . . . . . . . . . . . 5<br />
1 .3 Gegenanzeigen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5<br />
1 .4 <strong>BCG</strong>-Therapie und ihre Nebenwirkungen . . . . . . . . . . . 6<br />
1 .4 .1 Nebenwirkungsspektrum der <strong>BCG</strong>-Therapie . . . . 6<br />
1 .4 .2 Einfluss von Ofloxacin auf die <strong>BCG</strong>-Nebenwirkungen 12<br />
1 .5 Wechselwirkungen mit anderen Medikamenten . . . . . . 13<br />
1 .5 .1 <strong>BCG</strong> und Antibiotika . . . . . . . . . . . . . . . . . . . . . 13<br />
1 .5 .2 <strong>BCG</strong> und Antikoagulantien . . . . . . . . . . . . . . . . 14<br />
1 .6 Warnhinweise . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15<br />
1 .7 Dosierung . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 17<br />
1 .8 Anwendung . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 17<br />
1 .8 .1 Applikationsanleitung . . . . . . . . . . . . . . . . . . . . 18<br />
1 .9 Sicherheitsaspekte bei der Verwendung von <strong>BCG</strong> . . . . 20<br />
1 .10 Verschreibungsstatus . . . . . . . . . . . . . . . . . . . . . . . . . 20<br />
2 Geschichte . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 20<br />
2 .1 Entwicklung von <strong>BCG</strong> als Impfstoff . . . . . . . . . . . . . . . 22<br />
2 .2 Krebstherapie mit <strong>BCG</strong> . . . . . . . . . . . . . . . . . . . . . . . . 22<br />
3 Wirkmechanismus . . . . . . . . . . . . . . . . . . . . . . . . . . . . 23<br />
3 .1 In-vitro Untersuchungen . . . . . . . . . . . . . . . . . . . . . . . 23<br />
3 .1 .1 zytotoxische Aktivität von <strong>BCG</strong> . . . . . . . . . . . . . 23<br />
3 .1 .2 Mechanismen der zellvermittelten Zytotoxizität . 25<br />
3 .1 .3 Vergleich verschiedener <strong>BCG</strong>-Stämme . . . . . . . 26<br />
3 .2 Untersuchungen am Menschen . . . . . . . . . . . . . . . . . . 27<br />
4 Klinische Daten . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 30<br />
4 .1 Therapieschemata . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31<br />
4 .1 .1 Zweiter Instillationszyklus bei Cis . . . . . . . . . . . . 31<br />
4 .1 .2 Erhaltungstherapie . . . . . . . . . . . . . . . . . . . . . . 32<br />
4 .1 .3 Dosisreduktion . . . . . . . . . . . . . . . . . . . . . . . . . 34<br />
4 .1 .4 Kombinationstherapien . . . . . . . . . . . . . . . . . . . 37<br />
4 .2 Therapie des Urothelkarzinoms . . . . . . . . . . . . . . . . . . 40<br />
4 .2 .1 Papilläres Urothelkarzinom . . . . . . . . . . . . . . . . 40<br />
4 .2 .2 Carcinoma in situ . . . . . . . . . . . . . . . . . . . . . . . 41<br />
4 .2 .3 pT1G3 Karzinom . . . . . . . . . . . . . . . . . . . . . . . . 45<br />
4 .2 .4 Tumorprogression unter <strong>BCG</strong>-Therapie . . . . . . . 49<br />
4 .3 Urotheltumoren spezieller Lokalisationen . . . . . . . . . . . 51<br />
4 .3 .1 Oberer Harntrakt . . . . . . . . . . . . . . . . . . . . . . . . 51<br />
4 .3 .2 Prostata . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52<br />
4 .3 .3 Distale Urethra . . . . . . . . . . . . . . . . . . . . . . . . . 53
5 Therapie von Risikogruppen . . . . . . . . . . . . . . . . . . . 53<br />
5 .1 <strong>BCG</strong>-Therapie bei immunsupprimierten Patienten . . . . 53<br />
5 .2 <strong>BCG</strong>-Therapie bei vorbestrahlten Patienten . . . . . . . . . 54<br />
5 .3 <strong>BCG</strong>-Therapie bei Reflux-Patienten . . . . . . . . . . . . . . . 54<br />
6 Vergleich mit anderen Therapeutika . . . . . . . . . . . 55<br />
6 .1 Vergleich mit anderen Immuntherapeutika . . . . . . . . . . 55<br />
6 .2 Vergleich mit Chemotherapeutika . . . . . . . . . . . . . . . . 56<br />
7 Ausblick . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 59<br />
8 Stichwortverzeichnis . . . . . . . . . . . . . . . . . . . . . . . . . 60<br />
9 Literaturverzeichnis . . . . . . . . . . . . . . . . . . . . . . . . . . 62
4<br />
1.0 Produktbeschreibung<br />
1.1 Zusammensetzung<br />
Trockensubstanz<br />
Oberes Ventil<br />
Unteres Ventil<br />
Abb. 1:<br />
<strong>BCG</strong>-<strong>medac</strong> „ready to use“<br />
Eine Durchstechflasche <strong>BCG</strong>-<strong>medac</strong> enthält mindestens 2 x 10 8<br />
und nicht mehr als 3 x 10 9 lebensfähige Einheiten von <strong>BCG</strong>(Bacil<br />
lus Calmette-Guérin)-Bakterien (Stamm RIVM abgeleitet von<br />
Stamm 1173-P2) .<br />
Hilfsstoffe<br />
Pulver: Polygeline, wasserfreie Glucose und Polysorbat 80 .<br />
Lösungsmittel: Natriumchlorid und Wasser für Injektions zwecke<br />
(s .Abb . 1) .<br />
Adapter<br />
Lösungsmittel<br />
Katheterkonus + Katheter
1.2 Anwendungsgebiete<br />
1.3 Gegenanzeigen<br />
Behandlung nicht-invasiver urothelialer Harnblasenkarzinome:<br />
• kurative Behandlung eines Carcinoma in situ<br />
• prophylaktische Behandlung zur Vermeidung eines erneuten<br />
Auftretens von urothelialen Karzinomen beschränkt auf die<br />
Schleimhaut:<br />
� Ta G1-G2 bei einem multifokalen Tumor und/oder Tumor rezidiv<br />
� Ta G3<br />
� urotheliale Karzinome in der Lamina propia aber nicht im<br />
Muskelgewebe der Blase (T1)<br />
� Carcinoma in situ<br />
• Überempfindlichkeit gegenüber dem arzneilich wirksamen<br />
Be standteil oder einem der Hilfsstoffe .<br />
• <strong>BCG</strong>-<strong>medac</strong> sollte nicht bei immunsupprimierten Patienten<br />
oder Personen mit einer angeborenen oder erworbenen<br />
Immunschwäche angewandt werden . Dabei ist es unerhelich, ob<br />
diese Beeinträchtigung durch eine gleichzeitige Er kran kung (z .B .<br />
positive HIV-Sero logie, Leu kämie, Lymp hom), Krebs therapie<br />
(z .B . Zytostatika, Be strahlung) oder eine im mun suppressive<br />
Therapie (z .B . Kortiko stero ide) erworben wurde .<br />
• Patienten mit aktiver Tuberkulose sollte <strong>BCG</strong> nicht verabreicht<br />
werden . Eine ak tive Tuberkulose sollte vor Beginn einer<br />
Be handlung mit <strong>BCG</strong>-<strong>medac</strong> bei Personen ausgeschlossen<br />
werden, die einen positiven Hauttest auf Tuberkulin zeigten .<br />
• <strong>BCG</strong>-<strong>medac</strong> darf nicht verabreicht werden, wenn eine Radiotherapie<br />
der Blase in der Vorgeschichte durchgeführt wurde .<br />
• <strong>BCG</strong>-<strong>medac</strong> soll nicht während Schwangerschaft und Stillzeit<br />
verwendet werden .<br />
• Positive HIV-Serologie .<br />
• <strong>BCG</strong>-<strong>medac</strong> sollte erst 15-21 Tage nach einer TUR, einer<br />
Blasenbiopsie oder einer traumatischen Katheterisierung<br />
in stilliert werden .<br />
• Ein vesikoureteraler oder vesikorenaler Reflux stellt keine Kontraindikation<br />
dar, da sich gezeigt hat, dass keine zusätzlichen<br />
Komplikationen bei Patienten mit Reflux auftreten .<br />
5
6<br />
1.4 <strong>BCG</strong>-Therapie und ihre Nebenwirkungen<br />
Die Nebenwirkungen der intravesikalen <strong>BCG</strong>-Therapie sind überwiegend<br />
spontan reversibel oder symptomatisch behandelbar .<br />
60-80 % der Patienten berichten über lokale, meist zystitische<br />
Beschwerden (Lamm, 1992b; Brosman, 1992, Böhle & Jocham,<br />
2000) . Hier ist insbesondere eine sorgfältige Auf klärung des<br />
Patienten erforderlich, wobei dem Patienten vermittelt werden<br />
sollte, dass eine Zystitis therapeutisch induziert wird, somit die<br />
auftretenden Beschwerden zu erwarten sind und ein Hinweis auf<br />
die eintretende immunologische Reaktion gegen den Tumor sind .<br />
Die Beschwerden werden vom Patien ten nach entsprechender<br />
Aufklärung meist gut toleriert (Böhle & Jocham, 2000) . Die auftretenden<br />
Beschwerden können meistens erfolgreich symptomatisch<br />
therapiert werden .<br />
1.4.1 Nebenwirkungsspektrum der <strong>BCG</strong>-Therapie<br />
Mit unerwünschten Wirkungen ist häufig zu rechnen . In der Regel<br />
sind die beobachteten Symptome mild und vorübergehend . Die<br />
unerwünschten Wirkungen können im Verlauf der Therapie zunehmen<br />
.<br />
Nebenwirkungen können in lokale und systemische Neben wirkungen<br />
unterteilt werden .<br />
Lokale Nebenwirkungen<br />
Dysurie und häufiges Harnlassen treten in bis zu 90 % der Fälle auf .<br />
Makrohämaturie tritt in 0,4 % auf . Es wird angenommen, dass die<br />
arzneimittelinduzierte Zystitis für die Antitumor wirkung von <strong>BCG</strong><br />
nötig ist . Eine Therapie ist selten erforderlich; die Symptome lassen<br />
normalerweise 48 h nach der Instillation nach . Wenn eine schwere<br />
Arzneimittel-induzierte Zystitis länger anhält, sollte mit Isoniazid<br />
(INH) 300 mg täglich behandelt werden, bis die Symptome nachlassen<br />
. Analgetika und Spasmo lytika können verwendet werden .
Systemische Nebenwirkungen<br />
Systemische <strong>BCG</strong>-Nebenwirkungen werden charakterisiert<br />
durch Fieber über 39,5 °C über mindestens 12 Stunden, Fieber<br />
über 38,5 °C über 48 Stunden, miliare Pneumonie, granulomatöse<br />
Hepatitis, Abweichungen im Leberfunktionstest, or ga ni sche<br />
Dysfunktion (außer Urogenitaltrakt) mit Granu lomen in der Biopsie .<br />
Das Risiko einer schweren <strong>BCG</strong>- Infektion sollte vor Beginn der<br />
Therapie bedacht werden .<br />
Eine traumatische Instillation kann <strong>BCG</strong>-bedingte, septische<br />
Ereignisse mit möglichem septischen Schock und potenziell fatalen<br />
Folgen auslösen .<br />
Eine bakterielle Infektion des Harntraktes sollte vor jeder Instillation<br />
von <strong>BCG</strong> ausgeschlossen werden . Eine Entzündung der<br />
Blasenschleimhaut kann das Risiko einer hämatologischen Dissemination<br />
erhöhen .<br />
Wenn eine Infektion des Harntrakts während einer <strong>BCG</strong>-Therapie<br />
diagnostiziert wird, sollte die Therapie unterbrochen werden, bis<br />
sich der Urinbefund normalisiert hat und eine antibiotische Therapie<br />
abgeschlossen wurde .<br />
Eine Infektion von Implantaten und Organersatz wurde bei Patienten<br />
mit z .B . Aneurysma oder Prothesen beobachtet (Böhle & Jocham<br />
2000; Gonzales et al ., 2003) .<br />
Symptome einer generalisierten <strong>BCG</strong>-Infektion sind:<br />
• Symptomatische granulomatöse Prostatitis .<br />
• Hepatitis und Pneumonitis (0,8 % der Fälle) .<br />
• Orchitis und Epididymitis (0,8 % der Fälle) .<br />
• Arthritis<br />
• Nephritis<br />
• Sepsis<br />
Allergische Reaktionen wie:<br />
• Hautrötung<br />
• Arthralgie<br />
• Arthritis<br />
können gelegentlich beobachtet werden . Manchmal ist es nötig,<br />
<strong>BCG</strong> in diesen Fällen abzusetzen .<br />
Anwendung von Urin-Antiseptika oder Antibiotika gleichzeitig mit<br />
der <strong>BCG</strong>-Instillation kann zu Interaktionen mit <strong>BCG</strong> führen und ist<br />
deshalb nicht angeraten .<br />
7
8<br />
Tab. 1:<br />
Häufigkeit der Nebenwirkungen<br />
unter <strong>BCG</strong>-Therapie<br />
In Tab . 1 werden die Nebenwirkungen einer <strong>BCG</strong>-Therapie<br />
zusammengefasst .<br />
Häufigkeit Unerwünschte Wirkungen<br />
Sehr häufig (>1/10) Gastrointestinaltrakt: Übelkeit<br />
Nieren und ableitende Harnwege: Zystitis und<br />
entzündliche Reaktionen (Granulomata) der Blase, er -<br />
höhte Miktionsfrequenz mit Schmerzen und Unwohlsein<br />
Genitaltrakt: Asymptomatische granulomatöse<br />
Prostatitis<br />
Allgemeinsymptome: Fieber < 38 .5°C, grippeähnliche<br />
Symptome (Unwohlsein, Fieber, Schüttelfrost),<br />
allgemeines Unwohlsein<br />
Häufig<br />
(>1/100, 38 .5°C<br />
Gelegentlich Blutsystem: Zytopenie, Anämie<br />
(>1/1 .000, 1/10 .000, Gefäßsystem: Gefäßinfektionen (z . B . infiziertes<br />
Tab. 2:<br />
Nebenwirkungen der <strong>BCG</strong>-<br />
Therapie bezogen auf<br />
die jeweils angewendeten<br />
<strong>BCG</strong>-Stämme<br />
Abb. 2:<br />
Auftreten von Dysurie<br />
während der 6-wöchigen<br />
<strong>BCG</strong>-Initialtherapie (Pfeile<br />
zeigen die Instillationstage)<br />
(nach Böhle & Jocham 2000)<br />
Eine Zystitis kommt nach der zweiten oder dritten Instillation vor,<br />
dauert 1 oder 2 Tage und nimmt an Intensität mit dem Fortschreiten<br />
der Therapie zu (Lamm et al ., 1986) .<br />
Ein weiteres generelles Symptom der <strong>BCG</strong>-Therapie ist das leichte<br />
Ansteigen der Körpertemperatur 3-4 h nach Instillation . Fieber von<br />
über 39,5°C kann bei 2,9 % der Patienten vorkommen (Lamm et<br />
al ., 1986) . Die Körpertemperatur normalisiert sich innerhalb 48 h<br />
und benötigt in der Regel keine weitere Behandlung .<br />
Bei 2 % der <strong>BCG</strong>-behandelten Patienten ist ein Krankenhausaufenthalt<br />
notwendig . Eine Zusammenfassung der Nebenwirkungen<br />
der verschiedenen <strong>BCG</strong>-Stämme zeigt folgende Tabelle, die<br />
nach einem Review von Lamm et al . (1989) mit insgesamt 2251<br />
Patienten zusammengestellt wurde (s . Tab . 2):<br />
Nebenwirkungen (%)<br />
Armand-Frappier Connaught Pasteur RIVM Tice Gesamt<br />
(718 Pat .) (353 Pat .) (325 Pat .) (129 Pat .) (726 Pat .) n %<br />
Fieber 3,8 4,7 0,6 2,1 4,7 75 2,9<br />
Granulom . Prostatitis . 1,8 0,2 0,6 0,0 1,0 23 0,9<br />
Pneumonie/Hepatitis 0,4 0,6 1,2 0,8 0,8 18 0,7<br />
Arthralgie 0,7 0,6 1,8 0,0 0,1 12 0,5<br />
Haematurie 0,3 2,4 1,0 0,4 0,6 24 1,0<br />
Hautausschlag 0,4 0,9 0,0 0,0 0,0 8 0,3<br />
Ureter Obstruktion 0,6 0,2 0,0 0,0 0,4 8 0,3<br />
Epididymitis 0,4 0,2 1,2 0,8 0,0 10 0,4<br />
Schrumpfblase 0,0 0,2 0,6 0,0 0,3 6 0,2<br />
Nieren-Abszess 0,0 0,4 0,0 0,0 0,0 2 0,1<br />
Sepsis 0,1 0,9 0,2 0,0 0,4 10 0,4<br />
Zytopenie 0,0 0,0 0,0 0,0 0,3 2 0,1<br />
Böhle et al . haben 1997 insgesamt 700 Patienten mit Fragenbögen<br />
zu den Ne benwirkungen der <strong>BCG</strong>-Behandlung untersucht .<br />
Bereits nach der ersten Instillation zeigten 50 % der Patienten<br />
Dysurie-Symptome . Diese Symptome wurden dann bei bis zu<br />
80 % der Patienten während der nachfolgenden Instillationen beobachtet<br />
(s . Abb . 2) .<br />
Patienten (%)<br />
9
10<br />
Abb. 3:<br />
Auftreten von Hämaturie<br />
während der <strong>BCG</strong>-Therapie.<br />
(Pfeile zeigen die Instillationstage)<br />
(nach Böhle &<br />
Jocham 2000)<br />
Abb. 4:<br />
Darstellung der subjektiven<br />
Empfindung von<br />
Nebenwirkungen bei der <strong>BCG</strong>-<br />
Therapie (Pfeile zeigen die<br />
Instillationstage) (nach Böhle &<br />
Jocham 2000)<br />
Die Miktionsfrequenz war sowohl am Tag als auch in der Nacht nach<br />
der <strong>BCG</strong>-Instillation erhöht (tagsüber 10x, nachts 3x) . Während der<br />
nachfolgenden Tage hat dieser Wert signifikant abgenommen . Die<br />
Miktionsfrequenz erhöhte sich allerdings nur in der letzten Woche<br />
des 6-wöchigen <strong>BCG</strong>-Instillationszyklus .<br />
Eine Hämaturie wurde interessanterweise bei 40 % der Pati en ten<br />
zwischen dem 2 . und 6 . Instillationstag beobachtet (s . Abb . 3):<br />
Patienten (%)<br />
Den Patienten wurden u . a . Fragen über das Gesamtauftreten<br />
von Nebenwirkungen gestellt . Die Patienten konnten die Nebenwirkungen<br />
in 4 Stufen einteilen d . h . von leicht bis unerträglich . In<br />
dieser Untersuchung haben die Patienten die Nebenwirkungen der<br />
<strong>BCG</strong>-Therapie zwischen leicht und moderat eingestuft (s . Abb . 4) .<br />
Über den Zusammenhang zwischen Nebenwirkungen und Erfolg<br />
der <strong>BCG</strong>-Therapie gibt es kontroverse Berichte .<br />
Lüftenberger et al . untersuchten insgesamt 154 Patienten mit<br />
high risk oder rezidivierendem nicht muskelinvasivem Harnblasenkarzinom<br />
(HBCA), die 6 <strong>BCG</strong>-Instillationen bekamen . Davon<br />
zeigten 107 kein Fieber (< 37,5 °C) und 47 Fieber >37,5 °C .<br />
51 von 107 Patienten (48 %), die kein Fieber zeigten, beka-
men Rezidive . Im Vergleich dazu zeigten nur 14 von 47 (30 %)<br />
der Patienten mit Fieber nach der <strong>BCG</strong>-Instillation Rezidive .<br />
Die Differenz ist signifikant (p=0,039) . Von den 47 Patienten mit<br />
Fieber zeigten 27 (57 %) einen positiven PPD-Test, wobei nur<br />
40 (37 %) der 107 Patienten ohne Fieber einen positiven PPD-<br />
Test aufwiesen (p=0 .021) . Von diesen 154 Patienten wurden<br />
24 mit einem zweiten <strong>BCG</strong>-Instillationszyklus behandelt, nachdem<br />
die Rezidivtumore per TUR entfernt wurden . Eine muskelinvasive<br />
Tumorprogression fand sich bei 12/154 Patienten (8 %) .<br />
8 dieser 12 Patienten wurden radikal zystektomiert, 3 starben aufgrund<br />
von Metastasen und ein Patient starb aufgrund einer kardiovaskulären<br />
Erkrankung (Lüftenberger et al ., 1996) .<br />
Die Gruppe von Sylvester et al . (2003) untersuchte 520 Pati en ten<br />
in einer groß angelegten randomisierten Studie die Abhän gigkeit<br />
der Therapieeffizienz von den <strong>BCG</strong>-Neben wirkun gen .<br />
87 von insgesamt 520 Patienten (16,7 %) verzögerten oder unterbrachen<br />
die Therapie, 40 davon (7,7 %) wegen lokaler Toxizität,<br />
23 (4,4 %) davon wegen systemischer Neben wirkun gen und 24<br />
(4,6 %) aufgrund beider Ursachen .<br />
Die These, dass Patienten mit <strong>BCG</strong>-Toxizität ein besseres<br />
Therapieergebnis zeigen, konnte bei dieser Studie nicht bestätigt<br />
werden .<br />
Tab . 3 zeigt die Behandlung von Symptomen und Syndromen, die<br />
unter einer <strong>BCG</strong>-Therapie auftreten können .<br />
Behandlung von Sympomen und Sydromen<br />
Symptom oder Syndrom Behandlung<br />
Symptome einer Symptomatische Behandlung<br />
Blasenirritation < 48 h<br />
Symptome einer Unterbrechung der <strong>BCG</strong>-Behandlung . Quinolone<br />
Blasenirritation > 48 h sollten verabreicht werden . Falls nach 10 Tagen<br />
kein kompletter Rückgang der Symptomatik:<br />
Gabe von Isoniazid (INH) für 3 Monate .<br />
Falls eine tuberkulostatische Therapie eingeleitet<br />
wurde: Abbruch der <strong>BCG</strong>-Behandlung .<br />
Bakterielle Aussetzen der <strong>BCG</strong>-Therapie bis zur<br />
Harnweginfektion Normalisierung des Urinbefundes und beendeter<br />
antibiotischer Therapie .<br />
Andere unerwünschte Effekte Unterbrechung der <strong>BCG</strong>-Behandlung . Gabe von<br />
im Urogenitaltrakt: Isoniazid (INH) und Rifampicin für 3 bis 6 Monate .<br />
symptomatische granuloma-<br />
töse Prostatitis, Epididymitis Falls eine tuberkulostatische Therapie eingeleitet<br />
und Orchitis, Harnstauung wurde: Abbruch der <strong>BCG</strong>-Behandlung .<br />
und Nierenabszess<br />
Fieber < 38,5 °C für < 48 h Symptomatische Behandlung mit Paracetamol .<br />
Fortsetzung nächste Seite<br />
11
12<br />
Tab. 3:<br />
Behandlung von Symptomen/<br />
Syndromen<br />
Symptom oder Syndrom Behandlung<br />
Hautausschläge, Unterbrechung der <strong>BCG</strong>-Behandlung .<br />
Arthralgie oder Arthritis Behandlung mit Antihistaminika oder nichtoder<br />
Reiter-Syndrom steroidalen anti-inflammatorischen Medikamenten .<br />
Falls kein Rückgang der Symptome:<br />
Gabe von Isoniazid für 3 Monate .<br />
Falls eine tuberkulostatische Therapie eingeleitet<br />
wurde: Abbruch der <strong>BCG</strong>-Behandlung .<br />
Systemische <strong>BCG</strong>-Reaktion Abbruch der <strong>BCG</strong>-Behandlung .<br />
ohne Zeichen eines Dreifachtherapie mit Tuberkulostatika<br />
septischen Schocks über 6 Monate .<br />
Evtl . Konsultation eines Spezialisten für<br />
Infektionskrankheiten .<br />
Systemische <strong>BCG</strong> Reaktion Abbruch der <strong>BCG</strong>-Behandlung .<br />
mit Zeichen eines Sofortige Dreifachtherapie mit Tuberkulostatika<br />
septischen Schocks kombiniert mit Hochdosistherapie<br />
schnell wirksamer Kortikoide .<br />
Konsultation eines Spezialisten für<br />
Infektionskrankheiten .<br />
1.4.2 Einfluss von Ofloxacin auf die <strong>BCG</strong>-Nebenwirkungen<br />
Die Arbeitsgruppe von Rischmann (Colombel et al . 2006 und<br />
Rischmann et al . 2007) veröffentlichte die Ergebnisse einer randomisierten,<br />
prospektiven, doppelblinden und placebokontrollierten<br />
Studie, die den Einfluss von Ofloxacin auf <strong>BCG</strong>-induzierten<br />
Nebenwirkungen untersuchte .<br />
Es wurden 115 Patienten in zwei Gruppen randomisiert und entweder<br />
mit <strong>BCG</strong> plus Ofloxacin (Gruppe 1, N=57) oder nur mit <strong>BCG</strong><br />
(Gruppe 2, N=58) behandelt . Beide Gruppen wurden mit <strong>BCG</strong> 6x<br />
plus 3x instilliert . Die Gruppe 1 bekam 200mg Ofloxacin 6 h und<br />
12 h nach der <strong>BCG</strong>-Instillation .<br />
Bei einem follow up von 24 Monaten ist bei der Gruppe 1 das<br />
Auftreten von Nebenwirkungen der Klassen II und III signifikant<br />
reduziert worden, nicht aber die Nebenwirkungen der Klasse I .<br />
Bei der Gruppe 1 haben 80,7% der Patienten alle 9 Instillationen<br />
bekommen verglichen zu 65,5% der Patienten der Gruppe 2 .<br />
Nach 24 Monaten lag die Rezidivrate in der Gruppe 1 und 2 entsprechend<br />
bei 15,8% und 22,4% und die Progressionsrate bei<br />
8,8% und 3,4% .<br />
Die Autoren empfehlen eine längere Nachbeobachtungszeit und<br />
weitere Studien, um diese Ergebnisse verifizieren zu können .
1.5 Wechselwirkungen mit anderen Medikamenten<br />
1.5.1 <strong>BCG</strong> und Antibiotika<br />
Tab. 4:<br />
<strong>BCG</strong> und Antibiotika.<br />
Systemische und<br />
lokale Wirkung<br />
(nach Durek et al., 1999)<br />
In der Praxis werden moderne Antibiotika wie Fluorochinolone und<br />
Cephalosporine der 3 . Generation zur Prophylaxe und Therapie<br />
von Harntrakt-Infektionen eingesetzt .<br />
In älteren Publikationen wird <strong>BCG</strong> als empfindlich gegenüber<br />
den meisten Tuberkulostatika (Ausnahme Pyrazinamid) dargestellt,<br />
wobei keine Unterschiede zwischen den verschiedenen<br />
<strong>BCG</strong>-Stämmen festgestellt wurden (van der Meijden et al ., 1991) .<br />
Interessanterweise zeigen klinische Studien, dass Isonia zid prophylaktisch<br />
gegeben keine Reduktion der <strong>BCG</strong>-Wirkung verursacht<br />
(Vegt et al .,1997; Durek et al ., 1999) .<br />
Es sollten nur Antibiotika verwendet werden, die keinen Einfluss<br />
auf die Wirkung von <strong>BCG</strong> haben (Böhle & Jocham, 2000) . Tab . 4<br />
zeigt die Aufteilung der antibiotischen Substanzen, gegen die <strong>BCG</strong><br />
sensibel oder resistent ist .<br />
SySteMIScH<br />
Sensibel Resistent<br />
Tuberkulostatika Pyrazinamid<br />
Chinolone = Gyrasehemmer Cycloserin<br />
(Aminoglykoside) Penicilline<br />
Cephalosporine<br />
Tetracycline<br />
Cotrim<br />
LokAL / BLASe<br />
Sensibel Resistent<br />
Tuberkulostatika Cotrim<br />
Aminoglykoside Nitrofurantoin<br />
ß-Lactame<br />
Cephalosporine<br />
Chinolone = Gyrasehemmer<br />
Tetracycline<br />
(Makrolide)<br />
13
14<br />
1.5.2 <strong>BCG</strong> und Antikoagulantien<br />
Hudson et al ., untersuchten 1991 den Einfluss gerinnungshemmender<br />
Medikamente auf die <strong>BCG</strong>-Therapie . Im Tierversuch<br />
zeigte sich, dass eine Stabilisierung des Fibrinkoagels zu einer<br />
Verstärkung der Adhäsion und des Antitumoreffektes führte .<br />
Medikamente, die mit der Blutgerinnung interferierten, führten zu<br />
einer verringerten Retention von <strong>BCG</strong> in der Mausblase (Hudson<br />
et al ., 1991a) .<br />
In einer retrospektiven klinischen Untersuchung wurde diese<br />
Hypothese an 149 auswertbaren Patienten untersucht (Hudson<br />
et al ., 1991b) . Während 48 % der Patienten, welche Gerin nungsinhibitoren<br />
einnahmen, tumorfrei blieben, zeigten 67 % der<br />
Patienten ohne eine derartige Medikation ein Ansprechen der<br />
Tumoren (p=0,0655) (Hudson et al ., 1991b) .<br />
Andere Ergebnisse zeigten Untersuchungen von Witjes et al .<br />
1993 . Es wurden insgesamt 183 Patienten mit oberflächlichem<br />
Harnblasenkarzinom untersucht und keine signifikanten Unterschiede<br />
zwischen der <strong>BCG</strong>+Antikoagulantien-Gruppe und der<br />
<strong>BCG</strong>-Gruppe gefunden . 13 von 42 (31%) der Patienten, die<br />
zusätzlich Antikoagulantien einnahmen, zeigten Rezidive, verglichen<br />
mit 56 von 141 (40 %), die keine solchen Medikamente<br />
bekamen (p=0,92) .<br />
Eine Erklärung für die Ergebnisse von Hudson et al . könnte die<br />
antiphlogistische Wirkung von Aspirin-ähnlichen Substanzen sein,<br />
die den entzündungsauslösenden Effekt von <strong>BCG</strong> inhibieren können<br />
(Witjes et al ., 1993) . Letzterer ist nötig für die Anti tumorwirkung<br />
von <strong>BCG</strong> (Lüftenegger et al ., 1996) .<br />
See & Williams haben 1992 das Anhaften an das Urothel als<br />
ein Resultat von Urothelverletzung und Aktivierung der Gerinnungskaskade<br />
beschrieben . Sie konnten demonstrieren, dass<br />
sowohl die Tumorzell- als auch die <strong>BCG</strong>-Anhaftung durch das<br />
Ausmaß der Urothel-Verletzung bestimmt wird . Tumorzell-Anhaftung<br />
und -Implantation kann durch die Gabe von Heparin verhindert<br />
werden (See & Chapman, 1987, Witjes et al ., 1993) .<br />
In einer unversehrten Blase ist die Oberfläche neutral beladen, da<br />
sie von einer neutral beladenen hydrophilen Glykosamino glykan<br />
Schicht bedeckt ist . In einer verletzten Blase ist die epitheliale<br />
Integrität unterbrochen und die Gerinnungskaskade aktiviert (Witjes<br />
et al ., 1993) .<br />
Der Einfluss von Antikoagulantien könnte der gleiche für die Haftung<br />
sowohl von Tumorzellen als auch von <strong>BCG</strong> an das verletzte Urothel<br />
sein . Das bedeutet: Eine erniedrigte Tumorzell-Anhaftung kann zu<br />
einer niedrigeren Rezidivrate führen, während eine gestörte <strong>BCG</strong>-<br />
Anhaftung zu einer Erhöhung der Rezidivrate führen kann . Daher<br />
ist es sehr schwierig, den Einfluss von Antikoagulantien vorherzusehen<br />
.
1.6 Warnhinweise<br />
Die Anhaftung von Tumorzellen an das verletzte Urothel variiert<br />
außerdem sehr zwischen in vivo- und in vitro-Untersuchun gen .<br />
Hudson et al . haben Patienten mit Rezidiv- und multifokalen<br />
Tumoren untersucht, während Witjes et al . nur Patienten mit primären<br />
und monofokalen Tumoren hatten . Es könnte daher auch<br />
sein, dass bei High-risk-Tumoren der Einfluss von Anti koagulantien<br />
stärker ist als bei Low-risk-Tumoren (Witjes et al ., 1993) .<br />
<strong>BCG</strong>-<strong>medac</strong> darf nicht subkutan, intradermal, intramuskulär, in travenös<br />
oder zur Impfung gegen Tuberkulose verabreicht werden .<br />
TUR, Blasenbiopsie, traumatische Katheterisierung<br />
<strong>BCG</strong>-<strong>medac</strong> sollte erst 15 – 21 Tage nach einer TUR, einer<br />
Blasenbiopsie oder einer traumatischen Katheterisierung instilliert<br />
werden .<br />
Symptome, Symptomenkomplexe und deren Behandlung<br />
siehe Abschnitt 4 .8 .<br />
Anzahl der <strong>BCG</strong>-Instillationen<br />
Nebenwirkungen einer Behandlung mit <strong>BCG</strong>-<strong>medac</strong> sind häufig,<br />
aber im Allgemeinen leicht und vorübergehend . Sie nehmen mit<br />
der Anzahl der Instillationen zu .<br />
Systemische <strong>BCG</strong>-Infektion/Reaktion<br />
Über systemische <strong>BCG</strong>-Reaktionen wurde selten berichtet .<br />
Sie werden charakterisiert durch Fieber über 39,5 °C über mindestens<br />
12 Stunden, Fieber über 38,5 °C über mindestens 48<br />
Stunden, miliare Pneumonie, granulomatöse Hepatitis, Abweichungen<br />
im Leberfunktionstest, organische Dysfunktion (außer im<br />
Urogenitaltrakt) mit Granulomen in der Biopsie .<br />
Die Möglichkeit einer schweren <strong>BCG</strong>-Infektion sollte vor Beginn<br />
der Therapie bedacht werden .<br />
Eine traumatische Instillation kann <strong>BCG</strong>-bedingte septische<br />
Ereignisse mit möglichem septischem Schock und potenziell<br />
fatalen Folgen fördern .<br />
Eine Infektion des Harntraktes sollte vor jeder Blaseninstillation<br />
von <strong>BCG</strong>-<strong>medac</strong> ausgeschlossen werden . Eine Entzündung<br />
der Blasenschleimhaut kann das Risiko einer hämatologischen<br />
Dissemination erhöhen . Wenn eine Infektion des Harntraktes während<br />
einer <strong>BCG</strong>-Therapie diagnostiziert wird, sollte die Therapie<br />
unterbrochen werden, bis sich der Urinbefund nor malisiert hat und<br />
eine antibiotische Therapie abgeschlossen wurde .<br />
Eine Infektion von Implantaten und Organersatz wurde bei<br />
Patienten mit z . B . Aneurysma oder Prothesen beobachtet .<br />
15
16<br />
Fieber oder Makrohämaturie<br />
Im Falle eines begleitenden Fiebers oder einer Makrohämaturie<br />
sollte die Behandlung bis zum Abklingen der Symptome verschoben<br />
werden .<br />
Niedrige Blasenkapazität<br />
Das Risiko einer Schrumpfblase kann bei Patienten mit einer niedrigen<br />
Blasenkapazität erhöht sein .<br />
HLA-B27<br />
Bei Patienten mit positivem HLA-B27 kann vermehrt eine reaktive<br />
Arthritis oder ein Reiter-Syndrom auftreten .<br />
Vorsichtsmaßnahmen für die Anwendung<br />
Der Umgang mit <strong>BCG</strong>-<strong>medac</strong> sollte weder im selben Raum noch<br />
durch dasselbe Personal erfolgen, das Zytostatika zur in tra venösen<br />
Anwendung vorbereitet . Das Präparat sollte nicht durch Personen<br />
mit einer bekannten Immunschwäche zubereitet werden .<br />
Patienten mit Immunschwäche<br />
Patienten mit einer bekannten Immunschwäche sollten den<br />
Kontakt mit Patienten vermeiden, die zeitgleich mit <strong>BCG</strong>-<strong>medac</strong><br />
behandelt werden .<br />
Hauttest auf Tuberkulin<br />
Die intravesikale Behandlung mit <strong>BCG</strong>-<strong>medac</strong> kann eine<br />
Empfindlichkeit gegenüber Tuberkulin bewirken und dadurch die<br />
nachfolgende Interpretation eines Hauttests auf Tuberkulin im<br />
Rahmen der Diagnose einer mycobakteriellen Infektion erschweren<br />
. Daher kann ein Test auf Tuberkulin vor einer An wendung von<br />
<strong>BCG</strong>-<strong>medac</strong> durchgeführt werden .<br />
Schwangerschaft<br />
Eine Behandlung mit <strong>BCG</strong>-<strong>medac</strong> während der Schwanger schaft<br />
wird nicht empfohlen .<br />
Sexuelle Übertragung<br />
Über eine sexuelle Übertragung von <strong>BCG</strong>-Bakterien wurde<br />
bisher nicht berichtet; es wird aber empfohlen, während des<br />
Geschlechtsverkehrs für eine Woche nach der <strong>BCG</strong>-Instillation ein<br />
Kondom zu benutzen .<br />
Verschütten von <strong>BCG</strong>-<strong>medac</strong><br />
Eine verschüttete <strong>BCG</strong>-Suspension muss mit einem De sin fek tionsmittel<br />
entfernt werden, das gegen gegen Mykobakterien wirkt .
1.7 Dosierung<br />
1.8 Anwendung<br />
Der Inhalt einer Durchstechflasche wird für eine Blasen instil la tion<br />
benötigt .<br />
<strong>BCG</strong>-<strong>medac</strong> sollte unter den gleichen Kautelen wie für eine intravesikale<br />
Endoskopie verabreicht werden .<br />
Der Patient sollte 4 Stunden vor und 2 Stunden nach der Instillation<br />
keine Flüssigkeit zu sich nehmen . Die Harnblase muss vor der <strong>BCG</strong>-<br />
Instillation entleert sein . <strong>BCG</strong>-<strong>medac</strong> wird mit Hilfe eines Einmal-<br />
Katheters und mit geringem Druck in die Blase instilliert . Die instillierte<br />
Suspension sollte für etwa 2 Stunden in der Blase verbleiben .<br />
Während dieser Zeit sollte die Suspension einen ausreichenden<br />
Kontakt mit der gesamten Schleimhautoberfläche haben . Es sollte<br />
daher darauf geachtet werden, dass der Patient so weit wie möglich<br />
mobil bleibt . Ein bettlägeriger Patient sollte jede Viertelstunde<br />
aus der Rückenlage in die Bauchlage wechseln und umgekehrt .<br />
Nachdem die Suspension 2 Stunden in der Harnblase geblieben<br />
ist, entleert der Patient sitzend die Blase .<br />
Sofern keine besondere medizinische Gegenanzeige besteht, wird<br />
eine Hyperhydratation des Patienten für 48 Stunden nach jeder<br />
Instillation empfohlen .<br />
<strong>BCG</strong>-<strong>medac</strong> sollte nicht bei Kindern angewendet werden, da<br />
Sicherheit und Wirksamkeit bisher in Studien nicht belegt wurden .<br />
Es gibt keine speziellen Hinweise für die Anwendung bei älteren<br />
Patienten .<br />
Vor der Verwendung muss das Präparat unter aseptischen<br />
Bedingungen mit steriler 0,9-prozentiger Natriumchloridlösung<br />
resuspendiert werden (siehe unten) . Die Suspension sollte vor<br />
Anwendung durch leichtes Drehen gemischt werden . Der Einsatz<br />
von Handschuhen wird empfohlen .<br />
Makroskopisch erkennbare Partikel haben keinen Einfluss auf die<br />
Wirksamkeit und Sicherheit des Präparates .<br />
17
18<br />
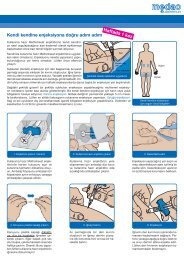
1.8.1 Applikationsanleitung<br />
1 . Schutzhülle aufreißen und<br />
nicht ganz entfalten! Die<br />
Spitze des Instillationssys-<br />
tems bleibt somit vor<br />
Keimen geschützt .<br />
2 . Die Abdeckkappen von der<br />
Durch stech flasche und vom<br />
Adapter des Instillations systems<br />
entfernen . Ent sorgungs beutel<br />
zurechtlegen .<br />
3 . Durchstechflasche fest in den<br />
Adapter des Instillationssystems<br />
drücken bis dieser einrastet und<br />
mindestens 1x komplett drehen .<br />
4 . Verbindung herstellen: Sollbruchstelle<br />
im Schlauchteil des Adapters durch<br />
Hin- und Herbiegen brechen .
6 . Durchstechflasche nicht abnehmen!<br />
Flasche nach oben halten und Luft<br />
einpumpen . Das gelöste Medikament<br />
so in das Instillationssystem pumpen .<br />
5 . Lösen: Einen Teil der Flüssigkeit in die<br />
Durchstechflasche pumpen .<br />
Wichtig: etwas Luft in der Flasche<br />
belassen . Medikament vorsichtig lösen,<br />
nicht schütteln! Da es sich um eine Sus-<br />
pension handelt, löst sich das Medika-<br />
ment erwartungsgemäß ungleichmäßig .<br />
7 . Die Schutzhülle vollständig entfernen . Katheter<br />
mit Instillationssystem verbinden .<br />
8 . Instillation: Erst jetzt Verschluss mecha nis mus<br />
im Schlauchteil aufbrechen und Lösung instillieren .<br />
Katheter mit Luft frei drücken . Instillationssystem<br />
zusammen gedrückt halten und mit dem Katheter<br />
in den Entsorgungs beutel geben . Als mikrobio-<br />
logischen Abfall behandeln .<br />
19
20<br />
1.9 Sicherheitsaspekte bei der Verwendung von <strong>BCG</strong>-<strong>medac</strong><br />
1.10 Verschreibungsstatus<br />
2.0 Geschichte<br />
Nach den derzeitigen Kenntnissen kann <strong>BCG</strong> nicht von Mensch zu<br />
Mensch übertragen werden und bei einer intravesikalen Applikation<br />
besteht keine Gefahr für den Anwender oder für dritte unbeteiligte<br />
Personen in der Umgebung .<br />
Desinfektionsmaßnahmen (mit mykobakterienwirksamen Desinfektionslösungen)<br />
sind erforderlich, wenn eine Ampulle oder ein<br />
Behälter mit <strong>BCG</strong> zerbricht oder aufreißt .<br />
<strong>BCG</strong> ist im Urin der Patienten nachweisbar, die Mengen an Bakterien<br />
sind allerdings so gering, dass keine Umwelt gefähr dung existiert<br />
(Böhle & Jocham, 2000) .<br />
Bei Nadelstichverletzungen mit <strong>BCG</strong> besteht die Möglichkeit einer<br />
ungewollten Immunisierung der betroffenen Person . Es hängt<br />
immer davon ab, wie hoch die injizierte <strong>BCG</strong>-Menge ist . Die<br />
Injektionsstelle sollte sorgfältig gewaschen und desinfiziert werden .<br />
Eine systemische Therapie mit Tuberkulostatika sollte nur dann<br />
erfolgen, wenn die lokalen Maßnahmen nicht gewirkt haben (INH<br />
für 3-6 Wochen) . Bei immunsupprimierten Perso nen sollte eine<br />
antituberkulöse Behandlung sofort erfolgen .<br />
Wenn Augen in Kontakt mit <strong>BCG</strong> kommen, sollte das betroffene<br />
Auge mit reichlich Wasser für mindestens 15 min gespült werden .<br />
Mit Kanamycin-haltigen Augentropfen sollte für mehrere Wochen<br />
behandelt werden (Böhle & Jocham, 2000) . Alternativ kämen auch<br />
Salben/Tropfen mit Gyrasehemmern in Frage .<br />
<strong>BCG</strong>-<strong>medac</strong> ist verschreibungspflichtig .<br />
Im Jahr 1904 isolierte A . Nocard Mycobacterium bovis aus einer<br />
Kuh mit Tuberkulose-Mastitis . Nach Isolierung im Labor zeigten die<br />
Reinkulturen von M. bovis eine starke Tendenz zur Verklumpung .<br />
Um die Adhäsion zu verhindern, gaben Calmette und Guérin 1908<br />
zum Nährmedium Rindergallenflüssigkeit hinzu .<br />
Auf diesem Nährboden verlor M. bovis langsam seine Virulenz<br />
und nach mehreren Passagen auf Kulturmedien wurde 1920<br />
dieses Isolat als avirulent erklärt . Es waren 231 Passagen über 13<br />
Jahre nötig, um dieses Stadium zu erreichen (Guérin, 1957) . Dieser<br />
spezielle M. bovis-Stamm wurde Calmette und Guérin zu ehren<br />
„Bacillus Calmette Guérin,“ kurz <strong>BCG</strong>, genannt (Crispen, 1989) (s .<br />
Tab . 5 & Abb . 5) .
Tab. 5:<br />
„Stammbaum“ von <strong>BCG</strong>:<br />
Internationale Verbreitung der<br />
<strong>BCG</strong>-Kulturen<br />
(nach Crispen, 1989)<br />
Abb. 5:<br />
Stammbaum der internationalen<br />
Verbreitung von <strong>BCG</strong>-<br />
Kulturen (nach Wittes 1993)<br />
1921 Institut Pasteur FRANKREICH<br />
1924 UdSSR<br />
� nach BULGARIEN 1958<br />
1924 BRASILIEN<br />
1924 NIEDERLANDE<br />
1925 JAPAN<br />
1926 RUMÄNIEN<br />
1926 SCHWEDEN<br />
� nach EKUADOR 1954<br />
� nach NORWEGEN 1966<br />
1930 BELGIEN<br />
1931 DÄNEMARK (Staatl . Serum-Institut)<br />
� in die TSCHECHOSLOWAKEI 1947<br />
� nach ÄGYPTEN 1954<br />
� nach GROSSBRITANNIEN 1952<br />
� in die SCHWEIZ 1959<br />
� nach JAPAN 1965<br />
� nach INDIEN 1967<br />
1934 USA (Chigago) 1937<br />
1937 KANADA (Quebec)<br />
1949 KANADA (Toronto)<br />
1948 USA (New York)<br />
� nach AUSTRALIEN 1951<br />
1957 TUNESIEN<br />
1963 SENEGAL<br />
1965 NIEDERLANDE<br />
1965 CHINA<br />
1966 KOREA<br />
Dänemark, 1931<br />
M. Bovis 1904<br />
Dauerkultur, 1908<br />
BcG-Lille, 1921<br />
RIVM, Holland 1921<br />
Glaxo, 1961 tIce, chicago 1934<br />
evans Merieux Montreal, 1937<br />
tokio, 1965 Pasteur Paris, 1961<br />
connaught, 1948 Frappier<br />
21
22<br />
2.1 Entwicklung von <strong>BCG</strong> als Impfstoff<br />
2.2 Krebstherapie mit <strong>BCG</strong><br />
1921 wurde zum ersten Mal der Stamm vom Institut Pasteur<br />
einem Neugeborenen intrakutan injiziert, dessen Mutter mit<br />
Tuberkulose erkrankt war und aus einer Familie stammt, wo mehrere<br />
Tuberkulosefälle registriert waren . Das Kind hat die Impfung<br />
gut vertragen und wuchs ohne tuberkulöse Infektion auf .<br />
Weitere Impfungen fanden in den folgenden Jahren statt und <strong>BCG</strong><br />
wurde somit weltweit als Impfstoff gegen die humane Tuberkulose<br />
verwendet . Zu diesem Zeitpunkt konnte <strong>BCG</strong> allerdings als<br />
Impfstoff nur aus einer Reinkultur gewonnen werden . Um eine<br />
weltweite Verbreitung zu gewährleisten, wurden verschiedene<br />
Stämme in verschiedenen Ländern etabliert (Crispen, 1989) .<br />
Heute wird <strong>BCG</strong> als Impfstoff in Konzentrationen von 800 .000 bis<br />
2 .300 .000 CFUs angeboten (Pasteur vaccins) .<br />
Holmgren et al . (1935) haben Patienten mit malignen Tumoren mit<br />
Tuberkulin und/oder <strong>BCG</strong> behandelt und haben über einige deutliche<br />
Tumorremissionen berichtet . Anderen Gruppen haben ebenfalls<br />
über die erfolgreiche Bekämpfung von Bronchialkarzinomen in<br />
fortgeschrittenen Stadien mit <strong>BCG</strong> berichtet (Hadziev & Kavaklieva-<br />
Dimitrova, 1969) . Klinische Untersuchungen von Mathé et al . 1969<br />
in Frankreich, die eine kombinierte Immuntherapie der akuten lymphatischen<br />
Leukämie mit <strong>BCG</strong> und Zytostatika durchführten, lieferten<br />
einen wichtigen Beitrag zur Immuntherapie von Tumoren mit<br />
<strong>BCG</strong> .<br />
Die anfänglich viel versprechenden Ergebnisse konnten aber in<br />
nachfolgenden Untersuchungen in den USA und Europa nicht<br />
bestätigt werden (Mathé et al . 1969a) .<br />
Morton et al ., 1970, beschrieb die Rückbildung von malignen<br />
Melanomen nach intraläsionaler <strong>BCG</strong>-Injektion . Diese Arbeit<br />
führte zu einer Zunahme der Untersuchungen mit mehreren <strong>BCG</strong>-<br />
Stämmen . Bei insgesamt 12 Studien bildeten sich nach intraläsionaler<br />
Injektion 72 von 125 (58 %) Melanomknoten zurück verglichen<br />
mit einer spontanen Rückbildung von 15 aus 110 (14 %) (Morton et<br />
al ., 1970; Morton, 1971; Morton et al . 1971; Krementz et al ., 1971) .<br />
Die besten Ergebnisse konnten bei Patienten mit Melanomen der<br />
Haut, des subkutanen Gewebes und der Lymphknoten gezeigt<br />
werden . Patienten mit Fernmetastasen sprachen auf die <strong>BCG</strong>-<br />
Therapie nicht an . Bei Patienten, welche tuberkulinpositiv geworden<br />
waren, bildeten sich bis zu 90 % der Melanomläsionen nach<br />
der <strong>BCG</strong>-Behandlung zurück, wohingegen bei tuberkulinnegativen<br />
Pa tien ten kein Ansprechen auf die <strong>BCG</strong>-Therapie beobachtet wurde<br />
(Smith et al ., 1973) .
3.0 Wirkmechanismus<br />
3.1 In-vitro Untersuchungen<br />
3.1.1 Zytotoxische Aktivität von <strong>BCG</strong><br />
Da sich jedoch trotz des lokalen Ansprechens bei dieser Erkrankung<br />
keine Lebensverlängerung erzielen ließ, verlor <strong>BCG</strong> weitgehend<br />
seinen Status als Standardtherapie in der Derma tologie .<br />
Im Gegensatz zur systemischen Therapie hat sich die lokale The-<br />
rapie mit <strong>BCG</strong> bei Blasenkarzinomen seit 1976 etabliert (Hrouda<br />
et al ., 1997) und ist heute in den einschlägigen Leitlinien zur<br />
Behandlung des oberfl . HBCA zu finden (Oosterlink et al ., 2002) .<br />
Nachdem die immunaktivierenden Eigenschaften von <strong>BCG</strong> entdeckt<br />
wurden, sind Untersuchungen zum Wirkmechanismus<br />
durchgeführt worden . Alle Untersuchungen ergaben bisher, dass<br />
nicht ein einziges Wirkprinzip, sondern eine Reihe immunologischer<br />
Prozesse involviert sind .<br />
Die Untersuchungen zum Wirkmechanismus von <strong>BCG</strong> weisen<br />
darauf hin, dass die Bindung von <strong>BCG</strong> an die Blasenwand und<br />
damit die Retention von <strong>BCG</strong> in der Blase Fibronectin-abhängig<br />
ist . Fibronectin befindet sich reichhaltig im suburothelialen Stroma<br />
und wird durch Elektrokauterisation des Urothels freigelegt .<br />
Weiterhin befindet es sich in Blutgerinnseln, so dass auch durch<br />
Mikrotraumata und hieraus resultierende kleinste Blutgerinnsel<br />
<strong>BCG</strong> retiniert werden kann (Böhle & Jocham, 2000) .<br />
Die Relevanz möglicher zytotoxischer Mechanismen für die<br />
Wirksamkeit von <strong>BCG</strong> wurde in In-vitro-Untersuchungen geklärt .<br />
Um die Frage zu klären, ob <strong>BCG</strong> ebenso wie ein Zytostatikum<br />
rein zytotoxisch wirkt, wurde die direkte zytotoxische Aktivität<br />
von <strong>BCG</strong> gegen Blasenkarzinomzellen untersucht (Hawkyard<br />
et al ., 1992; Thanhäuser et al ., 1993): Die Koinkubation ansteigender<br />
Konzentrationen von <strong>BCG</strong> mit den 4 Zielzelllinien und der<br />
Kontrollzelllinie zeigte keine signifikante Zytotoxizität . Es kann<br />
somit angenommen werden, dass unter den bekannten klinischen<br />
Bedingungen ein direkter zytotoxischer Effekt von <strong>BCG</strong> auf<br />
Blasenkarzinomzellen als Wirkprinzip nicht in Frage kommt .<br />
Um zu klären, inwieweit immunkompetente Zellen in der Lage<br />
sind, Urothelkarzinomzellen abzutöten, wurde die Zytotoxizität von<br />
natürlichen Killerzellen (NK-Zellen) untersucht (Wang et al ., 1991;<br />
Böhle et al ., 1991): Alle 5 untersuchten Urothelkarzinom-Zelllinien<br />
23
24<br />
waren gegenüber NK-Zellen nahezu resistent . Die zur Kontrolle<br />
mit untersuchte, bekanntermaßen NK-sensitive Leukämiezelllinie<br />
K562, wies im selben Experiment eine ausgeprägte Sensitivität auf .<br />
Auch Kurzzeitkulturen frisch resezierter papillärer Blasen kar zinome<br />
zeigten eine derartige Resistenz gegenüber nicht aktivierten<br />
Immunzellen (Schäfer et al ., 1995), was ein Hinweis für die<br />
Unfähigkeit des Immunsystems ist, ein einmal etabliertes Karzinom<br />
ohne ausreichende Stimulation zu bekämpfen . Auch unterstreicht<br />
dieser Befund die Wertigkeit der aus den Zelllinien gewonnenen<br />
Ergebnisse für die In-vivo-Situation beim Men schen .<br />
Immunzellen können durch Koinkubation mit IL-2 zu einer ausgeprägten,<br />
sog . Lymphokin-aktivierten Killerzell-Zytotoxizität<br />
(LAK-Zytotoxizität) stimuliert werden . Es wurde die Toxizität von<br />
LAK-Zellen gegen BCA-Zellen geprüft . Die Ergebnisse dieser<br />
Untersuchungen zeigten, dass eine ausgeprägte Zytotoxizität<br />
gegen BCA-Zellen und gegen frisch gewonnene Tumorzellen<br />
durch IL-2 und TNF induziert werden konnte (Wang et al ., 1991;<br />
Wang et al ., 1993) .<br />
Dieser Mechanismus kann somit als eines der möglichen<br />
Wirkprinzipien der intravesikalen Immuntherapie mit <strong>BCG</strong> angesehen<br />
werden .<br />
Nach Vorinkubation von Immunzellen mit <strong>BCG</strong> über mehrere Tage<br />
konnte eine erhebliche Zytotoxizität gegen mehrere BCA-Linien<br />
induziert werden . Diese <strong>BCG</strong>-induzierte Zytotoxizität wurde mit<br />
der LAK-Zell-Zytotoxizität verglichen und als BAK-Zellen (<strong>BCG</strong>-<br />
Aktivierte-Killerzellen) bezeichnet (Böhle et al ., 1998) . BAK-Zellen<br />
zeigten keine Zytotoxizität gegenüber normalen Urothelzellen . LAK-<br />
Zellen lysierten sowohl maligne als auch benigne Zielzellen auch in<br />
Anwesenheit von BCA-Zellen . Umgekehrt waren LAK-Zellen in der<br />
Lage, BCA-Zellen auch in Gegenwart normalen Urothels abzutöten<br />
(Böhle et al ., 1998) . Die LAK-Zellen zeigten eine etwas höhere<br />
Zytotoxizität gegen BCA-Zellen als BAK-Zellen . Beide Zelltypen<br />
wiesen jedoch ein deutlich höheres Ausmaß an Zytotoxizität auf<br />
als unstimulierte NK-Zellen, die weder maligne noch normale<br />
Urothelzellen allein oder in Kombination lysieren konnten (Böhle et<br />
al ., 1998; Thanhäuser et al ., 1993) .<br />
Die Zytotoxizität der LAK-Zellen weist ein Maximum nach 2-3<br />
Tagen Stimulation mit IL-2 auf (Coplen et al ., 1990), während die<br />
der BAK-Zellen bis zum 7 . Tag anstieg .<br />
Im Gegensatz zu BAK-Zellen ließen sich LAK-Zellen auch aus<br />
CD4 + - und CD8 + -depletierten Zellpopulationen generieren .<br />
Aufgrund dieser Tatsache kann geschlossen werden, dass BAK-<br />
Zellen eine andere Zellpopulation darstellen und anders als LAK-<br />
Zellen aktiviert werden (Böhle et al ., 1998) .<br />
Es konnte nachgewiesen werden, dass weder Makrophagen<br />
noch CD4 + -T-Zellen als Effektorzellen in Frage kommen, sondern<br />
T-Zellen, welche die CD3 -, CD8- und CD56-Antigene auf ihrer
Oberfläche exprimieren, verantwortlich für diese <strong>BCG</strong>-induzierte<br />
Zytotoxizität sind (Böhle et al ., 1998) .<br />
3.1.2 Mechanismen der zellvermittelten Zytotoxizität<br />
Nach Erkennung einer empfänglichen Zielzelle erfolgt deren<br />
Ab tötung . Für die Abtötung erkannter Zielzellen durch Effektorzellen<br />
stehen prinzipiell mehrere Möglichkeiten zur Verfügung:<br />
1 . Die Produktion und Freisetzung von Sauerstoff- oder Stickstoffmonoxidradikalen<br />
. Die Rolle dieser Moleküle bei der zytotoxischen<br />
Reaktion kann durch den Einsatz von NO-Synthetasehemmer L-<br />
N-Mono-Methyl Arginin (L-NMMA) überprüft werden . Es zeigte<br />
sich, dass die Hemmung der NO-Synthetasen keinen Einfluss<br />
auf die BAK-zell-vermittelte Zytotoxizität hatte . Die Radikalbildung<br />
konnte somit als zytotoxisches Prinzip ausgeschlossen werden<br />
(Böhle et al ., 1998) .<br />
2 . Die Interaktion von FAS Ligand (FASL) und CD95 (FAS; APO1)<br />
ist der einzige zytotoxische Mechanismus, der Kalzium-unabhängig<br />
abläuft . Entsprechende Experimente wurden unter<br />
Zugabe von EGTA, einem Kalzium-Chelator, durchgeführt .<br />
Die zytotoxische Reaktion der BAK-Zellen wurde deutlich ab<br />
ca . 2 mM reduziert . Im Gegensatz dazu war keine wesentliche<br />
Beeinflussung der Zytotoxizität von LAK-Zellen feststellbar<br />
(Böhle et al ., 1998) .<br />
3 . Als einziger zytotoxischer Mechanismus für BAK-Zellen blieb<br />
die kalziumabhängige, perforinvermittelte Lyse der BCA-<br />
Zellen . Perforin wird als Monomer in sauren Granula von<br />
zytotoxischen Effektorzellen eingelagert . Nach der Degranulation<br />
im Spalt zwischen Effektor und Zielzelle integrieren<br />
die Perforinmoleküle kalziumabhängig in die Zielmembran<br />
und bilden dort Poren . Hierdurch kann Zellinhalt austreten<br />
und führt zur Nekrose der Zielzellen . Bei neutralem pH jedoch<br />
lagern sich Perforinmonomere zu Oligomeren zusammen, die<br />
nun nicht mehr in die Zielmembran integrieren können . Zur<br />
Untersuchung der perforinvermittelten Zytotoxizität wurde<br />
Concanamycin A (CMA) eingesetzt . CMA inhibiert die ATPabhängigen<br />
Protonenpumpen, welche das saure Milieu der<br />
Granula von zytotoxischen Lymphozyten aufrechterhalten . Die<br />
BAK-Zytotoxizität sank unter der Einwirkung von CMA konzentrationsabhängig,<br />
die LAK-Zell-vermittelte Lyse der BCA-Zellen<br />
hingegen blieb unbeeinflusst . Hierdurch ist die perforininduzierte<br />
Nekrose als zytotoxischer Mechanis mus der BAK-Zellen als<br />
zugrunde liegender Mechanismus belegt (Böhle et al ., 1998) .<br />
25
26<br />
Die Ergebnisse der Zielzelltoxizität können wie folgt zusammengefasst<br />
werden:<br />
• Die Zytotoxizität von BAK-Zellen gegen maligne Urothel zellen<br />
ist perforinvermittelt .<br />
• Die Zytotoxizität von LAK-Zellen gegen maligne Urothel zellen<br />
ist FAS-vermittelt, gegen normale Urothelzellen hingegen perforinvermittelt<br />
.<br />
• NO und TNF spielen keine Rolle .<br />
3.1.3 Vergleich verschiedener <strong>BCG</strong>-Stämme<br />
Vegt et al . (1995) untersuchten 437 Patienten mit primären oberflächlichen<br />
Harnblasenkarzinomen . Sie verglichen die therapeutische<br />
Effektivität von zwei <strong>BCG</strong>-Stämmen (RIVM und Tice) und<br />
MMC . Während MMC und <strong>BCG</strong>-RIVM die gleiche therapeutische<br />
Effektivität besaßen, war zwischen MMC und <strong>BCG</strong>-Tice ein signifikanter<br />
Unterschied feststellbar . Der Anteil der rezidivfreien Patienten<br />
war unter MMC-Therapie nach drei und mehr Jahren deutlich höher<br />
als unter <strong>BCG</strong>-Tice (s . Abb . 6) .<br />
Abb. 6:<br />
Kaplan-Meier Kurve für<br />
Primärtumoren, Zeit in Jahren<br />
bis zum Rezidiv<br />
(nach Vegt et al., 1995)<br />
Die Unterschiede zwischen den <strong>BCG</strong>-Stämmen waren wenig auffälig<br />
bis auf eine Ausnahme: die Behandlung mit <strong>BCG</strong>-Tice erzeugte<br />
einen erheblich höheren Anteil systemischer Nebenwirkungen als<br />
<strong>BCG</strong>-RIVM (27,1 % Tice vs . 18,1 % RIVM) (Vegt et al ., 1995) .<br />
Mit einer standardisierten Methodik wurden immuntherapeutisch relevante<br />
Parameter von <strong>BCG</strong>-Stämmen untersucht (Böhle et al ., 1995) .<br />
Der Adhäsions-Assay bewertet die Adhäsions fähig keit von <strong>BCG</strong><br />
an Urothelkarzinomzellen als mutmaßliche Voraussetzung für zytotoxische<br />
Wirksamkeit . Dabei zeigen die Stämme „RIVM“, „Pasteur“<br />
und „Tice“ ein vergleichbar gutes Ad häsions verhalten (s . Abb . 7) .
Abb. 7:<br />
Vergleich des Adhäsionsverhaltens<br />
verschiedener<br />
<strong>BCG</strong>-Stämme<br />
(nach Böhle et al., 1995)<br />
Abb. 8:<br />
Tumor-Inhibierung durch die<br />
Applikation verschiedener<br />
<strong>BCG</strong>-Stämme (10 7 CFU/ml)<br />
(nach Rajala et al. 1992)<br />
3.2 Untersuchungen am Menschen<br />
Die Ergebnisse des Zytotoxizitäts-Assays (relative Zytotoxizität<br />
in Abhängigkeit von der Anzahl eingesetzter <strong>BCG</strong>-Zellen pro<br />
Karzinomzelle) korrelierten mit denen der Adhäsionsfähigkeit . Die<br />
Stämme „RIVM“, „Pasteur“ und „Tice“ zeigten in allen untersuchten<br />
Dosisbereichen eine ausgeprägtere Induktion zellulärer Zytotoxizität<br />
als andere klinisch eingesetzte <strong>BCG</strong>-Stämme . Noch deutlicher war<br />
der Unterschied im Vergleich zu atypischen Mykobakterien (Böhle<br />
et al ., 1995) .<br />
Rajala et al . haben 1992 die zytostatischen Effekte verschiedener<br />
<strong>BCG</strong>-Stämme untersucht . Fünf <strong>BCG</strong>-Stämme (RIVM,<br />
Tice, Connaught, Pasteur und Evans) wurden gegen humane<br />
Karzinomzellen T24 in vitro getestet . Der <strong>BCG</strong>-Stamm RIVM hat<br />
die höchste zytostatische Aktivität von allen getesteten <strong>BCG</strong>-<br />
Stämmen . (s . Abb . 8) (Rajala et al ., 1992) .<br />
Die stark immunogene Wirkung mykobakterieller Präparate wurde<br />
von Freund 1956 erforscht und therapeutisch angewendet (Freund,<br />
1956) . 1966 zeigten Coe und Feldmann, dass ebenso wie z .B . die<br />
Haut auch die Harnblase in der Lage ist, mit einer Immunantwort vom<br />
verzögerten Typ (delayed-type hypersensitivity, DTH) auf einen anti-<br />
27
28<br />
Abb. 9:<br />
Zelluläre Charakteristika.<br />
Semiquantitative immunhistolo<br />
gi sche Analyse der <strong>BCG</strong>behandelten<br />
Harnblase (Nach<br />
Böhle & Jocham, 2000)<br />
genen Reiz zu reagieren und somit ein ideales Organ für die lokale<br />
Immuntherapie darstellt (Coe & Feldmann, 1966) . Durch diese Untersuchungen<br />
wurde die theoretische Basis für die topische intravesikale<br />
Immuntherapie geschaffen .<br />
Vor der Therapie zeigen die Biopsien aus den nicht tumortragenden<br />
Anteilen der Blase eine nur relativ geringe Präsenz mononukleärer<br />
Zellen . Diese sind überwiegend unmittelbar suburothelial angeordnet,<br />
das Urothel ist weitgehend frei von Entzündungs zellen . Hinsichtlich<br />
der T-Zell-Subpopulationen zeigt sich eine etwas geringere Anzahl<br />
CD4 + -(T-Helfer)Zellen im Vergleich zu den CD8 + -(T-Suppressor)Zellen<br />
. Das Verteilungsmuster der CD8 + -Zellen ist gleich . Das<br />
lokale T-Helfer/T-Suppressor-Zell-Verhältnis in der Blasenwand vor<br />
Therapiebeginn beträgt etwa 1:2 . Makrophagen finden sich ebenfalls<br />
vor Therapiebeginn vereinzelt diffus verteilt im suburothelialen<br />
Stroma .<br />
Nach der 6 . Instillation von <strong>BCG</strong> zeigt sich eine heftige entzündliche<br />
Reaktion der gesamten Blasenwand . Mononukleäre Zellen und segmentkernige<br />
Granulozyten infiltrieren überwiegend die Submukosa,<br />
sind aber auch im Urothel und in der Muskulatur zu finden . Das<br />
Urothel ist abgeflacht, bildet jedoch eine vollständige Schicht mit<br />
intakter Basalmembran . In allen Biopsien sind unter der Therapie<br />
entstandene Aggregate immunkompetenter Zellen nachweisbar,<br />
welche den so genannten <strong>BCG</strong>-induzierten Granulomen entsprechen<br />
(El-Demiry et al ., 1987; Papadimitriou & Spector, 1982) .<br />
Diese follikel-ähnlichen Strukturen finden sich nahezu ausschließlich<br />
in der gefäßreichen Submukosa . Das mononukleärzellige Infiltrat<br />
der Blasenwand besteht nach Beendigung der intravesikalen <strong>BCG</strong>-<br />
Therapie überwiegend aus T-Zellen mit deutlicher Prädominanz der<br />
CD4 + -(T-Helfer/Inducer)Zellen gegen über den CD8 + -(T-Suppressor/<br />
Zytotoxizitäts) Zellen im Granulom . Der Quo-tient submukös nachweisbarer<br />
CD4 + / CD8 + -T-Zellen liegt bei 2:1 und entspricht damit<br />
einer Umkeh rung des ursprünglichen Verhältnisses in der normalen<br />
Blase .<br />
Diese immunhistologischen Charakteristika bleiben auch zu späteren<br />
Untersuchungszeitpunkten nach 6,9 und 12 Monaten nach<br />
Therapiebeginn erhalten . Die semiquantitative Analyse der diversen<br />
Zellpopulationen zeigt einen charakteristischen Verlauf (s . Abb . 9):
Aktivierte, HLA-DR exprimierende Zellen sind bis maximal 6<br />
Wochen nach <strong>BCG</strong>-Induktionszyklus vermehrt, anschließend ist<br />
ein langsamer Rückgang IL-2-Rezeptor-exprimierender Zellen zu<br />
verzeichnen . Die Zahl der HLA-DR-positiven Zellen bleibt 3 Monate<br />
im Wesentlichen konstant . Die absolute Zahl der T-Zellen zeigt ein<br />
Maximum nach 3 Monaten verbunden mit einem Rückgang der<br />
T-Suppressor/Toxizitäts-Zellen in der Folgezeit und konstantem<br />
Verlauf der T-Helfer-Zellen . Aufgrund dieser Verschiebung ist das<br />
Verhältnis der lokalen T-Helfer/T-Suppres sor-Zellen auch in den<br />
Untersuchungen ein Jahr nach Therapie noch deutlich zugunsten<br />
des T-Helfer-Phänotyps erhöht (Böhle & Jocham, 2000) .<br />
Diese immunhistologischen Untersuchungen nach <strong>BCG</strong>-Thera pie<br />
weisen auf eine Stimulation des lokalen Immunsystems der Blase<br />
hin, welche sich sowohl in ihrer zeitlichen Ausdehnung als auch<br />
in qualitativer Hinsicht erheblich von einer unspezifischen Zystitis<br />
unterscheidet: Während bei einer unspezifischen Zystitis eine<br />
überwiegend granulozytäre Infiltration vorliegt, wurde nach <strong>BCG</strong><br />
eine nahezu ausschließliche Vermehrung mononukleärer Zellen<br />
(Lymphozyten und Makrophagen) festgestellt . Einhergehend mit<br />
dieser quantitativen fällt auch eine qualitative Veränderung des<br />
Zellinfiltrats nach <strong>BCG</strong> auf: Während vor der Instillation in der normalen<br />
Blase T-Suppres sor-Zellen dominieren, ist das Verhältnis<br />
Helfer/Suppressor-T-Zellen bereits nach der 6 . Instillation umgekehrt<br />
. Die vermehrt nachweisbaren im munkompetenten mononukleären<br />
Zellen exprimieren sog . Aktivierungsmarker (IL-2-R und<br />
HLA-DR) . Dieses charakteristisch aktivierte Zellinfiltrat persistiert<br />
über mindestens 12 Monate überwiegend in den suburothelial<br />
gelegenen Granu lomen und Follikeln . Durch die Ansammlung großer<br />
Mengen immunkompetenter Zellen vorwiegend innerhalb dieser<br />
suburothelialen Granulome und Follikel können sie als Zentren<br />
der langfristig persistierenden lokalen Immunaktivie rung angesehen<br />
werden (Böhle & Jocham, 2000) .<br />
Innerhalb von 24h nach <strong>BCG</strong>-Instillation kann eine erhebliche<br />
Sekretion der Zytokine Interleukin-1 (IL-1), Interleukin-2 (IL-2) und<br />
Tumornekrosefaktor (TNF) in den Urin festgestellt werden . Nach<br />
der Instillation von <strong>BCG</strong> differieren die Zytokinwerte im Urin zwischen<br />
einzelnen Patienten erheblich – sowohl bezüglich des zeitlichen<br />
Maximums als auch bezüglich der Höhe der gesamten 24-<br />
Stunden-Ausscheidung . Bereits 2 h nach <strong>BCG</strong>-Instillation können<br />
signifikant erhöhte Werte mit einem Maxi mum nach 2-8 h nachgewiesen<br />
werden . Die erhöhten Titer fallen inner halb von 24 h auf<br />
Normwerte zurück (de Boer et al ., 1992a) .<br />
TNF, IL-1 und IL-2 werden im Rahmen von immunologischen<br />
Reaktionen gebildet, welche im Gegensatz zur unspezifischen<br />
Entzündung mit einer Antigenerkennung einhergehen . Der starke<br />
29
30<br />
4.0 klinische Daten<br />
Anstieg dieser Zytokine im Urin weist somit auf den immunologischen<br />
Charakter der <strong>BCG</strong>-induzierten Reaktion hin .<br />
Die starke Sekretion von IL-2 und TNF nach <strong>BCG</strong>-Behandlung<br />
stellt jedoch eine im Vergleich zur unspezifischen Zystitis qualitativ<br />
andersartige Reaktion dar . Weder IL-2 (Donohue & Rosen berg,<br />
1983; de Boer et al ., 1992a) noch TNF wurden im Urin Gesunder<br />
gefunden und nur in wenigen Ausnahmen war IL-2 bei Patienten<br />
mit unspezifischer Zystitis nachweisbar . IL-2 wird überwiegend<br />
von aktivierten T-Helfer-Zellen produziert . Es wirkt spezifisch bei<br />
der Proliferation und Differenzierung von T-Lymphozyten . Ein<br />
Effekt auf Tumorzellen wird vorwiegend über die Generation von<br />
Lymphokin-aktivierten-Killerzellen (LAK-Zel len) ausgeübt, was als<br />
Behandlungsform fortgeschrittener menschlicher Karzinome auch<br />
klinisch angewendet worden ist (Rosenberg, 1987) .<br />
Die intravesikale Rezidivprophylaxe mit <strong>BCG</strong> nach kompletter<br />
TUR oder Elektrokoagulation von oberflächlichem Tumor konnte<br />
in zahlreichen kontrollierten Studien eine signifikante Verrin gerung<br />
von Tumorrezidiven und ein verlängertes rezidivfreies Intervall im<br />
Vergleich zur chirurgischen Behandlung (TUR) allein bewirken (Herr<br />
et al ., 1987) .<br />
In der ersten Studie von Lamm et al ., 1980, wurde bei lediglich 37<br />
randomisierten Patienten das Tumorrezidiv durch die intravesikale<br />
und perkutane <strong>BCG</strong>-Therapie von 42 % bei Patienten mit TUR auf<br />
17 % bei Patienten mit zusätzlicher <strong>BCG</strong>-Behandlung reduziert, was<br />
ein statistisch signifikanter Unterschied ist (p=0,029) .<br />
In dem anschließenden Bericht über 57 randomisierte Patienten<br />
zeigte sich bei 82 % der Kontrollpatienten ein Rezidiv, während nur<br />
20 % der mit <strong>BCG</strong> behandelten Patienten ein Tumorrezidiv aufwiesen<br />
(Lamm, 1985) .<br />
Das durchschnittliche rezidivfreie Intervall verdoppelte sich bei den<br />
mit <strong>BCG</strong> behandelten Patienten von 24 auf 48 Monate . In einer<br />
ähnlich angelegten Studie fanden Herr et al . heraus, dass 40 % der<br />
mit <strong>BCG</strong> behandelten Patienten über 60 Monate lang rezidivfrei<br />
blieben, während keiner in der nur mit TUR behandelten Gruppe<br />
über einen so langen Zeitraum rezidivfrei blieb (Herr, 1992a) .<br />
Weitere Studien bestätigen die lang anhaltende Wirkung der <strong>BCG</strong>-<br />
Immuntherapie: Cookson und Sarosdy untersuchten 1992 ein<br />
größeres Patientenkollektiv im Tumorstadium T1, das mit <strong>BCG</strong><br />
therapiert wurde und stellten fest, dass 91% der Patienten durchschnittlich<br />
59 Monate rezidivfrei blieben . 69 % der Patienten dieser<br />
Studie blieben nach der Anfangstherapie rezidivfrei, und bei wei-
4.1 therapieschemata<br />
Abb. 10:<br />
Instillationsschema<br />
der Initialtherapie.<br />
F*: Frühinstillation<br />
mit mito-extra ®<br />
4.1.1 Zweiter Instillationszyklus bei cis<br />
teren 22 % war eine zusätzliche TUR und ein weiterer <strong>BCG</strong>-Zyklus<br />
erforderlich, um rezidivfrei zu bleiben .<br />
Das seit Einführung der <strong>BCG</strong>-Therapie meistgebräuchliche<br />
Behandlungsprotokoll beinhaltet die wöchentliche Instillation von<br />
ca . 1–5x10 8 lebenden <strong>BCG</strong>-Keimen über einen Zeitraum von 6<br />
Wochen (Morales et al ., 1976) . Dieses empirische Protokoll stellt<br />
die weltweit anerkannte Basistherapie dar (s . Abb . 10) .<br />
Bei der Initialtherapie ist darauf zu achten, die erste <strong>BCG</strong>-Instillation<br />
frühestens 2 Wochen nach TUR zu geben .<br />
Eine Verbesserung der Behandlungsergebnisse nach dem<br />
Induktionszyklus ließ sich im Falle eines Rezidives eines papillären<br />
Tumors bzw . Persistenz von CIS durch einen zweiten<br />
sechswöchigen Behandlungszyklus erzielen (Grünwald et al .,<br />
1997; Brake et al ., 2000) .<br />
Haaff et al . konnten 1986 beim Carcinoma in situ (CIS) nach einem<br />
Zyklus <strong>BCG</strong> bei 42 % der Patienten Tumorfreiheit erzielen, nach<br />
einem zweiten Zyklus lagen die Ergebnisse in der Gesamtgruppe<br />
mit CIS bei 68 % . Bei papillären Tumoren konnte die Rezidivfreiheit<br />
bei einer mittleren Nachbeobachtungszeit von 12,8 Monaten von<br />
67 % nach einem Zyklus auf 90 % nach zwei Zyklen <strong>BCG</strong> gesteigert<br />
werden (Haaff et al ., 1986) .<br />
Zu ähnlichen Ergebnissen kamen Kavoussi et al . 1988: Während<br />
nach einem Zyklus <strong>BCG</strong> 37,5 % der Patienten tumorfrei waren, lag<br />
die Erfolgsrate nach einem zweiten Zyklus bei 70 % (Kavoussi et<br />
al ., 1988) .<br />
Catalona et al . wiesen in einer Risiko-Nutzen-Analyse ebenfalls den<br />
Vorteil eines zweiten Behandlungszyklus mit <strong>BCG</strong> im Falle eines<br />
Rezidives nach . Allerdings stieg das Risiko, im Falle eines erneuten<br />
Rezidives nach zwei Behandlungszyklen einen invasiven oder<br />
metastatischen Tumor zu entwickeln, auf 30 % bzw . 50 % an, so<br />
dass eine weitere Behandlung mit <strong>BCG</strong> nach zwei erfolgslosen<br />
Zyklen abgelehnt wurde (Catalona et al ., 1988; Bui & Schelhammer,<br />
1997) . Andere Autoren berichten, dass sogar drei Instillationszyklen<br />
mit <strong>BCG</strong> bei Patienten effektiv sind, die am Anfang nicht reagiert<br />
haben (Okamura et al ., 1996) .<br />
31
32<br />
4.1.2 erhaltungstherapie<br />
Der Langzeiterfolg eines zweiten Instillationszyklus ist nach<br />
Untersuchungen von Bretton et al . abhängig von der Dauer des<br />
Ansprechens auf den ersten Zyklus (Bretton et al ., 1990) .<br />
Der dauerhafte Erfolg einer Immuntherapie hängt von einer lang<br />
anhaltenden oder wiederholt durchgeführten Stimulation des<br />
Immunsystems (Boosterung) ab .<br />
Die Erhaltungstherapie wurde erstmals durch Brosman durchgeführt<br />
(Brosman, 1982; Brosman, 1985) . Er behandelte eine<br />
Gruppe von 61 Patienten mit rezidivierenden oberflächlichen<br />
Harnblasenkarzinomen in einer vergleichenden Studie zwischen<br />
<strong>BCG</strong> und Thiotepa . Nach einer 6-wöchigen Induktionsphase wurden<br />
die intravesikalen Instillationen alle 2 Wochen für 3 Monate,<br />
danach monatlich bis zu 2 Jahren gegeben . In der <strong>BCG</strong>-Gruppe<br />
waren keine Rezidive zu verzeichnen, während 40 % der Patienten<br />
in der Thiotepa-Gruppe ein Rezidiv hatten . Die Nebenwirkungen<br />
der <strong>BCG</strong>-behandelten Patienten waren deutlich größer als bei<br />
den Thiopeta-behandelten Patienten . Brosman schlussfolgerte,<br />
dass die Erhaltungstherapie von Vorteil war, die Neben wirkungen<br />
jedoch zugenommen haben (Brosman, 1985) .<br />
Lamm et al . (2000) untersuchten 660 Patienten mit schnell rezidivierendem<br />
Tumor Ta, T1 oder CIS . Sie erhielten einen 6wöchigen<br />
Standardinduktionszyklus mit <strong>BCG</strong> . Die Patienten wurden<br />
anschließend stratifiziert nach früherer Therapie, Tumortyp<br />
(Papillär versus CIS) und PPD-Hauttest . Anschließend erfolgte<br />
eine Randomisierung in Nachbeobachtungsarm (192 Patienten)<br />
bzw . den Erhaltungstherapiearm (193 Patienten) . Dieser bestand<br />
aus 3 <strong>BCG</strong>-Instillationen in wöchentlichen Abständen jeweils zum<br />
Zeitpunkt 3 und 6 Monate und anschließend halbjährlich bis zu 3<br />
Jahren . Nach einer durchschnittlichen Beobachtungszeit von 3,2<br />
Jahren zeigte sich in der Zeit bis zum Auftreten eines histologisch<br />
bestätigten Rezidives ein dramatischer und hoch signifikanter<br />
Vorteil der Erhaltungstherapie . Durch die Erhaltungs therapie wurde<br />
die Tumor-Rezidivrate signifikant gesenkt: 52 % der Patienten mit<br />
einer nur 6-wöchigen <strong>BCG</strong>-Therapie hatten Rezidive, verglichen<br />
mit nur 25 % der Patienten, die eine Erhaltungstherapie bekommen<br />
hatten (p
Allgemein wurde bei Patienten mit einer Erhaltungstherapie<br />
• die rezidivfreie Überlebensrate von 30 auf 48 % (p
34<br />
Abb. 11:<br />
Instillationsschema der<br />
Erhaltungstherapie<br />
Standardinduktionstherapie ist die Erhaltungs immun the rapie<br />
mit <strong>BCG</strong> bei Patienten mit Carcinoma in situ und ausgewählten<br />
Patienten mit Ta- oder T1-Blasentumor von Vorteil . Das mediane<br />
rezidivfreie Überleben war im Erhaltungs thera piearm doppelt so<br />
lang und die Patienten hatten ein signifikant längeres progressionsfreies<br />
Überleben (Lamm et al ., 2000) .<br />
Nach dem Kontakt mit einem Immunogen ist die Reaktion der<br />
sekundären Immunantwort schnell und gleichzeitig stark . Dies ist<br />
auch der Grund, warum 3 Instillationen gegenüber 6 für eine optimale<br />
Immunstimulation für die meisten Patienten besser ist .<br />
Studien haben gezeigt, dass bei Patienten, die schon einen<br />
ersten <strong>BCG</strong>-Therapiezyklus bekommen haben, der Peak der<br />
Immunstimulation während des zweiten <strong>BCG</strong>-Instillationszyklus<br />
nach der 3 . Instillation seinen höchsten Wert erreicht hat . Eine<br />
Abschwächung der Immunantwort erfolgt dann, wenn weiter eine<br />
vierte, fünfte und sechste Instillation folgt (de Reijke et al ., 1996;<br />
de Reijke et al ., 1999) . Da die lymphozytäre Infiltration nach einer<br />
<strong>BCG</strong>-Instillation erst nach Monaten verschwindet, wird somit vorgeschlagen,<br />
dass die Erhaltungstherapie alle 6 Monate stattfinden<br />
soll .<br />
Durch eine 3-wöchige <strong>BCG</strong>-Erhaltungstherapie im 3 ., 6 ., 12 ., 18 .,<br />
24 ., 30 . und 36 . Monat wird eine Reduktion der Tumor rezidive von<br />
52 % auf 15 % erreicht . Vorsicht ist allerdings geboten mit zusätzlichen<br />
<strong>BCG</strong>-Gaben, da sie zu einer Immun suppression führen können<br />
(Böhle, Jocham, 2000) .<br />
4.1.3 Dosisreduktion (low dose BcG)<br />
Es gibt Bestrebungen, sowohl die Effektivität der Behandlung<br />
durch eine Intensivierung des Behandlungsprotokolls mit Hilfe<br />
weiterer Instillationen zu verbessern als auch die Nebenwir kungen<br />
durch Verringerung der Dosis zu minimieren .<br />
Die optimale Dosis von <strong>BCG</strong> ist noch nicht klar definiert . Die<br />
Möglichkeit der Dosisreduktion wird kontrovers diskutiert . Vom<br />
immunologischen Standpunkt könnte eine low-dose Immunisierung<br />
vorteilhaft sein (Power et al ., 1998) .<br />
Morales et al ., 1992, zeigten jedoch, dass bei einem Teil der<br />
Patienten die Dosisreduktion zu einem schlechteren Therapieergebnis<br />
führte . In einer vergleichenden Studie mit 97 Patien -
ten wurden entweder 60 mg oder 120 mg <strong>BCG</strong> während des<br />
6-wöchigen Induktionszyklus pro Instillation verabreicht . Es zeigte<br />
sich, dass die übliche Dosis von 120 mg <strong>BCG</strong> zu keiner statistisch<br />
signifikanten Verbesserung des Behandlungs erfol ges im Vergleich<br />
zur halbierten Dosis führte . Bei Vorliegen eines papillären Tumors<br />
(Ta) und begleitendem CIS zeigten sich jedoch signifikant bessere<br />
Ergebnisse für die Patienten, die mit der Standardosis von 120 mg<br />
behandelt worden waren . Hier blieben 67 % der Patienten verglichen<br />
zu 37 % der Patien ten, die mit 60 mg behandelt wurden,<br />
rezidivfrei (p
36<br />
Abb. 12:<br />
Krankheitsfreie Überlebens rate<br />
bei 70 Patienten mit Cis (nach<br />
Losa et al., 2000).<br />
Tab. 6:<br />
Verteilung der Rezidiv-<br />
und Progressionsraten nach<br />
Standarddosis (SD) und<br />
low-dose (LD) <strong>BCG</strong> (nach<br />
Martinez-Pineiro et al., 1999)<br />
Die Gruppe von Martinez-Pineiro et al . zeigte 1995 und 1999,<br />
dass mit low-dose <strong>BCG</strong> eine geringere Toxizität und kein Wirkungsunterschied<br />
zwischen der Standarddosis und der low-dose<br />
nachzuweisen war . Bei der Rezidivrate zeigte sich kein signifikanter<br />
Unterschied zwischen high- und low-dose <strong>BCG</strong> . Bei der<br />
Progressionsrate von high risk Tumoren T1G3 und Cis (s . Tab . 6)<br />
war die niedrige Dosierung schwächer wirksam .<br />
Rezidive (%)<br />
SD <strong>BCG</strong> (204 Pat .) LD <strong>BCG</strong> (214 Pat .)<br />
Ta 21/58 (36,2) 18/57 31,5 ns<br />
T1 30/129 (23,2) 51/141 36,2 ns<br />
Cis, Cis+ TaT1 3/17 (17,6) 7/16 43,7 ns<br />
Progression (%)<br />
Ta 3/58 (5 .1) 6/57 (10,5) ns<br />
T1 12/129 (9 .3) 15/141 (10,6) ns<br />
T1G3 3/25 (12) 8/17 (47) p
4.1.4 kombinationstherapien<br />
dose <strong>BCG</strong> (27mg) vs . Very-low-dose <strong>BCG</strong> (13,5mg) vs . Mitomycin<br />
C (30mg) .<br />
Insgesamt 430 Patienten wurden mit intermediate-risk HBCA in<br />
3 Gruppen randomisiert: 27mg low-dose <strong>BCG</strong>, 13,5mg very-lowdose<br />
<strong>BCG</strong> und 30mg Mitomycin C (MMC) .<br />
Instillationen wurden 1x die Woche für 6 Wochen und anschließend<br />
1x alle 2 Wochen für insgesamt 12 Wochen durchgeführt .<br />
Es ergab sich ein signifikant längeres krankheitsfreies Intervall für<br />
<strong>BCG</strong> 27mg vs . Mitomycin 30mg (p=0,006) . Es gab keine signifikanten<br />
Unterschiede zwischen den beiden <strong>BCG</strong>-Dosierungen und<br />
auch zwischen 13,5mg <strong>BCG</strong> vs . MMC 30mg .<br />
Das krankheitsfreie Intervall bei primärer Erkrankung war ebenfalls<br />
signifikant besser bei 27 mg <strong>BCG</strong> .<br />
Auch lagen keine signifikanten Unterschiede zwischen den 3<br />
Gruppen in der Zeit bis zur Progression und krankheitspezifischer<br />
Überlebenszeit vor .<br />
Es scheint, dass ein Drittel der normalen <strong>BCG</strong> Dosis (27mg) die<br />
Minimum-Dosierung für die Therapie des HBCA ist . Ein Sechstel<br />
(13,5mg) wirkt zwar ähnlich wie MMC 30mg ist aber mit mehr<br />
Toxizität verbunden (Ojea et al . 2007) .<br />
Die alternierende Therapie von Mitomycin-C (MMC) und <strong>BCG</strong> wurde<br />
von der Finn Bladder Group beim CIS der Harnblase untersucht<br />
(Rintala et a ., 1995) . In einem Behandlungsarm wurden<br />
40 Patienten mit 20-40 mg MMC behandelt . In dem anderen<br />
Behandlungsarm wurden die Patienten alternierend mit 75 mg<br />
<strong>BCG</strong> und MMC behandelt . Die erste Instillation von MMC wurde<br />
innerhalb der ersten 48 h nach TUR durchgeführt und weiter<br />
wöchentlich für 4 Wochen . Anschließend wurden die Patienten in<br />
einen MMC- oder alternierenden MMC-/<strong>BCG</strong>-Arm randomisiert .<br />
Hier erhielten die Patienten einmal pro Monat eine Instillation für<br />
ein Jahr und anschließend jeden 3 . Monat im 2 . Jahr . Nach 12<br />
Monaten waren 59 % der Patienten im MMC-Arm und 82 % der<br />
Patienten im MMC-<strong>BCG</strong>-Arm tumorfrei, nach 24 Monaten entsprechend<br />
47 % bzw . 74 % . Die Unter schiede waren statistisch<br />
signifikant (p=0,041) .<br />
In dieser Studie wurde festgestellt, dass die Erfolgsrate der alternierenden<br />
Therapie höher ist als die der alleinigen Chemo therapie,<br />
dass die Erfolge jedoch nicht höher sind als die der alleinigen <strong>BCG</strong>-<br />
Therapie beim CIS .<br />
In einer Metaanalyse von Smith et al ., 1999, wurden die Leitlinien<br />
der American Urological Association (AUA) erarbeitet . Für die<br />
Metaanalyse wurden zwei Vorgehensweisen gewählt . Zum<br />
37
38<br />
Tab. 7:<br />
Vergleiche der Kombina -<br />
tions therapien des HBCA mit<br />
<strong>BCG</strong>, MMC und Doxorubicin<br />
(nach Smith et al. 1999)<br />
Abschätzen der Rezidiv- und Progressionsrate wurden mehrarmige,<br />
randomisierte, kontrollierte Studien analysiert . Zur Abschätzung<br />
der Nebenwirkungsrate wurden auch einarmige, nichtkontrollierte<br />
Studien herangezogen .<br />
Die Ergebnisse dieser Metaanalyse werden in Tab . 7 zusammengefasst:<br />
Behandlung A Behandlung B Unterschied<br />
signifikant<br />
TUR allein vs . TUR + <strong>BCG</strong> Ja<br />
TUR allein vs . TUR + MMC Ja<br />
TUR allein vs . TUR + Doxorubicin Ja<br />
TUR + Doxorubicin vs . TUR + <strong>BCG</strong> Ja<br />
TUR + MMC vs . TUR + <strong>BCG</strong> Nein<br />
Schlussfolgerung dieser Analyse ist, dass <strong>BCG</strong> oder MMC für<br />
die Behandlung des CIS und T1-Tumors zu empfehlen sind .<br />
<strong>BCG</strong> und MMC sind dem Doxorubicin und Thiotepa überlegen<br />
und es gibt keinen Beweis, dass eine der beiden Therapien die<br />
Progressionsrate beeinflusst .<br />
Malmström et al . berichteten 1999 über ein 5-Jahres-Follow-up<br />
eines randomisierten Vergleichs von <strong>BCG</strong> und Mitomycin bei 250<br />
Patienten mit nicht invasivem HBCA . Nach einem Follow up von 64<br />
Monaten waren 101 Patienten (42 %) krankheitsfrei . Es wurde ein<br />
signifikanter Unterschied im erkrankungsfreien Überleben zugunsten<br />
von <strong>BCG</strong> (p=0,04) festgestellt, welcher am ausgeprägtesten<br />
gegen Carcinoma in situ war .<br />
Da <strong>BCG</strong> und MMC unterschiedliche Wirkmechanismen haben,<br />
ist es denkbar, dass ein additiver Antitumoreffekt erzielt werden<br />
kann . Diese Hypothese beruht auf zwei Argumenten: Ratliff et al .<br />
konnten 1987 zeigen, dass die Bindung von Mykobakterien an<br />
der Blasenwand essentiell für die Entstehung einer Immun antwort<br />
und für eine Antitumoraktivität ist (Ratliff et al ., 1987b; Hudson et<br />
al ., 1990) . Einer dieser Faktoren ist möglicherweise Fibronektin,<br />
welches sowohl nach Elektrokoagulation der Bla senwand als auch<br />
durch Induktion einer chemischen Zystitis nach Instillation von<br />
MMC verstärkt nachweisbar ist . Auf diese Weise könnte die vorherige<br />
Gabe von MMC zur Verbesserung der Adhäsion von <strong>BCG</strong><br />
führen und damit eine verstärkte Immun antwort hervorrufen . Die<br />
Autoren konnten in ihren Versu chen jedoch keine Verstärkung der<br />
Immunantwort nach Kombi nationsbehandlung im Vergleich zur<br />
alleinigen Behandlung mit <strong>BCG</strong> nachweisen .<br />
Die Effektivität einer sequentiellen <strong>BCG</strong>-Zytostatika-Therapie im<br />
Vergleich zur reinen Zytostatika-Therapie wurde von der Dutch South-<br />
East Co-operative Group geprüft . Nach der TUR wurden in einem<br />
Behandlungsarm 40 mg MMC in 50 ml NaCl gelöst wöchentlich<br />
über 10 Wochen verabreicht . In der sequentiellen Therapie-Gruppe
Tab. 8:<br />
<strong>BCG</strong>-MMC<br />
Kombinationstherapie<br />
Abb. 13:<br />
Kaplan-Meier Kurve für<br />
die Schätzung der Zeit<br />
bis zum Rezidiv<br />
(nach Kaasinen et al., 2000)<br />
wurde zunächst MMC einmal pro Woche für einen Monat verabreicht,<br />
anschließend wurde ein vollständiger <strong>BCG</strong>-Induktionszyklus<br />
über 6 Wochen gegeben . Nach einer Nachbeobachtungszeit von<br />
32 Monaten war die Zahl der Rezidive in beiden Gruppen ähnlich .<br />
Dies zeigt, dass die sequentielle Gabe von <strong>BCG</strong> und MMC in dieser<br />
zeitlichen Abfolge keinen Beitrag zur Effizienz geleistet hat . Die<br />
lokalen Nebenwirkungen waren in beiden Gruppen gleich (Witjes et<br />
al ., 1998a) .<br />
Tab . 8 zeigt eine Zusammenfassung der Studien mit <strong>BCG</strong>-MMC<br />
Kombinationstherapie:<br />
Autor kombination Modalität N ergebnis toxizität/NW<br />
v . d . Meiden 1996 MMC/<strong>BCG</strong> Marker-Tumor Antw .: 32 CR: 16 Lokal: WHO 3°:<br />
Sequentiell NC: 11 6,45 % mild<br />
MMC x 4 wöchent . n .d .: 4<br />
<strong>BCG</strong> x 6 wöchent . Prog .: 1<br />
Rintala 1996 MMC/<strong>BCG</strong> MMC x 5 wöchent . Nicht signifikant Lokal: gleich<br />
vs . MMC dann altern . MMC +<br />
<strong>BCG</strong> x 10 wöchent .<br />
Vs .<br />
92<br />
MMC x 10 monatlich 90<br />
Witjes 1998 MMC/<strong>BCG</strong> Sequentiell Nicht signifikant Lokal: gleich<br />
vs . MMC MMC x 4 wöchent ./ systemisch: MMC<br />
<strong>BCG</strong> x 6 wöchent .<br />
vs .<br />
90 besser (p=0,07)<br />
MMC x 10 wöchentl . 92<br />
El-Dein 1999 Epirub ./<strong>BCG</strong> Wechselnd <strong>BCG</strong> & Vorteil der Kombination:<br />
vs . <strong>BCG</strong> Epirub . X 6 wöchent . Kombination Lokal & system .<br />
dann monatl x 10 66 (p=0,05) NW . signifikant<br />
vs . reduziert:<br />
<strong>BCG</strong> x 10 wöchentl ., (p=0,001)<br />
dann monatl . X 10 58<br />
Kaasinen et al . berichteten 2000 und 2002 über die Behand lung<br />
von 236 Patienten mit Ta- und T1-Harnblasenkarzinom mit einer<br />
Kombinationstherapie von MMC, <strong>BCG</strong> und Interferon .<br />
Der erste Arm hat 5 x MMC gefolgt von 11 Instillationen <strong>BCG</strong> über 12<br />
Monate bekommen und der zweite Arm 5 x MMC gefolgt von einer<br />
sequenziellen Therapie mit <strong>BCG</strong> und Interferon für 12 Monate .<br />
Es hat sich gezeigt, dass die Zeit bis zum ersten Rezidiv bei der<br />
Gruppe mit MMC+<strong>BCG</strong> signifikant länger war als bei der Gruppe<br />
mit MMC+<strong>BCG</strong>+Interferon (0 .4 vs . 0,9, p< 0,00001), (s . Abb . 13) .<br />
log rank p < 0,00001<br />
MMC+<strong>BCG</strong><br />
MMC+IFN/<strong>BCG</strong><br />
39
40<br />
4.2 therapie des Urothelkarzinoms<br />
4.2.1 Papilläres Urothelkarzinom<br />
Die Klassifikation der Blasenkarzinome wird durch Jewett & Strong<br />
im Jahre 1946 (UICC 1979) in oberflächliche und in muskelinvasive<br />
Blasenkarzinome mit unterschiedlicher prognostischer Bedeu tung<br />
unterteilt (Jewett & Strong 1946) .<br />
Diese Autoren konnten bereits in ihrer ersten Arbeit zeigen,<br />
dass bei Infiltration der Submukosa weder Lymphknoten noch<br />
Fernmetastasen vorlagen, bei Infiltration der Muskularis sowohl<br />
bereits Lymphknoten als auch Fernmetastasen zu finden waren .<br />
Den oberflächlichen Harnblasenkarzinomen zugeordnet wurden<br />
die Tumorstadien Carcinoma in situ (intraepitheliale Neo plasie), pTa<br />
(papilläres oder solides Tumorwachstum auf das Urothel begrenzt,<br />
keine Penetration der Lamina propia, keine Invasion des suburothelialen<br />
Stromas) und pT1 (Penetration der Lamina propia, d .h .<br />
der subepithelialen Basalmembran und beginnende Invasion des<br />
subepithelialen Stromas) . Da dieses subepitheliale Stroma lymphgefäß-<br />
und kapillarreich ist, besteht bei Invasion dieser bindegewebigen<br />
Schicht ein erhöhtes Risiko, dass der Tumor Anschluss an<br />
die Gefäße findet und somit schneller hämatogen oder lymphogen<br />
metastasiert .<br />
Nach tierexperimentellen Arbeiten berichteten Morales et al . 1976<br />
erstmals über die intravesikale Immuntherapie des oberflächlichen<br />
Blasenkarzinoms beim Menschen . Diese erfolgversprechenden<br />
Daten konnten in weiteren Untersuchungen in der Folgezeit<br />
bestätigt und verbessert werden (z .B .Lamm et al ., 1981a; Herr<br />
et al ., 1983; Morales, 1984; Brosman, 1985; Pinsky et al ., 1985;<br />
Catalona et al ., 1987; Kavoussi et al ., 1988; Boccon-Gibod et al .,<br />
1989; Bretton et al ., 1990) .<br />
In mehreren multizentrischen Studiengruppen wie der South west<br />
Oncology Group (SWOG) in den USA (Lamm et al ., 1995b), der<br />
European Organisation for Research and Treat ment of Cancer<br />
(EORTC) in Europa (Malmström et al ., 1999) der Niederländischen<br />
Dutch South-East Co-operative Group (Witjes et al ., 1998b),<br />
der Spanischen Kooperation (CUETO) (Martinez-Pineiro et al .,<br />
1995), der Deutschen Gruppe aus Essen (RUTT) (Krege et al .,<br />
1996) und der italienischen Grup pe aus Padua wurden vergleichende,<br />
prospektive Untersu chun gen durchgeführt, die dazu beitrugen,<br />
die Rolle der <strong>BCG</strong>-Immuntherapie zu bestimmen und die<br />
Behandlungsergebnisse zu verbessern .<br />
Die Behandlung des papillären HBCA ohne vorausgegangene vollständige<br />
transurethrale Entfernung des papillären Tumors ist unüblich .
Tab. 9:<br />
Ergebnisse der topischen<br />
Therapie gegen nicht resezierten<br />
Tumor oder belassene<br />
„Markerläsion“<br />
(nach Böhle & Jocham 2000)<br />
4.2.2 carcinoma in situ<br />
In einer Übersicht über 2 .152 Fälle wurde eine vollständige<br />
Rückbildung verbliebener papillärer Tumoren oder „Marker läsionen“<br />
bei der Behandlung mit Thiotepa in 34 %, bei der Behandlung mit<br />
dem Zytostatikum Doxorubicin in 32 %, bei MMC in 47 %-72 %<br />
und bei Epodyltherapie in 60 % beobachtet . (Malmström, 2002;<br />
van der Meijden et al ., 1996) .<br />
Für die intravesikale Behandlung derartiger Resttumoren mit<br />
<strong>BCG</strong> lag die Vollremissionsrate bei 63 % von 313 beobachteten<br />
Patienten (Böhle Jocham, 2000) (s . Tab . 9) .<br />
Substanz Patienten Vollremission (% cR)<br />
der Markerläsionen<br />
<strong>BCG</strong> 313 63 %<br />
MMC 407 47-72 %<br />
Thiotepa 474 34 %<br />
Doxorubicin 585 42 %<br />
Epodyl 373 60 %<br />
Gesamt 2 .152 49 %<br />
Akaza et al . berichteten 1995 über die Ergebnisse dieser klinisch<br />
nicht etablierten Behandlung: Die Vollremissionsrate lag bei<br />
125 Patienten mit papillären Ta- oder T1-Tumoren bei 66,4 %,<br />
etwa 70 % der Patienten hatten kein Rezidiv innerhalb der<br />
Nachbeobachtungszeit von 3 Jahren .<br />
Die Behandlung des Carcinoma in situ (CIS) der Harnblase ist eine<br />
spezielle und anerkannte Form der intravesikalen The ra pie gegen<br />
einen existierenden Tumor . Dieses hochmaligne Karzinom kann mit<br />
Hilfe der TUR und/oder Laser-Therapie nur unvollständig entfernt<br />
werden (Hudson & Herr 1995; Neumann et al ., 1999) . Durch den<br />
Einsatz der Fluoreszenzendoskopie kann das CIS leichter nachgewiesen<br />
und erfolgreicher reseziert werden (Zaak et al . 2004, 2005) .<br />
Das Carcinoma in situ wird in primäres, sekundäres und begleitendes<br />
CIS unterteilt (Jakse et al ., 2001) .<br />
Primäres CIS: Bezeichnet das CIS ohne begleitenden oder vorbestehenden<br />
papillären Tumor = de novo . Die Tumorprogressionsrate<br />
beträgt 15-37 % (Lamm, 1992) . Bei Patienten, bei denen nach<br />
dem ersten <strong>BCG</strong>-Therapiezyklus keine Wirkung erzielt wird, kann<br />
ein zweiter Instillationszyklus erfolgreich sein .<br />
41
42<br />
Abb. 14:<br />
Kaplan-Meier Überlebenskurven<br />
von 138 Patienten mit<br />
CIS (nach Cheng et al. 1999).<br />
Sekundäres CIS: bezeichnet ein CIS, dass im Verlauf der<br />
Nachsorge bei Patienten mit primär papillären Tumoren diagnostiziert<br />
wurde .<br />
Begleitendes CIS: Als begleitendes CIS bezeichnet man das<br />
zeitgleich mit einem papillären Tumor diagnostizierte CIS .<br />
Cheng et al . haben das Überleben von 138 Patienten mit multifokalem<br />
CIS und einer medianen Beobachtungszeit nach TUR von<br />
11 Jahren (0,7-25 Jahre) untersucht . Nach 10 Jahren blieben 63 %<br />
der Patienten progressionsfrei . Die karzinomspezifische und allgemeine<br />
Überlebensrate lag bei 79 % bzw . 55 % . Nach 15 Jahren<br />
blieben 59 % der Patienten progressionsfrei . Die tumorspezifische<br />
und allgemeine Überlebensrate lag entsprechend bei 74 % bzw .<br />
40 % (s . Abb . 14) . Es gab keinen signifikanten Unterschied der<br />
Überlebensraten zwischen zystektomierten Patienten und den<br />
Patienten, die ihre Blase behalten haben (p=0,16) (Cheng et al .,<br />
1999) .<br />
Der natürliche Verlauf des CIS ist höchst unterschiedlich . Es<br />
zeigen sich nach TUR/Biopsie Invasionsraten zwischen 3 und<br />
50 % (Lamm 1992a) . Die Erstdiagnose des CIS führte früher zur<br />
Empfehlung der radikalen Zystektomie als Therapie erster Wahl bei<br />
dieser Erkrankung (Utz & Farrow 1984; Utz et al ., 1980) .<br />
Erst mit Einführung der intravesikalen <strong>BCG</strong>-Immuntherapie auch<br />
für das CIS der Harnblase konnte eine Verbesserung der schlechten<br />
Prognose für die Patienten erreicht werden . Die klinischen<br />
Studien zur Behandlung des CIS (s . Tab . 10) zeigen bei über 700<br />
Patienten eine Erfolgsrate von etwa 70 % bei einer Dauer dieses<br />
Therapieerfolges von durchschnittlich 39 Monaten .
Tab. 10:<br />
Ansprechen auf <strong>BCG</strong><br />
bei Patienten mit CIS der<br />
Harnblase.<br />
Literatur Pat. Zahl Patienten mit Vollremission „follow up“<br />
(n) % Monate<br />
Brosman 1985 33 27 82 60<br />
Brosman 1989 40 28 70 35<br />
DeKernion et al ., 1985 19 13 66 15<br />
Enderli 1989 55 47 85 26<br />
Herr et al ., 1986 47 34 72 18<br />
Kavoussi et al ., 1988 59 23 39 24<br />
Kelley et al ., 1985 12 8 67 11<br />
Lamm 1985 14 11 79 14<br />
Morales 1980 7 5 71 23<br />
Prescott et al ., 1989 16 14 88 24<br />
Reitsma 1989 153 107 70 18<br />
Rintala et al ., 1989 10 4 40 21<br />
ISchellhammer et al ., 1986 6 6 100 12<br />
Soloway & Perry 1987 9 5 56 16<br />
SWOG 8216 64 45 70 39<br />
(Lamm et al ., 1991)<br />
SWoG 8507 (Lamm et al., 1992)<br />
6 Wochen 78 55 70 48<br />
6 + 3 72 49 82 48<br />
Gesamt 694 481 69<br />
Eine vergleichende multizentrische Studie von <strong>BCG</strong> gegen<br />
Doxorubicin beim CIS wurde durch die SWOG durchgeführt<br />
(Lamm et al ., 1991b) .<br />
Bei Patienten mit CIS war die Ansprechrate nach <strong>BCG</strong>-Behandlung<br />
prozentual signifikant höher: So zeigte sich nach <strong>BCG</strong> in 70 %<br />
Rezidivfreiheit versus 34 % nach Doxo rubicin (p
44<br />
Tab. 11:<br />
Gefahr der Progression bei<br />
Therapieversagen von <strong>BCG</strong> bei<br />
der Behandlung von CIS (mod.<br />
nach Hudson & Herr, 1995;<br />
DeJager et al., 1991)<br />
Abb. 15:<br />
Kaplan-Meier Kurve für<br />
die Rezidivfreiheit bei der<br />
Behandlung von CIS mit <strong>BCG</strong><br />
(nach Jakse et al. 2001)<br />
Patienten angehoben (Böhle & Jocham, 2000) . Dennoch ist das<br />
CIS ein potentiell gefährlicher Tumor . Bei Nichtansprechen auf eine<br />
<strong>BCG</strong>-Therapie ist die Gefahr einer Progression hoch (s . Tab . 11) .<br />
Ansprechen n Art der Progression<br />
Wahrscheinlichkeit der<br />
Progression (%)<br />
1 Jahr 2 Jahre 3 Jahre<br />
Vollremission 105 Gesamt 2 11 19<br />
Lokal 1 7 11<br />
T2+ 1 3 7<br />
Metastasen 0 1 1<br />
Teilremission 75 Gesamt 23 60 95<br />
Lokal 20 43 65<br />
T2+ 3 15 25<br />
Metastasen 0 2 5<br />
Jakse et al . von der EORTC-GU-Gruppe berichteten 2001 von<br />
einer Phase II-Studie über die <strong>BCG</strong>-Behandlung von 103 Patienten<br />
mit primären (n=19), sekundären (n=40) und ge misch ten CIS<br />
(primäres und sekundäres CIS zusammen, n=44) . Die Patienten<br />
wurden sechsmal im wöchentlichen Abstand mit 120 mg <strong>BCG</strong><br />
behandelt . Die Patienten, die nicht auf den ersten Zyklus reagiert<br />
haben, wurden mit einem zweiten 6-wöchentlichen <strong>BCG</strong>-Zyklus<br />
behandelt . 77 (75 %) der 103 Patienten zeigten ein Ansprechen auf<br />
<strong>BCG</strong> . Bei 6 von 10 Patienten wurde ein zweiter Instillationszyklus<br />
gegeben . Nach einer medianen Nachbeobachtungszeit von 7,6<br />
Jahren lebten 39 der 77 der Patienten (50 %) noch mit ihrer eigenen<br />
Blase, 31 (40 %) ohne Rezidive . 7 Patienten wurden zystektomiert<br />
und waren noch am Leben und 16 sind an den Folgen des<br />
Blasenkarzinoms gestorben . 10 Patienten brachen die Therapie<br />
wegen Neben wirkun gen ab (s . Abb . 15) .
4.2.3 pt1 G3 karzinom<br />
Harnblasenkarzinome pT1 sind bei 30 % der Patienten zu erwarten .<br />
Harnblasenkarzinome des Stadiums pT1G3 sind im urologischen<br />
Patientengut mit einer Häufigkeit von etwa 5 % zu erwarten (Herr,<br />
1990) . Es handelt sich somit um ein im Vergleich zu pTa weniger<br />
häufig vorkommendes Tumorstadium (Kirkali et al .2005), welches<br />
jedoch wegen der Progression und verkürzten Lebens erwar tung<br />
eine große Bedeutung hat (Böhle & Jocham, 2000) .<br />
Ca . 20 % der Patienten mit T1-Tumoren werden innerhalb von 5<br />
Jahren sterben (Heney et al ., 1983; Lutzeyer et al ., 1982; Pryor,<br />
1973; Anderström et al ., 1980) .<br />
Es stellt sich somit die Frage, ob diese Tumore bereits initial wie<br />
muskelinfiltrierende Karzinome radikal mit Zystektomie und Harnableitung<br />
behandelt werden sollten oder konservativ wie die<br />
übrigen nicht muskelinvasiven Karzinome .<br />
Daten zur TUR dieser Tumoren mit einer adjuvanten <strong>BCG</strong>-<br />
Immuntherapie zeigen gute Ergebnisse . Mehrere retrospektive<br />
Studien bestätigen die Effizienz von <strong>BCG</strong> bei diesem Pa tien ten gut<br />
(Lebret et al ., 1998a; Lebret et al ., 1998b; Bennett et al ., 1992;<br />
Pham & Soloway, 1997; Zhang et al ., 1996; Gohji et al ., 1999; Lee<br />
et al ., 1997) . Diese Studien zeigen eine An sprechrate zwischen 70<br />
und 80 % . Diese Daten zeigen außerdem, dass ca . 70 % dieser<br />
Patienten mit eigener Harnblase lange überleben (Böhle, 1997a;<br />
Böhle & Jocham, 2000) .<br />
Das pT1G3 Harnblasenkarzinom ist ein potenziell aggressiver<br />
Tumor, welcher nicht als oberflächlich, sondern als oberflächlich<br />
invasiv bezeichnet werden könnte . Das bekannte erhöhte<br />
Rezidiv- und Progressionsrisiko erfordert sorgfältige und individuelle<br />
Therapieentscheidungen . Während das rezidivierende<br />
pT1G3-Karzinom einer radikalen Therapie zugeführt werden sollte,<br />
ist beim primären pT1G3-Karzinom zunächst ein konservativer<br />
Therapieversuch gerechtfertigt . Voraussetzung für einen derartigen<br />
Therapieversuch ist die Resektion des Primärtumors und<br />
Nachresektion bis zur Tumorfreiheit . Die anschließende intravesikale<br />
Prophylaxe sollte vorzugsweise durch <strong>BCG</strong> mit Erhaltungstherapie<br />
erfolgen, welches zumindest bei dem genannten Risikoprofil eine<br />
erhöhte Effektivität im Vergleich zur intravesikalen Chemotherapie<br />
verspricht (Böhle & Jocham, 2000) .<br />
Die Nachkontrolle sollte alle 3 Monate erfolgen, wobei hier wiederholte<br />
Biopsieentnahmen aus dem ehemaligen Tumorbereich<br />
und weiteren suspekten Arealen zu fordern sind . Falls ein Rezidiv<br />
eintritt, so ist im Tumorstadium T1G3 die Zystektomie zu emp-<br />
45
46<br />
Abb. 16:<br />
Kaplan-Meier Kurve für<br />
die Überlebenszeit unter <strong>BCG</strong>-<br />
Therapie<br />
(aus Brake et al., 2000)<br />
fehlen . Falls das Rezidiv ein pTa-Tumor ist, kann ein 2 . <strong>BCG</strong>-<br />
Behandlungszyklus angeschlossen werden . Bei Rezidiv freiheit<br />
sollte eine intravesikale Erhaltungstherapie durch 3-malige <strong>BCG</strong>-<br />
Instillationen nach 3, 6, 12, 18, 24, 30 und 36 Monaten erfolgen<br />
(Lamm et al ., 2000; Böhle & Jocham, 2000) .<br />
Eine derartige Strategie kann die Blase bei etwa 70 % der Patienten<br />
erhalten . Auch bei Patienten, bei denen eine Organerhaltung<br />
im weiteren Verlauf nicht möglich ist, zeigte sich kein erhöhtes<br />
Metastasierungsrisiko verglichen mit Pa tien ten, die gleich radikal<br />
zystektomiert werden (Böhle & Jocham, 2000) .<br />
Brake et al . haben 2000 die Entstehung von Rezidiven und den<br />
Progressionsverlauf beim pT1-Harnblasenkarzinom bei 123<br />
Patienten untersucht . Bei 44 (36 %) dieser Patienten war der<br />
Differenzierungsgrad G3 festzustellen . Von diesen Patienten blieben<br />
36 (82 %) tumorfrei nach 1 oder 2 <strong>BCG</strong>-Zyklen . Rezidive sind bei 5<br />
(11%) der Patienten aufgetreten und 7 (16 %) der Pa tienten zeigten<br />
eine muskelinvasive Progression . Eine Rad ikale Zystektomie wurde<br />
in 4 (9 %) Fällen durchgeführt und 5 (11%) Patienten verstarben<br />
an den Folgen des Tumors (s . Abb . 16) .<br />
Diese Untersuchung zeigt ebenfalls, dass eine radikale Zystektomie<br />
nach einer intravesikalen Therapie mit <strong>BCG</strong> für die meisten Fälle<br />
nicht nötig ist (Brake et al ., 2000) .<br />
Hurle et al . haben 1999 51 pT1G3-Karzinom-Patienten mit <strong>BCG</strong><br />
behandelt . Diese Patienten wurden nach der TUR sowohl mit<br />
Induktions- als auch mit Erhaltungstherapie behandelt . Nachbeobachtungszeit<br />
war mindestens 5 Jahre oder bis zum Tod . Die<br />
mediane Nachbeobachtungszeit von progressionsfreien Patienten<br />
war 85 Monate (64 bis 108) . In dieser Zeit blieben 32 (62,7 %)<br />
progressionsfrei, 9 (17,6 %) hatten eine Tumorpro gression, 8<br />
(15,7 %) starben aus anderen Gründen und 2 (3,9 %) hatten die<br />
Nachbeobachtung abgebrochen . Sieben Patienten hatten extravesikale<br />
Befunde (Tumor des oberen Harntraktes, Prostatakarzinom) .<br />
Krankheitsspezifisches Über leben war 86,3 % (s . Abb . 17) .
Abb. 17:<br />
Progressionsfreie<br />
Überlebensrate bei<br />
51 Patienten mit pT1G3-<br />
Harnblasenkarzinom<br />
(nach Hurle et al.,1999)<br />
1998 haben Baniel et al . 78 Patienten mit pT1G3-Karzinom nach<br />
TUR mit <strong>BCG</strong> behandelt . Mediane Nachbeobachtungs zeit war 56<br />
Monate .<br />
Nach dem <strong>BCG</strong>-Initialzyklus waren 52 (67 %) Patienten tumorfrei .<br />
22 Patienten (28 %) zeigten Rezidive nach einer medianen Zeit von<br />
7 Monaten . Progression zeigten 6 (7,7 %) Patienten nach durchschnittlich<br />
18 Monaten .<br />
Pansadoro et al . haben zwischen 1989 und 1997 670 Patien ten<br />
transurethral reseziert . 81 davon (12 %) hatten pT1G3 und wurden<br />
nach TUR mit <strong>BCG</strong> therapiert . Die <strong>BCG</strong>-Behandlung wurde in vier<br />
Instillationszyklen unterteilt, wobei in jedem Zyklus sechsmal instilliert<br />
wurde . Im ersten Zyklus wurde in wöchentlichem Abstand, im<br />
zweiten alle 2 Wochen, im dritten monatlich und im vierten alle 3<br />
Monate instilliert .<br />
69 Patienten (84 %) haben mindestens die ersten zwei Instillationszyklen<br />
abgeschlossen . Nach einer medianen Nachbeobachtungszeit<br />
von 76 Monaten lag die Gesamtrezidivrate bei 33 %<br />
(27 von 81 Pat .) . Von diesen Patienten zeigten 12 (15 %) eine<br />
Progression nach im Mittel 16 Monaten . Eine Zystektomie wurde<br />
bei 7 (8 %) durchgeführt . Die Gesamtmortalität betrug 6 %<br />
(5 der 81 Pat .) . 60 Patienten (74 %) waren am Leben nach einer<br />
Nachbeobachtungszeit von 79 Monaten . Von diesen leben 56 Pat .<br />
(69 %) mit ihrer eigenen Harnblase (Pansadoro et al ., 2002) .<br />
Davis et al. behandelten zwischen 1981 und 1989 98 Patienten mit<br />
high risk oder rezidivierenden Karzinomen mit TUR und anschließenden<br />
ein- oder sechswöchigen Instillationszyklen mit <strong>BCG</strong> .<br />
Die Patienten wurden weiter bis ins Jahr 2000 sorgfältig beobachtet<br />
. Es wurde dabei keine <strong>BCG</strong>-Erhaltungstherapie durchgeführt<br />
. Bei 44 der Patienten wurde CIS mit oder ohne papilläre<br />
Tumoren, bei 35 pT1G3 diagnostiziert . Bei 27 der 98 Patienten<br />
mit einem Minimum follow up größer als 10 Jahre zeigte sich eine<br />
Progression in das T2-Stadium innerhalb von 30,7 Monaten . Bei<br />
16 davon wurde eine Zystektomie durchgeführt . Das progressionsfreie<br />
10-Jahres-Überleben lag bei 67 %, und das progressionsfreie<br />
47
48<br />
Abb. 18A:<br />
Progressionsfreies<br />
Überleben von Patienten mit<br />
T1-Tumoren und mit oder<br />
ohne begleitendes CIS<br />
(nach Davis et al., 2002).<br />
Abb. 18B:<br />
Krankheitsspezifisches<br />
Überleben bei Patienten mit<br />
T1-Tumor und mit oder ohne<br />
begleitendes CIS<br />
(nach Davis et al., 2002).<br />
Überleben mit erhaltener Harnblase betrug 59 % (s . Abb . 18A/B) .<br />
Die Gesamtzystektomierate war 26 % . Das krankheitsspezifische<br />
10-Jahres-Überleben lag bei 85 % (Davis et al ., 2002) .<br />
Die optimale Therapie des T1G3-CA wird in der Publikation von<br />
Manoharan & Soloway et al . 2005 erläutert .<br />
Bei Vorliegen eines T1G3-Karzinoms sind die folgenden prognostischen<br />
Faktoren zu berücksichtigen:<br />
• Frühes Rezidiv nach TUR und <strong>BCG</strong><br />
• Begleitendes CIS<br />
• Tumorbeteiligung in der prostatischen Urethra<br />
• Tiefe der Lamina propria-Invasion<br />
Die Durchführung der Frühinstillation unmittelbar nach TURB und<br />
die Nachresektion sind zwei Schlüsselfaktoren, die zur Rettung der<br />
Blase und des Patienten beitragen können .<br />
Manoharan & Soloway et al . empfehlen folgendes Therapie-<br />
Stufenschema:
Tab. 12:<br />
Progressionsraten des HBCA<br />
(nach Malmström et al., 1987;<br />
Heney et al.,1983,<br />
Lamm, 1992).<br />
Schlechte prognostische<br />
Faktoren<br />
Zystektomie<br />
4.2.4 tumorprogression und BcG-therapie<br />
T1G3<br />
TUR +<br />
Frühinstillation<br />
Begleitende Zystoskopie +<br />
Zytologie<br />
Auch Nieder et al . 2005 stellen in ihrer Publikation das Management<br />
des T1-Blasentumors vor .<br />
Sie empfehlen neben der TURB und reTURB zunächst eine<br />
Frühinstillation . Das Vorliegen von prognostischen Faktoren wie CIS<br />
und die Tiefe der Lamina-propria-Invasion indiziieren Zystektomie .<br />
Daneben ist die intravesikale Therapie mit <strong>BCG</strong> Mittel der Wahl .<br />
Die Patienten sollten vorab über die Risiken beider Behandlungsmethoden<br />
informiert werden .<br />
Die reTUR spielt eine entscheidende Rolle: Erst wenn eine Muskelinvasion<br />
ausgeschlossen ist, soll mit <strong>BCG</strong> therapiert werden .<br />
Eines der wichtigsten Ziele der Therapie des Harnblasen karzinoms<br />
ist die Verhinderung der Progression des Tumors in ein muskelinvasives<br />
Stadium .<br />
Die Progressionsraten beim Ta-, T1- und CIS-Karzinom sehen wie<br />
folgt aus: (s . Tab . 12)<br />
Tumortyp % Progression<br />
Ta 4-15<br />
T1 29-50<br />
CIS 15-37<br />
ReTUR innerhalb 4 Wochen<br />
Wöchentlich <strong>BCG</strong> 6x<br />
Kein Tumor Low grade/stage T1G3/ CIS T2<br />
Erhaltungstherapie<br />
mit <strong>BCG</strong><br />
TUR + <strong>BCG</strong> (INF<br />
oder MMC)<br />
Nachbeobachtung Nachbeobachtung<br />
Zystektomie<br />
Zystektomie<br />
(Chemo + Radiatio)<br />
Ob <strong>BCG</strong> den Zeitpunkt der Progression verhindert oder verzögert,<br />
wird immer noch kontrovers diskutiert . Manche Studien zeigen<br />
einen Einfluss, andere aber nicht . Diese Diskrepanz liegt zum größ-<br />
49
50<br />
Abb. 19:<br />
Studien und Progression<br />
(Vorteil mit und<br />
ohne <strong>BCG</strong>-Therapie)<br />
(nach Sylvester et al., 2002)<br />
ten Teil an den kurzen follow up Zeiten und der kleinen Anzahl von<br />
Progressionen, die bei individuellen Studien beobachtet werden .<br />
Sylvester et al ., 2002, haben im Rahmen einer Metaanalyse den<br />
Einfluss von <strong>BCG</strong> auf die Progression analysiert .<br />
Es wurden 24 Studien mit insgesamt 4 .863 Patienten zusammengefasst<br />
mit einem medianen follow up von 2,5 Jahren (s . Abb .<br />
19) . In der mit <strong>BCG</strong> behandelten Gruppe (2 .658 Pat .) zeigten<br />
260 Patienten eine Progression . In der Nicht-<strong>BCG</strong>-Gruppe<br />
(2 .205 Pat .) zeigten 304 eine Progression . Das bedeutet eine<br />
Reduktion der Progression in der <strong>BCG</strong>-Gruppe um 27 % . Dies ist<br />
die erste Metaanalyse, die einen positiven Effekt von <strong>BCG</strong> auf die<br />
Progression belegt .<br />
Insgesamt zeigten relativ wenig Patienten eine Progression (6,4 %<br />
mit papillären Tumoren und 13,9 % mit CIS) . Dies liegt am kurzen<br />
follow up und der Tatsache, dass viele Patienten mit Low-risk-<br />
Tumoren in diese Studien eingebracht wurden .<br />
Der positive Effekt der <strong>BCG</strong>-Behandlung war außerdem nur bei<br />
Durchführung einer Erhaltungstherapie nachweisbar .<br />
Fälle/Patienten Fälle/Patienten Statistik mit <strong>BCG</strong> Ohne <strong>BCG</strong><br />
Publ. Jahr Autor (Gruppe) ohne <strong>BCG</strong> mit <strong>BCG</strong> (O-E) Var.<br />
1997 Cookson (MSKCC) 23/43 23/43 0 5,4<br />
1991 Pagano (Padova) 11/63 3/70 -4,4 3,1<br />
1987 Badalament (MSKCC) 6/46 6/47 -0,1 2,6<br />
200 Lamm (SW8507) 102/192 87/192 -7,5 24,1<br />
2001 Palou 2/61 3/65 0,4 1,2<br />
1996 Rintala (Finnbl 2) 3/90 3/92 0 1,5<br />
1995 Rintala (fFinnbl 2) 4/40 2/28 -0,5 1,3<br />
1998 Witjes (Dutch) 4/92 5/90 0,5 2,2<br />
1995 Lamm (SW8795) 24/186 15/191 -4,8 8,8<br />
1999 Malmström (Sw-N) 22/125 15/125 -3,5 7,9<br />
2001 Noguiera (CUETO) 8/127 10/247 -1,9 3,9<br />
1991 Rintala (Finnbl 1) 2/58 3/51 0,7 1,2<br />
1995 Vegt (Dutch) 8/148 15/289 -0,2 4,9<br />
1998 Witjes (EORTC Dutch) 12/173 21/171 4,6 7,5<br />
2001 de Reijke (EORTC) 18/84 10/84 -4 5,9<br />
2001 vd Meijden (EORTC) 19/279 24/558 -4,7 9,1<br />
1982 Brosman (UCLA) 0/22 0/27 0 0<br />
1990 Martinez-Pineiro 4/109 1/67 -0,9 1,2<br />
1999 Witjes (Eur Bropir) 2/25 1/28 -0,6 0,7<br />
1997 Jimenez-Cruz 7/61 6/61 -0,5 2,9<br />
1994 Kälble 2/35 0/32 -1 0,5<br />
1991 Kälble 2/17 0/21 -1,1 0,5<br />
1993 Melekos (Patras) 7/99 2/62 -1,5 2<br />
1988 Ibrahiem (Egypt) 12/30 5/17 -1,1 2,6<br />
0,0 0,5 1,0 1,5 2,0<br />
Therapieeffekt: p=0,001<br />
Verglichen mit der Arbeit von Sylvester et al . haben Shahin et al .<br />
2002 153 Patienten mit primärem pT1G3-Tumor mit <strong>BCG</strong> behandelt<br />
und u .a . Progression, Rezidiv- und Überlebensrate untersucht .<br />
92 Patienten haben nach TUR eine zusätzliche <strong>BCG</strong>-Therapie<br />
erhalten im Gegensatz zu den übrigen 61, die nur mit TUR behandelt<br />
wurden . Es bekamen jedoch nur 22 % dieser Patienten mehr<br />
als einen Instillationszyklus <strong>BCG</strong> .<br />
Die Progressionsrate lag bei 33 % im TUR+<strong>BCG</strong>-Arm verglichen<br />
mit 36 % im TUR-Arm . Die Autoren berichten, dass durch die<br />
<strong>BCG</strong>-Therapie der Zeitpunkt des Auftretens von Rezidiven und<br />
der Zystektomie verschoben wird, allerdings wird das End ergeb nis<br />
nicht signifikant beeinflusst .
4.3 Urotheltumoren spezieller Lokalisationen<br />
4.3.1 oberer Harntrakt<br />
Karzinome des oberen Harntraktes sind eher selten . Es wird angenommen,<br />
dass sich 5 % der Urothelkarzinome im oberen Harntrakt<br />
befinden (Tawfiek & Bagley, 1997) . Die Nephroure terektomie stellt<br />
die Therapie der Wahl dar . Nur in Ausnahme fällen kann oder muss<br />
eine organerhaltende Behandlung durchgeführt werden . Nach derartigen<br />
organerhaltenden Behand lungen oberflächlicher Tumoren<br />
wird die Rezidiv häufigkeit auf der ipsilateralen Seite mit 7-28 %<br />
beschrieben . Tumoren im kontralateralen oberen Hohlsystem treten<br />
in 0,5 bis 2 % auf (Blute et al ., 1989; Kantor et al ., 1986) .<br />
Während die intravesikale <strong>BCG</strong>-Instillationstherapie oberflächlicher<br />
Urothelkarzinome der Harnblase eine anerkannte und hoch effektive<br />
Therapie darstellt, ist diese Behandlung für Karzinome im oberen<br />
Harntrakt aufgrund der geringen Inzidenz bisher nicht etabliert .<br />
Es liegen in der Literatur diverse Berichte zu dieser Therapie vor<br />
(Studer et al . 1989; Böhle et al ., 1989a; Böhle et al ., 1992c; Böhle<br />
et al ., 1992b; Sharpe et al ., 1993; Bellman et al ., 1994) . So führten<br />
Studer et al . 1989 eine <strong>BCG</strong>-Perfusion des oberen Hohlsystems<br />
zur Behandlung des ureteralen CIS bei 8 Patienten durch .<br />
Seitdem haben mehrere Gruppen über ihre Erfahrungen in diesem<br />
Gebiet berichtet (Yokogi et al ., 1996; Schnapp et al ., 1996; Patel &<br />
Fuchs, 1998; Clark et al ., 1999; Bassi et al ., 2001; Irie et al ., 2002;<br />
Tavolini et al ., 2002; Okubo et al ., 2002; Iborra et al ., 2003) .<br />
Böhle et al . berichteten 1992 über eine prospektive klinische<br />
Untersuchung, bei der die Verträglichkeit und Langzeit ergebnisse<br />
der Rezidivprophylaxe mit <strong>BCG</strong> im oberen Harntrakt bei 15<br />
Patienten analysiert wurden .<br />
Die Behandlung wurde wie folgt durchgeführt:<br />
Nach vollständiger Wundheilung, d .h . etwa 4-6 Wochen nach offener<br />
Operation bzw . 2-4 Wochen nach endoskopischer Resektion,<br />
erfolgte die <strong>BCG</strong>-Instillation in das obere Hohlsystem: Entsprechend<br />
der für die Blase vorgesehenen <strong>BCG</strong>-Instillationsmenge wurde perfusorgesteuert<br />
über 2 Stunden instilliert . Die Perfusorspritze wurde<br />
an ein 3-Wege-System angeschlossen, wobei ein Schenkel<br />
15 cm oberhalb des Hohlsystems abgeschnitten und an einem<br />
Infusionsständer in dieser Höhe fixiert wurde . Hierdurch konnten<br />
intrapelvine Drucke >15 cm Wassersäule vermieden werden, so dass<br />
ein pyelovenöser Influx mit konsekutiv möglicher Einschwemmung<br />
von <strong>BCG</strong> vermieden wurde . Die Instillation erfolgte über eine perkutane<br />
Nephrostomie in 10 Hohlsysteme und über einen jeweils vor<br />
Instillation in Lokalanästhesie eingelegten 4 Charr . Ureterenkatheter<br />
(UK) in 7 Hohlsysteme (Böhle & Jocham, 2000) (s . Tab . 13) .<br />
51
52<br />
Tab. 13:<br />
Nebenwirkungen und<br />
Ergebnisse der <strong>BCG</strong>-<br />
Therapie im oberen Harntrakt.<br />
Auswertung von<br />
126 Instillationen<br />
(nach Böhle et al., 1992c).<br />
4.3.2 Prostata<br />
Zweiter <strong>BCG</strong>-Zyklus 4 Hohlsysteme<br />
Anzahl Zyklen 21<br />
Anzahl Instillationen 126<br />
Nebenwirkungen<br />
Temperatur < 38,5 °C 60 %<br />
Fieber > 38,5 °C 9 %<br />
systemische . Infektion 0<br />
verlängerte Hospitalisierung 3 %<br />
Nachbeobachtungszeit 42 (8-51 Monate)<br />
Behandlungsergebnisse<br />
rezidivfrei 12 Pat . (80 %)<br />
lebend 10 Pat . (67 %)<br />
verstorben 2 Pat . (13 %)<br />
verstorben an Tumor 3 Pat . (20 %)<br />
Zusammenfassend kann die Rezidivprophylaxe des Urothelkarzinoms<br />
im oberen Hohlsystem mit <strong>BCG</strong> als mögliche konservative<br />
Therapie bezeichnet werden .<br />
Das Urothelkarzinom der prostatischen Harnröhre ist schwierig<br />
zu behandeln und hat eine schlechte Prognose (Schellhammer &<br />
Whitemore, 1976) . Die radikale Prostatektomie ist in diesen Fällen<br />
ein häufig praktiziertes Verfahren .<br />
Das CIS der prostatischen Harnröhre hat ein von der Infiltrationstiefe<br />
abhängiges hohes Progressionspotential . So zeigten sich bei 11 %<br />
der Patienten mit Urothelkarzinom der Prostata Metastasen, während<br />
100 % der Patienten mit Invasion des Stromas trotz radikaler<br />
Operation Fernabsiedlungen entwickelten (Wishnow & Ro, 1988) .<br />
Wenn jedoch das CIS nur auf das Urothel der prostatischen<br />
Harnröhre beschränkt ist, ist eine Behandlung mit <strong>BCG</strong> möglich .<br />
Hillyard et al . behandelten 1988 8 Patienten mit CIS der prostatischen<br />
Harnröhre, welches lediglich auf die Mukosa beschränkt<br />
war . Es wurde <strong>BCG</strong> nicht direkt in die prostatische Harnröhre<br />
instilliert und auch nicht die Prostata reseziert, sondern es wurde<br />
eine normale intravesikale Instillation durchgeführt . Dennoch konnte<br />
eine vollständige Remission des CIS der Prostata bei 7 dieser 8<br />
Patienten erzielt werden (Hillyard et al ., 1988) .
4.3.3 Distale Urethra<br />
5.0 therapie von Risikogruppen<br />
Bassi et al . (1997) behandelten zwischen 1989 und 1996 27<br />
Patienten mit intravesikaler <strong>BCG</strong>-Immuntherapie . Die Indikation<br />
für diese Therapie war Tumor der urethralen Mukosa . Die<br />
Patienten haben 6x <strong>BCG</strong> in wöchentlichem Abstand bekommen .<br />
Ein zusätzlicher 6wöchiger <strong>BCG</strong>-Zyklus wurde gegeben, wenn<br />
Rezidive ohne Progression dokumentiert wurden . Wenn nach<br />
der Induktionstherapie oder dem zweiten Instillations zyklus eine<br />
Remission auftrat, wurde eine <strong>BCG</strong>-Erhaltungs therapie einmal<br />
monatlich im ersten Jahr und einmal jedes Quartal im zweiten Jahr<br />
gegeben . Zusätzlich wurden alle papillären Tumore mit TUR entfernt<br />
.<br />
Die lokale Responserate betrug 78 % (21 Patienten) . Lokale<br />
Progression wurde bei 3 Patienten (11 %) festgestellt . Fünf der<br />
Responder (19 %) haben Rezidive der prostatischen Urethra während<br />
des follow up ohne Anzeichen von Progression ent wickelt .<br />
Diese Arbeiten zeigen, dass eine Therapiemöglichkeit des CIS der<br />
prostatischen Urethra mit <strong>BCG</strong>-Instillation besteht . Die empfohlene<br />
Methode ist nach dem Durchführen einer üblichen Instillation,<br />
die letzten 5-10 ml des Instillats unter Zurückziehen des Katheters<br />
in die Urethra zu platzieren . Zweckmäßigerweise komprimiert der<br />
Patient selbst beim Entfernen des Katheters den Meatus, so dass<br />
das Instillat nicht herausläuft (Böhle & Jocham, 2000) .<br />
Neben der prostatischen Urethra, kann die distale Urethra bei individuellen<br />
Fällen ebenfalls mit <strong>BCG</strong> behandelt werden . Es ist allerdings<br />
ein direkter Kontakt zwischen Urothel und <strong>BCG</strong> erforderlich,<br />
um eine effektive Therapie zu erreichen, d .h . <strong>BCG</strong> muss direkt<br />
in die Urethra appliziert werden (Böhle & Jocham, 2000; Herr &<br />
Whitmore, 1987) .<br />
5.1 BcG-therapie bei immunsupprimierten Patienten<br />
Die Erkennung von immunsupprimierten Patienten und deren<br />
prophylaktischer Ausschluss von einer <strong>BCG</strong>-Therapie ist von<br />
großer Bedeutung: Nahezu alle tödlichen Verläufe nach <strong>BCG</strong>-<br />
Immunisierung im Rahmen einer intrakutanen Tuberkulose-<br />
Prophylaxe (35 von 1500 Millionen Impfungen) betrafen Kinder<br />
mit zellulären Immundefekten . Die intravesikale <strong>BCG</strong>-Instillation<br />
bei zwei HIV-positiven Patienten führte allerdings zu keiner<br />
Komplikation, wenngleich auch kein therapeutischer Effekt zu<br />
53
54<br />
erkennen war (Lamm, 1993) .<br />
Zur Gruppe der immunsupprimierten Patienten zählen solche<br />
mit aktiver Tuberkulose, angeborenen Immunmangelsyndromen<br />
oder HIV-positive Patienten . Auch Patienten mit Leukämie oder<br />
Morbus Hodgkin haben gelegentlich zelluläre Immundefekte .<br />
Transplantierte Patienten sollten ebenfalls kein <strong>BCG</strong> erhalten . <strong>BCG</strong><br />
sollte auch nicht während der Schwangerschaft und der Stillzeit<br />
angewendet werden (Böhle & Jocham, 2000) .<br />
5.2 BcG-therapie bei vorbestrahlten Patienten<br />
5.3 BcG-therapie bei Reflux-Patienten<br />
Grossman berichtete 1993, dass sich bei vorbestrahlten Patienten<br />
nach <strong>BCG</strong>-Therapie eine Schrumpfblase entwickelt hat . Dies<br />
machte eine Zystektomie mit supravesikaler Harn ableitung erforderlich<br />
. Alle Fälle waren mit mindestens 40 Gy vorbestrahlt .<br />
Konträre Ergebnisse sind allerdings von Zietman et al . 1998 und<br />
Palou et al . 1999 vorgestellt worden .<br />
Zietman berichtet von eine Serie von Patienten, die gegen muskelinvasive<br />
Tumore radiotherapiert waren . Bei 3 Patienten, die erfolgreich<br />
intravesikal mit <strong>BCG</strong> behandelt wurden, sind oben erwähnte<br />
Komplikationen nicht aufgetreten .<br />
Palou hat 13 vorbestrahlte Patienten mit <strong>BCG</strong> nachbehandelt,<br />
ohne dass weitere Nebenwirkungen beobachtet wurden .<br />
Diese Daten zeigen eine gute Verträglichkeit von <strong>BCG</strong> auch wenn<br />
die Patienten vorbestrahlt sind . Sollte die Strahlendosis 40 Gy<br />
überschritten haben, muss die intravesikale Behandlung mit <strong>BCG</strong><br />
mit äußerster Vorsicht stattfinden und nur dann angewendet werden,<br />
wenn keine andere Therapiemöglichkeit besteht (Böhle &<br />
Jocham, 2000) .<br />
Nach wiederholter TUR kann in 19-48 % ein vesikoureteraler bzw .<br />
vesikorenaler Reflux auftreten (Freed 1979; Gottfries 1975) .<br />
Böhle et al ., 1990, berichteten über die <strong>BCG</strong>-Therapie bei 14<br />
Patienten mit vesikorenalem Reflux . Bei einem Patienten mit Doppel-<br />
J-Katheter kam es infolge einer Katheterobstruktion zu einer hochfiebrigen<br />
Reaktion . Alle anderen Patienten tolerierten einen sechswöchigen<br />
Instillationszyklus oder zwei Zyklen (6/14 Pat .)<br />
Die topische intravesikale Therapie des Urothelkarzinoms mit <strong>BCG</strong><br />
erscheint bei Vorliegen eines vesikorenalen Refluxes gefahrlos<br />
durchführbar und im Hinblick auf das multifokale Auftreten des<br />
Urothelkarzinoms besonders in dieser Patienten gruppe wünschenswert<br />
zu sein .
6.0 Vergleich mit anderen therapeutika<br />
6.1Vergleich mit Immuntherapeutika<br />
Interferon<br />
Kälble et al ., führten 1994 eine Studie mit 78 Patienten durch,<br />
in der die Patienten entweder 120 mg <strong>BCG</strong> oder 107 Einheiten<br />
Interferon α 2b erhielten . Instillationen erfolgten einmal pro Woche<br />
für 6 Wochen, anschließend einmal pro Monat für 4 Monate und<br />
danach zweimal in vierteljährlichen Abständen, so dass insgesamt<br />
12 Instillationen im ersten Jahr verabreicht wurden .<br />
Die durchschnittliche Nachbeobachtungszeit betrug 24 Monate<br />
(6-32 Monate) . 15,6% der Patienten entwickelten nach <strong>BCG</strong> einen<br />
Rezidivtumor, wobei ein Progress bei 6,3% der Patienten zu verzeichnen<br />
war . In der Interferon-Gruppe hatten 60% der Patienten<br />
ein Rezidiv, welches in 11,4% mit einem Progress einherging .<br />
Die Unterschiede hinsichtlich der Rezidivhäufigkeit sind statistisch<br />
signifikant (p=0,001) . Auch die Stratifikation hinsichtlich<br />
der T1-Tumoren zeigte eine statistisch signifikant geringere<br />
Rezidivhäufigkeit nach Behandlung mit <strong>BCG</strong> (Kälble et al ., 1994) .<br />
Eine weitere prospektive Studie von <strong>BCG</strong> vs . Interferon wurde von<br />
Jimenez-Cruz et al ., 1997 durchgeführt . 122 Patienten mit pT1<br />
G1-G3 wurden mit 150 mg <strong>BCG</strong> oder mit INF-α 2b 54 MU behandelt<br />
. Die Rezidivrate betrug 96,4% in der INF-Gruppe und 39,3%<br />
in der <strong>BCG</strong>-Gruppe . Die Anzahl der Rezidive betrug für die beiden<br />
Gruppen 28 vs . 47 Monate und die krankheitsfreie Zeit betrug 19,3<br />
bzw . 15,3 Monate . Alle Werte waren zugunsten von <strong>BCG</strong> statistisch<br />
signifikant (p=0,001) .<br />
Keyhole-Limpet-Haemocyanin<br />
Keyhole-Limpet-Haemocyanin (KLH) ist eine weitere immunmodulierende<br />
Substanz zur Rezidivprophylaxe des HBCA . Sie wird aus<br />
der Hämolymphe der Schlüssellochnapfschnecke (Keyhole limpet)<br />
gewonnen, ist ein blaues, kupferhaltiges Protein und entspricht<br />
etwa dem Hämoglobin der Säugetiere . KLH wird als Antigen in der<br />
Immunforschung verwendet .<br />
Kälble et al . haben 1991 KLH mit <strong>BCG</strong> bei der Rezidivprophylaxe<br />
des urothelialen HBCA in einer prospektiv randomisierten Studie<br />
verglichen . Nach einer Nachbeobachtungszeit von 20 Monaten<br />
(8-32 Monaten) entwickelten 41,2 % der KLH- und 14,3% der<br />
<strong>BCG</strong>-behandelten Patienten ein Rezidiv (p=0,061) (s . Tab . 14) . Die<br />
KLH-Gruppe zeigte eine höhere Rezidivrate im Vergleich zur <strong>BCG</strong>-<br />
Gruppe, wobei trotz kleiner Fallzahl der Unterschied in der Gruppe<br />
mit pT1-Tumoren statistische Signifikanz erreichte (p=0,024)<br />
(Kälble et al ., 1991)<br />
55
56<br />
Tab. 14:<br />
Vergleichende Studien<br />
von <strong>BCG</strong> gegen andere<br />
Immuntherapeutika<br />
(nach Kälble et al., 1991)<br />
6.2 Vergleich mit chemotherapeutika<br />
therapie Rezidiv Progress Autor<br />
BGC 15 % 6 % Kälble et al ., 1994<br />
INF 60 % 11 % p
Datensammlung und Analyse: Die Eignung der Studien hinsichtlich<br />
ihrer methodischen Qualität und Datenherkunft wurde unabhängig<br />
von 2 Reviewern eingeschätzt . Die Zeit bis zum Ereignis wurde<br />
mittels log hazard ratios analysiert und eine Sensitivitätsanalyse für<br />
Subgruppen entsprechend dem Rezidivrisiko durchgeführt .<br />
25 Artikel wurden gefunden, aber nur 7 wurden als geeignet<br />
betrachtet . Diese umfassten insgesamt 1901 Patienten, 820 randomisiert<br />
zu Mitomycin und 1081 zu <strong>BCG</strong> . 6 Studien hatten ausreichend<br />
Daten für eine Metaanalyse und umfassten 1527 Patienten,<br />
693 im Mitomycin-Arm und 834 im <strong>BCG</strong>-Arm . Das mittlere gewichtete<br />
log hazard ratio (Varianz) für ein Tumorrezidiv dieser 6 Studien<br />
war –0,022 (0,005) . Dies war nicht signifikant zwischen MMC und<br />
<strong>BCG</strong> (p = 0,76) . Allerdings zeigte die Metaanalyse eine signifikante<br />
Heterogenität zwischen den einzelnen Studien (p = 0,001) .<br />
Eine Subgruppenanalyse von 3 Studien, die nur high risk Ta und<br />
T1 Patienten enthielten, zeigte keine Heterogenität (p = 0,25) und<br />
die log hazard ratio (Varianz) für ein Rezidiv von -0 .371 (0,012) .<br />
Nimmt man Mitomycin als Kontrolle in der Metaanalyse, zeigt eine<br />
negative Ratio einen Vorteil von <strong>BCG</strong> an, der in diesem Fall hoch<br />
signifikant ist (p = 0,0008) .<br />
Die siebte Studie benutzte <strong>BCG</strong> low dose in zwei Armen (27mg<br />
und 13,5mg) im Vergleich zu einer Standarddosis Mitomycin C<br />
(30mg) . Sie gab eine signifikant reduzierte Rezidivrate mit <strong>BCG</strong><br />
27mg im Vergleich zu Mitomycin C an (p = 0,001) .<br />
Nur zwei Studien lieferten genügend Daten zur Analyse der<br />
Progression und des Überlebens . Diese repräsentierten 681<br />
Patienten; davon 338 <strong>BCG</strong>- und 343 MMC-Patienten . Hier gab<br />
es keinen signifikanten Unterschied zwischen MMC und <strong>BCG</strong> hinsichtlich<br />
einer Progression (log hazard ratio und Varianz: 0,044 +<br />
0,04, p = 0,16), für Überleben (-0,112 + 0,03 p = 0,5) .<br />
Lokale Nebenwirkungen (Dysurie, Zystitis, Pollakisurie und<br />
Hämaturie) waren sowohl mit MMC (30 %) als auch <strong>BCG</strong> (44 %)<br />
assoziiert . Systemische Nebenwirkungen wie Schüttelfrost, Fieber<br />
und allgemeines Krankheitsgefühl waren mit MMC und <strong>BCG</strong> zu<br />
12% bzw . 19 % assoziiert, wobei Hautausschläge häufiger bei<br />
Mitomycin auftraten .<br />
Die Daten dieser Metaanalyse zeigen, dass ein Tumorrezidiv mit<br />
<strong>BCG</strong> im Vergleich zu MMC signifikant nur in der Subgruppe der<br />
high risk Patienten reduziert werden kann . Es gab jedoch keinen<br />
Unterschied in Bezug auf Tumorprogression oder Überleben Die<br />
Entscheidung, welche Substanz verwendet wird, könnte somit von<br />
Nebenwirkungen und Kosten abhängig gemacht werden .<br />
57
58<br />
Huncharek & Kupelnick 2003 haben den Einfluß der intravesikalen<br />
Chemotherapie versus <strong>BCG</strong> Immuntherapie auf Rezidive oberflächlicher<br />
Übergangsepithelkarzinome der Blase untersucht .<br />
In dieser Arbeit wird eine Metaanalyse zur Untersuchung der existierenden<br />
Daten zu dieser Thematik durchgeführt, um den relativen<br />
Effekt beider Behandlungsmodalitäten auf das Tumorrezidiv<br />
zu quantifizieren . Ein prospektives Protokoll für die Metaanalyse<br />
wurde entwickelt, gefolgt von einer sorgfältigen Suche der publizierten<br />
Literatur mit strengen Auswertungskriterien . 9 randomisierte<br />
Studien wurden gefunden, die die Spezifikation des Protokolls<br />
erfüllten . Diese beinhalteten Daten von 2261 Patienten, die statistisch<br />
mit dem Peto-Modell kombiniert wurden . Endpunkt war der<br />
Anteil von Patienten mit Rezidiven nach 1, 2 und 3 Jahren intravesikaler<br />
Therapie (d .h . eine „Summen odds ratio“, ORp) .<br />
Bei der Kombination aller 9 Studien zum 1-Jahres-Rezidivzeitpunkt<br />
zeigte sich eine kombinierte odds ratio zum Vorteil von <strong>BCG</strong> von<br />
0,89 bei allerdings signifikanter statistischer Heterogenität . Letztere<br />
schließt ein statistisches Pooling der Daten aus . Es wurde daraufhin<br />
eine Sensitivitätsanalyse durchgeführt, um die Ursache für die<br />
Heterogenität zu finden . Es zeigte sich, dass eine Vorbehandlung<br />
der Patienten mit Chemotherapie in einer großen Zahl der randomisierten<br />
Studien einen Vorteil zugunsten von <strong>BCG</strong> bewirkte .<br />
Nachdem die Daten nach Vorhandensein und nicht Vorhandensein<br />
einer Vorbehandlung mit intravesikaler Chemotherapie stratifiziert<br />
wurden, zeigte die intravesikale Chemotherapie eine Reduktion der<br />
1, 2 und 3 Jahresrezidive von 21 - 82 % gegenüber <strong>BCG</strong>, abhängig<br />
vom Endpunkt .<br />
Die zur Verfügung stehenden Daten zeigen, dass klinische<br />
Untersuchungen, die intravesikales <strong>BCG</strong> mit einer intravesikalen<br />
Chemotherapie vergleichen, nach Vorhandensein oder<br />
nicht Vorhandensein einer Vortherapie mit Chemotherapie stratifiziert<br />
werden müssen . Rezidive nach Vorbehandlung mit intravesikaler<br />
Chemotherapie sprechen schlechter auf eine erneute<br />
Chemotherapie an als chemotherapie-naive Patienten .<br />
Die z . Zt . empfundene Überlegenheit der <strong>BCG</strong>-Therapie könnte<br />
daher ein Artefakt dieses Phänomens sein, weil die meisten<br />
randomisierten Studien auch Chemotherapie-Versager in ihre<br />
Chemotherapie-Behandlungsarme randomisiert haben .<br />
2007 wurde die Arbeit von Gårdmark et al . aus Schweden vorgestellt<br />
.<br />
Ziel dieser Arbeit ist es, die Ergebnisse der Nachbeobachtungszeit<br />
von 10 Jahren bei high-risk HBCA-Patienten, die entweder mit<br />
40mg Mitomycin C oder <strong>BCG</strong> behandelt wurden, zu dokumentieren<br />
. Viele der vorhandenen Studien haben eine kurze
Abb. 20:<br />
Kaplan-Mayer Kurve des<br />
Follow-up nach <strong>BCG</strong>bzw.<br />
Chemotherapie<br />
(nach Gårdmark et al.2007)<br />
7.0 Ausblick<br />
Nachbeobachtungszeit, daher war der Bedarf an Langzeitdaten<br />
über das Progressions- und Überlebensverhalten dringend nötig .<br />
Zwischen 1987 und 1992 wurden 261 Patienten mit T1G3, primären<br />
CIS oder schnell rezidivierenden Ta/T1G1-2 randomisiert<br />
und entweder mit Mitomycin C 40mg oder <strong>BCG</strong> (Dänischer Stamm<br />
1331) behandelt . Sie wurden zunächst 6x in wöchentlichem<br />
Abstand und dann über ein Jahr 1x im Monat und schließlich 1x<br />
alle 3 Monate im 2 . Jahr instilliert .<br />
Medianer follow-up waren 123 Monate . 58 Patienten (23%) zeigten<br />
eine Progression; davon 23 in der Mitomycin-Gruppe und 24 in<br />
der <strong>BCG</strong>-Gruppe (p=0,26) . Von den 140 Patienten, die starben,<br />
gehörten 68 zur <strong>BCG</strong>-Gruppe und 72 zur Mitomycin-Gruppe<br />
(p=0 .98) . Die meisten (95% bzw . 68%) starben an anderen<br />
Ursachen als Blasenkrebs .<br />
FAZIT: Diese follow-up Ergebnisse zeigen, dass kein signifikanter<br />
Wirkungsunterschied zwischen Mitomycin 40mg und <strong>BCG</strong> bei<br />
Progression und Gesamtüberleben besteht .<br />
Betrachtet man die Ergebnisse dieser Studie von Anfang an, die<br />
zunächst von Lundholm et al . 1996 und dann von Malmström et al .<br />
1999 publiziert wurde, sieht man, dass <strong>BCG</strong> anfänglich besser als<br />
Mitomycin 40mg war . Mit zunehmender Nachbeobachtungszeit,<br />
wurde deren Wirkung aber ausgeglichen (s . Abb . 20) .<br />
Überlebenswahrscheinlichkeit<br />
1<br />
0,9<br />
0,8<br />
0,7<br />
0,6<br />
0,5<br />
0,4<br />
0,3<br />
0,2<br />
0,1<br />
MMC<br />
0<br />
0 25 50 75 100 120<br />
Monate nach TUR<br />
Die intravesikale Therapie mit <strong>BCG</strong> stellt heute eine sehr wirkungsvolle<br />
Alternative für die Therapie des nichtmuskelinvasiven<br />
Harnblasenkarzinoms dar .<br />
Die Reduktion der Rezidiv- und vor allem der Progressionsrate<br />
durch die konsequente Durchführung der Initial- und Erhaltungstherapie<br />
sprechen dafür, dass diese Therapie Mittel der ersten Wahl<br />
zur Behandlung des high-risk nichtmuskelinvasiven Harnblasenkarzinoms<br />
sein sollte .<br />
<strong>BCG</strong><br />
59
60<br />
8.0 Stichwortverzeichnis<br />
Seitenzahl<br />
A<br />
Adhäsion . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .14, 20, 26, 27, 38<br />
Antibiotika . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7, 13<br />
Antikoagulantien . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .14, 15<br />
Applikation . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .18, 20, 27<br />
Arthralgie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7, 8, 9, 12<br />
Arthritis . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7, 8, 12, 16<br />
B<br />
BAK-Zellen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .24, 25, 26<br />
<strong>BCG</strong>-Stämme . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .9, 13, 22, 26, 27<br />
Blutgerinnung . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .14<br />
c<br />
CD . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .24, 25, 28<br />
CIS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .31, 32, 33, 35-38, 41-44, 47-53, 59<br />
Connaugh . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .9, 21, 27<br />
D<br />
Desinfektionslösung . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .20<br />
Doppel-J-Katheter . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .54<br />
Doxorubicin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .38, 41, 43<br />
DTH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .27<br />
e<br />
Epididymitis . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7, 8, 9, 11<br />
F<br />
Fernmetastasen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .22, 40<br />
Fibronektin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .38<br />
H<br />
Hämaturie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .6, 8, 10, 16, 35, 57<br />
Hautrötung . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7<br />
Heparin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .14<br />
Hepatitis . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7, 8, 9, 15<br />
HIV . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .5, 53, 54<br />
HLA-DR . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .29<br />
I<br />
IL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .24, 29, 30<br />
Immunologische Reaktion . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .6<br />
Immunsuppression . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .34<br />
Impfstoff . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .22<br />
Instillationszyklus . . . . . . . . . . .10, 11, 31, 32, 34, 35, 41, 44, 50, 53, 54<br />
Interferon . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .39, 55<br />
intraepitheliale Neoplasie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .40
k KLH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .55, 56<br />
L LAK-Zellen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .24<br />
low-dose . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34-37<br />
Lymphozyten . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .25, 29, 30<br />
M Makrophagen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .24, 28, 29<br />
Markerläsion . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .41<br />
Miktionsfrequenz . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .8, 10<br />
miliare Pneumonie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7, 8, 15,<br />
MMC . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .26, 37, 38, 39, 41, 49, 56, 57, 59<br />
muskelinvasiv . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .10, 11, 40, 45, 46, 49, 54, 59<br />
N Nebenwirkungen . . . . . . . . . . . . . .6-12, 15, 26, 32-35, 39, 44, 52, 54, 57<br />
Nephritis . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7<br />
Nephrostomie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .51<br />
NK-Zellen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .23, 24<br />
P Pasteur . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .9, 21, 22, 26, 27, 35<br />
Pneumonitis . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7<br />
Progression . . . . . . . . . . . . . . . . . . . . . . . . . 36, 37, 44-47, 49, 50, 53, 56, 57, 59<br />
pT1G3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .45, 46, 47, 50<br />
R Rezidivrate . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .12, 14, 32, 36, 47, 55, 57<br />
RIVM . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .4, 9, 21, 26, 27<br />
S Sepsis . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7, 8, 9<br />
septischer Schock . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7, 12, 15<br />
Suppressor . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .28, 29<br />
SWOG . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .40, 43<br />
Symptome . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6-12, 15, 16<br />
Syndrome . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .11, 12, 54<br />
t Tice . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .9, 21, 26, 27<br />
TNF . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .24, 26, 29, 30<br />
Toxizität . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .11, 24, 35, 36, 37, 39<br />
Tuberkulose . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .5, 15, 20, 22, 53, 54<br />
TUR . . . . . . . . . . . .5, 11, 15, 30, 31, 34, 35, 37, 38, 41, 42, 45-50, 53, 54, 59<br />
U Überlebensrate . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .33, 36, 42, 47, 50<br />
Z Zystektomie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .42, 45, 46, 47, 49, 50, 54<br />
Zystitis . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .6, 8, 9, 29, 30, 35, 38, 57<br />
Zytokine . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .29, 30<br />
Zytotoxizität . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 23-27<br />
61
62<br />
9.0 Literaturverzeichnis<br />
Akaza H., Hinotsu S., Aso y., kakizoe t., koiso k. (1995)<br />
Bacillus Calmette-Guérin Treatment of Existing Papillary Bladder Cancer and Carcinoma In<br />
Situ of the Bladder<br />
Cancer, 75:552-9<br />
Anderström c., Johannsson S., Nilson S. (1980)<br />
The significance of lamina propria invasion on prognosis of patients with bladder tumors<br />
J . Urol ., 124: 23-36<br />
Baniel J., Grauss D., engelstein D., Sella A. (1998)<br />
Intravesical Bacillus Calmette-Guérin Treatment For Stage T1 Grade 3 Transitional Cell<br />
Carcimoma Of The Bladder<br />
Urology, 52: 785-789<br />
Bassi P., Piazza N., Abatangelo G., Saraeb S carando R., et al. (1997)<br />
Intravesical therapy of high risk superficial bladder cancer <strong>BCG</strong> immunotherpy of high risk<br />
superficial bladder cancer .<br />
Proceedings of the first Lübeck symposium on bladder cancer .No 37<br />
Bassi P., Iafrate M., Longo F., Ianello A., Mostaccio G., Ingrassia A.,<br />
Repele M., tavolini I.M. (2001)<br />
Intracavitary Therapy of Noninvasive transitional Cell Carcinoma of the Upper Urinary Tract<br />
Urol . Int ., 67: 189-194<br />
Bellman G.c., Sweetser P., Smith A.D. (1994)<br />
Complications of intracavitary Bacillus Calmette Guérin after percutaneous resection of<br />
upper tract transitional cell carcinoma<br />
J . Urol ., 151: 13-15<br />
Bennett c.F., chiang M.y., chan H., Shoemaker J.e., Mirabelli c.k. (1992)<br />
Cationic lipids enhance cellular uptake and activity of phosphorothiotate antisence oligonucleotides<br />
Mol . Pharmacol ., 41: 1023-1033<br />
Blute M.L., Segura J.W., Patterson D.e., Benson R.c. Zincke H. (1989)<br />
Impact of endourology on diagnosis and management of upper urinary tract urothelial cancer<br />
Eur . Urol ., 21, 304-308<br />
Boccon-Gibod L., Leleu c., Herve J.M., Belas M., Steg A. (1989)<br />
Bladder tumors invading the lamina propria (stage A/T1): Influence of endovesical <strong>BCG</strong> therapy<br />
on recurrence and progression<br />
Aur . Urol ., 16: 401-404<br />
Böhle A., Wang M.H., Flad H.D., Ulmer A.J. (1991)<br />
In vitro cellular cytototxity against human bladder carcinoma celllines . In Investigative<br />
Urology 4 Eds D . Jocham, J .W . Thüroff H . Rüben . Berlin Springer Verlag pp .: 131-139<br />
Böhle A., knipper A., Hofstetter A.G. (1989a)<br />
Rezidivprophylaxe des Urothelcarcinoms im oberen Harntrakt mit <strong>BCG</strong><br />
Z . Urologie Poster 2: 99-100<br />
Böhle A., Lemburg F., knipper A., Fornara P., Jocham D. (1992a)<br />
Recurrence prophylaxis with Bacillus Calmette-Guérin in the upper urinary tract .<br />
Long term results of 15 Patients .<br />
Urology Eds L .Giuliani & P . Puppo, Bologna: Monduzzi Editore: 141-143<br />
Böhle A., Lemburg F., knipper A., Fornara P., Jocham D. (1992b)<br />
Recurrence prophylaxis with Bacillus Calmette-Guérin in the upper urinary tract .<br />
Long term results of 15 Patients .<br />
European Association of Urology Xth Congress July 22-25 1992 Genoa: Abst . 256
Böhle A., Schäfer I., Ulmer A.J., Rüsch-Gerdes S., Flad H.D., Jocham D. (1995)<br />
Standardisierter Vergleich der immuntherapeutischen Potenz verschiedener Stämme<br />
von Bacillus Calmette-Guérin<br />
Urologe A, 34: (Suppl .), 17 (Abstr .)<br />
Böhle A., Durek c., Schäfer I., Brandau S., Ulmer A.J., Flad H.D., Jocham D. (1998)<br />
Die <strong>BCG</strong>-aktivierte Killerzelle: Untersuchung spezifischer Erkennungs- und<br />
Tötungsmechanismen zur Charakterisierung des Wirkprinzips der intravesikalen<br />
Immuntherapie mit Bacillus Calmette-Guérin .<br />
Akt . Urol ., 29: 157-187 .<br />
Böhle A., Jocham D. (2000)<br />
Intravesical immunotherapy with Bacillus Calmette-Guérin . Facts figures and results<br />
Urban & Fischer, München, Jena<br />
Brake M., Loertzer H., Horsch R., keller H. (2000)<br />
Recurrence and progression of stage T1, Grade 3 transitional cell carcinoma of the bladder<br />
following intravesical immunotherapy with bacillus calmette-guérin\NLN\<br />
J . Urol ., 163: 1697-1701<br />
Bretton P.R., Herr H.W.,Whitmore W.F., Badalament R.A., kimmel M., Provet J.,<br />
oettingen H.F., Melamed M.R., Fair W.R. (1990)<br />
Intravesical Bacillus Calmette-Guérin therapy for in situ transitional carcinoma involving the<br />
prostatic urethra<br />
J . Urol ., 141: 853-856<br />
Brosman S.A. (1982)<br />
Experience with Bacillus Calmette-Guérin in patients with superficial bladder carcinoma<br />
J . Urol ., 141, 853-856<br />
Brosman S.A. (1985)<br />
The use of Bacillus Calmette Guérin in the therapy of bladder carcinoma in citu<br />
J . Urol ., 134: 36-39<br />
Brosman S.A. (1992)<br />
Bacillus Calmette-Guérin immunotherapy<br />
Urol .Clin .N .Am ., 19: 557-564<br />
Bui t.t., Schelhammer P.F. (1997)<br />
Additional Bacillus Calmette-Guérin therapy for recurrent transitional cell carcinoma after an<br />
initial complete responce<br />
Urology, 49 (5): 687-691<br />
catalona W.J.,Hudson M.A., Gillen D.P., Andriole G.L., Ratliff t.L. (1987)<br />
Risks and benefits of repeated courses of intravesical Bacillus Calmette-Guérin therapy for<br />
superficial bladder cancer<br />
J . Urol . 137: 220-224<br />
chapman P.B. Houghton A.N. (1993)<br />
Non-antibody immunotherapy of cancer<br />
Curr . Opin . Immunol 5: 726-731<br />
cheng L., cheville J.c., Neumann R.M., Leibovich B.c., egan k.S. Spotts B.e.,<br />
Bostwick D.G. (1999)<br />
Survival of patients with carcinoma in situ of the urinary bladder<br />
Cancer, 85: 2469-74<br />
clark P.e., Streem S.B., Geisinger M.A.<br />
13-Year Experience With Percutanceous Management of Upper Tract Transitional Cell<br />
Carcimoma . J . Urol ., 161: 772-776<br />
coe J.e., Feldmann J.D. (1966)<br />
Extracutaneous delayed hypersensitivity, particularly in the guinea pig bladder<br />
Immunol ., 10: 127-136<br />
63
64<br />
colombel M, Saint F, chopin D, Malavaud B, Nicolas L, Rischmann P. (2006)<br />
The effect of ofloxacin on bacillus calmette-guerin induced toxicity in patients with superficial<br />
bladder cancer: results of a randomized, prospective, double-blind, placebo controlled,<br />
multicenter study .<br />
J Urol . Sep;176(3):935-9<br />
coplen D.e., Marcus M.D., Myers J.A., Ratliff t.L., catalona W.J. (1990)<br />
Long term follow up of patients treated with 1 or 2, 6-week courses of intravesical Bacillus<br />
Calmette-Guérin: Analysis of possible predictors of responce free of tumor<br />
J . Urol ., 144 652-657<br />
cookson M.S., Sarosdy M.F. (1992)<br />
Management of Stage T1 Superficial Bladder-Cancer with intravesikal Bacillus-Calmette-<br />
Guérin Therapy<br />
J: Urol:, 148:787-801<br />
crispen R. (1989)<br />
History of <strong>BCG</strong> and ist Substrains .<br />
In EORT Geniourinary Group Monograph 6; <strong>BCG</strong> in Superficial Bladder Cancer . Eds F .M .J .<br />
Debruyne, L . Denis & A .P .M . van der Meijden . New York: Alan R . Liss, Inc . Pp . 53-50<br />
Davis J.W., Sheth S.I., Doviak M.J., Schellhammer P.F. (2002)<br />
Superficial Bladder Carcinoma Treated with Bacillus Calmette-Guérin: Progression-Free<br />
And Desease Specific Survival with Minimum 10-Year follow-up<br />
J . Urol ., 167: 494-501<br />
De Boer e.c., De Jong W.H., Steerenberg P.A., Aarden L.A., tetteroo e., De Groot<br />
e.R., van der Meijden A.P.M., Vegt P.D.J., Debruyne F.M.J., Ruitenberg e.J. (1992a)<br />
Induction of urinary interleukin-I (IL-1), IL-2, IL-6, and tumor necrosis factor during intravesical<br />
immunotherapy with Bacillus Calmette-Guérin in superficial bladder cancer .<br />
Cancer Immunol . Immunother . 34 306-312<br />
De Reijke t.M., de Boer e.c., kurth k.H., Schamhart D.H.J. (1996)<br />
Urinary cytokines during intravesical Bacillus Calmette Guérin therapy for superficial bladder<br />
cancer: processing, stability and prognostic value<br />
J . Urol ., 155: 477-482<br />
De Reijke t.M., de Boer e.c., kurth k.H., Schamhart D.H.J. (1999)<br />
Urinary interleukin-2 monitoring during prolonged Bacillus Calmette-Guérin treatment: can it<br />
predict the optimal naumber of instillations?<br />
J . Urol ., 161: 67-71<br />
DeJager R., Guinan P.D., Lamm D.L., khanna o.P., Brosman S.A., et al. (1991)<br />
Long term complete remission in bladder carcinoma in situ with intravesical Tice Bacillus<br />
Calmette Guérin . Overview analysis of six phase II clinical trials<br />
Urology, 38: 507-513<br />
Donohue J.H., Rosenberg S.A. (1983)<br />
The fate of interleukin 2 after in vivo admistration .<br />
J . immunol ., 130: 2203-22308<br />
Durek c., Rüsch-Gerdes S., Jocham D., Böhle A. (1999)<br />
Interference of Modern Antibacterials with Bacillus Calmette-Guérin Viability<br />
J Urol; 162, 6: 1959-1962<br />
el-Demiry M.I.M., Smith G., Ritchie A.W.S., James cumming J.A., Hargraeve t.B.,<br />
chisholm G.D. (1984)<br />
Local immune responses after intravesical <strong>BCG</strong> treatment for carcinoma in situ<br />
Brit . J . Urol ., 60: 543-548<br />
Freund J. (1956)<br />
The mode of action of immunologic adjuvants<br />
Adv . Tuderc . Res ., 7: 130-148<br />
Gårdmark t, Jahnson S, Wahlquist R, Wijkstrom H, Malmstrom PU. (2007)<br />
Analysis of progression and survival after 10 years of a randomized prospective study comparing<br />
mitomycin-C and bacillus Calmette-Guerin in patients with high-risk bladder cancer .<br />
BJU Int ., 99(4):817-20
Gohji k., Nomi M., okamoto M., takenaka A., Hara I., okada H., Arakawa S.,<br />
Fujii A., kamidono S. (1999)<br />
Conservative therapy for stage T1b grade 3 transitional cell carcinoma of the bladder<br />
Urology, 53: 308-313<br />
Grossman H.B. (1993)<br />
Bladder Contracture following intravesical <strong>BCG</strong> Immunotherapy<br />
Urology, 41:4<br />
Grünwald L.e., SteinA., Rashcovitsky R., Shifrone G., Lurie A. (1997)<br />
A 12 versus 6-week course of Bacillus Calmette-Guérin prophylaxis for the treatment of<br />
high risk superficial bladder cancer<br />
J . Urol ., 157: 487-491<br />
Guérin c. (1957)<br />
Early history of <strong>BCG</strong> .<br />
In <strong>BCG</strong> Vaccination Against Tuberculosis . Ed S .R . Rosenthal . Boston: Little Brown<br />
pp . 48-53<br />
Haaff e.o., Dresner S.M., Ratliff t.L, catalona W.J. (1986)<br />
Two courses of intravesical Bacillus Calmette-Guérin for transitional cell carcinoma of the<br />
bladder<br />
J . Urol ., 136: 820-824<br />
Hadziev S. & kavaklieva-Dimitrova S. (1969)<br />
Applikation du <strong>BCG</strong> dans le cancer chez l’homme .<br />
J . Folia Med . Neerl ., 11, 8-14<br />
Hawkyard S.J., Jackson A.M., James k., Prescott S., Smyth J.F., chisholm G.D.<br />
(1992)<br />
The inhibitory effects of interferon gamma on the grwth of bladder cancer cells<br />
J . Urol ., 147: 1399-1403<br />
Heney N.M., Ahmed S., Flanagan M.J., et al. (1983)<br />
Superficial bladder cancer: Progression and recurrence<br />
J . Urol ., 130: 1083-1086<br />
Herr H.W., Pinsky c.M., Whitmore W.F., oetggen H.F., Melamed M.R. (1983)<br />
Effect of intravesical <strong>BCG</strong> on carcinoma in situ of the bladder<br />
Cancer, 51: 1323-1326<br />
Herr H.W., Laudome V.P., Whitmore W.F. (1987)<br />
An overview of intravesical therapy for superficial bladder tumors<br />
J . Urol ., 138: 1363-1368<br />
Herr H.W., Whitmore W.F. (1987)<br />
Urethral carcinoma in situ after successful intravesical therapy for superficial bladder<br />
tumors: Incidence, posible pathogenesis and management<br />
J . Urol ., 138, 292-294<br />
Herr H.W. (1992a)<br />
Intravesical <strong>BCG</strong>: current results, natural history, and implications for urothelial cancer prevention<br />
J . Cell . Biochem ., Suppl ., 161: 112-119<br />
Hillyard R.W., Ladaga L., Schellhammer P.F. (1988)<br />
Superficial Transitional Cell Carcinoma Of The Bladder Associated With Mucosal<br />
Involvement Of The Prostatic Urethra: Results Of Treatment With Intravesical Bacillus<br />
Calmette-Guérin<br />
J . Urol ., 139: 290-293<br />
Holmgren I. (1935)<br />
La tuberculine et le <strong>BCG</strong> chez les cancereux<br />
Schweiz . Med . Wochenschr ., 65: 1203-1206<br />
Hrouda D., Muir G.H., Dalgleisch A.G. (1997)<br />
The role of immunotherapy for urological tumors<br />
Brit . J . Urol ., 79: 307-316<br />
65
66<br />
Hudson M.A., Ritchey J.k., catalona W.J., Brown e.J., Ratliff t.L. (1990)<br />
Comparison of the Fibronectin-binding Ability and Antitumor Efficacy of Various<br />
Mycobacteria<br />
Cancer Res ., 50: 3843-3847<br />
Hudson M.A., Brown e.J., Ritchey J.k., Ratliff t.L. (1991a)<br />
Modulation of fibronectin-mediated bacillus calmette guérin attachment to murine bladder<br />
mucosa by drugs influencing the coagulation pathways<br />
Cancer Res ., 51: 3726-3732<br />
Hudson M.A., yuan J.J., catalona W.J., Ratliff t.L. (1991b)<br />
Adverse impact of fibrin clot inhibitors on intravesical bacillus calmette-guérin therapy for<br />
superficial bladder tumors<br />
J . Urol ., 144: 1362-1364<br />
Hudson M.A., Herr H.W. (1995)<br />
Carcinoma In Situ Of The Bladder<br />
J . Urol ., 153; 564-572<br />
Huncharek M., kupelnick B. (2003)<br />
Impact of intravesical chemotherapy versus <strong>BCG</strong> immunotherapy on recurrence of superficial<br />
transitional cell carcinoma of the bladder . Metaanalytic reevaluation<br />
Am J Clin Oncol; 26(4): 402-407<br />
Hurle R., Losa A., Manzetti A., Lambo A. (1999)<br />
Intravesical Bacille Calmette-Guerin In Stage T1 Grade 3 Bladder Cancer Therapy: A 7-Year<br />
Follow-Up<br />
Urology, 54: 258-263<br />
Irie A., Iwamura M., kadowaki k., ohkawa A., Uchida t., Baba S. (2002)<br />
Intravesical instillation of bacille calmette-guérin for carcinoma in situ of the urothelium involving<br />
the upper urinary tract using vesicoureteral reflux created by a double-pigtail catheter<br />
Urology, 59 (1): 53-57<br />
Jakse G., Hall R., Bono A., Höltl W., carpentier P., Spaander J.,<br />
van der Meijden A.P.M., Sylvester R. (2001)<br />
Intravesical <strong>BCG</strong> in Patients with Carcinoma in situ of the Urinary Bladder: Long-term<br />
results of EORTC GU Group Phase II Protocol 30861<br />
Eur .Urol ., 40: 144-150<br />
Jewett H.J., Strong G.H. (1946)<br />
Infiltrating carcinoma of the bladder: Relation of depth of penetration of the bladder wall to<br />
incidence of local extention and metastases<br />
J . Urol ., 55: 366<br />
Jimenez-cruz J.F., Vera-Donoso c.D., Leiva o., Pampola M., et al., (1997)<br />
Intravesical immunoprophylaxis in recurrent superficial bladder cancer (stage T1): multicenter<br />
trial comparing Bacille Calmette-Guerin and interferon-alpha .<br />
Urology, 50: 529-535<br />
kälble t., Möhring k., Ikinger U., et al. (1991)<br />
Intravesikale Rezidivprophylaxe beim oberflächlichen Harnblasenkarzinom mit <strong>BCG</strong> und KLH<br />
Urologe A, 30; 118-121<br />
kälblet., Beer M., Mendoza e., Ikinger U., Link M., et al. (1994)<br />
<strong>BCG</strong> vs . Interferon A zur Rezidivprophylaxe beim oberflächlichen Harnblasenkarzinom<br />
Urologe A, 33 133-137<br />
kantor A.F., McLaughlin J.k., curtis R.e., Flannery J.t., Fraumeni J.F. (1986)<br />
Risk of a second malignacy after cancers of the renal parenchyma, renal pelvis and ureter<br />
Cancer, 58: 1158<br />
kavoussi L.R., torrence R.J., Gillen D.P., Hudson M.A., Haaff e.o., Dresner S.M.,<br />
Ratliff t.L. (1988)<br />
Results of 6 weekly intravesical Bacillus Calmette-Guérin instillations on the treatment of<br />
superficial bladder tumors<br />
J . Urol ., 139, 935-940 .
kirkali et al. Bladder cancer: epidemiology, Staging and Grading and Diagnosis (2005).<br />
Urology 2005; 66: 4-34<br />
koss L.G. (1975)<br />
Tumors of the urinary bladder<br />
Armed Forces Institut of Pathology 2 nd series, fasc . 11: 16-17<br />
krege S., Giani G., Meyer R., otto t., Rübben H. (1996)<br />
A Randomized Multicenter trial of adjuvant therapy in superficial bladder cancer:<br />
Transurethral resection only versus Transurethral Resection plus Mitomycin C versus<br />
Transurethral resection plus Bacillus Calmette-Guérin<br />
J Urol; 156: 962-966<br />
krementz e.t., Samuels M.S., Wallace J.H. (1971)<br />
Clinical experiences in immunotherapy of cancer<br />
Surg . Gynecol . Obstet ., 133: 209-217<br />
Lamm D.L. (1985)<br />
Bacillus Calmette Guérin immunotherapie for bladder cancer .<br />
J . Utol ., 134: 40-47<br />
Lamm D.L. (1992a)<br />
Long-Term Results of Intravesical Therapy for Superficial Bladder Cancer<br />
Urol .Clin .N .Am ., 19:573-580<br />
Lamm D.L (1992b)<br />
Complications of Bacillus Calmette Guérin immunotherapy<br />
Urol . Clin . N . Am . 19: 573-580<br />
Lamm D.L. (1995a)<br />
<strong>BCG</strong> in perspective: advances in the treatment of superficial bladder cancer<br />
Eur . Urol ., 27 (suppl 1), 2-8<br />
Lamm D.L., Blumenstein B.A., crawford e.D., et al. (1995b)<br />
Randomized intergroup comparison of <strong>BCG</strong> immunotherapy and MMC chemotherapy prophylaxis<br />
in superficial transitional cell carcinoma of the bladder .<br />
Urol Oncol ; 1: 119-126<br />
Lamm D.L., thor D.e., Harris S.c., Reyna J.A., Stogdill V.D., Radwin H.M. (1980)<br />
Bacillus Calmette Guérin immunotherapy of superficial bladder cancer .<br />
J . Urol ., 124: 38-42<br />
Lamm D.L., thor D.e., Stogdill V.D., Radwin H.M. (1981a)<br />
<strong>BCG</strong> Immunotherapy of bladder cancer: Inhibition of tumor recurrence and associated<br />
immune responses<br />
Cancer, 48: 82-82<br />
Lamm D.L., Stogdill V.D., Stogdill B.J., et al. (1986)<br />
Complications of bacillus calmette guérin immunotherapy in 1,278 patients with bladder<br />
cancer<br />
J . Urol ., 135: 272-274<br />
Lamm D.L., Steg A., Boccon-Gibod L., Morales A., Hanna M.G., Pagano F., et al.<br />
(1989)<br />
Complications of Bacillus Calmette Guerin immunotherapy: A review of 2062 patients and<br />
comparison of chemotherapy complications . In EORTC Genito-Urinary Group Monogr . 6:<br />
<strong>BCG</strong> in superficial bladder cancer . Eds . F .M .J . Debruyne, L . Denis & A .P .M . v .d . Meijden .<br />
New York: Liss pp . 335-355<br />
Lamm D.L., Blumenstein B.A., crawford e.D., et al. (1991b)<br />
A randomized trial of intravesical doxorubicin and immumotherapy with bacille calmette<br />
guérin for transitional cell carcinoma of the bladder<br />
N .Engl .J .Med ., 325: 1205-1209<br />
Lamm-D.L., MorgantownW.V., Blumenstein B., Seattle-W.A., Sarosdy M.F.,<br />
Grossman-H.B., crawford e.D. (1997)<br />
Significant long-term patient benefit with <strong>BCG</strong> maintenance therapy: a<br />
southwest oncology group study<br />
J . Urol ., 157(Suppl .): 213 (Abstr . 831f)<br />
67
68<br />
Lamm D.L., Blumenstein B.A., crissman J.D., Montie J.e., Gottesman J.e.,<br />
Lowe B.A., Sarosdy M.F., Bohl R.D., Grossman H.B., Beck t.M., Leimert J.t.,<br />
crawford e.D. (2000)<br />
Maintenence Bacillus Calmette-Guérin Immunotherapy For Recurrent Ta, T1 and Carcinomain Situ<br />
Transitional Cell Carcinoma Of The Bladder: A Randomized Southwest Oncology Group Study<br />
J . Urol ., 163: 1124-1129<br />
Lebret t., Gaudez F., Hervé J.M., Barré P., Lugagne P.M., Botto H. (1998a)<br />
Low Dose <strong>BCG</strong> instillations in the treatment of stage T1 grade 3 bladder tumors:<br />
Recurrence, progression and success . Eur . Urol ., 34: 67-72<br />
Lebret t., Becette V., Barbagelatta M., Hervé J.M., Gaudez F., Barré P., Lugagne<br />
P.M., Botto H. (1998b)<br />
Correlation between p53 over expression and response bacillus calmette-guérin therapy in<br />
a high risk select population of patients with T1G3 bladder cancer<br />
J . Urol ., 159:788-791<br />
Lee e., Park I., Lee c. (1997)<br />
Prognostic markers of intravesical Bacillus Calmette Guérin therapy for multiple, high grade,<br />
stage T1 bladder cancers<br />
Int . J . Urol ., 4 552-556<br />
Losa A., Hurle R., Lembo A. (2000)<br />
Low Dose Bacillus Calmette-Guérin For Carcinoma In Situ Of The Bladder: Long-Term<br />
Results<br />
J . Urol ., 163: 68-72<br />
Lüftenegger W., Ackermann D.k., Futterlieb A., kraft R., Minder c.e., Nadelhaft P.,<br />
Studer U.e. (1996)<br />
Intravesical Versus Intravesical Plus Intradermal Bacillus Calmette-Guérin: A Prospective<br />
Randomized Study In Patients With Recurrent Superficial Bladder Tumors<br />
J . Urol ., 155: 483-487<br />
Lutzeyer W., Rübben H., Dahm H. (1982)<br />
Prognostic Parameters In Superficial Bladder Cancer: An Analysis Of 315 Cases<br />
J . Urol ., 127: 250-252<br />
Malmström P.U., Wijkström H., Lundholm c., Wester k., Busch c., Norlen B.J.<br />
(1999)<br />
5-Year Follow up Of A Randomized Prospective Study Comparing Mitomycin C And<br />
Bacillus Calmette-Guérin In Patients With Superficial Bladder Carcinoma<br />
J . Urol ., 161: 1124-1127<br />
Manoharan M. Soloway M.S. (2005)<br />
Optimal management of the T1G3 bladder cancer .<br />
Urol Clin North Am . 32(2):133-45<br />
Marinez-Piniero JA., Solsona e., Flores N., Isorna S. (1995)<br />
Cooperative Group (CUETO) . Improving the saftety of <strong>BCG</strong> immunotherapy by dose reduction<br />
Eur Urol; 27(Suppl): 13-18<br />
Martínez-Piñeiro JA, Martínez-Piñeiro L, Solsona e, Rodríguez RH, Gómez JM,<br />
Martín MG, Molina JR, collado AG, Flores N, Isorna S, Pertusa c, Rabadán M,<br />
Astobieta A, camacho Je, Arribas S, Madero R; club Urológico español de<br />
tratamiento oncológico (cUeto). (2005)<br />
Has a 3-fold decreased dose of bacillus calmette-guerin the same efficacy against<br />
recurrences and progression of t1g3 and tis bladder tumors than the standard dose?<br />
results of a prospective randomized trial<br />
J Urol ., 174(4 Pt 1):1242-7<br />
Mathe G., Amiel J., Schwarzenberg L., Schneider M., catton A., Schlumberger J.,<br />
Hayat M., Vassal F. (1969a)<br />
Acute immunotherapy for acute lymphoblastic leukemia .<br />
Lancet ., 1 679-699<br />
Morales A., eidinger D., Bruce A.W. (1976)<br />
Intracavitary bacillus Calmette-Guérin in the treatment of superficial bladder tumors<br />
J . Urol ., 116: 180-183
Morales A. (1984)<br />
Long-Term Results and Complications of Intracavitary bacillus Calmette-Guérin Therapy for<br />
Bladder Cancer<br />
J . Urol ., 132: 457-459<br />
Morales A., Nickel J.c., Wilson J.W.L. (1992)<br />
Dose-response of bacillus calmette-guérin in the treatment of superficial bladder cancer<br />
J . Urol ., 147: 1256-1258<br />
Morton D.L., eilber F.R., Malmgren R.A. (1970)<br />
Immunological factors which influence response to immunotherapy in malingnant melanoma<br />
.<br />
Surgery, 68: 158-164<br />
Morton D.L. (1971)<br />
Immunological studies with human neoplasms<br />
J . Reticuloendothel Soc .; 10, 137-160<br />
Morton D.L., Holmes e.c., eilber F.R. (1971)<br />
Immunological aspects of neoplasia: a rational basis for immunotherapy<br />
Ann . Intern . Med ., 74: 587-604<br />
Neumann R.M., cheng L., cheville J.c., Leibovich B.c., Spotts B.e.,<br />
Bostwick D.G. (1999)<br />
Long-Term Follow-Up Of Patients With Carcinoma In Situ Of The Urinary Bladder<br />
J . Urol ., 161 (Suppl .): A<br />
Nieder A.M., Brausi M., Lamm D., o‘Donnell M., tomita k., Woo H., Jewett MA. (2005)<br />
Management of stage T1 tumors of the bladder: International Consensus Panel .<br />
Urology; 66(6 Suppl 6A):108-25<br />
ojea A, Nogueira JL, Solsona e, Flores N, Gomez JM, Molina JR, chantada V,<br />
camacho Je, Pineiro LM, Rodriguez RH, Isorna S, Blas M, Martinez-Pineiro JA,<br />
Madero R; Members of the cueto Group (club Urologico espanol De tratamiento<br />
oncologico).(2007)<br />
A Multicentre, Randomised Prospective Trial Comparing Three Intravesical Adjuvant Therapies<br />
for Intermediate-Risk Superficial Bladder Cancer: Low-Dose Bacillus Calmette-Guerin<br />
(27 mg) versus Very Low-Dose Bacillus Calmette-Guerin (13 .5 mg) versus Mitomycin C .<br />
Eur Urol .;52(5):1398-406<br />
okamura t., tozawa k., yamada y., Sakagami H., Ueda k., kohri k. (1996)<br />
Clinicopathological evaluation of repeated courses of intravesical Bacillus Calmette-Guérin<br />
instillation for preventing recurrence of initially resistannt superficial bladder cancer .<br />
J . Urol ., 156: 967-971<br />
Pagano F., Bassi P., Milani c., Meneghini A., Maruzzi D., Garbeglio A. (1991)<br />
A low dose bacillus calmette guérin regimen in superficial bladder cancer therapy: is it effective?<br />
J . Urol ., 146: 32-35<br />
Pagano F, Bassi P, Piazza N, Abatangelo G, Drago Ferrante GL, Milani c. (1995)<br />
Improving the efficacy of <strong>BCG</strong> immunotherapy by dose reduction .<br />
Eur Urol .;27 Suppl 1:19-22<br />
Palou J., Sanchez-Martin F.M., Rosales A., Salvador J., et al. (1999)<br />
Intravesical Bacillus Calmette Guérin in the treatment of carcinoma in situ or high grade<br />
superficial bladder carcinoma after radiotherapy for bladder cancer<br />
BJU . Int ., 83: 429-431<br />
Pansadoro V, emiliozzi P, de Paula F, Scarpone P, Pansadoro A, Sternberg cN (2002)<br />
Long-Term Follow-up of G3T1 Transitional Cell Carcinoma of the Bladder Treated with<br />
Intravesical Bacille Calmette-Guérin: 18-Year Experience<br />
Urology, 59 (2): 227-230<br />
Papadimitriou J.M., Spector W.G. (1982)<br />
The ultrastructure of high- and low-turnover inflammatory granulomata<br />
J . Pathol ., 106: 37-37<br />
69
70<br />
Patel A., Fuchs G.J. (1998)<br />
New techniques for the administration of topical adjuvant therapy after endoscopic ablation<br />
of upper urinary tract transitional cell carcinoma<br />
J . Urol ., 159: 71-75<br />
Pham H.t., Soloway M.S. (1997)<br />
High-risk superficial bladder cancer: Intravesical therapy for T1 G3 transitional cell carcinoma<br />
of the urinary bladder<br />
Sem .Urol .Oncol ., 15,3: 147-153<br />
Power c.A., Wie G., Bretscher P.A. (1998)<br />
Mycobacterial dose defines the Th1/Th2 nature of the immune responce independently of<br />
whether immunization is administered by the intravenous, subcutaneous or intradermal route .<br />
Infect . Immun ., 66 (No .12): 5743-5750<br />
Pryor J.P. (1973)<br />
Factors influencing the survival of patients with transitional cell tumors of the urinary bladder<br />
Br . J . Urol ., 45: 586-592<br />
Rajala P., kaasinen e., Rintala e., et al. (1992)<br />
Cytostatic effect of different strains of bacillus calmette-guérin on human baldder cancer<br />
cells in vitro alone and in combination with mitomycin C and interferon-alpha<br />
Urol . Res ., 20: 215-217<br />
Ratliff t.L., Gillen D.P., catalona W.J. (1987b)<br />
Requirement of a thymus-dependent immune response for <strong>BCG</strong>- mediated antitumor activity<br />
J . Urol ., 137: 155-158<br />
Ratliff t.L., Hudson M.A., catalona W.J. (1991)<br />
Strategy for improving therapy of superficial bladder cancer<br />
World J . Urol ., 9: 95-98<br />
Reynolds R., Stogdill V.D., Lamm D.L., Herr H.W. (1995)<br />
Disease progression in <strong>BCG</strong>-treated patients with transitional cell carcinoma of the bladder<br />
J . Urol ., 133: 211 A<br />
Rintala e., Jauhiainen k., Rajala P., Ruutu M., kaasinen e., Alfthan o.,<br />
the Finnbladder Group (1995)<br />
Alternating Mitomycin C and Bacillus Calmette-Guérin instillation therapy for carcinoma in<br />
situ of the bladder<br />
J . Urol ., 154:2050-2053<br />
Rischmann P., Saint F., Nicolas L., colombel M. (2007)<br />
Ofloxacin to prevent bcg-induced toxicity in patients with superficial bladder cancer: results<br />
of a randomised prospective, double-blind, placebo-controlled, multicentre study<br />
Eur Urol, Suppl 6(2) Abstr . 152: 60<br />
Rosenberg S.A. (1987)<br />
A progress report on the treatment of 157 Patients with advanced cancer using lymphokine-activated<br />
killer celles and interleukin-2 or high dose interleukin-2 alone<br />
N . Eng .J .Med ., 316, 889-897<br />
Schäfer I., Braasch H., Wang S., Ulmer A.J., Flad H.D., Jocham D., Böhle A. (1995)<br />
The zytotoxity of natural killer cells ex-vivo against isolated autologous human urothelial<br />
bladder tumor cells .<br />
Urol Res ., 23: 286 (Abstr .)<br />
Schellhammer P.F., Whitmore W.F. (1976)<br />
Transitional cell carcinoma in the urethra of men having zystectomy for bladder cancer<br />
J . Urol ., 115 46-48<br />
Schnapp D.S., Weiss G.H., Smith A.D., (1996)<br />
Fever following intracavitary bacillus Calmette-Guérin Therapy for upper tract transitional<br />
cell carcinoma<br />
J . Urol ., 156:386-388
See W.A., chapman P.H. (1987)<br />
Hepatin prevention of tumor cell adherence and implantation on injured urothelial surfaces .<br />
J, Urol ., 138: 182-186<br />
Sharpe J.R., Duffy c., chin J.L. (1993)<br />
Intrarenal Bacillus Calmette Guérin therapy for upper urinary tract carcinoma in situ<br />
J . Urol ., 149: 457-460<br />
Smith G.V., Morse P.A.Jr., Deraps G.D. (1973)<br />
Immunotherpy of patients with cancer<br />
Surgery; 74: 59-68<br />
Smith J.A., Labasky R.F., cockett A.t.k., Fracchia J.A., Montie J.e.,<br />
Rowland R.G. (1999)<br />
Bladder cancer clinical guidelines panel summary report on the management of non muscle<br />
invasive bladder cancer (Stages Ta, T1 and TIS)<br />
J . Urol ., 162: 1697-1701<br />
Studer U.e., casanova G., kraft R., Zingg e.J. (1989)<br />
Percutaneous Bacillus Calmette-Guérin Perfusion Of The Upper Urinary Tract for<br />
Carcinoma In Situ<br />
J . Urol ., 142: 975-977<br />
Sylvester R., van der Meijden APM., oosterlink W., casetta G., Hoeltl W.,<br />
Bono A. (2003)<br />
The side effects of Bacillus Calmette Guérin in the treatment of Ta T1 bladder cancer do not<br />
predict its efficacy: Results from an EORTC genitourinary group phase III trial<br />
Eur . Urol . (Suppl): 2, 1: Abstr . 753<br />
Sylvester-RJ, Van der Meijden-APM, Lamm-DL (2002)<br />
Intravesical Bacillus Calmette-Guérin Reduces the risk of Progression in Patients with<br />
superficial Bladder Cancer: A meta Analysis of the Published Results of Randomized<br />
Clinical Trials .<br />
J . Urol . ,168, 1964-1970<br />
tavolini I.M., Gardiman M., Benedetto G., Bassi P. (2002)<br />
Unmanageable fever and granulomatous renal mass after intracavitary upper urinary tract<br />
Bacillus Calmette-Guérin therapie<br />
J . Urol ., 167: 244-245<br />
tawfiek e.R., Bagley D.H. (1997)<br />
Uppertract transitional cell carcinoma<br />
Urology, 50 (3): 321-329<br />
thanhäuser A., Böhle A., Flad H.D., ernst M., Mattern t., Ulmer A.J. (1993)<br />
Induction of Bacillus Calmette-Guérin-activated killer cells from human peripheral blood<br />
mononuclear cells against human bladder carcinoma cells lines in vitro<br />
Cancer Immunol, Immunother ., 37: 105-111<br />
Utz D.c., Farrow G.M., Rife c.c., Segura J.W., Zincke M. (1980)<br />
Carcinoma in situ of the bladder<br />
Cancer, 45: 1842-1848<br />
Utz D.c., Farrow G.M. (1984)<br />
Carcinoma in situ of the urinary tract<br />
Urol . Clin . N . Am ., 11:735-735<br />
Vegt P.D.J., Witjes A., Witjes W.P.J., Doesburg W.H., Debruyne M.J., van der<br />
Meijden A.P.M. (1995)<br />
A randomized study of intravesical Mitomycin C, Bacillus Calmette-Guérin Tice and Bacillus<br />
Calmette-Guérin RIVM treatment in pTa-pT1 papillary carcinoma and carcinoma in situ of<br />
the bladder<br />
J . Urol ., 153: 929-933<br />
71
72<br />
Vegt P.D.J., van der Meijden A.P.M., Sylvester R., Brausi M., Höltl W.,<br />
de Balincourt c. (1997)<br />
Does isoniazid reduce side effects of intravesical Bacillus Calmette Guérin therapy in superficial<br />
bladder cancer? Interim results of european organization for research and treatment of<br />
cancer protocol 30911<br />
J . Urol ., 157: 1246-1249<br />
yokogi H., Wada y., Mizutani M., Igawa M., Ishibe t. (1996)<br />
Bacillus Calmette-Guérin perfusion therapy for carcinoma in situ of the<br />
upper urinary tract<br />
Br . J . Urol ., 77: 676-679<br />
Wang M.H., Flad H.D., Böhle A., chen y.Q., Ulmer A.J. (1991)<br />
Cellular cytotoxity of human natural killer cells and lymphokine activated killer cells against<br />
bladder carcinoma cells lines<br />
Immunol . Lett ., 27: 191-198<br />
Wang M.H., chen y.Q., Gercken J., ernst M., Böhle A., Flad H.D., Ulmer A.J. (1993)<br />
Specific activation of human pripheral blood t/d+T lymphocytes by sonicated antigens of<br />
mycobacterium tuberculosis: Role in vitro in killing human bladder carcinoma cell lines<br />
Scand . J . Immunol ., 38: 239-246<br />
Wishnow k.I., Ro J.y. (1988)<br />
Importance of early treatment of transitional cell carcinoma of prostatic ducts<br />
Urology, 32: 11-14<br />
Witjes J.A., van der Meijden A.P.M., Doesburg W., et al. (1993)<br />
Influence of fibrin clot inhibitors on the efficacy of intravesical bacillus calmette-guérin in the<br />
treatment of superficial bladder cancer<br />
Eur . Urol ., 23: 366-370<br />
Witjes J.A., caris c.t.M., Mungan N.A., Debruyne F.M.J., Witjes W.P.J. (1998a)<br />
Results of a randomized phase III trial of sequential intravesical therapy with Mitomycin C and<br />
Bacillus Calmette-Guérin versus Mitomycin C alone in patients with superficial bladder cancer<br />
J . Urol ., 160:1668-1672<br />
Witjes JA., van der Meijden APM., Sylvester Lc et al. (1998b)<br />
Long term follow up of an EORTC randomized prospective trial comparing intravesical<br />
bacille Calmette-Guérin-RIVM and Mitomycin C in superficial bladder cancer<br />
Urology; 52: 403-410<br />
Wittes (1993)<br />
<strong>BCG</strong> in Prophylaxe und Therapie des oberflächlichen Blasenkarzinoms: ein Überblick über<br />
klinische Studien .<br />
Der Urologe (B) (33) Beilage Heft 1: 9<br />
Zaak-D, Hungerhuber-e, Reich-o, et al. (2004)<br />
Detection of bladder cancer with 5-ALA-results of 1713 fluorescence endoscopies<br />
Eur-Urol (Suppl) 2004; 3 (2): pp 95 Abstr . 370<br />
Zaak-D, karl-A, knüchel-R, Stepp-H, Hartmann-A et al. (2005)<br />
Diagnosis of urothelial carcinoma of the bladder using fluorescence endoscopy<br />
BJU-International 2005; 96: 217-222<br />
Zhang G.k., Uke e.t., Sharer W.c., Borkon W.D., Bernstein S.M. (1996)<br />
Reassessment Of Conservative Management For Stage T1N0M0 Transitional Cell<br />
Carcinoma Of The Bladder<br />
J . Urol ., 155: 1907-1909<br />
Zietman A.L., Shipley W.U., kaufman D.S., Zehr e.M., Heney N.M., Althausen A.F.,<br />
McGovern F.J. (1998)<br />
A phase I/II Trial of transurethral surgery combined with concurrent Cisplatin, 5-Fluorouracil<br />
and twice daily radiation followed by selective bladder preservation in operable patients with<br />
muscle invading bladder cancer<br />
J . Urol ., 160:1673-1677
BcG-<strong>medac</strong>, Pulver und Lösungsmittel zur Herstellung einer Suspension zur intravesikalen<br />
Anwendung . Zus.: Nach Rekonst. enth. 1 Durchstechfl.: <strong>BCG</strong> (Bacillus Calmette-<br />
Guérin) Bakterien (Stamm RIVM abgeleitet von Stamm 1173-P2) 2 x 10 8 bis 3 x 10 9 lebensfähige<br />
Einheiten. And. Best.: Pulver: Polygeline, wasserfreie Glucose, Polysorbat 80.<br />
Lösungsmittel: NaCl, Wasser f. Injektionszwecke. Anwendungsgebiete: Nicht-invasive<br />
urotheliale Harnblasenkarzinome: kurative Behandl. eines CIS. Rezidivprophylaxe: Ta<br />
G1-G2 multifokale Tu. u./o. Rezidiv-Tu.;Ta G3; T1; CIS. Gegenanz.: Überempfindlichk.<br />
geg. <strong>BCG</strong> od. Hilfsstoffe; angeborene od. durch Erkrank. od. Therapie erworbene<br />
Immunschwäche; aktive Tuberkulose (Ausschluss bei pos. Hauttest auf Tuberkulin erforderl.).<br />
Vorherig. Radiotherapie d. Blase; Schwangerschaft u. Stillzeit. Nebenwirkungen:<br />
häufig, aber meist milde u. vorübergehende Sympt., Zunahme im Verlauf d. Therapie.<br />
Sehr häufig: Übelkeit; Zystitis, Granulomata der Blase, erhöhte Miktionsfrequenz mit<br />
Schmerzen u. Unwohlsein; asymptomatische granulomatöse Prostatitis. Fieber < 38.5°C,<br />
Unwohlsein, Fieber, Schüttelfrost als Zeichen der gewünschten beginnenden immunolog.<br />
Reaktion. Häufig: Fieber > 38.5°C. Gelegentlich: Zytopenie, Anämie; Reiter-Syndrom; miliare<br />
Pneumonie, Lungengranulomatose; Hepatitis. Exantheme, Hautabszesse; Arthritis,<br />
Arthralgie. HWI, Makrohämaturie, Einschränkung d. Blasenkapazität, Harnstauung;<br />
Orchitis, Epididymitis. Arterielle Hypotonie. Selten: <strong>BCG</strong>-Sepsis; Gefäßinfektionen, Nierenabszess;<br />
symptomatische granulomatöse Prostatitis. Sehr selten: <strong>BCG</strong>-Infektion von<br />
Implantaten u. umgebenden Gewebe. Zervikale Lymphadenitis, regionale Lymphknoten-<br />
infektion; Hypersensitivitätsreakt.; Osteomyelitis, Knochenmarkinfektion, Psoas-Abszess;<br />
Chorioretinitis, Konjunktivitis, Uveitis. Gefäßfisteln; Erbrechen, intestinale Fisteln, Peritonitis;<br />
gegenüber Tuberkulostatika resistente Orchitis od. Epididymitis, Infektion d. Glans<br />
Penis. Verschreibungspflichtig.<br />
<strong>medac</strong> <strong>GmbH</strong>, Fehlandtstr . 3, D-20354 Hamburg . 6/2008<br />
mito-<strong>medac</strong> ® / mito-extra ® Pulver zur Herstellung einer Lösung zur intravesikalen<br />
Anwendung . Zusammensetzung: 1 Durchstechflasche mito-<strong>medac</strong> ® mit 500 mg<br />
Pulver enthält 20 mg Mitomycin . 1 Durchstechflasche mito-extra ® mit 1000 mg Pulver<br />
enthält 40 mg Mitomycin . Sonstige Bestandteile: NaCl . Zusätzlich: Applikationssystem<br />
mit 20ml (mito-<strong>medac</strong> ® ) bzw . 40ml (mito-extra ® ) steriler 0,9%iger NaCl-Lösung; Katheter .<br />
Anwendungsgebiet: Intravesikale Anwendung zur Rezidivprophylaxe bei oberflächlichem<br />
Harnblasenkarzinom . Gegenanzeigen: Intravesikale Therapie: Blasenwandperforation;<br />
Harnblasenentzündung als relative Kontraindikation; Stillzeit. Nebenwirkungen:<br />
Intravesikale Therapie: Häufig allergische Hautreaktionen in Form lokaler Exantheme (z .B .<br />
Kontaktdermatitis, auch in Form von Palmar- und Plantarerythemen), selten generalisierte<br />
Exantheme . Häufig Zystitis (u .U . hämorrhagischer Natur), Dysurie, Nykturie, Pollakisurie,<br />
Hämaturie, lokale Blasenwandirritation . Auftretende Zystitis sollte symptomatisch<br />
durch lokale antiphlogistische und analgetische Maßnahmen behandelt werden . Meist<br />
kann die Therapie mit Mitomycin, ggf . dosisreduziert, fortgesetzt werden . Sehr selten<br />
nekrotisierende Zystitis, allergische (eosinophile) Zystitis, die Therapieabbruch erfordert;<br />
Stenosen der ableitenden Harnwege; Einschränkung der Blasenkapazität . Zusätzliche<br />
Anwendungsgebiete, Gegenanzeigen und Nebenwirkungen zur systemischen Therapie<br />
siehe Fachinformation. Verschreibungspflichtig .<br />
<strong>medac</strong> <strong>GmbH</strong> Fehlandtstraße 3, D-20354 Hamburg . Stand: Oktober 2009
<strong>medac</strong> <strong>GmbH</strong><br />
Theaterstraße 6 · 22880 Wedel<br />
Tel. 0800 1030300 · Fax 04103 8006-328<br />
www.<strong>medac</strong>.de<br />
WU-1014/06.2008