SÁCH TÓM TẮT LÝ THUYẾT HÓA 2019 (SỬ DỤNG LUYỆN THI CHUYÊN HÓA VÀO 10 VÀ LUYỆN THI ĐẠI HỌC)
https://app.box.com/s/1nnzwa2jza8s44wnk6qgdj0gfucfqfcr
https://app.box.com/s/1nnzwa2jza8s44wnk6qgdj0gfucfqfcr
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
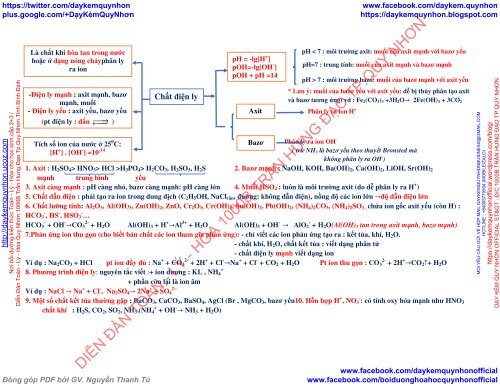
Là chất khi hòa tan trong nước<br />
hoặc ở dạng nóng chảyphân ly<br />
pH = -lg[H + ]<br />
ra ion<br />
pOH=-lg[OH - ]<br />
pOH + pH =14<br />
-Điện ly mạnh : axit mạnh, bazơ Chất điện ly<br />
mạnh, muối<br />
- Điện ly yếu : axit yếu, bazơ yếu<br />
Axit<br />
(pt điện ly : dấu ←⎯⎯→<br />
⎯ )<br />
Tích số ion của nước ở 25 0 C:<br />
Bazơ<br />
[H + ] . [OH - ] =<strong>10</strong> -14<br />
pH < 7 : môi trường axit: muối của axit mạnh với bazơ yếu<br />
pH=7 : trung tính: muối của axit mạnh và bazơ mạnh<br />
pH > 7 : môi trường bazo: muối của bazơ mạnh với axit yếu<br />
* Lưu ý: muối của bazơ yếu với axit yếu: dễ bị thủy phân tạo axit<br />
và bazơ tương ứng) vd : Fe 2 (CO 3 ) 3 +3H 2 O→ 2Fe(OH) 3 + 3CO 2<br />
Phân ly ra ion H +<br />
Phân ly ra ion OH -<br />
( trừ NH 3 là bazơ yếu theo thuyết Bronsted mà<br />
không phân ly ra OH - )<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
1. Axit : H 2 SO 4 > HNO 3 > HCl >H 3 PO 4 > H 2 CO 3 , H 2 SO 3 , H 2 S 2. Bazơ mạnh : NaOH, KOH, Ba(OH) 2 , Ca(OH) 2 , LiOH, Sr(OH) 2<br />
mạnh trung bình yếu<br />
3. Axit càng mạnh : pH càng nhỏ, bazơ càng mạnh: pH càng lớn 4. Muối HSO - 4 : luôn là môi trường axit (do dễ phân ly ra H + )<br />
5. Chất dẫn điện : phải tạo ra ion trong dung dịch (C 2 H 5 OH, NaCl rắn , đường: không dẫn điện), nồng độ các ion lớn →độ dẫn điện lớn<br />
6. Chất lưỡng tính: Al 2 O 3 , Al(OH) 3 , Zn(OH) 2 , ZnO, Cr 2 O 3 , Cr(OH) 3 , Sn(OH) 2 , Pb(OH) 2 , (NH 4 ) 2 CO 3 , (NH 4 ) 2 SO 3 , chứa ion gốc axit yếu (còn H) :<br />
HCO - 3 , HS - , HSO - 3 …<br />
HCO - 3 + OH - →CO 2- 3 + H 2 O Al(OH) 3 + H + →Al 3+ + H 2 O Al(OH) 3 + OH - → AlO - 2 + H 2 O(Al(OH) 3 tan trong axit mạnh, bazơ mạnh)<br />
7.Phản ứng ion thu gọn (cho biết bản chất các ion tham gia phản ứng): - chỉ viết các ion phản ứng tạo ra : kết tủa, khí, H 2 O.<br />
- chất khí, H 2 O, chất kết tủa : viết dạng phân tử<br />
- chất điện ly mạnh viết dạng ion<br />
Ví dụ : Na 2 CO 3 + HCl pt ion đầy đủ : Na + + CO 2- 3 + 2H + + Cl - →Na + + Cl - + CO 2 + H 2 O Pt ion thu gọn : CO 2- 3 + 2H + →CO 2 ↑+ H 2 O<br />
+<br />
8. Phương trình điện ly: nguyên tắc viết :+ ion dương : KL , NH 4<br />
+ phần còn lại là ion âm<br />
Ví dụ : NaCl → Na + + Cl - , Na 2 SO 4 → 2Na + 2−<br />
+ SO 4<br />
9. Một số chất kết tủa thường gặp : BaCO 3 , CaCO 3 , BaSO 4 , AgCl (Br , MgCO 3 , bazơ yếu<strong>10</strong>. Hỗn hợp H + , NO - 3 : có tính oxy hóa mạnh như HNO 3<br />
chất khí : H 2 S, CO 2 , SO 2 , NH 3 (NH + 4 + OH - → NH 3 + H 2 O)<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
+N 2 : NH 4 NO 2 → N 2 + 2H 2 O<br />
Hoặc hỗn hợp NaNO 2 (KNO 2 ) + NH 4 Cl<br />
+ HNO 3 :<br />
N2<br />
+O 2<br />
+O2<br />
+ O2 + H2O<br />
⎯⎯⎯→ NO ⎯⎯⎯→ NO 2 ⎯⎯⎯⎯→ HNO 3<br />
NH<br />
3<br />
+ P : từ apatic (Ca 5 F(PO 4 ) 3 hoặc photphoric<br />
(Ca 3 (PO 4 ) 2 )<br />
Ca 3 (PO4) 2 + 3SiO 2 + 5C→ 3CaSiO 3 + 2P +5CO<br />
- Hỗn hợp KNO 3 (diêm tiêu), S, C : thuốc súng có khói<br />
- NH 3 lỏng làm chất gây lạnh, sx phân dạm, sx N 2 H 4<br />
(nhiên liệu tên lửa)<br />
PHÂN BÓN<br />
1. Phân đạm (chứa N) : cây phát triển nhanh<br />
+ đạm 1 lá : (NH 4 ) 2 SO 4 + đạm 2 lá: NH 4 NO 3<br />
+ ure : (NH 2 ) 2 CO (% đạm cao nhất)<br />
2.Phân lân (chứa P, độ dinh dưỡng theo %P 2 O 5 )<br />
(làm cành khỏe, chắc, quả to)<br />
+sunpephotphat đơn: Ca 3 (PO 4 ) 2 và CaSO 4<br />
+ sunpephotphat kép: Ca(H 2 PO 4 ) 2<br />
3.Phân kali (độ dinh dưỡng theo %K 2 O) (tăng cường<br />
chống bệnh, chống rét) : K 2 CO 3 (tro)<br />
4.Phân hỗn hợp (chứa N,P,K : NPK)<br />
Nitrophotka : (NH 4 ) 2 HPO 4 , KNO 3<br />
5.Phân phức hợp<br />
Amophot: NH 4 H 2 PO 4 , (NH 4 ) 2 HPO 4<br />
làm<br />
NO 2 : oxit axit, khí màu nâu đỏ<br />
NO 2 + 2NaOH→ NaNO 3 + NaNO 2 + H 2 O<br />
NO: oxit không tạo muối (không t/d axit, bazơ)<br />
Điều<br />
chế<br />
NHÓM VA<br />
(ns 2 np 3 )<br />
(N, P, As, Sb, Bi)<br />
Hợ<br />
p<br />
ch<br />
ất<br />
Tính chất<br />
đơn chất<br />
1. NH 3 làm tan (tạo phức) các kết tủa của Cu, Ag, Zn như Cu(OH) 2 , AgCl, Zn(OH) 2 ….<br />
2. Nhiệt phân muối nitrat : K……….. Ca Mg………………..Cu Ag……………….<br />
3. Muối photphat :H 2 PO 4 - (dihyrophotphat), HPO 4 2- (hydrophotphat), PO 4 3- (photphat)<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
1.Tính oxy hóa (tác dụng chất khử)<br />
0<br />
t cao<br />
+ tác dụng H 2 : N 2 + 3H 2 ←⎯ ⎯⎯ ⎯→ ⎯ 2NH 3<br />
+ tác dụng KL: N 2 + 3Mg → Mg 3 N 2<br />
* N 2 ở t 0 thường chỉ tác dụng Liti<br />
2.Tính khử (tác dụng chất oxy hóa)<br />
+ tác dụng oxy : N 2 + O 2<br />
ử đệ<br />
2NO<br />
P + O 2 ⎯⎯→ P 2 O 3 (thiếu O 2 ) hoặc P 2 O 5 (dư O 2 )<br />
+ tác dụng Cl 2 : (N 2 không tác dụng trực tiếp)<br />
P + Cl 2 ⎯⎯→PCl 3 hoặc PCl 5<br />
+ tác dụng hợp chất có tính oxy hóa :<br />
P + KClO 3 ⎯⎯→ 3P 2 O 5 + 5KCl<br />
Hợp chất Nitơ Photpho<br />
Aixt HNO 3 :axit mạnh, điều chế bằng pp sunfat H 3 PO 4 : axit trung bình<br />
Muối NO - 3 + H 2 SO 4 (đặc) → muối + HNO 3 - kém bền nhiệt<br />
- có tính oxy hóa mạnh ở N +5 H 3 PO 4 →H 4 P 2 O 7 → HPO 3<br />
Amoniac NH 3 : mùi khai, bazơ yếu: NH 3 (k) + HCl→ NH 4 Cl (khói trắng)<br />
+ tạo hydroxit KL kết tủa (trừ Na,K,Ba,Ca): NH 3 + M n+ + H 2 O → NH + 4 + M(OH) n<br />
+ tính khử mạnh<br />
*tác dụng O 2 (có xúc tác Pt tạo NO, không có xúc tác tạo N 2 )<br />
4NH 3 +5O 2 → 4NO + 6H 2 O 4NH 3 + 3O 2 → 2N 2 + 6H 2 O<br />
*tác dụng Cl 2 : 2NH 3 + 3Cl 2 →N 2 + 6HCl ( NH 3 tác dụng tiếp HCl tạo khói trắng)<br />
* tác dụng oxit KL tạo KL : 2NH 3 + 3CuO → 3Cu + N 2 + 3H 2 O<br />
* nhận biết ion NH + 4 : dùng OH -<br />
Điều chế : cho muối amoni + bazơ mạnh (NaOH, Ca(OH) 2 …)<br />
R(NO 2 ) n + O 2 R 2 O n + O 2 + NO 2 KL+ O 2 + NO 2<br />
Nhiệt phân muối amoni:<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
+ X là gốc axit Cl - , CO 2- 3 …: (NH 4 ) n X → NH 3 + HX<br />
+ X là gốc axit NO - 2 , NO - 3 : NH 4 NO 2 → N 2 + 2H 2 O<br />
NH 4 NO 3 → N 2 O + 2H 2 O<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
+ CO:HCOOH→CO + 2H 2 O<br />
+ CO 2 : muối CO 3 2- + axit<br />
+ Si : SiO 2 + 2Mg→ 2MgO + Si<br />
Quặng<br />
Canxit: CaCO 3<br />
Dolomit: CaCO 3 .MgCO 3<br />
Điều<br />
chế<br />
NHÓM IVA<br />
(ns 2 np 2 )<br />
(C, Si)<br />
Hợ<br />
p<br />
chấ<br />
t<br />
Tính chất<br />
đơn chất<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
1.Tính oxy hóa (tác dụng chất khử)<br />
+ tác dụng H 2 : C + 2H 2<br />
→CH 4<br />
+ tác dụng KL: 3C + 4Al→Al 4 C 3<br />
2.Tính khử (tác dụng chất oxy hóa)<br />
+ tác dụng oxy : C + O 2<br />
→CO 2 Si + O 2<br />
→ SiO 2<br />
+ tác dụng phi kim: Si + F 2 ⎯⎯→ SiF 4<br />
+ tác dụng hợp chất có tính oxy hóa :<br />
Si + 2NaOH + H 2 O ⎯⎯→ Na 2 SiO 3 + 2H 2<br />
C + CO 2 → 2CO<br />
Hợp chất Cacbon Silic<br />
Aixt<br />
H 2 CO 3 :axit yếu, dễ bị phân hủy thành CO 2 , H 2 O<br />
H 2 SiO 3 : axit rấtyếu, dạng rắn (sấy khô tạo thành silicagen<br />
hút ẩm mạnh)<br />
Oxit<br />
CO: : độc ,oxit không tạo muối(không t/d axit, bazơ),tính khử<br />
mạnh<br />
*CO khử được oxit KL sau Al<br />
CO 2 : khí không màu, dạng rắn gọi là “nước đá khô”<br />
SiO 2 (cát, thạch anh): tan chậm trong kiềm đặc, nóng,<br />
tan dễ trong kiềm nóng chảy<br />
*khắc chữ thủy tinh<br />
SiO 2 + 4HF → SiF 4 + 2H 2 O<br />
CO 2 làm tan CaCO 3 , BaCO 3<br />
CO 2 + CaCO 3 +H 2 O →Ca(HCO 3 ) 2<br />
Khi than ướt (cho C qua than nung đỏ): 44% CO còn lại CO 2 ,<br />
H 2 , N 2<br />
Khí lò gas (không khí qua than nung đỏ): 25% CO, N 2<br />
Muối Cacbonat (CO 2- 3 ) kết tủa kém bền nhiệt<br />
R 2 (CO 3 ) n → R 2 O n + CO 2<br />
*muối KL kiềm, amoni thì tan14<br />
Hydrocacbonat (HCO - 3 ) : lưỡng tính, kém bền nhiệt<br />
2HCO - 3 → CO 2- 3 + CO 2 + H 2 O<br />
Na 2 SiO 3 , K 2 SiO 3 : thủy tinh lỏng<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
<strong>ĐẠI</strong> CƯƠNG<br />
HỮU CƠ<br />
Là hợp chất cacbon (trừ CO,<br />
CO 2 , muối CO 3 2- , CN - , cacbua..)<br />
Ankan < C 4 : khí, C 5 → C 17 :<br />
lỏng, C 18 trở lên : rắn<br />
No (ankan)<br />
C n H 2n+2<br />
Hydrocacbon<br />
C n H 2n+2-2a<br />
(a là số lk )<br />
Thơm<br />
C n H 2n-6<br />
Phản ứng thế ở vòng (đặc trưng)<br />
Đồng đẳng<br />
Đồng phân<br />
Danh pháp<br />
hơn kém một hoặc nhiều CH 2 , cấu trúc tương tự nhau (khác số C nhưng giống cấu trúc)<br />
cùng CTPT nhưng khác cấu trúc (cùng số C nhưng khác cấu trúc)<br />
Số vị trí-tên nhóm thế (nhánh) + tên mạch C chính- số vị trí chức-tên chức<br />
-Mạch chính: chứa nhóm chức, nhiều nhánh, dài nhất (1C: me, 2C: et, 3C: prop, 4C: but, 5C: pent)<br />
-Đánh số: + sao cho nhánh, nhóm thế nhỏ nhất (ưu tiên chức→ nhánh)<br />
+ nhiều nhóm giống nhau : thêm đi, tri, tetra… (đọc tên nhánh theo thứ tự bảng chữ cái)<br />
<br />
Phản ứng thế CH 4 + Cl 2 → CH 3 Cl + HCl<br />
<br />
(đặc trưng) CH 3 -CH 2 -CH 3 + Cl 2 → CH 3 -CHCl-CH 3 (sp chính) Quy luật thế: tác nhân X ưu tiên thế<br />
CH 2 Cl-CH 2 -CH 3 (sp phụ)<br />
vào C bậc cao (C ít hydro)<br />
Phản ứng tách C n H 2n+2 → C m H 2m + C n’ H 2n’+2<br />
(Cracking)<br />
anken hoặc ankin+ H 2<br />
+ H 2 , Br 2<br />
+ HX (X là : OH, Br)<br />
Phản ứng cộng CH 2 =CH 2 + H 2 →CH 3 -CH 3 CH 2 =CH 2 + HX→ CH 3 -CH 2 X<br />
(đặc trưng) CH≡CH + H 2 →CH 2 =CH 2 CH 2 =CH-CH 3 + HX → CH 3 -CHX-CH 3 (chính)<br />
Không no<br />
+ 2H 2 →CH 3 -CH 3<br />
CH 2 X-CH 2 -CH 3 (phụ)<br />
Quy luật cộng: anken không đối xứng tác dụng HX thì X ưu tiên cộng vào C ít hydro<br />
Anken:C n H 2n Phản ứng oxy + oxy hóa không hoàn toàn: t/d KMnO 4 đều tạo MnO 2 ↓ (đen)<br />
Ankin hoặc<br />
hóa-khử<br />
* C 2 H 4 (etylen) → C 2 H 4 (OH) 2 (etylen glycol), C 2 H 2 (axetylen) → (HOOC) 2<br />
ankadien: C n H 2n-2<br />
(làm hoa quả mau chín) (axit oxalic)<br />
Phản ứng<br />
riêng<br />
+ Br 2 /Fe : C 6 H 6 + Br 2<br />
<br />
C 6 H 5 Br + HBr(ankyl benzen R-C 6 H 5 thế o, p)<br />
+ HNO 3 /H 2 SO 4 : C 6 H 6 + HNO 3<br />
<br />
C 6 H 5 NO 2 + H 2 O<br />
* Có ánh sáng thế vào nhánh (không thế vào vòng)<br />
+ benzen không tác dụng KMnO 4 , stiren (C 6 H 5 -CH=CH 2 ) : mất màu ngay<br />
<br />
ankyl benzen (R-C 6 H 5 ) + KMnO <br />
4 C 6 H 5 COOH (axit benzoic)<br />
Điều chế : benzen :trime C 2 H 2 ankylbenzen (R-C 6 H 5 ): C 6 H 6 + C n H 2n<br />
* Tên gốc : C n H 2n+1 - : tên số C + yl , CH 2 =CH-: vinyl, CH 2 =CH-CH 2 -: anlyl,<br />
C 6 H 5 - : pheyl , C 6 H 5 -CH 2 - : benzyl , CHCl 3 : clorofrom (làm thuốc mê)<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
Phản ứng trùng hợp nCH 2 =CH 2 → (-CH 2 -CH 2 -) n nCH 2 =CH-CH=CH 2 → (-CH 2 -CH=CH-CH 2 -) n<br />
+ Ankin đầu mạch (RC≡CH: thay H của ankin) : t/d AgNO 3 /NH 3<br />
RC≡CH / <br />
RC≡CAg↓ <br />
RC≡CH (nếu là C 2 H 2 → C 2 Ag 2 ↓)<br />
+ Ankadien (CH 2 =CH-CH=CH 2 : buta-1,3-dien, isopren (2-metyl buta-1,3-dien) )<br />
CH 2 =CH-CH=CH 2 + Br 2 → CH 2 Br-CHBr-CH=CH 2 (cộng 1-2 : giống anken)<br />
1 2 3 4<br />
CH 2 Br-CH=CH-CH 2 Br (cộng 1-4: cộng đầu-đuôi)<br />
1. CH≡CH (axetylen) <br />
CH 3 -CHO (andehyt axetic), CH≡CH đ,<br />
C 4 H 4 , C 6 H 6<br />
2. Điều chế: RCOONa + NaOH <br />
R-H + Na 2 CO 3 Al 4 C 3 + 12H 2 O→ 4Al(OH) 3 + 3CH 4<br />
Anken: tách nước từ ancol : CH 3 -CH 2 -OH , <br />
CH 2 =CH 2 + H 2 O<br />
Axetylen : 2CH 4<br />
, à ạ <br />
C 2 H 2 + 3H 2 CaC 2 +2H 2 O → Ca(OH) 2 + C 2 H 2<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
- có nhóm hydroxyl (OH) gắn với C no<br />
- CTTQ : C n H 2n+2-2k O a (k là số liên kết , a là số chức)<br />
- Danh pháp:<br />
+ tên thường :ancol + tên gốc R + ic<br />
CH 3 OH : metylic, C 2 H 5 OH : etylic, C 3 H 5 (OH) 3 : glyxerol<br />
+ tên IUPAC: ancol + tên hydrocacbon mạch chính + ol<br />
CH 3 OH : metanol, C 2 H 5 OH: etanol, C 3 H 7 OH: propanol<br />
- tan tốt trong nước, nhiệt độ sôi cao (do có liên kết H).<br />
Phân tử khối tăng thì t 0 sôi tăng, độ tan giảm<br />
Etanol<br />
+ từ etylen : C 2 H 4 + H 2 O→ C 2 H 5 OH (công nghiệp)<br />
+ từ tinh bột : (C 6 H <strong>10</strong> O 5 ) <br />
<br />
C 6 H 12 O 6 2C 2 H 5 OH<br />
-no , đơn chức : C n H 2n O (n≥1), C n H 2n+1 CHO (n≥0)<br />
*Thêm 1 liên kết : mất 2H : không no 1 liên đôi, đơn: C n H 2n-2 O<br />
Thêm 1 chức : mất 2H: no, hai chức : C n H 2n-2 O 2<br />
Danh pháp IUPAC: Tên hydrocacbon mạch chính + al<br />
+ HCHO : andehyt fomic (formandehyt) CH 3 CHO : andehyt axetic<br />
+ CH 2 =CH-CHO : anđehyt acrylic OHC-CHO : andehyt oxalic<br />
Điều chế : từ ancol hoặc anken<br />
- RCH 2 OH +CuO → RCHO +Cu + H 2 O<br />
- 2C 2 H 4 + O 2 →2CH 3 CHO<br />
- CH 4 + O 2 → HCHO + H 2 O<br />
Điều kiện không bền của ancol<br />
+ ancol có dạng : -CH=CH-OH→ -CH 2 -CH=O, -CH=C-OH→ -CH 2 -C=O<br />
+ ancol có nhiều OH trên 1 cacbon :-CH 2 -CH(OH)-OH → -CH 2 -CH=O<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
- Ít tan trong nước, nhiệt độ sôi<br />
thấp<br />
- dung dịch nước của andehyt<br />
fomic gọi là fomon(dùng ướp<br />
xác), 37-40% gọi là fomalin<br />
ANCOL(R<br />
OH)<br />
+<br />
H 2<br />
ANĐEHYT<br />
(R-CHO)<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
1.Tác dụng Na(tính axit)<br />
R(OH) a + aNa→R(ONa) a + H 2<br />
<br />
2. Tách nước<br />
-140 0 C : 2ROH →ROR + H 2 O<br />
- 170 0 C : ROH →C n H 2n + H 2 O<br />
Quy tắc tách: OH tách cùng H của C có ít H bên cạnh<br />
3.Khử CuO<br />
- Ancol bậc 1 (RCH 2 OH)<br />
RCH 2 OH + CuO→RCHO + Cu + H 2 O<br />
-Ancol bậc 2 (R 2 CHOH)<br />
R 2 CHOH + CuO→ R 2 CO + Cu + H 2 O<br />
Tính chất của ancol có nhiều nhóm OH - liên tiếp: tác<br />
dụng Cu(OH) 2 tạo phức xanh lam<br />
1.Tính khử<br />
+ Tác dụng AgNO 3 /NH 3 (tráng bạc)<br />
R(CHO) a<br />
/ <br />
R(COONH 4 ) a + 2a Ag<br />
* HCHO / <br />
(NH 4 ) 2 CO 3 + 4Ag<br />
+ HCl<br />
CO 2<br />
+ Tác dụng Br 2<br />
RCHO + Br 2 + H 2 O → RCOOH + 2HBr<br />
2. Tính oxy hóa<br />
+ Tác dụng H 2<br />
RCHO + H 2 → RCH 2 OH<br />
Axeton : CH 3 -CO-CH 3 (làm nước rửa móng<br />
tay )<br />
- tính chất giống andehyt nhưng không có<br />
tráng bạc, tác dụng brom<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
- no , đơn chức : C n H 2n O 2 (n≥2), C n H 2n+1 COOH (n≥0)<br />
*Thêm 1 liên kết : mất 2H : không no 1 liên đôi,<br />
đơn: C n H 2n-2 O 2<br />
Thêm 1 chức : mất 2H: no, hai chức : C n H 2n-2 O 4<br />
Danh pháp : Tên hydrocacbon no mạch chính + oic<br />
+ HCOOH : Axit fomic (metanoic)<br />
+ CH 3 COOH : axit axetic (etanoic)<br />
+ CH 2 =CH-COOH : axit acrylic<br />
+ HOOC-COOH : axit oxalic<br />
tan trong nước, nhiệt độ sôi cao (do có liên kết H)<br />
-R : đẩy e : tăng tính axit (OH, C n H 2n+1 - (nhiều C đẩy<br />
mạnh) , OCH 3 , -NH 2<br />
- R hút e : giảm tính axit (Cl, F, nối đôi, nối ba, vòng<br />
benzen.)<br />
PHENOL<br />
(C 6 H 5 OH)<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
AXIT<br />
(R-COOH)<br />
1.Tính axit (do có H + )<br />
RCOOH + NaHCO 3 (Na 2 CO 3 ) → RCOONa + CO 2 + H 2 O<br />
RCOOH + Na → RCOONa + H 2<br />
2. Tác dụng ancol (phản ứng este hóa)<br />
RCOOH + R ’ OH ↔ RCOOR ’ + H 2 O<br />
*Tính chất đặc biệt của HCOOH<br />
- tác dụng AgNO 3 /NH 3 → 2Ag + (NH 4 ) 2 CO 3<br />
- tác dụng Brom<br />
Điều chế : Từ ancol hoặc anđehyt<br />
- CH 3 OH + CO → CH 3 COOH<br />
men giaám<br />
- C 2 H 5 OH + O 2 ⎯⎯⎯⎯→ CH 3 COOH +H 2 O<br />
- 2CH 3 CHO + O 2 →2CH 3 COOH<br />
Chất rắn,độc, gây bỏng da, không tan trong nước lạnh, tan trong nước nóng, là<br />
axit yếu hơn H 2 CO 3 (không làm quỳ hóa đỏ)<br />
1. Tính axit yếu (do vòng bezen ảnh hưởng OH)<br />
+ Tác dụng Na : C 6 H 5 OH + Na→ C 6 H 5 ONa + H 2<br />
<br />
+ Tác dụng NaOH : C 6 H 5 OH + NaOH→ C 6 H 5 ONa + H 2 O<br />
*Tác dụng anhydric axit:C 6 H 5 OH + (RCO) 2 O→ RCOOC 6 H 5 + RCOOH<br />
2. Phản ứng tại vòng benzen (do OH ảnh hưởng vòng benzen, thế dễ hơn benzen)<br />
+ Tác dụng brom: C 6 H 5 OH + 3Br 2 → C 6 H 2 Br 3 OH↓ + 3HBr<br />
kết tủa trắng<br />
+ tác dụng HNO 3 : tạo axit picric (kết tủa vàng) C 6 H 2 (NO 2 ) 3 OH<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
Điều chế: từ<br />
cumen(ispropyl<br />
benzen) tạo phenol<br />
vàaxeton<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Ứng dụng:làm phẩm<br />
nhuộm, dược phẩm,<br />
chất diệt cỏ (2,4-D)<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
CTTQ : no , đơn chức : C n H 2n O 2 (n≥2)<br />
*thêm 1 chức hay 1 lk thì mất 2H<br />
→ không no, 1 lk đôi: C n H 2n-2 O 2 (n≥3)<br />
No, hai chức: C n H 2n-2 O 4<br />
Danh pháp :<br />
Tên R ’ + tên axit (bỏ “ic” thay=<br />
“at”)<br />
- HCOO - : fomat (fomiat)<br />
- CH 3 COO - : axetat<br />
- C 2 H 5 COO - : propionat<br />
- CH 2 =CH-COO - : acrylat<br />
- CH 3 - : metyl , C 2 H 5 - : etyl<br />
C H - : phenyl , C H -CH -: benzyl<br />
ESTE<br />
(R-COOR ’ )<br />
1.Thủy phân<br />
+mt axit :<br />
RCOOR ’ +H 2 O ⎯⎯→<br />
H +<br />
←⎯⎯ RCOOH + R’ OH<br />
+mt bazơ (xà phòng hóa)<br />
RCOOR ’ + NaOH →RCOONa + R ’ OH<br />
*Nếu R’ là gốc không no, có dạng<br />
+ CH 2 =CH-…. : thì thu anđehyt<br />
+ C 6 H 5 - (C 6 H 4 ….): thu muối phenol<br />
dễ bay hơi, không tan<br />
trong nước, mùi đặc<br />
trưng (làm nước hoa) Điều chế :<br />
- axit + ancol→ este + H 2 O (este hóa)<br />
- anhyđric axit + phenol → RCOOC 6 H 5<br />
C 15 H 31 : pamitic<br />
no, chất rắn<br />
(mỡ, bơ…)<br />
[(RCO) 2 O]<br />
C 17 H 35 : stearic<br />
-vinyl axetat : CH 3 COOH + C 2 H 2<br />
C 17 H 33 : oleic (1 lk đôi) hydro hóa<br />
C 17 H 31 : linoleic (2 =)<br />
C 17 H 29 : linolenic (3 =)<br />
không no, chất<br />
lỏng (dầu) Chất béo - Trieste (triglyxerit, triaxyl) của axit béo (đơn,<br />
(RCOO) 3 C 3 H 5 dài, số C≥ 16) vớiglyxerol (C 3 H 5 (OH) 3 )<br />
Isoamylic axetat : mùi chuối<br />
- Muối của Na, K với axit béo : xà phòng<br />
Triglyxerit, triaxylglixerol<br />
Benzyl axetat: hoa nhài<br />
-Chất béo ôi, thiu: do oxy hóa lk C=C<br />
etyl butirat, etyl propionat: mùi dứa<br />
Lipit<br />
CACBOHYDRAT<br />
Monosaccarit<br />
Disaccarit<br />
Polysaccarit<br />
t<br />
C 6 H 12 O 6 C 12 H 22 O 11 (C 6 H <strong>10</strong> O 5 ) n<br />
hỗn hợp chất béo, sáp, photphoric…<br />
có nhóm OH-(ancol)<br />
Glucozơ Fructozơ Saccarozơ Mantozơ Tinh bột Xenlulozơ<br />
OH -<br />
(nho, trong máu (mật ong, 40%) (mía)<br />
(C 6 H 7 O 2 (OH) 3 ) n<br />
người 0,1% )<br />
+ H + (axit)<br />
(thủy phân)<br />
gồm<br />
glucozơ, fructozơ 2 glucozơ<br />
+ amilozơ<br />
+ amilopectin : có nhánh<br />
-nhiều OH liên tiếp→t/d Cu(OH) 2<br />
-chức CHO→t/d AgNO 3 /NH 3 , Br 2 (glucozơ bị oxi hóa)<br />
-5 nhóm OH→t/d anhydric axetic (CH 3 CO) 2 O<br />
(C 6 H <strong>10</strong> O 5 ) n → C 6 H 12 O 6 → 2CO 2 + 2C 2 H 5 OH<br />
C 6 H 12 O 6 → 2Ag<br />
C 6 H 12 O 6 + H 2 →C 6 H 14 O 6 (sobitol)<br />
Glucozơ + Br 2 → axit gluconic (glucozơ bị khử)<br />
( )<br />
(C 6 H <strong>10</strong> O 5 ) n glucozơ<br />
Tinh bột, xenlulozơ<br />
- Tinh bột và xenlulozơ không phải đồng phân,<br />
không tan trong nước lạnh.<br />
- Tinh bột tan trong nước nóng<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
-Glucozơ làm thuốc tăng lực, tráng ruột phích. Saccarozơ pha chế thuốc, làm bánh kẹo<br />
- Chuyển hóa tinh bột trong cơ thể :Tinh bột→đextrin→mantozơ→glucozơ(dự trữ ở gan: glicogen)<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
-thay H của NH 3 bằng gốc R<br />
thu được amin<br />
+ RNH 2 : amin bậc 1<br />
+ R 2 NH : amin bậc 2<br />
+ R 3 N : amin bậc 3<br />
-Danh pháp<br />
+ tên gốc R + amin<br />
+ tên IUPAC :<br />
tên hydrocacbon + amin<br />
CTTQ :<br />
- amin đơn chức (RN)<br />
- no, đơn chức : C n H 2n+3 N<br />
(n≥ )<br />
AMINO AXIT<br />
(NH 2 -R-COOH)<br />
AMIN<br />
(R-NH 2 )<br />
Gây mùi tanh của<br />
cá→ dùng axit để<br />
khử (giấm, chanh)<br />
- CH 3 NH 2 , C 2 H 5 NH 2 , CH 3 NHCH 3 ,<br />
(CH 3 ) 3 N : chất khí mùi khai, tan<br />
trong nước , độc<br />
- C 6 H 5 NH 2 ( anilin, phenylamin) :<br />
chất lỏng không màu, hóa đen ngoài<br />
không khí.<br />
-Tính bazơ (do cặp e tự do trên N)<br />
+ làm quỳ hóa xanh (trừ anilin)<br />
+ tác dụng axit :<br />
RNH 2 + HCl → RNH 3 Cl<br />
HNO 3 → RNH 3 NO 3<br />
* phản ứng riêng của anilin<br />
C 6 H 5 NH 2 + 3Br 2 → C 6 H 2 Br 3 NH 2 ↓+ 3HBr<br />
(kết tủa trắng)<br />
-Danh pháp<br />
+ tên thường :<br />
Glyxin : H 2 N-CH 2 -COOH Alain : H 2 N-CH(CH 3 )-COOH<br />
Valin (117 : 1 NH 2 , 1 COOH) Lysin (M=146) (2 NH 2 )<br />
Axit glutamic : H 2 N-C 3 H 5 -(COOH) 2 (muối mono Na: làm bột<br />
ngọt, axit glutamic làm thuốc bổ thần kinh, methionin: bổ gan)<br />
+ tên IUPAC : axit + số chỉ vị trí nhóm NH 2 + tên axit<br />
(Nếu dùng , , … thì tên axit là tên thường<br />
Nếu dùng 1,2,3…..thì tên axit là tên IUPAC)<br />
* -amino axit (aminoaxit tự nhiên, kiến tạo tế bào) : NH 2 và<br />
COOH cùng gắn trên một C : vd : NH 2 -CH 2 -COOH<br />
CTTQ : - amino axit no1 nhóm NH 2 , 1 nhóm COOH<br />
H 2 N-R-COOH (C n H 2n+1 O 2 N)<br />
-là chất rắn kết tinh không màu, tan trong nước (do tồn tại dạng<br />
ion lưỡng cực), nhiệt độ sôi, nóng chảy cao<br />
1.Tính lưỡng tính<br />
H 2 N-R-COOH + HCl → ClH 3 N-R-COOH<br />
H 2 N-R-COOH + HNO 3 → HOOC-R-NH 3 NO 3<br />
H 2 N-R-COOH + NaOH → H 2 N-RCOONa + H 2 O<br />
2. Tính chất nhóm COOH<br />
+ Tác dụng ancol (R’OH)<br />
H 2 N-R-COOH + R’OH →H 2 N-R-COOR’ + H 2 O<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
dạng sợi:<br />
tóc, lông, móng<br />
không tan<br />
PEPTIT-<br />
PROTEIN<br />
nhi<br />
ệt<br />
độ<br />
đông tụ<br />
dạng cầu :<br />
hồng cầu….<br />
tan<br />
- Do -amino axit tạo nhau qua liên kết peptit (CO-NH)<br />
- Trong peptit: Aminoaxit đầu (Đầu N : chứa NH 2 ), aminoaxit<br />
đuôi (đầu C: chứa COOH)<br />
- Tên : tên gốc axyl (đầu N) + tên aminoaxit đuôi C (giữ nguyên)<br />
Ví dụ: NH 2 -CH 2 -CONH-CH 2 -COOH : GlyxylGlyxin (Gly-Gly)<br />
1.Phản ứng thủy phân<br />
+ mt axit : peptit + H 2 O <br />
-amino axit<br />
+ mt bazơ : peptit + NaOH → muối -amino axit + H 2 O<br />
2. Phản ứng màu biure<br />
Peptit + Cu(OH) 2 tạo sản phẩm màu tím xanh (trừ đipeptit)<br />
+ HNO 3 tạo sản phẩm màu vàng<br />
1. Tác dụng (AgNO 3 /NH 3 ) tạo Ag (tráng bạc, gương): RCHO, HCOOR, glucozơ, fructozơ<br />
AgNO 3 /NH 3 tạo tủa vàng: nối ba đầu mạch R-C≡CH<br />
2. Tác dụng Br 2 (mất màu): nối =, nối ≡ , glu, CHO, HCOOR<br />
Tác dụng được với H 2<br />
mất màu, tạo kết tủa trắng : phenol , anilin<br />
3. Tác dụng Cu(OH) 2 màu xanh lam: axit RCOOH, glu, fruc, sacca, glyxerol(C 3 H 5 (OH) 3 ),<br />
etylenglycol (C 2 H 4 (OH) 2 )<br />
4. Thủy phân trong axit , bazơ : este, protein, peptit, các loại nilon (amit) , tơ lapsan<br />
axit : tinh bột, xenlulozơ, saccarozơ<br />
5. Thứ tự bazơ : C 6 H 5 NH 2 < NH 3 < amin bậc 1 < amin bậc 2 < NaOH<br />
6. Đổi màu quỳ<br />
+ hóa đỏ : muối amoniclorua, muối clorua , amino axit có COOH > NH 2 (axit glutamic)<br />
+ hóa xanh : muối natri, amin (trừ anilin), amino axit có COOH < NH 2 (lysin)<br />
+ không đổi : amino axit số COOH = số NH 2<br />
7. Nhận biết<br />
• Quỳ tím (nếu thấy có amin, axit… )<br />
• Dung dịch brom (nếu thấy có Phenol , anilin, hợp chất không no)<br />
• Phân biệt giữa Glucozơ và Fructozơ dùng dung dịch brom.<br />
• Cu(OH) 2 ( nếu thấy có Glucozơ , Glixerol, anđehit, peptit... )<br />
• Phân biệt giữa đipeptit và các polipeptit khác dùng Cu(OH) 2 (phản ứng màu biure)<br />
• Nhận biết protein (lòng trắng trứng …) : + dùng Cu(OH) 2 ⇒ có màu tím<br />
+ dùng HNO 3 ⇒ có màu vàng.<br />
8. Tác dụng NaOH : axit RCOOH , este , amino axit, muối amoni của amin, peptit (protein),<br />
phenol<br />
9.Nhiệt độ sôi: amino axit > axit > phenol>ancol > este, andehyt, xeton, ete<br />
(M càng lớn thì t 0 sôi càng cao)<br />
<strong>10</strong>. Muối amoni :<br />
+ C x H y O 2 N : RCOONH 4 hoặc RCOONH 3 R’ (có thể dạng muối amin bậc II, III)<br />
+ C x H y O 3 N (C x H y O 6 N 2 ) : RNH 3 -HCO 3<br />
+ C x H y O 3 N : RNH 3 -NO 3 hoặc (RNH 3 ) 2 CO 3 ( R-NH 3 -CO 3 -NH 4 )<br />
+ C x H y O 4 N 2 : R(COONH 4 ) 2 hoặc , R(COONH 3 R’)<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Phản ứng thủy phân<br />
m/trường axit<br />
Poly este<br />
tơ polyamit.<br />
Tinh bột<br />
xenlulozơ<br />
m/trường bazơ<br />
Poly este<br />
tơ polyamit.<br />
Tơ clopren<br />
Theo cấu trúc mạch<br />
+ Mạch phân nhánh :<br />
amilopectin, glicogen…<br />
+ Mạch mạng lưới. :cao su lưu<br />
hóa, nhựa bakelit…<br />
Theo cách tổng hợp<br />
- Trùng hợp : các loại nhựa, cao su (trừ nhựa<br />
phenolformandehyt hay novolac là trùng ngưng)<br />
- Trùng ngưng : các loại tơ (trừ tơ nitron (olon,<br />
nitrin, acronitrin, vinylcianua là trùng hợp), tơ<br />
capron (đi từ caprolactam))<br />
TÍNH CHấT<br />
PHảN ứNG<br />
Phân loại<br />
POLYME<br />
(M lớn , do nhiều mắt<br />
xích tạo thành)<br />
CÁCH TổNG HợP<br />
(cộng hợp phân tử nhỏ<br />
giống hay tương tự nhau )<br />
Theo nguồn gốc<br />
- polyme tự nhiên : tinh bột, xenlulozơ, tre, nứa, bông, len, tơ tằm (glyxin), protein<br />
- polyme hóa học<br />
+ polyme bán tổng hợp (nhân đạo) : tơ visco (từ xenlulozơ) , tơ axetat (xenlulozơ<br />
axetat)<br />
+ polyme tổng hợp :các loại còn lại<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
Chất rắn, độ nhớt cao ( do M lớn ), không tan trong dung<br />
môi bình thường<br />
không bay hơi, không có nhiệt độ nóng chảy xác định(vì<br />
gồm nhiều loại mắc xích khác nhau)<br />
Đun<br />
nóng<br />
*Axit axetic không tham gia phản ứng trùng ngưng<br />
* Nhựa phenolformandehyt (PPF) : trùng ngưng từ phenol + andehyt fomic<br />
* Tên polyme: poly + tên monome(nếu tên monome từ 2 từ hoặc đi<br />
từ 2 monome thì tên monome để trong ngoặc)<br />
* Ví dụ : CH 2 =CH 2 → -(CH 2 -CH 2 -) n<br />
CH 2 =CH 2 : monome , -CH 2 -CH 2 - : mắt xích , n : hệ số polyme, số mắc xích<br />
Poly Isopren poly clopren<br />
CH 2 =C-CH=CH 2 CH 2 =C-CH=CH 2<br />
CH 3 Cl<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
nguội rắn lại<br />
phân hủy<br />
Chất nhiệt<br />
dẻo<br />
Chất nhiệt<br />
rắn<br />
- Trùng hợp :có nối đôi hoặc vòng kém bền<br />
*chất có nối đôi: tên có “en”, vinyl, acry, clopren.. (trừ<br />
toluen, xilen, cumen). Axetilen (CH≡CH) vẫn trùng hợp<br />
- Trùng ngưng : có giải phóng H 2 O<br />
Điều kiện: có 2 nhóm chức có khả năng tạo liên kết với<br />
nhau (NH 2 và COOH) hoặc (OH và COOH)<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Cao su buna (C 4 H 6 )n : đi từ buta-1,3-đien<br />
nCH 2 =CH-CH=CH 2 →(-CH 2 -CH=CH-CH 2 -) n<br />
Cao su thiên nhiên : (C 5 H 8 )n mắc xích là<br />
isopren(2-metyl buta-1,3-dien), tuy nhiên<br />
cao su isopren không phải cao su thiên<br />
nhiên<br />
Cao su buna-S<br />
Buta-1,3-dien + stiren<br />
Đồng trùng hợp<br />
Tơ polyamit<br />
Cao su<br />
Cao su buna -N<br />
Buta-1,3-dien + acronitrin<br />
Tơ vinylic<br />
(tơ nitron,nitrin, olon, len nhân tạo)<br />
nCH 2 =CH-CN →-[-CH 2 -CH(CN)-]- n<br />
Phương trình trùng ngưng<br />
nNH 2 -R-COOH→(-NH-R-CO-) n + nH 2 O<br />
Nilon-6 (tơ capron)<br />
H 2 N-(CH 2 ) 5 -COOH<br />
Trùng hợp<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
Nilon-7 (tơ enăng)<br />
H 2 N-(CH 2 ) 6 -COOH<br />
VẬT LIỆU<br />
POLYME<br />
Chất dẻo<br />
Tơ<br />
(có khả năng<br />
kéo sợi)<br />
PE (poly etylen) làm màng<br />
mỏng, túi đựng:<br />
nCH 2 =CH 2 →(-CH 2 -CH 2 -) n<br />
Poly vinyl ancol:thủy phân<br />
trong NaOH từừ poly vinlyl<br />
axetat (PVA)<br />
PMMA (poly metylmetacrylat) :thủy tinh hữu cơPEXIGLAS<br />
CH 3<br />
n CH 2 =C(CH 3 )-COOCH 3 → -CH 2 -Cn<br />
COOCH 3<br />
PVC (poly vinyl clorua) làm ống nước, da giả:<br />
n CH 2 =CH-Cl →-CH 2 -CHn<br />
Cl<br />
Tơ polyeste (tơ lapsan)<br />
n(p-HOOC-C 6 H 4 -COOH) + n HO-CH 2 -CH 2 -OH→→ CO-C 6 H 4 -CO-O-CH 2 -CH 2 -O n + 2n H<br />
axit terephtalic etylen glycol poly (etylen-teraphatalt)<br />
Đồng trùng ngưng<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
Telflon (tetraflo<br />
etylen):chất chống dính<br />
nCF 2 =CF 2 →(-CF 2 -CF 2 -<br />
PS (poly stiren) :<br />
C 6 H 5 -CH=CH 2<br />
PP (poly propilen):<br />
CH 2 =CH-CH 3<br />
n H 2 N-(CH 2 ) 6 -NH 2 + n HOOC-(CH 2 ) 4 -COOH→ NH-(CH 2 ) 6 NH-CO-(CH 2 ) 4 -CO n + 2nH 2 O<br />
hexametylendiamin axit adipic<br />
nilon- 6,6<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
KIM LOẠI<br />
(có 1→ 3 electron<br />
ngoài cùng)<br />
Ăn mòn kim loại<br />
(phá hủy bề mặt<br />
do môi trường)<br />
Quá trình<br />
oxy hóa-khử<br />
Điều chế<br />
Khử ion KL → KL<br />
Tính khử<br />
không có<br />
dòng điện<br />
có dòng điện<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
Tính dẫn nhiệt<br />
Ánh kim<br />
Tính dẫn điện<br />
Tính dẻo<br />
t 0 cao→ dẫn điện giảm<br />
do electron tự do gây ra<br />
tính oxy hóa ion tăng dần, tính khử kim loại giảm dần<br />
K + Ba 2+ Ca 2+ Na + Mg 2+ Al 3+ Zn 2+ Cr 3+ Fe 2+ Ni 2+ Sn 2+ Pb 2+ H + Cu 2+ Fe 3+ Ag +<br />
K Ba Ca Na Mg Al Zn Cr Fe Ni Sn Pb H 2 Cu Fe 2+ Ag<br />
Điện phân nóng chảy<br />
(kim loại mạnh)<br />
1.Tác dụng phi kim<br />
+O 2 : trừ Ag, Au, Pt<br />
Ví dụ : 3Fe+ 2O 2 → Fe 3 O 4 (FeO.Fe 2 O 3 )<br />
+ phi kim khác : Cl 2 , S, N 2 …<br />
Ví dụ : 2Fe + 3Cl 2 → 2FeCl 3<br />
nhiệt luyện (dùng CO, H 2 , Al, C<br />
khử oxit)(KL trung bình, yếu)<br />
3. Tác dụng muối<br />
KL mạnh + muối KL yếu → muối mới + KL mới<br />
( pp thủy luyện)<br />
Ví dụ : Fe + CuSO 4 → FeSO 4 + Cu<br />
*Riêng KL tan trong H 2 O<br />
ví dụ Na + CuSO 4 thì thứ tự phản ứng<br />
Pứ : 2Na + 2H 2 O → 2NaOH + H 2<br />
NaOH + CuSO 4 → Na 2 SO 4 + Cu(OH) 2<br />
Ăn mòn hóa học<br />
Ăn mòn điện hóa<br />
ăn mòn nhanh hơn<br />
- electron chuyển trực tiếp<br />
- do tác dụng O 2 , H 2 O ở t 0 cao<br />
- 2 điện cực tiếp xúc (KL-KL, KL-C(Pt))<br />
- dung dịch điện ly (H 2 O, axit, bazo, muối)<br />
- KL mạnh hơn bị ăn mòn (anot (cực âm): sự khử)<br />
- Kim loại càng nguyên chất→khó ăn mòn<br />
Dẻo nhất : Au Nhẹ nhất : Li<br />
Mềm nhất: CsCứng nhất : Cr<br />
Nóng chảy cao nhất : W<br />
Dẫn điện : Ag>Cu>Au>Al>Fe<br />
thủy luyện(KL yếu)<br />
Fe 2+<br />
Cu 2+<br />
Fe<br />
Cu<br />
Chiều phản ứng<br />
2. Tác dụng axit<br />
+ HCl, H 2 SO 4 loãng (trừ Ag, Cu, Au, Pt)<br />
(* Fe tạo muối Fe(II) )<br />
HCl<br />
KL + → muối + H 2<br />
H<br />
2SO4(<br />
l)<br />
+ HNO 3 , H 2 SO 4 đặc :<br />
(*Fe và hợp chất Fe(II) tạo muối Fe(III) )<br />
HNO3<br />
KL + → muối + sản phẩm khử + H 2 O<br />
H<br />
2SO4(<br />
đ )<br />
*Al, Fe, Cr thụ động trong HNO 3 , H 2 SO 4 đặc<br />
nguội<br />
4.Tác dụng H 2 O ở t 0 thường ( Na, K, Ca, Ba, Li)<br />
2R +2n H 2 O → 2R(OH) n + nH 2<br />
5.Tác dụng H 2 O có OH - ( Al, Zn)<br />
2Al + 2H 2 O + 2NaOH → 2NaAlO 2 + 3H 2<br />
Bảo vệ<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
- cách ly với môi trường<br />
- bề mặt: sơn, phủ, mạ<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
- điện hóa: dùng KL mạnh hơn hy sinh<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Chất điện ly<br />
đ<br />
Pt: 2MCl n 2M + nCl 2<br />
catot anot<br />
Pt: 2MOH đ<br />
2M + O 2 +H 2 O<br />
catot anot<br />
Pt: 2Al 2 O 3<br />
đ,<br />
4Al + 3O 2<br />
CÔNG THỨC<br />
FARADAY<br />
=<br />
. <br />
. . <br />
. <br />
đổ =<br />
<br />
nóng chảy<br />
dung dịch<br />
CO, CO 2 , O 2 dư<br />
dòng điện một chiều<br />
quá trình oxy hóa-khử<br />
Muối clorua<br />
(IA,IIA)<br />
Hydroixt<br />
(Na,K)<br />
Al 2 O 3<br />
điện cực C (graphic)<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
m : klượng chất sinh ra ở điện<br />
cực<br />
M: phân tử khối<br />
I: cường độ dòng điện (A)<br />
a: số e trao đổi tạo 1 phân tử<br />
t: thời gian điện phân<br />
xảy ra tại bề mặt điện cực<br />
ĐIỆN PHÂN<br />
NÓNG CHẢY<br />
(kim loại mạnh)<br />
ĐIỆN PHÂN<br />
Catot (cực -)<br />
1. ion KL từ Zn 2+ về sau<br />
(ion mạnh đp trước)<br />
2. H 2 O hoặc H + axit<br />
2H 2 O + 2e → H 2 + 2OH -<br />
3. ion từ Al 3+ đến trước<br />
không bị điện phân<br />
Pt điện phân:<br />
Anot (cực +)<br />
(hút ion âm)<br />
X n- → X + ne<br />
Catot (cực -)<br />
(hút ion dương)<br />
M n+ + ne → M<br />
ĐIỆN PHÂN<br />
DUNG DỊCH<br />
(kim loại trung bình và yếu)<br />
Thứ tự điện phân<br />
2RCl n<br />
đ<br />
sphẩm<br />
sphẩm<br />
Anot (cực +)<br />
1. ion Cl - , S 2-<br />
2Cl - → Cl 2 +2e<br />
Cl 2 hoặc O 2<br />
Sự oxy hóa<br />
Kim loại hoặc H 2<br />
Sự khử<br />
2.H 2 O hoặc OH - bazơ<br />
2H 2 O → O 2 + 4H + + 4e<br />
3. ion NO 3 - , SO 4 2- , PO 4 3- …<br />
không điện phân<br />
2R + nCl 2 (R là KL sau Al )<br />
2RCl n + 2nH 2 O đ<br />
2R(OH) n + nCl 2 + nH 2<br />
(R là KL trước Al )<br />
RX + H 2 O đ<br />
R + O 2 + HX<br />
(X : NO - 3 , SO 2- 4 ……, R là KL sau Al )<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
Nếu anot làm bằng KL của muối<br />
thì cực dương bị tan ra (anot tan)<br />
M → M n+ + ne (m catot tăng =m anot giảm)<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
HCO 3<br />
-<br />
CO 3<br />
2-<br />
SO 4<br />
2-<br />
Tác dụng H 2 O<br />
Tác dụng O 2<br />
Tác dụng oxit<br />
Nước<br />
Nhóm IA<br />
Nhóm IIA<br />
- dễ bị nhiệt phân: HCO - 3 → CO 2- 3 + CO 2 + H 2 O<br />
- muối axit (lưỡng tính): HCO - 3 + H + → CO 2 + H 2 O<br />
HCO - 3 + OH - → CO 2- 3 + H 2 O<br />
*NaHCO 3 làm thuốc chữa dạ dày<br />
Na 2 CO 3 : soda<br />
CaCO 3 :đá vôi ,kém bền nhiệt<br />
(bền với nhiệt): tẩy sạch dầu<br />
CaCO 3 → CaO + CO 2<br />
mỡ chi tiết máy, tráng kim - xâm thực vùng có đá vôi:<br />
loại, làm thủy tinh, gốm CaCO 3 +CO 2 + H 2 O→ Ca(HCO 3 ) 2<br />
- tạo thạch nhũ:<br />
Ca(HCO 3 ) 2 → CaCO 3 + CO 2 +H 2 O<br />
-bền với nhiệt<br />
CaSO 4 .2H 2 O: thạch cao sống<br />
2CaSO 4 .H 2 O: thạch cao nung: đúc tượng, tạo khuôn, phấn, bó bột<br />
CaSO 4 : thạch cao khan<br />
Nhóm IA<br />
Nhóm IIA<br />
2R + 2nH 2 O → 2R(OH) n + nH 2<br />
* Be hoàn toàn không phản ứng, Mg phản ứng chậm ở t 0 thường (coi như<br />
đ ó<br />
không phản ứng): Mg + H 2 O hơi MgO + H 2<br />
4R + nO 2 → 2R 2 O n<br />
* Nhóm IA ở nhiệt độ cao tạo: R 2 O 2 hoặc RO 2<br />
2Na + CuO → 2Mg + CO<br />
Na 2 O + Cu<br />
2 → 2MgO + C<br />
Không dùng CO 2 dập đám cháy có Mg<br />
Nguyên tắc làm mềm: loại Ca 2+ , Mg 2+ →đưa về dạng kết tủa<br />
vĩnh cửu<br />
-<br />
không chứa HCO 3<br />
Cứng<br />
(chứa SO 2- 4 , Cl - )<br />
Mềm<br />
chứa HCO 3<br />
-<br />
tạm thời<br />
đun nóng<br />
Na 2 CO 3 , Na 3 PO 4<br />
toàn phần<br />
Nhiệt độ nóng chảy, sôi<br />
Nhóm IA<br />
thấp<br />
(giảm dần từ Li→Cs)<br />
Nhóm IIA<br />
Cao hơn IA<br />
(không theo 1 chiều)<br />
Tính cứng Mềm Cứng hơn IA<br />
Điện phân nóng chảy<br />
Điều chế<br />
đệ â ó ả<br />
4R(OH) n 4R + nO 2 + 2nH 2 O<br />
đệ â ó ả<br />
2RCl n 2R + nCl 2<br />
Hợp chất phổ biến<br />
Nước cứng : nhiều Ca 2+ , Mg 2+ (làm giảm vị thức ăn, tốn xà phòng (do tạo kết tủa), tắc ống dẫn) nhưng chất<br />
giặt rửa tổng hợp giặt được trong nước cứng)<br />
(2HCO 3 - → CO 3 2- + CO 2 + H 2 O)<br />
Ca(OH) 2 vừa đủ, Na 2 CO 3<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
Mềm<br />
Tính chất<br />
đặc trưng<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
Tính chất vật lý<br />
KIM LOẠI NHÓM IA, IIA<br />
(IA: Li,Na,K,Rb,Cs : ns 1<br />
IIA: Be, Mg, Ca,Sr,Ba : ns 2 )<br />
Ứng dụng<br />
-Be: chế tạo hợp kim tính đàn hồi cao, bền,<br />
chắc<br />
-Mg: tạo hợp kim cứng, nhẹ, bền chế tạo máy<br />
bay, tên lửa, ôtô…<br />
Kim lọai kiềm dùng trong thiết bị báo cháy,<br />
tổng hợp hữu cơ…<br />
-Na, K:chất trao đổi nhiệt trong lò hạt nhân.<br />
- Cs dùng làm tế bào quang điện.<br />
1. Bảo quản kim loại kiềm trong dầu hỏa<br />
2. Quặng dolomit: CaCO 3 .MgCO 3<br />
3. CO 2 vào Ca(OH) 2 : tạo kết tủa sau đó kết tủa<br />
(CaCO 3 ) tan trong CO 2 dư<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
- chế tạo máy bay, ô tô, tên lửa...<br />
- trang trí nội thất<br />
-hỗn hợp “tecmit” (gồm Al + Fe 2 O 3 )<br />
dùng hàn đường ray<br />
criolit<br />
⎯⎯⎯→4Al + 3O 2<br />
2Al 2 O 3<br />
(boxit)<br />
-Criolit : Na 3 AlF 6 (3NaF.AlF 3 ) : hạ<br />
nhiệt độ nóng chảy, tạo hỗn hợp dẫn<br />
điện tốt hơn, bảo vệ nhôm không bị<br />
oxy hóa<br />
Ứng dụng<br />
Điều chế<br />
NHÔM<br />
(Al: 3s 2 3p 1 )<br />
trắng, mềm, nhẹ<br />
HỢP CHẤT<br />
NHÔM<br />
Tính<br />
chất<br />
có tính lưỡng tính<br />
Al 2 O 3 (rắn, bền)<br />
Al(OH) 3 (trắng, dạng keo)<br />
Tính lưỡng tính + tác dụng axit<br />
Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O<br />
Al(OH) 3 + 3HCl → AlCl 3 + 3H 2 O<br />
+ tác dụng bazơ<br />
Al 2 O 3 + 2OH - → 2AlO - 2 + H 2 O<br />
Al(OH) 3 + OH - → AlO - 2 + 2H 2 O<br />
Dạng tự nhiên<br />
Al 2 O 3 .2H 2 O : boxit<br />
-corindon : cứng, không màu (lẫn<br />
Cr 2 O 3 :màu đỏ (rubi)<br />
Phèn chua, phèn nhôm: KAl(SO 4 ) 2 .12H 2 O (K 2 SO 4 .Al 2 (SO 4 ) 3 .24H 2 O) : làm trong nước, cầm máu..<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
1.Tác dụng phi kim<br />
2. Tác dụng axit<br />
*Al thụ động hóa trong HNO 3 , H 2 SO 4 đặc nguội<br />
3. Tác dụng muối của KL yếu hơn<br />
4. Tác dụng H 2 O<br />
-Al có lớp oxit Al 2 O 3 bảo vệ nên không phản ứng<br />
5. Tác dụng H 2 O có bazơ<br />
Thứ tự phản ứng : 2Al + 2H 2 O →2Al(OH) 3 + 3H 2<br />
Al(OH) 3 + OH - →AlO - 2 + H 2 O<br />
Nếu gộp 2 pt : Al + H 2 O + OH - → AlO 2 - + 3 2 H 2<br />
6. Phản ứng nhiệt nhôm<br />
Al + oxit KL sau Al → Al 2 O 3 + KL<br />
giải<br />
thích<br />
1. Al 2 O 3 , Al(OH) 3 chỉ tan trong axit mạnh, bazơ<br />
mạnh, không tan trong CO 2 , NH 3<br />
2. AlO - 2 + CO 2 + H 2 O→ HCO - 3 + Al(OH) 3<br />
AlO - 2 + H + + H 2 O→ Al(OH) 3<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Điều chế : không tồn tại dạng đơn chất, chỉ có<br />
dạng hợp chất. Quặng cromit sắt Fe 2 O 3 .Cr 2 O 3<br />
, điều chế bằng phản ứng nhiệt nhôm<br />
Cr 2 O 3 + 2Al → Al 2 O 3 + 2Cr<br />
Phèn crom-kali:K 2 SO 4 .Cr 2 (SO 4 ) 3 .24H 2 O<br />
(KCr(SO 4 ) 2 .12H 2 O )<br />
Đồng thau : Cu-Zn Đồng bạch: Cu-Ni<br />
Đồng thanh : Cu-Sn Vàng 9 cara: Cu-Au<br />
Oxit<br />
Hydroxit<br />
Muối<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
Điều<br />
chế<br />
CROM<br />
([Ar]3d 5 4s 1 )<br />
HỢP CHẤT<br />
CROM<br />
1.Tác dụng phi kim : 4Cr+ 3O 2 → 2Cr 2 O 3<br />
2Cr + 3Cl 2 →2CrCl 3<br />
2. Tác dụng axit<br />
+ HCl , H 2 SO 4 loãng nóng : tạo muối Cr (II)<br />
+ HNO 3 , H 2 SO 4 đặc : tạo muối Cr (III)<br />
*Cr thụ động hóa trong HNO 3 , H 2 SO 4 đặc nguội<br />
3. Tác dụng muối của KL yếu hơn<br />
* Số oxy hóa phổ biến: +2, +3 (giống Fe) , +6<br />
Cr (III) giống Al (có màng oxit bền Cr 2 O 3 )<br />
Cr (VI) giống S<br />
Zn + CrCl 3 CrCl 2 + ZnCl 2 (dù Zn dư vẫn thu Cr 2+ )<br />
Cr (II) Cr (III) Cr(VI)<br />
CrO :màu đen, là oxit bazơ Cr 2 O 3 : oxit lưỡng tính, màu lục , tan trong kiềm đặc, CrO 3 : oxit axit, màu đỏ, tính oxy hóa mạnh, làm<br />
tạo màu lục cho gốm, thủy tinh.<br />
bốc cháy một số chất S, P, C, NH 3 , C 2 H 5 OH…<br />
CrO 3 + H 2 O → H 2 CrO 4 (axit cromic) ,<br />
Cr(OH) 2 : màu vàng, bazơ yếu Cr(OH) 3 : màu lục nhạt, lưỡng tính, tác dụng bazơ<br />
H 2 Cr 2 O 7 (axit dicromic)<br />
-<br />
tạo muối CrO 2<br />
Muối Cr (II) : tính khử mạnh Muối Cr (III) : tính oxy hóa, khử<br />
2Cr 3+ + 16OH - + 3Br 2 → 2CrO 2- 4 + 6Br - + 8H 2 O<br />
(màu vàng)<br />
Lưu ý: sự chuyển màu trong dung dịch giữa CrO 2- 2-<br />
4 và Cr 2 O 7<br />
axit<br />
2-<br />
2CrO 4<br />
⎯⎯⎯→<br />
+ 2H +<br />
base<br />
(vàng) (da cam)<br />
t<br />
(NH 4 ) 2 Cr 2 O 0<br />
7 ⎯⎯→ 4H 2 O + N 2 + Cr 2 O 3 (hiện tượng núi lửa phun)<br />
Tính<br />
chất<br />
←⎯⎯ Cr 2 O 7<br />
2-<br />
+ H 2 O<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
Muối Cr (VI): tính oxy hóa mạnh<br />
Cr 2 O 7 2- + H + + chất khử→ Cr 3+<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
1.Tác dụng phi kim : 3Fe+ 2O 2 →Fe 3 O 4<br />
2Fe + 3Cl 2 →2FeCl 3<br />
2. Tác dụng axit<br />
+ HCl , H 2 SO 4 loãng : tạo muối Fe (II)<br />
+ HNO 3 , H 2 SO 4 đặc : tạo muối Fe (III)<br />
*Fe thụ động hóa trong HNO 3 , H 2 SO 4 đặc nguội<br />
3. Tác dụng muối của KL yếu hơn<br />
4. Tác dụng H 2 O ở nhiệt độ cao<br />
Tính<br />
chất<br />
HỢP CHẤT SẮT<br />
SẮT<br />
([Ar]3d 6 4s 2 )<br />
KL phổ biến thứ 2 sau<br />
nhôm trong vỏ trái đất<br />
Quặng<br />
Gang<br />
Thép<br />
Thành phần 2-5% cacbon 0,01-2% cacbon<br />
Nguyên tắc<br />
sản suất<br />
Dùng CO khử Fe 2 O 3<br />
Nguyên liệu Oxit sắt gang<br />
Phân loại Gang trắng :cứng,<br />
giòn (Fe 3 C)<br />
Gang xám: đúc bộ<br />
phận máy<br />
Dùng O 2 Oxi hóa tạp<br />
chất trong gang (Si,<br />
Mn, S, P, C)<br />
Thép thường: làm vật<br />
dụng, nhà cừa<br />
Thép đặc biệt: Chứa<br />
Cr, Ni, Mn, V ...<br />
Fe 2 O 3 Fe 2 O 3 .nH 2 O Fe 3 O 4 FeCO 3 FeS 2<br />
Hematit<br />
đỏ<br />
Hematit<br />
nâu<br />
Manhetit<br />
%Fe cao<br />
nhất<br />
xiderit pirit<br />
Fe (II)<br />
Fe (III)<br />
Tính chất<br />
- ion Fe 2+ co1 tính oxy hóa, tính khử (tác dụng: Br 2 , Cl 2 ,<br />
KMnO 4 , hh (H +, NO - 3 ), OH - , NH 3 , Ag + )<br />
* FeO (đen) không tan trong nước, là oxit bazơ<br />
Fe(OH) 2 ↓ : trắng xanh, kém bền nhiệt, bazơ yếu<br />
ô ó ô í<br />
Fe(OH) 2 FeO + H 2 O<br />
(Fe(NO 3 ) 2 phản ứng hoàn toàn thì thu Fe 2 O 3 )<br />
ó ô í<br />
4Fe(OH) 2 + O 2 2Fe 2 O 3 + 4H 2 O<br />
Muối Fe 2+ : lục nhạt<br />
* FeCl 2 + AgNO 3 →Fe(NO 3 ) 3 + Ag + AgCl<br />
- ion Fe 3+ có tính oxy hóa (tác dụng : Cu, Fe, OH - , NH 3 , I - , S 2- …)<br />
Fe 2 O 3 ( đỏ nâu) : không tan trong nước, là oxit bazơ<br />
Fe(OH) 3 ↓ : nâu đỏ, kém bền nhiệt, bazơ yếu<br />
2Fe(OH) 3 → Fe 2 O 3 + 3H 2 O<br />
Muối Fe 3+ : vàng nâu<br />
* Lưu ý: 2Fe 3+ + 2I - → Fe 2+ + I 2<br />
2Fe 3+ + H 2 S → Fe 2+ + S + 2H +<br />
Fe 3 O 4 = FeO.Fe 2 O 4 (tác dụng HCl, H 2 SO 4 loãng tạo 2 muối Fe 2+ , Fe 3+ )<br />
Fe 3 O 4 + 2I - → Fe 2+ + I 2<br />
Fe(NO 3 ) 2 , FeCl 3 : tính oxy hóa, tính khử (tính khử thể hiện tại Cl - , O 2- )<br />
*FeS kết tủa đen nhưng tan trong axit HCl<br />
Ứng dụng FeSO 4 : chất diệt sâu bọ, pha sơn FeCl 3 : làm xúc tác<br />
(NH 4 ) 2 SO 4 .Fe 2 (SO 4 ) 3 .24H 2 O: (phèn sắt amoni ): làm trong nước<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
Quặng<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Hợp<br />
kim<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com<br />
CHƯƠNG THÍ NGHIỆM, NHẬN BIẾT <strong>VÀ</strong> <strong>HÓA</strong> MÔI TRƯỜNG<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
HÌNH VẼ<br />
THÍ<br />
NGHIỆM<br />
Tính tan<br />
trong nước<br />
Làm khô<br />
(hấp thu H 2 2O<br />
mà không pứ<br />
chất làm khô)<br />
Xử lý khí<br />
Khí Chất phản ứng<br />
Phương trình phản ứng<br />
Chất lỏng Chất rắn<br />
CO 2 HCl CaCO 3 2HCl + CaCO 3 → CaCl 2 + CO 2 + H 2 O<br />
C 2 H 2 H 2 O CaC 2 2H 2 O + CaC 2 → C 2 H 2 + Ca(OH) 2<br />
H 2 S HCl FeS<br />
2HCl + FeS → FeCl 2 + H 2 S<br />
HCl<br />
SO 2<br />
HNO 3<br />
Phương pháp<br />
sunfat<br />
NaCl (rắn)+ H 2 SO 4 (đặc) → NaHSO 4 + HCl<br />
H 2 SO 4 + Na 2 SO 3 (rắn) → Na 2 SO 4 + SO 2 + H 2 O<br />
H 2 SO 4 + NaNO 3 → HNO 3 + NaHSO 4<br />
Khí<br />
C<br />
ác<br />
h<br />
đi<br />
ều<br />
ch<br />
ế<br />
Chất phản ứng<br />
5. Nhận biết Chất (NHlỏng<br />
4 ) 2 CO 3 , Chất lỏng<br />
N 2 NH 4 Cl bão hòa NaNO 2 bão hòa<br />
CO HCOOH H 2 SO 4 đặc<br />
C 2 H 4 C 2 H 5 OH H 2 SO 4 đặc,<br />
Chất rắn + Chất rắn (ống nghiệm chứa hóa chất nằm ngang, miệng hơi trút xuống)<br />
Khí<br />
Chất phản ứng<br />
Phương trình phản ứng<br />
Chất rắn<br />
Chất gây nghiện<br />
- heroin, cocain, hassish (cần sa)<br />
Amphetamin, cafein<br />
Chất rắn<br />
NH 3 NH 4 Cl Ca(OH) 2 hoặc NaOH<br />
CH 4 CH 3 COONa NaOH/CaO<br />
(vôi tôi xút)<br />
- mocphin, seduxen : thuốc an thần<br />
- nicotin : trong thuốc lá<br />
Không tan hoặc ít tan<br />
Đẩy nước (thu khí không tác dụng H 2 O<br />
không tan, ít tan trong nước)<br />
Đẩy y không khí (thu khí không tác dụng<br />
không khí)<br />
O 2 , H 2 , CO 2 , N 2 , C 2 H 4 , CH 4 … Khí nặng hơn<br />
Khí nhẹ hơn không<br />
Cách<br />
không khí : Cl 2 , O 2 ,<br />
SO 2 , NO..<br />
khí: NH 3 , H 2<br />
thu khí<br />
Các ion KL nặng : Pb 2+ , Hg 2+ ,<br />
Cr 3+ , Cd 2+ , thuốc bảo vệ thực<br />
vật, anion Cl - , SO 2- 4 , NO - 3 …<br />
Tan vừa phải<br />
N 2 , H 2 , O 2 , CO 2 , CH 4 ,<br />
H 2 S, C 2 H 4 , C 2 H 2<br />
Cl 2<br />
SO 2 , HCl, NH 3<br />
H 2 SO 4 đặc, P 2 O 5 : làm khô Cl 2 , O 2 , SO 2 , N 2 , CO 2<br />
CuSO 4 khan, màu trắng <br />
CuSO 4 .5H 2 O (màu xanh) : phát hiện H<br />
trong HCHC). Ca(OH) 2 phát hiện C<br />
NaOH, CaO, KOH: làm khô NH 3 , H 2 , O 2 , N2...<br />
2<br />
NaOH, Ca(OH) 2 : hấp thụ NO 2 , CO 2 , H 2 S, SO 2<br />
NaCl bão hòa: hấp thụ HCl Cl 2 hấp thụ NH 3<br />
Cu(NO 3 ) 2 , Pb(NO 3 ) 2 : xử lý H 2 S, muối S 2- (tạo kết tủa đen)<br />
Phương trình phản ứng<br />
NH 4 Cl+ NaNO 2 →N 2 + NaCl + 2H 2 O<br />
HCOOH đặ<br />
CO + H2O<br />
C 2 H 5 OH đặ<br />
CH 2 =CH 2 + H 2 O<br />
2NH 4 Cl (r) + Ca(OH) 2 (r) →2NH 3 + 2H 2 O + CaCl 2<br />
CH 3 COONa + NaOH ,<br />
CH 4 + Na 2 CO 3<br />
Ô nhiễm nước, đất<br />
1. Nhận biết : muối (phần R n+ )<br />
+ dùng Ba hay Ba(OH) 2<br />
+ ion KL IA : màu ngọn lửa<br />
-<br />
2. Nhận biết ion NO 3<br />
dung Cu, H + (HCl, H 2 SO 4 )<br />
3. Nhận biết : CO 2 , SO 2<br />
+ Dùng Ca(OH) 2 , Ba(OH) 2<br />
+ Riêng SO 2 có thể dùng Br 2<br />
4. Nhận biết Cl - :dùng AgNO 3<br />
(NH 4 ) 2 SO 4<br />
Dùng Ba(OH) 2<br />
Ô nhiễm không khí<br />
Mưa axit: SO 2 , NO 2<br />
Hiệu ứng nhà à kính : CO 2 (chính), CH 4<br />
Suy giảm ozon: CFC, freon (hợp chất Clo)<br />
penixilin, ampixilin, erthyromixin : thuốc kháng sinh<br />
Tan nhiều<br />
DIỄN ĐÀN TOÁN - <strong>LÝ</strong> - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial