ENFERMEDAD PULMONAR OBSTRUCTIVA CRÓNICA D.D. ...
ENFERMEDAD PULMONAR OBSTRUCTIVA CRÓNICA D.D. ...
ENFERMEDAD PULMONAR OBSTRUCTIVA CRÓNICA D.D. ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>ENFERMEDAD</strong> <strong>PULMONAR</strong> <strong>OBSTRUCTIVA</strong> <strong>CRÓNICA</strong><br />
D.D.: <strong>ENFERMEDAD</strong> QUÍSTICA <strong>PULMONAR</strong><br />
<strong>ENFERMEDAD</strong> <strong>PULMONAR</strong> <strong>OBSTRUCTIVA</strong> <strong>CRÓNICA</strong> (EPOC)<br />
Dr. Àngel Gayete Cara<br />
Hospital Universitari del Mar<br />
Definición:<br />
Se trata de la enfermedad de mayor prevalencia e impacto socioeconómico de todas las enfermedades<br />
respiratorias.<br />
La definicón que podemos encontrar en el documento “Guía clínica para el diagnóstico y el tratamiento de la<br />
enfermedad pulmonar obstructiva crónica”, una de las publicaciones de la colección Normativa SEPAR,<br />
publicada por la Sociedad Española de Patología del Aparato Respiratorio (SEPAR), y referenciada en la<br />
revista Archivos de Bronconeumología (Arch Bronconeumol 2001;37:297-316), dice:<br />
• La EPOC se caracteriza por la presencia de obstrucción crónica y poco reversible al flujo aéreo<br />
(disminución del volumen espiratorio forzado en el primer segundo [FEV1] y de la relación<br />
FEV1/capacidad vital forzada [FVC]) causada, principalmente, por una reacción inflamatoria<br />
frente al humo del tabaco.<br />
• Se recomienda utilizar el término EPOC en vez de los de bronquitis crónica o de enfisema porque<br />
define mejor la enfermedad obstructiva que se observa en los fumadores.<br />
• La bronquitis crónica se define clínicamente por la presencia de tos y expectoración durante<br />
más de 3 meses al año y durante más de 2 años consecutivos, que no son debidas a otras<br />
causas conocidas.<br />
• El enfisema pulmonar se define en términos anatomopatológicos por el agrandamiento<br />
permanente de los espacios aéreos distales a los bronquiolos terminales, con destrucción de la<br />
pared alveolar, sin fibrosis manifiesta.<br />
• El asma bronquial, enfermedad que cursa con obstrucción reversible al flujo aéreo ………..<br />
queda específicamente diferenciada conceptual y terminológicamente de la EPOC, aunque la<br />
separación con algunos casos de asma crónica con obstrucción al flujo aéreo no reversible<br />
puede ser difícil.<br />
• ……… EPOC no debe emplearse para definir procesos ……….. que tienen una causa específica,<br />
como es el caso de la obstrucción de la vía aérea superior, la fibrosis quística, las bronquiectasias o<br />
la bronquiolitis obliterante.<br />
Epidemiología:<br />
• El 9,1% se da en individuos entre 40 y 70 años.<br />
• Relación Hombre : Mujer (4:1).<br />
• Se estima que sólo el 22% de los pacientes son diagnosticados (estudio IBER-POC).<br />
• Teniendo en cuenta su relación con el tabaquismo, es importante considerar que el 33,7% de los<br />
españoles mayores de 16 años son fumadores.<br />
• Es la 4ª causa de mortalidad global (33 / 100.000).<br />
• La mortalidad es mucho mayor en sujetos mayores de 75 años (176 / 100.000).<br />
• La enfermedad es responsable del 35% de las consultas externas en neumología.<br />
• Es responsable de 39.000 hospitalizaciones / año.<br />
• Consume el 0,2% del Producto Interior Bruto (PIB).<br />
• La EPOC es un factor de riesgo de cáncer de pulmón, independiente del tabaco.<br />
Anatomía patológica:<br />
• Inflamación crónica de las vías aéreas y el parénquima pulmonar.<br />
o Bronquios<br />
Hiperplasia de las glándulas mucosas<br />
Aumento de las células caliciformes<br />
Metaplasia escamosa<br />
Anomalías ciliares<br />
o Vías aéreas periféricas (responsable de la obstrucción al flujo aéreo)<br />
Fibrosis<br />
Hipertrofia del músculo liso<br />
Impactación mucosa<br />
Metaplasia de las células caliciformes<br />
o Infiltrado inflamatorio de linfocitos T citotóxicos (CD8)<br />
En vías aéreas principales y de pequeño calibre, septos alveolares y arterias<br />
musculares
• Lesión propia del parénquima pulmonar.<br />
o Enfisema<br />
agrandamiento permanente y destructivo de los espacios aéreos distales<br />
sin fibrosis evidente<br />
puede existir remodelado tisular, con aumento del colágeno intersticial<br />
• centroacinar<br />
o destrucción alrededor de los bronquiolos respiratorios<br />
o el más frecuente en los fumadores<br />
• panacinar<br />
o destrucción uniforme del acino<br />
o característico del déficit homozigoto de α-1-antitripsina<br />
o también puede existir en fumadores<br />
• Cambios estructurales en los vasos pulmonares.<br />
o Engrosamiento de la íntima de las arterias musculares<br />
o Muscularización de las arteriolas<br />
o Pueden existir en fases iniciales<br />
o Se asocian a disfunción endotelial<br />
Patogenia:<br />
• El humo del tabaco es la principal causa en nuesro medio<br />
• En regiones en desarrollo tiene importancia la exposición a productos de combustión en ambientes<br />
cerrados (leña…)<br />
• Estrés oxidativo<br />
• Alteración del balance proteasas / antiproteasas<br />
• Activación respuesta inflamatoria (polimorfonucleares, macrófagos…)<br />
• Estos factores se hallan presentes tanto en el fumador con EPOC como en el que no desarrolla<br />
EPOC, lo que induce a pensar que para desarrollar la enfermedad se precisa de una susceptibilidad<br />
individual<br />
• Se estima que sólo el 20-25% de los fumadores desarrollarán EPOC, aunque probablemente existe<br />
un infradiagnóstico de la enfermedad<br />
Evaluación:<br />
• Clínica y exploración física.<br />
• Exploración funcional respiratoria.<br />
o Exámenes con relevancia clínica alta<br />
Espirometría forzada<br />
Prueba broncodilatadora (d.d. Con asma)<br />
Gasometría arterial<br />
o Exámenes con relevancia clínica media<br />
Capacidad de difusión pulmonar del monóxido de carbono (dlco)<br />
Volúmenes pulmonares estáticos<br />
Pruebas de esfuerzo<br />
Oximetría nocturna / polisomnografía<br />
Función muscular respiratoria<br />
o Exámenes con relevancia clínica baja<br />
Medición del flujo pico<br />
Pruebas de broncoprovocación<br />
Exámenes de pequeñas vías aéreas<br />
Estudio de distensibilidad (compliance) pulmonar<br />
Estudio hemodinámico pulmonar<br />
Respuesta ventilatoria a la hipoxia y a la hipercapnia<br />
• Exámenes radiológicos.<br />
o radiografía de tórax<br />
o tomografía computarizada (TC)<br />
• Medida de la calidad de vida relacionada con la salud.<br />
• Otros exámenes.<br />
o ECG, hemograma, proteinograma, α-1-antitripsina, esputo…
Exámenes radiológicos<br />
Los cambios morfológicos que ocurren a nivel pulmonar en la EPOC, tanto en el paciente en el que<br />
predomina el enfisema, como en el que la alteración más importante es la bronquitis crónica, pueden ser<br />
estudiados por las dos técnicas habitualmente utilizadas en la patología pulmonar, la radiología simple y la<br />
tomografía computarizada (TC).<br />
• Enfisema<br />
Los cambios morfológicos dominantes en el enfisema son:<br />
o Destrucción pulmonar<br />
o Bullas<br />
o Hiperinsuflación<br />
Signos directos<br />
• Bullas (es el único signo directo de destrucción pulmonar por RX simple)<br />
Signos indirectos<br />
• Vasculares<br />
o Ausencia de vasos<br />
o Vasoconstricción hipóxica<br />
• Reducción del calibre vascular<br />
• Afilamiento periférico<br />
Sensibilidad del 40%<br />
• Hiperinsuflación<br />
o Aumento del volumen pulmonar<br />
o Disminución de la excursión diafragmática (debe ser superior a 3 cm)<br />
La combinación de ambos grupos de signos (vasculares e hiperinsuflación) permiten el<br />
diagnóstico en la mayor parte de los casos.
Hiperinsuflación<br />
La radiografía lateral es más sensible.<br />
o ↑ del eje craneocaudal<br />
La cúpula del hemidiafragma derecho debe estar por encima del<br />
extremo anterior de la 7ª costilla<br />
Descenso y aplanamiento diafragmático<br />
• En PA se considera normal si ≥ 15 mm<br />
• En L se considera normal si ≥ 27 mm<br />
Inversión diafragmática<br />
↑ de la altura pulmonar (≥ 29,9 cm – en pulmón derecho)<br />
Apertura del seno costofrénico<br />
Visualización de las inserciones diafragmáticas<br />
• En condiciones normales la propia convexidad de la cúpula<br />
diafragmática las oculta. Cuando el diafragma desciende<br />
pueden hacerse visibles.<br />
o ↑ del eje ánteroposterior<br />
↑ del espacio retroesternal (≥ 25 mm)<br />
• Se busca un punto a 3 cm por debajo de la unión entre el<br />
manubrio y el cuerpo, y a partir de ese punto se traza una línea<br />
paralela al suelo hasta encontrar a la aorta ascendente (la<br />
distancia de esa línea debe ser < a 25 mm)<br />
Tórax en tonel<br />
Horizontalización de las costillas
o Tráquea en sable<br />
↑ del índice traqueal (
o Panlobular (panacinar)<br />
Afecta uniformemente al pulmón, provocando una destrucción extensa<br />
que tiende a la “simplificación” de la arquitectura pulmonar<br />
Se asocia al déficit de α-1-antitripsina<br />
• Amplias áreas de hiperclaridad<br />
• Predomina en los campos pulmonares inferiores<br />
• Si < 40 años, determinar la α-1-antitripsina (la OMS / ATS-ERS<br />
recomiendan que en estos pacientes se haga la determinación,<br />
al menos, una vez en la vida)<br />
Puede plantear diagnóstico diferencial con la bronquiolitis constrictiva,<br />
aunque en esta no hay destrucción parenquimatosa, y se presenta con<br />
bronquios dilatados de paredes engrosadas junto a vasoconstricción<br />
hipóxica<br />
o Paraseptal (acinar distal)<br />
Afecta a la periferia del lóbulo pulmonar secundario<br />
Adyacente a los septos interlobulares y a la pleura visceral
• Bronquitis crónica<br />
o Engrosamiento de la pared bronquial<br />
o Aumento de la trama pulmonar (“pulmón sucio”)<br />
Sensibilidad (18%)<br />
↓ especificidad, ya que también se ve en:<br />
• Sanos no fumadores<br />
• Asma<br />
• Bronquiectasias<br />
• Bronquitis aguda<br />
Puede ser útil el examen comparativo con exploraciones anteriores, para valorar cambios<br />
que puedan indicar exacerbación (agudización)<br />
o Impactaciones mucosas<br />
Más detectables en TC<br />
o Patrón de árbol en brote / en gemación (tree-in-bud)<br />
Refleja la afectación más periférica de la vía aérea (bronquiolar)<br />
26-09-2006 02-11-2006
Se están dando importantes avances en el conocimiento de la EPOC, de modo que en las más recientes<br />
guías de la American Thoracic Society / European Respiratory Society (ATS / ERS), se define como una<br />
“enfermedad prevenible y tratable, caracterizada por una limitación al flujo aéreo que no es totalmente<br />
reversible. La limitación al flujo aéreo usualmente es progresiva, y se asocia a una respuesta inflamatoria<br />
anormal de los pulmones a partículas nocivas o gases, causada principalmente por el humo del tabaco.<br />
Aunque la EPOC afecta a los pulmones, también produce significativas consecuencias sistémicas”.<br />
Así pues, es algo ya reconocido en la actualidad que se trata de una enfermedad inflamatoria prevenible y<br />
tratable con afectación sistémica.<br />
Por otra parte, se ha demostrado la importancia de la inflamación en las pequeñas vías aéreas en el<br />
desarrollo y la progresión de la EPOC, y esto podría llevar a pensar en esta patología como una<br />
enfermedad inhalatoria crónica inducida por polvo. El polvo inorgánico responsable en el humo del tabaco<br />
es el silicato de aluminio (caolinita), que se ha encontrado en los macrófagos alveolares de los fumadores,<br />
provocando bronquiolitis respiratoria (BR).<br />
En fumadores susceptibles, factores genéticos, ambientales y mecánicos interactúan y modulan la<br />
inflamación de la vía aérea, conduciendo a la aparición de enfisema.<br />
Estudios radiológicos longitudinales también han encontrado evidencia de esta secuencia de hechos, de<br />
modo que la Dra. Martine Remy-Jardin publicó en Radiology, en el año 2002, un trabajo en el que en TCs<br />
seriadas en pacientes fumadores se demostraba que en los puntos donde existía afectación centrolobular<br />
por BR, posteriormente aparecía enfisema.<br />
El desequiibrio entre destrucción y regeneración tisular provocan la aparición de enfisema.<br />
En el pulmón enfisematoso se encuentra un aumento de los productos de degeneración de la elastina,<br />
indicando proteólisis acentuada.<br />
Existe destrucción de la matriz extracelular.<br />
La aparición de enfisema se relaciona con la disminución del FEV1.
Bronquiolitis respiratoria y bronquitis en paciente EPOC fumador
El mejor conocimiento del origen y evolución de la enfermedad están permitiendo ensayar nuevas<br />
estrategias terapéuticas, y, en este momento, han aparecido resultados prometedores, y están en curso<br />
estudios con múltiples fármacos, que actúan a diferentes niveles:<br />
Terapias antiproteasas<br />
• α-1-antitripsina<br />
• Antielastasa neutrofílica<br />
• Inhibidores de las metaloproteinasas<br />
Ac. Retinoico<br />
Ac. hialurónico<br />
N-acetil-cisteína<br />
Factores de crecimiento<br />
• HGF (factor de crecimiento del hepatocito)<br />
• LGF (factor de crecimiento del hígado)<br />
Anti-TGF (antifibrótico)<br />
Inhibidor de PDE4 (fosfodiesterasa 4) -Roflumilast-<br />
• En tratº experimental en ratas protege del enfisema inducido por el humo del tabaco<br />
(impide que aparezca)<br />
• ↓ la inflamación de las vías aéreas.<br />
• Mejora el FEV1<br />
Broncodilatadores<br />
Inmunomodulación<br />
Esta moderna concepción de la EPOC, entendida como una enfermedad inflamatoria de repercusión<br />
sistémica, ha hecho que su clasificación clínica haya pasado de una categorización unidimensional basada<br />
en el FEV1, y en su relación con el FVC, la clásica GOLD (Global Initiative for Chronic Obstructive Lung<br />
Disease), a una más compleja, multidimensional, la conocida como BODE (Body mass index / Obstruction<br />
bronchial / Dyspnea / Exercise), propuesta por Bartolomé R. Celli y Claudia G. Cote (N Engl J Med 2004).<br />
Se ha demostrado que, a peor índice BODE corresponde un mayor número de exacerbaciones, aunque se<br />
tenga el mismo FEV1.<br />
Celli BR, Cte CG, Marin JM, Casanova C, Montes de Oca M, Mendez RA, Pinto Plata V, Cabral HJ. The Body-Mass Index, Airflow<br />
Obstruction, Dyspnea, and Exercise Capacity Index in Chronic Obstructive Pulmonary Disease. N Engl J Med 2004;350:1005-12
En este contexto clínico es posible que en un futuro próximo la radiología pueda ver potenciado su papel en<br />
el manejo de los pacientes con EPOC.<br />
Utilidad potencial de la TCAR en la EPOC<br />
Detección precoz<br />
o Si existe la posibilidad de actuar terapéuticamente sobre la enfermedad, pudiendo influir en<br />
su evolución, probablemente sea importante que podamos detectar precozmente, y<br />
caracterizar fenotípicamente, la enfermedad, ya que parece razonable que los potenciales<br />
tratamientos específicos sean distintos si nos encontramos ante pacientes con EPOC de<br />
predominio enfisematoso o de predominio bronquítico.<br />
Conocer la historia natural de la enfermedad<br />
o La TCAR es la mejor técnica de estudio morfológico incruento in vivo de que disponemos<br />
para la valoración de la patología pulmonar, y su utilización en estudios clínicos puede<br />
aportar información relevante para avanzar en el conocimiento de esta heterogénea<br />
entidad.<br />
Detectar candidatos a cirugía de reducción de volumen pulmonar (CRVP)<br />
o Algunos pacientes con EPOC, aquellos con enfisema heterogéneo de predominio en<br />
campos pulmonares superiores, pueden beneficiarse de una cirugía agresiva como es la<br />
cirugía de reducción de volumen pulmonar, cuyo objetivo es resecar el pulmón destruido, no<br />
funcionante, para eliminar su efecto compresivo sobre el parénquima más preservado de<br />
los campos inferiores, que así podrá mejorar su función. Al mismo tiempo, se mejora la<br />
mecánica respiratoria, ya que, al reducir el volumen pulmonar, el diafragma recupera su<br />
convexidad, mejorando su función.<br />
Valorar la eficacia del tratamiento con α-1-antitripsina<br />
o En pacientes con enfisema panlobular por déficit de α-1-antitripsina, la respuesta al<br />
tratamiento específico podría ser monitorizada mediante exámenes secuenciales de TCAR.<br />
Respuesta a nuevas terapias<br />
o Tanto en el contexto de la investigación clínica de la eficacia de nuevos fármacos, como<br />
posteriormente en el seguimiento de los pacientes candidatos a recibirlos, la TCAR puede<br />
jugar un papel crucial como técnica de estudio morfológico de elección.<br />
Esta importancia se fundamente en la necesidad de detectar y tratar a los pacientes antes de que<br />
evolucionen a las formas clásicas de presentación de esta enfermedad, hoy ya menos frecuentes que en<br />
años pasados, cuando la destrucción del parénquima pulmonar, las alteraciones en la estructura bronquial,<br />
y los efectos sistémicos pueden ser difícilmente reversibles.
Correlación morfológico-funcional<br />
Correlación TCAR – Pruebas de Función Respiratoria (PFR)<br />
o En estudios comparando la TCAR con la anatomía patológica (AP), se ha dicho que la<br />
TCAR es poco sensible para detectar enfisema, con cifras in vivo de 0,7-0,9, lo que<br />
sugeriría que hay sobre o infravaloración.<br />
o Sin embargo, la TCAR ha demostrado mayor precisión que las PFR en su detección precoz.<br />
o Esto se explica porque el enfisema centrolobular, el típico de los fumadores,<br />
característicamente afecta a los campos pulmonares superiores, pudiendo, en fases<br />
iniciales, cursar con normalidad de los inferiores. En esta situación, fácilmente identificable<br />
por la TCAR, las PFR pueden ser normales o hallarse muy discretamente disminuidas, ya<br />
que los lóbulos superiores contribuyen a la función respiratoria en mucha menor medida<br />
que los inferiores.<br />
o Cuando el enfisema afecta de forma relevante a los campos pulmonares inferiores, las PFR<br />
estarán severamente alteradas.<br />
o Remy-Jardin (Radiology 1996) demostró que la valoración de la TCAR con técnicas de<br />
reconstrucción de mínima intensidad de proyección (minIP) aumentaba la sensibilidad para<br />
la detección de enfisema, pasando del 62 al 81%.
o Bankier (Radiology 1999) demostró una sobreestimación del enfisema en la valoración<br />
visual, abogando por la utilización de métodos objetivos de cuantificación del enfisema.<br />
Previamente otros autores habían descrito que, cuando se hace por observadores expertos,<br />
hay buenas correlaciones entre la valoración visual y la AP, y también entre el análisis<br />
subjetivo y el objetivo.<br />
o Actualmente se acepta que la cuantficación por métodos objetivos es más precisa y útil para<br />
seguimientos longitudinales, reduciendo la variabilidad intra e interobservador.<br />
Cuantificación del enfisema por TC<br />
Pueden hacerse diferentes tipos de mediciones:<br />
o Volúmenes<br />
o Densidad media del pulmón en unidades Hounsfield (UH)<br />
o Rango de densidades en un corte (histograma)<br />
o Índice de enfisema (pixel index – PI)<br />
• % de pulmón en un rango de densidades inferior a un umbral por debajo del cual<br />
consideramos enfisema. Según el grosor de corte utilizado se considera que el<br />
umbral es -910 / -950UH.<br />
• Puede calcularse para la totalidad del pulmón o para un corte individual.<br />
o En la actualidad existen software que permiten segmentaciones automáticas por lóbulos e,<br />
incluso, por segmentos, permitiendo calcular el índice de bullas y definir el tipo de enfisema.
Kuhnigk JM. RadioGraphics 2005; 25:525–536<br />
Valoración objetiva de la vía aérea por TC<br />
o En la valoración del calibre y el grosor de la pared de la vía aérea existe una importante<br />
variabilidad interobservador.<br />
o En la TCAR esta valoración se verá influenciada por la ventana de visualización que<br />
utilicemos.<br />
Nivel de ventana recomendado para la valoración pulmonar estándar: -700 UH<br />
Nivel de ventana recomendado para la valoración de la vía aérea: -450 UH<br />
o Otros factores que influenciarán en cómo veamos la vía aérea son:<br />
El grosor del corte<br />
El ángulo de orientación (entre el plano del corte y el eje del bronquio valorado)<br />
Veremos la luz menor cuanto mayores sean<br />
el grosor del corte o el ángulo de orientación<br />
C : ∅ luz bronquial con nivel de ventana a -700 UH<br />
D : ∅ luz bronquial con nivel de ventana a -450 UH<br />
King GG. Am J Respir Crit Care Med 1999; 159:992-1004<br />
o En la actualidad existen, y se están estudiando y mejorando, software para valoración<br />
objetiva automatizada de la vía aérea, que efectúan las mediciones en planos ortogonales<br />
al eje anatómico de cada uno de los bronquios, obtenido a partir de reconstrucciones<br />
volumétricas con reconocimiento automático del árbol bronquial.
Venkatraman R. J Digital Imaging 2006; 19:132-9
<strong>ENFERMEDAD</strong> QUÍSTICA <strong>PULMONAR</strong><br />
Definición:<br />
Es un grupo heterogéneo de enfermedades que se caracterizan por presentar, como dato común, quistes<br />
pulmonares, definidos como unas áreas de hiperclaridad focal mayor de 1 cm, en general esférica y bien<br />
definida, y con una pared fina, menor de 3 mm.<br />
Estas entidades se tratan aquí porque la existencia de espacios aéreos anómalos en el interior del<br />
parénquima pulmonar podrían tener algún parecido con el enfisema. Sin embargo, en la práctica clínica,<br />
estas enfermedades acostumbran a presentarse con otros hallazgos morfológicos asociados, y en un<br />
contexto que, en su conjunto, no plantean confusión con la EPOC / enfisema.<br />
Las dos entidades que característicamente se estudian en este capítulo son la linfangioleiomiomatosis<br />
(LAM) y la histiocitosis de células de Langerhans (HCL). Sin embargo, existen otras muchas enfermedades<br />
pulmonares que se asocian a quistes: neumatoceles infecciosos (Pneumocystis jiroveci, Staphylococcus<br />
aureus, Escherichia coli, Serratia marcensens…), neumonía intersticial linfocítica (NIL), neumonitis por<br />
hipersensibilidad subaguda, neumonía intersticial usual (NIU) / fibrosis pulmonar idiopática (FPI),<br />
bronquiectasias…<br />
En general, el mecanismo productor de estos quistes es común, tratándose del acúmulo de células,<br />
granulomas o fibrosis alrededor de la vía aérea periférica (bronquiolos), que, por mecanismo valvular,<br />
produce una hiperinsuflación del espacio aéreo distal.<br />
Linfangioleiomiomatosis (LAM)<br />
Afecta a mujeres en edad fértil.<br />
Se caracteriza por una proliferación de células musculares lisas atípicas, a nivel pulmonar y del linfático<br />
torácico y retroperitoneal.<br />
En algunos casos se asocia a esclerosis tuberosa.<br />
• A nivel torácico se presenta con:<br />
Opacidades reticulares<br />
Volumen pulmonar normal o aumentado<br />
Quistes<br />
o Bilaterales<br />
o Difusamente distribuidos<br />
o De pared fina<br />
o Rodeados de parénquima pulmonar normal<br />
Adenopatías<br />
Puede existir neumotórax o derrame pleural, que en un 70% de los casos puede ser quiloso<br />
• A nivel abdominal pueden presentarse con:<br />
Adenopatías<br />
Angiomiolipomas<br />
Linfangioleiomiomas<br />
Ascitis
Histiocitosis de células de Langerhans (HCL)<br />
Enfermedad relacionada con el tabaco (>90%), que se da en las 3ª-4ª décadas de la vida.<br />
Se le había atribuido una marcada predilección por el sexo masculino, pero hoy en día se sabe que si había<br />
existido esa mayor prevalencia en varones era únicamente por las diferencias en el hábito tabáquico.<br />
Es una inflamación granulomatosa bronquiolocéntrica con abundantes células de Langerhans y eosinófilos<br />
(nódulos). En fases avanzadas los granulomas son reemplazados por fibrosis y quistes.<br />
• Signos radiológicos<br />
Nódulos mal definidos / cavitación<br />
Quistes irregulares, lobulados y ramificados<br />
Predominio en campos superiores y medios<br />
Bases respetadas (senos costofrénicos posteriores)<br />
Neumotórax<br />
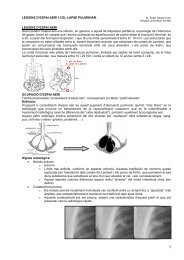
Esquema y correlación histológica mostrando la morfología alargada<br />
y variable composición, celular y fibrótica, de la HCL. En la evolución<br />
de la lesión, el nódulo inicial de células densamente empaquetadas<br />
(a) es centrípetamente reemplazado por tejido fibroso y, finalmente,<br />
queda reducido a una cicatriz estrellada (c). Este continuo de<br />
cambios es identificable en una misma lesión. La HCL es una lesión<br />
bronquiolocéntrica que progresa proximal y distalmente a lo largo de<br />
la pequeña vía aérea. La luz bronquiolar puede hallarse dilatada u<br />
obliterada. a) Fase precoz. Nódulo densamente celular con finas<br />
extensiones estrelladas a lo largo de las paredes alveolares<br />
adyacentes. b) Fase intermedia. Los fibroblastos reemplazan la<br />
lesión, y la celularidad disminuye. Las extensiones estrelladas se<br />
hacen más prominentes y el bronquiolo central se dilata (*), mientras<br />
que los espacios alveolares adyacentes coalescen por la destrucción<br />
focal de las paredes alveolares (enfisema paracicatricial). c) Fase<br />
terminal. No están las características células de Langerhans, y<br />
únicamente existe una cicatriz fibrosa y estrellada, asociada a<br />
enfisema paracicatricial (**).<br />
07‐06‐2007<br />
Abbott GF. RadioGraphics 2004; 24:821–41
Neumatocele<br />
Espacio lleno de gas, contenido dentro del parénquima pulmonar, de paredes finas, generalmente asociado<br />
a neumonías agudas, y casi invariablemente de curso transitorio.<br />
Múltiples agentes etiológicos pueden cursar con neumonía asociada a neumatocele:<br />
Staphylococcus aureus<br />
Streptococcus pneumoniae<br />
Klebsiella pneumoniae<br />
Escherichia coli<br />
Haemophilus influenzae<br />
Legionella pneumophila<br />
Pneumocystis jiroveci<br />
virus<br />
hongos (criptococo y aspergillus…)<br />
Otras causas pueden dar lugar a quistes similares: traumatismo pulmonar (laceración / hematoma),<br />
barotrauma, aspiración de hidrocarburos…<br />
Neumonía intersticial linfocítica (NIL)<br />
10‐12‐2007<br />
Pneumocystis jiroveci<br />
Proceso linfoproliferativo benigno caracterizado por una proliferación intersticial difusa de linfocitos, células<br />
plasmáticas y otros elementos del sistema linforeticular.<br />
Puede ser idiopática o estar asociada a otras enfermedades (S. de Sjögren, Castleman y SIDA).<br />
• Signos radiológicos<br />
Nódulos centrolobulares mal definidos de vidrio deslustrado<br />
Distribución difusa y uniforme<br />
Opacidades de vidrio deslustrado<br />
Engrosamiento nodular peribroncovascular y perilobular<br />
Consolidaciones parcheadas<br />
Adenopatías<br />
Quistes pulmonares (por infiltración linfocítica peribronquiolar)
Neumonitis subaguda por hipersensibilidad<br />
La neumonitis por hipersensibilidad es una enfermedad pulmonar difusa causada por la inhalación de una<br />
amplia variedad de antígenos que provocan una reacción inmune en los pulmones de individuos<br />
predispuestos.<br />
Los hallazgos patológicos son granulomas mal definidos, bronquiolitis y alveolitis. La alveolitis se caracteriza<br />
por un infiltrado intersticial linfoplasmocítico que se parece a los vistos en la neumonía intersticial linfocítica.<br />
• Signos radiológicos<br />
Opacidades de vidrio deslustrado bilaterales y simétricas<br />
Nódulos centrolobulares mal definidos<br />
Atrapamiento aéreo lobular<br />
Quistes pulmonares, atribuidos a infiltración linfocítica peribronquiolar<br />
Franquet T. J Comput Assist Tomogr 27(4):475-8
Neumonía Intersticial Usual (NIU) / Fibrosis Pulmonar Idiopática (FPI)<br />
Se denomina neumonía intersticial usual (NIU) a un patrón anatomopatológico caracterizado por la<br />
existencia de fibrosis densa de predominio subpleural, con distintos grados de panalización, asociada a<br />
focos fibroblásticos en la interfase entre la fibrosis y el pulmón normal.<br />
La panalización se forma por la coalescencia de espacios aéreos en áreas fibróticas, debida a la ruptura de<br />
las paredes alveolares. Las cavidades están limitadas por paredes gruesas de tejido fibroso, y tapizadas por<br />
epitelio bronquiolar o neumocitos hiperplásicos.<br />
Es característica la heterogeneidad espacial (alternancia de zonas normales y patológicas) y temporal<br />
(alternancia de focos de enfermedad en diferentes fases evolutivas: fibrosis –antigua– y focos fibroblásticos<br />
–precoz–).<br />
Este patrón se encuentra en colagenosis, asbestosis, neumonitis por hipersensibilidad crónica y toxicidad a<br />
fármacos<br />
Cuando existe este patrón radiopatológico sin poder atribuirlo a una entidad concreta, lo llamamos fibrosis<br />
pulmonar idiopática (FPI).<br />
• Signos radiológicos<br />
Panalización subpleural de predominio basal y posterior, constituida por:<br />
o Pequeños quistes (2-10 mm) que comparten paredes gruesas y se distribuyen en<br />
capas concéntricas<br />
o Bronquiectasias y bronquiolectasias<br />
En fases precoces existen zonas parcheadas de vidrio deslustrado, que con el tiempo<br />
evolucionaran a reticulación y a fibrosis<br />
Pérdida de volumen (si la fibrosis es importante)<br />
Cuando el patrón radiológico es el típico descrito, el diagnóstico de NIU es de certeza, no precisándose<br />
estudio histológico.<br />
En los pacientes con NIU / FPI está aumentada la incidencia de carcinoma broncopulmonar, especialmente<br />
de carcinoma escamoso y adenocarcinoma.<br />
La FPI habitualmente es progresiva, con una supervivencia media desde el diagnóstico de 2,5-3,5 años.<br />
Bronquiectasias<br />
Son dilataciones anómalas permanentes de los bronquios, y son debidas a múltiples causas:<br />
• Postinfecciosas (bacterias, micobacterias, hongos o virus)<br />
• Congénitas (fibrosis quística, discinesia ciliar, déficit de α-1-antitripsina…)<br />
• Inmunodeficiencia<br />
• Aspiración o inhalación de tóxicos<br />
• Enfermedades reumáticas<br />
• Fibrosis<br />
• …<br />
Pueden presentar diferentes morfologías: cilíndricas, varicosas o quísticas, siendo estas últimas las que<br />
potencialmente podrían incluirse en el diagnóstico diferencial de las lesiones quísticas pulmonares. Sin<br />
embargo, su morfología, distribución, agrupación y contexto clínico, acostumbran a su reconocimiento,<br />
permitiendo objetivar su dependencia de la vía aérea. Puede ser de utilidad, en adquisiciones volumétricas,<br />
el obtener reconstrucciones multiplanares oblicuas alrededor de la lesión quística, lo que permitirá en alguno<br />
de los planos identificar su origen bronquial.