Les électrons dans un potentiel périodique. Structure de bande - EPFL
Les électrons dans un potentiel périodique. Structure de bande - EPFL
Les électrons dans un potentiel périodique. Structure de bande - EPFL
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
20 CHAPITRE 5. STRUCTURE DE BANDE<br />
<strong>de</strong> chaque site atomique. Lorsqu’on fait diminuer le paramètre du réseau, on<br />
peut considérer que les atomes n’interagissent pas jusqu’à ce que l’extension<br />
spatiale <strong>de</strong>s fonctions d’on<strong>de</strong> soit telle que les fonctions d’on<strong>de</strong> <strong>de</strong> 2 atomes<br />
voisins se recouvrent. Dans ce cas apparait <strong>un</strong>e interaction entre les <strong>électrons</strong><br />
associés au niveau électronique <strong>de</strong> plus gran<strong>de</strong> extension spatiale. Dans le cas<br />
du Na cette situation apparaît bien avant que l’on ait atteint le paramètre<br />
du réseau du métal.<br />
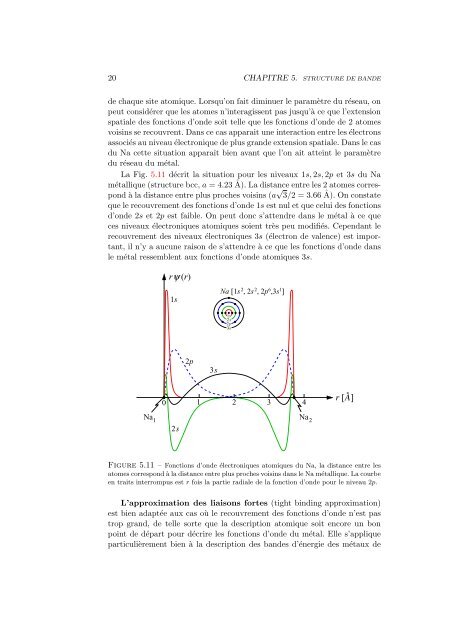
La Fig. 5.11 décrit la situation pour les niveaux 1s, 2s, 2p et 3s du Na<br />
métallique (structure bcc, a = 4.23 ˚ A). La distance entre les 2 atomes correspond<br />
à la distance entre plus proches voisins (a √ 3/2 = 3.66 ˚ A). On constate<br />
que le recouvrement <strong>de</strong>s fonctions d’on<strong>de</strong> 1s est nul et que celui <strong>de</strong>s fonctions<br />
d’on<strong>de</strong> 2s et 2p est faible. On peut donc s’attendre <strong>dans</strong> le métal à ce que<br />
ces niveaux électroniques atomiques soient très peu modifiés. Cependant le<br />
recouvrement <strong>de</strong>s niveaux électroniques 3s (électron <strong>de</strong> valence) est important,<br />
il n’y a auc<strong>un</strong>e raison <strong>de</strong> s’attendre à ce que les fonctions d’on<strong>de</strong> <strong>dans</strong><br />
le métal ressemblent aux fonctions d’on<strong>de</strong> atomiques 3s.<br />
Na 1<br />
rψ (r)<br />
1s<br />
2s<br />
2p<br />
3s<br />
Na [1s 2 , 2s 2 , 2p 6 ,3s 1 ]<br />
1s<br />
2s<br />
2p<br />
3s<br />
0 1 2 3 4<br />
Na 2<br />
r [Å]<br />
Figure 5.11 – Fonctions d’on<strong>de</strong> électroniques atomiques du Na, la distance entre les<br />
atomes correspond à la distance entre plus proches voisins <strong>dans</strong> le Na métallique. La courbe<br />
en traits interrompus est r fois la partie radiale <strong>de</strong> la fonction d’on<strong>de</strong> pour le niveau 2p.<br />
L’approximation <strong>de</strong>s liaisons fortes (tight binding approximation)<br />
est bien adaptée aux cas où le recouvrement <strong>de</strong>s fonctions d’on<strong>de</strong> n’est pas<br />
trop grand, <strong>de</strong> telle sorte que la <strong>de</strong>scription atomique soit encore <strong>un</strong> bon<br />
point <strong>de</strong> départ pour décrire les fonctions d’on<strong>de</strong> du métal. Elle s’applique<br />
particulièrement bien à la <strong>de</strong>scription <strong>de</strong>s ban<strong>de</strong>s d’énergie <strong>de</strong>s métaux <strong>de</strong>