02 - Szerves Kémiai Tanszék
02 - Szerves Kémiai Tanszék
02 - Szerves Kémiai Tanszék
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
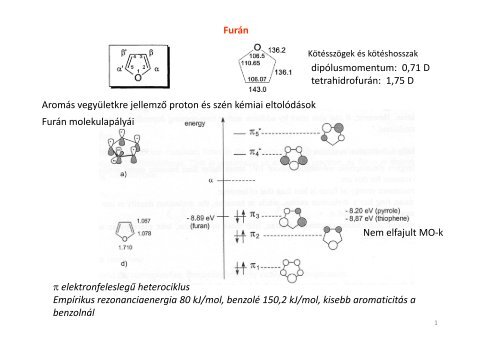
Furán<br />
Aromás vegyületkre jellemző proton és szén kémiai eltolódások<br />
Furán molekulapályái<br />
Kötésszögek és kötéshosszak<br />
dipólusmomentum: 0,71 D<br />
tetrahidrofurán: 1,75 D<br />
Nem elfajult MO-k<br />
π elektronfeleslegű heterociklus<br />
Empírikus rezonanciaenergia 80 kJ/mol, benzolé 150,2 kJ/mol, kisebb aromaticitás a<br />
benzolnál<br />
1
Benzol rezonancia energia emlékeztető<br />
Benzol molekulapályái<br />
2
-Elektrofil aromás szubsztitúció<br />
-addíciós és gyűrűnyitási reakciók<br />
Elektrofil aromás szubsztitúció<br />
10 11 –szer gyorsabban reagál a benzolnál hasonló körülmények között<br />
1) Benzolnál kisebb rezonancia energia<br />
2) π-elektron felesleg<br />
σ-komplexek pirrollal szemlélteve<br />
1) α-helyzetű támadás esetén a töltésdelokalizáció hatékonyabb, 3 határszerkezeti forma<br />
2) A HOMO koefficines nagyobb az α -szénatomon.<br />
3
1) nitrálás<br />
2) Szulfonálás<br />
3) Halogénezés<br />
4
4) Acilezés<br />
5) Alkilezés<br />
Metallálás<br />
5
Addíciós reakciók: 1,3-butadiénre jellemző reakciók<br />
Diels-Alder reakció, normál elektronigényű<br />
Furán HOMO, maleinsavanhidrid<br />
LUMO<br />
Kinetikus termék<br />
40 °C-on 500-szor gyorsabban<br />
keletkezik<br />
Termodinamikai termék<br />
6
Paterno-Büchi reakció: fotokémiai [2+2] reakció<br />
Gyűrűnyitási reakciók: tömény kénsav és perklórsav polimerizációt vált ki<br />
Híg savakkal 1,4-dikarbonil származék keletkezik<br />
7
Retroszintetikus megközelítés<br />
Előállítás<br />
1,4-dikarbonil származék<br />
S N i<br />
alkilezés<br />
aldol<br />
8
1) Paal-Knorr szintézis: tömény kénsav, polifoszforsav, SnCl 2 , DMSO<br />
2) Feist-Benary szintézis: α-halo karbonil származék és β-keto észter<br />
9
Regioszelektivitás: C-alkilezés/ aldol reakció<br />
Furfurol (furán-2-karbaldehid)<br />
10
Benzo[b]furán<br />
C-2/C-3 szelektivitás<br />
salétromsavval<br />
kizárólagosan<br />
Előállítás:<br />
1)<br />
2)<br />
11
3)<br />
4)<br />
gyűrűs éter,<br />
peroxidmentesítés<br />
Tetrahidrofurán<br />
oldószer, Grignard<br />
reakciók<br />
előállítás<br />
12
Tiofén<br />
kén nagyobb mérete miatt<br />
hosszabb C-S kötés<br />
dipólusmomentum 0,52 D, kisebb, mint a furáné; rezonancia energia 120 kJ/mol, aromaticitás<br />
kisebb, mint a benzolé, de nagyobb a furánénál.<br />
- kén kisebb EN-a<br />
- 3d pályák részvétele<br />
S E Ar C-2 szelektivitás<br />
1)<br />
2) Szulfonálás 96%-os kénsavval végrehajtható<br />
3) Halogénezés 10 8 -szor gyorsabb 25 °C-on ,mint a benzolnál<br />
13
metallálás<br />
Addíciós reakciók: Diels-Alder reakcióban kisebb reaktivitás furánnal, csak erősen aktivált<br />
dienofilekkel reagál, nyomás alatt<br />
14
Gyűrűnyitási reakciók: közepes töménységű Brönsted savakkal nem hidrolizál és polimerizál<br />
Gyűrűnyitáshoz speciális reagensek<br />
reduktív deszulfurálással<br />
Oxidáció:tiofén-1-oxid és -1,1-dioxid<br />
Előállítás<br />
1) Paal szintézis<br />
2) alkánokból<br />
15
3) Fiesselmann szintézis: β-klórvinilaldehid származékból<br />
aldol<br />
Micheal addíció<br />
HCl elimináció<br />
Kiindulási anyag előállítása: VILSMEIER-HAACK-ARNOLD reakció<br />
4) Gewald szintézis: aktív α-metilén csoportot tartalmazó oxo vegyület és ciánecetsav<br />
Knoevenagel<br />
kondenzáció<br />
16
5) Hinsberg reakció: 1,2-dikarbonil származék és 3-tiapentándisav<br />
Benzo[b]tiofén<br />
előállítás: α-heloketonból és tiofenolátból<br />
2<br />
Benzo[c]tiofén<br />
bomlékony<br />
17
Tipikus reakció: [4+2] Diels-Alder cikloaddíció<br />
pirrol<br />
1,58 D, N atom a pozitív an polározott<br />
100 kJ/mol rezonancia energia<br />
furán és tiofén közötti<br />
Aromaticitás: furán
Pirrol, mint NH sav, pK a 17,51<br />
NH deprotonálása<br />
pK a 37<br />
pK a 45<br />
S E Ar: furánnál 10 5 -ször gyorsabban reagál azonos körülmények között, pedig rezonancia<br />
energiája nagyobb a furánénál.<br />
σ-komplexet különösen jól stabilizálja az iminium forma<br />
19
S E Ar reakciókoordinátája furán és pirrol esetén<br />
1) nitrálás: nitráló elegy bomláshoz vezet, acetil-nitráttal végezhető<br />
2) szulfonálás: termodinamikailag stabilabb terméket eredményezi, tömény kénsav<br />
polimerizációt okoz<br />
20
3) Halogénezés: tetrahalo származékok a termékek a nagy reaktivitás miatt<br />
4) acilezés<br />
5) Vilsmeyer-Haack formilezés<br />
21
Reakció gyenge elektrofilekkel, pl. diazónium sókkal demonstrálja a pirrol reaktivitását<br />
hidroximetilezés<br />
dipirrolilmetán származék<br />
22
Elektrofil szubsztitúció a nitrogénen<br />
1-alkilpirrol reakciója BuLi-val<br />
23
Maleinsav anhidriddel nem Diels-Alder reakció szerint reagál, hanem Michael addícióval<br />
Előállítás<br />
1) Paal-Knorr szintézis: 1,4-dikarbonil vegyületből ammóniával vagy primer aminnal.<br />
24
2) Hantzsch szintézis: regioszelektivitás a szubsztituensektől függ, 1,2,3,5-tetraszubsztituált<br />
pirrol a kedevezményezett<br />
Amin és β-keto észter reakciója β-amino-akril-észtert (12) ad.<br />
N-alkilezés:<br />
1,2,3,4-tetraszubsztituált<br />
pirrol<br />
25
3) Knorr szintézis: α-amino ketonok és β-ketoészterek reakciója<br />
α-amino ketonok generálása in situ történik; keton nitrozálása alkil-nitrittel NaOMe<br />
jelenlétében<br />
26
Lineáris tetrapirrol származékok- bilirubinoidok, bilirubin és biliverdin<br />
Gyűrűs tetrapirrolok: porfirinek<br />
porfirin<br />
27
Indol vagy benzo[b]pirrol<br />
S E Ar: pirrolnál kisebb reaktivitás, 3-pozíció kedvezményezett a szubsztitúcióban<br />
-Imínium intermedier alacsonyabb energiájú<br />
- HOMO koeeficiens nagyobb a C-3 szénatomon<br />
28
Mannich reakció<br />
Addíciós reakció<br />
Indigó redukciója<br />
Na 2 S 2 O 4<br />
nem vízoldható<br />
vízoldható<br />
29
Szintézis<br />
1) Reissert szintézis: o-nitro-benzilkarbonil származékok reduktív gyűrűzárása<br />
2) Bischler szintézis: α-arilaminoketonokból<br />
30
3) Fischer szintézis (1883): N-arilhidrozonokból Lewis (ZnCl 2 , BF 3 ) vagy Brönsted savval<br />
(H 2 SO 4 , HCl) ammónia vesztéssel.<br />
[3,3] szigmatróp átrendeződés<br />
Diaza-Cope átrendeződés<br />
Cope átrendeződés<br />
biszimin<br />
31
Előfordulás<br />
triptofán<br />
szerotonin<br />
Melaninok: barna és fekete haj pigmentjei, bőrszín pigmentjei<br />
phaeomelanin<br />
32<br />
eumelanin