BENTUK MOLEKUL (BAHAN AJAR KIMIA UMUM I)
Bahan Ajar Kimia Umum I, Bentuk Molekul, Teori VSEPR, Hibridisasi, Kepolaran Molekul
Bahan Ajar Kimia Umum I, Bentuk Molekul, Teori VSEPR, Hibridisasi, Kepolaran Molekul
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
32<br />
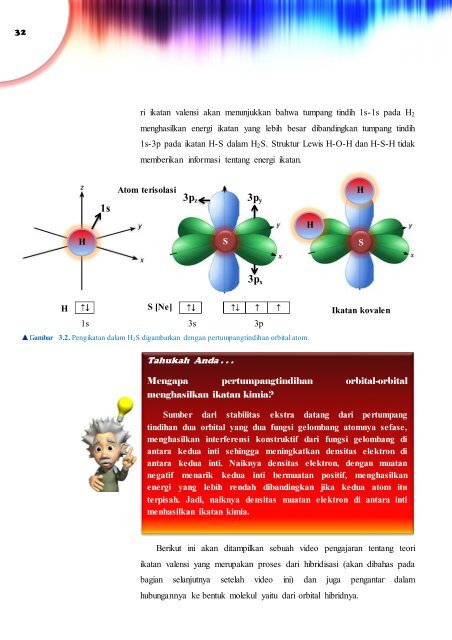
ri ikatan valensi akan menunjukkan bahwa tumpang tindih 1s-1s pada H 2<br />
menghasilkan energi ikatan yang lebih besar dibandingkan tumpang tindih<br />
1s-3p pada ikatan H-S dalam H 2 S. Struktur Lewis H-O-H dan H-S-H tidak<br />
memberikan informasi tentang energi ikatan.<br />
1s<br />
Atom terisolasi<br />
3p z<br />
3p y<br />
H<br />
H<br />
H<br />
S<br />
S<br />
3p x<br />
H<br />
S [Ne]<br />
1s 3s 3p<br />
Gambar 3.2. Pengikatan dalam H 2 S digambarkan dengan pertumpangtindihan orbital atom.<br />
Ikatan kovalen<br />
Tahukah Anda . . .<br />
Mengapa pertumpangtindihan orbital-orbital<br />
menghasilkan ikatan kimia?<br />
Sumber dari stabilitas ekstra datang dari pertumpang<br />
tindihan dua orbital yang dua fungsi gelombang atomnya sefase,<br />
menghasilkan interferensi konstruktif dari fungsi gelombang di<br />
antara kedua inti sehingga meningkatkan densitas elektron di<br />
antara kedua inti. Naiknya densitas elektron, dengan muatan<br />
negatif menarik kedua inti bermuatan positif, menghasilkan<br />
energi yang lebih rendah dibandingkan jika kedua atom itu<br />
terpisah. Jadi, naiknya densitas muatan elektron di antara inti<br />
menhasilkan ikatan kimia.<br />
Berikut ini akan ditampilkan sebuah video pengajaran tentang teori<br />
ikatan valensi yang merupakan proses dari hibridisasi (akan dibahas pada<br />
bagian selanjutnya setelah video ini) dan juga pengantar dalam<br />
hubungannya ke bentuk molekul yaitu dari orbital hibridnya.