7° Congresso Internazionale SOI
7° Congresso Internazionale SOI
7° Congresso Internazionale SOI
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
36<br />
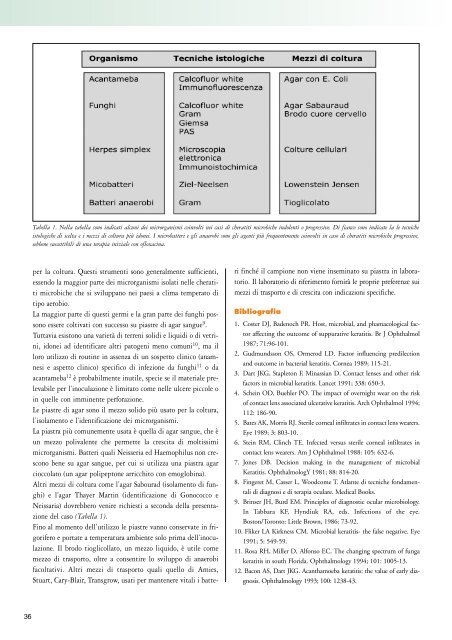
Tabella 1. Nella tabella sono indicati alcuni dei microrganismi coinvolti nei casi di cheratiti microbiche indolenti o progressive. Di fianco sono indicate la le tecniche<br />
istologiche di scelta e i mezzi di coltura più idonei. I microbatteri e gli anaerobi sono gli agenti più frequentemente coinvolti in caso di cheratiti microbiche progressive,<br />
sebbene suscettibili di una terapia iniziale con ofloxacina.<br />
per la coltura. Questi strumenti sono generalmente sufficienti,<br />
essendo la maggior parte dei microrganismi isolati nelle cheratiti<br />
microbiche che si sviluppano nei paesi a clima temperato di<br />
tipo aerobio.<br />
La maggior parte di questi germi e la gran parte dei funghi possono<br />
essere coltivati con successo su piastre di agar sangue 9 .<br />
Tuttavia esistono una varietà di terreni solidi e liquidi o di vetrini,<br />
idonei ad identificare altri patogeni meno comuni 10 , ma il<br />
loro utilizzo di routine in assenza di un sospetto clinico (anamnesi<br />
e aspetto clinico) specifico di infezione da funghi 11 o da<br />
acantameba 12 è probabilmente inutile, specie se il materiale prelevabile<br />
per l’inoculazione è limitato come nelle ulcere piccole o<br />
in quelle con imminente perforazione.<br />
Le piastre di agar sono il mezzo solido più usato per la coltura,<br />
l’isolamento e l’identificazione dei microrganismi.<br />
La piastra più comunemente usata è quella di agar sangue, che è<br />
un mezzo polivalente che permette la crescita di moltissimi<br />
microrganismi. Batteri quali Neisseria ed Haemophilus non crescono<br />
bene su agar sangue, per cui si utilizza una piastra agar<br />
cioccolato (un agar polipeptone arricchito con emoglobina).<br />
Altri mezzi di coltura come l’agar Sabourad (isolamento di funghi)<br />
e l’agar Thayer Martin (identificazione di Gonococco e<br />
Neissaria) dovrebbero venire richiesti a seconda della presentazione<br />
del caso (Tabella 1).<br />
Fino al momento dell’utilizzo le piastre vanno conservate in frigorifero<br />
e portate a temperatura ambiente solo prima dell’inoculazione.<br />
Il brodo tioglicollato, un mezzo liquido, è utile come<br />
mezzo di trasporto, oltre a consentire lo sviluppo di anaerobi<br />
facoltativi. Altri mezzi di trasporto quali quello di Amies,<br />
Stuart, Cary-Blair, Transgrow, usati per mantenere vitali i batte-<br />
ri finché il campione non viene inseminato su piastra in laboratorio.<br />
Il laboratorio di riferimento fornirà le proprie preferenze sui<br />
mezzi di trasporto e di crescita con indicazioni specifiche.<br />
Bibliografia<br />
1. Coster DJ, Badenoch PR. Host, microbial, and phamacological factor<br />
affecting the outcome of suppurative keratitis. Br J Ophthalmol<br />
1987; 71:96-101.<br />
2. Gudmundsson OS, Ormerod LD. Factor influencing predilection<br />
and outcome in bacterial keratitis. Cornea 1989; 115-21.<br />
3. Dart JKG, Stapleton F, Minassian D. Contact lenses and other risk<br />
factors in microbial keratitis. Lancet 1991; 338: 650-3.<br />
4. Schein OD, Buehler PO. The impact of overnight wear on the risk<br />
of contact lens associated ulcerative keratitis. Arch Ophthalmol 1994;<br />
112: 186-90.<br />
5. Bates AK, Morris RJ. Sterile corneal infiltrates in contact lens wearers.<br />
Eye 1989; 3: 803-10.<br />
6. Stein RM, Clinch TE. Infected versus sterile corneal infiltrates in<br />
contact lens wearers. Am J Ophthalmol 1988: 105: 632-6.<br />
7. Jones DB. Decision making in the management of microbial<br />
Keratitis. OphthalmologY 1981; 88: 814-20.<br />
8. Fingeret M, Casser L, Woodcome T. Atlante di tecniche fondamentali<br />
di diagnosi e di terapia oculare. Medical Books.<br />
9. Brinser JH, Burd EM. Principles of diagnostic ocular microbiology.<br />
In Tabbara KF, Hyndiuk RA, eds. Infections of the eye.<br />
Boston/Toronto: Little Brown, 1986: 73-92.<br />
10. Fliker LA Kirkness CM. Microbial keratitis- the false negative. Eye<br />
1991; 5: 549-59.<br />
11. Rosa RH, Miller D, Alfonso EC. The changing spectrum of funga<br />
keratitis in south Florida. Ophthalmology 1994; 101: 1005-13.<br />
12. Bacon AS, Dart JKG. Acanthamoeba keratitis: the value of early diagnosis.<br />
Ophthalmology 1993; 100: 1238-43.