Richtlijn Galweg- en Galblaascarcinoom Versie - Oncoline
Richtlijn Galweg- en Galblaascarcinoom Versie - Oncoline
Richtlijn Galweg- en Galblaascarcinoom Versie - Oncoline
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
1<br />
2<br />
3<br />
4<br />
5<br />
6<br />
7<br />
8<br />
9<br />
10<br />
11<br />
12<br />
13<br />
14<br />
15<br />
16<br />
17<br />
18<br />
19<br />
20<br />
21<br />
22<br />
<strong>Richtlijn</strong> <strong>Galweg</strong>- <strong>en</strong> galblaascarcinoom<br />
<strong>Versie</strong>: 2.0<br />
Datum: juli 2012<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 1 van 75<br />
11 juli 2012<br />
<strong>Richtlijn</strong><br />
<strong>Galweg</strong>- <strong>en</strong> <strong>Galblaascarcinoom</strong><br />
<strong>Versie</strong>
23<br />
24<br />
25<br />
26<br />
27<br />
28<br />
29<br />
30<br />
31<br />
32<br />
33<br />
34<br />
35<br />
36<br />
37<br />
38<br />
39<br />
40<br />
41<br />
42<br />
43<br />
44<br />
45<br />
46<br />
47<br />
48<br />
49<br />
50<br />
51<br />
52<br />
53<br />
54<br />
55<br />
56<br />
57<br />
58<br />
59<br />
60<br />
61<br />
62<br />
63<br />
64<br />
65<br />
66<br />
67<br />
68<br />
69<br />
70<br />
71<br />
Inhoudsopgave<br />
1, Algeme<strong>en</strong><br />
2. Diagnostiek<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 2 van 75<br />
11 juli 2012<br />
2.1 Pre-operatief onderzoek<br />
2.1.1. Pre-operatieve diagnostiek<br />
2.1.2 Pre-operatieve voorbereiding<br />
2.2 Beeldvorm<strong>en</strong>d onderzoek<br />
3. Behandeling<br />
2.2.1 Optimale beeldvorming voor diagnosestelling<br />
2.2.2 Beeldvorming voor accurate stadiering<br />
3.1 Resectiecriteria<br />
3.1.1. Resectiecriteria voor galblaascarcinoom<br />
3.1.2. Resectiecriteria voor galwegcarcinoom<br />
3.2 Preoperatieve galwegdrainage<br />
3.3 Medisch technisch<br />
3.3.1 Chirurgische behandeling galblaascarcinoom<br />
3.3.2. Chirurgische behandeling galwegcarcinoom<br />
3.3.3. Levertransplantatie bij galwegcarcinoom<br />
3.4. Adjuvante behandeling<br />
4. Pathologie<br />
3.4.1 Adjuvante radiotherapie <strong>en</strong>/of chemotherapie voor galwegcarcinoom<br />
4.1 Pathologie galblaascarcinoom<br />
4.2 Pathologie galwegcarcinoom<br />
5. Galblaaspoliep<strong>en</strong><br />
6. Palliatieve behandeling<br />
7. Nazorg<br />
7.1 Algeme<strong>en</strong><br />
7.2 Gevolg<strong>en</strong> ziekte <strong>en</strong> behandeling<br />
7.3 Detectie nieuwe kankermanifestaties<br />
7.4 Organisatie van nazorg bij galblaas- <strong>en</strong> galwegcarcinoom<br />
8. Palliatieve zorg<br />
9. Implem<strong>en</strong>tatie <strong>en</strong> evaluatie<br />
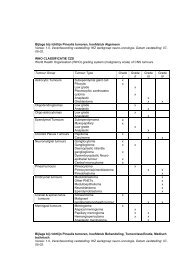
10. TNM <strong>en</strong> classificatie galgangcarcinoom volg<strong>en</strong>s Bismuth Corlette<br />
11. Sam<strong>en</strong>vatting / kernaanbeveling<strong>en</strong><br />
12. Bijlag<strong>en</strong>
72<br />
73<br />
74<br />
75<br />
76<br />
77<br />
78<br />
79<br />
80<br />
81<br />
82<br />
83<br />
84<br />
85<br />
86<br />
87<br />
88<br />
89<br />
90<br />
91<br />
92<br />
93<br />
94<br />
95<br />
96<br />
97<br />
98<br />
99<br />
100<br />
101<br />
102<br />
103<br />
104<br />
105<br />
106<br />
107<br />
108<br />
109<br />
110<br />
111<br />
112<br />
113<br />
114<br />
H1 ALGEMEEN<br />
Aanleiding<br />
De Landelijke Werkgroep Gastro Intestinale Tumor<strong>en</strong> gaf in haar activiteit<strong>en</strong>plan 2011 aan<br />
behoefte te hebb<strong>en</strong> aan revisie van de richtlijn<strong>en</strong> galgangcarcinoom <strong>en</strong> galblaascarcinoom.<br />
Het idee was om beide richtlijn<strong>en</strong> te bundel<strong>en</strong> in één nieuwe, evid<strong>en</strong>ce based richtlijn. De<br />
vorige cons<strong>en</strong>sus based versies van deze richtlijn<strong>en</strong> dateerd<strong>en</strong> van respectievelijk oktober<br />
2003 (galgang) <strong>en</strong> mei 2004 (galblaas).<br />
Al bij het besprek<strong>en</strong> van de uitkomst<strong>en</strong> van de knelpunt<strong>en</strong>inv<strong>en</strong>tarisaties onder professionals<br />
<strong>en</strong> patiënt<strong>en</strong> (tweede bije<strong>en</strong>komst, mei 2011) war<strong>en</strong> er binn<strong>en</strong> de werkgroep, die met de<br />
revisie van de richtlijn aan de slag ging, twijfels over de haalbaarheid van e<strong>en</strong> evid<strong>en</strong>ce based<br />
aanpak. De lage incid<strong>en</strong>tie van beide tumorsoort<strong>en</strong> (zie onder Cijfers) br<strong>en</strong>gt met zich mee dat<br />
er relatief weinig onderzoeksresultat<strong>en</strong> beschikbaar zijn. De werkgroep opteerde daarom<br />
uiteindelijk voor e<strong>en</strong> opnieuw cons<strong>en</strong>sus based revisie van de richtlijn. E<strong>en</strong> cons<strong>en</strong>sus based<br />
gereviseerde richtlijn maakt óók gebruik van wet<strong>en</strong>schappelijke literatuur, echter zonder<br />
voorafgaande systematische zoektocht naar <strong>en</strong> beoordeling van literatuur door e<strong>en</strong> (externe)<br />
methodoloog.<br />
Naamgeving<br />
De vorige versie van de richtlijn hanteerde nog de term galgangcarcinoom. Diverse instanties<br />
(bijvoorbeeld de Maag Lever Darm Stichting) gebruik<strong>en</strong> in de regel de term galweg- of<br />
cholangiocarcinoom. Ook de TNM classificatie (zie hoofdstuk TNM) spreekt over<br />
galwegcarcinoom, <strong>en</strong> maakt daarbij onderscheid tuss<strong>en</strong> kanker van de intra- of<br />
extrahepatische (binn<strong>en</strong> of buit<strong>en</strong> de lever geleg<strong>en</strong>) galweg<strong>en</strong>. De extrahepatische<br />
galwegcarcinom<strong>en</strong> word<strong>en</strong> vervolg<strong>en</strong>s verder onderverdeeld in distale <strong>en</strong> proximale (of<br />
perihilaire) galwegcarcinom<strong>en</strong>. Laatstg<strong>en</strong>oemd<strong>en</strong> word<strong>en</strong> ook wel Klatskin tumor<strong>en</strong> g<strong>en</strong>oemd.<br />
Klatskin tumor<strong>en</strong> zijn de meest voorkom<strong>en</strong>de vorm van galwegkanker.<br />
De werkgroep heeft ervoor gekoz<strong>en</strong> bov<strong>en</strong>staande terminologie (galweg in plaats van<br />
galgang) in deze gereviseerde versie van de richtlijn over te nem<strong>en</strong>. Daarbij richt deze richtlijn<br />
zich met name op het proximaal galwegcarcinoom. Het distaal galwegcarcinoom komt aan bod<br />
in de richtlijn voor het pancreas(kop)carcinoom (zie www.oncoline.nl).<br />
Naast aandacht voor het proximaal galwegcarcinoom besteedt de gereviseerde richtlijn<br />
uiteraard opnieuw aandacht aan het galblaascarcinoom.<br />
Cijfers<br />
Er zijn wat betreft proximaal galweg- <strong>en</strong> galblaascarcinoom relatief weinig (Nederlandse)<br />
cijfers over incid<strong>en</strong>tie <strong>en</strong> preval<strong>en</strong>tie, sterfte <strong>en</strong> overleving. De Nederlandse Kankerregistratie<br />
(NKR) maakt pas sinds 2010 onderscheid tuss<strong>en</strong> het distaal <strong>en</strong> het proximaal<br />
galwegcarcinoom. Dit resulteert in het volg<strong>en</strong>de overzicht.<br />
Incid<strong>en</strong>tie, 2010 (bron: Nederlandse Kankerregistratie)<br />
Galblaas 148<br />
Extrahepatische galweg<strong>en</strong> (exclusief Papil van Vater), waarvan: 297<br />
+ Proximaal 171<br />
+ Distaal 105<br />
+ Onbek<strong>en</strong>d 21<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 3 van 75<br />
11 juli 2012
115<br />
116<br />
117<br />
118<br />
119<br />
120<br />
121<br />
122<br />
123<br />
124<br />
125<br />
126<br />
127<br />
128<br />
129<br />
130<br />
131<br />
132<br />
133<br />
134<br />
135<br />
136<br />
137<br />
138<br />
139<br />
140<br />
141<br />
142<br />
143<br />
144<br />
145<br />
146<br />
147<br />
148<br />
149<br />
150<br />
151<br />
152<br />
153<br />
154<br />
155<br />
156<br />
157<br />
158<br />
159<br />
160<br />
161<br />
162<br />
163<br />
164<br />
Kanker van de galblaas of galweg<strong>en</strong> komt vooral voor bij m<strong>en</strong>s<strong>en</strong> die ouder zijn dan zestig<br />
jaar. Het wordt meestal pas in e<strong>en</strong> laat stadium ontdekt.<br />
Doelstelling<br />
Deze cons<strong>en</strong>sus based richtlijn bevat aanbeveling<strong>en</strong> gericht op het verbeter<strong>en</strong> van de kwaliteit<br />
van zorg voor patiënt<strong>en</strong> met e<strong>en</strong> proximaal galweg- of galblaascarcinoom. De onderwerp<strong>en</strong><br />
waarop deze aanbeveling<strong>en</strong> betrekking hebb<strong>en</strong> vloei<strong>en</strong> voort uit e<strong>en</strong> voorafgaande<br />
inv<strong>en</strong>tarisatie onder professionals <strong>en</strong> patiënt<strong>en</strong> van de belangrijkste knelpunt<strong>en</strong> uit de<br />
dagelijkse praktijk.<br />
Doelgroep<br />
Deze richtlijn is bestemd voor alle professionals die betrokk<strong>en</strong> zijn bij de diagnostiek,<br />
behandeling <strong>en</strong> begeleiding van patiënt<strong>en</strong> met proximaal galweg- of galblaascarcinoom. Het<br />
betreft vooral maag-darm-leverarts<strong>en</strong>, chirurg<strong>en</strong>, internist<strong>en</strong>/medisch oncolog<strong>en</strong>, patholog<strong>en</strong>,<br />
radiolog<strong>en</strong>, radiotherapeut<strong>en</strong> <strong>en</strong> verpleegkundig<strong>en</strong>.<br />
Werkwijze werkgroep<br />
De werkgroep startte met de revisie van de richtlijn in maart 2011 (eerste bije<strong>en</strong>komst<br />
werkgroep). Kort daarop (april/mei 2011) volgde e<strong>en</strong> knelpunt<strong>en</strong>inv<strong>en</strong>tarisatie in de vorm van<br />
e<strong>en</strong> web-based <strong>en</strong>quête onder professionals. Deze is verspreid via diverse (mandater<strong>en</strong>de <strong>en</strong><br />
andere) ver<strong>en</strong>iging<strong>en</strong>, landelijke werkgroep<strong>en</strong> <strong>en</strong> regionale werkgroep<strong>en</strong> c.q. netwerk<strong>en</strong>.<br />
De vraag naar prioritering <strong>en</strong> ev<strong>en</strong>tuele aanvulling van de vooraf door de werkgroep<br />
opgestelde lijst met mogelijke knelpunt<strong>en</strong> is door 203 professionals, met name chirurg<strong>en</strong><br />
(32%) <strong>en</strong> MDL arts<strong>en</strong> (27%), beantwoord.<br />
Als aanvulling hierop vond e<strong>en</strong> knelpunt<strong>en</strong>inv<strong>en</strong>tarisatie plaats onder ervaringsdeskundig<strong>en</strong>;<br />
hiervoor werd<strong>en</strong> vier patiënt<strong>en</strong> geïnterviewd door e<strong>en</strong> adviseur van de NFK (zie verder onder<br />
Patiënt<strong>en</strong>verteg<strong>en</strong>woordiging).<br />
Op basis van de uitkomst<strong>en</strong> van deze inv<strong>en</strong>tarisaties formuleerde de werkgroep e<strong>en</strong> achttal<br />
uitgangsvrag<strong>en</strong> (zie bijlage 4). E<strong>en</strong> van de k<strong>en</strong>merk<strong>en</strong> van e<strong>en</strong> cons<strong>en</strong>sus based richtlijn is dat<br />
niet e<strong>en</strong> (externe) methodoloog, maar de werkgroepled<strong>en</strong> zelf de voor beantwoording van<br />
deze vrag<strong>en</strong> beschikbare literatuur aandrag<strong>en</strong>. Om de volledigheid van deze zelf aangedrag<strong>en</strong><br />
literatuur te waarborg<strong>en</strong>, voerde e<strong>en</strong> IKNL-adviseur e<strong>en</strong> beperkte aanvull<strong>en</strong>de literatuursearch<br />
uit. Zie voor e<strong>en</strong> beschrijving van de daarbij gebruikte zoekstrategie bijlage 6).<br />
Naast het beantwoord<strong>en</strong> van de eerder g<strong>en</strong>oemde uitgangsvrag<strong>en</strong> heeft de werkgroep ook<br />
aandacht besteed aan het opnem<strong>en</strong> van het hoofdstuk over nazorg <strong>en</strong> nacontrole in<br />
de richtlijn galweg- <strong>en</strong> galblaascarcinoom. Dit hoofdstuk is e<strong>en</strong> door het IKNL ontwikkelde<br />
algem<strong>en</strong>e basistekst, gebaseerd op de richtlijn<strong>en</strong> ‘Detecter<strong>en</strong> behoefte psychosociale<br />
zorg’ (juni 2010), ‘Herstel na kanker’ (februari 2011) <strong>en</strong> ‘Oncologische revalidatie’<br />
(oktober 2011). E<strong>en</strong> aantal led<strong>en</strong> van de werkgroep (verteg<strong>en</strong>woordigers van<br />
verpleegkundig<strong>en</strong> <strong>en</strong> patiënt<strong>en</strong>) heeft de algem<strong>en</strong>e tekst over nazorg <strong>en</strong> nacontrole op<br />
onderdel<strong>en</strong> verder toegespitst op patiënt<strong>en</strong> met proximaal galweg- of galblaascarcinoom.<br />
E<strong>en</strong> in april 2012 (vierde bije<strong>en</strong>komst werkgroep) besprok<strong>en</strong> concept versie van de richtlijn is<br />
daarna door e<strong>en</strong> gedeelte van de werkgroep ook redactioneel helemaal klaargemaakt voor de<br />
comm<strong>en</strong>taarronde. De concept richtlijn is daartoe (juli 2012) aangebod<strong>en</strong> aan de<br />
mandater<strong>en</strong>de ver<strong>en</strong>iging<strong>en</strong> <strong>en</strong> relevante regionale werkgroep<strong>en</strong>.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 4 van 75<br />
11 juli 2012
165<br />
166<br />
167<br />
168<br />
169<br />
170<br />
171<br />
172<br />
173<br />
174<br />
175<br />
176<br />
177<br />
178<br />
179<br />
180<br />
181<br />
182<br />
183<br />
184<br />
185<br />
186<br />
187<br />
188<br />
189<br />
190<br />
191<br />
192<br />
193<br />
De vijfde <strong>en</strong> laatste bije<strong>en</strong>komst van de werkgroep (oktober 2012) stond vooral in het tek<strong>en</strong><br />
van het besprek<strong>en</strong> <strong>en</strong> verwerk<strong>en</strong> van de - naar aanleiding van verspreiding van de concept<br />
versie - ontvang<strong>en</strong> comm<strong>en</strong>tar<strong>en</strong>.<br />
Patiënt<strong>en</strong>verteg<strong>en</strong>woordiging<br />
De werkgroep bestond uit zowel verteg<strong>en</strong>woordigers van e<strong>en</strong> aantal professionele disciplines<br />
als ook uit e<strong>en</strong> tweetal patiënt<strong>en</strong>verteg<strong>en</strong>woordigers (nam<strong>en</strong>s NFK). E<strong>en</strong> van beide<br />
patiënt<strong>en</strong>verteg<strong>en</strong>woordigers was betrokk<strong>en</strong> bij het aanpass<strong>en</strong> van de algem<strong>en</strong>e tekst over<br />
nazorg <strong>en</strong> nacontrole voor patiënt<strong>en</strong> met proximaal galweg- of galblaascarcinoom.<br />
Als aanvulling op de <strong>en</strong>quête onder professionals vond e<strong>en</strong> knelpunt<strong>en</strong>inv<strong>en</strong>tarisatie plaats<br />
onder ervaringsdeskundig<strong>en</strong>; hiervoor werd<strong>en</strong> vier patiënt<strong>en</strong> geïnterviewd door e<strong>en</strong> adviseur<br />
van de NFK. Dit gebeurde aan de hand van e<strong>en</strong> gestructureerde vrag<strong>en</strong>lijst, waarbij met name<br />
onderwerp<strong>en</strong> als diagnose (wanneer <strong>en</strong> waar gesteld, met behulp van welke techniek<strong>en</strong>?<br />
behandeling (waar, welke?), contact met lotg<strong>en</strong>ot<strong>en</strong> <strong>en</strong> ervar<strong>en</strong> knelpunt<strong>en</strong> aan bod kwam<strong>en</strong>.<br />
Meer informatie over<br />
Led<strong>en</strong> van de werkgroep (bijlage 1)<br />
Onafhankelijkheid werkgroepled<strong>en</strong> (bijlage 2)<br />
Betrokk<strong>en</strong> ver<strong>en</strong>iging<strong>en</strong>/instanties (bijlage 3)<br />
Uitgangsvrag<strong>en</strong> (bijlage 4)<br />
Zoekstrategie (bijlage 5)<br />
Actualisatie (bijlage 6)<br />
Houderschap richtlijn (bijlage 7)<br />
Juridische betek<strong>en</strong>is (bijlage 8)<br />
Verantwoording (bijlage 9)<br />
Voorbeeld nazorgplan oncologie (bijlage 10)<br />
Refer<strong>en</strong>ties (bijlage 11)<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 5 van 75<br />
11 juli 2012
194<br />
195<br />
196<br />
197<br />
198<br />
199<br />
200<br />
201<br />
202<br />
203<br />
204<br />
205<br />
206<br />
207<br />
208<br />
209<br />
210<br />
211<br />
212<br />
213<br />
214<br />
215<br />
216<br />
217<br />
218<br />
219<br />
220<br />
221<br />
222<br />
223<br />
224<br />
225<br />
226<br />
227<br />
228<br />
229<br />
230<br />
231<br />
232<br />
233<br />
234<br />
235<br />
236<br />
237<br />
238<br />
239<br />
240<br />
H 2 Diagnostiek<br />
2.1 Pre-operatief onderzoek<br />
2.1.1 Pre-operatieve diagnostiek<br />
Literatuurbespreking<br />
Patiënt<strong>en</strong> met e<strong>en</strong> proximale gelokaliseerd galwegcarcinoom pres<strong>en</strong>ter<strong>en</strong> zich frequ<strong>en</strong>t met<br />
e<strong>en</strong> pijnloze icterus. Bij beeldvorm<strong>en</strong>d onderzoek wordt dilatatie gevond<strong>en</strong> van de<br />
intrahepatische galweg<strong>en</strong>, maar niet van de extrahepatische galweg<strong>en</strong>. CT of MR scan toont<br />
e<strong>en</strong> c<strong>en</strong>trale massa of indirecte tek<strong>en</strong><strong>en</strong> hiervan met c<strong>en</strong>trale obstructie van segm<strong>en</strong>tele<br />
galweg<strong>en</strong>. Differ<strong>en</strong>tieel diagnostische overweging<strong>en</strong> betreff<strong>en</strong> in eerste instantie e<strong>en</strong><br />
maligniteit, maar e<strong>en</strong> b<strong>en</strong>igne oorzaak behoort tot de mogelijkhed<strong>en</strong> <strong>en</strong> wordt gerapporteerd<br />
met e<strong>en</strong> frequ<strong>en</strong>tie tuss<strong>en</strong> de 8% <strong>en</strong> 24% [Kloek 2008]. In e<strong>en</strong> serie van 185 patiënt<strong>en</strong> die e<strong>en</strong><br />
chirurgische resectie onderging<strong>en</strong> in verband met de verd<strong>en</strong>king op e<strong>en</strong> hilair<br />
galwegcarcinoom bleek dat er in 17,3% ge<strong>en</strong> sprake was van maligniteit [Erdogan 2008]. In<br />
bijna de helft van de gevall<strong>en</strong> betrof het e<strong>en</strong> IgG4 gerelateerde scleroser<strong>en</strong>de cholangitis.<br />
Vanwege dit relatief hoge perc<strong>en</strong>tage van b<strong>en</strong>igne ziekte zou het logisch zijn te stell<strong>en</strong> dat<br />
alvor<strong>en</strong>s e<strong>en</strong> resectie wordt overwog<strong>en</strong> er eerst bewijs moet zijn van kwaadaardige ziekte.<br />
Helaas is het niet mogelijk om (met de thans ter beschikking staande techniek<strong>en</strong>), preoperatief<br />
e<strong>en</strong> betrouwbare cytologische of histologisch diagnose te verkrijg<strong>en</strong>. Deze techniek<strong>en</strong><br />
omvatt<strong>en</strong> het verkrijg<strong>en</strong> van weefsel tijd<strong>en</strong>s ERCP zoals cytologie van gal verkreg<strong>en</strong> middels<br />
intraductale aspiratie, <strong>en</strong>dobiliaire forceps biopsie, <strong>en</strong> <strong>en</strong>dobiliaire brush cytologie. Via EUS-<br />
FNA kan getracht word<strong>en</strong> materiaal te verkrijg<strong>en</strong> vanuit de primaire tumor of verdachte<br />
lymfklier<strong>en</strong>. Brush cytologie heeft e<strong>en</strong> specificiteit van bijna 100%, maar e<strong>en</strong> beperkte<br />
s<strong>en</strong>sitiviteit van 20-60% [De Bellis 2002]. Betreff<strong>en</strong>de de waarde <strong>en</strong> opbr<strong>en</strong>gst van EUS-FNA<br />
is slechts beperkt informatie beschikbaar, maar in e<strong>en</strong> rec<strong>en</strong>te serie werd gemeld dat de<br />
s<strong>en</strong>sitiviteit 59% bedroeg [Mohamadnejad 2011]. Deze beperkte opbr<strong>en</strong>gst wordt verklaard<br />
door geringe cellulariteit <strong>en</strong> uitgebreide desmopastische verandering<strong>en</strong> bij het<br />
galwegcarcinoom. E<strong>en</strong> dergelijke s<strong>en</strong>sitiviteit is onvoldo<strong>en</strong>de om in geval van e<strong>en</strong> negatieve<br />
brush cytologie af te zi<strong>en</strong> van e<strong>en</strong> resectie. Dit zou betek<strong>en</strong><strong>en</strong> dat 40 tot 80% van de patiënt<strong>en</strong><br />
t<strong>en</strong> onrechte e<strong>en</strong> operatie zou word<strong>en</strong> ontzegd.<br />
Extra aandacht is gew<strong>en</strong>st indi<strong>en</strong> e<strong>en</strong> auto-immuun gemedieerde cholangitis wordt overwog<strong>en</strong><br />
als mogelijke verklaring voor het klinische beeld. In de eerder g<strong>en</strong>oemde serie van 185<br />
patiënt<strong>en</strong> bleek hiervan sprake in 8% van de patiënt<strong>en</strong>. Het is onduidelijk of al deze patiënt<strong>en</strong><br />
ook e<strong>en</strong> verhoogd IgG4 in het serum hebb<strong>en</strong>. Indi<strong>en</strong> wordt overwog<strong>en</strong> om e<strong>en</strong> patiënt te<br />
behandel<strong>en</strong> met corticosteroïd<strong>en</strong> is het belangrijk om e<strong>en</strong> afgr<strong>en</strong>sbare periode van maximaal<br />
2-4 wek<strong>en</strong> te stell<strong>en</strong>, waarin de behandelrespons wordt geëvalueerd <strong>en</strong> tev<strong>en</strong>s e<strong>en</strong> e<strong>en</strong>duidig<br />
te evaluer<strong>en</strong> criterium voor respons te hanter<strong>en</strong>. Indi<strong>en</strong> e<strong>en</strong> patiënt nog ge<strong>en</strong> biliaire drainage<br />
heeft ondergaan <strong>en</strong> er hiertoe ge<strong>en</strong> klinische noodzaak bestaat (cholangitis), is het verdwijn<strong>en</strong><br />
van de icterus <strong>en</strong> cholestase de beste maat van respons. In andere gevall<strong>en</strong> moet m<strong>en</strong> var<strong>en</strong><br />
op regressie van de tumormassa <strong>en</strong> normalisatie van het cholangiogram. Ev<strong>en</strong>tueel moet<br />
hiertoe e<strong>en</strong> ERCP word<strong>en</strong> herhaald. De mogelijke verd<strong>en</strong>king <strong>en</strong> behandeling van e<strong>en</strong> autoimmuun<br />
gemedieerde cholangitis mag niet leid<strong>en</strong> tot e<strong>en</strong> onverantwoorde delay in e<strong>en</strong><br />
noodzakelijke resectie.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 6 van 75<br />
11 juli 2012
241<br />
242<br />
243<br />
244<br />
245<br />
246<br />
247<br />
248<br />
249<br />
250<br />
251<br />
252<br />
253<br />
254<br />
255<br />
256<br />
257<br />
258<br />
259<br />
260<br />
261<br />
262<br />
263<br />
264<br />
265<br />
266<br />
267<br />
268<br />
Conclusies<br />
Het is aangetoond dat de test karakteristiek<strong>en</strong> van (de thans ter beschikking staande<br />
techniek<strong>en</strong>) om e<strong>en</strong> preoperatieve weefsel diagnose te verkrijg<strong>en</strong> onvoldo<strong>en</strong>de zijn om e<strong>en</strong><br />
betrouwbare preoperatieve PA diagnose te verkrijg<strong>en</strong>.<br />
De Bellis 2002; Mohamadnejad 2011<br />
Het is aangetoond dat bij 8% tot 24% van de patiënt<strong>en</strong> die - op grond van e<strong>en</strong> klinische<br />
verd<strong>en</strong>king van e<strong>en</strong> proximale gelokaliseerd galwegcarcinoom - e<strong>en</strong> resectie ondergaan er<br />
sprake blijkt van e<strong>en</strong> b<strong>en</strong>igne ziekte.<br />
Kloek 2008<br />
Overige overweging<strong>en</strong><br />
Indi<strong>en</strong> e<strong>en</strong> auto-immuun cholangitis wordt overwog<strong>en</strong> als verklaring van de klinische<br />
pres<strong>en</strong>tatie <strong>en</strong> de patiënt wordt behandeld met corticosteroïd<strong>en</strong> is het belangrijk om e<strong>en</strong><br />
afgr<strong>en</strong>sbare periode van maximaal 2-4 wek<strong>en</strong> te stell<strong>en</strong> waarna de behandelrespons wordt<br />
geëvalueerd <strong>en</strong> tev<strong>en</strong>s e<strong>en</strong> e<strong>en</strong>duidig te evaluer<strong>en</strong> criterium voor respons te hanter<strong>en</strong>.<br />
De mogelijke verd<strong>en</strong>king <strong>en</strong> behandeling van e<strong>en</strong> auto-immuun gemedieerde cholangitis mag<br />
niet leid<strong>en</strong> tot e<strong>en</strong> onverantwoorde delay in e<strong>en</strong> noodzakelijke resectie van e<strong>en</strong> proximale<br />
gelokaliseerd galwegcarcinoom.<br />
In het geval van palliatieve chemo <strong>en</strong>/of radiotherapie di<strong>en</strong>t wel pathologische bevestiging van<br />
maligniteit te word<strong>en</strong> verkreg<strong>en</strong>.<br />
Aanbeveling<br />
Gezi<strong>en</strong> de beperkte s<strong>en</strong>sitiviteit van weefselonderzoek om de diagnose te bevestig<strong>en</strong> <strong>en</strong> de hoge<br />
pretest likelyhood op maligniteit bij e<strong>en</strong> klinische verd<strong>en</strong>king op e<strong>en</strong> proximaal gelokaliseerd<br />
galwegcarcinoom, is het ge<strong>en</strong> absolute noodzaak om preoperatief de diagnose pathologisch te<br />
bevestig<strong>en</strong>.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 7 van 75<br />
11 juli 2012
269<br />
270<br />
271<br />
272<br />
273<br />
274<br />
275<br />
276<br />
277<br />
278<br />
279<br />
280<br />
281<br />
282<br />
283<br />
284<br />
285<br />
286<br />
287<br />
288<br />
289<br />
290<br />
291<br />
292<br />
293<br />
294<br />
295<br />
296<br />
297<br />
298<br />
299<br />
300<br />
301<br />
302<br />
303<br />
304<br />
305<br />
306<br />
307<br />
308<br />
309<br />
310<br />
311<br />
312<br />
313<br />
314<br />
2.1.2. Pre-operatieve work-up<br />
Literatuurbespreking<br />
In e<strong>en</strong> aantal c<strong>en</strong>tra wordt bij patiënt<strong>en</strong> met galwegcarcinoom die op grond van beeldvorm<strong>en</strong>d<br />
onderzoek resectabel word<strong>en</strong> geacht, routinematig e<strong>en</strong> diagnostische laparoscopie verricht.<br />
Door dit onderzoek werd bij 25-40% van de patiënt<strong>en</strong> e<strong>en</strong> onnodige laparotomie voorkom<strong>en</strong>,<br />
meestal door het vind<strong>en</strong> van kleine lever- of peritoneaalmetastas<strong>en</strong> [Tilleman 2002; Weber<br />
2002; Goere 2006; Joseph 2008]. Door de rec<strong>en</strong>te, verbeterde opbr<strong>en</strong>gst<strong>en</strong> van<br />
beeldvorm<strong>en</strong>de techniek<strong>en</strong> (CT, MRI) heeft diagnostische laparoscopie ge<strong>en</strong> meerwaarde<br />
meer. Laparoscopie wordt nu alle<strong>en</strong> nog aanbevol<strong>en</strong> in geselecteerde gevall<strong>en</strong> [Ruys 2011].<br />
Bij de voorbereiding voor resectie spel<strong>en</strong> het volume van de beoogde leverrest <strong>en</strong> opheff<strong>en</strong><br />
van de obstructie-icterus e<strong>en</strong> cruciale rol [Kawasaki 2003].<br />
Hoewel bij patiënt<strong>en</strong> met normaal leverpar<strong>en</strong>chym kan word<strong>en</strong> volstaan met e<strong>en</strong> leverrest van<br />
25-30% van het totale levervolume, wordt bij patiënt<strong>en</strong> met galwegcarcinoom uitgegaan van<br />
e<strong>en</strong> minimaal leverrestvolume van 40% na optimale galwegdrainage, gezi<strong>en</strong> het door<br />
(rec<strong>en</strong>te) cholestase gecompromitteerde leverpar<strong>en</strong>chym [Van Gulik 2011]. Bij kleiner<br />
leverrestvolume kan preoperatieve embolisatie van de contralaterale v<strong>en</strong>a portae word<strong>en</strong><br />
uitgevoerd t<strong>en</strong>einde het volume <strong>en</strong> de functie van de leverrest te vergrot<strong>en</strong> [Nagino 2006;<br />
Ebata 2012].<br />
In e<strong>en</strong> beperkt aantal studies is e<strong>en</strong> verband gesuggereerd tuss<strong>en</strong> preoperatieve<br />
galwegdrainage <strong>en</strong> het postoperatief optred<strong>en</strong> van <strong>en</strong>tmetastas<strong>en</strong> in operatielittek<strong>en</strong>s door<br />
losgeraakte tumorcell<strong>en</strong> die bij de resectie van de gal de buikholte kunn<strong>en</strong> contaminer<strong>en</strong>. In<br />
e<strong>en</strong> <strong>en</strong>kel c<strong>en</strong>trum word<strong>en</strong> patiënt<strong>en</strong> om deze red<strong>en</strong> op drie ope<strong>en</strong>volg<strong>en</strong>de dag<strong>en</strong> voor de<br />
operatie kortdur<strong>en</strong>d bestraald (3 x 3.5Gy) om de tumorcell<strong>en</strong> in de gal onschadelijk te mak<strong>en</strong><br />
[T<strong>en</strong> Hoop<strong>en</strong> 1990]. De effectiviteit van deze voorbehandeling is echter niet aangetoond.<br />
Voor het galblaascarcinoom dat aanleiding heeft gegev<strong>en</strong> tot e<strong>en</strong> obstructie-icterus als gevolg<br />
van infiltratie van de leverhilus, geld<strong>en</strong> dezelfde overweging<strong>en</strong> als bij het proximaal<br />
gelokaliseerde galwegcarcinoom waar e<strong>en</strong> uitgebreide partiële leverresectie voor geïndiceerd<br />
is. Indi<strong>en</strong> bij het galblaascarcinoom de leverhilus vrij is, hangt de preoperatieve voorbereiding<br />
af van de uitgebreidheid van de b<strong>en</strong>odigde partiële leverresectie. Bij e<strong>en</strong> voorg<strong>en</strong>om<strong>en</strong><br />
(uitgebreide) rechtszijdige hemihepatectromie wordt e<strong>en</strong> toekomstige restlevervolume van<br />
>30% nagestreefd. Bij e<strong>en</strong> kleiner restlevervolume kan preoperatieve embolisatie van de<br />
contralaterale v<strong>en</strong>a portae word<strong>en</strong> overwog<strong>en</strong>.<br />
Conclusies<br />
Er zijn aanwijzing<strong>en</strong> dat diagnostische laparoscopie ge<strong>en</strong> meerwaarde heeft bov<strong>en</strong> de<br />
beschikbare verbeterde beeldvorm<strong>en</strong>de techniek<strong>en</strong> (CT, MRI).<br />
[Ruys 2011]<br />
Bij patiënt<strong>en</strong> met galwegcarcinoom waarbij uitgebreide partiële leverresectie is geïndiceerd<br />
wordt uitgegaan van e<strong>en</strong> minimaal leverrestvolume van 40% na optimale galwegdrainage,<br />
gezi<strong>en</strong> het door (rec<strong>en</strong>te) cholestase gecompromitteerde leverpar<strong>en</strong>chym. Bij kleiner<br />
leverrestvolume kan preoperatieve embolisatie van de contralaterale v<strong>en</strong>aportae word<strong>en</strong><br />
uitgevoerd om het volume <strong>en</strong> de functie van de leverrest te vergrot<strong>en</strong>.<br />
[Nagino 2006; Ebata 2012]<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 8 van 75<br />
11 juli 2012
315<br />
316<br />
317<br />
318<br />
319<br />
320<br />
321<br />
322<br />
323<br />
324<br />
325<br />
326<br />
327<br />
328<br />
329<br />
330<br />
331<br />
332<br />
333<br />
334<br />
335<br />
336<br />
337<br />
338<br />
339<br />
De werkgroep is van m<strong>en</strong>ing dat preoperatieve radiotherapie (3 x 3.5Gy) om vrije tumorcell<strong>en</strong><br />
in de gal onschadelijk te mak<strong>en</strong> ge<strong>en</strong> bewez<strong>en</strong> voordeel heeft.<br />
[T<strong>en</strong> Hoop<strong>en</strong> DSU 1990]<br />
De werkgroep is van m<strong>en</strong>ing dat voor het galblaascarcinoom dat aanleiding heeft gegev<strong>en</strong> tot<br />
e<strong>en</strong> obstructie-icterus, dezelfde preoperatieve voorbereiding<strong>en</strong> geld<strong>en</strong> als bij het proximaal<br />
gelokaliseerde galwegcarcinoom. Indi<strong>en</strong> bij het galblaascarcinoom de leverhilus vrij is, hangt<br />
de preoperatieve voorbereiding af van de uitgebreidheid van de partiële leverresectie. Bij e<strong>en</strong><br />
(uitgebreide) rechtszijdige hemihepatectromie wordt e<strong>en</strong> toekomstige restlevervolume van<br />
>30% nagestreefd. Bij e<strong>en</strong> kleiner restlevervolume kan preoperatieve embolisatie van de<br />
contralaterale v<strong>en</strong>a portae word<strong>en</strong> overwog<strong>en</strong>.<br />
Overige overweging<strong>en</strong><br />
Het verricht<strong>en</strong> van galwegresectie in combinatie met partiële leverresectie, heeft geleid tot e<strong>en</strong><br />
groter aantal R0 resecties <strong>en</strong> verbeterde vijf-jaarsoverleving. Deze uitgebreide resecties gaan<br />
echter gepaard met aanzi<strong>en</strong>lijke morbiditeit <strong>en</strong> mortaliteit (5-10%). Cholangitis <strong>en</strong> insufficiëntie<br />
van de restlever zijn de belangrijkste oorzak<strong>en</strong> voor deze postoperatieve morbiditeit <strong>en</strong><br />
mortaliteit. Preoperatieve galwegdrainage <strong>en</strong> vergrot<strong>en</strong> van het toekomstige restlevervolume<br />
door preoperatieve v<strong>en</strong>a portae embolisatie zijn daarom belangrijke preoperatieve<br />
maatregel<strong>en</strong>.<br />
Aanbeveling<strong>en</strong><br />
De werkgroep is van m<strong>en</strong>ing dat routinematige diagnostische laparoscopie bij het proximaal<br />
gelokaliseerd galwegcarcinoom niet wordt aanbevol<strong>en</strong>.<br />
De werkgroep is van m<strong>en</strong>ing dat bij patiënt<strong>en</strong> met galwegcarcinoom waarbij uitgebreide<br />
partiële leverresectie is geïndiceerd, e<strong>en</strong> minimaal leverrestvolume van 40% na optimale<br />
galwegdrainage wordt nagestreefd. Bij kleiner leverrestvolume di<strong>en</strong>t preoperatieve<br />
embolisatie van de contralaterale v<strong>en</strong>a portae te word<strong>en</strong> overwog<strong>en</strong>.<br />
De werkgroep is van m<strong>en</strong>ing dat voor het galblaascarcinoom dat aanleiding heeft gegev<strong>en</strong> tot<br />
e<strong>en</strong> obstructie-icterus, dezelfde preoperatieve voorbereiding<strong>en</strong> geld<strong>en</strong> als bij het proximaal<br />
gelokaliseerde galwegcarcinoom. Indi<strong>en</strong> bij het galblaascarcinoom de leverhilus vrij is, hangt<br />
de preoperatieve voorbereiding af van de uitgebreidheid van de b<strong>en</strong>odigde partiële<br />
leverresectie. Bij e<strong>en</strong> voorg<strong>en</strong>om<strong>en</strong> (uitgebreide) rechtszijdige hemihepatectromie wordt e<strong>en</strong><br />
toekomstige restlevervolume van >30% nagestreefd. De werkgroep is van m<strong>en</strong>ing dat bij e<strong>en</strong><br />
kleiner restlevervolume, preoperatieve embolisatie van de contralaterale v<strong>en</strong>a portae di<strong>en</strong>t te<br />
word<strong>en</strong> overwog<strong>en</strong>.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 9 van 75<br />
11 juli 2012
340<br />
341<br />
342<br />
343<br />
344<br />
345<br />
346<br />
347<br />
348<br />
349<br />
350<br />
351<br />
352<br />
353<br />
354<br />
355<br />
356<br />
357<br />
358<br />
359<br />
360<br />
361<br />
362<br />
363<br />
364<br />
365<br />
366<br />
367<br />
368<br />
369<br />
370<br />
371<br />
372<br />
373<br />
374<br />
375<br />
376<br />
377<br />
378<br />
379<br />
380<br />
381<br />
382<br />
383<br />
384<br />
385<br />
386<br />
387<br />
388<br />
389<br />
390<br />
391<br />
392<br />
2.2 Beeldvorm<strong>en</strong>d onderzoek<br />
2.2.1. Optimale beeldvorming voor diagnosestelling<br />
Literatuurbespreking<br />
<strong>Galweg</strong>carcinoom<br />
De meeste patiënt<strong>en</strong> die het ziek<strong>en</strong>huis inkom<strong>en</strong> met (stille) icterus / verd<strong>en</strong>king galweg<br />
problematiek zull<strong>en</strong> in eerste instantie word<strong>en</strong> beoordeeld met transabdominale echografie. Dit is<br />
e<strong>en</strong> snel toegankelijk onderzoek, waarbij de meest voorkom<strong>en</strong>de oorzaak van e<strong>en</strong> galwegobstructie<br />
(galst<strong>en</strong><strong>en</strong>) meestal snel kan word<strong>en</strong> onderscheid<strong>en</strong> van andere pathologie. Met name<br />
(intrahepatische)galweg dilatatie kan goed word<strong>en</strong> vastgesteld [Choi 2008]. Bij e<strong>en</strong> andere<br />
obstructie dan galst<strong>en</strong><strong>en</strong> is vervolg onderzoek nodig.<br />
Optimale beeldvorming bij het galwegcarcinoom houdt in dat er e<strong>en</strong> accurate inschatting kan word<strong>en</strong><br />
gemaakt of (curatieve) chirurgisch resectie mogelijk is. Hiervoor moet de locatie van de tumor<br />
word<strong>en</strong> bepaald <strong>en</strong> lokale uitbreiding in de galweg<strong>en</strong>, arteria hepatica, v<strong>en</strong>a porta <strong>en</strong> ingroei in het<br />
leverpar<strong>en</strong>chym [Choi 2008; Park 2008; Weber 2008; Chung 2008]. Transabdominale echografie<br />
speelt bij deze diagnosestelling ge<strong>en</strong> rol. Echografie is tev<strong>en</strong>s erg operator afhankelijk.<br />
Multi-Detector-CT (MDCT) in 4 fas<strong>en</strong> (blanco, arterieel, portaal v<strong>en</strong>eus <strong>en</strong> e<strong>en</strong> late fase) kan e<strong>en</strong><br />
acceptabele inschatting gev<strong>en</strong> over ingroei in de arteria hepatica <strong>en</strong> v<strong>en</strong>a porta. Bij twijfel over<br />
(vasculaire) ingroei kan e<strong>en</strong> echo-duplex word<strong>en</strong> overwog<strong>en</strong>. De mate van ductale uitbreiding is over<br />
het algeme<strong>en</strong> iets minder goed vast te stell<strong>en</strong>, maar de gemiddelde s<strong>en</strong>sitiviteit <strong>en</strong> specificiteit voor<br />
het bepal<strong>en</strong> van vasculaire <strong>en</strong> ductale uitbreiding varieert tuss<strong>en</strong> 81-90%.<br />
Aanvull<strong>en</strong>de invasieve 3D-MDCT cholangiografie middels ERCP of PTC kan meer informatie gev<strong>en</strong><br />
over anatomische uitbreiding <strong>en</strong> locatie van de tumor.<br />
Voor het inschatt<strong>en</strong> van resectabiliteit heeft MRI (T1W, T2W <strong>en</strong> dynamische 3D-contrast series in<br />
arteriële, portaal v<strong>en</strong>euze <strong>en</strong> late fase) ongeveer dezelfde accuratesse als CT. De mate van<br />
vasculaire uitbreiding is met MRI minder goed in te schatt<strong>en</strong> dan met CT. De mate van ductale<br />
uitbreiding is beter te bepal<strong>en</strong> met MRI 3D-CE/MRCP, met e<strong>en</strong> accuraatheid tuss<strong>en</strong> 71-96% (beter<br />
dan ERCP)[Park 2008].<br />
ERCP, <strong>en</strong>do-echografie <strong>en</strong> intraductale echografie kunn<strong>en</strong> informatie gev<strong>en</strong> over de mate van tumor<br />
uitbreiding; dit is e<strong>en</strong> invasief onderzoek dat afhankelijk is van de k<strong>en</strong>nis <strong>en</strong> ervaring van de<br />
operator <strong>en</strong> niet beter dan CT of MRI. Het <strong>en</strong>ige voordeel hiervan is dat er biopt<strong>en</strong> kunn<strong>en</strong> word<strong>en</strong><br />
g<strong>en</strong>om<strong>en</strong> [Weber 2008].<br />
Indi<strong>en</strong> er drainage of plaatsing van e<strong>en</strong> st<strong>en</strong>t bij de galweg<strong>en</strong> moet plaatsvind<strong>en</strong> di<strong>en</strong>t dit het best ná<br />
MRI of CT te gebeur<strong>en</strong>. Dit om overschatting van tumorinfiltratie door artefact<strong>en</strong> <strong>en</strong> lokale<br />
inflammatie te voorkom<strong>en</strong> [Weber 2008].<br />
PET/CT speelt ge<strong>en</strong> rol in het onderzoek naar lokale tumor uitbreiding [Chung 2008, Vilgrain 2008,<br />
Furukawa 2008, Ruys 2011].<br />
<strong>Galblaascarcinoom</strong><br />
<strong>Galblaascarcinoom</strong> wordt meestal per toeval gevond<strong>en</strong> na cholecystectomie. Wanneer bij de eerste<br />
echografie e<strong>en</strong> massa in de galblaas wordt gezi<strong>en</strong> di<strong>en</strong>t e<strong>en</strong> MDCT in 4 fas<strong>en</strong> te word<strong>en</strong> gemaakt.<br />
Dit om lokale ingroei in omligg<strong>en</strong>de weefsels, met name in de lever, te bepal<strong>en</strong>.<br />
Conclusies<br />
<strong>Galweg</strong>carcinoom<br />
M<strong>en</strong> kan galwegdilatatie vaststell<strong>en</strong> met transabdominale echografie <strong>en</strong> daarmee het niveau van de<br />
galwegobstructie (intra- of extrahepatisch) vaststell<strong>en</strong>. De echografie speelt echter verder ge<strong>en</strong> rol<br />
in de diagnose stelling.<br />
[Choi 2008]<br />
Er zijn aanwijzing<strong>en</strong> dat MDCT (4-fas<strong>en</strong>) e<strong>en</strong> acceptabele inschatting geeft over vasculaire<br />
uitbreiding van de galwegtumor.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 10 van 75<br />
11 juli 2012
393<br />
394<br />
395<br />
396<br />
397<br />
398<br />
399<br />
400<br />
401<br />
402<br />
403<br />
404<br />
405<br />
406<br />
407<br />
408<br />
409<br />
410<br />
411<br />
412<br />
413<br />
414<br />
415<br />
416<br />
417<br />
418<br />
419<br />
420<br />
421<br />
422<br />
423<br />
424<br />
425<br />
426<br />
427<br />
428<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 11 van 75<br />
11 juli 2012<br />
[Choi 2008; Park 2008; Weber 2008; Chung 2008]<br />
Er zijn aanwijzing<strong>en</strong> dat MRI met MRCP e<strong>en</strong> meer accurate inschatting geeft over ductale<br />
uitbreiding van de galwegtumor.<br />
[Choi 2008; Park 2008; Weber 2008; Chung 2008]<br />
Er zijn aanwijzing<strong>en</strong> dat PET/CT ge<strong>en</strong> rol speelt in de beoordeling van lokale tumorgroei <strong>en</strong><br />
uitbreiding.<br />
[Chung 2008; Vilgrain 2008; Furukawa 2008. Ruys 2011]<br />
Plaatsing van e<strong>en</strong> st<strong>en</strong>t of drainage di<strong>en</strong>t bij voorkeur te gebeur<strong>en</strong>, na vaststell<strong>en</strong> van resectabiliteit<br />
met CT <strong>en</strong> MRI.<br />
<strong>Galblaascarcinoom</strong><br />
De werkgroep is van m<strong>en</strong>ing dat wanneer bij transabdominale echografie e<strong>en</strong> afwijk<strong>en</strong>de massa in<br />
de galblaas zichtbaar is; e<strong>en</strong> MDCT (4fas<strong>en</strong>) meer informatie kan gev<strong>en</strong> over lokale uitbreiding.<br />
Overige overweging<strong>en</strong><br />
<strong>Galweg</strong>- <strong>en</strong> galblaascarcinoom<br />
Plaatsing v<strong>en</strong> e<strong>en</strong> st<strong>en</strong>t of drainage di<strong>en</strong>t bij voorkeur te gebeur<strong>en</strong>, na vaststell<strong>en</strong> van resectabiliteit<br />
met CT <strong>en</strong> MRI. Dit om overschatting van tumor infiltratie te voorkom<strong>en</strong>. Bij aanhoud<strong>en</strong>de twijfel of<br />
onduidelijkheid kan middels EUS-FNA of ERCP e<strong>en</strong> cytologische punctie word<strong>en</strong> g<strong>en</strong>om<strong>en</strong> van de<br />
intraductale tumor.<br />
Er wordt geadviseerd om vasculaire uitbreiding te bepal<strong>en</strong> met 4-fas<strong>en</strong> MDCT, waarbij de meest<br />
moderne apparatuur de beste beeldkwaliteit <strong>en</strong> accuraatheid geeft; er wordt hier uitgegaan van<br />
t<strong>en</strong>minste e<strong>en</strong> 64-slice MDCT, waarbij MIP <strong>en</strong> MPR reconstructies kunn<strong>en</strong> help<strong>en</strong> bij het bepal<strong>en</strong><br />
van tumor uitbreiding.<br />
Aanbeveling<strong>en</strong><br />
galwegcarcinoom<br />
Er wordt geadviseerd te start<strong>en</strong> met transabdominale echografie om galwegdilatatie te bepal<strong>en</strong> waarbij<br />
het niveau van de galwegobstructie (intra- of extrahepatisch) kan word<strong>en</strong> vastgesteld .<br />
Er wordt geadviseerd om vasculaire uitbreiding te bepal<strong>en</strong> met 4-fas<strong>en</strong> MDCT.<br />
De werkgroep is van m<strong>en</strong>ing dat bij onduidelijkheid over vasculaire ingroei e<strong>en</strong> echo-duplex overwog<strong>en</strong><br />
kan word<strong>en</strong><br />
De werkgroep is van m<strong>en</strong>ing dat wanneer met CT de resectabiliteit niet is uitgeslot<strong>en</strong> dat MRI met<br />
MRCP moet word<strong>en</strong> uitgevoerd om meer duidelijkheid te gev<strong>en</strong> over met name de ductale uitbreiding.<br />
De werkgroep is van m<strong>en</strong>ing dat galwegdrainage <strong>en</strong> st<strong>en</strong>ting ná de beeldvorming di<strong>en</strong>t te gebeur<strong>en</strong><br />
om overschatting van de tumor te voorkom<strong>en</strong>.<br />
galblaascarcinoom<br />
De werkgroep is van m<strong>en</strong>ing dat wanneer er echografisch verd<strong>en</strong>king is op e<strong>en</strong> massa in de galblaas er<br />
aanvull<strong>en</strong>d e<strong>en</strong> 4-fas<strong>en</strong> MDCT kan word<strong>en</strong> gemaakt voor vaststelling van lokale uitbreiding van de<br />
tumor.
429<br />
430<br />
431<br />
432<br />
433<br />
434<br />
435<br />
436<br />
437<br />
438<br />
439<br />
440<br />
441<br />
442<br />
443<br />
444<br />
445<br />
446<br />
447<br />
448<br />
449<br />
450<br />
451<br />
452<br />
453<br />
454<br />
455<br />
456<br />
457<br />
458<br />
459<br />
460<br />
461<br />
462<br />
463<br />
464<br />
465<br />
466<br />
467<br />
468<br />
469<br />
470<br />
471<br />
472<br />
473<br />
474<br />
475<br />
476<br />
477<br />
478<br />
479<br />
2.2.2 Beeldvorming voor accurate stadiering<br />
Literatuurbespreking<br />
<strong>Galweg</strong>carcinoom (GWCa)<br />
Niet alle<strong>en</strong> (lokale) tumor uitbreiding is van belang voor het vaststell<strong>en</strong> of e<strong>en</strong> galwegtumor<br />
resectabel is, ook metastas<strong>en</strong> in (locoregionale) lymfklier<strong>en</strong> <strong>en</strong> metastas<strong>en</strong> op afstand moet<strong>en</strong><br />
word<strong>en</strong> vastgesteld.<br />
Met name het vaststell<strong>en</strong> van pathologische locoregionale lymfklier<strong>en</strong> blijft lastig met de<br />
verschill<strong>en</strong>de modaliteit<strong>en</strong> [Chung 2008]. MDCT met contrast geeft de beste s<strong>en</strong>sitiviteit <strong>en</strong><br />
specificiteit voor de detectie van lymfklier<strong>en</strong>, met name in- <strong>en</strong> rond de leverhilus.<br />
MDCT kan behalve e<strong>en</strong> vergrote diameter van lymfklier<strong>en</strong> minder goed andere maligne k<strong>en</strong>merk<strong>en</strong><br />
zoals c<strong>en</strong>trale necrose <strong>en</strong> aankleuring bepal<strong>en</strong>. Indi<strong>en</strong> e<strong>en</strong> klier vergroot is (>10mm), is daarmee<br />
nog niet zeker of e<strong>en</strong> klier daadwerkelijk pathologisch is of niet [Chung 2008]. CT heeft e<strong>en</strong><br />
s<strong>en</strong>sitiviteit tuss<strong>en</strong> de 50-60% voor het vaststell<strong>en</strong> van pathologische klier<strong>en</strong> <strong>en</strong> is daarmee beter<br />
dan MRI [Vilgrain 2008; Furukawa 2008]. Bij onzeker maligne klier<strong>en</strong> kan word<strong>en</strong> overgegaan tot<br />
EUS met FNA voor cytologie [Weber 2007].<br />
PET/CT heeft e<strong>en</strong> matige s<strong>en</strong>sitiviteit voor locoregionale klier<strong>en</strong>; ongeveer tuss<strong>en</strong> 12-38%; dit komt<br />
vooral doordat de klier<strong>en</strong> rond de 1cm vaak net onder de detectiegr<strong>en</strong>s ligg<strong>en</strong> [Vilgrain 2008].<br />
MRI <strong>en</strong> transabdominale echografie spel<strong>en</strong> ge<strong>en</strong> besliss<strong>en</strong>de rol bij het detecter<strong>en</strong> van<br />
pathologische klier<strong>en</strong>.<br />
Metastas<strong>en</strong> op afstand kunn<strong>en</strong> het best word<strong>en</strong> opgespoord met e<strong>en</strong> contrast CT van thorax <strong>en</strong><br />
abdom<strong>en</strong> in t<strong>en</strong>minste de portaal v<strong>en</strong>euze fase [Vilgrain 2008; Furukawa 2008; Petrowsky 2006].<br />
MRI <strong>en</strong> echografie spel<strong>en</strong> ge<strong>en</strong> rol in het vaststell<strong>en</strong> van metastas<strong>en</strong> op afstand [Choi 2008].<br />
PET/CT lijkt ge<strong>en</strong> plaats te hebb<strong>en</strong> in onderzoek naar metastas<strong>en</strong> op afstand, maar kan bij e<strong>en</strong><br />
selecte groep patiënt<strong>en</strong> soms toch onverwacht metastas<strong>en</strong> oplever<strong>en</strong> [Petrowsky 2006].<br />
<strong>Galblaascarcinoom</strong><br />
Bov<strong>en</strong>staande bevinding<strong>en</strong> geld<strong>en</strong> ook voor galblaascarcinoom, hoewel metastas<strong>en</strong> hiervan lastiger<br />
zijn te detecter<strong>en</strong> met e<strong>en</strong> s<strong>en</strong>sitiviteit op CT van 24% [Petrowsky 2006].<br />
Conclusies<br />
<strong>Galweg</strong>carcinoom<br />
Er zijn aanwijzing<strong>en</strong> dat voor het beoordel<strong>en</strong> van locoregionale pathologische lymfklier<strong>en</strong> CT betere<br />
resultat<strong>en</strong> geeft dan echografie, MRI <strong>en</strong> PET/CT.<br />
[Chung 2008; Vilgrain 2008; Furukawa 2008]<br />
Bij twijfel over metastas<strong>en</strong> in e<strong>en</strong> klier van de galweg, kan <strong>en</strong>do-echografie met FNA word<strong>en</strong><br />
uitgevoerd voor het verkrijg<strong>en</strong> van cytologie.<br />
[Weber 2007]<br />
Er zijn aanwijzing<strong>en</strong> dat metastas<strong>en</strong> op afstand het best te detecter<strong>en</strong> zijn met contrast CT thorax<br />
<strong>en</strong> abdom<strong>en</strong>.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 12 van 75<br />
11 juli 2012<br />
[Vilgrain 2008; Furukawa 2008; Petrowsky 2006].<br />
<strong>Galblaascarcinoom</strong><br />
Er zijn aanwijzing<strong>en</strong> dat voor het beoordel<strong>en</strong> van locoregionale pathologische lymfklier<strong>en</strong> CT betere<br />
resultat<strong>en</strong> geeft dan echografie, MRI <strong>en</strong> PET/CT, hoewel pathologische locoregionale klier<strong>en</strong> vaak<br />
nog moeilijker zijn vast te stell<strong>en</strong>.<br />
[Petrowsky 2006]<br />
Overige overweging<strong>en</strong>
480<br />
481<br />
482<br />
483<br />
484<br />
485<br />
486<br />
487<br />
488<br />
489<br />
490<br />
491<br />
492<br />
<strong>Galweg</strong>- <strong>en</strong> galblaascarcinoom<br />
PET/CT lijkt ge<strong>en</strong> plaats te hebb<strong>en</strong> in het opspor<strong>en</strong> van metastas<strong>en</strong> op afstand. Hoewel in meerdere<br />
artikel<strong>en</strong> staat dat soms e<strong>en</strong> beleidsverandering optreed na PET/CT, of dat toch onverwacht<br />
metastas<strong>en</strong> op afstand word<strong>en</strong> gevond<strong>en</strong> [Chung 2008, Furukawa 2008, Ruys 2011]. Wanneer na<br />
het mak<strong>en</strong> van e<strong>en</strong> CT thorax/abdom<strong>en</strong> over de aanwezigheid van metastas<strong>en</strong> nog twijfel is zou e<strong>en</strong><br />
PET/CT overwog<strong>en</strong> kunn<strong>en</strong> word<strong>en</strong>.<br />
Aanbeveling<strong>en</strong><br />
galwegcarcinoom<br />
Er wordt geadviseerd om voor detectie van locoregionale lymfklier<strong>en</strong> <strong>en</strong> metastas<strong>en</strong> op afstand e<strong>en</strong> CT<br />
thorax <strong>en</strong> abdom<strong>en</strong> met contrast te mak<strong>en</strong> in t<strong>en</strong>minste e<strong>en</strong> portaal v<strong>en</strong>euze fase.<br />
Er wordt geadviseerd om bij twijfel over de pathologie van (locoregionale) klier<strong>en</strong> e<strong>en</strong> cytologische<br />
punctie middels <strong>en</strong>do-echografie <strong>en</strong> FNA uit te voer<strong>en</strong>.<br />
Er wordt geadviseerd om bij twijfel over metastas<strong>en</strong> op afstand e<strong>en</strong> aanvull<strong>en</strong>de PET/CT te overweg<strong>en</strong><br />
ook wanneer deze niet in het standaard behandelprotocol staat.<br />
galblaascarcinoom<br />
Er wordt geadviseerd om voor detectie van locoregionale lymfklier<strong>en</strong> <strong>en</strong> metastas<strong>en</strong> op afstand e<strong>en</strong> CT<br />
thorax <strong>en</strong> abdom<strong>en</strong> met contrast te mak<strong>en</strong> in t<strong>en</strong>minste e<strong>en</strong> portaal v<strong>en</strong>euze fase.<br />
M<strong>en</strong> di<strong>en</strong>t er echter bedacht op te zijn dat het vaststell<strong>en</strong> van locoregionale klier<strong>en</strong> vaak nog lastiger is.<br />
Er wordt geadviseerd om bij twijfel over de pathologie van (locoregionale) klier<strong>en</strong> e<strong>en</strong> cytologische<br />
punctie middels <strong>en</strong>do-echografie <strong>en</strong> FNA uit te voer<strong>en</strong>.<br />
Er wordt geadviseerd om bij twijfel over de pathologie van (locoregionale) klier<strong>en</strong> e<strong>en</strong> cytologische<br />
punctie middels <strong>en</strong>do-echografie <strong>en</strong> FNA uit te voer<strong>en</strong>.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 13 van 75<br />
11 juli 2012
493<br />
494<br />
495<br />
496<br />
497<br />
498<br />
499<br />
500<br />
501<br />
502<br />
503<br />
504<br />
505<br />
506<br />
507<br />
508<br />
509<br />
510<br />
511<br />
512<br />
513<br />
514<br />
515<br />
516<br />
517<br />
518<br />
519<br />
520<br />
521<br />
522<br />
523<br />
524<br />
525<br />
526<br />
527<br />
528<br />
529<br />
530<br />
531<br />
532<br />
533<br />
534<br />
535<br />
536<br />
537<br />
538<br />
539<br />
540<br />
3. BEHANDELING<br />
3.1 Resectiecriteria<br />
3.1.1. Resectiecriteria voor galblaascarcinoom<br />
Literatuurbespreking<br />
Historisch gezi<strong>en</strong> heeft het galblaascarcinoom e<strong>en</strong> slechte prognose met e<strong>en</strong> 5-<br />
jaarsoverleving van 5-10% <strong>en</strong> e<strong>en</strong> mediane overleving van 3-6 maand<strong>en</strong> vanaf de<br />
diagnose [Cubertafond 1994; Piehler 1978]. Verschill<strong>en</strong>de studies lat<strong>en</strong> zi<strong>en</strong> dat bij e<strong>en</strong><br />
geselecteerde groep patiënt<strong>en</strong> acceptabele lange-termijn overleving bereikt kan word<strong>en</strong><br />
door chirurgie[Hueman 2009; Lai 2008]. De resectabiliteit <strong>en</strong> curabiliteit wordt bepaald<br />
door het tumorproces <strong>en</strong> de mate van metastasering. Verschill<strong>en</strong>de artikel<strong>en</strong> lat<strong>en</strong> zi<strong>en</strong> dat<br />
R0-resectie de belangrijkste factor is die de lange-termijn overleving bepaalt [Pawlik 2007;<br />
Chijiiwa 2001]. Het verricht<strong>en</strong> van e<strong>en</strong> R1-resectie of debulking van e<strong>en</strong><br />
galblaascarcinoom wordt niet zinvol geacht aangezi<strong>en</strong> dat in het geheel ge<strong>en</strong><br />
overlevingswinst oplevert [Gourgiotis 2008]. Het type resectie om R0-marges te verkrijg<strong>en</strong><br />
is afhankelijk van de uitgebreidheid van de tumor. Om R0-marges te verkrijg<strong>en</strong> kan het<br />
ev<strong>en</strong>tueel noodzakelijk zijn uitgebreide leverresecties <strong>en</strong> resectie van omligg<strong>en</strong>de organ<strong>en</strong><br />
te verricht<strong>en</strong> [Hueman 2009]. Indi<strong>en</strong> lymfkliermetastasering beperkt is geblev<strong>en</strong> tot de<br />
regionale lymfklier<strong>en</strong> in het ligam<strong>en</strong>tum hepatoduod<strong>en</strong>ale is er overlevingsvoordeel te<br />
behal<strong>en</strong> door lymfad<strong>en</strong>ectomie van het ligam<strong>en</strong>tum hepatoduod<strong>en</strong>ale [Kondo 2000;<br />
Goetze 2011]. Resectie van levermetastas<strong>en</strong> levert ge<strong>en</strong> overlevingsvoordeel op<br />
[Gourgiotis 2008]. Indi<strong>en</strong> de verwachting is e<strong>en</strong> R0-resectie te kunn<strong>en</strong> verricht<strong>en</strong>, wordt bij<br />
alle patiënt<strong>en</strong> bij wie pre-operatief de verd<strong>en</strong>king is op e<strong>en</strong> galblaascarcinoom of bij wie<br />
pre-operatief e<strong>en</strong> galblaascarcinoom is bewez<strong>en</strong> e<strong>en</strong> chirurgische resectie geadviseerd<br />
[Lai 2008].<br />
Conclusies<br />
Het is aannemelijk dat de compleetheid van de resectie van e<strong>en</strong> galblaascarcinoom de<br />
lange-termijn overleving na resectie bepaalt.<br />
[Pawlik 2007; Chijiiwa 2001]<br />
Er zijn aanwijzing<strong>en</strong> dat het niet zinvol lijkt e<strong>en</strong> R1-resectie of debulking van e<strong>en</strong><br />
galblaascarcinoom te verricht<strong>en</strong>.<br />
[Gourgiotis 2008]<br />
Het is aannemelijk dat lymfad<strong>en</strong>ectomie van het ligam<strong>en</strong>tum hepatoduod<strong>en</strong>ale<br />
overlevingsvoordeel oplevert.<br />
[Kondo 2000; Goetze 2011]<br />
Er zijn aanwijzing<strong>en</strong> dat resectie van metastas<strong>en</strong> op afstand ge<strong>en</strong> overlevingsvoordeel<br />
biedt.<br />
[Kondo 2000]<br />
Overige overweging<strong>en</strong><br />
Hoe uitgebreid de chirurgie moet zijn om e<strong>en</strong> R0-resectie te realiser<strong>en</strong> hangt af van het<br />
stadium van de tumor (zie hoofdstuk 3.2.1, Chirugische behandeling bij<br />
galblaascarcinoom). Per patiënt moet bepaald word<strong>en</strong> welke vorm van chirurgie toegepast<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 14 van 75<br />
11 juli 2012
541<br />
542<br />
543<br />
544<br />
545<br />
546<br />
547<br />
548<br />
549<br />
550<br />
551<br />
552<br />
553<br />
554<br />
555<br />
556<br />
557<br />
558<br />
559<br />
560<br />
561<br />
562<br />
563<br />
564<br />
565<br />
566<br />
567<br />
568<br />
569<br />
570<br />
571<br />
572<br />
573<br />
574<br />
575<br />
576<br />
577<br />
578<br />
579<br />
580<br />
581<br />
582<br />
583<br />
584<br />
585<br />
586<br />
587<br />
moet word<strong>en</strong> <strong>en</strong> of dat mogelijk is. Dit laatste hangt onder andere af van de conditie, comorbiditeit<br />
<strong>en</strong> leeftijd van de individuele patiënt.<br />
Aanbeveling<br />
Er wordt geadviseerd om iedere patiënt met e<strong>en</strong> galblaascarcinoom of de verd<strong>en</strong>king hierop<br />
in aanmerking te lat<strong>en</strong> kom<strong>en</strong> voor chirurgische resectie wanneer R0-resectie mogelijk lijkt.<br />
3.1.2. Resectiecriteria voor galwegcarcinoom<br />
Literatuurbespreking<br />
De belangrijkste prognostische factor voor overleving na resectie van galwegcarcinoom<br />
(GWCa) is het verricht<strong>en</strong> van e<strong>en</strong> R0 resectie [Wakai 2005; Baton 2007; Oliviera 2007;<br />
Kloek 2008]. Resectabiliteit van het GWCa wordt bepaald door:<br />
• de mate van proximale infiltratie in de segm<strong>en</strong>tele galweg<strong>en</strong>,<br />
• de afwezigheid van afstandsmetastas<strong>en</strong>,<br />
• mate van tumor ingroei in het leverpar<strong>en</strong>chym,<br />
• ingroei in (takk<strong>en</strong> van) de arteriahepatica <strong>en</strong>/of v<strong>en</strong>a portae <strong>en</strong><br />
• het volume van de toekomstige restlever<br />
[Jarnagin 2001; VanGulik 2007; Neuhaus 999; Neuhaus 2008; van Gulik 2011].<br />
De indeling van het GWCa volg<strong>en</strong>s de Bismuth-Corlette classificatie berust op proximale<br />
ingroei van de tumor in de eerste segm<strong>en</strong>tele vertakking<strong>en</strong> van de linker <strong>en</strong> rechter ductus<br />
hepaticus in de lever [Bismuth 1975]. Voor e<strong>en</strong> GWCa dat zich beperkt tot de conflu<strong>en</strong>s<br />
van de linker <strong>en</strong> rechter ductus hepaticus zonder uitbreiding proximaal in de segm<strong>en</strong>tele<br />
galweg<strong>en</strong> (Bismuth type I <strong>en</strong> sommige type II tumor<strong>en</strong>) volstaat lokale resectie van de<br />
extrahepatische galweg [Ikeyama 2007] Bij unilaterale betrokk<strong>en</strong>heid van de segm<strong>en</strong>tele<br />
galweg<strong>en</strong> (Bismuth type IIIa of IIIb) wordt het GWCa verwijderd in combinatie met e<strong>en</strong><br />
(uitgebreide) hemihepatectomie [Kosuge 1999; Seyama 2003]. Bilaterale ingroei in de<br />
segm<strong>en</strong>tele galweg<strong>en</strong> (Bismuth type IV tumor<strong>en</strong>) werd voorhe<strong>en</strong> als e<strong>en</strong> contra-indicatie<br />
voor resectie beschouwd. Bij bilaterale segm<strong>en</strong>tele ingroei geldt dat de resectabiliteit wordt<br />
bepaald door de lokale anatomie van de galweg<strong>en</strong> [Baton 2007; Van Gulik 2007].<br />
Intra- of extrahepatische metastasering is in de regel e<strong>en</strong> contra-indicatie voor resectie. Bij<br />
lymfekliermetastas<strong>en</strong> beperkt tot het lig. hepatoduod<strong>en</strong>ale (N1) is er e<strong>en</strong><br />
overlevingsvoordeel voor resectie met lymfad<strong>en</strong>ectomie van het lig. hepatoduod<strong>en</strong>ale<br />
[Kitagawa 2001; Ito 2010]. Lymfekliermetastas<strong>en</strong> langs de arteria hepatica communis<br />
<strong>en</strong>/of truncus coeliacus wordt in het algeme<strong>en</strong> als e<strong>en</strong> contra-indicatie voor resectie<br />
beschouwd.<br />
De nauwe relatie van (takk<strong>en</strong> van) de arteria hepatica <strong>en</strong> v<strong>en</strong>a portae tot het GWCa in de<br />
leverhilus maakt dat vaak sprake is van vasculaire ingroei hetge<strong>en</strong> mede de resectabiliteit<br />
van de tumor bepaalt. Bij ingroei in het gebied van de v<strong>en</strong>a portae bifurcatie, is<br />
resectabiliteit afhankelijk van de mogelijkhed<strong>en</strong> voor resectie <strong>en</strong> reconstructie van de v<strong>en</strong>a<br />
portae [Neuhaus 1999; Ebata 2003; Neuhaus 2008]. Ingroei in (takk<strong>en</strong> van) de arteria<br />
hepatica naar de toekomstige restlever is meestal e<strong>en</strong> contra-indicatie voor resectie<br />
[Miyazaki 2007; Van Gulik 2007].<br />
Bij patiënt<strong>en</strong> met GWCa die resectie van de galweg<strong>en</strong> met e<strong>en</strong> partiële leverresectie<br />
di<strong>en</strong><strong>en</strong> te ondergaan, wordt uitgegaan van e<strong>en</strong> minimaal leverrestvolume van 40% (CT<br />
volumetrie) na optimale galwegdrainage, gezi<strong>en</strong> het door (rec<strong>en</strong>te) cholestase<br />
gecompromitteerde leverpar<strong>en</strong>chym. Bij kleiner leverrestvolume kan preoperatieve<br />
embolisatie van de contralaterale v<strong>en</strong>a portae word<strong>en</strong> uitgevoerd om het leverrestvolume<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 15 van 75<br />
11 juli 2012
588<br />
589<br />
590<br />
591<br />
592<br />
593<br />
594<br />
595<br />
596<br />
597<br />
598<br />
599<br />
600<br />
601<br />
602<br />
603<br />
604<br />
605<br />
606<br />
607<br />
608<br />
609<br />
610<br />
611<br />
612<br />
613<br />
614<br />
615<br />
616<br />
617<br />
618<br />
619<br />
620<br />
621<br />
622<br />
623<br />
624<br />
625<br />
626<br />
627<br />
te vergrot<strong>en</strong> [Kawasaki 2003; Nagino 2006; Ebata 2012].<br />
Conclusies<br />
De werkgroep is van m<strong>en</strong>ing dat de resectabiliteit van het galwegcarcinoom wordt bepaald<br />
door de mate van proximale infiltratie in de segm<strong>en</strong>tele galweg<strong>en</strong> volg<strong>en</strong>s de classificatie<br />
van Bismuth-Corlette [Bismuth SGO 1975] <strong>en</strong> de lokale anatomie van de galweg<strong>en</strong> in de<br />
leverhilus.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 16 van 75<br />
11 juli 2012<br />
[Baton 2007; v Gulik 2007].<br />
De werkgroep is van m<strong>en</strong>ing dat bij aanwezigheid van metastas<strong>en</strong> op afstand er ge<strong>en</strong><br />
resectie van het galwegcarcinoom moet plaatsvind<strong>en</strong>.<br />
[Kitagawa 2001; Ito 2010]<br />
De werkgroep is van m<strong>en</strong>ing dat de resectabiliteit van het galwegcarcinoom wordt bepaald<br />
door de ingroei in (de takk<strong>en</strong> van) de arteria hepatica <strong>en</strong>/of v<strong>en</strong>a portae. Bij ingroei in de<br />
v<strong>en</strong>a portae is resectabiliteit afhankelijk van de mogelijkhed<strong>en</strong> voor resectie <strong>en</strong><br />
reconstructie van de v<strong>en</strong>a portae.<br />
[Neuhaus 1999; Ebata 2003; Neuhaus 2008]<br />
De werkgroep is van m<strong>en</strong>ing dat ingroei in (de takk<strong>en</strong> van) de arteria hepatica naar de<br />
toekomstige restlever e<strong>en</strong> contra-indicatie is voor resectie.<br />
[Miyazaki 2007]<br />
De werkgroep is van m<strong>en</strong>ing dat de resectabiliteit van het galwegcarcinoom mede wordt<br />
bepaald door het volume van de toekomstige restlever vastgesteld door middel van CTvolumetrie.<br />
Bij e<strong>en</strong> geschat leverrestvolume van
628<br />
629<br />
630<br />
Aanbeveling<strong>en</strong><br />
Er wordt geadviseerd om bij patiënt<strong>en</strong> met e<strong>en</strong> proximaal galwegcarcinoom e<strong>en</strong> chirurgische<br />
resectie alle<strong>en</strong> dan te do<strong>en</strong>, wanneer e<strong>en</strong> R0 resectie kan word<strong>en</strong> verkreg<strong>en</strong> met behoud van<br />
voldo<strong>en</strong>de restlevervolume (>40%) <strong>en</strong> met inachtneming van de lokale anatomie van de<br />
galweg<strong>en</strong> in de leverhilus.<br />
De werkgroep is van m<strong>en</strong>ing dat het galwegcarcinoom dat zowel in de v<strong>en</strong>a porta als in de<br />
arteria hepatica van de toekomstige restlever infiltreert, niet in aanmerking komt voor<br />
resectie.<br />
De werkgroep is van m<strong>en</strong>ing dat bij resectie van de galweg<strong>en</strong> met e<strong>en</strong> partiele leverresectie<br />
er > 40% volume van de lever di<strong>en</strong>t te rester<strong>en</strong>.<br />
De werkgroep is van m<strong>en</strong>ing dat bij e<strong>en</strong> te kleine leverrest (< 40%) er embolisatie plaats<br />
di<strong>en</strong>t te vind<strong>en</strong> van de contralaterale v<strong>en</strong>a portae.<br />
Er wordt geadviseerd om patiënt<strong>en</strong> met e<strong>en</strong> proximaal galwegcarcinoom én met metastas<strong>en</strong><br />
op afstand niet in aanmerking te lat<strong>en</strong> kom<strong>en</strong> voor e<strong>en</strong> curatieve resectie.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 17 van 75<br />
11 juli 2012
631<br />
632<br />
633<br />
634<br />
635<br />
636<br />
637<br />
638<br />
639<br />
640<br />
641<br />
642<br />
643<br />
644<br />
645<br />
646<br />
647<br />
648<br />
649<br />
650<br />
651<br />
652<br />
653<br />
654<br />
655<br />
656<br />
657<br />
658<br />
659<br />
660<br />
661<br />
662<br />
663<br />
664<br />
665<br />
666<br />
667<br />
668<br />
669<br />
670<br />
671<br />
672<br />
673<br />
3.2. Preoperatieve galwegdrainage<br />
Literatuurbespreking<br />
Er is discussie over de waarde van preoperatieve galwegdrainage bij patiënt<strong>en</strong> met e<strong>en</strong><br />
obstruer<strong>en</strong>de galwegtumor. Door cholestase is de functie <strong>en</strong> het reg<strong>en</strong>eratief vermog<strong>en</strong><br />
van de lever ernstig aangedaan, red<strong>en</strong> waarom wordt aanbevol<strong>en</strong> preoperatief de<br />
galweg<strong>en</strong> van in ieder geval, de toekomstige leverrest te drainer<strong>en</strong> [Nimura 2008; Gaag<br />
2009]. Onlangs is voor het distaal galwegcarcinoom aangetoond dat preoperatieve<br />
galwegdrainage ge<strong>en</strong> voordel<strong>en</strong> biedt [Gaag 2011]. Het verschil is echter dat e<strong>en</strong><br />
oncologische resectie van het distaal galwegcarcinoom bestaat uit resectie van de<br />
pancreaskop (Whipple-resectie of PPPD), terwijl resectie van het proximaal gelokaliseerde<br />
galwegcarcinoom meestal gepaard gaat met uitgebreide partiële leverresectie. De<br />
uitkomst hiervan is in hoge mate afhankelijk van postoperatieve functie <strong>en</strong> reg<strong>en</strong>eratie van<br />
de leverrest.<br />
Bij patiënt<strong>en</strong> met e<strong>en</strong> resectabel galwegcarcinoom die preoperatieve galwegdrainage<br />
onderging<strong>en</strong>, is e<strong>en</strong> voordeel geblek<strong>en</strong> van percutane, transhepatische drainage van de<br />
galweg<strong>en</strong> [Kloek 2010]. Er is echter onvoldo<strong>en</strong>de bewijs voor e<strong>en</strong> voorkeur voor<br />
percutane, transhepatische drainage van de galweg<strong>en</strong> bov<strong>en</strong> <strong>en</strong>docopische drainage<br />
(ERCP) door middel van plastic st<strong>en</strong>ts. Gezi<strong>en</strong> de complexiteit van de meestal segm<strong>en</strong>tele<br />
galwegobstructies, wordt galwegdrainage in e<strong>en</strong> c<strong>en</strong>trum met ervaring aanbevol<strong>en</strong>.<br />
Conclusies<br />
Door galwegobstructie <strong>en</strong> cholestase is de functie <strong>en</strong> het reg<strong>en</strong>eratief vermog<strong>en</strong> van de<br />
lever aangedaan. Er zijn aanwijzing<strong>en</strong> dat preoperatieve drainage van de galweg<strong>en</strong> van in<br />
ieder geval de toekomstige leverrest, e<strong>en</strong> gunstige invloed heeft op deze functies.<br />
[Kawasaki 2003; Nimura 2008]<br />
De werkgroep is van m<strong>en</strong>ing dat er onvoldo<strong>en</strong>de bewijs is voor e<strong>en</strong> voorkeur voor<br />
percutane, transhepatische drainage van de galweg<strong>en</strong> bov<strong>en</strong> <strong>en</strong>docopische drainage<br />
(ERCP) door middel van plastic st<strong>en</strong>ts. Gezi<strong>en</strong> de complexiteit van de meestal segm<strong>en</strong>tele<br />
galwegobstructies, is het w<strong>en</strong>selijk galwegdrainage in e<strong>en</strong> c<strong>en</strong>trum met ervaring uit te<br />
voer<strong>en</strong>.<br />
[Kloek 2010].<br />
Overige overweging<strong>en</strong><br />
Preoperatieve galwegdrainage kan via de percutane, transhepatische weg plaatsvind<strong>en</strong> of<br />
langs <strong>en</strong>doscopische weg (ERCP) door het inbr<strong>en</strong>g<strong>en</strong> van e<strong>en</strong> of meerdere plastic st<strong>en</strong>ts.<br />
E<strong>en</strong> voordeel van één van beide method<strong>en</strong> is vooralsnog niet aangetoond .<br />
Aanbeveling<strong>en</strong><br />
Preoperatieve galwegdrainage van in ieder geval de toekomstige leverrest is van toepassing<br />
in patiënt<strong>en</strong> met galwegcarcinoom waarbij gezi<strong>en</strong> de tumoruitbreiding (Bismuth type III/IV),<br />
resectie van de galweg<strong>en</strong> met e<strong>en</strong> partiële leverresectie (uitgebreide hemihepatectomie) is<br />
geïndiceerd. Gezi<strong>en</strong> de complexiteit van de meestal segm<strong>en</strong>tele galwegobstructies, wordt<br />
galwegdrainage in e<strong>en</strong> c<strong>en</strong>trum met expertise aanbevol<strong>en</strong>.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 18 van 75<br />
11 juli 2012
674<br />
675<br />
676<br />
677<br />
678<br />
679<br />
680<br />
681<br />
682<br />
683<br />
684<br />
685<br />
686<br />
687<br />
688<br />
689<br />
690<br />
691<br />
692<br />
693<br />
694<br />
695<br />
696<br />
697<br />
698<br />
699<br />
700<br />
701<br />
702<br />
703<br />
704<br />
705<br />
706<br />
707<br />
708<br />
709<br />
710<br />
711<br />
712<br />
713<br />
714<br />
715<br />
716<br />
717<br />
718<br />
719<br />
720<br />
3.3 Medisch technisch<br />
3.3.1. Chirurgische behandeling bij galblaascarcinoom<br />
Literatuurbespreking<br />
Bij de behandeling van het galblaascarcinoom moet onderscheid gemaakt word<strong>en</strong> tuss<strong>en</strong><br />
• pre-operatief verdacht of bewez<strong>en</strong> galblaascarcinoom (carcinom<strong>en</strong> die pre-operatief<br />
gediagnosticeerd of verondersteld word<strong>en</strong>)<br />
• per-operatief verdacht galblaascarcinoom (carcinom<strong>en</strong> die per-operatief tijd<strong>en</strong>s e<strong>en</strong><br />
electieve cholecystectomie, voor galst<strong>en</strong><strong>en</strong> of andere b<strong>en</strong>ige oorzaak, wordt vastgesteld)<br />
• incid<strong>en</strong>teel gevond<strong>en</strong> galblaascarcinoom (carcinom<strong>en</strong> die postoperatief bij toeval word<strong>en</strong><br />
vastgesteld na pathologisch onderzoek van de galblaas)<br />
Pre-operatief verdacht of bewez<strong>en</strong> galblaascarcinoom.<br />
Van alle patiënt<strong>en</strong> met e<strong>en</strong> galblaascarcinoom, is dit in 30% van de gevall<strong>en</strong> pre-operatief<br />
verdacht of bewez<strong>en</strong>. Tumor<strong>en</strong> die al pre-operatief ontdekt zijn betreff<strong>en</strong> vaak T3 <strong>en</strong> T4<br />
tumor<strong>en</strong>. Patiënt<strong>en</strong> met T3 of T4 galblaastumor<strong>en</strong> mog<strong>en</strong> ge<strong>en</strong> (poging tot)<br />
laparoscopische resectie krijg<strong>en</strong> [Lai 2008; Jin 2011]. Gallekkage tijd<strong>en</strong>s laparoscopie<br />
treedt in 15-45% van de operaties op met peritoneale disseminatie tot gevolg, hetge<strong>en</strong><br />
gepaard gaat met e<strong>en</strong> significant verminderde overleving [Hueman 2009; Isambert 2011].<br />
Derhalve moet<strong>en</strong> patiënt<strong>en</strong> met e<strong>en</strong> pre-operatief verdacht of bewez<strong>en</strong> galblaascarcinoom<br />
e<strong>en</strong> op<strong>en</strong> exploratie krijg<strong>en</strong> waarbij radicale resectie bij voorkeur mete<strong>en</strong> uitgevoerd kan<br />
word<strong>en</strong> [Lai 2008; Jin 2011].<br />
Afhankelijk van het stadium van de tumor zijn peritoneale metastas<strong>en</strong> in 30%-75%<br />
aanwezig. [Hueman 2009] Het verricht<strong>en</strong> van e<strong>en</strong> diagnostische laparoscopie met<br />
ev<strong>en</strong>tueel laparoscopische echografie van de lever alvor<strong>en</strong>s e<strong>en</strong> laparotomie te verricht<strong>en</strong><br />
kan zinvol zijn om peritoneale metastas<strong>en</strong> of additionele levertumor<strong>en</strong> op te spor<strong>en</strong><br />
[Gourgiotis 2008]. De opbr<strong>en</strong>gst van de diagnostische laparoscopie bedraagt 37-48%<br />
[Agrawal 2005; Weber 2002]. Op deze manier zou 38% onnodige laparotomieën<br />
voorkom<strong>en</strong> kunn<strong>en</strong> word<strong>en</strong> [Agrawal 2005].<br />
Tijd<strong>en</strong>s e<strong>en</strong> laparotomie of laparoscopie is het ess<strong>en</strong>tieel om tumorspil, door het op<strong>en</strong><strong>en</strong><br />
van de galblaas of door tumor te snijd<strong>en</strong>, tijd<strong>en</strong>s de operatie te voorkom<strong>en</strong> [Lai 2008].<br />
Welke chirurgische behandeling moet volg<strong>en</strong> tijd<strong>en</strong>s exploratie is afhankelijk van de<br />
uitgebreidheid in de lever, galweg<strong>en</strong> of andere omligg<strong>en</strong>de structur<strong>en</strong>. De behandeling is<br />
afhankelijk van de uitgebreidheid van de tumor <strong>en</strong> kan variër<strong>en</strong> van alle<strong>en</strong><br />
cholecystectomie tot partiële leverresectie (wigexcisie, resectie segm<strong>en</strong>t<strong>en</strong> IVb <strong>en</strong> V,<br />
(ext<strong>en</strong>ded) hemihepatectomie). Dit in combinatie met lymfklierdissectie van het<br />
ligam<strong>en</strong>tum hepatoduod<strong>en</strong>ale <strong>en</strong> ev<strong>en</strong>tueel in combinatie met extra-hepatische<br />
galwegresectie <strong>en</strong> (partiële) resectie van andere organ<strong>en</strong> zoals pancreas, duod<strong>en</strong>um <strong>en</strong><br />
colon [Gourgiotis 2008; Lai 2008]. Aangezi<strong>en</strong> alle<strong>en</strong> R0-resectie kans geeft op langetermijn<br />
overleving, moet<strong>en</strong> dergelijke resecties alle<strong>en</strong> verricht word<strong>en</strong> als R0 resectie<br />
mogelijk lijkt.<br />
Het lange-termijn voordeel van agressieve chirurgie (uitgebreide resectie in combinatie<br />
met omligg<strong>en</strong>de organ<strong>en</strong>) is niet duidelijk <strong>en</strong> controversieel, mede gezi<strong>en</strong> het feit dat<br />
dergelijke operaties gepaard gaan met hoge morbiditeit <strong>en</strong> mortaliteit [Lai 2008]. Met name<br />
in Japan is er e<strong>en</strong> tr<strong>en</strong>d naar het uitvoer<strong>en</strong> van uitgebreide gecombineerde resecties<br />
[Sasaki 2006; Shirai 1997; Araida 2004; Gourgiotis 2008]. Hierbij wordt 5-jaarsoverleving<br />
gerapporteerd van 7-87% met morbiditeits- mortaliteitsperc<strong>en</strong>tages van respectievelijk 40-<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 19 van 75<br />
11 juli 2012
721<br />
722<br />
723<br />
724<br />
725<br />
726<br />
727<br />
728<br />
729<br />
730<br />
731<br />
732<br />
733<br />
734<br />
735<br />
736<br />
737<br />
738<br />
739<br />
740<br />
741<br />
742<br />
743<br />
744<br />
745<br />
746<br />
747<br />
748<br />
749<br />
750<br />
751<br />
752<br />
753<br />
754<br />
755<br />
756<br />
757<br />
758<br />
759<br />
760<br />
761<br />
762<br />
763<br />
764<br />
765<br />
766<br />
767<br />
768<br />
769<br />
57% <strong>en</strong> 0-6%. Maar bij deze studies kan sprake zijn van publicatiebias <strong>en</strong> zeer<br />
geselecteerde patiënt<strong>en</strong>populaties [Lai 2008]. Daarnaast betroff<strong>en</strong> deze studies kleine<br />
aantall<strong>en</strong> patiënt<strong>en</strong>. Bij patiënt<strong>en</strong> met e<strong>en</strong> T3/T4 galblaascarcinoom is bij 19-25% sprake<br />
van positieve para-aortale lymfkliermetastas<strong>en</strong> [Gourgiotis 2008]. Bij dergelijke patiënt<strong>en</strong> is<br />
ge<strong>en</strong> overlevingswinst te behal<strong>en</strong> door chirurgische resectie [Kondo 2000]. Over het<br />
algeme<strong>en</strong> wordt geadviseerd om niet routinematig agressieve chirurgische behandeling<strong>en</strong>,<br />
uitgebreide leverresectie in combinatie met resectie andere organ<strong>en</strong>, uit te voer<strong>en</strong>. Het<br />
zou per individuele patiënt geëvalueerd moet<strong>en</strong> word<strong>en</strong> [Gourgiotis 2008; Lai 2008; Miller<br />
2008]. Debulking van e<strong>en</strong> galblaascarcinoom is niet zinnig <strong>en</strong> leidt niet tot overlevingswinst<br />
[Gourgiotis 2008]. Levermetastas<strong>en</strong> zijn e<strong>en</strong> contra-indicatie voor uitgebreide resectie<br />
aangezi<strong>en</strong> dit e<strong>en</strong> manifestatie is van gedissemineerde ziekte [Gourgiotis 2008].<br />
Per-operatief verdacht galblaascarcinoom.<br />
Tijd<strong>en</strong>s het uitvoer<strong>en</strong> van e<strong>en</strong> op<strong>en</strong> of laparoscopische cholecystectomie in verband met<br />
verme<strong>en</strong>d galste<strong>en</strong>lijd<strong>en</strong> of e<strong>en</strong> andere red<strong>en</strong> kan er de suspectie op e<strong>en</strong><br />
galblaascarcinoom ontstaan. Dit kan voor of tijd<strong>en</strong>s het verricht<strong>en</strong> van de<br />
cholecystectomie zijn of als de galblaas wordt geop<strong>en</strong>d nadat de cholecystectomie verricht<br />
is. In beide gevall<strong>en</strong> moet er per-operatief stadiering plaatsvind<strong>en</strong> door inspectie van het<br />
peritoneum, lever <strong>en</strong> de rest van het abdom<strong>en</strong>. Stadiering kan ook plaatsvind<strong>en</strong> door het<br />
verricht<strong>en</strong> van biopsieën wanneer er afwijking<strong>en</strong> zijn, die verdacht zijn voor metastas<strong>en</strong><br />
[Hueman 2009]. Biopsie van de galblaasafwijking of cholangiografie moet vermed<strong>en</strong><br />
word<strong>en</strong> [Hueman 2009]. Als de galblaas nog in-situ is, is het raadzaam echografie van de<br />
lever te verricht<strong>en</strong> om de uitgebreidheid van de tumor <strong>en</strong> de ev<strong>en</strong>tuele invasie hiervan in<br />
de lever vast te stell<strong>en</strong> [Hueman 2009]. Wanneer de galblaas al verwijderd is, is het<br />
raadzaam om direct vriescoupe onderzoek te verricht<strong>en</strong> om de diagnose te bevestig<strong>en</strong><br />
[Hueman 2009; Pilgrim 2009]. Vriescoupe onderzoek is geïndiceerd bij de volg<strong>en</strong>de<br />
k<strong>en</strong>merk<strong>en</strong>:<br />
• macroscopisch gecontraheerde of sclerotische mucosa,<br />
• macroscopische of palpabele verdikking<strong>en</strong> of tumor van e<strong>en</strong> deel van de galblaaswand,<br />
• bindweefsel in plaats van normaal weefsel in alle wandlag<strong>en</strong>,<br />
• macroscopische kleurverandering van de mucosa,<br />
• de aanwezigheid van polypoïde afwijking<strong>en</strong>, ulceratie of e<strong>en</strong> massa.<br />
[Pilgrim 2009; Jin 2011; Isambert 2011].<br />
Poging<strong>en</strong> om e<strong>en</strong> voor carcinoom verdachte galblaas laparoscopisch te verwijder<strong>en</strong><br />
moet<strong>en</strong> vermed<strong>en</strong> word<strong>en</strong> in verband met de verhoogde kans op gallekkage tijd<strong>en</strong>s<br />
laparoscopie [Hueman 2009; Isambert 2011]. Of na het vaststell<strong>en</strong> van het<br />
galblaascarcinoom of bij hoge suspectie hierop direct e<strong>en</strong> radicale oncologische resectie<br />
uitgevoerd moet word<strong>en</strong>, hangt af van de expertise <strong>en</strong> ervaring van de chirurg [Hueman<br />
2009]. Wanneer deze zich niet bekwaam acht, dan di<strong>en</strong>t de operatie afgebrok<strong>en</strong> te word<strong>en</strong><br />
<strong>en</strong> moet patiënt verwez<strong>en</strong> word<strong>en</strong> naar e<strong>en</strong> hepatobiliair c<strong>en</strong>trum. [Hueman 2009].<br />
Onderzoek laat zi<strong>en</strong> dat dit ge<strong>en</strong> nadelige gevolg<strong>en</strong> heeft voor de prognose van de patiënt<br />
[Ouchi 2002; Shih 2007; Fong 2000].<br />
Incid<strong>en</strong>teel gevond<strong>en</strong> galblaascarcinoom.<br />
M<strong>en</strong> spreekt van e<strong>en</strong> incid<strong>en</strong>teel gevond<strong>en</strong> galblaascarcinoom als de pathologie-uitslag na<br />
e<strong>en</strong> cholecystectomie bij toeval carcinoom laat zi<strong>en</strong>. In de meerderheid van deze gevall<strong>en</strong><br />
is cholecystectomie verricht in verband met symptomatische galst<strong>en</strong><strong>en</strong> <strong>en</strong> betreft het e<strong>en</strong><br />
carcinoom in e<strong>en</strong> relatief vroeg stadium (Tis-T2).<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 20 van 75<br />
11 juli 2012
770<br />
771<br />
772<br />
773<br />
774<br />
775<br />
776<br />
777<br />
778<br />
779<br />
780<br />
781<br />
782<br />
783<br />
784<br />
785<br />
786<br />
787<br />
788<br />
789<br />
790<br />
791<br />
792<br />
793<br />
794<br />
795<br />
796<br />
797<br />
798<br />
799<br />
800<br />
801<br />
802<br />
803<br />
804<br />
805<br />
806<br />
807<br />
808<br />
809<br />
810<br />
811<br />
812<br />
813<br />
814<br />
815<br />
816<br />
817<br />
Of aanvull<strong>en</strong>de chirurgische behandeling na e<strong>en</strong> incid<strong>en</strong>teel galblaascarcinoom<br />
noodzakelijk is, is met name afhankelijk van het T-stadium van het galblaascarcinoom <strong>en</strong><br />
daarnaast van de pathologie-uitslag van het snijvlak van de ductus cysticus. Doel is, naast<br />
het stadier<strong>en</strong> van de tumor, het verbeter<strong>en</strong> van de lange-termijn overleving. Als<br />
aanvull<strong>en</strong>de chirurgische behandeling noodzakelijk is, dan kan deze bestaan uit de<br />
volg<strong>en</strong>de behandeling<strong>en</strong> [Hueman 2009; Gourgiotis 2008; Lai 2008]:<br />
• Leverchirurgie<br />
• Lymfad<strong>en</strong>ectomie<br />
• Excisie van de trocar-insteekop<strong>en</strong>ing<strong>en</strong><br />
• Inkort<strong>en</strong> van de ductus cysticus of het verricht<strong>en</strong> van e<strong>en</strong> extra-hepatische galwegresectie<br />
Leverchirurgie<br />
Leverchirurgie wordt uitgevoerd om ev<strong>en</strong>tueel aanwezige residuele ziekte te verwijder<strong>en</strong><br />
<strong>en</strong> kan bestaan uit excisie van het galblaasbed tot uitgebreide leverresecties. Ondanks<br />
series die ge<strong>en</strong> correlatie lat<strong>en</strong> zi<strong>en</strong> tuss<strong>en</strong> de incid<strong>en</strong>tie van residuele ziekte <strong>en</strong> het T-<br />
stadium [Fuks 2011], lijkt er wel e<strong>en</strong> correlatie te bestaan waarbij de incid<strong>en</strong>tie van<br />
residuele tumor voor T1, T2, T3 <strong>en</strong> T4 carcinom<strong>en</strong> respectievelijk 0-10%, 10-61%, 36-85%<br />
<strong>en</strong> 100% is [Pawlik 2007; Duffy 2008; Lee 2011]. Hoe uitgebreid de aanvull<strong>en</strong>de<br />
leverchirurgie moet zijn is omstred<strong>en</strong> . De tr<strong>en</strong>d lijkt meer leverspar<strong>en</strong>de, non-anatomische<br />
resecties te verricht<strong>en</strong> dan uitgebreide resecties wanneer dat niet strikt noodzakelijk is<br />
[Kondo 2000; D’Angelica 2009]. Dit komt omdat majeure leverresecties tot meer<br />
morbiditeit leid<strong>en</strong> <strong>en</strong> niet noodzakelijkerwijs tot overlevingswinst [Pawlik 2007, Hueman<br />
2009].<br />
Lymfad<strong>en</strong>ectomie<br />
Lymfkliermetastas<strong>en</strong> kom<strong>en</strong> in 12% tot 45% van de patiënt<strong>en</strong> met e<strong>en</strong> incid<strong>en</strong>teel<br />
galblaascarcinoom voor [Pawlik 2007]. De incid<strong>en</strong>tie hiervan is gecorreleerd met het T-<br />
stadium [Pawlik 2007]. Aanvull<strong>en</strong>de regionale lymfad<strong>en</strong>ectomie, in de vorm van excisie<br />
van de klier<strong>en</strong> van het ligam<strong>en</strong>tum hepatoduod<strong>en</strong>ale (inclusief portale <strong>en</strong> hilaire klier<strong>en</strong>),<br />
geeft belangrijke informatie weer over het stadium van de ziekte <strong>en</strong> verlaagt mogelijk de<br />
kans op lokaal recidief van de tumor [Hueman 2009]. Radicale lymfklierdissectie door<br />
middel van excisie van de klier<strong>en</strong> rondom de truncus coeliacus, peripancreatisch,<br />
periduod<strong>en</strong>aal <strong>en</strong> rondom de arteria mes<strong>en</strong>terica superior wordt niet routinematig<br />
geadviseerd omdat dit niet leidt tot overlevingswinst [Bartlett 1996; B<strong>en</strong>oist 1998]. E<strong>en</strong><br />
dergelijke dissectie zou uitgevoerd kunn<strong>en</strong> word<strong>en</strong> ter stadiering. Bij positieve klier<strong>en</strong> zou<br />
het tot terughoud<strong>en</strong>dheid moet<strong>en</strong> leid<strong>en</strong> tot het verricht<strong>en</strong> van additionele leverchirurgie<br />
[Gourgiotis 2008].<br />
Excisie van de trocar-insteekop<strong>en</strong>ing<strong>en</strong><br />
Laparoscopische excisie van e<strong>en</strong> galblaascarcinoom zou mogelijk kunn<strong>en</strong> leid<strong>en</strong> tot e<strong>en</strong><br />
verhoogde kans op recidief tumor ter plaatse van de insteekop<strong>en</strong>ing<strong>en</strong> van de trocars<br />
[Hueman 2009]. Dit zou het gevolg zijn van de CO2-insufflatie, het zog<strong>en</strong>aamde<br />
‘schoorste<strong>en</strong>effect’ aan het einde van de laparoscopische operatie waarbij de CO2 uit de<br />
buikholte wordt gelat<strong>en</strong> én door het manoeuvrer<strong>en</strong> van laparoscopische instrum<strong>en</strong>t<strong>en</strong> door<br />
de trocar-insteekop<strong>en</strong>ing<strong>en</strong> [Hueman 2009]. De incid<strong>en</strong>tie van recidief tumor ter hoogte<br />
van de trocar-insteekop<strong>en</strong>ing<strong>en</strong> varieert van 2-14% [Fuks 2011; Pawlik 2007; Lai 2008].<br />
Na galblaasperforatie tijd<strong>en</strong>s laparoscopische resectie is tot 40% recidief tumor gemeld<br />
[Z’gragg<strong>en</strong> 1998]. Recidief tumor ter plaatse van de trocarop<strong>en</strong>ing<strong>en</strong> is e<strong>en</strong> uiting van<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 21 van 75<br />
11 juli 2012
818<br />
819<br />
820<br />
821<br />
822<br />
823<br />
824<br />
825<br />
826<br />
827<br />
828<br />
829<br />
830<br />
831<br />
832<br />
833<br />
834<br />
835<br />
836<br />
837<br />
838<br />
839<br />
840<br />
841<br />
842<br />
843<br />
844<br />
845<br />
846<br />
847<br />
848<br />
849<br />
850<br />
peritoneale disseminatie <strong>en</strong> gaat gepaard met e<strong>en</strong> slechtere overleving [Fong 2000;<br />
Ricardo 1997; Pearlstone DB 1999; Maker 2012]. Omdat het de overleving niet verbetert<br />
wordt standaard excisie van de trocar-insteekop<strong>en</strong>ing<strong>en</strong> dan ook niet aanbevol<strong>en</strong> [Maker<br />
2012].<br />
Inkort<strong>en</strong> van de ductus cysticus of het verricht<strong>en</strong> van e<strong>en</strong> extra-hepatische galwegresectie<br />
Als het snijvlak van de ductus cysticus niet vrij van tumorcell<strong>en</strong> is dan di<strong>en</strong>t aanvull<strong>en</strong>d de<br />
ductus cysticus ingekort te word<strong>en</strong> tot sprake is van e<strong>en</strong> tumor-negatief snijvlak. Indi<strong>en</strong> het<br />
snijvlak uiteindelijk positief blijft, dan moet resectie van de extra-hepatische galweg<br />
verricht word<strong>en</strong>. De incid<strong>en</strong>tie van e<strong>en</strong> positief snijvlak van de ductus cysticus kan 20%<br />
bedrag<strong>en</strong> [Pawlik 2007]. Bij deze patiënt<strong>en</strong> blijkt tot circa 40% sprake van carcinoom in<br />
de ductus choledochus [Pawlik 2007]. Het routinematig verricht<strong>en</strong> van e<strong>en</strong> extrahepatische<br />
galwegresectie verbetert de overleving niet, levert niet meer lymfklier<strong>en</strong> op <strong>en</strong><br />
leidt tot meer morbiditeit in vergelijking tot het niet-verricht<strong>en</strong> van e<strong>en</strong> extra-hepatische<br />
galwegresectie [D’Angelica 2009; Pawlik 2009].<br />
Tis <strong>en</strong> T1a galblaascarcinoom (zie figuur 1)<br />
Na cholecystectomie van het Tis <strong>en</strong> T1a galblaascarcinoom bestaat wereldwijd cons<strong>en</strong>sus<br />
dat dit ge<strong>en</strong> additionele behandeling behoeft [Hueman 2009; Gourgiotis 2008; Pilgrim<br />
2009; Lee 2011]. In e<strong>en</strong> review bleek de incid<strong>en</strong>tie op lymfkliermetastas<strong>en</strong> 1.8% <strong>en</strong> trad<br />
recidief galblaascarcinoom in 1.1% van de patiënt<strong>en</strong> op [Lee 2011]. De 5-jaarsoverleving<br />
is meer dan 90% na alle<strong>en</strong> cholecystectomie [Jin 2011; Lai 2008]. Retrospectieve analyse<br />
van de SEER-database liet e<strong>en</strong> mediane overleving van 156 maand<strong>en</strong> na Tis<br />
galblaascarcinoom <strong>en</strong> van 93 maand<strong>en</strong> na T1a carcinoom zi<strong>en</strong> [Downing 2011]. De<br />
overleving van deze patiënt<strong>en</strong> werd niet beïnvloed door uitgebreidere resecties dan alle<strong>en</strong><br />
cholecystectomie, lymfad<strong>en</strong>ectomie of door excisie van de trocar-insteekop<strong>en</strong>ing<strong>en</strong><br />
[Downing 2011; Pilgrim 2009].<br />
Figuur 1. Anatomische weergave van sagittale doorsnede van de galblaas <strong>en</strong> lever (L)<br />
waarin aangegev<strong>en</strong> de verschill<strong>en</strong>de lag<strong>en</strong> van de galblaas<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 22 van 75<br />
11 juli 2012
851<br />
852<br />
853<br />
854<br />
855<br />
856<br />
857<br />
858<br />
859<br />
860<br />
861<br />
862<br />
863<br />
864<br />
865<br />
866<br />
867<br />
868<br />
869<br />
870<br />
871<br />
872<br />
873<br />
874<br />
875<br />
876<br />
877<br />
878<br />
879<br />
880<br />
881<br />
882<br />
883<br />
884<br />
885<br />
886<br />
887<br />
888<br />
889<br />
890<br />
891<br />
892<br />
893<br />
894<br />
895<br />
896<br />
897<br />
898<br />
T1b galblaascarcinoom<br />
Of patiënt<strong>en</strong> met e<strong>en</strong> T1b galblaascarcinoom aanvull<strong>en</strong>de chirurgie moet<strong>en</strong> krijg<strong>en</strong> is<br />
controversieel in de literatuur [Hueman 200; Lee 2011; Jin 2011]. E<strong>en</strong> aantal<br />
retrospectieve studies lat<strong>en</strong> 5-jaars overlevingsperc<strong>en</strong>tages van 95-100% zi<strong>en</strong> na alle<strong>en</strong><br />
cholecystectomie [Sun 2005; Shirai 1992]. Patiënt<strong>en</strong> in de SEER-database, van wie de<br />
overleving niet werd beïnvloed door uitgebreidere resecties of lymfad<strong>en</strong>ectomie, hadd<strong>en</strong><br />
e<strong>en</strong> mediane overleving van 33 maand<strong>en</strong> [Downing 2011]. Ander<strong>en</strong> m<strong>en</strong><strong>en</strong> dat<br />
aanvull<strong>en</strong>de chirurgie noodzakelijk is in verband met de kans op locoregionale recidiev<strong>en</strong><br />
<strong>en</strong> de aanwezigheid lymfkliermetastas<strong>en</strong> na alle<strong>en</strong> cholecystectomie. Lymfkliermetastas<strong>en</strong><br />
tot 20%, residuele tumor tot 10% <strong>en</strong> recidief galblaascarcinoom tot 60% is gerapporteerd<br />
[Lee 2011; Hueman 2009; Pilgrim 2009; Pawlik 2007]. De 5-jaarsoverleving na T1b<br />
galblaascarcinoom varieert van 37.5%-100%, waarbij overleving minder dan 50% vaak<br />
patiënt<strong>en</strong> betreft die <strong>en</strong>kel cholecystectomie onderging<strong>en</strong> [Lee 2011; Goetze 2010; Fuks<br />
2011].<br />
T2 galblaascarcinoom<br />
De meerderheid (tot 67%) van de bij toeval gevond<strong>en</strong> galblaascarcinom<strong>en</strong> betreff<strong>en</strong> T2<br />
tumor<strong>en</strong> [Hueman 2009]. Studies hebb<strong>en</strong>, bij deze pati<strong>en</strong>t<strong>en</strong> met aanvull<strong>en</strong>de chirurgie,<br />
residuele ziekte lat<strong>en</strong> zi<strong>en</strong> tot 61% <strong>en</strong> lymfkliermetatas<strong>en</strong> tot 62% [Pawlik 2007; Duffy<br />
2008; Hueman 2009; Gourgiotis 2008; Goetze 2011]. Na alle<strong>en</strong> cholecystectomie zijn tot<br />
40% locoregionale recidiev<strong>en</strong> beschrev<strong>en</strong> [Hueman 2009]. Meerdere retrospectieve<br />
studies lat<strong>en</strong> zi<strong>en</strong> dat er e<strong>en</strong> overlevingsvoordeel te behal<strong>en</strong> valt met aanvull<strong>en</strong>de<br />
chirurgie. De mediane overleving van patiënt<strong>en</strong> in de SEER-database was 17 maand<strong>en</strong><br />
[Downing 2011]. De overleving van patiënt<strong>en</strong> die aanvull<strong>en</strong>de resectie <strong>en</strong><br />
lymfad<strong>en</strong>ectomie kreg<strong>en</strong> was significant beter dan patiënt<strong>en</strong> die dat niet kreg<strong>en</strong>. De 5-<br />
jaarsoverleving van patiënt<strong>en</strong> die aanvull<strong>en</strong>de chirurgie krijgt varieert van 52 tot 80% <strong>en</strong> is<br />
significant beter dan van patiënt<strong>en</strong> na alle<strong>en</strong> cholecystectomie (0-41%) [Fuks 2011;<br />
Goetze 2011; Hueman 2009]. Er is ge<strong>en</strong> verschil in overleving tuss<strong>en</strong> patiënt<strong>en</strong> die e<strong>en</strong><br />
galblaasbedresectie kreg<strong>en</strong> <strong>en</strong> e<strong>en</strong> resectie van segm<strong>en</strong>t<strong>en</strong> IVb <strong>en</strong> V [Fuks 2011].<br />
T3 <strong>en</strong> T4 galblaascarcinoom<br />
T3 <strong>en</strong> T4 tumor<strong>en</strong> zoud<strong>en</strong> pre-operatief vastgesteld moet<strong>en</strong> word<strong>en</strong> [Pilgrim 2009].<br />
Dergelijke tumor<strong>en</strong> groei<strong>en</strong> de lever <strong>en</strong>/of andere organ<strong>en</strong> in <strong>en</strong> vereis<strong>en</strong> daardoor<br />
uitgebreidere resecties [Goetze 2010]. De lange-termijn overleving na resectie van T3<br />
tumor<strong>en</strong> door middel van cholecystectomie is laag (0-15%) [Hueman 2009; Goetze 2010;<br />
Goetze 2011; Fuks 2011]. Bij patiënt<strong>en</strong> na e<strong>en</strong> T3 carcinoom is het perc<strong>en</strong>tage residuele<br />
ziekte na cholecystectomie 36-85% <strong>en</strong> lymfkliermetastas<strong>en</strong> 38-46% [Pawlik 2007; Duffy<br />
2008; Goetze 2011]. In geval van T4 carcinoom ligg<strong>en</strong> deze perc<strong>en</strong>tages tot<br />
respectievelijk 100% <strong>en</strong> 80% [Duffy 2008].<br />
Na aanvull<strong>en</strong>de resectie, leverresectie al of niet in combinatie met andere organ<strong>en</strong>, blijkt<br />
de 5-jaarsoverleving te variër<strong>en</strong> tuss<strong>en</strong> 15% <strong>en</strong> 65% in geselecteerde patiënt<strong>en</strong>groep<strong>en</strong><br />
na T3 carcinoom <strong>en</strong> 7-25% na T4 carcinoom [Hueman 2009; Goetze 2010; Goetze 2011;<br />
Fuks 2011; Gourgiotis 2008]. Agressieve chirurgie met uitgebreide resecties wordt niet<br />
standaard aanbevol<strong>en</strong> <strong>en</strong> zou voor iedere patiënt individueel bekek<strong>en</strong> moet<strong>en</strong> word<strong>en</strong><br />
[Pilgrim 2009].<br />
Conclusies<br />
Pre-operatief verdacht of bewez<strong>en</strong> galblaascarcinoom<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 23 van 75<br />
11 juli 2012
899<br />
900<br />
901<br />
902<br />
903<br />
904<br />
905<br />
906<br />
907<br />
908<br />
909<br />
910<br />
911<br />
912<br />
913<br />
914<br />
915<br />
916<br />
917<br />
918<br />
919<br />
920<br />
921<br />
922<br />
923<br />
924<br />
925<br />
926<br />
927<br />
928<br />
929<br />
930<br />
931<br />
932<br />
933<br />
934<br />
935<br />
936<br />
937<br />
938<br />
939<br />
940<br />
941<br />
942<br />
943<br />
944<br />
945<br />
946<br />
Het is aannemelijk dat (e<strong>en</strong> poging tot) e<strong>en</strong> laparoscopische resectie van e<strong>en</strong><br />
galblaascarcinoom gepaard gaat met e<strong>en</strong> slechtere overleving in vergelijking met e<strong>en</strong><br />
op<strong>en</strong> resectie.<br />
[Hueman 2009; Isambert 2011; Lai 2008; Jin 2011]<br />
Het is aannemelijk dat laparoscopie gebruikt kan word<strong>en</strong> ter stadiering van het<br />
galblaascarcinoom <strong>en</strong> daarmee tot 38% van de laparotomieën voorkom<strong>en</strong> kan word<strong>en</strong>.<br />
[Gourgiotis 2008; Agrawal 2005; Weber 2002]<br />
Per-operatief verdacht galblaascarcinoom<br />
M<strong>en</strong> kan bij het peroperatief vaststell<strong>en</strong> of verd<strong>en</strong>king op e<strong>en</strong> galblaascarcinoom direct<br />
e<strong>en</strong> radicale oncologische resectie uitvoer<strong>en</strong> of de operatie afbrek<strong>en</strong> <strong>en</strong> de patiënt<br />
verwijz<strong>en</strong> naar e<strong>en</strong> hepatobiliair c<strong>en</strong>trum.<br />
[Hueman 2009; Ouchi 2002; Shih 2007; Fong 2000]<br />
Incid<strong>en</strong>teel gevond<strong>en</strong> galblaascarcinoom<br />
M<strong>en</strong> zou na e<strong>en</strong> postoperatief, incid<strong>en</strong>teel gevond<strong>en</strong> galblaascarcinoom de aanvull<strong>en</strong>de<br />
chirurgie moet<strong>en</strong> lat<strong>en</strong> afhang<strong>en</strong> van het T-stadium <strong>en</strong> het snijvlak van de ductus cysticus.<br />
[Hueman 2009; Gourgiotis 2008; Lai 2008]<br />
Tis <strong>en</strong> T1a galblaascarcinoom<br />
Het is aannemelijk dat aanvull<strong>en</strong>de chirurgische behandeling van het incid<strong>en</strong>teel<br />
gevond<strong>en</strong> Tis <strong>en</strong> T1a galblaascarcinoom ge<strong>en</strong> overlevingswinst oplevert.<br />
[Hueman 2009; Gourgiotis 2008; Pilgrim 2009; Lee 2011]<br />
T1b galblaascarcinoom<br />
De werkgroep is van m<strong>en</strong>ing dat er ge<strong>en</strong> cons<strong>en</strong>sus bestaat over overlevingsvoordeel van<br />
aanvull<strong>en</strong>de chirurgische behandeling van het incid<strong>en</strong>teel gevond<strong>en</strong> T1b<br />
galblaascarcinoom..<br />
[Hueman 2009; Lee 2011; Jin 2011]<br />
T2 galblaascarcinoom<br />
Het is aannemelijk dat aanvull<strong>en</strong>de chirurgische behandeling van het T2<br />
galblaascarcinoom overlevingsvoordeel oplevert.<br />
[Fuks 2011; Goetze 2011; Hueman 2009]<br />
T3 <strong>en</strong> T4 galblaascarcinoom<br />
Het is aannemelijk dat chirurgische behandeling van het T3 <strong>en</strong> T4 galblaascarcinoom bij<br />
geselecteerde patiënt<strong>en</strong> e<strong>en</strong> overlevingsvoordeel biedt hoewel er verschil van m<strong>en</strong>ing<br />
hierover bestaat.<br />
[Hueman 2009; Goetze 2010; Goetze 2011; Fuks 2011; Gourgiotis 2008]<br />
Overige overweging<strong>en</strong><br />
Aanvull<strong>en</strong>de chirurgische behandeling na eerdere (laparoscopische) resectie van e<strong>en</strong><br />
galblaascarcinoom bestaat uit:<br />
• leverresectie,<br />
• resectie van het galblaasbed (segm<strong>en</strong>t IV <strong>en</strong> V)<br />
• regionale lymfad<strong>en</strong>ectomie <strong>en</strong><br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 24 van 75<br />
11 juli 2012
947<br />
948<br />
949<br />
950<br />
951<br />
952<br />
953<br />
954<br />
955<br />
• inkort<strong>en</strong> van de ductus cysticus<br />
of<br />
• het verricht<strong>en</strong> van e<strong>en</strong> extra-hepatische galwegresectie indi<strong>en</strong> de stomp van de ductus<br />
cysticus tumorpositief is [Hueman 2009; Gourgiotis 2008; Lai 2008].<br />
Omdat standaard excisie van trocarinsteekop<strong>en</strong>ing<strong>en</strong> ge<strong>en</strong> overlevingsvoordeel oplevert<br />
wordt dit niet meer aanbevol<strong>en</strong> [Maker 2012].<br />
Aanbeveling<strong>en</strong><br />
Er wordt geadviseerd bij e<strong>en</strong> bewez<strong>en</strong> galblaascarcinoom of de verd<strong>en</strong>king hierop<br />
laparoscopische stadiering te verricht<strong>en</strong> om onnodige laparotomie te voorkom<strong>en</strong>.<br />
Er wordt geadviseerd om bij e<strong>en</strong> bewez<strong>en</strong> galblaascarcinoom of de verd<strong>en</strong>king hierop poging tot<br />
laparoscopische resectie te vermijd<strong>en</strong>.<br />
Er wordt geadviseerd om bij e<strong>en</strong> peroperatief vastgesteld galblaascarcinoom, of indi<strong>en</strong><br />
peroperatief de verd<strong>en</strong>king hierop ontstaat, direct e<strong>en</strong> radicale oncologische resectie uit te<br />
voer<strong>en</strong> of de operatie af te brek<strong>en</strong> <strong>en</strong> patiënt te verwijz<strong>en</strong> naar e<strong>en</strong> hepatobiliair c<strong>en</strong>trum.<br />
Er wordt geadviseerd om na het incid<strong>en</strong>teel gevond<strong>en</strong> Tis <strong>en</strong> T1a galblaascarcinoom ge<strong>en</strong><br />
additionele chirurgische behandeling uit te voer<strong>en</strong>.<br />
Er wordt geadviseerd om na het incid<strong>en</strong>teel gevond<strong>en</strong> T1b galblaascarcinoom de pati<strong>en</strong>t<br />
additioneel chirurgisch te behandel<strong>en</strong>.<br />
Er wordt geadviseerd om het T2 galblaascarcinoom additioneel chirurgisch te behandel<strong>en</strong>.<br />
Er wordt geadviseerd om in geval van e<strong>en</strong> T3 of T4 galblaascarcinoom per patiënt te<br />
evaluer<strong>en</strong> of chirurgische resectie zinvol is.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 25 van 75<br />
11 juli 2012
956<br />
957<br />
958<br />
959<br />
960<br />
961<br />
962<br />
963<br />
964<br />
965<br />
966<br />
967<br />
968<br />
969<br />
970<br />
971<br />
972<br />
973<br />
974<br />
975<br />
976<br />
977<br />
978<br />
979<br />
980<br />
981<br />
982<br />
983<br />
984<br />
985<br />
986<br />
987<br />
988<br />
989<br />
990<br />
991<br />
992<br />
993<br />
994<br />
995<br />
996<br />
997<br />
998<br />
999<br />
3.3.2. Chirurgische behandeling bij galwegcarcinoom<br />
Literatuurbespreking<br />
De chirurgische behandeling van het GWCa heeft in de laatste twintig jaar e<strong>en</strong> belangrijke<br />
ontwikkeling doorgemaakt. Japanse chirurg<strong>en</strong> hebb<strong>en</strong> in de jar<strong>en</strong> 1990 aangetoond dat<br />
uitgebreide resecties van de leverhilus in combinatie met partiële leverresectie tot e<strong>en</strong><br />
groter aantal curatieve (R0) resecties leid<strong>en</strong> [Kosuge 1999; Seyama 2003]. Op grond van<br />
deze ervaring<strong>en</strong> werd in de Westerse wereld overgegaan van overweg<strong>en</strong>d lokale<br />
galwegresecties voor GWCa, naar uitgebreidere resecties met partiële leverresectie<br />
[Neuhaus 1999; Jarnagin 2001; Van Gulik 2011].<br />
Resectie van het galwegcarcinoom (GWCa) heeft tot doel e<strong>en</strong> R0 resectie te verkrijg<strong>en</strong>.<br />
De uitgebreidheid van de resectie wordt bepaald door de mate van proximale infiltratie in<br />
de segm<strong>en</strong>tele galweg<strong>en</strong> volg<strong>en</strong>s de classificatie van Bismuth-Corlette (zie classificatie<br />
Bismuth Corlette, hoofdstuk 12) [Bismuth 1975]. Bij beperkte proximale infiltratie (Bismuth<br />
type I/II) kan in de meeste gevall<strong>en</strong> word<strong>en</strong> volstaan met e<strong>en</strong> lokale resectie van de<br />
galweghilus in combinatie e<strong>en</strong> volledige lymfad<strong>en</strong>ectomie van het ligam<strong>en</strong>tum<br />
hepatoduod<strong>en</strong>ale [Ikeyama 2007]. Bij uitgebreidere tumor<strong>en</strong> (Bismuth type III/IV) bestaat<br />
de operatietechniek uit resectie van de leverhilus <strong>en</strong> extrahepatische galweg<strong>en</strong> <strong>en</strong> bloc<br />
met (uitgebreide) hemihepatectomie <strong>en</strong> me<strong>en</strong>em<strong>en</strong> van segm<strong>en</strong>t 1 (lobus caudatus) <strong>en</strong><br />
segm<strong>en</strong>t 4 [ Dinant 2005; Baton 2007; Van Gulik 2011]. Hierbij wordt e<strong>en</strong> volledige<br />
lymfad<strong>en</strong>ectomie van het ligam<strong>en</strong>tum hepatoduod<strong>en</strong>ale uitgevoerd [Kitagawa 2001; Ito<br />
2010] <strong>en</strong> wordt bij infiltratie van (takk<strong>en</strong> van) de v<strong>en</strong>a portae, de bifurcatie van de v<strong>en</strong>a<br />
portae mee gereseceerd <strong>en</strong> e<strong>en</strong> vaatreconstructie verricht [Ebata 2003; Miyazaki 2007;<br />
Neuhaus 2008]. Tijd<strong>en</strong>s de resectie word<strong>en</strong> de snijrand<strong>en</strong> van de galweg<strong>en</strong> proximaal <strong>en</strong><br />
distaal (ductus choledochus) door middel van vriescoupeonderzoek gecontroleerd op<br />
tumorcell<strong>en</strong> [Wakai 2005].<br />
De proximale stomp van de ductus hepaticus c.q. de segm<strong>en</strong>tele galweg<strong>en</strong> van de<br />
leverrest word<strong>en</strong> aangeslot<strong>en</strong> op e<strong>en</strong> Roux-Y jejunumlis [vGulik 2011].<br />
Conclusies<br />
Bij beperkte proximale infiltratie (Bismuth type I/II) kan in de regel word<strong>en</strong> volstaan met<br />
e<strong>en</strong> lokale resectie van de galweghilus.<br />
[Ikeyama 2007; vGulik 2011]<br />
Bij tumor<strong>en</strong> met proximale ingroei in de segm<strong>en</strong>tele galweg<strong>en</strong> (Bismuth type III/IV) bestaat<br />
de operatietechniek uit resectie van de leverhilus <strong>en</strong> extrahepatische galweg<strong>en</strong> <strong>en</strong> bloc<br />
met (uitgebreide) hemihepatectomie <strong>en</strong> me<strong>en</strong>em<strong>en</strong> van segm<strong>en</strong>t 1 (lobus caudatus) <strong>en</strong><br />
segm<strong>en</strong>t 4.<br />
[Dinant 2005; Baton 2007; Van Gulik 2011]<br />
De werkgroep is van m<strong>en</strong>ing dat bij infiltratie van (takk<strong>en</strong> van) de v<strong>en</strong>a portae, de<br />
bifurcatie van de v<strong>en</strong>a portae mee gereseceerd kan word<strong>en</strong> <strong>en</strong> e<strong>en</strong> vaatreconstructie kan<br />
word<strong>en</strong> verricht.<br />
[Ebata 2003; Miyazaki 2007; Neuhaus 2008]<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 26 van 75<br />
11 juli 2012
1000<br />
1001<br />
1002<br />
1003<br />
1004<br />
1005<br />
1006<br />
1007<br />
1008<br />
1009<br />
1010<br />
1011<br />
1012<br />
1013<br />
1014<br />
1015<br />
1016<br />
1017<br />
1018<br />
1019<br />
1020<br />
1021<br />
1022<br />
1023<br />
1024<br />
1025<br />
1026<br />
1027<br />
1028<br />
1029<br />
1030<br />
1031<br />
De werkgroep is van m<strong>en</strong>ing dat er in alle gevall<strong>en</strong> e<strong>en</strong> combinatie van e<strong>en</strong> resectie met<br />
e<strong>en</strong> volledige lymfad<strong>en</strong>ectomie van het ligam<strong>en</strong>tum hepatoduod<strong>en</strong>ale plaats kan vind<strong>en</strong>.<br />
[Kitagawa 2001, Ito 2010]<br />
Tijd<strong>en</strong>s de resectie wordt gestreefd naar e<strong>en</strong> R0 resectie waarbij de snijrand<strong>en</strong> van de<br />
galweg<strong>en</strong> proximaal <strong>en</strong> distaal (ductus choledochus) door middel van<br />
vriescoupeonderzoek word<strong>en</strong> gecontroleerd op tumorcell<strong>en</strong>.<br />
[Wakai 2005]<br />
Herstel van de continuïteit van de galweg<strong>en</strong> wordt bereikt door aansluit<strong>en</strong> van de<br />
proximale stomp van de ductus hepaticus c.q. de segm<strong>en</strong>tele galweg<strong>en</strong> van de leverrest<br />
op e<strong>en</strong> Roux-Y jejunumlis.<br />
[Van Gulik 2011]<br />
Overige overweging<strong>en</strong><br />
De chirurgische b<strong>en</strong>adering van het proximaal galwegcarcinoom (GWCa) gaat uit van e<strong>en</strong><br />
drie-dim<strong>en</strong>sionale perceptie van het leverhilusgebied. Hierbij breidt het GWCa zich vanuit<br />
de galwegconflu<strong>en</strong>s niet alle<strong>en</strong> langs de naar links <strong>en</strong> rechts verlop<strong>en</strong>de galweg<strong>en</strong>, maar<br />
ook naar vor<strong>en</strong> in de galweg<strong>en</strong> van segm<strong>en</strong>t 4, <strong>en</strong> naar achter<strong>en</strong> in de galweg<strong>en</strong> van<br />
segm<strong>en</strong>t 1. Van belang is dat met rechter of linker hemihepatectomie, ook de voorachterwaartse<br />
“as” in de zin van segm<strong>en</strong>t 4 <strong>en</strong> 1 in de resectie wordt betrokk<strong>en</strong>.<br />
Met name bij Bismuth type III/IV tumor<strong>en</strong> waarbij uitgebreide leverresecties word<strong>en</strong><br />
verricht, is postoperatieve morbiditeit <strong>en</strong> mortaliteit aanzi<strong>en</strong>lijk. In de meeste series in de<br />
literatuur wordt e<strong>en</strong> ziek<strong>en</strong>huis-mortaliteit van 5-10% vermeld [Ito 2009]. De belangrijkste<br />
oorzaak van de mortaliteit is postoperatief leverfal<strong>en</strong>.<br />
De belangrijkste factor<strong>en</strong> om postoperatief leverval<strong>en</strong> te voorkom<strong>en</strong> zijn:<br />
• goede inschatting van de restleverfunctie<br />
• pre-operatieve voorbereiding in de zin van optimale galwegdrainage<br />
• ev<strong>en</strong>tueel pre-operatieve embolisatie van de v<strong>en</strong>a portae<br />
Aanbeveling<strong>en</strong><br />
De werkgroep is van m<strong>en</strong>ing dat bij patiënt<strong>en</strong> met galwegcarcinoom Bismuth type I/II in de<br />
regel kan word<strong>en</strong> volstaan met lokale resectie van de galweghilus.<br />
Bij tumor<strong>en</strong> met proximale ingroei in de segm<strong>en</strong>tele galweg<strong>en</strong> (Bismuth type III/IV) bestaat de<br />
operatietechniek uit resectie van de leverhilus <strong>en</strong> extrahepatische galweg<strong>en</strong> <strong>en</strong> bloc met<br />
(uitgebreide) hemihepatectomie <strong>en</strong> me<strong>en</strong>em<strong>en</strong> van segm<strong>en</strong>t 1 (lobus caudatus) <strong>en</strong> segm<strong>en</strong>t<br />
4.<br />
De werkgroep is van m<strong>en</strong>ing dat bij infiltratie van (de takk<strong>en</strong> van) de v<strong>en</strong>a portae, de<br />
bifurcatie van de v<strong>en</strong>a portae ook gereseceerd di<strong>en</strong>t te word<strong>en</strong> in combinatie met e<strong>en</strong><br />
vaatreconstructie.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 27 van 75<br />
11 juli 2012
1032<br />
1033<br />
1034<br />
1035<br />
1036<br />
1037<br />
1038<br />
1039<br />
1040<br />
1041<br />
1042<br />
1043<br />
1044<br />
1045<br />
1046<br />
1047<br />
1048<br />
1049<br />
1050<br />
1051<br />
1052<br />
1053<br />
1054<br />
1055<br />
1056<br />
1057<br />
1058<br />
1059<br />
1060<br />
1061<br />
1062<br />
1063<br />
1064<br />
1065<br />
1066<br />
1067<br />
1068<br />
De werkgroep is van m<strong>en</strong>ing dat in alle gevall<strong>en</strong> resectie gecombineerd di<strong>en</strong>t te word<strong>en</strong> met<br />
e<strong>en</strong> volledige lymfad<strong>en</strong>ectomie van het ligam<strong>en</strong>tum hepatoduod<strong>en</strong>ale.<br />
Tijd<strong>en</strong>s de resectie wordt gestreefd naar e<strong>en</strong> R0 resectie. Dit kan word<strong>en</strong> bereikt door met<br />
behulp van vriescoupeonderzoek de proximale <strong>en</strong> distale snijrand<strong>en</strong> van de galweg<strong>en</strong> te<br />
controler<strong>en</strong>.<br />
Herstel van de continuïteit van de galweg<strong>en</strong> wordt bereikt door aansluit<strong>en</strong> van de proximale<br />
stomp van de ductushepaticus c.q. de segm<strong>en</strong>tele galweg<strong>en</strong> van de leverrest op e<strong>en</strong> Roux-Y<br />
jejunumlis (hepaticojejunostomie).<br />
3.3.3. Levertransplantatie voor proximaal gelokaliseerd galwegcarcinoom<br />
Literatuurbespreking<br />
Tot voor kort was het proximaal gelokaliseerd galwegcarcinoom e<strong>en</strong> absolute contraindicatie<br />
voor levertransplantatie. Rec<strong>en</strong>t zijn bij geselecteerde groep<strong>en</strong> patiënt<strong>en</strong>, na zeer<br />
int<strong>en</strong>sieve behandeling met chemoradiotherapie, 5-jaars overlevingsperc<strong>en</strong>tages tot 73%<br />
gerapporteerd [Ros<strong>en</strong> 2010; Sudan 2002]. Andere studies, met ev<strong>en</strong>e<strong>en</strong>s str<strong>en</strong>ge<br />
selectiecriteria maar zonder int<strong>en</strong>sieve neo-adjuvante behandeling, hebb<strong>en</strong> 5-<br />
jaarsoverleving tot 58% lat<strong>en</strong> zi<strong>en</strong> [Friman 2011; Robles 2004]. Deze resultat<strong>en</strong> hebb<strong>en</strong> in<br />
Nederland geleid tot de ontwikkeling van het protocol ‘Indicatiestelling <strong>en</strong> selectie voor<br />
levertransplantatie bij patiënt<strong>en</strong> met perihilair galwegcarcinoom’ door het Landelijk Overleg<br />
Levertransplantatie (LOL). Het LOL is te raadpleg<strong>en</strong> via de Nederlandse Transplantatie<br />
Ver<strong>en</strong>iging (NTV) of via e<strong>en</strong> van de drie levertransplantatiec<strong>en</strong>tra in Nederland. Volg<strong>en</strong>s<br />
het protocol kunn<strong>en</strong> str<strong>en</strong>g geselecteerde patiënt<strong>en</strong> met e<strong>en</strong> proximaal gelokaliseerd<br />
galwegcarcinoom in aanmerking kom<strong>en</strong> voor e<strong>en</strong> levertransplantatie zonder neoadjuvante<br />
therapie. De belangrijkste selectiecriteria zijn:<br />
- Chirurgische resectie van het proximaal gelokaliseerd galwegcarcinoom is anatomisch of<br />
functioneel niet mogelijk<br />
- Ge<strong>en</strong> eerdere percutane tumorbiopsie, percutane galwegdrainage <strong>en</strong>/of chirurgische<br />
exploratie van de galweg<strong>en</strong> waarbij contact is geweest met het tumorgebied<br />
- Ge<strong>en</strong> tumor groter dan 3 cm zichtbaar op CT of MRI <strong>en</strong> ge<strong>en</strong> aanwijzing<strong>en</strong> voor doorgroei<br />
van tumor in de distale galweg in de pancreaskop<br />
- Ge<strong>en</strong> aanwijzing<strong>en</strong> voor peritoneaal-, lymfklier- <strong>en</strong>/of ander metastase<br />
Conclusie<br />
Er zijn aanwijzing<strong>en</strong> dat bij e<strong>en</strong> zeer geselecteerde groep patiënt<strong>en</strong> (zie<br />
literatuurbespreking) met e<strong>en</strong> proximaal gelokaliseerd galwegcarcinoom<br />
levertransplantatie zinvol is.<br />
[Friman 2011; Robles 2004]<br />
Overige overweging<strong>en</strong><br />
Levertransplantatie voor GWca is e<strong>en</strong> experim<strong>en</strong>tele behandeling, waar e<strong>en</strong><br />
geselecteerde groep patiënt<strong>en</strong> voor in aanmerking komt.<br />
Aanbeveling<strong>en</strong><br />
De werkgroep adviseert om contact op te nem<strong>en</strong> met e<strong>en</strong> van de drie<br />
levertransplantatiec<strong>en</strong>tra indi<strong>en</strong> e<strong>en</strong> patiënt met e<strong>en</strong> proximaal gelokaliseerd<br />
galwegcarcinoom mogelijk in aanmerking komt voor levertransplantatie.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 28 van 75<br />
11 juli 2012
1069<br />
1070<br />
1071<br />
1072<br />
1073<br />
1074<br />
1075<br />
1076<br />
1077<br />
1078<br />
1079<br />
1080<br />
1081<br />
1082<br />
1083<br />
1084<br />
1085<br />
1086<br />
1087<br />
1088<br />
1089<br />
1090<br />
1091<br />
1092<br />
1093<br />
1094<br />
1095<br />
1096<br />
1097<br />
1098<br />
1099<br />
1100<br />
1101<br />
1102<br />
1103<br />
1104<br />
1105<br />
1106<br />
1107<br />
1108<br />
1109<br />
1110<br />
1111<br />
1112<br />
1113<br />
1114<br />
1115<br />
1116<br />
1117<br />
1118<br />
3.4 Adjuvante behandeling<br />
3.4.1 Adjuvante radiotherapie <strong>en</strong>/of chemotherapie voor galwegcarcinoom<br />
Inleiding<br />
Aangezi<strong>en</strong> galblaas <strong>en</strong> galwegcarcinom<strong>en</strong> zeer zeldzaam zijn is het uitvoer<strong>en</strong> van<br />
gerandomiseerde trials e<strong>en</strong> uitermate moeilijke zaak. Aan de hand van de beperkte<br />
literatuur wordt hieronder geschetst wat de mogelijke rol van radiotherapie, chemotherapie<br />
of de combinatie daarvan kan zijn.<br />
Literatuurbeschrijving<br />
Radiotherapie<br />
In het Academisch Medisch C<strong>en</strong>trum is in de jar<strong>en</strong> ‘80 <strong>en</strong> '90 langdurig adjuvante<br />
radiotherapie gegev<strong>en</strong> rond resectie van e<strong>en</strong> hilair galwegcarcinoom [González González<br />
1999]. E<strong>en</strong> tijdlang is gepoogd e<strong>en</strong> gerandomiseerde trial te do<strong>en</strong>, maar na 6 jaar is die<br />
weg<strong>en</strong>s gebrek aan deelnem<strong>en</strong>de pati<strong>en</strong>t<strong>en</strong> geslot<strong>en</strong>. In e<strong>en</strong> cohort van 112 patiënt<strong>en</strong><br />
blek<strong>en</strong> deg<strong>en</strong><strong>en</strong> die wel radiotherapie hadd<strong>en</strong> gehad e<strong>en</strong> betere mediane overleving te<br />
hebb<strong>en</strong> (24 maand<strong>en</strong>) dan deg<strong>en</strong><strong>en</strong> die alle<strong>en</strong> e<strong>en</strong> resectie hadd<strong>en</strong> gehad (8 maand<strong>en</strong>)<br />
[Gerhards 2003]. Opvall<strong>en</strong>d was dat <strong>en</strong>tmetastas<strong>en</strong> in laparoscopie- of<br />
laparotomielittek<strong>en</strong>s sinds het gebruik van radiotherapie niet meer voorkwam<strong>en</strong>. Om die<br />
red<strong>en</strong> wordt in het AMC nog e<strong>en</strong> korte voorbestraling gegev<strong>en</strong> van 3 maal 3.5 Gy. Er is<br />
e<strong>en</strong> grote review van gegev<strong>en</strong>s van de Amerikaanse SEER database gedaan. Hierbij werd<br />
e<strong>en</strong> cohort geanalyseerd van 1491 patiënt<strong>en</strong> die e<strong>en</strong> resectie hadd<strong>en</strong> ondergaan weg<strong>en</strong>s<br />
e<strong>en</strong> hilair galwegcarcinoom. Tweeëndertig proc<strong>en</strong>t hiervan hadd<strong>en</strong> aanvull<strong>en</strong>de<br />
radiotherapie gehad (473/1491 patiënt<strong>en</strong>). De mediane overleving was 33 maand<strong>en</strong> voor<br />
patiënt<strong>en</strong> met lokale ziekte <strong>en</strong> 18 maand<strong>en</strong> voor patiënt<strong>en</strong> met locoregionale ziekte. Wel of<br />
ge<strong>en</strong> aanvull<strong>en</strong>de radiotherapie maakte in dit cohort ge<strong>en</strong> verschil [Vern-Gross 2011]. E<strong>en</strong><br />
nadeel van deze analyse is dat er ge<strong>en</strong> details bestond<strong>en</strong> over belangrijke zak<strong>en</strong> als<br />
resectiemarges, aanvull<strong>en</strong>de chemotherapie <strong>en</strong> de red<strong>en</strong> om wel of ge<strong>en</strong> radiotherapie te<br />
kiez<strong>en</strong>. Bonet Beltran et al. publiceerd<strong>en</strong> e<strong>en</strong> serie waarin hun bestraalde patiënt<strong>en</strong> het<br />
beter ded<strong>en</strong> dan deg<strong>en</strong><strong>en</strong> die alle<strong>en</strong> e<strong>en</strong> resectie hadd<strong>en</strong> ondergaan <strong>en</strong> adviseerd<strong>en</strong><br />
gerandomiseerd onderzoek [Bonet Beltran 2011]. Dezelfde auteurs verrichtt<strong>en</strong> e<strong>en</strong><br />
systematische review van observationele studies waaruit ze concludeerd<strong>en</strong> dat in het<br />
algeme<strong>en</strong> de bestraalde patiënt<strong>en</strong> slechtere prognostische k<strong>en</strong>merk<strong>en</strong> hadd<strong>en</strong> <strong>en</strong> toch<br />
e<strong>en</strong> betere overleving hadd<strong>en</strong> [Bonet-Beltran 2012]. Dit wordt ook in e<strong>en</strong> andere rec<strong>en</strong>te<br />
review gesuggereerd [Anderson 2009]. Er zijn dus aanwijzing<strong>en</strong> dat aanvull<strong>en</strong>de<br />
radiotherapie kan help<strong>en</strong>, maar gerandomiseerde evid<strong>en</strong>ce ontbreekt.<br />
Chemotherapie <strong>en</strong> chemoradiotherapie<br />
Ook op het gebied van adjuvante chemotherapie is de evid<strong>en</strong>ce schaars. Er is e<strong>en</strong><br />
gerandomiseerde trial die voor irresectabel <strong>en</strong>/of gemetastaseerd galwegcarcinoom e<strong>en</strong><br />
voordeel liet zi<strong>en</strong> van de combinatie van gemcitabine <strong>en</strong> cisplatinum bov<strong>en</strong> alle<strong>en</strong><br />
gemcitabine [Valle 2010]. Met betrekking tot adjuvante behandeling na resectie van<br />
galwegcarcinom<strong>en</strong> is één gerandomiseerde fase 3 trial gepubliceerd die ge<strong>en</strong> voordeel liet<br />
zi<strong>en</strong> van adjuvante mitomycine-C met 5-FU [Takada 2002]. Ook op het gebied van<br />
chemotherapie zijn observationele studies die e<strong>en</strong> mogelijk voordeel lat<strong>en</strong> zi<strong>en</strong>, maar in<br />
voornoemde review wordt geconcludeerd dat er onvoldo<strong>en</strong>de aanwijzing<strong>en</strong> zijn dat<br />
chemotherapie in de adjuvante setting nuttig is [Anderson 2009].<br />
Ook over het gebruik van chemoradiotherapie is vrijwel ge<strong>en</strong> deugdelijke literatuur.<br />
Opmerkelijk is dat Skipworth et al. in hun uitgebreide rec<strong>en</strong>te review e<strong>en</strong> <strong>en</strong>quête onder<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 29 van 75<br />
11 juli 2012
1119<br />
1120<br />
1121<br />
1122<br />
1123<br />
1124<br />
1125<br />
1126<br />
1127<br />
1128<br />
1129<br />
1130<br />
1131<br />
1132<br />
1133<br />
1134<br />
1135<br />
1136<br />
1137<br />
1138<br />
1139<br />
1140<br />
1141<br />
1142<br />
1143<br />
1144<br />
1145<br />
1146<br />
1147<br />
1148<br />
331 institut<strong>en</strong> wereldwijd beschrijv<strong>en</strong> waarbij in Noord <strong>en</strong> Zuid Amerika 71% van de<br />
institut<strong>en</strong> adjuvante chemoradiotherapie gebruik<strong>en</strong>, in Azie 55% <strong>en</strong> in Europa 29% van de<br />
institut<strong>en</strong>. [Skipworth 2011]. Ondanks dit uitgebreide gebruik van chemoradiotherapie is de<br />
werkgroep van m<strong>en</strong>ing dat er onvoldo<strong>en</strong>de evid<strong>en</strong>ce is om chemoradiotherapie als<br />
standaard behandeling te adviser<strong>en</strong>.<br />
Conclusies<br />
Er zijn aanwijzing<strong>en</strong> dat na resectie van e<strong>en</strong> extrahepatisch galwegcarcinoom aanvull<strong>en</strong>de<br />
radiotherapie e<strong>en</strong> verbetering van de lokale controle <strong>en</strong> ziektevrije overleving kan gev<strong>en</strong>.<br />
[Anderson 2009; Bonet Beltran 2012]<br />
Er zijn onvoldo<strong>en</strong>de aanwijzing<strong>en</strong> dat adjuvante chemotherapie van voordeel is na<br />
resectie van e<strong>en</strong> galwegcarcinoom<br />
[Takada, 2002; Anderson 2009; Skipworth 2011]<br />
Er zijn onvoldo<strong>en</strong>de aanwijzing<strong>en</strong> dat adjuvante chemoradiotherapie van voordeel is na<br />
resectie van e<strong>en</strong> galwegcarcinoom.<br />
[Anderson 2009; Skipworth 2011]<br />
Overweging<strong>en</strong><br />
Hoewel er dus aanwijzing<strong>en</strong> zijn dat aanvull<strong>en</strong>de radiotherapie de lokale controle <strong>en</strong> de<br />
ziektevrije overleving kan verbeter<strong>en</strong> <strong>en</strong> (chemo)radiotherapie wereldwijd veel wordt<br />
toegepast is de werkgroep van m<strong>en</strong>ing dat er onvoldo<strong>en</strong>de evid<strong>en</strong>ce is om standaard<br />
gebruik van adjuvante radiotherapie, chemotherapie of e<strong>en</strong> combinatie daarvan te<br />
adviser<strong>en</strong>.<br />
Aanbeveling<strong>en</strong><br />
De werkgroep is van m<strong>en</strong>ing dat na resectie van e<strong>en</strong> galwegcarcinoom ge<strong>en</strong> standaard<br />
adjuvante radiotherapie, chemotherapie of chemoradiotherapie wordt geadviseerd.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 30 van 75<br />
11 juli 2012
1149<br />
1150<br />
1151<br />
1152<br />
1153<br />
1154<br />
1155<br />
1156<br />
1157<br />
1158<br />
1159<br />
1160<br />
1161<br />
1162<br />
1163<br />
1164<br />
1165<br />
1166<br />
1167<br />
1168<br />
1169<br />
1170<br />
1171<br />
1172<br />
1173<br />
1174<br />
1175<br />
1176<br />
1177<br />
1178<br />
1179<br />
1180<br />
1181<br />
1182<br />
1183<br />
1184<br />
1185<br />
H 4 Pathologie<br />
4.1 Pathologie galblaascarcinoom<br />
Inleiding<br />
Het pathologieonderzoek van het resectiepreparaat is van cruciale betek<strong>en</strong>is voor de<br />
prognose. In dit hoofdstuk wordt besprok<strong>en</strong> aan welke eis<strong>en</strong> het pathologieverslag di<strong>en</strong>t te<br />
voldo<strong>en</strong> <strong>en</strong> wat de (aanvull<strong>en</strong>de) waarde is van e<strong>en</strong> aantal pathologische k<strong>en</strong>merk<strong>en</strong>. Aan het<br />
einde van dit hoofdstuk word<strong>en</strong> de gebruikte begripp<strong>en</strong> gedefinieerd. T<strong>en</strong> behoeve van het<br />
pathologieverslag di<strong>en</strong>t de patholoog adequate informatie te ontvang<strong>en</strong> over de<br />
voorgeschied<strong>en</strong>is van de patiënt <strong>en</strong> de verrichte ingreep.<br />
Aanbeveling<br />
Voor e<strong>en</strong> optimale beoordeling van e<strong>en</strong> resectiepreparaat is het noodzakelijk dat de<br />
patholoog beschikt over de volg<strong>en</strong>de klinische informatie:<br />
• lokalisatie van de tumor<br />
• ev<strong>en</strong>tuele neoadjuvante therapie<br />
• familiaire belasting<br />
• type operatie (palliatief/curatief, ruime of beperkte lymfklierdissectie).<br />
Minimale dataset voor het pathologieverslag voor galblaascarcinoom<br />
\Literatuurbespreking<br />
Het doel van e<strong>en</strong> pathologisch verslag is drieledig:<br />
1. Het verschaff<strong>en</strong> van voldo<strong>en</strong>de informatie voor e<strong>en</strong> goede besluitvorming betreff<strong>en</strong>de het<br />
beleid voor de individuele patiënt.<br />
2. Het verschaff<strong>en</strong> van voldo<strong>en</strong>de prognostische informatie.<br />
3. Het verschaff<strong>en</strong> van voldo<strong>en</strong>de informatie voor e<strong>en</strong> ev<strong>en</strong>tuele audit van medisch handel<strong>en</strong>.<br />
Uit diverse studies is geblek<strong>en</strong> dat standaardformulier<strong>en</strong> de verslaglegging van de pathologie<br />
verbetert {King 2004}. Hierbij wordt gebruik gemaakt van e<strong>en</strong> minimale dataset, die nodig is<br />
voor bov<strong>en</strong>g<strong>en</strong>oemde 3 punt<strong>en</strong>. Hiervoor zijn ook in Nederland standaard-sjablon<strong>en</strong> in<br />
ontwikkeling, deze kom<strong>en</strong> voor het galblaascarcinoom naar verwachting begin 2013<br />
beschikbaar. Parameters die in de diverse (inter)nationale richtlijn<strong>en</strong> word<strong>en</strong> gebruikt staan in<br />
tabel 1.<br />
Tabel 1. Parameters internationale richtlijn<strong>en</strong><br />
K<strong>en</strong>merk 1 e auteur <strong>en</strong> jaartal publicatie<br />
Histologische typering WHO 2011<br />
Histologische gradering Park 2007<br />
Tumor diameter<br />
Invasie-diepte Sasaki 2006, Butte 2011, Goetze 2012<br />
Radicaliteit Balachandran 2006, Murakami 2011<br />
Lymfklierstatus Goetze 2012, Negi 2011<br />
Perineurale invasie Yamaguchi 1997<br />
Lymfatische invasie Chijiiwa 1997<br />
Vasculaire invasie Kobayashi 2012<br />
Het verslag van de patholoog vermeldt t<strong>en</strong> minste alle bevinding<strong>en</strong> die nodig zijn voor het<br />
vaststell<strong>en</strong> van het TNM-stadium (zie hoofdstuk 12, TNM). Daarnaast zijn er de volg<strong>en</strong>de<br />
parameters (zie tabel 1) die de prognose <strong>en</strong> het beleid mede bepal<strong>en</strong><br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 31 van 75<br />
11 juli 2012
1186<br />
1187<br />
1188<br />
1189<br />
1190<br />
1191<br />
1192<br />
1193<br />
1194<br />
1195<br />
1196<br />
1197<br />
1198<br />
1199<br />
1200<br />
1201<br />
1202<br />
1203<br />
1204<br />
1205<br />
1206<br />
1207<br />
1208<br />
1209<br />
1210<br />
1211<br />
1212<br />
1213<br />
1214<br />
1215<br />
1216<br />
1217<br />
1218<br />
1219<br />
1220<br />
1221<br />
1222<br />
1223<br />
1224<br />
1225<br />
1226<br />
1227<br />
1228<br />
1229<br />
1230<br />
Aanbeveling<strong>en</strong><br />
De voorkeur gaat uit naar e<strong>en</strong> standaardverslag van de bevinding<strong>en</strong> van de patholoog.<br />
In het pathologieverslag di<strong>en</strong><strong>en</strong> t<strong>en</strong> minste de volg<strong>en</strong>de gegev<strong>en</strong>s te staan:<br />
− histologische typering van de tumor<br />
− histologische gradering van de tumor<br />
− invasiediepte (T stadium)<br />
− afstand van de tumor tot (dichtstbijzijnde) resectierand<strong>en</strong><br />
− volledigheid van resectie<br />
− aantal geëxcideerde lymfklier<strong>en</strong>)<br />
− aantal aangedane lymfklier<strong>en</strong> (N-stadium)<br />
− perineurale invasie<br />
− lymfatische invasie<br />
− vasculaire invasie<br />
De werkgroep is van m<strong>en</strong>ing dat, naast de standaardinformatie, de onderstaande gegev<strong>en</strong>s<br />
ook van belang zijn voor de compleetheid van de rapportage:<br />
− grootte van de tumor<br />
− lokalisatie van de tumor<br />
− macroscopische beschrijving van de tumor<br />
− bijkom<strong>en</strong>de pathologische bevinding<strong>en</strong> (zoals: dysplasie, cholelithiasis, chronische<br />
ontsteking, intestinale metaplasie, diffuse calcificaties)<br />
4.2 Pathologie galwegcarcinoom<br />
Inleiding<br />
Het pathologieonderzoek van het resectiepreparaat is van cruciale betek<strong>en</strong>is voor de<br />
prognose. T<strong>en</strong> behoeve van het pathologieverslag di<strong>en</strong>t de patholoog adequate informatie te<br />
ontvang<strong>en</strong> over de voorgeschied<strong>en</strong>is van de patiënt <strong>en</strong> de verrichte ingreep. Het verslag van<br />
de patholoog vermeldt t<strong>en</strong> minste alle bevinding<strong>en</strong> die nodig zijn voor het vaststell<strong>en</strong> van het<br />
TNM-stadium (zie hoofdstuk TNM). Daarnaast zijn er andere parameters die de prognose <strong>en</strong><br />
het beleid mede bepal<strong>en</strong>. In dit hoofdstuk wordt besprok<strong>en</strong> aan welke eis<strong>en</strong> het<br />
pathologieverslag di<strong>en</strong>t te voldo<strong>en</strong> <strong>en</strong> wat de (aanvull<strong>en</strong>de) waarde is van e<strong>en</strong> aantal<br />
pathologische k<strong>en</strong>merk<strong>en</strong>.<br />
Aanbeveling<strong>en</strong><br />
Voor e<strong>en</strong> optimale beoordeling van e<strong>en</strong> resectiepreparaat is het noodzakelijk dat de<br />
patholoog beschikt over de volg<strong>en</strong>de klinische informatie: lokalisatie van de tumor, type<br />
resectie (welke structur<strong>en</strong> zijn gereseceerd), ruime of beperkte lymfklierdissectie, ev<strong>en</strong>tuele<br />
neoadjuvante therapie, familiaire belasting <strong>en</strong> aard van de ingreep (palliatief/curatief),<br />
Minimale dataset voor het pathologieverslag voor proximaal galwegcarcinoom<br />
Het doel van e<strong>en</strong> pathologisch verslag is drieledig:<br />
1. Het verschaff<strong>en</strong> van voldo<strong>en</strong>de informatie voor e<strong>en</strong> goede besluitvorming betreff<strong>en</strong>de<br />
het beleid voor de individuele patiënt.<br />
2. Het verschaff<strong>en</strong> van voldo<strong>en</strong>de prognostische informatie.<br />
3. Het verschaff<strong>en</strong> van voldo<strong>en</strong>de informatie voor e<strong>en</strong> ev<strong>en</strong>tuele audit van medisch<br />
handel<strong>en</strong>.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 32 van 75<br />
11 juli 2012
1231<br />
1232<br />
1233<br />
1234<br />
1235<br />
1236<br />
1237<br />
1238<br />
1239<br />
1240<br />
1241<br />
1242<br />
1243<br />
1244<br />
1245<br />
1246<br />
1247<br />
1248<br />
1249<br />
1250<br />
1251<br />
1252<br />
1253<br />
1254<br />
1255<br />
1256<br />
1257<br />
1258<br />
1259<br />
1260<br />
1261<br />
1262<br />
1263<br />
1264<br />
1265<br />
1266<br />
1267<br />
Uit diverse studies is geblek<strong>en</strong> dat standaardformulier<strong>en</strong> de verslaglegging van de pathologie<br />
verbetert [King 2004]. Hierbij wordt gebruik gemaakt van e<strong>en</strong> minimale dataset, die nodig is<br />
voor bov<strong>en</strong>g<strong>en</strong>oemde 3 punt<strong>en</strong>.<br />
E<strong>en</strong> voorbeeld van e<strong>en</strong> standaard sjabloon voor het perihilair/proximaal galweg carcinoom is<br />
het cancer-protocol van de College of American Pathologists (www.cap.org). Dit checklistprotocol<br />
omvat zowel het macroscopisch <strong>en</strong> microscopisch onderzoek als de verslaglegging.<br />
Aanbeveling<strong>en</strong><br />
De voorkeur gaat uit naar e<strong>en</strong> standaardverslag.<br />
Het pathologieverslag di<strong>en</strong>t informatie te bevatt<strong>en</strong> over t<strong>en</strong> minste de volg<strong>en</strong>de k<strong>en</strong>merk<strong>en</strong>:<br />
- Type operatie preparaat<br />
- Macroscopische beschrijving van de tumor<br />
- Grootte van de tumor<br />
- Lokalisatie <strong>en</strong> uitgebreidheid van de tumor<br />
- Histologische typering van de tumor (WHO 2010); papillaire variant expliciet vermeld<strong>en</strong><br />
(Jarnagin et al. 2005)<br />
- Histologische gradering van de tumor (WHO 2010)<br />
- Invasiediepte (T stadium)<br />
- Afstand van de tumor tot dichtstbijzijnde resectievlak <strong>en</strong> specificatie van dit resectievlak<br />
- Volledigheid van resectie<br />
- Specificatie van de verschill<strong>en</strong>de resectierand<strong>en</strong>:<br />
- Proximale <strong>en</strong> distale galweg<strong>en</strong><br />
- Leverpar<strong>en</strong>chym<br />
- Perineurale invasie<br />
- Lymf-angioinvasie<br />
- Aantal geëxcideerde <strong>en</strong> aangedane lymfklier<strong>en</strong> (N-stadium)<br />
Optioneel is informatie over bijkom<strong>en</strong>de pathologische bevinding<strong>en</strong> :<br />
- Biliaire Intraepitheliale Neoplasie met gradering: low-grade/high grade (WHO 2010)<br />
- Intraductal papillary Neoplasia (WHO 2010)<br />
- PSC of andere chronische ontsteking,<br />
- Intestinale metaplasie,<br />
- Choledochus cyste<br />
- Cholelithiasis<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 33 van 75<br />
11 juli 2012
1268<br />
1269<br />
1270<br />
1271<br />
1272<br />
1273<br />
1274<br />
1275<br />
1276<br />
1277<br />
1278<br />
1279<br />
1280<br />
1281<br />
1282<br />
1283<br />
1284<br />
H5 Galblaaspoliep<strong>en</strong><br />
Literatuurbespreking<br />
Poliep<strong>en</strong> in de galblaas word<strong>en</strong> over het algeme<strong>en</strong> bij toeval gevond<strong>en</strong> bij transabdominale<br />
echo, <strong>en</strong>doscopische ultrasonografie (EUS), CT of MR scan. Van klinisch belang is het<br />
onderscheid tuss<strong>en</strong><br />
a. neoplastische poliep<strong>en</strong> (ad<strong>en</strong>om<strong>en</strong>, carcinoma in situ) <strong>en</strong><br />
b. niet-neoplastische poliep<strong>en</strong> bijvoorbeeld ad<strong>en</strong>omyomatosis, cholesterol poliep<strong>en</strong> of<br />
inflammatoire poliep<strong>en</strong>.<br />
De niet-neoplastische variant<strong>en</strong> zijn verantwoordelijk voor 95% van alle galblaaspoliep<strong>en</strong><br />
[Persley 2006]. Ad<strong>en</strong>omyomatosis van de galblaas is e<strong>en</strong> deg<strong>en</strong>eratieve, goedaardige<br />
aando<strong>en</strong>ing welke bij beeldvorming wordt gekarakteriseerd door e<strong>en</strong> verdikte galblaaswand<br />
met intramurale divertikels (sinuss<strong>en</strong> van Rokitansky-Aschoff). Ad<strong>en</strong>omyomatosis is meestal<br />
asymptomatisch. In geval van symptom<strong>en</strong> <strong>en</strong> indi<strong>en</strong> andere differ<strong>en</strong>tiaal diagnostische<br />
overweging<strong>en</strong> geld<strong>en</strong>, inclusief de verd<strong>en</strong>king op e<strong>en</strong> mogelijke maligniteit, is e<strong>en</strong><br />
cholecystectomie aangewez<strong>en</strong>.<br />
1285<br />
1286 Er wordt algeme<strong>en</strong> aang<strong>en</strong>om<strong>en</strong> dat ook de overgrote meerderheid van de neoplastische<br />
1287 galblaaspoliep<strong>en</strong> ge<strong>en</strong> klinische symptom<strong>en</strong> veroorzaakt. De klinische relevantie van<br />
1288 galblaaspoliep<strong>en</strong> is geleg<strong>en</strong> in de kans dat e<strong>en</strong> ad<strong>en</strong>omateuze galblaaspoliep maligne<br />
1289 ontaardt. De frequ<strong>en</strong>tie waarmee dit gebeurd is onbek<strong>en</strong>d. Wel zijn e<strong>en</strong> aantal risicofactor<strong>en</strong><br />
1290 bek<strong>en</strong>d waarvan de poliepgrootte de beste correlatie toont met het risico op maligne<br />
1291 ontaarding. In e<strong>en</strong> Japanse serie van 1605 patiënt<strong>en</strong> die e<strong>en</strong> galblaas resectie onderging<strong>en</strong><br />
1292 werd bij 18 patiënt<strong>en</strong> e<strong>en</strong> galblaasad<strong>en</strong>oom (poliep) gevond<strong>en</strong> waarvan 7 foci bevatt<strong>en</strong> met<br />
1293 maligne cell<strong>en</strong> [Kozuka 1982]. Alle maligne ontaarde poliep<strong>en</strong> war<strong>en</strong> >12 mm. E<strong>en</strong> Japanse<br />
1294 multic<strong>en</strong>ter datareview betreff<strong>en</strong>de 503 galblaaspoliep<strong>en</strong> 10 mm, e<strong>en</strong> op<strong>en</strong> dan wel<br />
laparoscopische cholecystectomie verricht moet word<strong>en</strong>. In e<strong>en</strong> Japanse studie, waarbij in 16<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 34 van 75<br />
11 juli 2012
1318<br />
1319<br />
1320<br />
1321<br />
1322<br />
1323<br />
1324<br />
1325<br />
1326<br />
1327<br />
1328<br />
1329<br />
1330<br />
1331<br />
1332<br />
1333<br />
1334<br />
1335<br />
1336<br />
1337<br />
1338<br />
1339<br />
1340<br />
1341<br />
1342<br />
1343<br />
1344<br />
1345<br />
1346<br />
1347<br />
1348<br />
1349<br />
1350<br />
1351<br />
1352<br />
1353<br />
1354<br />
1355<br />
van 72 patiënt<strong>en</strong> met galblaaspoliep<strong>en</strong> e<strong>en</strong> carcinoom werd vastgesteld, werd geconcludeerd<br />
dat indi<strong>en</strong> e<strong>en</strong> poliep
1356<br />
cholecystectomie verricht moet word<strong>en</strong>. Bij e<strong>en</strong> galblaaspoliep kleiner dan 15 mm zonder<br />
<strong>en</strong>ige aanwijzing op maligniteit kan laparoscopische cholecystectomie overwog<strong>en</strong> word<strong>en</strong>.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 36 van 75<br />
11 juli 2012
1357<br />
1358<br />
1359<br />
1360<br />
1361<br />
1362<br />
1363<br />
1364<br />
1365<br />
1366<br />
1367<br />
1368<br />
1369<br />
1370<br />
1371<br />
1372<br />
1373<br />
1374<br />
1375<br />
1376<br />
1377<br />
1378<br />
1379<br />
1380<br />
1381<br />
1382<br />
1383<br />
1384<br />
1385<br />
1386<br />
1387<br />
1388<br />
1389<br />
1390<br />
1391<br />
1392<br />
1393<br />
1394<br />
1395<br />
1396<br />
1397<br />
1398<br />
1399<br />
1400<br />
1401<br />
1402<br />
1403<br />
1404<br />
1405<br />
H 6 Palliatieve behandeling<br />
Inleiding.<br />
Aangezi<strong>en</strong> galblaas- <strong>en</strong> galwegcarcinom<strong>en</strong> uitermate zeldzaam zijn is het uitvoer<strong>en</strong> van<br />
gerandomiseerde trials uitermate moeilijk. Park et al. onderzocht<strong>en</strong> het onbehandeld natuurlijk<br />
beloop van 330 galwegcarcinom<strong>en</strong> (203 intrahepatisch, 127 hilair) uit hun serie van in totaal<br />
1377 patiënt<strong>en</strong>. Zij vond<strong>en</strong> dat de mediane overleving van intrahepatisch galwegcarcinoom 3<br />
maand<strong>en</strong> was <strong>en</strong> die van hilair galwegcarcinoom 5.9 maand<strong>en</strong>. Belangrijkste prognostische<br />
factor<strong>en</strong> war<strong>en</strong> afstandsmetastas<strong>en</strong> <strong>en</strong> e<strong>en</strong> carcino embryonaal antige<strong>en</strong> (CEA) > 30 ng/ml.<br />
[Park 2009]. Wanneer we deze overlevingscijfers als uitgangspunt nem<strong>en</strong> blijft interpretatie<br />
van retrospectieve series of prospectieve mono arm fase 2 studies moeilijk vanwege de<br />
mogelijkheid van selectie.<br />
Literatuurbeschrijving<br />
(Chemo)radiotherapie<br />
Er zijn ge<strong>en</strong> gerandomiseerde trials op het gebied van radiotherapie. In e<strong>en</strong> kleine serie van<br />
38 patiënt<strong>en</strong> uit het AMC werd e<strong>en</strong> mediane overleving van 10.4 maand<strong>en</strong> gevond<strong>en</strong>, waarbij<br />
het gebruik van intraluminale brachytherapie als boost ge<strong>en</strong> winst leek op te lever<strong>en</strong>, <strong>en</strong> de<br />
toxiciteit hoog was [Gonzalez 1999]. Ook Hejna et al. concludeerd<strong>en</strong> in e<strong>en</strong> uitgebreide review<br />
van vele kleine series van uitw<strong>en</strong>dige, inw<strong>en</strong>dige <strong>en</strong>/of intra operatieve radiotherapie dat er<br />
e<strong>en</strong> aanwijzing leek te bestaan van <strong>en</strong>ige werkzaamheid, maar dat gerandomiseerde evid<strong>en</strong>ce<br />
echt nodig was [Hejna 1998]. In dezelfde review werd<strong>en</strong> 5 chemoradiotherapie studies<br />
beschrev<strong>en</strong> met in totaal 146 patiënt<strong>en</strong> <strong>en</strong> e<strong>en</strong> mediane overleving tuss<strong>en</strong> 8 <strong>en</strong> 30 maand<strong>en</strong>.<br />
Ook hiervoor is ge<strong>en</strong> gerandomiseerde evid<strong>en</strong>ce [Hejna 1998]. E<strong>en</strong> rec<strong>en</strong>te ontwikkeling is de<br />
stereotactische radiotherapie, waarbij e<strong>en</strong> goed af te gr<strong>en</strong>z<strong>en</strong> tumorgebied nauwkeurig met<br />
e<strong>en</strong> beperkte marge tot e<strong>en</strong> hoge dosis bestraald kan word<strong>en</strong>. Kopek et al beschrev<strong>en</strong> e<strong>en</strong><br />
serie van 27 patiënt<strong>en</strong> waarbij stereotactische bestraling (SBRT) wel feasible leek, zij het t<strong>en</strong><br />
koste van 3 late duod<strong>en</strong>umst<strong>en</strong>oses <strong>en</strong> 6 bloed<strong>en</strong>de late duod<strong>en</strong>umulcera [Kopek 2010], Dit<br />
was vergelijkbaar met brachytherapie series [Morganti 2000]. Twee rec<strong>en</strong>te series toond<strong>en</strong><br />
opmerkelijke resultat<strong>en</strong>. Eén kleine serie beschreef ti<strong>en</strong> patiënt<strong>en</strong> waarbij met e<strong>en</strong> combinatie<br />
van gemcitabine <strong>en</strong> 3 maal 10 Gy SBRT e<strong>en</strong> mediane progressievrije overleving van 30<br />
maand<strong>en</strong> werd bereik [Polistina 2011]. E<strong>en</strong> andere serie toonde e<strong>en</strong> 32 maand<strong>en</strong> mediane<br />
ziektevrije overleving na gefractioneerde stereotactische radiotherapie bij 13 patiënt<strong>en</strong> met<br />
e<strong>en</strong> irresectabel proximaal galwegcarcinoom [Momm 2010]. Deze cijfers zijn hoopgev<strong>en</strong>d voor<br />
stereotactische radiotherapie met of zonder chemotherapie, maar één <strong>en</strong> ander moet wel in<br />
gerandomiseerde studies word<strong>en</strong> bevestigd.<br />
Chemotherapie<br />
Het verricht<strong>en</strong> van goede klinische trials naar de werkzaamheid van chemotherapie bij niet<br />
resectabele cq gemetastaseerde biliaire tumor<strong>en</strong> wordt in belangrijke mate beperkt door de<br />
lage incid<strong>en</strong>tie, heterog<strong>en</strong>iteit van de patiënt<strong>en</strong>populatie, gestoorde leverfuncties, <strong>en</strong> frequ<strong>en</strong>te<br />
infectieproblematiek. De meeste klinische trials met chemotherapie zijn uitgevoerd in e<strong>en</strong><br />
heterog<strong>en</strong>e populatie, bestaande uit galblaascarcinom<strong>en</strong>, intra- <strong>en</strong> extrahepatische<br />
galwegcarcinom<strong>en</strong> <strong>en</strong> carcinom<strong>en</strong> uitgaande van de ampulla van Vater. Gezi<strong>en</strong> de verschill<strong>en</strong><br />
in klinisch <strong>en</strong> biologische gedrag tuss<strong>en</strong> deze tumor<strong>en</strong> is e<strong>en</strong> goede interpretatie van de<br />
resultat<strong>en</strong> vaak lastig. Gerandomiseerde studies naar het effect van chemotherapie versus<br />
ge<strong>en</strong> behandeling zijn niet verricht. De meeste fase II studies werd<strong>en</strong> niet gerandomiseerd<br />
uitgevoerd in kleine heterog<strong>en</strong>e patiënt<strong>en</strong>populaties Alhoewel het vaststell<strong>en</strong> van de tumor<br />
grootte bij biliaire tumor<strong>en</strong> vaak lastig is werd het in de meeste fase II studies response toch<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 37 van 75<br />
11 juli 2012
1406<br />
1407<br />
1408<br />
1409<br />
1410<br />
1411<br />
1412<br />
1413<br />
1414<br />
1415<br />
1416<br />
1417<br />
1418<br />
1419<br />
1420<br />
1421<br />
1422<br />
1423<br />
1424<br />
1425<br />
1426<br />
1427<br />
1428<br />
1429<br />
1430<br />
1431<br />
1432<br />
1433<br />
1434<br />
1435<br />
1436<br />
1437<br />
1438<br />
1439<br />
1440<br />
1441<br />
1442<br />
1443<br />
1444<br />
1445<br />
1446<br />
1447<br />
1448<br />
1449<br />
1450<br />
1451<br />
1452<br />
1453<br />
1454<br />
1455<br />
als primair eindpunt gebruikt. De meest gebruikte cytostatica zijn 5-fluorouracil / capecitabine,<br />
cisplatin, gemcitabine,oxaliplatin, <strong>en</strong> epi-adriamycine.<br />
Schema’s met epi-adriamycine, cisplatin <strong>en</strong> 5-fluorouracil (5-FU)/capecitabine.<br />
In twee niet gerandomiseerde <strong>en</strong> één gerandomiseerde fase II studies [Ellis 1995; Rao 2005;<br />
Park 2006] werd kleine patiënt<strong>en</strong> aantall<strong>en</strong> (25-54) behandeld met de chemotherapie<br />
combinatie epirubicine/cisplatin/5-FU of capecitabine (ECF, ECC). In de gerandomiseerde<br />
studie werd ECF vergelek<strong>en</strong> met 5-FU/etoposide/leucovorin (2,FELV). De response rate<br />
bedroeg 20-40% <strong>en</strong> de mediane overleving 8-12 maand<strong>en</strong>. ECF <strong>en</strong> FELV liet<strong>en</strong> ge<strong>en</strong> verschil<br />
in uitkomst zi<strong>en</strong>.<br />
Schema’s met gemcitabine <strong>en</strong> cisplatin (GM)<br />
In twee niet gerandomiseerde fase II studies [Thongprasert 2005; Giuliani 2006] met<br />
gemcitabine <strong>en</strong> cisplatin werd e<strong>en</strong> response rate van 27-29% gezi<strong>en</strong> met e<strong>en</strong> mediane<br />
overleving van 8 maand<strong>en</strong>. In e<strong>en</strong> fase II gerandomiseerde studie werd gemcitabine + cisplatin<br />
(GC) vergelek<strong>en</strong> met gemcitabine [Valle 2009]. Gezi<strong>en</strong> de gunstige uitkomst werd deze studie<br />
uitgebreid naar e<strong>en</strong> fase III studie. In deze fase III studie [Valle 2010] werd<strong>en</strong> 410 patiënt<strong>en</strong><br />
met e<strong>en</strong> niet resectabel of gemetastaseerde biliaire tumor (galwegcarcinom<strong>en</strong> 59%,<br />
galblaascarcinom<strong>en</strong> 36% <strong>en</strong> ampullacarcinom<strong>en</strong> 5%) gerandomiseerd tuss<strong>en</strong> GC:<br />
gemcitabine (1000mg/m2 + Cisplatin 25 mg/m2, dag 1 <strong>en</strong> 8, iedere drie wek<strong>en</strong>) <strong>en</strong> G:<br />
gemcitabine monotherapie (1000mg/m2 dag 1,8,15, iedere 4 wek<strong>en</strong>). Het primaire eindpunt<br />
van deze studie was overleving. De mediane behandelduur in de GC-arm was 21 wek<strong>en</strong> <strong>en</strong> in<br />
de G-arm 14 wek<strong>en</strong>, waarbij de meeste patiënt<strong>en</strong> stopt<strong>en</strong> in verband met ziekteprogressie. Na<br />
e<strong>en</strong> follow-up van 8.2 maand<strong>en</strong> was de mediane overleving in de GC-arm: 11,7 <strong>en</strong> in de G-<br />
arm: 8,1 maand<strong>en</strong> (HR 0,64;95% CI, 0,52-0,80; p
1456<br />
1457<br />
1458<br />
1459<br />
1460<br />
1461<br />
1462<br />
1463<br />
1464<br />
1465<br />
1466<br />
1467<br />
1468<br />
1469<br />
1470<br />
1471<br />
1472<br />
1473<br />
1474<br />
1475<br />
1476<br />
1477<br />
Conclusies<br />
De werkgroep is van m<strong>en</strong>ing dat er ge<strong>en</strong> rol is voor palliatieve radiotherapie bij het<br />
locoregionaal uitgebreid galwegcarcinoom.<br />
[Hejna 1998; Gonzalez Gonzalez 1999]<br />
Er zijn aanwijzing<strong>en</strong> dat stereotactische radiotherapie, al of niet in combinatie met<br />
chemotherapie, e<strong>en</strong> voordeel biedt bij locoregionaal uitgebreid galwegcarcinoom.<br />
[Kopek 2010; Momm 2010; Polistina, 2011]<br />
Het is aannemelijk dat bij de behandeling van locoregionaal uitgebreid of gemetastaseerd<br />
galweg- of galblaascarcinoom Gemcitabine + Cisplatin e<strong>en</strong> betere overleving geeft dan<br />
Gemcitabine alle<strong>en</strong>.<br />
[Valle 2010; Okusaka 2010]<br />
Aanbeveling<strong>en</strong><br />
De werkgroep is van m<strong>en</strong>ing dat radiotherapie niet standaard moet<strong>en</strong> word<strong>en</strong> aangebod<strong>en</strong><br />
aan patiënt<strong>en</strong> met e<strong>en</strong> locoregionaal uitgebreid galwegcarcinoom.<br />
De werkgroep is van m<strong>en</strong>ing dat stereotactische radiotherapie, met of zonder chemotherapie, bij<br />
voorkeur in studieverband kan word<strong>en</strong> overwog<strong>en</strong>.<br />
Er wordt geadviseerd om aan patiënt<strong>en</strong> met e<strong>en</strong> locoregionaal uitgebreid of gemetastaseerd<br />
galblaas- of galwegcarcinoom de combinatie Gemcitabine met Cisplatin als palliatieve<br />
chemotherapie aan te bied<strong>en</strong>.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 39 van 75<br />
11 juli 2012
1478<br />
H7 Nazorg<br />
1479<br />
1480 7.1 Algeme<strong>en</strong><br />
1481 Het rapport ‘Nacontrole in de oncologie’ [Gezondheidsraad, 2007] definieert nazorg als e<strong>en</strong><br />
1482 ess<strong>en</strong>tieel onderdeel van de individuele patiënt<strong>en</strong>zorg na behandeling voor kanker. Nazorg<br />
1483 vraagt e<strong>en</strong> programmatische aanpak die zich - op basis van terugker<strong>en</strong>de contact<strong>en</strong> tuss<strong>en</strong> de<br />
1484 patiënt <strong>en</strong> zijn behandelar<strong>en</strong> - richt op drie elem<strong>en</strong>t<strong>en</strong>:<br />
1485 1. Voorlichting, begeleiding, ingaan op klacht<strong>en</strong> <strong>en</strong> symptom<strong>en</strong>, signaler<strong>en</strong> van directe of late<br />
1486 effect<strong>en</strong> van ziekte <strong>en</strong> behandeling <strong>en</strong> aandacht voor sociale gevolg<strong>en</strong>.<br />
1487 2. Detectie van nieuwe manifestaties van de primair behandelde kanker of nieuwe daarmee<br />
1488 geassocieerde maligniteit<strong>en</strong>.<br />
1489 3. Evaluatie van het medisch handel<strong>en</strong> <strong>en</strong> de gevolg<strong>en</strong> daarvan.<br />
1490<br />
1491<br />
1492<br />
1493<br />
1494<br />
1495<br />
1496<br />
1497<br />
1498<br />
1499<br />
1500<br />
1501<br />
1502<br />
1503<br />
1504<br />
1505<br />
1506<br />
1507<br />
1508<br />
1509<br />
1510<br />
1511<br />
1512<br />
1513<br />
1514<br />
1515<br />
1516<br />
1517<br />
1518<br />
1519<br />
1520<br />
1521<br />
1522<br />
1523<br />
1524<br />
1525<br />
1526<br />
1527<br />
In dit hoofdstuk word<strong>en</strong> met name de eerste twee elem<strong>en</strong>t<strong>en</strong> van nazorg nader uitgewerkt. Het<br />
tweede elem<strong>en</strong>t is in de praktijk ook bek<strong>en</strong>d onder de noemer ‘follow-up’. Zie verder ook de<br />
richtlijn<strong>en</strong> Detecter<strong>en</strong> behoefte psychosociale zorg [IKNL, juni 2010], Herstel na kanker [IKNL,<br />
februari 2011] <strong>en</strong> Oncologische revalidatie [IKNL, oktober 2011]. Deze zijn terug te vind<strong>en</strong> op<br />
www.oncoline.nl onder de niet-tumorspecifieke richtlijn<strong>en</strong>.<br />
7.2 Gevolg<strong>en</strong> ziekte <strong>en</strong> behandeling<br />
Literatuurbespreking<br />
Ziekte <strong>en</strong> behandeling hebb<strong>en</strong> grote gevolg<strong>en</strong><br />
Patiënt<strong>en</strong> met kanker verker<strong>en</strong> tijd<strong>en</strong>s het diagnostische <strong>en</strong> therapeutische traject in e<strong>en</strong><br />
onzekere situatie. Er is in deze fase e<strong>en</strong> grote behoefte aan duidelijke informatie. Goede<br />
mondelinge uitleg maar ook schriftelijke docum<strong>en</strong>tatie is hiervoor onontbeerlijk. Het heeft<br />
meerwaarde als de patiënt, naast het gesprek met de medisch specialist, voorlichting krijgt van<br />
e<strong>en</strong> gespecialiseerde verpleegkundige of e<strong>en</strong> verpleegkundig specialist (nurse practitioner)<br />
over het diagnostisch proces, de ziekte, behandeling <strong>en</strong> verwerking [Melville, 2001].<br />
Vroege gevolg<strong>en</strong><br />
Vroege gevolg<strong>en</strong> zijn die gevolg<strong>en</strong> die de patiënt direct na diagnose <strong>en</strong> tijd<strong>en</strong>s behandeling of<br />
in de eerste periode (tot één jaar) na de behandeling ervaart. De Gezondheidsraad (2007)<br />
stelt dat tijdige behandeling door vroege signalering, de ziektelast van vroege gevolg<strong>en</strong> kan<br />
verminder<strong>en</strong>. De zorg met betrekking tot vroege gevolg<strong>en</strong> valt primair onder de<br />
verantwoordelijkheid van de behandel<strong>en</strong>de specialist. Uiteraard kunn<strong>en</strong> hierbij andere<br />
hulpverl<strong>en</strong>ers ingeschakeld word<strong>en</strong>.<br />
Late gevolg<strong>en</strong><br />
Late gevolg<strong>en</strong> bij e<strong>en</strong> galblaas / galwegcarcinoom zijn vrijwel altijd gerelateerd aan<br />
inadequate drainage van de galweg<strong>en</strong>. Dit kan ontstaan door verlittek<strong>en</strong>ing van de<br />
hepaticojejunostomie <strong>en</strong> anderzijds door recidief van de tumor, lokaal danwel gemetastaseerd.<br />
Bij e<strong>en</strong> lokaal recidief van de tumor zal de behandeling gericht zijn op adequate drainage van<br />
de galweg<strong>en</strong> met plaats<strong>en</strong> van e<strong>en</strong> biliaire metal<strong>en</strong> st<strong>en</strong>t. Uit de literatuur blijkt dat obstructie<br />
klacht<strong>en</strong> in de palliatieve fase zowel <strong>en</strong>doscopisch (ERCP) als percutaan (PTC) plaats kunn<strong>en</strong><br />
vind<strong>en</strong>. Er is echter onvoldo<strong>en</strong>de evid<strong>en</strong>ce om e<strong>en</strong> voorkeur uit te sprek<strong>en</strong> [Connor 2006].<br />
Indi<strong>en</strong> er sprake is van e<strong>en</strong> recidief dan zijn er ge<strong>en</strong> curatieve behandelopties meer <strong>en</strong> de<br />
behandeling<strong>en</strong> zull<strong>en</strong> gericht zijn op het palliër<strong>en</strong> van de klacht<strong>en</strong>. Klacht<strong>en</strong> die voorkom<strong>en</strong><br />
zijn: jeuk, afvall<strong>en</strong>, verminderde eetlust, pijn, ascites, vermoeidheid, passageklacht<strong>en</strong> t<strong>en</strong><br />
gevolge van tumor doorgroei in het duod<strong>en</strong>um.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 40 van 75<br />
11 juli 2012
1528<br />
1529<br />
1530<br />
1531<br />
1532<br />
1533<br />
1534<br />
1535<br />
1536<br />
1537<br />
1538<br />
1539<br />
1540<br />
1541<br />
1542<br />
1543<br />
1544<br />
1545<br />
1546<br />
1547<br />
1548<br />
1549<br />
1550<br />
1551<br />
1552<br />
1553<br />
1554<br />
1555<br />
1556<br />
1557<br />
1558<br />
1559<br />
1560<br />
1561<br />
1562<br />
1563<br />
1564<br />
1565<br />
1566<br />
1567<br />
1568<br />
1569<br />
1570<br />
1571<br />
1572<br />
1573<br />
1574<br />
1575<br />
1576<br />
Medicam<strong>en</strong>teuze behandeling van jeuk wordt in de literatuur met wissel<strong>en</strong>d succes<br />
beschrev<strong>en</strong> [Kremer 2008].<br />
Behandeling van passageklacht<strong>en</strong> als gevolg van tumordoorgroei kan <strong>en</strong>doscopisch danwel<br />
chirurgisch plaatsvind<strong>en</strong>. Hierbij wordt e<strong>en</strong> lev<strong>en</strong>sverwachting van minder dan 6 maand<strong>en</strong><br />
aangehoud<strong>en</strong> om e<strong>en</strong> duod<strong>en</strong>ale metal<strong>en</strong> st<strong>en</strong>t te plaats<strong>en</strong>.<br />
In de palliatieve setting di<strong>en</strong>t individueel per patiënt de overweging te word<strong>en</strong> gemaakt welke<br />
ingrep<strong>en</strong> zinvol zijn in relatie tot het verwachte resultaat. Kwaliteit van lev<strong>en</strong> staat hierbij<br />
voorop.<br />
Overweging werkgroep<br />
Zolang onduidelijk is of de detectie van late gevolg<strong>en</strong> in e<strong>en</strong> asymptomatische fase voor de<br />
patiënt gezondheidswinst oplevert, bestaat er onvoldo<strong>en</strong>de rechtvaardiging om alle patiënt<strong>en</strong><br />
langdurig onder controle te houd<strong>en</strong>. Het is van belang de patiënt <strong>en</strong> zijn huisarts goede<br />
voorlichting <strong>en</strong> instructie over mogelijke late gevolg<strong>en</strong> te gev<strong>en</strong> <strong>en</strong> hoe daarmee om te gaan.<br />
De patiënt moet geïnformeerd word<strong>en</strong> bij welke zorgverl<strong>en</strong>er hij bij het optred<strong>en</strong> van deze<br />
klacht<strong>en</strong> terecht kan. Hiervoor kan gebruik gemaakt word<strong>en</strong> van het individuele nazorgplan<br />
(zie bijlage).<br />
Signalering<br />
Nazorg begint met het systematisch signaler<strong>en</strong> van klacht<strong>en</strong>. E<strong>en</strong> basisset van<br />
klacht<strong>en</strong>signalering di<strong>en</strong>t bij elke patiënt standaard toegepast te word<strong>en</strong>. In de richtlijn<br />
Detecter<strong>en</strong> van behoefte aan psychosociale zorg [IKNL 2010] wordt e<strong>en</strong><br />
signaleringsinstrum<strong>en</strong>t (de Lastmeter) aanbevol<strong>en</strong>.<br />
Bij het galblaas/galwegcarcinoom kan tev<strong>en</strong>s gedacht word<strong>en</strong> aan symptoomregistratie.<br />
Hierbij di<strong>en</strong>t gefocust te word<strong>en</strong> op klacht<strong>en</strong> van obstructie icterus: jeuk, ontkleurde ontlasting,<br />
donkere urine, koorts (>38,5) <strong>en</strong> koude rilling<strong>en</strong>. Hierbij kan gebruik gemaakt word<strong>en</strong> van het<br />
dagboek jeuk registratie (IKNL), de Lastmeter, Jeuk score (bv VAS score), e<strong>en</strong> score om de<br />
voedingstoestand te met<strong>en</strong> (bv Must score), met<strong>en</strong> van pijnklacht<strong>en</strong> (bv VAS-pijnscore) <strong>en</strong><br />
gebruik mak<strong>en</strong> van het Nazorgplan (zie bijlage).<br />
De gespecialiseerde verpleegkundige (oncologie of mdl verpleegkundige) danwel<br />
verpleegkundig specialist kan deze signaler<strong>en</strong>de functie overnem<strong>en</strong> van de medisch<br />
specialist. Zij heeft daarin tev<strong>en</strong>s e<strong>en</strong> belangrijke taak de mantelzorger van de patiënt voor te<br />
licht<strong>en</strong> over welke observaties van belang zijn bij de patiënt.<br />
<strong>Richtlijn</strong><strong>en</strong> voor ondersteun<strong>en</strong>de zorg<br />
Naast de in 7.1 g<strong>en</strong>oemde niet tumorspecifieke richtlijn<strong>en</strong> op het gebied van nazorg, zijn er<br />
diverse andere richtlijn<strong>en</strong> die adequate nazorg ondersteun<strong>en</strong>. Deze richtlijn<strong>en</strong> (bijvoorbeeld op<br />
de gebied<strong>en</strong> palliatieve zorg, pijn, verpleegkundige zorg <strong>en</strong> voeding) zijn terug te vind<strong>en</strong> op<br />
www.oncoline.nl onder de niet-tumorspecifieke richtlijn<strong>en</strong>.<br />
Aanbeveling<strong>en</strong><br />
Vroege gevolg<strong>en</strong><br />
De vroege gevolg<strong>en</strong> van galblaas / galwegcarcinoom (zowel fysiek als psychosociaal) verg<strong>en</strong><br />
e<strong>en</strong> systematische aanpak. Deze bestaat uit:<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 41 van 75<br />
11 juli 2012
1577<br />
1578<br />
1579<br />
1580<br />
1581<br />
1582<br />
1583<br />
1584<br />
1585<br />
1586<br />
1587<br />
1588<br />
1589<br />
1590<br />
1591<br />
1592<br />
1593<br />
1594<br />
1595<br />
1596<br />
1597<br />
1598<br />
1599<br />
1600<br />
1601<br />
1602<br />
1603<br />
1604<br />
1605<br />
1606<br />
1607<br />
1608<br />
1609<br />
1610<br />
1611<br />
1612<br />
1613<br />
1614<br />
1615<br />
1616<br />
1617<br />
1618<br />
1619<br />
1620<br />
1621<br />
1622<br />
1623<br />
1624<br />
1625<br />
1626<br />
• informer<strong>en</strong> van de patiënt <strong>en</strong> naast<strong>en</strong> over de mogelijke klacht<strong>en</strong> <strong>en</strong> behandeling<strong>en</strong> van<br />
galwegobstructie door middel van geschrev<strong>en</strong> informatie (obstructie klacht<strong>en</strong>, koorts, pijn,<br />
gewichtsverlies);<br />
• behandel<strong>en</strong> van de galwegobstructie door middel van ERCP danwel PTC, afhankelijk van<br />
de setting (curatief / palliatief) / locatie van de tumor;<br />
• regelmatig signaler<strong>en</strong> van de vroege psychosociale <strong>en</strong> fysieke gevolg<strong>en</strong> van<br />
galblaas/galwegcarcinoom met behulp van (gevalideerde) signaleringsinstrum<strong>en</strong>t<strong>en</strong>,<br />
start<strong>en</strong>d vanaf diagnose (Lastmeter, jeuk anamnese, voedingsanamnese);<br />
• patiënt e<strong>en</strong> duidelijk aanspreekpunt gev<strong>en</strong> bij fysieke / psychosociale klacht<strong>en</strong> (voorkeur<br />
verpleegkundig specialist danwel gespecialiseerde verpleegkundige);<br />
• duidelijk afsprek<strong>en</strong> op welke locatie behandeling van galwegobstructie plaatsvindt (eig<strong>en</strong><br />
c<strong>en</strong>trum danwel expertise c<strong>en</strong>trum);<br />
• patiënt verwijz<strong>en</strong> bij lastmeter score bov<strong>en</strong> de 5 naar betreff<strong>en</strong>de discipline.<br />
Heroverweging na één jaar <strong>en</strong> informatie over late gevolg<strong>en</strong><br />
• Verk<strong>en</strong> één jaar na afronding van de primaire behandeling van galblaas /<br />
galwegcarcinoom de rester<strong>en</strong>de gevolg<strong>en</strong> van (de behandeling van) galblaas /<br />
galwegcarcinoom <strong>en</strong> de behoefte aan nazorg hierbij, <strong>en</strong> sluit het nazorgtraject zo mogelijk<br />
af. Zonodig kan dit leid<strong>en</strong> tot e<strong>en</strong> deelsc<strong>en</strong>ario voor nazorg of tot verwijzing.<br />
• Geef bij het afsluit<strong>en</strong> van de nazorg de patiënt <strong>en</strong> zijn huisarts goede voorlichting <strong>en</strong><br />
instructie over mogelijke late gevolg<strong>en</strong> <strong>en</strong> hoe daarmee om te gaan (galwegobstructie<br />
klacht<strong>en</strong>, koorts, jeuk, ascites, gewichtsverlies, vermoeidheid, passageklacht<strong>en</strong>, pijn).<br />
Informeer de patiënt bij welke zorgverl<strong>en</strong>er hij bij het optred<strong>en</strong> van klacht<strong>en</strong> terecht kan <strong>en</strong><br />
neem dit op in het nazorgplan.<br />
• Zorg voor overdracht naar de huisarts.<br />
Individueel nazorgplan<br />
• Geadviseerd wordt om voor elke patiënt e<strong>en</strong> individueel nazorgplan te mak<strong>en</strong> dat is<br />
afgestemd op zijn restklacht<strong>en</strong> <strong>en</strong> behoeft<strong>en</strong>.<br />
• Het nazorgplan wordt ingezet, t<strong>en</strong>minste op de volg<strong>en</strong>de mom<strong>en</strong>t<strong>en</strong>: bij ontslag uit het<br />
ziek<strong>en</strong>huis, bij de afronding van de primaire kankerbehandeling, bij heroverweging van de<br />
nazorg één jaar na afronding van de behandeling, <strong>en</strong> indi<strong>en</strong> wijziging<strong>en</strong> optred<strong>en</strong> in de<br />
medisch <strong>en</strong>/of psychosociale situatie van de patiënt of andere mom<strong>en</strong>t<strong>en</strong> van<br />
heroverweging van de nazorg.<br />
• Geadviseerd wordt om het nazorgplan van de patiënt op te nem<strong>en</strong> in elektronische<br />
databases <strong>en</strong> dossiers <strong>en</strong> te gebruik<strong>en</strong> voor interdisciplinaire overdracht, onder aandere.<br />
naar de huisarts.<br />
7.3 Detectie nieuwe kankermanifestaties<br />
Literatuurbespreking<br />
Er bestaat ge<strong>en</strong> literatuur die welke vorm van follow-up na resectie van e<strong>en</strong> galweg- of<br />
galblaascarcinoom beschrijft of ondersteunt. Follow-up gericht op het diagnosticer<strong>en</strong> van e<strong>en</strong><br />
recidief galblaascarcinoom, recidief proximaal galwegcarcinoom of metastas<strong>en</strong> daarvan, is niet<br />
zinvol. Bij e<strong>en</strong> recidief tumor van e<strong>en</strong> galblaas / galwegcarcinoom is er ge<strong>en</strong> winst te behal<strong>en</strong><br />
in duur of kwaliteit van lev<strong>en</strong> door vroege detectie van nieuwe tumor manifestaties met<br />
curatieve behandeling <strong>en</strong> vroegdetectie leidt niet tot verandering van het behandelplan. De<br />
follow-up di<strong>en</strong>t gericht te zijn op de kwaliteit van lev<strong>en</strong> van de individuele patiënt. Wanneer e<strong>en</strong><br />
patiënt klacht<strong>en</strong> krijgt, is diagnostiek te overweg<strong>en</strong> indi<strong>en</strong> dit mogelijk consequ<strong>en</strong>ties heeft<br />
voor de palliatieve behandeling.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 42 van 75<br />
11 juli 2012
1627<br />
1628<br />
1629<br />
1630<br />
1631<br />
1632<br />
1633<br />
1634<br />
1635<br />
1636<br />
1637<br />
1638<br />
1639<br />
1640<br />
1641<br />
1642<br />
1643<br />
1644<br />
1645<br />
1646<br />
1647<br />
1648<br />
1649<br />
1650<br />
1651<br />
1652<br />
1653<br />
1654<br />
1655<br />
1656<br />
1657<br />
1658<br />
1659<br />
1660<br />
1661<br />
1662<br />
1663<br />
1664<br />
1665<br />
1666<br />
1667<br />
1668<br />
1669<br />
1670<br />
1671<br />
1672<br />
1673<br />
Voorlichting noodzakelijk<br />
Het rapport van de Gezondheidsraad geeft aan dat er structurele aandacht moet zijn voor<br />
g<strong>en</strong>uanceerde voorlichting over de mogelijkhed<strong>en</strong> <strong>en</strong> beperking<strong>en</strong> van vroege detectie van<br />
nieuwe manifestaties van kanker. Eerlijkheid over de beperking<strong>en</strong> verdi<strong>en</strong>t de voorkeur bov<strong>en</strong><br />
het zinloos opspor<strong>en</strong> van onbehandelbare ziekte. Het voorkomt valse hoop <strong>en</strong> gaat onnodige<br />
medicalisering teg<strong>en</strong>.<br />
Aanbeveling<strong>en</strong><br />
Er is onvoldo<strong>en</strong>de wet<strong>en</strong>schappelijk bewijs dat vroege detectie van nieuwe manifestaties van<br />
kanker leidt tot winst in duur of kwaliteit van lev<strong>en</strong> bij e<strong>en</strong> galblaas / galwegcarcinoom.<br />
Informeer de patiënt over de mogelijkhed<strong>en</strong> <strong>en</strong> beperking<strong>en</strong> van vroege detectie van nieuwe<br />
manifestaties van kanker. Eerlijkheid over de beperking<strong>en</strong> verdi<strong>en</strong>t de voorkeur bov<strong>en</strong> het<br />
zinloos opspor<strong>en</strong> van onbehandelbare ziekte. Het voorkomt valse hoop <strong>en</strong> gaat onnodige<br />
medicalisering teg<strong>en</strong>.<br />
7.4 Organisatie van nazorg bij galblaas/ galwegcarcinoom<br />
Literatuurbespreking<br />
Oncologische zorg is bij uitstek multidisciplinaire zorg, die voor de herstelfase deels vanuit de<br />
kliniek <strong>en</strong> deels in de eerste- of derdelijnsinstelling<strong>en</strong> gebod<strong>en</strong> wordt. Er blijkt ge<strong>en</strong> e<strong>en</strong>duidig<br />
bewijs voor de beste taakverdeling (nazorg aangebod<strong>en</strong> door de specialist, e<strong>en</strong> nurse<br />
practitioner of huisarts) <strong>en</strong> aanpak in de nazorg (persoonlijke <strong>en</strong> telefonische consult<strong>en</strong>). De<br />
behoeft<strong>en</strong> van patiënt<strong>en</strong> blijk<strong>en</strong> ook divers.<br />
De Gezondheidsraad geeft aan dat de nazorg na de behandeling weg<strong>en</strong>s kanker beter moet<br />
word<strong>en</strong> gecoördineerd. Dit sluit aan bij de aanbeveling<strong>en</strong> van de Inspectie van de<br />
Gezondheidszorg voor de kwaliteit van de oncologische zorgket<strong>en</strong> [IGZ 2009]. De<br />
behandelaar <strong>en</strong> overige hulpverl<strong>en</strong>ers sprek<strong>en</strong> bij de afronding van de tumorgerichte<br />
behandeling onderling <strong>en</strong> met de patiënt af wie de coördinatie van de (continuïteit van) nazorg<br />
op zich neemt. Het nazorgplan voor de patiënt kan funger<strong>en</strong> als middel voor de overdracht van<br />
zorg tuss<strong>en</strong> de zorgverl<strong>en</strong>ers betrokk<strong>en</strong> in de oncologische zorglijn.<br />
Aanbeveling<strong>en</strong><br />
Maak afsprak<strong>en</strong> over de taakverdeling<strong>en</strong> voor de nazorg, die gebod<strong>en</strong> wordt in het ziek<strong>en</strong>huis,<br />
de eerste- of derdelijnsinstelling<strong>en</strong>.<br />
Zorg ervoor dat bij de afronding van primaire behandeling voor de nazorg e<strong>en</strong> vaste<br />
contactpersoon voor iedere patiënt aangesteld wordt. Spreek dit multidisciplinair af in het team<br />
<strong>en</strong> met de huisarts.<br />
Informeer e<strong>en</strong> patiënt wie de vaste contactpersoon in de nazorg voor hem is. Leg dit vast in<br />
het nazorgplan voor de patiënt.<br />
Zorg voor regelmatige interdisciplinaire overdracht van informatie, zeker ook naar de huisarts,<br />
bijv. via het nazorgplan van de patiënt.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 43 van 75<br />
11 juli 2012
1674<br />
1675<br />
1676<br />
1677<br />
1678<br />
1679<br />
1680<br />
1681<br />
1682<br />
1683<br />
1684<br />
1685<br />
1686<br />
1687<br />
1688<br />
1689<br />
1690<br />
1691<br />
1692<br />
1693<br />
1694<br />
1695<br />
1696<br />
1697<br />
1698<br />
1699<br />
1700<br />
1701<br />
1702<br />
1703<br />
1704<br />
1705<br />
1706<br />
1707<br />
1708<br />
1709<br />
1710<br />
1711<br />
1712<br />
1713<br />
1714<br />
1715<br />
1716<br />
1717<br />
1718<br />
1719<br />
1720<br />
1721<br />
1722<br />
1723<br />
H8 Organisatie van Zorg<br />
Literatuurbespreking<br />
De medische zorg bij patiënt<strong>en</strong> met e<strong>en</strong> proximaal gelokaliseerd galwegcarcinoom is complex<br />
<strong>en</strong> omvat:<br />
• de differ<strong>en</strong>tiële diagnostiek<br />
• stadiering<br />
• preoperatieve of palliatieve drainage van de galweg<strong>en</strong> (via <strong>en</strong>doscopische of percutane<br />
route)<br />
• preoperatieve v<strong>en</strong>a porta embolisatie<br />
• chirurgische resectie<br />
• chemo(radio)therapeutische behandeling<br />
Dit brede scala van aandachtpunt<strong>en</strong> <strong>en</strong> inzet van verschill<strong>en</strong>de medische techniek<strong>en</strong> vereist<br />
de input <strong>en</strong> betrokk<strong>en</strong>heid van e<strong>en</strong> toegewijd multidisciplinair oncologisch team bestaande uit:<br />
• e<strong>en</strong> (interv<strong>en</strong>tie-)MDL arts<br />
• e<strong>en</strong> (interv<strong>en</strong>tie-) radioloog<br />
• e<strong>en</strong> hepato-pancreato-biliaire (HPB) chirurg<br />
• e<strong>en</strong> oncoloog<br />
Interv<strong>en</strong>ties bij proximaal gelokaliseerde galwegcarcinom<strong>en</strong> zoals ERCP of percutane<br />
drainage <strong>en</strong> in het bijzonder chirurgische resectie zijn hoog complexe ingrep<strong>en</strong>. Er is<br />
wet<strong>en</strong>schappelijk vastgesteld dat conc<strong>en</strong>tratie van zorg in hoog volume c<strong>en</strong>tra leidt tot<br />
significant betere uitkomst<strong>en</strong> bij hoog complexe chirurgische ingrep<strong>en</strong> zoals pancreas<br />
[Lemm<strong>en</strong>s 2011, Gooik<strong>en</strong>s 2011, van Heek 2005] <strong>en</strong> slokdarm resecties [Markar 2011]. Er is<br />
ge<strong>en</strong> red<strong>en</strong> om aan te nem<strong>en</strong> dat dit anders is voor complexe interv<strong>en</strong>ties zoals leverresecties<br />
bij proximale galwegcarcinom<strong>en</strong>. Om deze red<strong>en</strong> is door de Nederlandse Ver<strong>en</strong>iging van<br />
Heelkunde ook e<strong>en</strong> leverresectie geclassificeerd als e<strong>en</strong> hoog complexe laagvolume<br />
chirurgische behandeling waarvoor kwalitatieve voorwaard<strong>en</strong> voor de zorginstelling word<strong>en</strong><br />
g<strong>en</strong>oemd, aangevuld met e<strong>en</strong> volum<strong>en</strong>orm van minimaal 20 chirurgische behandeling<strong>en</strong> per<br />
jaar [Nederlandse Ver<strong>en</strong>iging van Heelkunde 2011].<br />
Omdat het proximaal gelokaliseerd galwegcarcinoom e<strong>en</strong> relatief zeldzame tumor betreft met<br />
e<strong>en</strong> geschatte incid<strong>en</strong>tie van 1-2/100.000, treft de ziekte in Nederland e<strong>en</strong> beperkt aantal van<br />
ongeveer 170-340 patiënt<strong>en</strong> per jaar. E<strong>en</strong> minderheid van de patiënt<strong>en</strong> komt in aanmerking<br />
voor e<strong>en</strong> in opzet curatieve resectie. Deze getall<strong>en</strong> mak<strong>en</strong> inzichtelijk dat, om <strong>en</strong>ige expertise<br />
in de behandeling van deze patiënt<strong>en</strong> te verkrijg<strong>en</strong>, het zeer w<strong>en</strong>selijk is deze zorg te<br />
conc<strong>en</strong>trer<strong>en</strong>.<br />
Nog zeldzamer dan het proximale galwegcarcinoom is het galblaascarcinoom met e<strong>en</strong><br />
geschatte incid<strong>en</strong>tie 0,7-1/100.000 (100-170 patiënt<strong>en</strong> per jaar). In de meeste gevall<strong>en</strong> betreft<br />
het e<strong>en</strong> bij toeval gevond<strong>en</strong> galblaascarcinoom bij e<strong>en</strong> patiënt die e<strong>en</strong> cholecystectomie<br />
onderging vanwege galwegst<strong>en</strong><strong>en</strong>. Wanneer e<strong>en</strong> galblaascarcinoom zich klinisch<br />
manifesteert, bijvoorbeeld met icterus, gaat het meestal om e<strong>en</strong> gevorderde tumor waarbij<br />
curatieve resectie niet mogelijk is. Ev<strong>en</strong>tuele chirurgische interv<strong>en</strong>tie omvat e<strong>en</strong> oncologische<br />
resectie met ev<strong>en</strong>tuele partiële leverresectie (<strong>en</strong> lymfklierdissectie) waardoor ook dergelijke<br />
ingrep<strong>en</strong> moet<strong>en</strong> word<strong>en</strong> beschouwd als hoog complexe laagvolume chirurgische<br />
behandeling.<br />
Conclusies<br />
Het is aangetoond dat conc<strong>en</strong>tratie van zorg van hoog complexe laagvolume chirurgische<br />
behandeling in hoog volume c<strong>en</strong>tra leidt tot significant betere uitkomst<strong>en</strong>.<br />
[Lemm<strong>en</strong>s 2011; Gooik<strong>en</strong>s 2011; Van Heek 2005; Markar 2011<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 44 van 75<br />
11 juli 2012
1724<br />
1725<br />
1726<br />
1727<br />
1728<br />
1729<br />
1730<br />
1731<br />
1732<br />
1733<br />
1734<br />
1735<br />
1736<br />
1737<br />
1738<br />
1739<br />
1740<br />
1741<br />
1742<br />
1743<br />
1744<br />
1745<br />
1746<br />
1747<br />
1748<br />
1749<br />
1750<br />
1751<br />
1752<br />
Leverresecties zijn de door de Nederlandse Ver<strong>en</strong>iging voor Heelkunde geclassificeerd als<br />
e<strong>en</strong> hoog complexe laagvolume chirurgische behandeling waarvoor kwalitatieve voorwaard<strong>en</strong><br />
voor de zorginstelling word<strong>en</strong> g<strong>en</strong>oemd, aangevuld met e<strong>en</strong> volum<strong>en</strong>orm van minimaal 20<br />
chirurgische behandeling<strong>en</strong> per jaar.<br />
[Nederlandse Ver<strong>en</strong>iging van Heelkunde 2011]<br />
Overige overweging<strong>en</strong><br />
Gezi<strong>en</strong> de complexiteit van de ingreep, waarbij e<strong>en</strong> leverresectie slechts e<strong>en</strong> onderdeel is van<br />
de behandeling, lijkt het aannemelijk <strong>en</strong> redelijk om ook voor de chirurgische behandeling van<br />
het proximale galwegcarcinoom te strev<strong>en</strong> naar c<strong>en</strong>tralisatie <strong>en</strong> e<strong>en</strong> minimale volume norm<br />
van 20 chirurgische behandeling<strong>en</strong> per jaar.<br />
Vanwege de lage incid<strong>en</strong>tie van het proximaal gelokaliseerde galwegcarcinoom <strong>en</strong> de<br />
complexiteit van differ<strong>en</strong>tieel diagnostische <strong>en</strong> preoperatieve zorg, inclusief preoperatieve<br />
galwegdrainage <strong>en</strong> ev<strong>en</strong>tuele v<strong>en</strong>a porta embolisatie, is het w<strong>en</strong>selijk de zorg van dergelijke<br />
patiënt<strong>en</strong> te conc<strong>en</strong>trer<strong>en</strong> in die c<strong>en</strong>tra waar tev<strong>en</strong>s de operatie plaats vindt.<br />
Vanwege de lage incid<strong>en</strong>tie van het symptomatische galblaascarcinoom <strong>en</strong> de mogelijke<br />
indicatie tot e<strong>en</strong> re-resectie in geval van e<strong>en</strong> bij toeval ontdekt galblaascarcinoom in het<br />
resectie preparaat, waarbij e<strong>en</strong> kans bestaat dat in het kader van e<strong>en</strong> oncologische resectie<br />
e<strong>en</strong> partiële leverresectie noodzakelijk is, moet<strong>en</strong> dergelijke ingrep<strong>en</strong> word<strong>en</strong> beschouwd als<br />
hoog complexe laagvolume chirurgische behandeling waarvoor behandeling is aangewez<strong>en</strong> in<br />
e<strong>en</strong> c<strong>en</strong>trum.<br />
Aanbeveling<br />
De werkgroep is van m<strong>en</strong>ing dat de behandeling van het galblaascarcinoom <strong>en</strong> het<br />
galwegcarcinoom di<strong>en</strong>t plaats vind<strong>en</strong> in e<strong>en</strong> hooggespecialiseerd c<strong>en</strong>trum.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 45 van 75<br />
11 juli 2012
1753<br />
1754<br />
1755<br />
1756<br />
1757<br />
1758<br />
1759<br />
1760<br />
1761<br />
1762<br />
H 9 Palliatieve zorg<br />
Er wordt verwez<strong>en</strong> naar de richtlijn palliatieve zorg op www.pallialine.nl<br />
H10 Implem<strong>en</strong>tatie <strong>en</strong> evaluatie<br />
Tekst volgt<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 46 van 75<br />
11 juli 2012
1763<br />
1764<br />
1765<br />
1766<br />
1767<br />
1768<br />
1769<br />
1770<br />
1771<br />
1772<br />
1773<br />
1774<br />
1775<br />
1776<br />
1777<br />
1778<br />
1779<br />
1780<br />
1781<br />
1782<br />
1783<br />
1784<br />
1785<br />
1786<br />
1787<br />
1788<br />
1789<br />
1790<br />
1791<br />
1792<br />
1793<br />
1794<br />
1795<br />
1796<br />
1797<br />
1798<br />
1799<br />
1800<br />
1801<br />
1802<br />
1803<br />
1804<br />
1805<br />
1806<br />
1807<br />
1808<br />
1809<br />
1810<br />
1811<br />
1812<br />
1813<br />
1814<br />
1815<br />
1816<br />
H 11 TNM Classificatie <strong>en</strong> Classificatie van Bismuth<br />
11.1. TNM Classificatie<br />
In 2009 versche<strong>en</strong> de zev<strong>en</strong>de editie van de TNM Classification of Malignant Tumours.<br />
<strong>Galblaascarcinoom</strong><br />
Gallbladder (ICD-O C23)<br />
Rules for Classification<br />
The classification applies to carcinomas of gallbladder and cystic dust. There should be<br />
histological confirmation of the disease.<br />
The following are the procedures for assessing T, N, and M categories:<br />
T categories Physical examination, imaging, and/or surgical exploration<br />
N categories Physical examination, imaging, and/or surgical exploration<br />
M categories Physical examination, imaging, and/or surgical exploration<br />
Regional Lymph Nodes<br />
Regional lymph nodes are the hepatic hilus nodes (including nodes along the common bile<br />
duct, common hepatic artery, portal vein, and cystic duct).<br />
Coeliac, periduod<strong>en</strong>al, peripancreatic, and superior mes<strong>en</strong>teric artery node involvem<strong>en</strong>t is<br />
considered distant metastasis (M1).<br />
T - Primary Tumour (zie figuur hoofdstuk chirurgische behandeling galblaascarcinoom)<br />
TX Primary tumour cannot be assessed<br />
T0 No evid<strong>en</strong>ce of primary tumour<br />
Tis Carcinoma in situ<br />
T1 Tumour invades lamina propria or muscular layer<br />
T1a Tumour invades lamina propria<br />
T1b Tumour invades muscular layer<br />
T2 Tumour invades perimuscular connective tissue; no ext<strong>en</strong>sion beyond serosa or into<br />
liver<br />
T3 Tumour perforates the serosa (visceral peritoneum) and/or directly invades the liver<br />
and/or one other adjac<strong>en</strong>t organ or structure, such as stomach, duod<strong>en</strong>um, colon,<br />
pancreas, om<strong>en</strong>tum, extrahepatic bile ducts<br />
T4 Tumour invades main portal vein or hepatic artery or invades two or more extrahepatic<br />
organs or structures<br />
N - Regional Lymph Nodes<br />
NX Regional lymph nodes cannot be assessed<br />
N0 No regional lymph node metastasis<br />
N1 Regional lymph node metastasis (including nodes along the cystic duct, common bile<br />
duct, common hepatic artery, and portal vein)<br />
M - Distant Metastasis<br />
M0 No distant metastasis<br />
M1 Distant metastasis<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 47 van 75<br />
11 juli 2012
1817<br />
1818<br />
1819<br />
1820<br />
1821<br />
1822<br />
1823<br />
1824<br />
1825<br />
1826<br />
1827<br />
1828<br />
1829<br />
1830<br />
1831<br />
1832<br />
1833<br />
1834<br />
1835<br />
1836<br />
1837<br />
1838<br />
1839<br />
1840<br />
1841<br />
1842<br />
1843<br />
1844<br />
1845<br />
1846<br />
1847<br />
1848<br />
1849<br />
1850<br />
1851<br />
1852<br />
1853<br />
1854<br />
1855<br />
1856<br />
1857<br />
1858<br />
1859<br />
1860<br />
1861<br />
1862<br />
1863<br />
1864<br />
1865<br />
1866<br />
1867<br />
1868<br />
1869<br />
1870<br />
pTNM Pathological Classification<br />
The pT <strong>en</strong> pN categories correspond to the T and N categories.<br />
pM1 Distant metastasis microscopically confirmed<br />
pM0 and pMX are not valid categories.<br />
G Histopathological Grading<br />
GX Grade of differ<strong>en</strong>tiation cannot be assessed<br />
G1 Well differ<strong>en</strong>tiated<br />
G2 Moderately differ<strong>en</strong>tiated<br />
G3 Poorly differ<strong>en</strong>tiated<br />
G4 Undiffer<strong>en</strong>tiated<br />
Stage Grouping<br />
Stage 0 Tis N0 M0<br />
Stage I T1 N0 M0<br />
Stage II T2 N0 M0<br />
Stage IIIA T3 N0 M0<br />
Stage IIIB T1, T2, T3 N1 M0<br />
Stage IVA T4 Any N M0<br />
Stage IVB Any T Any N M1<br />
Summary<br />
T1 Lamina propria or muscular layer<br />
T1a Lamina propria<br />
T1b Muscular layer<br />
T2 Perimuscular connective tissue<br />
T3 Serosa, one organ, and/or liver<br />
T4 Portal vein, hepatic artery, or two or more extrahepatic organs<br />
N1 Along cystic duct, common bile duct, common hepatic artery, portal vein<br />
<strong>Galweg</strong>carcinoom (proximaal)<br />
Extrahepatic Bile Ducts – Perihilair (ICD-O C24.0)<br />
Rules for Classification<br />
The classification applies to carcinomas of the extrahepatic bile ducts of perihilair localization<br />
(Klatskin tumour). Included are the right, left, and the common hepatic ducts.<br />
The following are the procedures for assessing T, N, and M categories:<br />
T categories Physical examination, imaging, and/or surgical exploration<br />
N categories Physical examination, imaging, and/or surgical exploration<br />
M categories Physical examination, imaging, and/or surgical exploration<br />
Anatomical Sites and Subsites<br />
Perihilair cholangiocarcinomas are tumours located in the extrahepatic biliary tree<br />
proximal to the origin of the cystic dust.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 48 van 75<br />
11 juli 2012
1871<br />
1872<br />
1873<br />
1874<br />
1875<br />
1876<br />
1877<br />
1878<br />
1879<br />
1880<br />
1881<br />
1882<br />
1883<br />
1884<br />
1885<br />
1886<br />
1887<br />
1888<br />
1889<br />
1890<br />
1891<br />
1892<br />
1893<br />
1894<br />
1895<br />
1896<br />
1897<br />
1898<br />
1899<br />
1900<br />
1901<br />
1902<br />
1903<br />
1904<br />
1905<br />
1906<br />
1907<br />
1908<br />
1909<br />
1910<br />
1911<br />
1912<br />
1913<br />
1914<br />
1915<br />
1916<br />
1917<br />
1918<br />
1919<br />
1920<br />
1921<br />
1922<br />
1923<br />
1924<br />
Regional Lymph Nodes<br />
The regional nodes are the hilar and pericholedochal nodes in the hepatoduod<strong>en</strong>al<br />
ligam<strong>en</strong>t.<br />
TNM Classification<br />
T - Primary Tumour<br />
TX Primary tumour cannot be assessed<br />
T0 No evid<strong>en</strong>ce of primary tumour<br />
Tis Carcinoma in situ<br />
T1 Tumour confined to the bile duct, with ext<strong>en</strong>sion up to the muscle layer or fibrous<br />
tissue<br />
T2a Tumour invades beyond the wall of the bile duct to surrounding adipose tissue<br />
T2b Tumour invades adjac<strong>en</strong>t hepatic par<strong>en</strong>chyma<br />
T3 Tumour invades unilateral branches of the portal vein or hepatic artery<br />
T4 Tumour invades the main portal vein or its branches bilaterally; or the common hepatic<br />
artery; or the second-order biliary radicals bilaterally; or unilateral second-order biliary<br />
radicals with contralateral portal vein or hepatic artery involvem<strong>en</strong>t<br />
N - Regional Lymph Nodes<br />
NX Regional lymph nodes cannot be assessed<br />
N0 No regional lymph node metastasis<br />
N1 Regional lymph node metastasis including nodes along the cystic duct, common bile<br />
duct, common hepatic artery, and portal vein<br />
M - Distant Metastasis<br />
M0 No distant metastasis<br />
M1 Distant metastasis<br />
pTNM Pathological Classification<br />
The pT <strong>en</strong> pN categories correspond to the T and N categories.<br />
pN0 Histological examination of a regional lymphad<strong>en</strong>ectomy specim<strong>en</strong> will ordinarily<br />
include 15 or more lymph nodes. If the regional lymph nodes are negative, but the<br />
number ordinarily examined is not met, classify as pN0<br />
pM1 Distant metastasis microscopically confirmed<br />
pM0 and pMX are not valid categories.<br />
G Histopathological Grading<br />
GX Grade of differ<strong>en</strong>tiation cannot be assessed<br />
G1 Well differ<strong>en</strong>tiated<br />
G2 Moderately differ<strong>en</strong>tiated<br />
G3 Poorly differ<strong>en</strong>tiated<br />
G4 Undiffer<strong>en</strong>tiated<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 49 van 75<br />
11 juli 2012
1925<br />
1926<br />
1927<br />
1928<br />
1929<br />
1930<br />
1931<br />
1932<br />
1933<br />
1934<br />
1935<br />
1936<br />
1937<br />
1938<br />
1939<br />
1940<br />
1941<br />
1942<br />
1943<br />
1944<br />
1945<br />
1946<br />
1947<br />
1948<br />
1949<br />
1950<br />
1951<br />
Stage Grouping<br />
Stage 0 Tis N0 M0<br />
Stage I T1 N0 M0<br />
Stage II T2a, T2b N0 M0<br />
Stage IIIA T3 N0 M0<br />
Stage IIIB T1, T2, T3 N1 M0<br />
Stage IVA T4 N0, N1 M0<br />
Stage IVB Any T Any N M1<br />
Summary<br />
T1 Ductal wall<br />
T2a Beyond ductal wall<br />
T2b Adjac<strong>en</strong>t hepatic par<strong>en</strong>chyma<br />
T3 Unilateral branches of portal vein or hepatic artery<br />
T4 Main portal vein; bilateral branches; common hepatic artery; second-order biliary<br />
radicals bilaterally; unilateral second-order biliary radicals with contralateral portal vein<br />
or hepatic artery involvem<strong>en</strong>t<br />
N1 Nodes along cystic duct, common bile duct, common hepatic artery, portal vein<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 50 van 75<br />
11 juli 2012
1952<br />
1953<br />
1954<br />
1955<br />
1956<br />
1957<br />
1958<br />
1959<br />
1960<br />
11.2 Classificatie van Bismuth Corlette<br />
Classificatie van proximale galwegcarcinom<strong>en</strong> (klatskin-tumor<strong>en</strong>) volg<strong>en</strong>s Bismuth-<br />
Corlette [Van de Velde 2005].<br />
type I tumor juist distaal van de conflu<strong>en</strong>s van rechter <strong>en</strong> linker d. hepaticus;<br />
type II tumor reikt voorbij de conflu<strong>en</strong>s tot in de linker <strong>en</strong> rechter d. hepaticus;<br />
type doorgroei van de tumor tot in de tweede segm<strong>en</strong>tele splitsing van de linker (IIIb) of<br />
III rechter (IIIa) d. hepaticus in de lever;<br />
type doorgroei van de tumor tot in de tweede segm<strong>en</strong>tele splitsing van de linker <strong>en</strong> rechter<br />
IV d. hepaticus in de lever.<br />
:<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 51 van 75<br />
11 juli 2012
1961<br />
1962<br />
1963<br />
1964<br />
1965<br />
1966<br />
H 12 Bijlag<strong>en</strong><br />
BIJLAGE 1 Led<strong>en</strong> van de werkgroep<br />
Naam Functie Werkplek Ver<strong>en</strong>iging<br />
Prof. dr. T.M. van Gulik<br />
voorzitter<br />
prof.dr. M.J. Bruno<br />
Mw. prof.dr. A.S.H. Gouw<br />
Dr. E. v.d. Lind<strong>en</strong><br />
Mw. dr. I.D. Nagtegaal,<br />
Mw. A. Ormeling<br />
Mw. C. Pek<br />
Prof. dr. D.J. Richel<br />
H.J. Roelants<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 52 van 75<br />
11 juli 2012<br />
Chirurg AMC, Amsterdam NVVH<br />
MDL-arts EMC, Rotterdam NVMDL<br />
Patholoog UMCG, Groning<strong>en</strong> NVVP<br />
Radioloog MCH, D<strong>en</strong> Haag NVR<br />
Patholoog UMC St Radboud,<br />
Nijmeg<strong>en</strong><br />
NVVP<br />
Patiënt<strong>en</strong>verteg<strong>en</strong>woordiger NFK NFK<br />
Nurse-practioner EMC, Rotterdam V&VN<br />
Internist-oncoloog AMC, Amsterdam NIV<br />
NFK NFK<br />
Mw. A. Schoorlemmer Verpleegkundig consul<strong>en</strong>t AMC, Amsterdam V&VN<br />
Dr. E. Sieders<br />
Dr. G. van Ti<strong>en</strong>hov<strong>en</strong>,<br />
drs. J.J.F. de Groot<br />
procesbegeleider<br />
Mw. S. Janss<strong>en</strong>-van Dijk<br />
Chirurg UMCG, Groning<strong>en</strong> NVVH<br />
Radiotherapeut-oncoloog AMC, Amsterdam NVRO<br />
Adviseur richtlijn<strong>en</strong><br />
IKNL loc. Maastricht<br />
Secretaresse IKNL loc. Rotterdam
1967<br />
1968<br />
1969<br />
1970<br />
1971<br />
1972<br />
1973<br />
1974<br />
1975<br />
1976<br />
1977<br />
1978<br />
1979<br />
1980<br />
1981<br />
1982<br />
1983<br />
1984<br />
1985<br />
1986<br />
1987<br />
1988<br />
1989<br />
1990<br />
1991<br />
1992<br />
1993<br />
1994<br />
1995<br />
1996<br />
1997<br />
1998<br />
1999<br />
2000<br />
2001<br />
BIJLAGE 2 Onafhankelijkheid werkgroepled<strong>en</strong><br />
Alle led<strong>en</strong> van de richtlijnwerkgroep hebb<strong>en</strong> door middel van het invull<strong>en</strong> van e<strong>en</strong><br />
belang<strong>en</strong>verklaring verklaard onafhankelijk gehandeld te hebb<strong>en</strong> bij het opstell<strong>en</strong> van de<br />
richtlijn.<br />
BIJLAGE 3 Betrokk<strong>en</strong> ver<strong>en</strong>iging<strong>en</strong>/instanties<br />
Initiatief <strong>en</strong> organisatie<br />
Integraal Kankerc<strong>en</strong>trum Nederland<br />
Mandater<strong>en</strong>de ver<strong>en</strong>iging<strong>en</strong>/instanties<br />
Nederlandse Federatie van Kankerpatiënt<strong>en</strong>organisaties (NFK)<br />
Nederlandse Internist<strong>en</strong> Ver<strong>en</strong>iging (NIV)<br />
Nederlandse Leverpatiënt<strong>en</strong> Ver<strong>en</strong>iging<br />
Nederlandse Ver<strong>en</strong>iging voor Heelkunde (NVVH)<br />
Nederlandse Ver<strong>en</strong>iging van Maag-Darm-Leverarts<strong>en</strong> (NVMDL)<br />
Nederlandse Ver<strong>en</strong>iging voor Pathologie (NVVP)<br />
Nederlandse Ver<strong>en</strong>iging voor Radiotherapie <strong>en</strong> Oncologie (NVRO)<br />
Nederlandse Ver<strong>en</strong>iging voor Radiologie (NVVR)<br />
Verpleegkundig<strong>en</strong> <strong>en</strong> Verzorg<strong>en</strong>d<strong>en</strong> Nederland Oncologie (V&VN Oncologie)<br />
Autoriser<strong>en</strong>de ver<strong>en</strong>iging<strong>en</strong><br />
Nederlandse Internist<strong>en</strong> Ver<strong>en</strong>iging (NIV)<br />
Nederlandse Ver<strong>en</strong>iging voor Heelkunde (NVVH)<br />
Nederlandse Ver<strong>en</strong>iging van Maag-Darm-Leverarts<strong>en</strong> (NVMDL)<br />
Nederlandse Ver<strong>en</strong>iging voor Pathologie (NVVP)<br />
Nederlandse Ver<strong>en</strong>iging voor Radiotherapie <strong>en</strong> Oncologie (NVRO)<br />
Nederlandse Ver<strong>en</strong>iging voor Radiologie (NVVR)<br />
Verpleegkundig<strong>en</strong> <strong>en</strong> Verzorg<strong>en</strong>d<strong>en</strong> Nederland Oncologie (V&VN Oncologie)<br />
Instemm<strong>en</strong>de ver<strong>en</strong>iging<strong>en</strong><br />
Nederlandse Federatie van Kankerpatiënt<strong>en</strong>organisaties (NFK)<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 53 van 75<br />
11 juli 2012
2002<br />
2003<br />
2004<br />
2005<br />
2006<br />
2007<br />
2008<br />
2009<br />
2010<br />
2011<br />
2012<br />
2013<br />
2014<br />
2015<br />
2016<br />
2017<br />
2018<br />
2019<br />
2020<br />
2021<br />
2022<br />
2023<br />
2024<br />
2025<br />
2026<br />
2027<br />
2028<br />
2029<br />
2030<br />
2031<br />
2032<br />
2033<br />
2034<br />
2035<br />
2036<br />
2037<br />
BIJLAGE 4 Uitgangsvrag<strong>en</strong><br />
A. Uitgangsvrag<strong>en</strong> voor zowel proximaal galweg- als galblaascarcinoom:<br />
1. Welke organisatie van zorg wordt aanbevol<strong>en</strong> bij patiënt<strong>en</strong> met wez<strong>en</strong>lijke verd<strong>en</strong>king<br />
op proximaal galweg- of galblaascarcinoom?<br />
2a. Is het nem<strong>en</strong> van e<strong>en</strong> biopt noodzakelijk voor diagnosestelling van proximaal galwegof<br />
galblaascarcinoom?<br />
2b. Welke preoperatieve voorbereiding <strong>en</strong>/of behandeling wordt aanbevol<strong>en</strong> bij patiënt<strong>en</strong><br />
met proximaal galweg- of galblaascarcinoom?<br />
3a. Wat is de optimale beeldvorming voor diagnosestelling van proximaal galweg- of<br />
galblaascarcinoom?<br />
3b. Welke beeldvorm<strong>en</strong>de techniek resulteert in de meest accurate stadiëring bij patiënt<strong>en</strong><br />
met proximaal galweg- of galblaascarcinoom?<br />
4. Voor welke patiënt<strong>en</strong> met proximaal galweg- of galblaascarcinoom wordt chirurgische<br />
resectie geadviseerd?<br />
5a. Welke chirurgische behandeling wordt geadviseerd bij patiënt<strong>en</strong> met proximaal<br />
galweg- of galblaascarcinoom?<br />
5b. Welke adjuvante behandeling wordt geadviseerd bij patiënt<strong>en</strong> met proximaal galwegof<br />
galblaascarcinoom na chirurgische resectie?<br />
5c. Welke follow-up wordt geadviseerd bij patiënt<strong>en</strong> met proximaal galweg- of<br />
galblaascarcinoom na chirurgische resectie?<br />
5d. Welke items moet<strong>en</strong> aan bod kom<strong>en</strong> in de pathologie verslaglegging bij patiënt<strong>en</strong> met<br />
verd<strong>en</strong>king op proximaal galweg- of galblaascarcinoom?<br />
6a. Welke niet-chirurgische behandeling wordt geadviseerd bij patiënt<strong>en</strong> met proximaal<br />
galweg- of galblaascarcinoom?<br />
6b. Welke follow-up wordt geadviseerd bij patiënt<strong>en</strong> met proximaal galweg- of<br />
galblaascarcinoom na niet-chirurgische behandeling?<br />
B. Uitgangsvrag<strong>en</strong> voor galblaascarcinoom<br />
7. Welke behandeling wordt geadviseerd bij patiënt<strong>en</strong> met e<strong>en</strong> incid<strong>en</strong>teel gevond<strong>en</strong><br />
galblaascarcinoom?<br />
8. Welke behandeling wordt geadviseerd bij patiënt<strong>en</strong> met e<strong>en</strong> poliep of dysplasie in de<br />
galblaas?<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 54 van 75<br />
11 juli 2012
2038<br />
2039<br />
2040<br />
2041<br />
2042<br />
2043<br />
2044<br />
2045<br />
2046<br />
2047<br />
2048<br />
2049<br />
2050<br />
2051<br />
2052<br />
2053<br />
2054<br />
2055<br />
2056<br />
2057<br />
2058<br />
2059<br />
2060<br />
2061<br />
2062<br />
2063<br />
2064<br />
2065<br />
2066<br />
2067<br />
2068<br />
2069<br />
2070<br />
2071<br />
2072<br />
2073<br />
2074<br />
2075<br />
2076<br />
2077<br />
2078<br />
2079<br />
2080<br />
2081<br />
2082<br />
2083<br />
2084<br />
2085<br />
BIJLAGE 5 Zoekstrategie<br />
Elk hoofdstuk van de richtlijn is volg<strong>en</strong>s e<strong>en</strong> vast strami<strong>en</strong> opgebouwd, namelijk<br />
literatuurbespreking, conclusies, overweging<strong>en</strong> <strong>en</strong> aanbeveling<strong>en</strong>. De antwoord<strong>en</strong> op de<br />
uitgangsvrag<strong>en</strong> (derhalve de aanbeveling<strong>en</strong> in deze richtlijn) zijn voor zover mogelijk<br />
gebaseerd op gepubliceerd wet<strong>en</strong>schappelijk onderzoek.<br />
De richtlijn is ontwikkeld (zie ook hoofdstuk Algeme<strong>en</strong>) volg<strong>en</strong>s de methodiek van cons<strong>en</strong>sus<br />
based richtlijnontwikkeling. Hierbij zijn alle stapp<strong>en</strong> van de evid<strong>en</strong>ce based methodiek<br />
doorlop<strong>en</strong>. Het <strong>en</strong>ige verschil bestaat in het feit dat de literatuur door de experts in de<br />
werkgroep is gezocht <strong>en</strong> besprok<strong>en</strong>, in plaats van dat deze systematisch is gezocht,<br />
beoordeeld, gewog<strong>en</strong> <strong>en</strong> sam<strong>en</strong>gevat door methodologische experts. Gezi<strong>en</strong> de geringe<br />
incid<strong>en</strong>tie van deze tumorsoort <strong>en</strong> mede daardoor beperkt beschikbare onderzoeksliteratuur<br />
zou het toepass<strong>en</strong> van de kostbare evid<strong>en</strong>ce based methodiek e<strong>en</strong> beperkt r<strong>en</strong>dem<strong>en</strong>t<br />
oplever<strong>en</strong>.<br />
Zoekstrategie<br />
De volledigheid van de door de werkgroepled<strong>en</strong> sam<strong>en</strong>gestelde lijst met refer<strong>en</strong>ties werd<br />
gewaarborgd met e<strong>en</strong> aanvull<strong>en</strong>de beperkte literatuursearch vanuit het IKNL.<br />
Er werd gezocht in de database Pubmed naar artikel<strong>en</strong> in het Engels of Nederlands.<br />
Betreft uitgangsvraag 7 (Welke behandeling wordt geadviseerd bij patiënt<strong>en</strong> met e<strong>en</strong><br />
incid<strong>en</strong>teel gevond<strong>en</strong> galblaascarcinoom?) werd e<strong>en</strong> specifieke zoekstrategie uitgezet. De<br />
volg<strong>en</strong>de syntax werd op 16 januari 2012 gehanteerd:<br />
Search: (("Therapeutics"[Mesh]) OR ((("Drug Therapy"[Mesh]) OR "G<strong>en</strong>eral Surgery"[Mesh])<br />
OR "Surgical Procedures, Operative"[Mesh]) OR (((("Radiotherapy"[Mesh])) OR<br />
"Endoscopy"[Mesh]) OR ("Chemoradiotherapy"[Mesh] OR "Chemoradiotherapy,<br />
Adjuvant"[Mesh])) OR (chemothera*) OR (surg*)) AND (((("Gallbladder"[Mesh]) OR<br />
(gallbladder) OR (gall-bladder) OR (gall bladder)) AND (("Neoplasms"[Mesh]) OR (cancer) OR<br />
(carcinom*) OR (tumor) OR (tumour) OR (neoplasm*) OR (malignan*))) OR ("Gallbladder<br />
Neoplasms"[Mesh])) AND ("incid<strong>en</strong>tal findings"[MeSH Terms] OR incid<strong>en</strong>tal finding[Text<br />
Word])<br />
Limits: English, Dutch; ge<strong>en</strong> tijdvak gespecificeerd.<br />
Deze zoekstrategie leverde e<strong>en</strong> lijst met 91 items op die, na e<strong>en</strong> handmatige selectie, werd<br />
aangebod<strong>en</strong> aan de werkgroep.<br />
Daarnaast is e<strong>en</strong> brede zoekstrategie t<strong>en</strong> uitvoer gebracht op 22 januari 2012. Daarbij werd de<br />
volg<strong>en</strong>de syntax gehanteerd:<br />
(bile duct)) OR (biliar*)) OR ("Bile Ducts"[Mesh])) OR ("Biliary Tract"[Mesh])) OR<br />
(("Gallbladder"[Mesh]) OR (gallbladder) OR (gall-bladder) OR (gall bladder)))) AND<br />
(("Neoplasms"[Mesh]) OR (cancer) OR (carcinom*) OR (tumor) OR (tumour) OR (neoplasm*)<br />
OR (malignan*)))) OR ("Bile Duct Neoplasms"[Mesh])) OR ("Biliary Tract Neoplasms"[Mesh]))<br />
OR ("Klatskin's Tumor"[Mesh])) OR (cholangiocarcinoma)) OR<br />
("Cholangiocarcinoma"[Mesh]))) AND (("meta-analysis"[pt] AND (<strong>en</strong>glish[la] OR dutch[la])) OR<br />
"meta-anal*"[tw] OR "metaanal*"[tw] OR ("quantitativ* review*"[tw] OR "quantitative*<br />
overview*"[tw]) OR ("systematic* review*"[tw] OR "systematic* overview*"[tw]) OR<br />
("methodologic* review*"[tw] OR "methodologic* overview*"[tw]) OR ("review"[pt] AND<br />
"medline"[tw] AND (<strong>en</strong>glish[la] OR dutch[la])) OR (randomized controlled trial[pt] OR controlled<br />
clinical trial[pt] OR randomized[tiab] OR placebo[tiab] OR clinical trials as topic[mesh:noexp]<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 55 van 75<br />
11 juli 2012
2086<br />
2087<br />
2088<br />
2089<br />
2090<br />
2091<br />
2092<br />
2093<br />
2094<br />
2095<br />
2096<br />
OR randomly[tiab] OR trial[ti]) NOT (animals[mh] NOT (animals[mh] AND humans[mh]))) AND<br />
("last 5 years"[PDat]))) NOT ((("Pancreatic Neoplasms"[Mesh])) AND (pancrea*)))) NOT<br />
((("Lung Neoplasms"[Mesh])) AND (lung cancer)))) NOT ("Liver Neoplasms"[Mesh]))) NOT<br />
("Neoplasm Metastasis"[Mesh]))) NOT ("Palliative Care"[Mesh])<br />
Limits: English, Dutch; literatuur niet ouder dan vijf jaar.<br />
De 293 refer<strong>en</strong>ties werd<strong>en</strong> handmatig geclusterd per type uitgangsvraag <strong>en</strong> aangebod<strong>en</strong> aan<br />
de werkgroepled<strong>en</strong>.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 56 van 75<br />
11 juli 2012
2097<br />
2098<br />
2099<br />
2100<br />
2101<br />
2102<br />
2103<br />
2104<br />
2105<br />
2106<br />
2107<br />
2108<br />
2109<br />
2110<br />
2111<br />
2112<br />
2113<br />
2114<br />
2115<br />
2116<br />
2117<br />
2118<br />
2119<br />
2120<br />
2121<br />
2122<br />
2123<br />
2124<br />
2125<br />
2126<br />
2127<br />
2128<br />
2129<br />
2130<br />
2131<br />
2132<br />
2133<br />
2134<br />
2135<br />
2136<br />
2137<br />
2138<br />
2139<br />
2140<br />
2141<br />
2142<br />
2143<br />
2144<br />
2145<br />
2146<br />
BIJLAGE 6 Actualisatie<br />
De geldigheidsduur van deze richtlijn is vastgesteld op vijf jaar. De geldigheidstermijn voor de<br />
richtlijn wordt vanuit IKNL bewaakt. Om verscheid<strong>en</strong>e red<strong>en</strong><strong>en</strong> kan herzi<strong>en</strong>ing eerder dan<br />
beoogd nodig zijn. De Landelijke Werkgroep Gastro-Intestinale Tumor<strong>en</strong> toetst daarom<br />
jaarlijks de actualiteit van de richtlijn. Het bestuur van deze landelijke werkgroep draagt de<br />
verantwoordelijkheid om de behoefte voor herzi<strong>en</strong>ing van de huidige richtlijn bij de<br />
beroepsgroep<strong>en</strong> te peil<strong>en</strong>. Zo nodig zal de richtlijn tuss<strong>en</strong>tijds op onderdel<strong>en</strong> word<strong>en</strong><br />
bijgesteld. Uiterlijk in 2017 zal e<strong>en</strong> nieuwe multidisciplinaire werkgroep word<strong>en</strong> geïnstalleerd<br />
voor e<strong>en</strong> herzi<strong>en</strong>e versie van de richtlijn.<br />
BIJLAGE 7 Houderschap richtlijn<br />
De houder van de richtlijn moet kunn<strong>en</strong> aanton<strong>en</strong> dat de richtlijn zorgvuldig <strong>en</strong> met de vereiste<br />
deskundigheid tot stand is gekom<strong>en</strong>. Onder houder wordt verstaan de ver<strong>en</strong>iging<strong>en</strong> van<br />
beroepsbeoef<strong>en</strong>ar<strong>en</strong> die de richtlijn autoriser<strong>en</strong>.<br />
Het Integraal Kankerc<strong>en</strong>trum Nederland draagt zorg voor het beheer <strong>en</strong> de ontsluiting van de<br />
richtlijn.<br />
BIJLAGE 8 Juridische betek<strong>en</strong>is<br />
De richtlijn bevat aanbeveling<strong>en</strong> van algem<strong>en</strong>e aard. Het is mogelijk dat deze aanbeveling<strong>en</strong><br />
in e<strong>en</strong> individueel geval niet van toepassing zijn. Er kunn<strong>en</strong> zich feit<strong>en</strong> of omstandighed<strong>en</strong><br />
voordo<strong>en</strong> waardoor het w<strong>en</strong>selijk is dat in het belang van de patiënt van de richtlijn wordt<br />
afgewek<strong>en</strong>.<br />
Wanneer van de richtlijn wordt afgewek<strong>en</strong>, di<strong>en</strong>t dit beargum<strong>en</strong>teerd gedocum<strong>en</strong>teerd te<br />
word<strong>en</strong>.<br />
De toepasbaarheid <strong>en</strong> de toepassing van de richtlijn<strong>en</strong> in de praktijk is de verantwoordelijkheid<br />
van de behandel<strong>en</strong>de arts.<br />
BIJLAGE 9 Verantwoording<br />
Het Integraal Kankerc<strong>en</strong>trum Nederland bevordert dat m<strong>en</strong>s<strong>en</strong> met kanker <strong>en</strong> hun naast<strong>en</strong> zo<br />
dicht mogelijk bij huis toegang hebb<strong>en</strong> tot e<strong>en</strong> sam<strong>en</strong>hang<strong>en</strong>d <strong>en</strong> kwalitatief verantwoord<br />
zorgaanbod.<br />
Het Integraal Kankerc<strong>en</strong>trum Nederland is opgericht om behandeling, zorg <strong>en</strong> klinisch<br />
onderzoek binn<strong>en</strong> de oncologie te verbeter<strong>en</strong>. Daarnaast heeft het e<strong>en</strong> taak in het opzett<strong>en</strong> <strong>en</strong><br />
ondersteun<strong>en</strong> van netwerk<strong>en</strong> voor palliatieve zorg.<br />
Het Integraal Kankerc<strong>en</strong>trum Nederland werkt aan multidisciplinaire richtlijnontwikkeling voor<br />
de oncologische <strong>en</strong> palliatieve zorg. Naast deze ontwikkeling van richtlijn<strong>en</strong> faciliteert het<br />
Integraal Kankerc<strong>en</strong>trum Nederland ook het onderhoud, het beheer, de implem<strong>en</strong>tatie <strong>en</strong> de<br />
evaluatie van deze richtlijn<strong>en</strong>.<br />
De leidraad voor de ontwikkeling van de richtlijn<strong>en</strong> voor oncologische <strong>en</strong> palliatieve zorg is het<br />
AGREE instrum<strong>en</strong>t. Dit instrum<strong>en</strong>t is gemaakt voor de beoordeling van bestaande, nieuwe <strong>en</strong><br />
herzi<strong>en</strong>e richtlijn<strong>en</strong>.<br />
Het AGREE Instrum<strong>en</strong>t beoordeelt zowel de kwaliteit van de verslaglegging als de kwaliteit<br />
van bepaalde aspect<strong>en</strong> van de aanbeveling<strong>en</strong>. Het beoordeelt de kans dat e<strong>en</strong> richtlijn zijn<br />
gew<strong>en</strong>ste doel zal behal<strong>en</strong>, maar niet de daadwerkelijke impact op patiëntuitkomst<strong>en</strong>.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 57 van 75<br />
11 juli 2012
2147<br />
2148<br />
2149<br />
2150<br />
2151<br />
2152<br />
2153<br />
2154<br />
2155<br />
2156<br />
2157<br />
2158<br />
2159<br />
2160<br />
2161<br />
2162<br />
2163<br />
2164<br />
Het AGREE Instrum<strong>en</strong>t is opgebouwd uit 23 items verdeeld over zes domein<strong>en</strong>. Elk domein<br />
beslaat e<strong>en</strong> aparte dim<strong>en</strong>sie van kwaliteit van richtlijn<strong>en</strong>, namelijk:<br />
- Onderwerp <strong>en</strong> doel betreft het doel van de richtlijn de specifieke klinische vrag<strong>en</strong> waarop<br />
de richtlijn e<strong>en</strong> antwoord geeft <strong>en</strong> de patiënt<strong>en</strong>populatie waarop de richtlijn van toepassing<br />
is.<br />
- Betrokk<strong>en</strong>heid van belanghebb<strong>en</strong>d<strong>en</strong> richt zich op de mate waarin de richtlijn de<br />
opvatting<strong>en</strong> van de beoogde gebruikers weerspiegelt.<br />
- Methodologie hangt sam<strong>en</strong> met het proces waarin bewijsmateriaal is verzameld <strong>en</strong><br />
sam<strong>en</strong>gesteld <strong>en</strong> met de gebruikte method<strong>en</strong> om aanbeveling<strong>en</strong> op te stell<strong>en</strong> <strong>en</strong> te<br />
herzi<strong>en</strong>.<br />
- Helderheid <strong>en</strong> pres<strong>en</strong>tatie gaat over het taalgebruik <strong>en</strong> de vorm van de richtlijn.<br />
- Toepassing houdt verband met de mogelijke organisatorische, gedragsmatige <strong>en</strong><br />
financiële consequ<strong>en</strong>ties van het toepass<strong>en</strong> van de richtlijn.<br />
- Onafhankelijkheid van de opstellers betreft de onafhankelijkheid van de aanbeveling<strong>en</strong><br />
<strong>en</strong> erk<strong>en</strong>ning van mogelijke conflicter<strong>en</strong>de belang<strong>en</strong> van led<strong>en</strong> van de werkgroep.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 58 van 75<br />
11 juli 2012
2165<br />
2166<br />
2167<br />
2168<br />
2169<br />
2170<br />
2171<br />
2172<br />
2173<br />
2174<br />
2175<br />
2176<br />
2177<br />
2178<br />
2179<br />
2180<br />
2181<br />
2182<br />
2183<br />
2184<br />
2185<br />
2186<br />
2187<br />
2188<br />
2189<br />
2190<br />
2191<br />
2192<br />
2193<br />
2194<br />
2195<br />
2196<br />
2197<br />
2198<br />
2199<br />
2200<br />
2201<br />
2202<br />
2203<br />
2204<br />
2205<br />
2206<br />
2207<br />
2208<br />
2209<br />
BIJLAGE 10 Voorbeeld nazorgplan oncologie<br />
Doel nazorgplan<br />
Het nazorgplan wordt in de nazorg ingezet voor:<br />
1. informatieverstrekking aan de patiënt<br />
2. signalering, begeleiding <strong>en</strong> behandeling van problem<strong>en</strong> <strong>en</strong> gevolg<strong>en</strong> van kanker(behandeling)<br />
3. monitoring van ziekte <strong>en</strong> gevolg<strong>en</strong><br />
4. zelfzorg van de patiënt<br />
5. verslaglegging<br />
6. interdisciplinaire overdracht<br />
Inhoud nazorgplan<br />
De onderdel<strong>en</strong> van het nazorgplan zijn (in ieder geval):<br />
• Sam<strong>en</strong>vatting van de behandeling<br />
• De afsprak<strong>en</strong> voor nazorg gericht op vroeg detectie van nieuwe manifestaties van kanker<br />
• Beschrijving van de (voorkom<strong>en</strong>de) gevolg<strong>en</strong> van kanker <strong>en</strong> de behandeling<strong>en</strong>, die al bij beëindiging<br />
van de behandeling opgetred<strong>en</strong> kunn<strong>en</strong> zijn of pas later manifest word<strong>en</strong><br />
• Informatie over gezondheidsgedrag <strong>en</strong> leefstijl<br />
• Informatie over de effect<strong>en</strong> van de kanker <strong>en</strong> de behandeling op de kwaliteit van lev<strong>en</strong>: fysiek,<br />
psychisch <strong>en</strong> sociaal<br />
• Informatie over nazorginterv<strong>en</strong>ties <strong>en</strong> -voorzi<strong>en</strong>ing<strong>en</strong><br />
• Informatie over werkhervatting <strong>en</strong> financiële gevolg<strong>en</strong><br />
• Informatie over de betreff<strong>en</strong>de zorgverl<strong>en</strong>ers bij specifieke problem<strong>en</strong><br />
Maatwerk<br />
Het nazorgplan Galblaas/<strong>Galweg</strong>carcinoom is e<strong>en</strong> algeme<strong>en</strong> plan voor de patiënt<strong>en</strong>populatie met kanker<br />
van de galblaas of galweg<strong>en</strong>. Dit zal:<br />
• op de behandellocaties verder uitgewerkt moet<strong>en</strong> word<strong>en</strong>, aangevuld met lokale informatie,<br />
material<strong>en</strong> <strong>en</strong> middel<strong>en</strong> <strong>en</strong> informatie over lokale voorzi<strong>en</strong>ing<strong>en</strong> <strong>en</strong> interv<strong>en</strong>ties, plus de afsprak<strong>en</strong><br />
over de taakverdeling tuss<strong>en</strong> de verschill<strong>en</strong>de betrokk<strong>en</strong> zorgverl<strong>en</strong>ers<br />
• per patiënt individueel op maat gemaakt moet<strong>en</strong> word<strong>en</strong><br />
• opg<strong>en</strong>om<strong>en</strong> moet<strong>en</strong> word<strong>en</strong> in het digitale patiënt<strong>en</strong>dossier<br />
Mom<strong>en</strong>t<strong>en</strong> voor nazorgplan in de zorglijn (zie figuur Nazorg in zorgpad)<br />
Het Nazorgplan di<strong>en</strong>t besprok<strong>en</strong> <strong>en</strong> op maat gemaakt te word<strong>en</strong> in e<strong>en</strong> consultatie op t<strong>en</strong> minste de<br />
volg<strong>en</strong>de mom<strong>en</strong>t<strong>en</strong>:<br />
1. bij ontslag uit het ziek<strong>en</strong>huis<br />
2. bij de afronding van de primaire kankerbehandeling<br />
3. bij heroverweging van de nazorg één jaar na afronding van de behandeling<br />
4. indi<strong>en</strong> wijziging<strong>en</strong> optred<strong>en</strong> in de medisch <strong>en</strong>/of psychosociale situatie van de patiënt of andere<br />
mom<strong>en</strong>t<strong>en</strong> van heroverweging van de nazorg<br />
Literatuur<br />
<strong>Richtlijn</strong> Herstel na kanker, IKNL 2011<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 59 van 75<br />
11 juli 2012
2210<br />
2211<br />
2212<br />
2213<br />
2214<br />
2215<br />
Kop: Nazorg in zorgpad Galblaas/ <strong>Galweg</strong>carcinoom<br />
In 4 e vierkant blokje tekst: delete “<strong>en</strong> besprek<strong>en</strong> adjuvante therapie”<br />
Het 5 e vierkante blokje kan in geheel verwijdert word<strong>en</strong><br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 60 van 75<br />
11 juli 2012
2216<br />
2217<br />
Nazorgplan Galblaas/ <strong>Galweg</strong>carcinoom<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 61 van 75<br />
11 juli 2012<br />
Persoonsgegev<strong>en</strong>s<br />
Naam patiënt: Geboortedatum<br />
Adres: Telefoon / e-mail<br />
Naam hoofdbehandelaar:<br />
Contactgegev<strong>en</strong>s<br />
Naam eerste aanspreekpersoon: Telefoon / e-mail<br />
Naam huisarts:<br />
Datum start Nazorgplan:<br />
Data Nazorgplann<strong>en</strong> in nazorgfase:<br />
Datum Nazorgplan bij heroverweging/beëindiging nazorg:<br />
Diagnostiek<br />
Data opstell<strong>en</strong> Nazorgplann<strong>en</strong><br />
Informatie kanker, behandeling, gevolg<strong>en</strong><br />
Datum Diagnostisch onderzoek Uitslag<br />
MDO<br />
CT pancreas (+ volume meting)<br />
ERCP<br />
MRCP<br />
Diagnose Datum definitieve PA<br />
Stagering<br />
Histologie<br />
Kankerbehandeling<br />
Data<br />
Behandelaar<br />
Behandeling<br />
Familiehistorie kanker, erfelijkheid<br />
Comorbiditeit, andere ziekt<strong>en</strong><br />
Operatie Chemotherapie Radiotherapie Anders<br />
Soort Datum Behandelaar Behandeling Overig Stopdatum<br />
Diabet<strong>en</strong><br />
Hart/-vaatziekt<strong>en</strong><br />
COPD<br />
Osteoroporose<br />
Anders<br />
Complicaties kanker<br />
Soort<strong>en</strong> Datum start Behandelaar Behandeling Stopdatum
Mogelijke gevolg<strong>en</strong> kanker(behandeling)<br />
Algeme<strong>en</strong> bij CC Lichamelijk Psychisch Sociaal<br />
Bij operatie<br />
Bij chemotherapie<br />
Bij radiotherapie<br />
Anders<br />
Kankerdetectie:<br />
Lichamelijk<br />
onderzoek<br />
Laboratorium<br />
onderzoek:<br />
Beeldvorm<strong>en</strong>d<br />
onderzoek:<br />
Anders:<br />
Signalering<br />
gevolg<strong>en</strong> kanker:<br />
instrum<strong>en</strong>t<strong>en</strong><br />
Lastmeter ><br />
distress<br />
Visuele Analoge<br />
Schaal (VAS) ><br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 62 van 75<br />
11 juli 2012<br />
Jeuk<br />
Vermoeidheid/conditie Conc<strong>en</strong>tratie,<br />
Pijn<br />
ADL-functies, functiebeperking<br />
Vermoeidheid Relaties partner, gezin<br />
Geheug<strong>en</strong>klacht<strong>en</strong><br />
Sociale contact<strong>en</strong><br />
Angst, Depressie Woonsituatie<br />
Woede Huishoud<strong>en</strong><br />
Voedingsproblem<strong>en</strong> Verdriet Arbeidsparticipatie,<br />
Werkhervatting<br />
Slaapproblem<strong>en</strong> Zelfbeeld, Lichaamsbeeld Maatschappelijke<br />
Spiritualiteit<br />
E<strong>en</strong>zaamheid<br />
Twijfel over prognose<br />
Problem<strong>en</strong> t.g.v. nacontrole<br />
Aanbevol<strong>en</strong> nazorgschema<br />
participatie<br />
Financiële problem<strong>en</strong><br />
datum datum datum datum datum datum datum datum zorgverl<strong>en</strong>er
kankergerelateerde<br />
vermoeidheid<br />
C<strong>en</strong>ter<br />
Epidemiologic<br />
Studies Depression<br />
Scale (CES-D) ><br />
emotionele<br />
problem<strong>en</strong><br />
Pati<strong>en</strong>t Specifieke<br />
Klacht<strong>en</strong>lijst (PSK)<br />
> fysieke<br />
problem<strong>en</strong><br />
bij de volg<strong>en</strong>de signal<strong>en</strong>/klacht<strong>en</strong> contact opnem<strong>en</strong> met:<br />
Geelzucht<br />
donkere urine, ontkleurde ontlasting (grijs/wit)<br />
Koorts > 38,5<br />
Misselijkheid , brak<strong>en</strong><br />
Gewichtsverlies<br />
Diaree<br />
Buikomvang to<strong>en</strong>ame<br />
Zorg<strong>en</strong> mak<strong>en</strong> over gezondheid<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 63 van 75<br />
11 juli 2012<br />
Zelfsignalering klacht<strong>en</strong> <strong>en</strong> contactperson<strong>en</strong><br />
Zorgverl<strong>en</strong>er telefoon / e-mail<br />
Overige gevolg<strong>en</strong> van kanker > fysiek, psychisch, sociaal: zorgverl<strong>en</strong>er telefoon / e-mail<br />
Angst<br />
Depressieve klacht<strong>en</strong><br />
Problem<strong>en</strong> met werk<br />
Signalering<br />
Lastmeter > distress<br />
VAS > vermoeidheid<br />
CES-D > emotionele problem<strong>en</strong><br />
PSK > fysieke problem<strong>en</strong><br />
Advies, behandeling:<br />
Aanpak gevolg<strong>en</strong> van kanker<br />
Datum<br />
Verwijzing: datum, zorgverl<strong>en</strong>er, aanvull<strong>en</strong>de diagnostiek, behandeling<br />
Monitoring, vervolg:<br />
Signaleringsinstrum<strong>en</strong>t<br />
Lastmeter > distress<br />
VAS > vermoeidheid<br />
CES-D > emotionele problem<strong>en</strong><br />
PSK > fysieke problem<strong>en</strong><br />
Conclusie<br />
Datum Conclusie
2218<br />
2219<br />
2220<br />
Advies, behandeling:<br />
Verwijzing: datum, zorgverl<strong>en</strong>er, aanvull<strong>en</strong>de diagnostiek, behandeling<br />
Monitoring, vervolg:<br />
Voorlichtingsmaterial<strong>en</strong>:<br />
Folders:<br />
galwegcarcinoom<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 64 van 75<br />
11 juli 2012<br />
Ondersteuning zelfzorg<br />
Verder lev<strong>en</strong> met kanker, Vermoeidheid na kanker, Als kanker meer is dan je aankunt, Kanker <strong>en</strong> hoe moet het nu met de<br />
kinder<strong>en</strong>, Voeding <strong>en</strong> kanker, Kanker <strong>en</strong> seksualiteit, kanker in de lever, levertumor<strong>en</strong> .<br />
Websites:<br />
www.kanker.kwfkankerbestrijding.nl; www.nvog.nl; www.kankerwiehelpt.nl; www.toekomstnakanker.nl; www.mlds.nl;<br />
www.nfk.nl; www.ipso.nl; www.mezzo.nl (mantelzorger ondersteuner)<br />
Advies zelfzorg<br />
Leefstijladvies <strong>en</strong> -interv<strong>en</strong>ties<br />
Bijv.:<br />
Nederlandse Norm gezond beweg<strong>en</strong>: www.30minut<strong>en</strong>beweg<strong>en</strong>.nl<br />
Gezonde voeding: www.voedingsc<strong>en</strong>trum.nl<br />
Stop met rok<strong>en</strong> interv<strong>en</strong>tie: www.stivoro.nl<br />
www.nhg.arts<strong>en</strong>net.k<strong>en</strong>nisc<strong>en</strong>trum.nl<br />
datum<br />
datum<br />
Nazorg besprok<strong>en</strong> in MDO<br />
Overdracht naar verpleegkundig specialist<br />
Overdracht naar huisarts<br />
Overdracht thuiszorg<br />
Aantek<strong>en</strong>ing<strong>en</strong> patiënt<br />
Interdisciplinaire overdracht
2221<br />
2222<br />
2223<br />
2224<br />
2225<br />
2226<br />
2227<br />
2228<br />
2229<br />
2230<br />
2231<br />
2232<br />
2233<br />
2234<br />
2235<br />
2236<br />
2237<br />
2238<br />
2239<br />
2240<br />
2241<br />
2242<br />
2243<br />
2244<br />
2245<br />
2246<br />
2247<br />
2248<br />
2249<br />
2250<br />
2251<br />
2252<br />
2253<br />
2254<br />
2255<br />
2256<br />
2257<br />
2258<br />
2259<br />
2260<br />
2261<br />
2262<br />
2263<br />
2264<br />
2265<br />
2266<br />
2267<br />
2268<br />
BIJLAGE 11 Refer<strong>en</strong>ties<br />
Agrawal S, Sonawane RN, Behari A et al. Laparoscopic staging in gallbladder caner. Dig Surg.<br />
2005;22:440-5.<br />
Anderson C, Kim R. Adjuvant therapy for resected extrahepatic cholangiocarcinoma: a review of the<br />
literature and future directions. Cancer Treat Rev. 2009 Jun;35(4):322-7.<br />
André T, Tournigand C, Rosmorduc O, Prov<strong>en</strong>t S, Maindrault-Goebel F, Av<strong>en</strong>in D, et al. GERCOR<br />
Group.Gemcitabine combined with oxaliplatin (GEMOX) in advanced biliary tract ad<strong>en</strong>ocarcinoma: a<br />
GERCOR study. Ann Oncol. 2004;15(9):1339.<br />
André T, Reyes-Vidal JM, Fartoux L, Ross P, Leslie M, Rosmorduc O, et al. Gemcitabine and oxaliplatin<br />
in advanced biliary tract carcinoma: a phase II study. Br J Cancer. 2008;99(6):862’<br />
Araida T, Yoshikawa T, Azuma T et al. Indications for pancreatoduod<strong>en</strong>ectomy in pati<strong>en</strong>ts undergoing<br />
lymphad<strong>en</strong>ectomy for advanced gallbladder cancer. J Hepatobiliary Pancreat Surg. 2004;11:45-9.<br />
Balachandran P, Agarwal S, Krishnani N, Pandey CM, Kumar A, Sikora SS, Sax<strong>en</strong>a R, Kapoor VK.<br />
Predictors of long-term survival in pati<strong>en</strong>ts with gallbladder cancer. J Gastrointest Surg. 2006<br />
Jun;10(6):848-54. PubMed PMID: 16769541.<br />
Bartlett DL, Fong Y, Fortner JG, Br<strong>en</strong>nan MF, Blumgart LH. Long-term results after resection for<br />
gallbladder cancer. Implications for staging and managem<strong>en</strong>t. Ann Surg. 1996;224:639-46.<br />
Baton O, Azoulay D, Adam DV, Castaing D. Major hepatectomy for hilar cholangiocarcinoma type 3 and<br />
4: prognostic factors and longterm outcomes. J Am Coll Surg 2007; 204(2):250-60<br />
B<strong>en</strong>oist S, Panis Y, Fagniez PL. Long-term results after curative resection for carcinoma of the<br />
gallbladder. Fr<strong>en</strong>ch University Association for Surgical Research, Am J Surg. 1998;175:118-22.<br />
B<strong>en</strong>zoni E, Lor<strong>en</strong>zin D, Baccarani U, et al. Resective surgery for liver tumor; a multivariate analysis of<br />
causes and risk factors linked to postoperative complications. Hepatobiliary Pancreat Dis Int 2006; 5:526-<br />
533.<br />
Bismuth H, Corlette MB. Intrahepatic cholangio<strong>en</strong>teric anastomosis in carcinoma of the hilus of the liver.<br />
Surg Gynecol Obstet 1975; 140(2): 170-8.<br />
Bonet Beltrán M, Roth AD, M<strong>en</strong>tha G, Allal AS. Adjuvant radio-chemotherapy for extrahepatic biliary tract<br />
cancers. BMC Cancer. 2011 Jun 24;11:267.<br />
Bonet Beltrán M, Allal AS, Gich I, Solé JM, Carrió I. Is adjuvant radiotherapy needed after curative<br />
resection of extrahepatic biliary tract cancers? A systematic review with a meta-analysis of observational<br />
studies. Cancer Treat Rev. 2012 Apr;38(2):111-9.<br />
Van D<strong>en</strong> Borne HW ; Pruyn JFA (1985), Lotg<strong>en</strong>ot<strong>en</strong>contact bij kankerpatiënt<strong>en</strong>. Van Gorcum<br />
Ass<strong>en</strong>/Maastricht<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 65 van 75<br />
11 juli 2012
2269<br />
2270<br />
2271<br />
2272<br />
2273<br />
2274<br />
2275<br />
2276<br />
2277<br />
2278<br />
2279<br />
2280<br />
2281<br />
2282<br />
2283<br />
2284<br />
2285<br />
2286<br />
2287<br />
2288<br />
2289<br />
2290<br />
2291<br />
2292<br />
2293<br />
2294<br />
2295<br />
2296<br />
2297<br />
2298<br />
2299<br />
2300<br />
2301<br />
2302<br />
2303<br />
2304<br />
2305<br />
2306<br />
2307<br />
2308<br />
2309<br />
2310<br />
2311<br />
2312<br />
2313<br />
2314<br />
2315<br />
2316<br />
2317<br />
Butte JM, Matsuo K, Gön<strong>en</strong> M, D'Angelica MI, Waugh E, All<strong>en</strong> PJ, et al . Gallbladder cancer: differ<strong>en</strong>ces<br />
in pres<strong>en</strong>tation, surgical treatm<strong>en</strong>t, and survival in pati<strong>en</strong>ts treated at c<strong>en</strong>ters in three countries. J Am<br />
Coll Surg. 2011 Jan;212(1):50-61. Epub 2010 Nov 12. PubMed PMID: 21075015.<br />
Chijiiwa K, Nakano K, Ueda J et. Surgical treatm<strong>en</strong>t of pati<strong>en</strong>ts with T2 gallbladder carcinomainvading<br />
the subserosal layer. J Am Coll Surg. 2001;192:600-7.<br />
Chijiiwa K, Yamaguchi K, Tanaka M. Clinicopathologic differ<strong>en</strong>ces betwe<strong>en</strong> long-term and short-term<br />
postoperative survivors with advanced gallbladder carcinoma. World J Surg. 1997 Jan;21(1):98-102.<br />
PubMed PMID: 8943185.<br />
Choi JY, Kim MJ, Lee JM, Kim KW, Lee JY, Han JK, Choi BI. Hilar Cholangiocarcinoma: Role of<br />
preoperative Imaging with Sonography, MDCT, MRI, and Direct Cholangiography. AJR Am J Ro<strong>en</strong>tg<strong>en</strong>ol.<br />
2008 Nov;191(5):1448-57. Review.<br />
Chung YE, Kim MJ, Park YN, Lee YH, Choi JY. Staging of extrahepatic cholangiocarcinoma. Eur Radiol.<br />
2008 Oct;18(10):2182-95. Epub 2008 May 6. Review.<br />
Connor S, Barron E, Redhead DN, Ireland H, et al. Palliation for suspected unresectable hilar<br />
cholangiocarcinoma. EJSO;2007;33:341-345<br />
Chryssou E, Guthrie JA, Ward J, Robinson PJ. Hilar cholangiocarcinoma: MR correlation with surgical<br />
and histological findings. Clin Radiol. 2010 Oct;65(10):781-8. Epub 2010 Jul 31.<br />
Cubertafond P, Gainant A, Ccchiaro G. Surgical treatm<strong>en</strong>t of 724 carcinomas of the gallbladder. Results<br />
of the Fr<strong>en</strong>ch Surgical Association Survey. Ann Surg. 1994;219:275-80.<br />
D’Angelica M, Dalal KM, DeMatteo RP, Fong Y, Blumgart LH, Jarnagin WR. Analysis of the ext<strong>en</strong>t of<br />
resection for ad<strong>en</strong>ocarcinoma of the gallbladder. Ann Surg Oncol. 2009;16:806-16.<br />
De Bellis M, Sherman S, Fogel EL et al. Tissue sampling at ERCP in suspected malignant biliary<br />
strictures (part 1). Gastrointest. Endosc 2002; 56:552–6.<br />
DeOliveira ML, Cunningham SC, Cameron JL, Kamangar F, Winter JM, Lillemoe KD et al.<br />
Cholangiocarcinoma: thirty-one-year experi<strong>en</strong>ce with 564 pati<strong>en</strong>ts at a single institution. Ann Surg 2007;<br />
245(5):755-62.<br />
Downing SR, Cadogan KA, Ortega G, et al. Early-stage gallbladder cancer in the surveillance,<br />
epidemiology, and the <strong>en</strong>d results database. Arch Surg. 2011;146:734-8.<br />
Duffy A, Capanu M, Abou-Alfa GK, et al. Gallbladder cancer (GBC): 10-year experi<strong>en</strong>ce at Memorail<br />
Sloan-Kettering Cancer C<strong>en</strong>tre (MSKCC). J Surg Oncol. 2008;98:485-9.<br />
Ebata T, Nagino M, Kamiya J, Uesaka K, Nagasaka T. Nimura Y. Hepatectomy with portal vein resection<br />
for hilar cholangiocarcinoma. Ann Surg 2003; 238: 720-27<br />
Ebata T, Yokoyama Y, Igami T, Sugawara G, Takahashi Y, Nagino M. Portal Vein Embolization before<br />
Ext<strong>en</strong>ded Hepatectomy for Biliary Cancer: Curr<strong>en</strong>t Technique and Review of 494 Consecutive<br />
Embolizations. Dig Surg. 2012;29(1): 23-9.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 66 van 75<br />
11 juli 2012
2318<br />
2319<br />
2320<br />
2321<br />
2322<br />
2323<br />
2324<br />
2325<br />
2326<br />
2327<br />
2328<br />
2329<br />
2330<br />
2331<br />
2332<br />
2333<br />
2334<br />
2335<br />
2336<br />
2337<br />
2338<br />
2339<br />
2340<br />
2341<br />
2342<br />
2343<br />
2344<br />
2345<br />
2346<br />
2347<br />
2348<br />
2349<br />
2350<br />
2351<br />
2352<br />
2353<br />
2354<br />
2355<br />
2356<br />
2357<br />
2358<br />
2359<br />
2360<br />
2361<br />
2362<br />
2363<br />
2364<br />
2365<br />
2366<br />
2367<br />
Ellis PA, Norman A, Hill A, O'Bri<strong>en</strong> ME, Nicolson M, Hickish T, Cunningham D. Epirubicin, cisplatin and<br />
infusional 5-fluorouracil (5-FU) (ECF) in hepatobiliary tumours. Eur J Cancer. 1995;31A(10):1594.<br />
Erdogan D, Kloek JJ, t<strong>en</strong> Kate FJ, et al. Immunoglobulin G4-related sclerosing cholangitis in pati<strong>en</strong>ts<br />
resected for presumed malignant bile duct strictures. Br J Surg 2008;95:727-34.<br />
Erdogan D, Busch OR, van Deld<strong>en</strong> OM, Rauws EA, et al. Incid<strong>en</strong>ce and managem<strong>en</strong>t of bile leakage<br />
after partial liver resection. Dig Surg 2008; 25:60-6.<br />
Fong Y, Jarnagin WR, Blumgart LH. Gallbladder cancer: comparison of pati<strong>en</strong>ts pres<strong>en</strong>ting initially for<br />
definitive operation with those pres<strong>en</strong>ting after noncurative interv<strong>en</strong>tion. Ann Surg. 2000;232:557-69<br />
Friman S, Foss A, Isoniemi H, et al. Liver transplantation for cholangiocarcinoma: selection is ess<strong>en</strong>tial<br />
for acceptable results. Scand J Gastro<strong>en</strong>terol. 2011;46:370-5.<br />
Fuks D, Regimbeau JM, Le Treut YP, et al. Incid<strong>en</strong>tal gallbladder cancer by the AFC-GBC-2009 Study<br />
Group. World j Surg 2011;35:1887-97<br />
Furukawa H, Ikuma H, Asakura-Yokoe K, Uesaka K. Preoperative staging of biliary carcinoma using 18F-<br />
fluorodeoxyglucose PET: prospective comparison with PET+CT, MDCT and histopathology. Eur Radiol.<br />
2008 Dec;18(12):2841-7. Epub 2008 May 29.<br />
Gerhards MF, van Gulik TM, González González D, Rauws EA, Gouma DJ. Results of postoperative<br />
radiotherapy for resectable hilar cholangiocarcinoma. World J Surg. 2003 Feb;27(2):173-9.<br />
Giuliani F, Gebbia V, Maiello E, Borsellino N, Bajardi E, Colucci G, Gruppo Oncologico dell'Italia<br />
Meridionale. Gemcitabine and cisplatin for inoperable and/or metastatic biliary tree carcinomas: a<br />
multic<strong>en</strong>ter phase II study of the Gruppo Oncologico dell'Italia Meridionale (GOIM). Ann Oncol. 2006;17<br />
Suppl 7:vii73.<br />
Goldin RD, Roa JC. Gallbladder cancer: a morphological and molecular update. Histopathology<br />
2009;55:218–29.<br />
González González D, Gouma DJ, Rauws EA, van Gulik TM, Bosma A, et al. Role of radiotherapy, in<br />
particular intraluminal brachytherapy, in the treatm<strong>en</strong>t of proximal bile duct carcinoma. Ann Oncol.<br />
1999;10:215-20.<br />
Goere D, Wagholikar GD, Pessaux P, Carrere N, Sibert A, Vilgrain V et al. Utility of staging laparoscopy<br />
in subsets of biliary cancers : laparoscopy is a powerful diagnostic tool in pati<strong>en</strong>ts with intrahepatic and<br />
gallbladder carcinoma. Surg Endosc 2006; 20(5):721-5.<br />
Goetze TO, Paolucci V. Adequate ext<strong>en</strong>t in radical re-resection of incid<strong>en</strong>tal gallbladder carcinoma:<br />
analysis of the German Registry. Surg Endosc. 2010;24:2156-64.<br />
Goetze TO, Paolucci V. The prognostic impact of positive lymph nodes in stages T1 to T3 incid<strong>en</strong>tal<br />
gallbladder carcinoma: results of the German registry. Surg Endosc. 2011 Nov 17. [Epub ahead of print].<br />
Gooiker GA, van der Geest LG, Wouters MW, et al. Quality improvem<strong>en</strong>t of pancreatic surgery by<br />
c<strong>en</strong>tralization in the western part of the Netherlands. Ann Surg Oncol. 2011; 18:1821-9.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 67 van 75<br />
11 juli 2012
2368<br />
2369<br />
2370<br />
2371<br />
2372<br />
2373<br />
2374<br />
2375<br />
2376<br />
2377<br />
2378<br />
2379<br />
2380<br />
2381<br />
2382<br />
2383<br />
2384<br />
2385<br />
2386<br />
2387<br />
2388<br />
2389<br />
2390<br />
2391<br />
2392<br />
2393<br />
2394<br />
2395<br />
2396<br />
2397<br />
2398<br />
2399<br />
2400<br />
2401<br />
2402<br />
2403<br />
2404<br />
2405<br />
2406<br />
2407<br />
2408<br />
2409<br />
2410<br />
2411<br />
2412<br />
2413<br />
2414<br />
2415<br />
Gourgiotis A, Kocher HM, Solaini L, et al. Gallbladder cancer. Am J Surg. 2008;196:252-64. Gourgiotis A,<br />
Kocher HM, Solaini L, et al. Gallbladder cancer. Am J Surg. 2008;196:252-64.<br />
Hejna M, Pruckmayer M, Raderer M. The role of chemotherapy and radiation in the managem<strong>en</strong>t of<br />
biliary cancer: a review of the literature. Eur J Cancer. 1998 ;34:977-86.<br />
Harder J, Rieck<strong>en</strong> B, Kummer O, Lohrmann C, Otto F, Usadel H, et al. Outpati<strong>en</strong>t chemotherapy with<br />
gemcitabine and oxaliplatin in pati<strong>en</strong>ts with biliary tract cancer. Br J Cancer. 2006;95(7):848.<br />
Hoekstra LT, van Gulik TM, Gouma DJ, Busch OR. Posthepatectomy bile leakage: How to manage. Dig<br />
Surgery 2012; 29(1); 48-53.<br />
Huang CS, Li<strong>en</strong> HH, J<strong>en</strong>g JY, Huang SH. Role of laparoscopic cholecystectomy in the managem<strong>en</strong>t of<br />
polypoid lesions of the gallbladder. Surg Laparosc Endosc Percutan Tech. 2001;11:242-7.<br />
Hueman MT, Vollmer Jr CM and Pawlik TM. Evolving strategies for gallbladder cancer. Ann Surg Oncol.<br />
2009;16:2101-15.<br />
Ikeyama T, Nagino M, Oda K, Ebata T, Nishio H, Nimura Y. Surgical approach to Bismuth type I and II<br />
hilar cholangiocarcinoma. Ann Surg 2007; 246: 1052-57<br />
Isambert M, Leux C, Metairie S, Paineau J. Incid<strong>en</strong>tally-discovered gallbladder cancer: Wh<strong>en</strong>, why and<br />
which reoperation? J Visc Surg. 2011;148:e77-e84.<br />
Ito K, Ito H, All<strong>en</strong> PJ, Gon<strong>en</strong> M, Klimstra D, D’Angelica MI, Fong Y, et al. Adequate lymph node<br />
assessm<strong>en</strong>t for extrahepatic bile duct ad<strong>en</strong>ocarcinoma. Ann Surg 2010; 251: 675-81<br />
Jarnagin WR, Fong Y, DeMatteo RP, Gon<strong>en</strong> M, Burke EC, Bodniewicz BJ et al. Staging, resectability,<br />
and outcome in 225 pati<strong>en</strong>ts with hilar cholangiocarcinoma. Ann Surg 2001; 234(4):507-17<br />
Jin K, Lan H, Zhu T, He K and T<strong>en</strong>g L. Gallbladder carcinoma incid<strong>en</strong>tally <strong>en</strong>countered during<br />
laparoscopic cholecystectomy: how to deal with it. Clin Transl Oncol. 2011;13:25-33<br />
Joseph S, Connor S, Gard<strong>en</strong> OJ. Staging laparoscopy for cholangiocarcinoma. HPB 2008; 10: 116-9.<br />
Kawasaki S, Imamura H, Kobayashi A, Noike T, Miwa S, Miyagawa S. Results of surgical resection for<br />
pati<strong>en</strong>ts with hilar bile duct cancer. Application of ext<strong>en</strong>ded hepatectomy after biliary drainage and<br />
hemihepatic portal vein embolization. Ann Surg 2003; 238: 84-92<br />
Kitagawa Y, Nagino M, Kamiya J, Uesaka K, Sano T, Yamamoto H, et al. Lymph node metastasis from<br />
hilar cholangiocarcinoma: Audit of 110 pati<strong>en</strong>ts who underw<strong>en</strong>t regional and paraaortic node dissection.<br />
Ann Surg 2001; 233: 385-92.<br />
Kloek JJ, van Deld<strong>en</strong> OM, Erdogan D, t<strong>en</strong> Kate FJ, Rauws EA, Busch OR, et al. Differ<strong>en</strong>tiation of<br />
malignant and proximal bile duct strictures: The diagnostic dilemma. World J Gastro<strong>en</strong>terol 2008;<br />
14:5032-8.<br />
Kloek JJ, T<strong>en</strong> Kate FJ, Busch OR, Gouma DJ, van Gulik TM. Surgery for extrahepatic<br />
cholangiocarcinoma: predictors of survival. HPB (Oxford) 2008; 10(3):190-195.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 68 van 75<br />
11 juli 2012
2416<br />
2417<br />
2418<br />
2419<br />
2420<br />
2421<br />
2422<br />
2423<br />
2424<br />
2425<br />
2426<br />
2427<br />
2428<br />
2429<br />
2430<br />
2431<br />
2432<br />
2433<br />
2434<br />
2435<br />
2436<br />
2437<br />
2438<br />
2439<br />
2440<br />
2441<br />
2442<br />
2443<br />
2444<br />
2445<br />
2446<br />
2447<br />
2448<br />
2449<br />
2450<br />
2451<br />
2452<br />
2453<br />
2454<br />
2455<br />
2456<br />
2457<br />
2458<br />
2459<br />
2460<br />
2461<br />
2462<br />
2463<br />
2464<br />
Kloek JJ, van der Gaag NA, Aziz Y, Rauws EA, van Deld<strong>en</strong> OM, Lameris JS, et al. Endoscopic and<br />
percutaneous preoperative biliary drainage in pati<strong>en</strong>ts with suspected hilar cholangiocarcinoma. J<br />
Gastrointest Surg 2010<br />
Kobayashi A, Oda T, Fukunaga K, Sasaki R, Ohkohchi N. Invasion of the hepatic artery is a crucial<br />
predictor of poor outcomes in gallbladder carcinoma. World J Surg. 2012 Mar;36(3):645-50. PubMed<br />
PMID: 22270983.<br />
Koga A, Watanabe K, Fukuyama T, et al. Diagnosis and operative indications for polypoid lesions of the<br />
gallbladder. Arch Surg 1988;123:26-9.<br />
Kondo S, Nimura Y, Hayakawa N, et al. Regional and para-aortic lymphad<strong>en</strong>ectomy in radical surgery for<br />
advanced gallbladder carcinoma. Br J Surg. 2000;87:418-22.<br />
Kopek N, Holt MI, Hans<strong>en</strong> AT, Høyer M. Stereotactic body radiotherapy for unresectable<br />
cholangiocarcinoma. Radiother Oncol. 2010 Jan;94(1):47-52.<br />
Kosuge T, Yamamoto J, Shimada K, Yamasaki S, Makuuchi M. Improved surgical results for hilar<br />
cholangiocarcinoma with procedures including major hepatic resection. Ann Surg. 1999 Nov;230(5):663-<br />
71.<br />
Kozuka S, Tsubone N, Yasui A, et al. Relation of ad<strong>en</strong>oma to carcinoma in the gallbladder. Cancer 1982;<br />
50: 2226-34.<br />
Kubota K, Bandai Y, Noie T, et al. How should polypoid lesions of the gallbladder be treated in the era of<br />
laparoscopic cholecystectomy. Surgery. 1995;117:481-7.<br />
Lai EC, Lau WY. Gallbladder cancer – a compreh<strong>en</strong>sive review. Surgeon. 2008;6:101-10.<br />
Lee KF, Wong J, Li JC, Lai PB. Polypoid lesions of the gallbladder. Am J Surg. 2004;188:186-90.<br />
Lee SE, Jang JY, Lim CS, Kang MJ and Kim SW. Systematic review on the surgical treatm<strong>en</strong>t for T1<br />
gallbladder cancer. World J Gastro<strong>en</strong>terol. 2011;17:174-80.<br />
Lemm<strong>en</strong>s VE, Bosscha K, van der Schelling G, Br<strong>en</strong>ninkmeijer S, et al. Improving outcome for pati<strong>en</strong>ts<br />
with pancreatic cancer through c<strong>en</strong>tralization. Br J Surg. 2011 Oct;98(10):1455-62.<br />
Leung UC, Wong PY, Roberts RH, et al. Gall bladder polyps in sclerosing cholangitis: does the 1-cm rule<br />
apply? ANZ J Surg 2007;77:355–7.<br />
Li N, Liu C, Bi W, Lin X, Jiao H, Zhao P. MRCP and 3D LAVA imaging of extrahepatic<br />
cholangiocarcinoma at 3T MRI. Clin Radiol. 2011 Dec 1. [Epub ahead of print].<br />
Maker AV, Butte JM, Ox<strong>en</strong>berg J et al. Is port site resection necessary in the surgical managem<strong>en</strong>t of<br />
gallbladder cancer? Ann Surg Oncol. 2012;19:409-17.<br />
Manzione L, Romano R, Germano D. Chemotherapy with gemcitabine and oxaliplatin in pati<strong>en</strong>ts with<br />
advanced biliary tract cancer: a single-institution experi<strong>en</strong>ce. Oncology. 2007;73(5-6):311.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 69 van 75<br />
11 juli 2012
2465<br />
2466<br />
2467<br />
2468<br />
2469<br />
2470<br />
2471<br />
2472<br />
2473<br />
2474<br />
2475<br />
2476<br />
2477<br />
2478<br />
2479<br />
2480<br />
2481<br />
2482<br />
2483<br />
2484<br />
2485<br />
2486<br />
2487<br />
2488<br />
2489<br />
2490<br />
2491<br />
2492<br />
2493<br />
2494<br />
2495<br />
2496<br />
2497<br />
2498<br />
2499<br />
2500<br />
2501<br />
2502<br />
2503<br />
2504<br />
2505<br />
2506<br />
2507<br />
2508<br />
2509<br />
2510<br />
2511<br />
Markar SR, Karthikesalingam A, Thrumurthy S, Low DE. Volume-Outcome Relationship in Surgery for<br />
Esophageal malignancy: Systematic Review and Meta-analysis 2000-2011. J Gastrointest Surg. 2011<br />
Nov 17.<br />
Melville A. Better quality of care for UGI cancer pati<strong>en</strong>ts. Nurs Times 2001; 97:36-7<br />
Mihalache F, Tantau M, Diaconu B, Acalovschi M. Survival and Quality of Live of cholangiocarcinoma<br />
pati<strong>en</strong>ts: a prospective study over a 4 year period. J Gastrointestin Liver Dis;2010(9):19(3);285-290.<br />
Miller G, Jarnagin WR. Gallbladder carcinoma. Eur J Surg Oncol. 2008;34:306-12<br />
Miyazaki M, Kato A, Ito H, Kimura F, Shimizu H, Ohtsuka M, et al. Combined vascular resection in<br />
operative resection for hilar cholangiocarcinoma: Does it work or not? Surgery 2007; 141: 581-8.<br />
Mohamadnejad M, DeWitt JM, Sherman S, et al. Role of EUS for preoperative evaluation of<br />
cholangiocarcinoma: a large single-c<strong>en</strong>ter experi<strong>en</strong>ce. Gastrointest Endosc 2011;73:71-8<br />
Momm F, Schubert E, H<strong>en</strong>ne K, Hodapp N, Frommhold H, Harder J, et al. Stereotactic fractionated<br />
radiotherapy for Klatskin tumours. Radiother Oncol. 2010 Apr;95(1):99-102. Epub 2010 Mar 26. PubMed<br />
PMID: 20347169.<br />
Morganti AG, Trodella L, Val<strong>en</strong>tini V, Montemaggi P, Costamagna G, Smaniotto D, et al. Combined<br />
modality treatm<strong>en</strong>t in unresectable extrahepatic biliary carcinoma. Int J Radiat Oncol Biol Phys. 2000 Mar<br />
1;46(4):913-9.<br />
Murakami Y, Uemura K, Sudo T, Hashimoto Y, Nakashima A, Kondo N, et al . Prognostic factors of<br />
pati<strong>en</strong>ts with advanced gallbladder carcinoma following aggressive surgical resection. J Gastrointest<br />
Surg. 2011 Jun;15(6):1007-16. Epub 2011 Mar 10. PubMed PMID: 21547707.<br />
Nagino M, Kamiya J, Nishio H, Ebata T, Arai T, Nimura Y. Two Hundred Forty Consecutive Portal Vein<br />
Embolizations Before Ext<strong>en</strong>ded Hepatectomy for Biliary Cancer: Surgical Outcome and Long-term<br />
Follow-Up. Ann Surg 2006; 243(3): 364-72.<br />
Nederlandse Ver<strong>en</strong>iging van Heelkunde. Normering chirurgische behandeling<strong>en</strong>. <strong>Versie</strong> 2.0, september<br />
2011. URL<br />
Negi SS, Singh A, Chaudhary A. Lymph nodal involvem<strong>en</strong>t as prognostic factor in gallbladder cancer:<br />
location, count or ratio? J Gastrointest Surg. 2011 Jun;15(6):1017-25. Epub 2011 Apr 13. PubMed PMID:<br />
21487831.<br />
Nehls O, Oettle H, Hartmann JT, Hofheinz RD, Hass HG, Horger MS, et al. Capecitabine plus oxaliplatin<br />
as first-line treatm<strong>en</strong>t in pati<strong>en</strong>ts with advanced biliary system ad<strong>en</strong>ocarcinoma: a prospective multic<strong>en</strong>tre<br />
phase II trial. Br J Cancer. 2008;98(2):309.<br />
Neuhaus P, Jonas S, Bechstein WO, Lohmann R, Radke C, Kling N et al. Ext<strong>en</strong>ded resections for hilar<br />
cholangiocarcinoma. Ann Surg 1999; 230(6):808-818.<br />
Neuhaus P, Thel<strong>en</strong> A. Radical surgery for right-sided klatskin tumor. HPB (Oxford) 2008; 10(3):171-3.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 70 van 75<br />
11 juli 2012
2512<br />
2513<br />
2514<br />
2515<br />
2516<br />
2517<br />
2518<br />
2519<br />
2520<br />
2521<br />
2522<br />
2523<br />
2524<br />
2525<br />
2526<br />
2527<br />
2528<br />
2529<br />
2530<br />
2531<br />
2532<br />
2533<br />
2534<br />
2535<br />
2536<br />
2537<br />
2538<br />
2539<br />
2540<br />
2541<br />
2542<br />
2543<br />
2544<br />
2545<br />
2546<br />
2547<br />
2548<br />
2549<br />
2550<br />
2551<br />
2552<br />
2553<br />
2554<br />
2555<br />
2556<br />
2557<br />
2558<br />
2559<br />
2560<br />
2561<br />
Nimura Y. Preoperative biliary drainage before resection for cholangiocarcinoma (Pro). HPB (Oxford).<br />
2008;10(2):130-3.<br />
Okusaka T, Nakachi K, Fukutomi A, Mizuno N, Ohkawa S, Funakoshi A, et al. Gemcitabine alone or in<br />
combination with cisplatin in pati<strong>en</strong>ts with biliary tract cancer: a comparative multic<strong>en</strong>tre study in Japan.<br />
Br J Cancer. 2010;103(4):469.<br />
Ouchi K, Mikuni J, Kakugawa Y. Laparoscopic cholecystectomy for gallbladder carcinoma: results of a<br />
Japanese survey of 498 pati<strong>en</strong>ts. J Hepatobiliary Pancreat Surg. 2002;9:256-60<br />
Park HS, Lee JM, Choi JY, Lee MW, Kim HJ, Han JK, et al. Preoperative evaluation of bile duct cancer:<br />
MRI combined with MR cholangiopancreatography versus MDCT with direct cholangiography AJR Am J<br />
Ro<strong>en</strong>tg<strong>en</strong>ol. 2008 Feb;190(2):396-405.<br />
Park JY, Hong SP, Kim YJ, et al. Long-term follow up of gallbladder polyps. J Gastro<strong>en</strong>terol Hepatol<br />
2009;24:219–22.<br />
Park J, Kim MH, Kim KP, Park do H, Moon SH, Song TJ, et al. Natural History and Prognostic Factors of<br />
Advanced Cholangiocarcinoma without Surgery, Chemotherapy, or Radiotherapy: A Large-Scale<br />
Observational Study. Gut Liver. 2009 Dec;3(4):298-305.<br />
Park JS, Yoon DS, Kim KS, Choi JS, Lee WJ, Chi HS, Kim BR. Actual recurr<strong>en</strong>ce patterns and risk<br />
factors influ<strong>en</strong>cing recurr<strong>en</strong>ce after curative resection with stage II gallbladder carcinoma. J Gastrointest<br />
Surg. 2007 May;11(5):631-7.<br />
Park SH, Park YH, Lee JN, Bang SM, Cho EK, Shin DB, et al. Phase II study of epirubicin, cisplatin, and<br />
capecitabine for advanced biliary tract ad<strong>en</strong>ocarcinoma. Cancer. 2006;106(2):361.<br />
Pawlik TM, Gleisner AL, Vigano L, et al. Incid<strong>en</strong>ce finding residual disease for incid<strong>en</strong>tal gallbladder<br />
carcinoma: implications for re-resection J Gastrointest Surg. 2007;11:1478-87.<br />
Pawlik TM, Choti MA. Biology dictates prognosis following resection of gallbladder carcinoma: sometimes<br />
less is more. Ann Surg Oncol 2009;16:787-8.<br />
Pearlstone DB, Mansfield PF, Curley SA et al. Laparoscopy in 533 pati<strong>en</strong>ts with abdominal malignancy.<br />
Surgery. 1999;125-67-72.<br />
Persley KM. Acalculous cholecystitis, cholesterolosis, ad<strong>en</strong>omyomatosis, and polyps of the gallbladder.<br />
In: Feldman M, Friedman LS, Brandt LJ, editors. Sleis<strong>en</strong>ger & Fordtran’s gastrointestinal and liver<br />
disease. 8th edition. Philadelphia (PA): Saunders; 2006. p. 1450–6.<br />
Petrowsky H, Wildbrett P, Husarik DB, Hany TF, Tam S, Jochum W, et al. Impact of integrated positron<br />
emission tomography and computed tomography on staging and managem<strong>en</strong>t of gallbladder<br />
cancer and cholangiocarcinoma. J Hepatol. 2006 Jul;45(1):43-50. Epub 2006 Apr 19.<br />
Piehler JM, Crichlow RW. Primary carcinoma of the gallbladder. Surg Gynecol Obstet. 1978;147:929-42.<br />
Pilgrim C, Usatoff V, EvansPM. A review of the surgical strategies for the managem<strong>en</strong>t of gallbladder<br />
carcinoma based on T stage and growth type of the tumour. Eur J Surg Oncol. 2009;35:903-7.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 71 van 75<br />
11 juli 2012
2562<br />
2563<br />
2564<br />
2565<br />
2566<br />
2567<br />
2568<br />
2569<br />
2570<br />
2571<br />
2572<br />
2573<br />
2574<br />
2575<br />
2576<br />
2577<br />
2578<br />
2579<br />
2580<br />
2581<br />
2582<br />
2583<br />
2584<br />
2585<br />
2586<br />
2587<br />
2588<br />
2589<br />
2590<br />
2591<br />
2592<br />
2593<br />
2594<br />
2595<br />
2596<br />
2597<br />
2598<br />
2599<br />
2600<br />
2601<br />
2602<br />
2603<br />
2604<br />
2605<br />
2606<br />
2607<br />
2608<br />
2609<br />
2610<br />
Polistina FA, Guglielmi R, Baiocchi C, Francescon P, Scalchi P, Febbraro A, et al. Chemoradiation<br />
treatm<strong>en</strong>t with gemcitabine plus stereotactic body radiotherapy for unresectable, non-metastatic, locally<br />
advanced hilar cholangiocarcinoma. Results of a five year experi<strong>en</strong>ce. Radiother Oncol. 2011<br />
May;99(2):120-3. Epub 2011 May 27. PubMed PMID: 21621289<br />
Rahbari NN, Gard<strong>en</strong> OJ, Padbury R, Brooke-Smith M, et al. Posthepatectomy liver failure: a def<strong>en</strong>ition<br />
and grading by the International Study Group of Liver Surger (ISGLS). Surgery 2011; 149: 1383-8.<br />
Rao S, Cunningham D, Hawkins RE, Hill ME, Smith D, Daniel F, et al. Phase III study of 5FU, etoposide<br />
and leucovorin (FELV) compared to epirubicin, cisplatin and 5FU (ECF) in previously untreated pati<strong>en</strong>ts<br />
with advanced biliary cancer. Br J Cancer. 2005;92(9):1650.<br />
Ricardo AE, Feig BW, Ellis LM et al. Gallbladder cancer and trocar site recurr<strong>en</strong>ces. Am J Surg.<br />
1997;174:619-22.<br />
Robles R, Figueras J, Turrion VS, et al. Spanish experi<strong>en</strong>ce in liver transplantation for hilar and<br />
peripheral cholangiocarcinoma. Ann Surg. 2004;239:265-71.<br />
Ros<strong>en</strong> CB, Heimbach JK and Gores GJ. Liver transplantation for cholangiocarcinoma. Transpl Int.<br />
2010;23:692-7.<br />
Ruys AT, Busch OR, Gouma DJ, van Gulik TM. Staging laparoscopy for hilar cholangiocarcinoma: is it<br />
still worthwhile? Ann Surg Oncol. 2011 Sep;18(9):2647-53.<br />
Ruys et al. FDG-positron emission tomography/computed tomography and standardized uptake value in<br />
the primary diagnosis and staging of hilar cholangiocarcinoma. HPB (Oxford). 2011 Apr;13(4):256-62<br />
Sasaki R, Itabashi H, Fujita T et al. Significance of ext<strong>en</strong>sive surgery including resection of the pancreas<br />
head for the treatm<strong>en</strong>t of gallbladder cancer – from the perspective of mode of lymph node involvem<strong>en</strong>t<br />
and surgical outcome. World J Surg. 2006;30-36-42.<br />
Schreck<strong>en</strong>bach T, Liese J, Bechstein WO, Mo<strong>en</strong>sch C. Posthepatectomy liver failure. Dig Surg 2012;<br />
29(1); 79-85.<br />
Sewnath ME, Karst<strong>en</strong> TM, Prins MH, Rauws EJ, et al. A meta nalysis on the efficacy of preoperative<br />
biliary drainage for tumors causing obstructive jaundice. Ann Surg 2002; 236:17-27.<br />
Seyama Y, Kubota K, Sano K, Noie T, Takayama T, Kosuge T et al. Long-term outcome of ext<strong>en</strong>ded<br />
hemihepatectomy for hilar bile duct cancer with no mortality and high survival rate. Ann Surg 2003;<br />
238(1):73-83.<br />
Shih SP, Schulick RD, Cameron JL et al. Gallbladder cancer: the role of laparoscopy and radical<br />
resection. Ann Surg. 2007;245:893-901.<br />
Shinkai H, Kimura W, Muto T. Surgical indications for small polypoid lesions of the gallbladder. Am J<br />
Surg 1998;175:114–7.<br />
Shirai Y, Yoshida K, Tsukada K et al. Inappar<strong>en</strong>t carcinoma of the gallbladder. An appraisal of a radical<br />
second operation after simple cholecystectomy. Ann Surg. 1992;215:326-31.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 72 van 75<br />
11 juli 2012
2611<br />
2612<br />
2613<br />
2614<br />
2615<br />
2616<br />
2617<br />
2618<br />
2619<br />
2620<br />
2621<br />
2622<br />
2623<br />
2624<br />
2625<br />
2626<br />
2627<br />
2628<br />
2629<br />
2630<br />
2631<br />
2632<br />
2633<br />
2634<br />
2635<br />
2636<br />
2637<br />
2638<br />
2639<br />
2640<br />
2641<br />
2642<br />
2643<br />
2644<br />
2645<br />
2646<br />
2647<br />
2648<br />
2649<br />
2650<br />
2651<br />
2652<br />
2653<br />
2654<br />
2655<br />
2656<br />
2657<br />
2658<br />
2659<br />
Shirai Y, Ohtani T, Tsukada K, Hatakeyama K. Combined pancreaticoduod<strong>en</strong>ectomy and hepatectomy<br />
for pati<strong>en</strong>ts with locally advanced gallbladder carcinoma : long term results. Cancer. 1997;80:1904-09.<br />
Skipworth JR, Olde Damink SW, Imber C, Bridgewater J, Pereira SP, Malagó M. Review article: surgical,<br />
neo-adjuvant and adjuvant managem<strong>en</strong>t strategies in biliary tract cancer. Alim<strong>en</strong>t Pharmacol Ther. 2011<br />
Nov;34(9):1063-78.<br />
Sun CD, Zhang BY, Wu LQ et al. Laparoscopic cholecystectomy for treatm<strong>en</strong>t of unexpected early-stage<br />
gallbladder cancer. J Surg Oncol. 2005;91:253-57.<br />
Sudan DL, DeRoover A, Chinnkotla S, et al. Radiochemotherapy and transplantation allow long-term<br />
survival for nonresectable hilar cholangiocarcinoma. Am J Transplant. 2002;2:774-9.<br />
Takada T, Amano H, Yasuda H, Nimura Y, Matsushiro T, Kato H, et al; Study Group of Surgical Adjuvant<br />
Therapy for Carcinomas of the Pancreas and Biliary Tract. Is postoperative adjuvant chemotherapy<br />
useful for gallbladder carcinoma? A phase III multic<strong>en</strong>ter prospective randomized controlled trial in<br />
pati<strong>en</strong>ts with resected pancreaticobiliary carcinoma. Cancer. 2002 Oct 15;95(8):1685-95.<br />
Terzi C, Sokm<strong>en</strong> S, Seckin S, et al. Polypoid lesions of the gallbladder: report of 100 cases with special<br />
refer<strong>en</strong>ce to operative indications. Surgery 2000;127: 622–7.<br />
Thongprasert S, Napapan S, Charo<strong>en</strong>tum C, Moonprakan S. Phase II study of gemcitabine and cisplatin<br />
as first-line chemotherapy in inoperable biliary tract carcinoma. Ann Oncol. 2005;16(2):279-81.<br />
Tilleman EH, de Castro SM, Busch OR, Bemelman WA, Van Gulik TM, Obertop H, et al. Diagnostic<br />
laparoscopy and laparoscopic ultrasound for staging of pati<strong>en</strong>ts with malignant proximal bile duct<br />
obstruction. J Gastrointest Surg. 2002 May-Jun;6(3):426-30; discussion 430-1.<br />
Valle JW, Wasan H, Johnson P, Jones E, Dixon L, Swindell R, et al. Gemcitabine alone or in combination<br />
with cisplatin in pati<strong>en</strong>ts with advanced or metastatic cholangiocarcinomas or other biliary tract tumours:<br />
a multic<strong>en</strong>tre randomised phase II study. Br J Cancer. 2009;101(4):621.<br />
Valle J, Wasan H, Palmer DH, Cunningham D, Anthoney A, Maraveyas A, et al. ABC-02 Trial<br />
Investigators Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med.<br />
2010;362(14):1273.<br />
Van d<strong>en</strong> Broek MA, Olde Damink SW, De Jong CH, Lang H, et al. Liver failure after partial hepatic<br />
resection: def<strong>en</strong>ition, pathopathology, risk factors and treatm<strong>en</strong>t. Liver Int 2008; 28:767-780.<br />
Van der Gaag NA, Kloek JJ, de Castro SM, Busch OR, van Gulik TM, Gouma DJ. Preoperative biliary<br />
drainage in pati<strong>en</strong>ts with obstructive jaundice: history and curr<strong>en</strong>t status. J Gastrointest Surg. 2009<br />
Apr;13(4):814-20.<br />
Van der Gaag NA, Rauws EA, van Eijck CH, Bruno MJ, van der Harst E, Kubb<strong>en</strong> FJ, et alPreoperative<br />
biliary drainage for cancer of the head of the pancreas. N Engl J Med. 2010 Jan 14;362(2):129-37.<br />
van Gulik TM, Gouma DJ. Changing perspectives in the assessm<strong>en</strong>t of resectability of hilar<br />
cholangiocarcinoma. Ann Surg Oncol. 2007 Jul;14(7):1969-71.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 73 van 75<br />
11 juli 2012
2660<br />
2661<br />
2662<br />
2663<br />
2664<br />
2665<br />
2666<br />
2667<br />
2668<br />
2669<br />
2670<br />
2671<br />
2672<br />
2673<br />
2674<br />
2675<br />
2676<br />
2677<br />
2678<br />
2679<br />
2680<br />
2681<br />
2682<br />
2683<br />
2684<br />
2685<br />
2686<br />
2687<br />
2688<br />
2689<br />
2690<br />
2691<br />
2692<br />
2693<br />
2694<br />
2695<br />
2696<br />
2697<br />
2698<br />
2699<br />
2700<br />
2701<br />
2702<br />
2703<br />
2704<br />
2705<br />
2706<br />
2707<br />
Van Gulik TM, Dinant S, Busch OR, Rauws EA, Obertop H, Gouma DJ. New surgical approaches to the<br />
Klatskin tumour. Alim<strong>en</strong>t Pharmacol Ther 2007; 26 Suppl 2:127-32.<br />
Van Gulik TM, Kloek JJ, Ruys AT, Busch OR, van Ti<strong>en</strong>hov<strong>en</strong> GJ, Lameris JS, Rauws EA, Gouma DJ<br />
Multidisciplinary managem<strong>en</strong>t of hilar cholangiocarcinoma (Klatskin tumor): ext<strong>en</strong>ded resection is<br />
associated with improved survival. Eur J Surg Oncol 2011; 37(1): 65-71.<br />
van Heek NT, Kuhlmann KF, Scholt<strong>en</strong> RJ, et al. Hospital volume and mortality after pancreatic resection:<br />
a systematic review and an evaluation of interv<strong>en</strong>tion in the Netherlands. Ann Surg. 2005;242:781-8.<br />
Velde CJH van de, Kriek<strong>en</strong> JHJM van, Mulder PHM de, Vermork<strong>en</strong> JB. Oncologie, 7e dr. Hout<strong>en</strong>: Bohn<br />
Stafleu van Loghum; 2005.<br />
Vern-Gross TZ, Shivnani AT, Ch<strong>en</strong> K, Lee CM, Tward JD, MacDonald OK, et al. Survival outcomes in<br />
resected extrahepatic cholangiocarcinoma: effect of adjuvant radiotherapy in a surveillance,<br />
epidemiology, and <strong>en</strong>d results analysis. Int J Radiat Oncol Biol Phys. 2011 Sep 1;81(1):189-98<br />
Vilgrain V. Staging cholangiocarcinoma by imaging studies. HPB (Oxford). 2008;10(2):106-9.<br />
Wagner AD, Buechner-Steudel P, Moehler M, Schmal<strong>en</strong>berg H, Behr<strong>en</strong>s R, Fahlke J, et al. Gemcitabine,<br />
oxaliplatin and 5-FU in advanced bile duct and gallbladder carcinoma: two parallel, multic<strong>en</strong>tre phase-II<br />
trials. Br J Cancer. 2009;101(11):1846.<br />
Wakai T, Shiraiu Y, Moroda T, Yokoyama N, Hatakeyama K. Impact of ductal resection margin status on<br />
long-term survival in pati<strong>en</strong>ts undergoing resection for extrahepatic cholangiocarcinoma. Cancer 2005;<br />
103: 1210-6.<br />
Weber A, Schmid RM, Prinz C. Diagnostic approaches for cholangiocarcinoma. World J Gastro<strong>en</strong>terol.<br />
2008 Jul 14;14(26):4131-6. Review.<br />
Weber A, Roland M Schmid, Christian Prinz. Diagnostic approaches for cholangiocarcinoma. World J<br />
Gastro<strong>en</strong>terol 2008 July 14; 14(26): 4131-4136<br />
Weber SM, DeMatteo RP, Fong y, Blumgart LH, Jarnagin WR. Staging laparoscopy in pati<strong>en</strong>ts with<br />
extra-hepatic biliary carcinoma. Ann Surg. 2002;235:392-9.<br />
Yamaguchi K, Chijiiwa K, Saiki S, Nishihara K, Takashima M, Kawakami K, Tanaka M. Retrospective<br />
analysis of 70 operations for gallbladder carcinoma. Br J Surg. 1997 Feb;84(2):200-4. PubMed PMID:<br />
9052434.<br />
Yang HL, Sun YG, Wang Z. Polypoid lesions of the gallbladder: diagnosis and indications for surgery. Br<br />
J Surg 1992;79:227–9.<br />
Z’gragg<strong>en</strong> K, Birrer S, Maurer CA et al. Incid<strong>en</strong>ce of port site recurr<strong>en</strong>ce after laparoscopic<br />
cholecystectomy for preoperatively unsuspected gallbladder carcinoma. Surgery. 1998;124:831-38<br />
Zielinski MD, Atwell TD, Davis PW, et al. Comparison of surgically resected polypoid lesions of the<br />
gallbladder to their pre-operative ultrasound characteristics. J Gastrointest Surg 2009;13:19–25.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 74 van 75<br />
11 juli 2012
2708<br />
2709<br />
2710<br />
2711<br />
No authors listed. Collective review of 503 cases of small polypoid lesions (less than 20mm in maximum<br />
diameter) of the gallbladder: size distribution in various diseases and the depth of carcinomatous<br />
invasion, Nihon Shokakibyo Gakkai Zasshi 1986;83:2086-7.<br />
Concept <strong>Richtlijn</strong> galweg- <strong>en</strong> galblaascarcinoom vs accoord werkgroep Pagina 75 van 75<br />
11 juli 2012