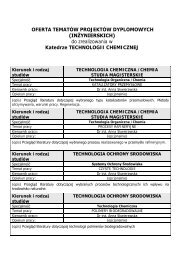
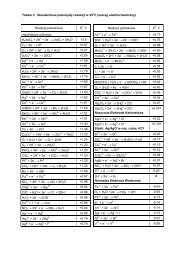
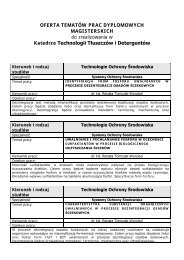
Slajdy z notatkami - Katedra Chemii Fizycznej
Slajdy z notatkami - Katedra Chemii Fizycznej
Slajdy z notatkami - Katedra Chemii Fizycznej
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Chemia Fizyczna<br />
Technologia Chemiczna II rok<br />
Wykład 1<br />
Kierownik przedmiotu:<br />
Dr hab. inż. Wojciech Chrzanowski<br />
Pozostali prowadzący:<br />
ćwiczenia rachunkowe<br />
Dr inż. Marek Kluczkowski<br />
Dr inż. Roman Pastewski<br />
Sam też prowadzę 2 grupy.<br />
Laboratorium:<br />
kierownik laboratorium:<br />
dr inż. Roman Pastewski<br />
1
Kontakt,informacja i konsultacje<br />
• Chemia „A”; pokój 307<br />
• Telefon: 347-2769<br />
• E-mail: wojtek@chem.pg.gda.pl<br />
• tablica ogłoszeń Katedry <strong>Chemii</strong> <strong>Fizycznej</strong><br />
http://www.pg.gda.pl/chem/Dydaktyka/ lub<br />
http://www.pg.gda.pl/chem/Katedry/Fizyczna<br />
• Konsultacje: do uzgodnienia.<br />
Chem. Fiz. TCH II/01 2<br />
Brak czasu i miejsca na omówienie szczegółów technicznych zaliczania<br />
przedmiotu.<br />
Obowiązuje to co już wisi w gablocie i jest w sieci WWW<br />
2
Co to jest chemia fizyczna<br />
Przedmiot:<br />
Definicja dziedziny nauki<br />
Przemiany fizyczne i chemiczne materii (bez wyróżniana jej rodzaju)<br />
i związane z nimi przepływy energii.<br />
Metoda:<br />
Matematyczno-fizyczna, tj. tworzenie modeli teoretycznych w<br />
oparciu o obserwacje doświadczalne. Formułowanie hipotez, teorii<br />
oraz praw natury w odniesieniu do swojego przedmiotu.<br />
Chem. Fiz. TCH II/01 3<br />
Przedmiot nie jest tu wyróżniony na zasadzie rodzaju materii, jak w chemii<br />
nieorganicznej, organicznej, czy biochemii, chemii polimerów, peptydów, itp.<br />
Chemia fizyczna jest teorią chemii. Mogą oczywiście istnieć takie przedmioty jak<br />
Fizyczna Chemia Nieorganiczna, Fizyczna Chemia Organiczna.<br />
Nazwę swą Chemia Fizyczna zyskała w XIX wieku, kiedy to zaczęto do chemii<br />
przykładać rygory (i metodę) fizyki.<br />
Działy chemii fizycznej związane z oddziaływaniem specyficznych energii na<br />
materię<br />
Fizyka chemiczna.<br />
Działy (subdyscypliny) chemii fizycznej związane z oddziaływaniem z materią<br />
różnych from (rodzajów) energii:<br />
otochemia, sonochemia.<br />
3
Pojęcia podstawowe (1)<br />
Materią jest wszystko, co posiada masę (bezwładność, Newton).<br />
Substancją chemiczną nazwiemy czystą, wyodrębnioną postać materii<br />
(miara ilości substancji, jednostka: mol)<br />
Energia jest to zdolność do wykonania pracy (upr.).<br />
(rodzaje energii, jednostka: dżul, J)<br />
Równoważność materii i energii<br />
E=mc 2<br />
W praktyce, efekty relatywistyczne i kwantowe występują tylko w mikroświecie,<br />
w skali makroskopowej są one pomijalne.<br />
Chem. Fiz. TCH II/01 4<br />
Jednostki, układ SI.<br />
Rodzaje energii: mechaniczna, cieplna, chemiczna, elektryczna, jądrowa,<br />
promienista (elektromagnetyczna).<br />
Nośniki energii: masa (mechaniczna, cieplna), wiązania chemiczne, pole<br />
elektromagnetyczne.<br />
Prawa zachowania: masy, energii (i pokrewne, np. pędu).<br />
4
Pojęcia podstawowe (2)<br />
Energia kinetyczna – energia ruchu:<br />
E k =½mv 2<br />
Energia potencjalna – zależna od położenia:<br />
w polu grawitacyjnym w polu elektrycznym<br />
(ziemskim)<br />
E p =mgh E p =q 1 q 2 /(4πε 0 r)<br />
Chem. Fiz. TCH II/01 5<br />
Rodzaje energii: kinetyczna i potencjalna, prawo zachowania energii, różne rodzaje<br />
energii kinetycznej (translacji, rotacji, oscylacji).<br />
5
Pojęcia podstawowe (3)<br />
Modelem teoretycznym jest pewien założony<br />
mechanizm zjawiska lub obraz i zespół właściwości obiektu,<br />
najczęściej uproszczony, starający się zawrzeć najistotniejsze jego<br />
cechy.<br />
Hipotezą jest pewne założenie dotyczące istoty badanego<br />
zjawiska, właściwie próba odgadnięcia modelu w oparciu o znane<br />
dotąd znane pojęcia i prawa.<br />
Teorią nazywamy hipotezę zweryfikowaną w wyniku dalszych<br />
badań, gdy zyskuje ona potwierdzenie i stosuje się do większej<br />
liczby przypadków (obiektów, zjawisk), często pokrewnych.<br />
Chem. Fiz. TCH II/01 6<br />
Gdy hipotetyczny model zostanie zweryfikowany i stanie się modelem<br />
teoretycznym, zazwyczaj się go udoskonala, tj. uwzględnia elementy, które<br />
pierwotnie pominięto dla uproszczenia.<br />
Przykłady znanych modeli: kinetyczny model gazu, gaz doskonały, model atomu<br />
wodoru.<br />
Przykłady znanych ważnych hipotez: hipoteza atomowa Daltona, hipoteza<br />
okresowości Mendelejewa (spektakularnie potwierdzone).<br />
6
Pojęcia podstawowe (4)<br />
Prawo natury (prawo fizykochemiczne) to jasno sformułowany<br />
fragment teorii dotyczący jednego konkretnego zjawiska, czyli<br />
powiązania między różnymi, obserwowalnymi wielkościami<br />
uwikłanymi w to zjawisko.<br />
Sformułowanie werbalne:<br />
Prawo Boyle’a-Mariotte’a:<br />
W stałej temperaturze, objętość gazu zmienia się odwrotnie<br />
proporcjonalnie do jego ciśnienia.<br />
Wzór:<br />
V1 P2<br />
dla T = const. = ; V1P<br />
1 = V2P2<br />
= VP = const.<br />
V P<br />
2<br />
1<br />
Chem. Fiz. TCH II/01 7<br />
Rodzaje praw fizycznych (fizykochemicznych):<br />
Ścisłe (spełniane zawsze), np. prawo Faradaya,<br />
Graniczne, gdy pewna wielkość determinująca obowiązywanie prawa ma zdążać<br />
granicznie do pewnej wartości, najczęściej do zera lub do nieskończoności (bardzo<br />
częste w chemii fizycznej), popularny przykład, prawo Boyle’a-Mariotte’a.<br />
Empiryczne, przybliżone.<br />
Wzajemna przekładalność sformułowania werbalnego i wzoru (bardzo ważne).<br />
Podobnie jeszcze można przekładać na trzecią postać – graficzną, czyli wyrażonej<br />
wzorem zależności funkcyjnej. Ważna umiejętność i należy ją ćwiczyć, albo<br />
odświeżyć z innych przedmiotów.<br />
7
Główne działy:<br />
Termodynamika<br />
Równowagi chemiczne<br />
Równowagi fazowe<br />
Roztwory – charakterystyka termodynamiczna<br />
Elektrochemia: jonika i elektrodyka.<br />
Zjawiska powierzchniowe i koloidy<br />
Kinetyka chemiczna<br />
Podstawy chemii kwantowej.<br />
Chem. Fiz. TCH II/01 8<br />
8
Wprowadzenie do<br />
termodynamiki<br />
Układ (definicja)<br />
Układ jest to fragment rzeczywistości poddany<br />
obserwacji bądź rozważaniom teoretycznym i<br />
wyodrębniony z niej fizycznie lub umownie<br />
Poza układem istnieje jego otoczenie.<br />
układ + otoczenie = wszechświat<br />
Chem. Fiz. TCH II/01 9<br />
Termodynamika będzie się przewijała właściwie przez całą chemię fizyczną.<br />
Zajmować się tu będziemy przede wszystkim tzw. termodynamiką<br />
fenomenologiczną (opisową w skali makro), a jedynie w niewielkiej części<br />
termodynamiką statystyczną (dochodzi do wniosków w skali makro na podstawie<br />
badania rozkładów statystycznych zachowania się cząsteczek w układach.<br />
Układ jest jednym z podstawowych pojęć termodynamiki.<br />
Układ wyodrębniony „umownie” (mentalnie, w wyobraźni) jest po prostu obiektem,<br />
który wyobrażamy sobie w celach rozważań teoretycznych i nadajemy mu rozmaite<br />
cechy. W zależności od tych cech wyróżniamy 3 główne kategorie układów.<br />
9
Wprowadzenie do<br />
termodynamiki<br />
Istnieją trzy rodzaje układów:<br />
Otwarte (mogą wymieniać z otoczeniem materię<br />
i energię)<br />
Zamknięte (mogą wymieniać energię, ale nie<br />
materię)<br />
Izolowane (nie wymieniają z otoczeniem ani<br />
materii, ani energii).<br />
Chem. Fiz. TCH II/01 10<br />
Można też klasyfikować układy inaczej, stosując inne kryteria (np. wyróżniamy<br />
układy jednorodne i niejednorodne; jednoskładnikowe i wieloskładnikowe).<br />
Ten drugi z wymienionych podziałów wydaje się oczywisty, ale omówimy to bliżej<br />
przy okazji równowag fazowych (składniki w sensie termodynamicznym).<br />
Układy jednorodne to takie, w których występuje tylko jedna faza. W układach<br />
niejednorodnych – dwie lub więcej faz. Te pierwsze nazywamy też<br />
homogenicznymi, te drugie – heterogenicznymi.<br />
Fazą nazywamy postać danej materii, która charakteryzuje się jednorodnym stanem<br />
składem chemicznym i stanem fizycznym. Może istnieć więc układ równocześnie<br />
jednoskładnikowy i wielofazowy (np. ciecz i jej para, jeden składnik – dwie fazy).<br />
Dwie odmiany alotropowe pierwiastka też stanowią różne fazy tego samego<br />
składnika, choć bowiem mają ten sam skład chemiczny, to stan fizyczny (np. układ<br />
krystalograficzny) jest odmienny.<br />
10
Wprowadzenie do<br />
termodynamiki<br />
Rodzaje układów:<br />
otwarte zamknięte izolowane<br />
Chem. Fiz. TCH II/01 11<br />
11
Sposoby przekazywania energii:<br />
Na sposób pracy.<br />
Wprowadzenie do<br />
termodynamiki<br />
Na sposób ciepła (jako ciepło).<br />
Rodzaje pracy<br />
Mechaniczna (objętościowa), praca zmiany<br />
powierzchni, praca elektryczna, praca<br />
odkształcenia.<br />
Chem. Fiz. TCH II/01 12<br />
Na początku rozważać będziemy jedynie układy, w których jedyną pracą<br />
wymienianą z otoczeniem jest praca objętościowa.<br />
Praca mechaniczna jest iloczynem siły działającej i drogi (przesunięcia). Stąd 1 J =<br />
1 N × 1 mW przypadku gazów jest to praca związana z przesunięciem tłoka<br />
ograniczającego układ (poruszającego się bez tarcia. Jeżeli tłok ogranicza układ od<br />
góry, to praca będzie iloczynem jego przesunięcia i ciężaru.<br />
Jeżeli układ wykonuje pracę, gaz rozpręża się, tłok się podnosi, to pracy<br />
„wykonanej przez układ” przyznajemy znak (-).<br />
Jeżeli to tłok swoim ciężarem zmniejsza objętość układu, to praca „wykonana na<br />
układzie” ma znak (+).<br />
Pamiętajmy, że punktem odniesienia jest dla nas (chemików) UKŁAD. Jeśli to on<br />
zyskuje energię, ma ona znak (+), jeśli ją traci – znak (-).<br />
Niektóre dziedziny i specjaliści (oraz starsze podręczniki) stosują odmienne<br />
konwencje, np. mechanicy, których interesuje uzyskanie energii z układów<br />
(silników, maszyn). Jak my ją uzyskujemy ma znak (+).<br />
12
Wprowadzenie do<br />
termodynamiki<br />
CIEPŁO<br />
Chem. Fiz. TCH II/01 13<br />
Jeśli przepływ energii pomiędzy układem a otoczeniem związany jest z różnicą<br />
temperatur pomiędzy nim, to mówimy, że energia przekazywana jest na sposób<br />
ciepła (jako ciepło).<br />
Układy, które mogą wymieniać energię jako ciepło, ograniczone są ściankami<br />
określanymi jako diatermiczne.<br />
Układy, które (mimo istniejącej pomiędzy nimi a ich otoczeniem różnicy<br />
temperatur) nie mogą wymieniać ciepła z otoczeniem, ograniczone są ściankami<br />
nazywanym adiabatycznymi. Podobnie określamy przemiany zachodzące w takich<br />
układach.<br />
Jak widzimy na rysunku, mimo, że w obu przypadkach termometry wskazują<br />
różnicę temperatur (otoczenia wyższa), to ciepło (żółta strzałka) wchodzi do układu<br />
po lewej (zielony), który jest zatem ograniczony ściankami diatermicznymi, zaś<br />
prawy (czerwony) ma ścianki uniemożliwiające przekaz energii jako ciepła<br />
(adiabatyczne).<br />
13
Wprowadzenie do<br />
termodynamiki<br />
przed<br />
po<br />
Proces endotermiczny z wymianą<br />
ciepła z otoczeniem<br />
Chem. Fiz. TCH II/01 14<br />
Przemiany zachodzące w układzie określamy jako egzoenergetyczne, jeśli<br />
towarzyszy im wydzielanie energii, a znak tej energii to (-). W szczególności,<br />
procesowi towarzyszy wydzielanie ciepła, to proces nazywamy egzotermicznym, a<br />
ciepło ma znak (-). Przemiany (procesy) endoenergetyczne (endotermiczne)<br />
zachodzą, gdy energia (ciepło) jest podczas nich pobierana (znak (+)). Na rysunku<br />
widoczny jest przebieg procesu endotermicznego w układzie umożliwiającym<br />
wymianę ciepła. Zaraz po jego rozpoczęciu i bezpośrednio po zakończeniu<br />
temperatury otoczenia i układu są takie same (ustalone), a szybkość wnikania ciepła<br />
jest ustalona (zależy od różnicy temperatur).<br />
14
Wprowadzenie do<br />
termodynamiki<br />
przed<br />
po<br />
Proces endotermiczny w układzie<br />
z osłoną adiabatyczną<br />
Chem. Fiz. TCH II/01 15<br />
W tym przypadku, zaraz po rozpoczęciu procesu dane są temperatury otoczenia i<br />
układu (w otoczeniu wyższa).<br />
Ponieważ ciepło nie może przekroczyć bariery adiabatycznej, proces prowadzi do<br />
obniżenia temperatury układu (ciepło jest pobierane z wnętrza samego układu).<br />
Temperatura otoczenia się nie zmienia.<br />
Przy procesie egzotermicznym w układzie z osłoną adiabatyczną sytuacja jest<br />
odwrotna, tzn. po ukończeniu procesu we wnętrzu układu panuje temperatura<br />
wyższa niż na początku.<br />
15
Wprowadzenie do<br />
termodynamiki<br />
Własności fizyczne układów:<br />
Ekstensywne (addytywne, zależne od ilości i<br />
rodzaju składników, wielkości układu)<br />
x<br />
n<br />
= ∑ i =<br />
(np. masa układu lub objętość układu)<br />
Intensywne nie są addytywne.<br />
(np. temperatura, ciśnienie, gęstość, wielkości<br />
molowe)<br />
1<br />
x<br />
i<br />
Chem. Fiz. TCH II/01 16<br />
W ramach jednej fazy własności intensywne są są stałe, a zmieniają się pomiędzy<br />
fazami (skokowo na granicy).<br />
W układzie jednorodnym znajdującym się w stanie równowagi termodynamicznej,<br />
dowolna własność intensywna jest stała – taka sama dla całego układu, jak i dla<br />
dowolnej jego części.<br />
Dlaczego wielkości molowe są intensywne (np. objętość molowa, masa molowa)<br />
Stanem równowagi termodynamicznej nazywamy stan, w którym w układzie nie<br />
zachodzą żadne zmiany. Jeżeli takowe zachodziły samorzutnie, to po dojściu do<br />
stanu równowagi – ustają (o ile na układ nie oddziaływuje otoczenie, ale to jest<br />
warunkiem zmian samorzutnych).<br />
16
Wprowadzenie do<br />
termodynamiki<br />
Parametry stanu:<br />
Wielkości ekstensywne wystarczające do<br />
całkowitego scharakteryzowania stanu układu.<br />
P, V, T<br />
Równanie stanu:<br />
f(P,V,T)=0<br />
Dla gazu doskonałego: pV=nRT<br />
Chem. Fiz. TCH II/01 17<br />
Okazuje się, że dla jednoznacznego scharakteryzowania stanu układu nie trzeba<br />
określać wartości wszystkich jego własności fizycznych. W termodynamice<br />
wystarczą te trzy, a nawet dwa spośród nich, związane są bowiem ze sobą<br />
równaniem stanu.<br />
Równanie stanu gazu rzeczywistego omówimy nieco później ze względu na<br />
konieczność dostosowania wykładu do potrzeb ćwiczeń rachunkowych.<br />
17
Wprowadzenie do<br />
termodynamiki<br />
Temperatura i „zerowa” zasada<br />
termodynamiki<br />
Dwa ciała, które osiągnęły stan równowagi<br />
cieplnej, mają taką samą temperaturę, a ciepło nie<br />
jest już między nimi wymieniane.<br />
Jeżeli ciało A pozostaje w równowadze termicznej z<br />
ciałem B i z ciałem C, to ciała B i C także pozostają<br />
ze sobą w równowadze termicznej (cieplnej).<br />
Chem. Fiz. TCH II/01 18<br />
Temperatura jest to parametr, który posiada identyczną wartość dla wszystkich ciał<br />
znajdujących się w stanie równowagi termicznej.<br />
Zerowa zasada termodynamiki wynika z wcześniej określonych pojęć ciepła (jako<br />
postaci energii wymienianej dzięki istnieniu różnicy temperatur), równowagi<br />
termodynamicznej (w tym przypadku termicznej), oraz kontaktu diatermicznego,<br />
który należy zapewnić między ciałami, aby mogło dojść do ustalenia się stanu<br />
równowagi termicznej.<br />
Postulaty te (twierdzenia przyjmowane bez dowodu) są podstawą pomiaru<br />
temperatury.<br />
18
Wprowadzenie do<br />
termodynamiki<br />
Praca objętościowa<br />
Pzewn<br />
dw = −P<br />
zewn<br />
Sdx = −P<br />
zewn<br />
dV<br />
Pgazu<br />
P ⋅ S =<br />
F<br />
dx<br />
2<br />
S = π ⋅r<br />
Chem. Fiz. TCH II/01 19<br />
Widzimy tutaj „przeźroczysty” cylinder, w którym przesuw tłoka dx został<br />
zaznaczony. Objętość układu zamkniętego tłokiem zmieniła się o dV. Praca przy<br />
rozprężaniu (wykonywana przez układ, dV>0) ma znak (-), przy sprężaniu<br />
(wykonywana na układzie, dV
Wprowadzenie do<br />
termodynamiki<br />
Praca objętościowa<br />
Trzy sposoby wykonywania pracy przez układ:<br />
1. Przeciwko stałemu ciśnieniu zewnętrznemu (P zewn = const).<br />
k<br />
w = ∫ dw = −P<br />
∫ dV = −P<br />
p<br />
k<br />
zewn<br />
p<br />
( V −V<br />
)<br />
2. Przeciwko zerowemu ciśnieniu zewnętrznemu (ekspansja do<br />
próżni, szczególny przypadek poprzedniego), P zewn = 0.<br />
w = 0<br />
zewn<br />
k<br />
p<br />
Chem. Fiz. TCH II/01 20<br />
Jeżeli przypadek 2 trudno sobie wyobrazić w układzie z tłokiem, to należy<br />
uprzytomnić sobie, że tłok jest nieważki i porusza się bez oporów. Oto, co<br />
nazywamy układem wyobrażonym. Fizyczna realizacja może być trudna (podobnie<br />
jak przegrody adiabatycznej).<br />
20
Wprowadzenie do<br />
termodynamiki<br />
Praca objętościowa (c.d.)<br />
3. Sposób kwasistatyczny: P zewn = P gazu ±dP, w szczególności<br />
izotermicznie.<br />
nRT<br />
dw = − dV<br />
V<br />
w =<br />
k<br />
∫ dw = −nRT∫<br />
=<br />
p<br />
k<br />
p<br />
dV<br />
V<br />
V<br />
nRT ln<br />
V<br />
p<br />
k<br />
Chem. Fiz. TCH II/01 21<br />
dP jest nieskończenie małą różnicą ciśnienia.<br />
Zatem w sposobie tym ciśnienie zewnętrzne jest cały czas „prawie” takie samo jak<br />
ciśnienie gazu. Oczywiście proces trwałby wtedy nieskończenie długo, bowiem<br />
byłby bardzo powolny, stąd nazwa.<br />
21
Wprowadzenie do<br />
termodynamiki<br />
Praca objętościowa (c.d.)<br />
Praca objętościowa zależy od drogi jaką realizowana jest<br />
przemiana. Jest ona całką z funkcji P=f(V)dV i polem<br />
powierzchni pod wykresem w układzie współrzędnych P-V.<br />
Chem. Fiz. TCH II/01 22<br />
Praca objętościowa jest w sposób oczywisty różna dla drogi A (pokazana jako<br />
zacieniowane pole) i B.<br />
|w A | < |w B |<br />
22
Kto to jest<br />
Wasz wykładowca (dla nieobecnych na wykładzie)<br />
Chem. Fiz. TCH II/01 23<br />
23