Skript SS 2013 - Institut für Organische Chemie - Leibniz Universität ...
Skript SS 2013 - Institut für Organische Chemie - Leibniz Universität ...
Skript SS 2013 - Institut für Organische Chemie - Leibniz Universität ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Spezielle <strong>Chemie</strong><br />
Vorlesungsteil<br />
Koordinationschemie<br />
(Stand <strong>SS</strong> <strong>2013</strong>)<br />
<strong>Institut</strong> <strong>für</strong> <strong>Organische</strong> <strong>Chemie</strong><br />
<strong>Leibniz</strong> <strong>Universität</strong> Hannover (Germany)<br />
1<br />
verantwortlich:<br />
Prof. Dr. A. Kirschning<br />
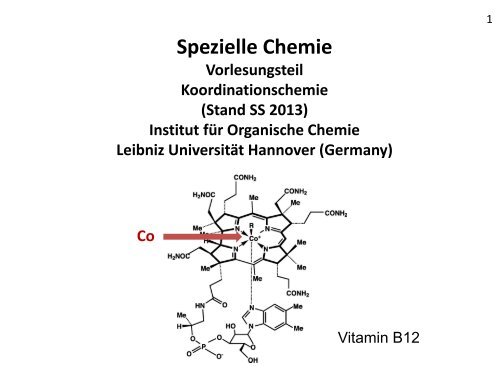
Co<br />
Vitamin B12
Chemische Bindungstypen (mit abnehmender Bindungstärke)<br />
1. Kovalente Bindungen 3. Wasserstoffbrückenbindungen<br />
H 2 : H-H<br />
2. Koordinative Bindungen 4. van der Waals Bindungen<br />
Dekan, ein Kohlenwasserstoff mit<br />
zeitlich befristeten Dipolen
Beispiele <strong>für</strong> Kordinationskomplexe<br />
Allgemein: M = Metall und L= Ligand<br />
Komplex: ML n<br />
Prinzipiell bilden alle Metalle Koordinationsverbindungen. Dabei findet man bei Übergangsmetallen<br />
gleiche Komplexe bei unterschiedlichen Oxidationszahlen, z. B. gelbes und rotes<br />
Blutlaugensalz: Na 4 Fe[CN] 6 (Eisen II) und Na 3 Fe[CN] 6 (Eisen III).<br />
Liganden können anionisch oder neutral sein, können anorganischer oder organischer<br />
Natur sein.<br />
Schauen wir uns einen solchen Komplex beispielhaft am NiCN 4<br />
-<br />
genauer an.
Warum kann Ni(CN) 2 noch weitere Liganden in seiner Koordinationssphäre<br />
aufnehmen?<br />
Die Elemente der höheren Perioden haben neben s- und p-Orbitalen zusätzliche d-Orbitale,<br />
die bei den Nebengruppenelementen aufgefüllt werden.
Warum kann Ni(CN) 2 noch weitere Liganden in seiner Koordinationssphäre<br />
aufnehmen?<br />
Besonders Übergangsmetalle sind prädestiniert, Koordinationsverbindungen z. B. mit<br />
Anionen zu bilden, weil sie weitere, leere Atomorbitale besitzen. Besonders wichtig sind hierbei<br />
d-Orbitale, die je nach Typ ganz bestimmte Bereiche im räumlichen Umfeld (x,y,z-Achsen)<br />
des Metalls befüllen. Sind sie nicht befüllt, dann können anionische oder neutrale Liganden<br />
mit freiem Elektronenpaar (z. B. NH 3 ) mit diesen überlappen und eine koordinative Bindung<br />
ausbilden.<br />
Je nach Metall und Oxidationszahl stehen nur wenige Orbitale zur Verfügung womit sich eine<br />
vorhersehbare Geometrie des Komplexes ergibt.
Unterschiede zwischen Elementen mit und ohne verfügbare d-Orbitale
Zwei vereinfachte Beispiele <strong>für</strong> die Überlappung eines Elektronenpaardonors (Ligand) und<br />
eines Elektronenpaarakzeptors ist der Komplex aus Ammoniak und Boran (BH 3 ) oder aus<br />
Ammoniak und Silberionen.<br />
Es gibt offensichtlich Analogien zu dem Konzept der Lewisbasen und Lewissäuren. Boran ist<br />
eine typische Lewissäure, während Ammoniak zu den Lewisbasen zählt.<br />
An dieser Stelle wissen wir noch nicht, welche Orbitale am Silber beteiligt sind, den linearen<br />
Komplex auszubilden.
Typen von Liganden / Metallkomplexen<br />
Optionen <strong>für</strong> Metalionen-Bindungen <strong>für</strong> den Carboxylat-Liganden (monodentat,<br />
bidentat, chelat).
Typen von Liganden / Metallkomplexen<br />
Beispiel <strong>für</strong> einen weiteren bidentaten Liganden:<br />
Ethylendiamin (en)<br />
Beispiel <strong>für</strong> einen tetradentaten Liganden:<br />
Porphyrin<br />
Beispiel <strong>für</strong> einen hexadentaten Liganden:<br />
Ethylendiamin-tetraacetat (EDTA)
Typen von Liganden / Metallkomplexen
Gängige Oxidationszahlen bei Übergangsmetallen
Gängige Oxidationszahlen bei Übergangsmetallen
Geometrien<br />
Je nach Zahl der Liganden am Zentralmetall kennt man verschiedene<br />
Vorzugsgeometrien. Sie sind abhängig von der Elektronenkonfiguration<br />
(Oxidationszahl) und dem Größenverhältnis zwischen Zentralatom und<br />
Ligand.<br />
KZ 2 3 4 5 6<br />
P<br />
o<br />
l<br />
y<br />
e<br />
d<br />
e<br />
r<br />
linear<br />
trigonal-planar<br />
pyramidal<br />
quadratisch-planar<br />
tetraedisch<br />
quadratischpyramidal<br />
trigonalpyramidal<br />
oktaedrisch<br />
T-förmig
Valenzbindungstheorie<br />
(valence bond theory)<br />
• Einfache Theorie zur Erklärung der<br />
Komplexbindung<br />
• Berücksichtigt die nicht besetzten d-Orbitale<br />
des Zentralatoms<br />
• Bindungselektronen werden von den Liganden<br />
geliefert
Valenzbindungstheorie<br />
• Beruht auf der Hybridisierung der freien (d-)Orbitale des<br />
Zentralatoms<br />
– sp 3 tetraedisch<br />
– dsp 2 quadratisch-planar<br />
– d 2 sp 3 oktaedrisch
Beschreibung eines Co(III)-Komplexes gemäß des<br />
Valenzbindungskonzepts
Eine einfache Beschreibung der Bindungsverhältnisse <strong>für</strong> das [Co(NH 3 ) 6 ] 3+<br />
Komplexion gemäß des Valenzbindungskonzepts
Gängige Oxidationszahlen bei Übergangsmetallen
Das oktaedrische [SiF 6 ] 2 -Komplexanion und die Deutung im Valenzbindungskonzept.<br />
Die Überlappung von jeweils zwei Elektronen der sechs Fluorid-Anionen<br />
mit einem der sechs Hybridorbitale des Si(IV) Kations liefert eine oktaedrische<br />
Anordnung bestehend aus sechs äquivalenten kovalenten Sigma-Bindungen.
Gängige Oxidationszahlen bei Übergangsmetallen
Valenzbindungstheorie<br />
• Einfache „Komplexbindung“
Gängige Oxidationszahlen bei Übergangsmetallen
Erweiterte Valenzbindungstheorie<br />
Die erweiterte Valenzbindungstheorie nutzt das Konzept der inneren<br />
Schale und äußeren Schale Architektur z. B. <strong>für</strong> oktaedrische Kobalt(III)<br />
Komplexes. Dieses bedeutet, dass verschiedene Besetzungen der d-<br />
Orbitale am Metall diskutiert werden. Die sechs leeren hybridisierten<br />
Orbitale können in beiden Fällen sechs nicht gebundene Elektronenpaare<br />
der Liganden aufnehmen.
Kristallfeldtheorie<br />
- Vereinfachte Beschreibung von Metall-Ligand Komplexen<br />
auf Basis von ionischen Interaktionen<br />
- Man betrachtet den Einfluss eines ionischen Umfelds auf die<br />
Orbitale des Zentralatoms.<br />
- Radiales ionisches Umfeld erhöht nur die Energie der Orbitale<br />
aber führt zu keiner Aufspaltung der Energien zueinander.<br />
- Gerichtete ionische Ladung führen zur Aufspaltung
Das Konzept des Einflusses eines Kristallfelds auf die Veränderung der relativen<br />
Energien von p-Orbitalen (dieses ist nur als Illustrationsbeispiel gezeigt). Es wird<br />
exemplarisch der Einfluss aus der Z-Achse gezeigt.<br />
Einfluss eines Kristallfelds auf die d-Orbitale in einem oktaedrischen Feld.
Ligandenfeldtheorie<br />
• Betrachtet die Wechselwirkungen der Liganden<br />
eines Komplexes mit den Elektronen der d-<br />
Orbitale eines Zentralatoms<br />
• Im Komplex Abstoßung zwischen dem<br />
Elektronenpaar des Liganden und den d-<br />
Elektronen des Zentralatoms<br />
entartete Orbitale spalten sich in 2 verschiedene<br />
Energieniveaus auf<br />
• Energiegewinn bei Orbitalaufspaltung:<br />
Ligandenfeldstabilisierungsenergie (LFSE)
Spektrochemische Reihe<br />
• Reihung der Liganden:<br />
I -
Oktaedrische Komplexe<br />
• Aufspaltung der Orbitale in<br />
– Energiearme Orbitale: d xy , d xz und d yz<br />
– Energiereiche Orbitale: d z<br />
2 und d x<br />
2 -y<br />
2<br />
• Übergangsmetallionen mit 1, 2, 3, 8, 9, 10 d-<br />
Elektronen haben nur einen Zustand<br />
Nur bei 4, 5, 6, 7 d-Elektronen 2 Zustände möglich<br />
• Hund´sche Regel wird weiter befolgt
high spin, low spin I<br />
• high spin: Anordnung des Zentralions mit den<br />
meisten ungepaarten d-Elektronen<br />
• low spin: Anordnung des Zentralions mit den<br />
wenigsten ungepaarten d-Elektronen<br />
• Wechsel von high spin zu low spin:<br />
– Energiebetrag ∆ wird gewonnen<br />
– Aber: Spinpaarungsenergie ist notwendig<br />
• Diamagnetismus: nur gepaarte Elektronen<br />
• Paramagnetismus: ungepaarte Elektronen
Vergleich von Spinpaarung (rechts) und getrennter Orbitalbesetzung (links) <strong>für</strong> ein<br />
einfaches (aber irreales) Modell von zwei nicht degenerierten Orbitalen mit zwei<br />
Elektronen.
high spin, low spin II
Vergleich des Kristallfeldes (ionisch; links) und Ligandenfeldes (Molekülorbitale;<br />
rechts) und Aufspaltungsdiagramm der d-Orbitale. Beide führen zum gleichen<br />
Ergebnis <strong>für</strong> die d-Elektronen, welche in zwei degenerierte Gruppen von Orbitalen,<br />
aufspalten, die durch relativ kleine Energieunterschiede (D) charakterisiert sind.
Tetraedrische Komplexe<br />
• Prinzipiell high und low spin möglich bei d 3 ,<br />
d 4 , d 5 , d 6<br />
Wegen niedriger Ligandenfeldaufspaltungsenergie<br />
nur high spin bekannt<br />
• Co 2+ bildet die meisten tetraedrischen<br />
Komplexe<br />
– Da größte LFSE als andere Übergangsmetallionen
Gängige Oxidationszahlen bei Übergangsmetallen
Tetraedrische Komplexe<br />
• Aufspaltung der Orbitale entgegengesetzt zu<br />
oktaedrischen Komplexen
Vergleich der d-Orbital-Aufspaltung <strong>für</strong> das oktaedrische und tetraedrische<br />
Feld (Dt = 4/9 Do ).
Quadratisch-planare Komplexe<br />
• Besitzt keine Liganden in z-Richtung<br />
Typisch <strong>für</strong> Ionen Pd 2+ , Pt 2+ und Au 3+<br />
– Alle quadratisch-planaren Komplexe dieser Ionen<br />
sind diamagnetische low spin Komplexe<br />
• Große Ligandenfeldaufspaltung ist bei<br />
quadratisch-planaren Komplexen mit d 8 -<br />
Konformation zu erwarten
Gängige Oxidationszahlen bei Übergangsmetallen
Quadratisch-planare Komplexe<br />
d xz und d yz sind entartet<br />
d x<br />
2 -y<br />
2 ist direkt auf<br />
Liganden gerichtet,<br />
deshalb energiereichstes
Ein Überblick zu den Veränderungen des Ligandenfeldes<br />
(d-Orbitalenergien) durch Verlängerung der Bindungen<br />
entlang der Z-Achse
Überblick, wie sich die Spinanordnung (high oder low spin) sich ändert mit der<br />
Größe von D am Beispiel eines d6 in einem oktaedrischen Feld. Die Typ der<br />
Liganden bestimmt das Resultat.<br />
Beispiele <strong>für</strong> d8 Nickel (II) Komplexe, die einerseits eine quadratisch planare oder andererseits eine<br />
tetraedrische Geometrie einnehmen (abhängig von der Stärke des Ligandenfelds der Liganden). Der<br />
quadratisch planare Komplex besitzt keine ungepaarten Elektronen und ist diamagnatisch. Der tetraedrische<br />
Komplex besitzt zwei ungepaarte Elektronen und ist paramagnetisch.
Isomerie<br />
• Konfigurationsisomerie<br />
– cis: Liganden stehen nebeneinander<br />
– trans: Liganden stehen gegenüber<br />
• cis-Form<br />
• trans-Form
Isomerie<br />
• Koordinationsisomerie<br />
– Bei Komplexen mit Anionen und Kationen<br />
– Beispiel:<br />
[Co(NH 3 ) 6 ][Cr(CN) 6 ] [Cr(NH 3 ) 6 ][Co(CN) 6 ]<br />
Kation Anion Kation Anion<br />
• Bindungsisomerie<br />
– Liganden werden durch verschiedene Atome an<br />
das Zentralatom gebunden<br />
CH 3 C N<br />
CH 3 N C<br />
Cyano-Komplex<br />
Isocyano-Komplex
Isomerie<br />
• Ionenisomerie<br />
– Ionen können als Ligand im Komplex oder<br />
außerhalb des Komplexes gebunden sein<br />
[Co(NH 3 ) 5 Cl]SO 4<br />
[Co(NH 3 ) 5 SO 4 ]Cl<br />
• Hydratisomerie<br />
– Spezieller Fall der Ionenisomerie<br />
[Cr(H 2 O) 6 ]Cl 3<br />
[Cr(H 2 O) 5 Cl]Cl 2 •H 2 O<br />
[Cr(H 2 O) 4 Cl 2 ]Cl•2H 2 O
Komplexstabilität<br />
• Thermodynamische Stabilität:<br />
– Geringe Komplexzerfallskonstante<br />
[Co(NH 3 ) 6 ] 3+ + 6 H 2 O [Co(H 2 O) 6 ] 3+ + 6 NH 3 K D ≈ 10 -34<br />
• Kinetische Stabilität:<br />
– Thermodynamisch instabil, aber langsamer Zerfall<br />
[Co(NH 3 ) 6 ] 3+ + 6 H 3 O + [Co(H 2 O) 6 ] 3+ + 6 NH 4<br />
+<br />
K D ≈ 10 25<br />
• Labile Komplexe:<br />
– Thermodynamisch und kinetisch instabil
Komplexstabilität<br />
• Stabilität von M 3+ meist größer als von M 2+ bei<br />
gleichen Liganden<br />
• Übergangsreihe nach Ivering und Williams<br />
– Mn 2+ < Fe 2+ < Co 2+ < Ni 2+ < Cu 2+ > Zn 2+<br />
• Es gilt das HSAB-Prinzip
Chelate<br />
• Mehrzähnige Liganden bilden Chelate<br />
A-X<br />
B -Y<br />
M<br />
• Zentralatom M von X und Y in die Zange<br />
genommen (griech. chelé = Krebsschere)<br />
• Chelateffekt: Chelate oft stabiler als einfache<br />
Komplexe -> Entropiegewinn<br />
• Typisches Chelat: Ethylendiamin (en)
Chelate<br />
• EDTA (Ethylendiamintetraessigsäure)<br />
planar<br />
im Komplex
[Ag(NH 3 ) 2 ]Cl<br />
K 3 [Fe(CN) 6 ]<br />
[Co(NH 3 ) 6 ][Cr(CN) 6 ]<br />
Nomenklatur<br />
Diamminsilber(I)-chlorid<br />
Kalium – hexacyanoferrat (III)<br />
Hexaammincobalt(III)-hexacyanochromat(III)<br />
[Cr(NH 3 ) 6 ][Co(CN) 6 ]<br />
Hexaamminchrom(III)-hexacyanocobaltat(III)<br />
[Co(NH 3 ) 5 Cl]SO 4<br />
Pentaamminchlorocobalt(II)-sulfat<br />
[Co(NH 3 ) 5 SO 4 ]Cl<br />
Pentaamminsulfatocobalt(II)-chlorid<br />
[Mo(CO) 6 ]<br />
Hexacarbonylmolybdän(0)
Chelate in der Natur -<br />
z. B. Häm oder Vitamin B12<br />
Vitamin B12<br />
Co
Biologische Komplexe<br />
Magnesium-ATP-Komplex<br />
Hämoglobin
Die Geometrie ändert sich am Eisenzentrum des Häm-Komplexes in Myoglobin oder<br />
Hämoglobin nach Koordination des Sauerstoffmoleküls.<br />
Mögliche Arten der Koordination eines zweiatomigen Moleküls sind gezeigt, wobei die<br />
gewinkelte Anordnung <strong>für</strong> Sauerstoff bevorzugt ist.
Das Häm-Rückgrat und die Koordination zu M(II)-Ionen<br />
Drei Typen von vierfach koordinierten Kupfer(II)-Zentren, die man in kupferhaltigen<br />
Proteinen findet. Daneben ein Beispiel <strong>für</strong> einen seltenen, fünfach koordinierten<br />
pyramidal quadratisch-planaren Prion-Protein Kupfer(II)-Komplex.