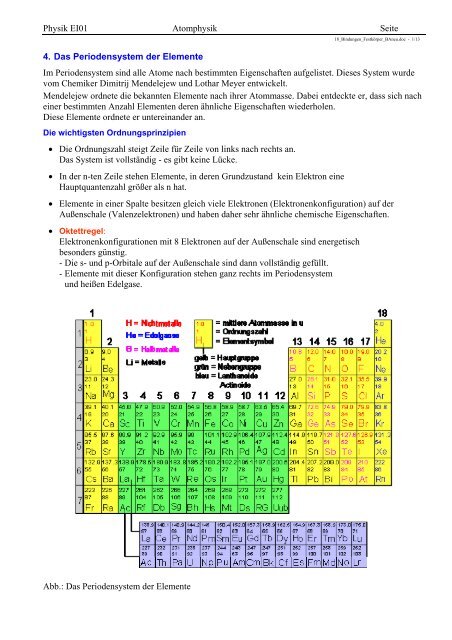
Physik EI01 Atomphysik Seite 4. Das Periodensystem der Elemente ...
Physik EI01 Atomphysik Seite 4. Das Periodensystem der Elemente ...
Physik EI01 Atomphysik Seite 4. Das Periodensystem der Elemente ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Physik</strong> <strong>EI01</strong> <strong>Atomphysik</strong> <strong>Seite</strong><br />
<strong>4.</strong> <strong>Das</strong> <strong>Periodensystem</strong> <strong>der</strong> <strong>Elemente</strong><br />
18_Bindungen_Festkörper_BAneu.doc - 1/13<br />
Im <strong>Periodensystem</strong> sind alle Atome nach bestimmten Eigenschaften aufgelistet. Dieses System wurde<br />
vom Chemiker Dimitrij Mendelejew und Lothar Meyer entwickelt.<br />
Mendelejew ordnete die bekannten <strong>Elemente</strong> nach ihrer Atommasse. Dabei entdeckte er, dass sich nach<br />
einer bestimmten Anzahl <strong>Elemente</strong>n <strong>der</strong>en ähnliche Eigenschaften wie<strong>der</strong>holen.<br />
Diese <strong>Elemente</strong> ordnete er untereinan<strong>der</strong> an.<br />
Die wichtigsten Ordnungsprinzipien<br />
Die Ordnungszahl steigt Zeile für Zeile von links nach rechts an.<br />
<strong>Das</strong> System ist vollständig - es gibt keine Lücke.<br />
In <strong>der</strong> n-ten Zeile stehen <strong>Elemente</strong>, in <strong>der</strong>en Grundzustand kein Elektron eine<br />
Hauptquantenzahl größer als n hat.<br />
<strong>Elemente</strong> in einer Spalte besitzen gleich viele Elektronen (Elektronenkonfiguration) auf <strong>der</strong><br />
Außenschale (Valenzelektronen) und haben daher sehr ähnliche chemische Eigenschaften.<br />
Oktettregel:<br />
Elektronenkonfigurationen mit 8 Elektronen auf <strong>der</strong> Außenschale sind energetisch<br />
beson<strong>der</strong>s günstig.<br />
- Die s- und p-Orbitale auf <strong>der</strong> Außenschale sind dann vollständig gefüllt.<br />
- <strong>Elemente</strong> mit dieser Konfiguration stehen ganz rechts im <strong>Periodensystem</strong><br />
und heißen Edelgase.<br />
Abb.: <strong>Das</strong> <strong>Periodensystem</strong> <strong>der</strong> <strong>Elemente</strong>
<strong>Physik</strong> <strong>EI01</strong> <strong>Atomphysik</strong> <strong>Seite</strong><br />
Perioden und Hauptgruppen<br />
Perioden (Zeilen): Perioden sind von links nach rechts aufgelistet.<br />
Diese Atome besitzen alle die gleiche Anzahl an Schalen.<br />
18_Bindungen_Festkörper_BAneu.doc - 2/13<br />
Elementgruppen (Spalten): <strong>Das</strong> <strong>Periodensystem</strong> ist in verschiedene Elementgruppen aufgeteilt<br />
und jedes Element gehört zu einer Elementgruppe.<br />
Die Elementgruppen aus <strong>der</strong> Hauptgruppe heißen: Alkalimetalle, Erdalkalimetalle, Borgruppe,<br />
Kohlenstoffgruppe, Stickstoffgruppe, Chalkogene, Halogene und Edelgase.<br />
Die Elementgruppen aus <strong>der</strong> Nebengruppe heissen: Kupfergruppe, Zinkgruppe, Scandiumgruppe,<br />
Titangruppe, Vanadiumgruppe, Chromgruppe, Magangruppe und Eisen-Platin-Gruppe.<br />
Ebenfalls zählt man die Lanthaniden und Actiniden dazu.<br />
Edelgase (8. Hauptgruppe):<br />
- Oktett auf <strong>der</strong> Außenschale<br />
- extrem reaktionsträge, Gase liegen atomar vor<br />
Halogene (7. Hauptgruppe):<br />
- ein Elektron fehlt zur Edelgaskonfiguration<br />
- chemisch sehr reaktiv<br />
- nehmen Elektronen leicht auf.<br />
Alkalimetalle (1. Hauptgruppe):<br />
- ein einzelnes (schwach gebundenes) Elektron auf <strong>der</strong> äußersten Schale<br />
- chemisch sehr reaktiv<br />
- geben gerne ein Elektron ab<br />
Der chemische Charakter eines Elements geht aus seiner Lage im <strong>Periodensystem</strong> hervor.<br />
- im linken Teil stehen <strong>Elemente</strong> mit metallischem Charakter.<br />
- im rechten Teil stehen dagegen <strong>Elemente</strong> mit nichtmetallischem Charakter.<br />
- in <strong>der</strong> Mitte des <strong>Periodensystem</strong>s, in <strong>der</strong> vierten Gruppe, befinden sich die Elementhalbleiter.<br />
Sie bilden den Übergang zwischen den Metallen und den Isolatoren.<br />
Beispiel: Ionisierungsenergien <strong>der</strong> <strong>Elemente</strong> (Gruppeneigenschaft)<br />
Edelgase haben wegen ihrer stabilen Elektronenkonfiguration die höchsten Ionisierungsenergien.<br />
Alkalimetalle haben die niedrigsten Ionisationsenergien (das äußerste Elektron lässt sich sehr<br />
leicht entfernen).
<strong>Physik</strong> <strong>EI01</strong> <strong>Atomphysik</strong> <strong>Seite</strong><br />
6. Chemische Bindung (Moleküle und Festkörper)<br />
18_Bindungen_Festkörper_BAneu.doc - 3/13<br />
Ein Molekül ist eine Verbindung von zwei o<strong>der</strong> mehreren Atomen zu einem stabilen Verband mit<br />
definierten chemischen Eigenschaften und definierter Struktur.<br />
Ein Festkörper ist im weitesten Sinne Materie im festen Aggregatszustand. Die kleinsten Bausteine<br />
können einzelne Atome o<strong>der</strong> Moleküle, aber auch eine Gruppe davon sein.<br />
Man unterscheidet Einkristalle, polykristalline Festkörper und amorphe Festkörper.<br />
Ursache <strong>der</strong> Bindung: - Anziehende Kräfte zwischen Atomen<br />
- Gemeinsames Verwenden von Elektronen ( kovalente Bindung)<br />
- Coulombanziehung zwischen Katíon und Anion ( ionische Bindung)<br />
Je nach <strong>der</strong> Natur <strong>der</strong> Kraftwirkung unterscheidet man verschiedene Bindungstypen.<br />
6.1 Ionische Bindung:<br />
Die Elektronenstruktur <strong>der</strong> beteiligten Atome bewirkt einen (teilweisen) Elektronentransfer,<br />
so dass die Atome eine abgeschlossene Elektronenschale erhalten.<br />
Halogene würden gerne ein Elektron aufnehmen<br />
Alkalimetalle können eins abgeben<br />
Ionenbindung<br />
Es entstehen Anion und Kation.<br />
Die Ionen ordnen sich so an, dass ihre Coulombanziehungsenergie größer ist<br />
als die Abstoßung gleichnamiger Ladungen Kristallstruktur.<br />
Die Bindung ist gerichtet.<br />
Bindungsenergie ca. 10eV - eine <strong>der</strong> stärksten chem. Bindungen<br />
Beispiel: Kochsalz NaCl<br />
<strong>Das</strong> Elektron des Natrium wan<strong>der</strong>t zum Chlor Na + und Cl - ziehen sich an ionische Bindung.<br />
An<strong>der</strong>es Beispiel: Lithiumfluorid (LiF)<br />
NaCl - Ionenkristall
<strong>Physik</strong> <strong>EI01</strong> <strong>Atomphysik</strong> <strong>Seite</strong><br />
18_Bindungen_Festkörper_BAneu.doc - 4/13<br />
6.2 Van-<strong>der</strong>-Waals-Bindung:<br />
Die Van <strong>der</strong> Waals-Bindung basiert auf <strong>der</strong> anziehenden, elektrostatischen Dipol-Dipol-Wechselwirkung<br />
von induzierten Dipolmomenten.<br />
Durch zufällige Ladungsverschiebungen <strong>der</strong> Elektronen im Atom/Molekül entsteht für<br />
kurze Zeit ein Dipol.<br />
<strong>Das</strong> dadurch erzeugte elektrische Feld des Dipols wirkt auf die Nachbaratome polarisierend.<br />
(Der induzierende Dipol induziert an<strong>der</strong>e Atome/Moleküle zu Dipolen).<br />
Daraus resultiert eine schwache Anziehungskraft <strong>der</strong> Atome/Moleküle.<br />
<strong>Das</strong> Wechselwirkungpotential V ist proportional zu<br />
const<br />
V ( R)<br />
<br />
6<br />
R<br />
Bei sehr geringem Abstand gibt es Abstoßung <strong>der</strong> Kerne (Abstoßungspotential ~ R -12 ).<br />
Minimum <strong>der</strong> Gesamtenergie = Gleichgewichtsabstand (Van <strong>der</strong> Waals-Radius)<br />
Typische Vertreter:<br />
Edelgaskristalle, Adhäsionskraft, Kohäsionskraft (Klebstoffe), Oberflächenspannung,<br />
Ursache <strong>der</strong> Reibungskraft, Phasenübergänge bei realen Gasen.<br />
6.3 Wasserstoffbrückenbindung<br />
Beson<strong>der</strong>e Art <strong>der</strong> Dipol-Dipol-Bindung (ähnlich wie Van-<strong>der</strong>-Waals-Bindung, aber viel stärker).<br />
Verantwortlich für Sekundärstruktur in biologischen Komplexen.<br />
H-Atom wirkt als Brücke zwischen zwei stark<br />
elektronegativen Atomen (z.B. O, N, F).<br />
Bindung mit dem H-Atom im Molekül<br />
durch eine polare kovalente Bindung.<br />
Bindung mit dem an<strong>der</strong>en H 2 O-Molekül<br />
durch elektrostatische Kräfte
<strong>Physik</strong> <strong>EI01</strong> <strong>Atomphysik</strong> <strong>Seite</strong><br />
6.4 Kovalente Bindung (homöopolar o<strong>der</strong> polar)<br />
18_Bindungen_Festkörper_BAneu.doc - 5/13<br />
Bindungsenergie nur quantenmechanisch zu verstehen.<br />
Großer Einfluss von Pauli-Prinzip und sog. Austausch-Symmetrien.<br />
Häufig zwischen gleichen o<strong>der</strong> gleichartigen Atomen.<br />
Atome streben bei ihren chem. Verbindungen vollständig besetzte Valenzschalen an.<br />
Dazu werden in <strong>der</strong> Regel 8 Elektronen benötigt.<br />
Um eine stabile Edelgas-Konfiguration zu erhalten, teilen sich die Atome Elektronen paarweise.<br />
Bindungsenergien: 1- 5 eV / Bindung.<br />
Abb.: Stark vereinfachtes Schema <strong>der</strong> kovalenten Bindung im Schalenbild.<br />
Wasser (H 2 O), Methan (CH 4 ), Chlor (Cl 2 )<br />
Molekülorbitale MO<br />
Ebenso wie in Atomen befinden sich in Molekülen die Elektronen in genau festgelegten Zuständen, hier<br />
Molekülorbitale genannt. Die Molekülorbitale werden in <strong>der</strong> Quantenmechanik durch Überlagerung<br />
(Linearkombination) <strong>der</strong> Atomorbitale gebildet (LCAO-Methode).<br />
Beim Überlapp <strong>der</strong> Wellenfunktionen entstehen immer bindende und antibindende Orbitale.<br />
Beispiel: Modell für das H 2 -Molekülion:<br />
g 1sa<br />
1sb<br />
: 1 s g<br />
bindendes MO mit Elektronendichte<br />
zwischen den Kernen<br />
Anziehung<br />
1s 1s<br />
:<br />
u<br />
a<br />
b<br />
*<br />
1s<br />
u<br />
antibindendes MO ohne Elektronendichte<br />
zwischen den Kernen<br />
Abstoßung<br />
Für die Bindung bedeutsam sind die Molekülorbitale, die durch Kombination von s-, p-, und d-<br />
Atomorbitalen entstehen. Durch die Überlappung entsteht neben dem bindenden Orbital immer auch<br />
ein antibindendes Orbital.<br />
Jedes Orbital kann mit zwei Elektronen besetzt werden (Elektronenpaar).
<strong>Physik</strong> <strong>EI01</strong> <strong>Atomphysik</strong> <strong>Seite</strong><br />
18_Bindungen_Festkörper_BAneu.doc - 6/13<br />
-Orbitale: Die -Orbitale entstehen durch Überlappung von Atom-Orbitalen, die symmetrisch zur<br />
Molekülachse (Bindungsachse) liegen. Ergeben meist die Einfachbindungen in Molekülen.<br />
Zwei s-Atomorbitale kombinieren zu<br />
einen bindenden s- und zu einem<br />
antibindenden s*-Molekülorbital.<br />
Zwei p z -Atomorbitale kombinieren zu<br />
einen bindenden p- und zu einem<br />
antibindenden p*-Molekülorbital.<br />
-Orbitale: Die -Orbitale entstehen durch Überlappung von Atomorbitalen, die senkrecht zu den<br />
Bindungen angeordnet sind. Sie ergeben die Doppel- und Mehrfachbindungen im Molekül.<br />
Zwei p x - o<strong>der</strong> zwei p y - Atomorbitale<br />
ergeben ein bindendes (p) und ein<br />
antibindendes p*-Molekülorbital.<br />
Bei <strong>der</strong> Bildung <strong>der</strong> Orbitale erfolgt für die bindenden Orbitale eine Absenkung <strong>der</strong> Energie gegenüber<br />
dem ungebundenen Zustand. Bei den antibindenden Orbitalen erfolgt dagegen eine Anhebung.<br />
Hybridorbitale<br />
Die s-, p x -, p y -, p z -Atomorbitale eines Atoms lassen sich durch einfache Linearkombination zu Hybridorbitalen<br />
kombinieren. Hybridorbitale erklären insbeson<strong>der</strong>e den Richtungscharakter einer Bindung<br />
(gerichtete Valenzen, lokalisierte MO).<br />
sp-Hybridisierung<br />
s p z 2 sp-Orbitale<br />
Geometrie: linear<br />
<br />
s + p z<br />
s - p z<br />
sp 2 -Hybridisierung<br />
s p x p y 3 sp 2 -Orbitale<br />
Geometrie: eben (120°)
<strong>Physik</strong> <strong>EI01</strong> <strong>Atomphysik</strong> <strong>Seite</strong><br />
sp 3 -Hybridisierung<br />
s p x p y p z 4 sp 3 -Orbitale<br />
Geometrie: räumlich<br />
tetrae<strong>der</strong>förmig (109,5°)<br />
18_Bindungen_Festkörper_BAneu.doc - 7/13<br />
Beispiel Benzol: - und - Bindung als Hybridorbitale<br />
<strong>Das</strong> C-Atom bildet drei sp 2 -Orbitale<br />
mit 3 Elektronen und ein p z -Orbital mit<br />
einem Elektron (= 4 Bindungselektronen).<br />
Im Molekül kombinieren je zwei<br />
sp 2 -Orbitale zu einer -Ringbindung und<br />
zwei p z -Orbitale zu einer - Bindung. <strong>Das</strong><br />
dritte sp 2 -Orbital ergibt die C-H Bindung.<br />
Benzolring:<br />
- -Bindungen aus sp 2 -Hybriden<br />
- Bindung aus p z -Orbitalen<br />
(Delokalisierung <strong>der</strong> -Elektronen über<br />
den Ring = Aromatisierung, Konjugation,<br />
konjugierte Doppelbindung)<br />
6.4 Metallische Bindung<br />
Die metallische Bindung ist kovalent, wobei die Bindungselektronen jedoch über den gesamten Kristall<br />
verteilt sind (delokalisiert).<br />
<strong>Das</strong> Elektronengasmodell erklärt die metallische Bindung zwischen den Atomen folgen<strong>der</strong>maßen:<br />
Die Metallatome geben ihr äußeres Elektron<br />
an einen gemeinsamen Elektronensee ab.<br />
Atomrümpfe ohne Valenzelektronen (positiv)<br />
geladen bilden Gitterstruktur.<br />
Diese Elektronen können sich wie ein Gas<br />
zwischen den Atomrümpfen bewegen.<br />
Die erhöhte Elektronendichte zwischen den<br />
Atomrümpfen führt zu einer Bindung <strong>der</strong><br />
Atomrümpfe untereinan<strong>der</strong> über die frei<br />
beweglichen Elektronen.<br />
Eine an<strong>der</strong>e Beschreibung <strong>der</strong> metallischen Bindung auf <strong>der</strong> Grundlage von Orbitalen liefert<br />
das sog. Energiebän<strong>der</strong>modell.
<strong>Physik</strong> <strong>EI01</strong> <strong>Atomphysik</strong> <strong>Seite</strong><br />
6.5 Halbleiter, Isolatoren und Metalle)<br />
18_Bindungen_Festkörper_BAneu.doc - 8/13<br />
6.5.1 Elementhalbleiter<br />
Die wichtigsten Elementhalbleiter sind Germanium und Silizium, beides kristalline Festkörper.<br />
Die Atome <strong>der</strong> Halbleiterkristalle werden durch kovalente Bindungen zusammengehalten.<br />
Dabei werden die Valenzelektronen von benachbarten Atomen paarweise genutzt.<br />
Da die Atome <strong>der</strong> Elementhalbleiter vier Valenzelektronen besitzen, ist jedes Halbleiteratom von<br />
vier Nachbaratomen umgeben. Durch die von diesen Atomen mitgenutzten Elektronen wird die<br />
Valenzschale mit acht Elektronen aufgefüllt. Es entsteht damit ein chemisch stabiler Zustand.<br />
Jedes Atom eines Elementhalbleiters ist tetrae<strong>der</strong>förmig von vier Nachbaratomen umgeben.<br />
Ein einkristalliner Elementhalbleiter ist homogen aus diesen atomaren Gitterzellen aufgebaut.<br />
Eine Bindung (Elektronenpaar) wird von zwei überlappenden lokalisierten<br />
sp 3 -Hybridorbitalen gebildet.<br />
Silizium-Kristallstruktur<br />
(Diamant-Struktur)<br />
Ebene Darstellung des Si-Kristalls<br />
6.5.2 Verbindungshalbleiter<br />
Verbindungshalbleiter bestehen aus zwei o<strong>der</strong> mehreren <strong>Elemente</strong>n.<br />
Bei binären Halbleitern, die sich aus zwei unterschiedlichen <strong>Elemente</strong>n zusammensetzen,<br />
ist die Summe <strong>der</strong> Valenzelektronen bei<strong>der</strong> Komponenten gleich 8.<br />
Beispiel: III-V-Verbindungen<br />
GaAs - Galliumarsenid<br />
GaP - Galliumphosphid<br />
AlAs- Aluminiumarsenid<br />
Galliumarsenid<br />
GaAs<br />
Die Summe von acht Valenzelektronen erhält man<br />
durch Kombination von <strong>Elemente</strong>n <strong>der</strong> dritten und<br />
<strong>der</strong> fünften Gruppe des <strong>Periodensystem</strong>s o<strong>der</strong> <strong>der</strong><br />
zweiten und <strong>der</strong> sechsten Gruppe. Entsprechend ihrer<br />
Gruppenzugehörigkeit wird zwischen III-Vo<strong>der</strong><br />
II-VI-Halbleitern unterschieden.<br />
Verbindungshalbleiter werden hauptsächlich in <strong>der</strong> Optoelektronik und in <strong>der</strong> Sensorik eingesetzt.
<strong>Physik</strong> <strong>EI01</strong> <strong>Atomphysik</strong> <strong>Seite</strong><br />
6.5.3 <strong>Das</strong> Bän<strong>der</strong>modell<br />
18_Bindungen_Festkörper_BAneu.doc - 9/13<br />
Vom diskreten Energieniveau (Atom) zum kontinuierlichen Energieband (Festkörper)<br />
Atome: Energieniveaus <strong>der</strong> Elektronen sind diskret<br />
Moleküle: Energieniveaus <strong>der</strong> Einzelatome stören sich gegenseitig und spalten sich aufgrund<br />
<strong>der</strong> elektrostatischen Wechselwirkung auf.<br />
Festkörper: Bei N Atomen spaltet sich jedes Einzelniveau <strong>der</strong> ungestörten Atome in N<br />
Elektronenniveaus auf. Diese liegen eng beieinan<strong>der</strong> und werden Energieband genannt.<br />
Die erlaubten Energieniveaus “verschmieren“ zu “quasikontinuierlichen“ Bän<strong>der</strong>n.<br />
Breite liegt zwischen 1 und 5eV.<br />
Zwischen den Bän<strong>der</strong>n liegen verbotene Zonen, in denen keine erlaubten<br />
Energieniveaus liegen.<br />
Leitungsband<br />
verbotenes Band<br />
Valenzband<br />
unbesetzt bzw.<br />
teilweise besetzt<br />
leer<br />
oberstes voll<br />
besetztes Band<br />
Valenzband:<br />
Leitungsband:<br />
Fermienergie:<br />
das oberste bei T = 0 K voll besetzte Band<br />
das über dem Valenzband liegende Band, das bei T = 0 K<br />
teilweise besetzt o<strong>der</strong> leer ist.<br />
höchste Energie, die bei T = 0 K besetzt sein kann<br />
Die Aufspaltung <strong>der</strong> Energieterme<br />
erfolgt mit zunehmen<strong>der</strong> Annäherung<br />
<strong>der</strong> Atome.<br />
Durch die abstoßende Wirkung <strong>der</strong> Kerne<br />
nimmt die Energie bei sehr kleinen<br />
Abständen wie<strong>der</strong> zu.<br />
Der inneratomare Gleichgewichtsabstand<br />
stellt sich so ein, dass die<br />
Gesamtenergie <strong>der</strong> Elektronen dabei<br />
minimal wird.
<strong>Physik</strong> <strong>EI01</strong> <strong>Atomphysik</strong> <strong>Seite</strong><br />
18_Bindungen_Festkörper_BAneu.doc - 10/13<br />
Verfeinertes Modell <strong>der</strong> Energiebän<strong>der</strong><br />
(Entstehung <strong>der</strong> Bän<strong>der</strong> im Modell <strong>der</strong> starken Bindung <strong>der</strong> Elektronen)<br />
Durch die enge Anordnung <strong>der</strong> Atome im Festkörper überlagern sich die Potentiale <strong>der</strong><br />
benachbarten Atome und werden abgesenkt.<br />
Zwischen den Atomen entstehen Potentialberge, die die Elektronen beim Überwechseln<br />
von einem Atom zum an<strong>der</strong>en zu überwinden haben.<br />
Dabei werden die Bahnen <strong>der</strong> locker gebundenen Elektronen in den äußeren Schalen stärker beeinflusst<br />
als die Bahnen <strong>der</strong> fester gebundenen Elektronen in den inneren Schalen.<br />
Die Verbiegung <strong>der</strong> Bahnen ist mit einer Verschiebung <strong>der</strong> Energieterme <strong>der</strong> Elektronen verbunden.<br />
freies Mg-Atom<br />
Atomkette (Kristall)<br />
Leitungsband<br />
W F<br />
Valenzband<br />
Bän<strong>der</strong> <strong>der</strong> äußeren Elektronen laufen durch den ganzen Kristall und sind nicht<br />
mehr einzelnen Atomen zuzuordnen.<br />
Innere Elektronen sind bei den Kernen lokalisiert (werden üblicherweise ignoriert).<br />
Die Elektronen gelangen im Leitungsband von Atom zu Atom, ohne einen Potentialberg überwinden zu<br />
müssen. Sie sind frei beweglich und bestimmen deshalb die elektrische Leitfähigkeit.<br />
Unterhalb des Leitungsbandes befindet sich das Valenzband, d.h. das Band <strong>der</strong> an den Atomkern<br />
gebundenen Valenzelektronen. Da sie nicht frei beweglich sind, tragen sie nicht zur elektrischen<br />
Leitfähigkeit bei. Die Valenzelektronen können nur dann in das Leitungsband gelangen, wenn ihnen<br />
eine genügend hohe Energie übertragen wird. Dann allerdings tragen sie auch zur elektrischen<br />
Leitfähigkeit bei.
<strong>Physik</strong> <strong>EI01</strong> <strong>Atomphysik</strong> <strong>Seite</strong><br />
Beispiel: Natriumatom und Natriumkristall<br />
18_Bindungen_Festkörper_BAneu.doc - 11/13<br />
(1s 2 )(2s 2 )(2p 6 )(3s 1 )<br />
l<br />
m l<br />
M<br />
s p d<br />
0 +1 0 -1 +2 +1 0 -1 -2<br />
L<br />
K<br />
Abb.: Natrium-Elektronenkonfiguration<br />
Abb.: Energieniveauschema eines isolierten Na-Atoms mit den besetzten Niveaus<br />
Abb.: Schema des Energieverlaufs in einem eindimensionalen Na-Kristall<br />
mit frei beweglichem 3s-Elektron.
<strong>Physik</strong> <strong>EI01</strong> <strong>Atomphysik</strong> <strong>Seite</strong><br />
Bandstruktur bei Si, Ge, Diamant<br />
Die energetische Aufspaltung <strong>der</strong><br />
3s- und 3p-Niveaus im Silizium als<br />
Funktion des Atomabstandes.<br />
18_Bindungen_Festkörper_BAneu.doc - 12/13<br />
Der geringere Gleichgewichtsabstand<br />
von 0,15 nm für Diamant<br />
ist ursächlich für die größere<br />
Bandlücke.<br />
Diamant: W g = 7 eV (Isolator)<br />
Silizium: W g = 1 eV (Halbleiter)<br />
Isolatoren, Halbleiter, Leiter<br />
Man unterscheidet 3 Kategorien von Festkörpern<br />
bezüglich ihrer elektrischen Eigenschaften.<br />
1. Isolatoren:<br />
Leitungsband leer<br />
Fermienergie liegt in <strong>der</strong> Mitte des Gaps.<br />
Abstand zwischen Valenzband und<br />
Leitungsband > 3 eV.<br />
2. Halbleiter:<br />
Wie Isolator, aber Abstand zwischen Valenzund<br />
Leitungsband kleiner.<br />
Beispiele: Silizium (Bandabstand 1,1eV);<br />
Germanium (Bandabstand 0,66eV)<br />
Bandabstand kann durch gezielte Verunreinigung<br />
(Dotierung) beeinflusst werden.<br />
Isolator<br />
Leitungsband<br />
Valenzband<br />
Halbleiter<br />
Leitungsband<br />
Valenzband<br />
3. Leiter:<br />
Leitungsband ist nicht leer.<br />
Fermienergie liegt mitten im Leitungsband.<br />
Metalle sind Leiter: äußere Elektronen<br />
befinden sich im Leitungsband.<br />
Beispiel: Lithium<br />
Die 2s-Zustände des Lithium-Atoms werden<br />
im Kristall zum Leitungsband<br />
Leitungsband ist halb voll.<br />
Leiter<br />
Leitungsband<br />
Valenzband
<strong>Physik</strong> <strong>EI01</strong> <strong>Atomphysik</strong> <strong>Seite</strong><br />
Elektrische und thermische Eigenschaften (Isolatoren, Halbleiter, Leiter)<br />
18_Bindungen_Festkörper_BAneu.doc - 13/13<br />
Wärmeleitung und elektrische Leitung erfolgt durch Elektronenbewegung.<br />
Wärmeleitung: Elektronen besitzen thermische (kinetische) Energie und geben sie durch Stöße weiter.<br />
Der Transport von Wärme durch Gitterschwingungen (Wellen) ist viel schwächer.<br />
El. Leitung: Ladungstransport geschieht durch Bewegung von Elektronen.<br />
Leiter:<br />
Elektronen können beliebig kleine Energiemengen aufnehmen, sie steigen energetisch im<br />
Leitungsband etwas höher gute elektrische Leitung und Wärmeleitung.<br />
(sog. Fermiblock schmilzt ab)<br />
f(W)<br />
f(W)<br />
W/W F<br />
W/W F<br />
Besetzung <strong>der</strong> Energieniveaus bei T = 0 Besetzung <strong>der</strong> Energieniveaus bei T > 0<br />
Isolatoren:<br />
Valenzband voll, Leitungsband leer<br />
Elektronen können nur Energie aufnehmen, wenn sie ins Leitungsband gelangen.<br />
Energiezufuhr bei elektrischer und Wärmeleitung nicht genügend groß,<br />
um Energielücke zu überbrücken.<br />
Geringe elektrische Leitung und Wärmeleitung<br />
Halbleiter:<br />
Geringe Lücke zwischen Valenz- und Leitungsband.<br />
Bei T = 0 verhalten sich Halbleiter wie Isolatoren.<br />
T > 0: Leitungsband wird aufgrund thermischer Anregungen bevölkert<br />
elektrische und Wärmeleitfähigkeit sind stark temperaturabhängig.<br />
Verunreinigungen (Dotierung) können Elektronen liefern, die für gute elektrische und<br />
Wärmeleitfähigkeit sorgen.