Lösung 11 - TUM
Lösung 11 - TUM
Lösung 11 - TUM
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Physik Department, Technische Universität München, PD Dr. W. Schindler<br />
ÜBUNGEN ZU EXPERIMENTALPHYSIK 1 - WS 12/13<br />
<strong>Lösung</strong>en zu Übungsblatt <strong>11</strong><br />
1. Ideales Gas<br />
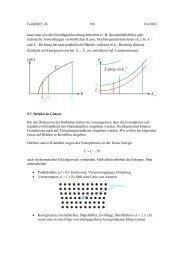
An einem zylindrischen Gefäß der Höhe H, der Grundfläche A und dem Volumen V 0 ist ein dünnes Rohr dicht angeschlossen.<br />
Dieses Rohr wird mit Wasser der Dichte ρ bis zur Höhe l gefüllt. Der atmosphärische Druck sei p 0 (vergleiche<br />
mit Skript, Kapitel 4.2).<br />
(a) Geben Sie einen Ausdruck für das Gasvolumen im Gefäß in Abhangigkeit von x (siehe Zeichnung) nach Einfüllen des<br />
Wassers an.<br />
(b) Wie groß ist der Gasdruck im Gefäß, wenn die Temperatur beim Einfüllen konstant geblieben ist?<br />
(c) Wie groß ist der Wasserdruck im Gefäß auf Höhe der Grenzfläche zwischen Wasser und Gas?<br />
(d) Berechnen Sie die Wasserhöhe x im Gefäß.<br />
(a) V = A · (H − x) =V 0<br />
H−x<br />
H<br />
(b) Zustandsgleichung des idealen Gases: pV = nRT = konstant =⇒ p 0 V 0 = p V → p = p0V0<br />
V aus (a)=⇒ p = p 0<br />
H<br />
H−x<br />
(c) Das Wasser im Rohr ist mit dem Wasser im Gefäß verbunden, d.h. der Druck auf Höhe der Grenzfläche im Gefäß ist<br />
gleich dem Druck auf der gleichen Höhe im Rohr.<br />
Sei h die Höhe der Wassersäule im Rohr oberhalb von x: p wx = p 0 + ρgh = p 0 + ρg (l − x)<br />
(d) Da sich an der Grenzfläche zwischen Wasser und Gas ein Gleichgewicht einstellt, müssen die Ergebnisse aus (b) und<br />
H<br />
(c) gleich sein: p 0 H−x = p 0 + ρg (l − x)<br />
Auflösen nach x: p 0 H = p 0 (H − x)+ρg (l − x)(H − x)<br />
p 0 H = p 0 H − p 0 x + ρg lH − xH − lx + x 2<br />
0=ρgx 2 + x(−p 0 − ρgH − ρgl)+ρglH<br />
<br />
x 2 − l + H + p0<br />
ρg<br />
x + lH =0<br />
<br />
pq-Formel benutzen: x 1,2 = l+H+ p 0<br />
ρg (l+H+ p 0<br />
ρg ) 2<br />
2<br />
±<br />
4<br />
− lH<br />
<strong>Lösung</strong> sinnvoll, wenn Wasserhöhe x → 0 für Füllstand l → 0<br />
<br />
=⇒ x = l+H+ p 0<br />
ρg<br />
2<br />
−<br />
(l+H+ p 0<br />
ρg ) 2<br />
4<br />
− lH<br />
1
ÜBUNGEN ZU EXPERIMENTALPHYSIK 1 - WS 12/13 2<br />
2. Gasaustausch<br />
Zwei Behälter A und B enthalten ein ideales Gas. Das Volumen von B sei 4-mal so groß wie das Volumen von A. Druck<br />
und Temperatur der Behälter sind: p A = 7 bar; T A = 400 K; p B = 1 bar; T B = 500 K. Beide Behälter werden nun<br />
verbunden, wobei die Temperatur jedes Behälters auf ihrem anfänglichen Wert gehalten wird. Welcher Enddruck stellt<br />
sich ein, nachdem das Gas die jeweilige Behältertemperatur angenommen hat?<br />
p A = 7 bar, T A = 400 K, V A = 1 4 V B<br />
p B = 1 bar, T B = 500 K, V B =4V A<br />
nach Verbinden:<br />
p A = p B (gesuchte Größe)<br />
TA = T A und TB = T B<br />
VA = V A und VB = V B<br />
Anzahl der Teilchen im System ändert sich nicht:<br />
N A + N B = NA + N B<br />
<br />
Zustandsgleichung: pV = Nk B T → N = pV<br />
k B T<br />
Mit den jeweiligen Indizes einsetzen in Teilchengleichung:<br />
p A V A<br />
k B T A<br />
+ p BV B<br />
k B T B<br />
Auflösen nach p A :<br />
p A =<br />
= p A V A<br />
k B T<br />
+ p<br />
A<br />
B V B<br />
k B TB<br />
<br />
<br />
k B pA V A<br />
1 V A T + 4 T A k B<br />
A T B<br />
<br />
+ 4pB<br />
TA T<br />
B <br />
1<br />
T + 4<br />
A T B<br />
p A = p B = pA<br />
<br />
+ p BV B<br />
T B k B<br />
= p A V A<br />
k B T A<br />
+ p A 4V A<br />
k B T B<br />
= p A V A<br />
k B<br />
<br />
1<br />
= pA V A<br />
1 V A T + 4 T A<br />
A T B<br />
=2, 43 · 10 5 Pa = 2, 43 bar<br />
<br />
<br />
1<br />
T A<br />
+ 4<br />
T B<br />
<br />
+ p B4V A<br />
T B<br />
1<br />
= <br />
<br />
1<br />
T + 4<br />
A T B<br />
<br />
pA<br />
TA<br />
<br />
+ 4p B<br />
T B<br />
3. Heizbarer Druckbehälter<br />
Ein Druckbehälter enthält ein Gemisch aus 0,368 kg Stickstoff (N 2 ) und 0,514 kg Kohlendioxid (CO 2 )bei0°C und<br />
einem Druck von 15,4 bar. Durch elektrische Heizung steigt die Temperatur auf 100°C (siehe z.B. im Skript Kapitel 4.1.7<br />
und 4.2).<br />
(a) Berechnen Sie für beide Gase die molaren isochoren Waermekapazitaeten nach c mol,V = f 2 N Ak B in J<br />
mol K ,mitf:<br />
Anzahl der Freiheitsgrade (siehe Skript 4.1.2).<br />
Stickstoff ist ein zweiatomiges Gas und hat daher 3 Translations- und 2 Rotationsfreiheitsgrade: f =5<br />
→ c mol,V,N2 = 5 ”T eilchen”<br />
2 · 6, 022 · 1023<br />
mol<br />
· 1, 38 · 10 −23 J J<br />
K<br />
= 20, 78<br />
mol K<br />
Kohlendioxid ist ein mehratomiges, nichtlineares Molekül und hat daher 3 Translations- und 3 Rotationsfreiheitsgrade:<br />
f =6
ÜBUNGEN ZU EXPERIMENTALPHYSIK 1 - WS 12/13 3<br />
→ c mol,V,CO2<br />
= 6 2<br />
”T eilchen”<br />
· 6, 022 · 1023<br />
mol<br />
· 1, 38 · 10 −23 J J<br />
K<br />
= 24, 93<br />
mol K<br />
(b) Welche Wärme wurde dem Gemisch zugeführt?<br />
Im Bild des idealen Gases lässt sich die Wärmemenge zur Erwärmung des Gasgemisches aus den Wärmemengen zur<br />
Erwärmung der einzelnen Stoffanteile zusammensetzen:<br />
W Q = W Q,i = c mol,V,i · n i ·T mit c mol,V,i : molare isochore Wärmekapazität fuer jeden einzelnen Stoff<br />
i<br />
i<br />
Stoffmengen aus den molaren Massen M N2 =2· 14 g<br />
mol = 28 g<br />
mol , M CO 2<br />
=(2· 16 + 12) g<br />
mol = 44 g<br />
mol :<br />
n N2 = m N 2<br />
M N2<br />
= 13.14 mol; n CO2 = m CO 2<br />
M CO2<br />
= <strong>11</strong>.68 mol<br />
−→ W Q = 56.42 kJ<br />
(c) Welches Volumen hat der Behälter?<br />
Gasgleichung für das Gemisch: p 1 V g = n g RT 1 mit p 1 = 15, 4 bar = 15, 4 · 10 5 J m 3<br />
n g = Stoffmenge Gasgemisch = n N2 + n CO2 = 24, 82 mol<br />
−→ V g = n g R T1<br />
p 1<br />
=3, 66 · 10 −2 m 3<br />
(d) Wie groß ist der Druck nach der Erwärmung?<br />
aus Gasgleichung: p 2 = n g R T2<br />
V g<br />
= 21, 03 bar<br />
und T 1 =0 ◦ C = 273, 15 K<br />
4. Maxwellsche Geschwindigkeitsverteilung<br />
In einem idealen Gas bewegen sich nicht alle Gasteilchen mit der gleichen Geschwindigkeit, sondern statistisch verteilt<br />
mit verschiedenen Geschwindigkeiten gemäß der Maxwell-Boltzmann-Verteilung. Die Wahrscheinlichkeitsdichte für die<br />
Geschwindigkeit ist gegeben durch (vergleiche mit Skript, Kapitel 4.1.2):<br />
<br />
2<br />
f (v) =<br />
π<br />
3/2 <br />
m<br />
· v 2 · exp<br />
− mv2<br />
k B T<br />
2k B T<br />
Berechnen Sie die Geschwindigkeit mit der größten Wahrscheinlichkeitsdichte v w an für ein Wasserstoffmolekül bei 300<br />
K und 1000 K. (Tipp: Siehe zur Maximalwertberechnung von f(v) Blatt 2, Aufgabe 2.1!)<br />
!<br />
Gesucht: Maximalwert der Verteilung → ∂f(v)<br />
∂v<br />
=0wurde auf Blatt 2, Aufgabe 2.1 bereits detailliert hergeleitet.<br />
3/2 <br />
<br />
Kurze Wiederholung: ∂f(v) 2 m<br />
∂v<br />
=<br />
π ·<br />
· exp<br />
− mv2 ·<br />
2v − mv3 =0<br />
k B T<br />
2k B T k B T<br />
<br />
wird nicht null!<br />
=0<br />
<br />
=⇒ v · (2 − mv2<br />
k B T )=0=⇒v =0(Minimum) und v = 2k B T<br />
m<br />
= v w (Maximum)<br />
Masse eines Wasserstoffmoleküls:<br />
m H2 = M H 2<br />
N A<br />
=<br />
=3.32 · 10 −24 g=3.32 · 10 −27 kg k B =1.3807 · 10 −23 J K<br />
v w (300 K) =<br />
2 g<br />
mol<br />
6.022·10 23 1<br />
mol<br />
<br />
2k B T<br />
v w (1000 K) = 2884 m s<br />
K ·300 K<br />
3.32·10 −27 kg<br />
m = <br />
2·1.3807·10 −23 J<br />
1 J=1 Nm; 1 N=1 kg·m<br />
s 2<br />
= 1579 m s