Komplexchemie - Ingo Schnell
Komplexchemie - Ingo Schnell
Komplexchemie - Ingo Schnell
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Naturwissenschaftlicher Nachmittag, Block E (02.05. bis 30.05.2011) Dr. <strong>Ingo</strong> <strong>Schnell</strong><br />
<strong>Komplexchemie</strong><br />
1. Definition einer Komplexverbindung<br />
2. Nomenklatur von Komplexen<br />
3. Liganden und ihre Zähnigkeit<br />
4. Eine kurze Geschichte der <strong>Komplexchemie</strong><br />
5. Experimente<br />
5.1. Löslichkeit durch Komplexbildung<br />
5.2. Gleichgewichtsverschiebungen bei Ligandenaustauschreaktionen<br />
5.3. Maskieren von Ionen durch Komplexbildung<br />
5.4. Bestimmung der Koordinationszahl von Ni 2+ -Komplexen<br />
5.5. Stabilität von Fe 3+ -Komplexen<br />
5.6. Chelateffekt an Ni 2+ -Komplexen<br />
5.7. Chlorophyll als komplexierender Ionenaustauscher<br />
5.8. Komplexometrie mit EDTA<br />
5.9. Qualitative Analyse mittels Komplexbildung<br />
Literatur & Quellen<br />
• Nicole Krempel: „Didaktische Aufbereitungen der <strong>Komplexchemie</strong> für die Sekundarstufen I und II anhand<br />
einfach durchführbarer Versuche unter besonderer Berücksichtigung von Chelatkomplexen<br />
und bioanorganischer Systeme“, Univ. Marburg, 2004.<br />
• Gade: Koordinationschemie; 1. Aufl., Wiley-VCH, 1998.<br />
• Holleman, Wiberg: Lehrbuch der Anorganischen Chemie; 101. Aufl., de Gruyter, 1995.<br />
• Mortimer, Müller: Chemie – das Basiswissen der Chemie, 8. Aufl., Thieme, 2003.<br />
• Riedel: Anorganische Chemie, 3. Aufl., de Gruyter, 1994.<br />
1. Definition einer Komplexverbindung<br />
Ein Komplex (auch Koordinationsverbindung genannt) ist eine chemische Verbindung,<br />
bei der ein Zentralatom Lücken in seiner Elektronenkonfiguration aufweist,<br />
so dass sich Moleküle oder Ionen (die Liganden) anlagern können, die jeweils<br />
mindestens ein freies Elektronenpaar für die Bindung zur Verfügung stellen. Zwischen<br />
Ligand und Metall entsteht dadurch eine koordinative Bindung, die sich<br />
von den anderen Formen der chemischen Bindung (kovalente Bindung, Ionenbindung,<br />
Metallbindung) einerseits und der intermolekularen Wechselwirkungen (vander-Waals,<br />
Dipol-Dipol, Wasserstoffbrücken) andererseits unterscheidet. Man<br />
kann koordinative Bindungen als ein „Bindeglied“ zwischen polaren kovalenten Bindungen<br />
und nicht-kovalenten Wasserstoffbrückenbindungen betrachten. Das bindende<br />
Elektronenpaar stammt stets vom Liganden und nicht – wie in einer gewöhnlichen<br />
kovalenten Bindung – mit je einem Elektron von beiden Bindungspartnern.<br />
Um als Ligand fungieren zu können, muss ein Teilchen folglich mindestens<br />
ein freies Elektronenpaar besitzen. An das Zentralatom sind in Komplexen mehr Liganden<br />
gebunden, als man nach der Ladung oder Stellung des Zentralatoms im<br />
Periodensystem erwarten würde.<br />
Schematische Darstellung von Komplexen<br />
mit Zentralteilchen (rot) und Liganden.<br />
Bei den Koordinationszahlen 4, 6 und 8<br />
ergeben sich häufig die Geometrien eines<br />
Tetraeders, Oktaeders und Würfels.<br />
Seite 1
Zentralteilchen können Atome oder Ionen sein. Am häufigsten treten dabei die Kationen von Übergangsmetallen<br />
mit relativ hohen Ladungen und kleinen Ionenradien auf. Wichtige Beispiele sind Cr 3+ , Fe 3+ , Ni 2+ oder<br />
Cu 2+ . Aber auch Metalle der Hauptgruppen – wie Ca 2+ oder Al 3+ – können Komplexe bilden. Die Liganden<br />
sind in vielen Fällen Nichtmetallanionen, Moleküle oder Molekülionen. Zu unterscheiden sind neutrale Liganden<br />
(z.B. H 2O, NH 3 oder CO) und anionische Liganden (z.B. Cl - , Br - , I - , CN - , OH - , SO 4 2- oder C2O 4 2- ).<br />
Selten treten auch kationische Liganden auf. Ein Beispiel hierfür wäre NO + . Im Normalfall sind die Liganden<br />
auch außerhalb des Komplexes stabile Teilchen. Als Donoratome der Liganden werden die Atome bezeichnet,<br />
die an der direkten Bindung zum Zentralteilchen beteiligt sind. Die Anzahl der Donoratome aller koordinierten<br />
Liganden wird als Koordinationszahl bezeichnet. Die Liganden sind in einer bestimmten Geometrie<br />
um das Zentralteilchen angeordnet. Der Raumkörper, der entsteht, wenn man sich die Mittelpunkte der direkt<br />
an das Zentralatom gebundenen Atome durch Linien miteinander verbunden denkt, wird Koordinationspolyeder<br />
genannt (siehe Abschnitt 3).<br />
2. Nomenklatur von Komplexen<br />
Während früher Komplexverbindungen häufig Trivialnamen hatten, wie z.B. “gelbes Blutlaugensalz“ für die<br />
Verbindung K 4[Fe(CN) 6] mit dem Eisenkomplex [Fe(CN) 6] 4- als Anion , wurde es mit fortschreitender Entwicklung<br />
der <strong>Komplexchemie</strong> notwendig, ein einheitliches Nomenklatursystem einzuführen, das vom Namen auf<br />
den Aufbau der Komplexe schließen lässt. Zu unterscheiden ist zwischen der formelmäßigen Wiedergabe<br />
durch die chemischen Symbole und der Benennung eines Komplexes.<br />
Regeln für die Aufstellung von Komplexformeln (z.B. [Fe(CN) 6] 4- )<br />
• Jede Komplexverbindung ist oder enthält eine Koordinationseinheit, die aus dem Zentralatom bzw.<br />
-ion und den daran gebundenen Liganden besteht. Die Koordinationseinheit, die geladen oder ungeladen<br />
sein kann, wird in eckige Klammern eingeschlossen.<br />
• Zuerst wird das Elementsymbol des Zentralteilchens angegeben. Es folgen kationische, anionische<br />
und darauf neutrale Liganden in alphabetischer Reihenfolge innerhalb der Ligandenklassen. Werden<br />
Abkürzungen für größere Liganden verwendet (z. B. py für Pyridin, C 5H 5N), so werden sie dort eingefügt,<br />
wo sie als Summenformeln stehen würden.<br />
• Mehratomige Liganden sowie Abkürzungen werden in runde Klammern gesetzt. Die Anzahl der Liganden<br />
wird als Index angegeben.<br />
• Liegt eine geladene Koordinationseinheit vor, wird die Ladung, die der Summe der Ladungen der<br />
Einzelionen entspricht, hochgestellt hinter die Koordinationseinheit gesetzt.<br />
Regeln für die Benennung von Komplexen (z.B. „Hexacyanoferrat“)<br />
• An die Namen anionischer Liganden wird in der Regel die Endung -o angehängt. Die Endung -id entfällt,<br />
und an den verbleibenden Wortstamm wird direkt ein -o angehängt.<br />
• Die Namen neutraler und kationischer Liganden werden unverändert verwendet und in runde Klammern<br />
eingeschlossen. Ausnahmen sind die Liganden H 2O (aqua), NH 3 (ammin), CO (carbonyl), NO<br />
(nitrosyl).<br />
• Zuerst werden die Liganden in alphabetischer Reihenfolge unabhängig von der Ladung genannt.<br />
Mittels Präfix (di-, tri-, tetra-, penta-, hexa-, hepta- usw. oder bei größeren Liganden bis-, tris-, tetrakis-<br />
usw.) wird die jeweilige Anzahl wiedergegeben.<br />
• Am Ende steht der Name des Zentralteilchens. Bei anionischen Koordinationseinheiten wird dem lateinischen<br />
Wortstamm des Zentralteilchens das Suffix -at angehängt, bei kationischen und neutralen<br />
Koordinationseinheiten wird der Name unverändert angegeben. Die Oxidationszahl des Zentralteilchens<br />
wird als römische Ziffer in runde Klammern angefügt.<br />
Seite 2
Abschließend einige Beispiele für Komplexverbindungen mit Formel und systematischem Namen.<br />
3. Liganden und ihre Zähnigkeit<br />
Ein Ligand kann mehrere Donoratome zur Ausbildung einer koordinativen Bindung zum Zentralteilchen besitzen.<br />
Die Zahl der koordinativen Bindungen, die ein Ligand in einem Komplex betätigt, nennt man die Zähnigkeit.<br />
Man unterscheidet einzähnige bis achtzähnige Liganden.<br />
Einzähnige Liganden können Ionen oder Moleküle sein, die mehrere freie Elektronenpaare besitzen können,<br />
aber nur eines zur koordinativen Bindung benutzen. Im einfachsten Fall sind sie einatomig wie z. B. F - ,<br />
Cl - oder O 2- . Sie können aber auch mehratomig sein, Beispiele hierfür sind H2O, NH3, CO, OH - oder SCN - .<br />
Zweizähnige Liganden enthalten zwei Donoratomen,<br />
die mit je einem freien Elektronenpaar zur koordinativen<br />
Bindung befähigt sind, sie aber nicht ausbilden<br />
müssen. Zweizähnige Liganden können im Komplex<br />
also auch einzähnig gebunden sein, wie z. B.<br />
CO3 2- . Weitere typische Vertreter sind in der Abbildung<br />
neben zusammengestellt; dabei sind die Donoratome<br />
rot gekennzeichnet und die gebräuchlichen Abkürzungen<br />
der komplizierteren Liganden mit angegeben.<br />
Sechszähnige Liganden können sich in einer Art Helix<br />
um das Zentralteilchen legen. Voraussetzung dafür ist<br />
eine geeignete räumliche Anordnung, wie man sie z.B.<br />
im Anion der Ethylendiamintetraessigsäure findet. Die<br />
sechszähnigen Liganden nehmen eine besondere Stellung<br />
ein, da sich die gebildeten Komplexe durch besonders<br />
hohe Stabilität auszeichnen. Sie finden deshalb bei<br />
Vierzähnige Liganden legen sich weitgehend eben um das<br />
Zentralteilchen. Für den Aufbau bioanorganischer Systeme ist<br />
das vierzähnige, ungesättigte Porphyrin-Dianion von Bedeutung.<br />
Bei diesem Ligand liegen die Donoratome bereits vor der Koordination<br />
am Metall in einem großen organischen Ring derart vor,<br />
dass sie ein Metallzentrum geeigneter Größe umschließen können.<br />
Seite 3
der quantitativen Bestimmung von Metall-Ionen Verwendung. Das Phänomen der erhöhten Stabilität, das allgemein<br />
bei mehrzähnigen Liganden auftritt, wird als Chelateffekt bezeichnet (griech., „Krebsschere“).<br />
4. Eine kurze Geschichte der <strong>Komplexchemie</strong><br />
Einzelne Substanzen, deren charakteristischer Inhaltsstoff eine Koordinationsverbindung war, stellte man<br />
schon im Altertum her, wie z. B. den Farblack Alizarin oder Hämderivate aus Tierblut. Erste Dokumentationen<br />
gibt es seit Herodot (450 v. Chr.). Den ersten wissenschaftlich dokumentierten Beleg einer Komplexverbindung<br />
lieferte der Hallenser Arzt und Alchimist Andreas Libavius aber erst 1597. Er beschrieb den Tetraamminkupfer(II)-Komplex,<br />
der jedoch erst viel später als Komplexverbindung charakterisiert wurde. Die erste<br />
Isolierung gelang Diesbach und Dippel 1704 im Falle von “Berliner Blau“, Fe4[Fe(CN)6]3. Eine chemische<br />
Formulierung der Hydrate und Amminkomplexe der Übergangsmetalle gehörte zu dieser Zeit aber noch zu<br />
den ungelösten Problemen der anorganischen Chemie.<br />
Es dauerte bis zum Beginn des 19. Jahrhunderts, dass Komplexverbindungen Gegenstand chemischer Forschung<br />
wurden und in rascher Abfolge eine ganze Reihe von Komplexverbindungen mit einer gezielten präparativen<br />
Methodik hergestellt werden konnten. Die synthetisierten Komplexe benannte man meist nach ihren<br />
Entdeckern. Mit Sophus Mads Jørgensen betrat 1878 der wohl produktivste präparative Komplexchemiker<br />
des 19. Jahrhunderts die Bühne der Wissenschaft. In den folgenden drei Jahrzehnten synthetisierte er<br />
systematisch eine Vielzahl von Komplexverbindungen und beschäftigte sich mit der chemischen Formulierung<br />
der Hydrate und Amminkomplexe der Übergangsmetalle. Jørgensen selbst war Anhänger eines Strukturkonzeptes,<br />
das der Schwede Christian W. Blomstrand entwickelt hatte. Dieses Konzept wurde ab 1870<br />
unter dem Begriff „Kettentheorie“ bekannt und basierte auf den erfolgreich angewendeten Grundprinzipien<br />
der organischen Chemie.<br />
Alfred Werner. Originalpräparate aus Alfred Werners Laboratorium.<br />
Die Widersprüche der Kettentheorie und nicht zuletzt die herausragenden präparativen Arbeiten von Jørgensen<br />
schufen die Grundlage für die Koordinationschemie Alfred Werners (1866-1919), der durch seinen epochalen<br />
Beitrag zum Aufbau der Komplexe heute gern als “Vater der <strong>Komplexchemie</strong>“ bezeichnet wird. Ende<br />
des Jahres 1892 reichte der damals erst 26-jährige Schweizer Chemiker seine Arbeit “Beiträge zur Konstitution<br />
anorganischer Verbindungen“ bei der kurz zuvor gegründeten Zeitschrift für Anorganische Chemie ein<br />
und führte damit die anorganische Chemie aus dem Schatten der alles dominierenden organischen Chemie.<br />
Bei der Formulierung seiner Koordinationstheorie gab Werner die Beschränkung Valenz (Wertigkeit) = Bindigkeit<br />
(Koordinationszahl) auf, die in Orientierung an die Chemie des Kohlenstoffs zu den oben genannten<br />
Kettentheorien geführt hatte. Er postulierte, dass jedes Zentralatom in einem Komplex neben seiner Valenzzahl<br />
(später von ihm umbenannt in “Hauptvalenz“ = Oxidationszahl) eine charakteristische Koordinationszahl<br />
(später “Nebenvalenz“) besitzt. Dabei waren neutrale Liganden direkt an das Metallatom gebunden, während<br />
anionische Liganden entweder “in der ersten Sphäre“ direkt an das Metall gebunden waren oder “in der<br />
zweiten Sphäre“ als Gegenion fungieren konnten. In seiner Neuformulierung des Aufbaus der Metallkomplexe<br />
beschäftigte sich Werner auch mit der Frage der Geometrie solcher Verbindungen und bot für die zur damaligen<br />
Zeit am häufigsten beobachtete Koordinationszahl sechs das Oktaeder als Ligandenpolyeder an.<br />
Für die vierfach koordinierten Pt(II)-Komplexe postulierte er angesichts der beobachteten Konfigurationsisomere<br />
eine quadratisch-planare Geometrie. Ein weiterer bemerkenswerter Aspekt der Arbeit von 1893 war<br />
das Fehlen einer adäquaten empirischen Grundlage für die weitreichenden Thesen (er selber hatte nicht ein<br />
einziges Experiment auf diesem Gebiet bis zu dem Zeitpunkt durchgeführt!). Dieser Umstand veranlasste<br />
später einmal einen deutschen Kollegen, die Wernersche Koordinationstheorie als eine “geniale Frechheit“<br />
zu bezeichnen. Es wurde das wissenschaftliche Lebenswerk Alfred Werners, diese geniale Frechheit auf<br />
Seite 4
eine sichere experimentelle Grundlage zu stellen. In den Jahren nach 1893 präparierte er unzählige<br />
Komplexverbindungen und unternahm den schrittweisen Beweis seiner Postulate.<br />
Ein früher Erfolg (1894) der neuen Koordinationslehre war zum Beispiel die vollständige Erklärung der Ergebnisse<br />
von Leitfähigkeitsmessungen an einer Reihe von Ammincobaltkomplexen, die von Arturo Miolati<br />
und Alfred Werner durchgeführt wurden. 1911 gelang die Enantiomerentrennung eines Komplexracemats<br />
durch Werners amerikanischen Doktoranden Victor L. King und erbrachte somit den endgültigen Beweis der<br />
stereochemischen Vorstellungen Werners. 1913 erhielt Alfred Werner für seine wissenschaftlichen Meister-<br />
leistungen als erster anorganischer Chemiker den Nobelpreis für Chemie. Auch nach Werners Tod 1919<br />
stand die Entwicklung der <strong>Komplexchemie</strong> ganz im Zeichen der experimentellen Absicherung und Erweiterung<br />
seiner Konstitutionslehre, so dass seine weit reichenden wissenschaftlichen Hypothesen in der Folgezeit<br />
weiter untermauert werden konnten. Noch heute bilden sie die theoretische Basis der <strong>Komplexchemie</strong>.<br />
5. Experimente<br />
5.1. Löslichkeit durch Komplexbildung<br />
Chemikalien. Aluminiumchloridlösung (c = 0,1 mol/L), Kupfersulfatlösung (c = 0,1 mol/L), Salzsäure (c =<br />
1 mol/L), Natronlauge (c = 1 mol/L), Seignettesalz.<br />
Durchführung. (a) In einem Reagenzglas wird die Aluminiumchloridlösung mit 2-3 Tropfen Salzsäure angesäuert.<br />
Nun wird tropfenweise Natronlauge bis zu einer Niederschlagsbildung zugefügt. Die Lösung wird<br />
durchmischt und weiter Natronlauge zugetropft, bis es zur Auflösung des Niederschlages kommt.<br />
(b) In einem Reagenzglas werden zu Kupfersulfatlösung 2-3 Tropfen Natronlauge gegeben. Es bildet sihc<br />
ein bläulich-weißer Niederschlag von Kupferhydroxid. Nun gibt man eine Spatelspitze Seignettesalz zu und<br />
erwärmt vorsichtig über dem Bunsenbrenner, bis es zur Auflösung des Niederschlages kommt und ein tiefblauer<br />
Kupfertartrat-Komplex entstanden ist.<br />
Erläuterung. (a) Das Aluminium liegt als dreifach positiv geladenes Kation in der Lösung vor. Mit Hydroxidionen<br />
bildet sich zunächst das schwerlösliche Aluminiumhydroxid Al(OH)3. Bei höheren Hydroxid-Konzentrationen<br />
bildet sich daraus das lösliche Tetrahydroxoaluminat [Al(OH)4] - .<br />
Elektronenkonfiguration<br />
von Al als Element (links),<br />
als Al 3+ (Mitte) und im<br />
[Al(OH)4] - -Komplex (rechts).<br />
(b) → Was passiert im Fall der Kupfersulfatlösung?<br />
5.2. Gleichgewichtsverschiebungen bei Ligandenaustauschreaktionen<br />
Chemikalien. Kupfer(II)nitratlösung (c = 0,1 mol/L), Salzsäure (konz.), Salpetersäure (halbkonz.), Ammoniaklösung<br />
(c = 2 mol/L) .<br />
Durchführung. (a) Gleichgewichtsverschiebung durch Konzentrationsänderung: In zwei Reagenzgläser<br />
wird die Kupfer(II)nitratlösung gegeben. Eines davon dient für die folgenden Versuche als Blindprobe. In<br />
das zweite wird solange konzentrierte Salzsäure getropft, bis eine deutliche Farbänderung von blau nach<br />
Seite 5
hellgrün erkennbar ist. Die gleiche Lösung wird mit Wasser verdünnt bis die blaue Ursprungsfarbe erneut<br />
auftritt.<br />
(b) Gleichgewichtsverschiebung durch Temperaturänderung: Von der in (a) erhaltenen, verdünnten<br />
blauen Lösung wird etwas in ein weiteres Reagenzglas gefüllt und vorsichtig in der Bunsenbrennerflamme<br />
bis zu einer Farbänderung erhitzt. Danach wird das Reagenzglas etwa eine Minute in einem Wasserbad abgekühlt.<br />
(c) Gleichgewichtsverschiebung durch pH-Wert-Änderung: Kupfer(II)nitratlösung wird in ein Reagenzglas<br />
gegeben und verdünnte Ammoniaklösung solange zugetropft, bis ein Niederschlag ausfällt. Weitere Ammoniaklösung<br />
wird zugefügt bis es zur Auflösung des Niederschlages und zu einer Farbänderung kommt.<br />
Ein Teil der erhaltenen tiefblauen Lösung wird in ein zweites Reagenzglas gegeben und halbkonzentrierte<br />
Salpetersäure bis zu einem erneuten Farbwechsel zugegeben.<br />
Erläuterung. (a) Gleichgewichtsverschiebung durch Konzentrationsänderung: Verdünnte Kupfer(II)salzlösungen<br />
enthalten den hellblauen Hexaaquakomplex des Kupferions [Cu(H2O)6] 2+ . Tropfenweise Zugabe<br />
von Salzsäure zu der blauen Lösung bewirkt, dass stufenweise Wassermoleküle gegen Chlorid-Ionen<br />
ausgetauscht werden. In dieser Ligandenaustauschreaktion bildet sich der hellgrüne Tetraaquadichlorokupfer(II)-Komplex,<br />
welcher durch Zugabe von Wasser wieder zerstört werden kann. Es bildet sich die ursprüngliche<br />
blaue Farbe der Kupfer(II)nitratlösung zurück.<br />
Die Gleichgewichtsverschiebungen entsprechen dem Prinzip von Le Chatelier; eine Konzentrationserhöhung<br />
eines der Edukte fördert die Hinreaktion. Im Beispiel wird also durch die Zugabe von Salzsäure die Bildung<br />
des hellgrünen Chlorokomplexes begünstigt und durch die Erhöhung der Wasserkonzentration die Rückbildung<br />
des blauen Aquakomplexes gefördert. Die vorliegende Gleichgewichtsreaktion ist wie folgt formulierbar:<br />
(b) → Was passiert bei der Temperaturänderung?<br />
(c) → Was passiert bei der Änderung des pH-Werts?<br />
5.3. Maskieren von Ionen durch Komplexbildung<br />
Chemikalien. Kupfer(II)sulfatlösung (c = 0,5 mol/L), Eisen(III)chloridlösung (c = 0,1 mol/L), Kaliumhexacyanoferrat(III)-Lösung<br />
(c = 0,1 mol/L), Ammoniumthiocyanatlösung (c = 0,1 mol/L), Natronlauge (c = 1 mol/L),<br />
Ammoniaklösung (c = 10 mol/L) .<br />
Durchführung. (a) Das System Cu 2+ (aq) / NH3(aq) / Fe(s): In zwei Reagenzgläser werden jeweils 2 mL der<br />
Kupfer(II)sulfatlösung gegeben und mit ca. 3 mL Wasser verdünnt. Dem ersten Glas wird ein Eisennagel zugefügt<br />
und dem zweiten einige mL Ammoniaklösung. Nach kurzem Schütteln des zweiten Reagenzglases<br />
wird diesem ebenfalls ein Eisennagel zugegeben. Nach etwa 5 Minuten Reaktionszeit werden die Lösungen<br />
vorsichtig abgeschüttet und die Nägel nebeneinander betrachtet.<br />
(b) Das System Cu 2+ (aq) / NH3(aq) / OH - (aq): Erneut werden zwei Reagenzgläser mit ca. 2 mL<br />
Kupfer(II)sulfatlösung und ca. 3 mL Wasser befüllt. Das erste Glas wird mit 10 Tropfen Natronlauge versetzt.<br />
In das zweite Glas werden 3 mL Ammoniaklösung und nach kurzem Schütteln der Lösung ebenfalls 10 Tropfen<br />
Natronlauge zugegeben.<br />
(c) Die Systeme Fe 3+ (aq) / SCN - (aq) und [Fe(CN)6] 3- (aq) / SCN - (aq): In ein Reagenzglas werden ca. 2 mL<br />
der Eisen(III)chloridlösung und ca. 3 mL Wasser gefüllt. In diese Lösung gibt man 5 Tropfen der verdünnten<br />
Ammoniumthiocyanatlösung. Ein zweites Reagenzglas wird mit ca. 2 mL einer Kalium-hexacyanoferrat(III)-<br />
Lösung und 3 mL Wasser befüllt und danach ebenfalls mit 5 Tropfen der verdünnten Ammoniumthiocyanatlösung<br />
versetzt. Es sind Farbänderungen zu beobachten.<br />
Seite 6
Erläuterung. (a) Das System Cu 2+ (aq) / NH3(aq) / Fe(s): Werden die beiden Eisennägel verglichen, ist nur<br />
auf dem Nagel aus dem ersten Reagenzglas ein Kupferüberzug mit typisch rotbrauner Farbe sichtbar. Eisen<br />
gibt als das unedlere Metall Elektronen an die Cu 2+ -Ionen ab und geht an deren Stelle als Fe 2+ (bzw. Fe 3+ ) in<br />
Lösung. Dies ist eine charakteristische Reaktion für Cu 2+ -Ionen. In der Kupfer(II)sulfatlösung liegen Hexaaquakupfer(II)-Ionen<br />
vor, die mit dem Eisennagel nach folgender Reaktionsgleichung reagieren:<br />
Nach Zugabe von Ammoniaklösung zur Kupfer(II)sulfatlösung im zweiten Reagenzglas tritt eine kräftige tiefblaue<br />
Färbung ein, welche auf die Bildung des Tetraammindiaquakupfer(II)-Komplexes zurückzuführen ist.<br />
Eine Abscheidung von Kupfer auf dem Eisennagel findet nicht statt und zeigt damit deutlich das Ausbleiben<br />
der für Metall-Ionen charakteristischen Redoxreaktion.<br />
(b) → Was passiert im System Cu 2+ (aq) / NH3(aq) / OH - (aq)? Vgl. Exp. 1b.<br />
(c) → Was passiert in den Systemen Fe 3+ (aq) / SCN - (aq) und [Fe(CN)6] 3- (aq) / SCN - (aq)?<br />
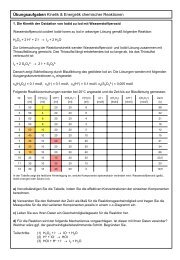
5.4. Bestimmung der Koordinationszahl von Ni 2+ -Komplexen<br />
Methode . Sind die Bestandteile eines Komplexes bekannt, ist es in manchen Fällen sehr einfach möglich<br />
die Komplexzusammensetzung zu bestimmen, indem man ein Äquivalent Metallionenlösung mit kontinuierlich<br />
steigenden Äquivalenten von Ligandenlösung versetzt. Es entstehen die einzelnen Komplexe mit steigender<br />
Anzahl von Liganden, welche durch eine stufenweise Farbänderung erkennbar sind. Die Farbe bleibt<br />
bestehen sobald die maximale Koordination erreicht ist. Sind die Farbabstufungen, wie bei der Reaktion von<br />
Nickel(II)nitratlösung mit dem zweizähnigen Liganden Ethylendiamin, sehr gut erkennbar, reicht ein visueller<br />
Vergleich der Farben zur Bestimmung der Koordinationszahl aus (Exp. 4a).<br />
Bei der Umsetzung von Nickel(II)nitratlösung mit Ammoniaklösung sind die Farbänderungen der Lösungen<br />
erkennbar, allerdings sind diese sehr fein, so dass es nicht so einfach möglich ist, die Koordinationszahl visuell<br />
zu bestimmen. In diesem Fall erfolgt die Bestimmung der Koordinationszahl durch quantitative Erfassung<br />
der Farbintensität mit Hilfe eines Photometers (Exp. 4b). Man strahlt dabei monochromatisches Licht<br />
der Intensität I0 durch die zu analysierende Lösung und misst die verbleibende Lichtintensität I nach Durchlaufen<br />
der Lösung. Die Größe E = lg(I/I0) wird als Extinktion der Lösung bezeichnet. Für Absorptionsvorgänge<br />
dieser Art gilt das Lambert-Beersche Gesetz:<br />
E = ε · c · d = lg(I/I0)<br />
mit Extinktionskoeffizient ε, Konzentration c des absorbierenden Stoffes und Schichtdicke d der untersuchten<br />
Probe). Der Extinktionskoeffizient ε ist abhängig von der Wellenlänge des verwendeten Lichts und vom untersuchten<br />
Stoff, ist also – wie auch die Schichtdicke d – bei der Messung konstant, so dass die Extinktion<br />
proportional zur Konzentration des Komplexes ist. Man bestimmt also die Extinktion (und damit die Konzentration<br />
des Komplexes) in Abhängigkeit vom Molverhältnis Ligand/Metallion.<br />
Chemikalien. Nickel(II)nitratlösung (c = 1 mol/L), Ethylendiaminlösung (c = 1 mol/L), Ammoniaklösung (c =<br />
1 mol/L) .<br />
Durchführung. (a) Koordinationszahl des Tris(ethylendiamin)nickel(II)-Komplexes : Für die Bestimmung<br />
wird in die fünf nummerierten Reagenzgläser jeweils 1 mL der Nickelsalzlösung (c = 1 mol/L) gegeben,<br />
dazu die in der Tabelle angegebene steigende Menge an Etylendiaminlösung (c = 1 mol/L). Dadurch werden<br />
in den Reagenzgläsern verschiedene Verhältnisse von Metallion zu Ligand erreicht. Alle Reagenzgläser wer-<br />
Seite 7
den mit der jeweils angegebenen Menge Wasser auf gleiches Niveau aufgefüllt und nach guter Durchmischung<br />
der Lösungen das Ende der Farbänderung festgestellt.<br />
(b) Photometrische Untersuchung der Nickel(II)ammin-Komplexe: Für die Bestimmung mit dem Photometer<br />
sind größere Mengen an Lösung als in Versuchsteil a erforderlich. Deshalb werden in jedem Reagenzglas<br />
2 mL Nickel(II)nitratlösung vorgelegt. Ammoniaklösung und Wasser werden gemäß folgender Tabelle<br />
zugegeben:<br />
Jedem Reagenzglas werden zusätzlich 1 g Ammoniumnitrat zugefügt, um den gebildeten Nickel(II)hydroxid-<br />
Niederschlag aufzulösen. Die Reagenzgläser werden mehrmals geschüttelt, bis klare Lösungen entstanden<br />
sind. Mit diesen Proben wird die photometrische Bestimmung bei einer Wellenlänge von 585 nm durchgeführt.<br />
Dazu wird die erste Küvette mit der Lösung aus Reagenzglas 0 gefüllt und dient während der gesamten<br />
Messung als Blindprobe. Die zweite Küvette wird nacheinander mit den Lösungen aus Reagenzglas 1<br />
bis 8 befüllt und ist vor jeder neuen Messung mit der entsprechenden Lösung zweimal zu spülen. Die gemessenen<br />
Extinktionswerte werden notiert und graphisch gegen das Molverhältnis Ligand/Metallion aufgetragen.<br />
Erläuterung. (a) Koordinationszahl des Tris(ethylendiamin)nickel(II)-<br />
Komplexes : Das erste Reagenzglas zeigt die grünliche Farbe der<br />
Nickel(II)nitratlösung, die sich durch Zugabe von Ethylendiamin schrittweise<br />
blau, dann violett färbt. Die Violettfärbung tritt erstmalig beim vierten Reagenzglas<br />
auf und bleibt im fünften Reagenzglas bestehen. Die Farbintensität<br />
erhöht sich nur bis zum vierten Reagenzglas, in dem ein molares Verhältnis<br />
von Ligand und Metallion von 3:1 vorliegt. Daraus lässt sich schließen, dass<br />
ein Nickel(II)-Ion maximal drei Ethylendiaminmoleküle binden kann. Da Ethylendiamin<br />
zwei Stickstoffatome mit freien Elektronenpaaren besitzt, die in<br />
Wechselwirkung mit den Nickel(II)-Ionen treten können, ergibt sich insgesamt<br />
eine Koordinationszahl von 6. Der gebildete Etylendiaminnickel(II)-Komplex<br />
weist also eine oktaedrische Struktur auf. Der Komplex wird schrittweise im<br />
Zuge von Ligandenaustauschreaktionen gebildet, die wie folgt beschrieben<br />
werden können:<br />
(b) → Welche Koordinationszahl und welche Struktur hat der Nickel(II)ammin-Komplex? Werten Sie die photometrische<br />
Bestimmung aus.<br />
5.5. Stabilität von Fe 3+ -Komplexen<br />
Chemikalien. Eisen(III)nitratlösung (c = 0,1 mol/L), Salpetersäure (c = 1 mol/L), Natriumchloridlösung (konzentriert)<br />
, Kaliumthiocyanatlösung (c = 0,1 mol/L), Natriumfluoridlösung (konzentriert).<br />
Seite 8
Durchführung. 50 mL der Eisen(III)nitratlösung werden in ein Becherglas gegeben und der pH- Wert mit Hilfe<br />
von pH-Papier oder des pH-Meters gemessen. Anschließend wird die Lösung so lange mit Salpetersäure<br />
versetzt, bis sie sich fast entfärbt hat. Der Inhalt des Becherglases wird auf 5 Reagenzgläser aufgeteilt.<br />
Das erste Reagenzglas bleibt unverändert und soll bei der Auswertung dem besseren Farbvergleich dienen.<br />
Der Inhalt der vier weiteren Reagenzgläser wird mit einigen Tropfen der folgenden Chemikalien versetzt:<br />
2. Reagenzglas: konz. NaCl-Lsung<br />
3. Reagenzglas: verd. KSCN-Lösung<br />
4. Reagenzglas: konz. NaF-Lösung<br />
5. Reagenzglas: nacheinander konz. NaCl-Lösung, verd. KSCN-Lösung und konz. NaF-Lösung.<br />
→ Werten Sie Ihre Ergebnisse aus. Welche Eisen(III)-Komplexe entstehen? Wie stabil sind sie jeweils? Geben<br />
Sie eine Stabilitätsreihenfolge an.<br />
5.6. Chelateffekt an Ni 2+ -Komplexen<br />
Chemikalien. Nickel(II)nitratlösung (c = 0,1 mol/L), Ammoniaklösung (25 %ig), Ethylendiamin.<br />
Durchführung. Fünf Reagenzgläser werden mit je 2 mL der Nickel(II)nitratlösung versetzt. Das erste wird<br />
beiseite gestellt und dient als Blindprobe. In das zweite wird tropfenweise Ammoniaklösung, in das dritte<br />
tropfenweise Ethylendiamin bis zu einer deutlichen Farbänderung gegeben. Reagenzglas 4 wird zunächst<br />
mit ein paar Tropfen Ammoniaklösung versetzt, danach werden noch einige Tropfen Ethylendiamin zugefügt.<br />
Dem fünften Reagenzglas werden nacheinander einige Tropfen Ethylendiamin, einige Tropfen Ammoniaklösung<br />
und danach mehrere Milliliter Ammoniaklösung hinzugefügt.<br />
→ Werten Sie Ihre Ergebnisse aus. Welche Nickel(II)-Komplexe entstehen? Wie stabil sind die Komplexe<br />
einzähniger und zweizähniger Liganden im Vergleich? Was ist der Chelateffekt?<br />
5.7. Chlorophyll als komplexierender Ionenaustauscher<br />
Chemikalien. grüne Bohnen, Natriumsulfit , Kaliumthiocyanat, Kupfer(II)sulfatlösung (c = 0,1 mol/L), Ammoniaklösung<br />
(25%ig), Mischindikator aus Eriochromschwarz T : Methylorange : Natriumchlorid im Masseverhältnis<br />
0,1 g : 0,04 g : 10 g .<br />
Durchführung. In das erste Becherglas werden 150 mL Kupfer(II)sulfatlösung, in das zweite die gleiche<br />
Menge an entionisiertem Wasser gefüllt. In beide Lösungen werden jeweils fünf grüne Bohnen gegeben. Der<br />
Inhalt der Bechergläser wird ca. 20 Minuten auf der Heizplatte des Magnetrührers gekocht. Danach werden<br />
die Bohnen mit einer Pinzette aus der Lösung genommen, mit Wasser abgespült, trocken getupft und die<br />
Farben vor einem weißen Blatt Papier verglichen.<br />
Der Ionenaustausch wird durch einen Mg 2+ -Nachweis mit Eriochromschwarz T bestätigt. Dazu müssen zunächst<br />
die störenden Kupfer(II)Ionen aus der Lösung ausgefällt werden. Ein Teil der Kupfer(II)sulfatlösung, in<br />
der die Bohnen gekocht wurden, wird in ein Reagenzglas gegeben und nacheinander eine Spatelspitze von<br />
Natriumsulfit und Kaliumthiocyanat hinzugegeben. Der entstandene weiße Niederschlag wird abfiltriert, indem<br />
man die Lösung durch einen kleinen Trichter mit Filterpapier in ein zweites Reagenzglas tropfen lässt.<br />
Die Vollständigkeit der Fällung wird durch eine Wiederholung des Vorgangs überprüft. Fällt weiterhin ein Niederschlag<br />
aus, so ist erneut zu filtrieren und die Fällung zu wiederholen, bis das Filtrat keine Kupfer(II)-Ionen<br />
mehr enthält. Da es sich in der Regel um sehr geringe Konzentrationen handelt, ist meist die Fällung schon<br />
nach der ersten Zugabe vollständig. Der Mg 2+ -Nachweis wird mit der filtrierten Lösung durchgeführt. Etwas<br />
Eriochromschwarz T-Mischindikator (siehe auch Exp. 8) wird der Lösung zugesetzt und danach Ammoniaklösung<br />
bis zur alkalischen Reaktion zugegeben. Eine Rotfärbung zeigt Mg 2+ -Ionen an.<br />
Erläuterung. Die Farben der Bohnen unterscheiden sich. Die nur in entionisiertem Wasser gekochten zeigen<br />
eine olivgrüne Farbe, während die in der Kupfer(II)sulfatlösung gekochten intensiv grün gefärbt sind.<br />
Seite 9
Werden letztere mit der Farbe ungekochter Bohnen verglichen, ist sogar eine Farbintensivierung feststellbar.<br />
Der Grund der unterschiedlichen Färbung liegt darin, dass die in der Kupfer(II)- sulfatlösung enthaltenen<br />
Kupfer(II)-Ionen mit dem Chlorophyll der Bohnen reagieren. Es findet eine Umkomplexierung statt, bei der<br />
die komplex gebundenen Magnesium-Ionen im Chlorophyll gegen Kupfer(II)-Ionen ausgetauscht werden.<br />
Der entstandene Kupfer(II)-Chelatkomplex (Chlorophyllin) ist offenbar stabiler als sein Analogon mit Magnesium-Ionen<br />
als Zentralteilchen. Chlorophyllin ist intensiv grün gefärbt und in der Lebensmittelindustrie als<br />
Farbstoff zugelassen.<br />
Varianten. Das Chlorophyll lässt sich aus vielen Pflanzen durch Kochen in Wasser (ggf. mit Ethanol gemischt)<br />
auch extrahieren. Stellen Sie eine solches wässriges Extrakt her und versetzen Sie es mit<br />
Kupfer(II)sulfat-Lösung. Können Sie eine Farbvertiefung beobachten? Prüfen Sie neben Cu 2+ auch den Austausch<br />
mit anderen Metallionen, z.B. Fe 2+ , Ni 2+ oder Co 2+ . → Mit welchen Metallionen können Sie Farbeffekte<br />
des Chlorophylls beobachten?<br />
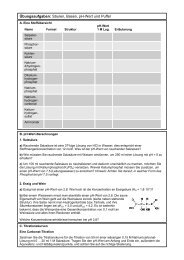
5.8. Komplexometrie mit EDTA<br />
Methode. Komplexreaktionen spielen im Bereich der chemischen Analytik sowohl in der qualitativen als<br />
auch in der quantitativen Analyse eine wichtige Rolle. Eine breite Anwendung findet dabei die Komplexometrie<br />
zur quantitativen Bestimmung von Metall-Ionen durch Titration. Aber auch im Bereich der qualitativen<br />
Analyse beruhen viele spezifische Nachweisreaktionen für Metall-Ionen auf der Bildung farbiger Komplexe.<br />
In beiden Gebieten haben Chelatliganden größte Bedeutung erlangt.<br />
Die Komplexometrie ist ein klassisches maßanalytisches<br />
Verfahren, das 1945 von Gerold Karl Schwarzenbach entwickelt<br />
wurde. Das Prinzip beruht darauf, dass Metallkationen<br />
mit dem zugesetzten Liganden einen stabilen stöchiometrischen<br />
Komplex bilden. Die Menge des zugesetzten Liganden<br />
gibt Aufschluss über die vorliegende Menge an Metallkationen.<br />
Zu den am häufigsten angewandten so genannten<br />
Komplexonen zählt die Etylendiamintetraessigsäure<br />
(H4EDTA), die in der besser löslichen Form des Dinatriumsalzes<br />
(H2Na2EDTA) eingesetzt wird. Dieser Komplexligand<br />
bildet mit Metallionen beliebiger Wertigkeit (z > 1) sechsfach<br />
koordinierte 1:1-Komplexe mit fünfgliedrigen Chelatringen.<br />
Die Komplexe sind wasserlöslich und nicht oder nur wenig<br />
farbig. Dabei ist das Metallkation oktaedrisch von vier Sauerstoffatomen<br />
und zwei Stickstoffatomen umgeben.<br />
Struktur des [M(EDTA)] (4-n)- -Komplexes<br />
mit einem M n+ -Zentralion<br />
Seite 10
Das Komplexon H2Na2EDTA ist auch geeignet, Metallkationen zu binden, die weniger zur Komplexbildung<br />
neigen, wie z.B. Mg 2+ oder Ca 2+ . Aus diesem Grund eignet es sich besonders gut zur Härtebestimmung von<br />
Wasser. Titrimetrische Bestimmungen der Gesamthärte und der Calcium-/Magnesiumhärte von Leitungswasser<br />
werden in den folgenden Experimenten durchgeführt.<br />
Die Endpunktbestimmung solcher Titrationen erfolgt ebenfalls mit Komplexbildnern, deren Komplexe mit den<br />
Metall-Ionen aber weniger stabil sein müssen als EDTA-Komplexe. Zu Beginn der Titration reagiert der Indikator<br />
mit der äquivalenten Menge Metall-Ionen unter Bildung des Metall-Indikator-Komplexes, der die Farbe<br />
der Lösung bestimmt. Das Komplexon setzt sich zunächst mit den freien Metall-Ionen um und entzieht gegen<br />
Ende der Titration auch dem schwächeren Indikatorkomplex das Metall. Der Umschlagspunkt wird durch<br />
die Farbe des freien Indikators bestimmt.<br />
Ein geeigneter Indikator für die Härtebestimmung von Wasser ist die<br />
dreiwertige Säure Eriochromschwarz T, die mit Mg 2+ -Ionen farbige<br />
Komplexe bildet und den Endpunkt einer Mg 2+ -Titration durch einen<br />
Farbumschlag von rotviolett nach blau anzeigt. Zur Erhöhung des<br />
optischen Kontrasts wird gerne noch etwas Methylorange beigemischt,<br />
so dass der Farbumschlag von rot nach grün erfolgt. Da Ca 2+<br />
mit EDTA stabilere Komplexe bildet als Mg 2+ , erfolgt der Farbumschlag<br />
des Eriochromschwarz T erst dann, wenn neben Mg 2+ auch<br />
alle Ca 2+ -Ionen von EDTA erfasst sind. Man bestimmt dadurch die<br />
sog. Gesamthärte des Wassers. Für die selektive Titration von Ca 2+ -<br />
Ionen mit EDTA verwendet man Murexid als Farbindikator, der in<br />
Gegenwart von Ca 2+ von blauviolett nach rot umschlägt. Aus der Eriochromschwarz T, ein drei-<br />
Differenz von Ca-Härte und Gesamthärte kann man dann die zähniger Ligand für Mg 2+<br />
Mg-Konzentration bestimmen.<br />
Chemikalien. Leitungswasser, Ammoniaklösung (25 %ig), Natriumetylendiamintetraacetatlösung (c =<br />
0,01 mol/L) , Ca/Mg-Mischindikator (Eriochromschwarz T : Methylorange : Natriumchlorid im Masseverhältnis<br />
0,1 g : 0,04 g : 10 g), Ca-Mischindikator (Murexid : Natriumchlorid im Masseverhältnis 0,1 g : 10 g).<br />
Durchführung. (a) Ca/Mg-Gesamthärte: Mit einer Vollpipette werden 100 mL des zu untersuchenden Leitungswassers<br />
in einen Erlenmeyerkolben gegeben, mit einigen Tropfen konz. Ammoniaklösung versetzt und<br />
ein wenig Ca/Mg-Mischindikator (Eriochriomschwarz T) hinzugefügt, bis sich die Lösung deutlich rot färbt.<br />
Die Lösung wird dann mit der 0,01 M Na2H2EDTA-Lösung von rot über grau nach grün titriert.<br />
(b) Ca-Härte: Mit einer Vollpipette werden 100 mL des zu untersuchenden Leitungswassers in einen Erlenmeyerkolben<br />
gegeben, mit einigen Tropfen konz. Ammoniaklösung versetzt und ein wenig Ca-Mischindikator<br />
(Murexid) hinzugefügt, bis sich die Lösung deutlich rot färbt. Die Lösung wird dann mit der 0,01 M Na2H2ED-<br />
TA-Lösung von rot nach blauviolett titriert.<br />
→ Bestimmen Sie die Konzentrationen an Calcium- und Magnesiumionen in einer Probe Leitungswasser.<br />
5.9. Qualitative Analyse mittels Komplexbildung<br />
Charakteristische Farbreaktionen und die Bildung schwer löslicher Niederschläge, die mit der Komplexbildung<br />
verbunden sind, spielen in der qualitativen Analytik für Metallionen eine wichtige Rolle. Einige ausgewählte<br />
Nachweisreaktionen sind hier aufgeführt.<br />
Chemikalien. Eisen(II)-, Eisen(III)-, Nickel(II)-, Aluminium- und Kupfer(II)salzlösungen (verdünnt), Kaliumhexacyanoferrat(II)-Lösung<br />
(c = 1 mol/L), Ammoniumthiocyanatlösung (c = 1 mol/L), Essigsäure (c = 1 mol/L),<br />
Dinatriumbis(dimethylglyoximat)lösung (0,1 mol/L), Natriumalizarinsulfonatlösung (c = 0,1 mol/L).<br />
Duchführung. (a) Nachweis von Eisen(II)- und Eisen(III)-Ionen. Zu einer Eisen(II)- und zu einer Eisen(III)salzlösung<br />
wird tropfenweise Kaliumhexacyanoferrat(II)-Lösung gegeben. In beiden Fällen wird ein tiefblauer<br />
Niederschlag gebildet. In der Eisen(II)salzlösung verläuft die Reaktion zunächst über die Bildung eines weißlichen<br />
bis hellblauen Niederschlages. In der Eisen(III)salzlösung tritt die tiefblaue Farbe sofort auf. Zur sicheren<br />
Unterscheidung von Eisen(II)- und Eisen(III)-Ionen können die Lösungen mit Thiocyanat-Ionen versetzt<br />
Seite 11
werden. Mit Eisen(III)-Ionen bildet sich eine blutrote Lösung, während die Analysenlösung mit Eisen(II)-Ionen<br />
keine Reaktion zeigt.<br />
(b) Nachweis von Kupfer(II)-Ionen. Mit Kaliumhexacyanoferrat(II)-Lösung bilden Kupfer(II)-Ionen einen<br />
braunen Niederschlag, der sich durch Zugabe von Ammoniaklösung unter Bildung einer blauen Färbung löst.<br />
(c) Nachweis von Nickel(II)-Ionen. Der spezifische Ni 2+ -Nachweis erfolgt<br />
mit der organischen Verbindung Dimethylglyoxim. Eine Lösung<br />
des Natriumsalzes bildet in ammoniakalischer Lösung mit Nickel(II)-Ionen<br />
einen himbeerroten schwerlöslichen Komplex.<br />
Planar-quadratische Struktur des<br />
Bis(dimethylglyoximato)-nickel(II)<br />
(d) Nachweis von Aluminium-Ionen. Aluminium-Ionen<br />
bilden mit dem Farbstoff Alizarin S einen roten Farblack.<br />
Dazu wird die Analysenlösung zunächst mit drei Tropfen<br />
der Reagenzlösung versetzt und tropfenweise verdünnte<br />
Essigsäure bis zum Verschwinden der Eigenfarbe hinzugegeben.<br />
Eine weitere Zugabe von Essigsäure führt zur<br />
Bildung der Rotfärbung oder des roten Niederschlages,<br />
der oft erst nach kurzer Wartezeit auftritt.<br />
Oktaedrische Struktur des Farblacks,<br />
den Al 3+ mit Alizarin S bildet.<br />
→ Formulieren Sie jeweils die Bildungsreaktionen und benennen Sie entstehenden Komplexe.<br />
Seite 12