Leitfähigkeit schwacher Elektrolyte - Institut für Physikalische ...
Leitfähigkeit schwacher Elektrolyte - Institut für Physikalische ...
Leitfähigkeit schwacher Elektrolyte - Institut für Physikalische ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
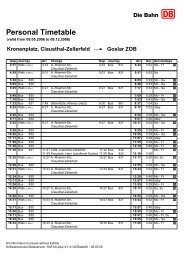
TU Clausthal Stand 10/01/2007<br />
<strong>Institut</strong> <strong>für</strong> <strong>Physikalische</strong> Chemie<br />
Grundpraktikum 13. LEITFÄHIGKEIT SCHWACHER ELEKTROLYTE<br />
LEITFÄHIGKEIT SCHWACHER<br />
ELEKTROLYTE<br />
1. Versuchsplatz<br />
Komponenten:<br />
- Thermostat<br />
- <strong>Leitfähigkeit</strong>smessgerät<br />
- Elektrode<br />
- Thermometer<br />
2. Allgemeines zum Versuch<br />
Der Widerstand R eines Leiters ist<br />
proportional seiner Länge l und umgekehrt<br />
proportional seinem Querschnitt q.<br />
l<br />
R = ρ<br />
(1)<br />
q<br />
Den Faktor ρ bezeichnet man als spezifischen Widerstand, seinen Kehrwert χ als spezifische<br />
<strong>Leitfähigkeit</strong>. Die <strong>Leitfähigkeit</strong> von Elektrolytlösungen hängt bei konstanter Temperatur und<br />
konstantem Druck von der Konzentration des <strong>Elektrolyte</strong>n, dem Dissoziationsgrad und der<br />
Geschwindigkeit der vorhandenen Ionen ab.<br />
Die Konzentration des <strong>Elektrolyte</strong>n ist aus der Einwaage bekannt und wird in Mol pro Liter<br />
angegeben.<br />
Bei vollständiger Dissoziation zerfällt der Elektrolyt in ν+ Kationen und ν– Anionen. Die Indizes<br />
beziehen sich auf das Vorzeichen der Ionenladung. Bei unvollständiger Dissoziation<br />
(„<strong>schwacher</strong>“ Elektrolyt) muss man ν+ und ν– noch mit dem Dissoziationsgrad α multiplizieren.<br />
Unter dem Einfluss eines elektrischen Feldes wandern die Ionen zu den Elektroden, d. h. es fließt<br />
ein Strom. Die Stromdichte, (der Strom pro Fläche) ist gegeben durch die Beziehung :<br />
I<br />
= = ( NA<br />
υ+<br />
c z+<br />
e v+<br />
+ N υ−<br />
c z−<br />
e v−)<br />
(2)<br />
A<br />
i A<br />
1
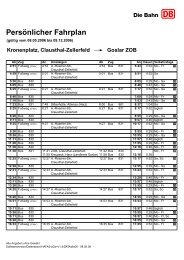
TU Clausthal Stand 10/01/2007<br />
<strong>Institut</strong> <strong>für</strong> <strong>Physikalische</strong> Chemie<br />
Grundpraktikum 13. LEITFÄHIGKEIT SCHWACHER ELEKTROLYTE<br />
Es bedeuten:<br />
A : Querschnittsfläche<br />
NA : Avogadrozahl<br />
c : Konzentration in mol·cm -3<br />
υ± : Geschwindigkeiten der negativen bzw. positiven Ionen<br />
e : Elementarladung<br />
z± : Ladungszahl der positiven bzw. negativen Ionen<br />
ν± : stöchiometrische Koeffizienten<br />
Die Ladung e · z± ist also ein ganzzahliges Vielfaches der elektrischen Elementarladung. Die<br />
Avogadrozahl ist in Gl. (2) enthalten, weil sie die in einem Mol enthaltende Zahl von Atomen<br />
angibt.<br />
Die Flüssigkeit ist natürlich ungeladen, so dass gelten muss:<br />
v (3)<br />
+ z + = v−<br />
z−<br />
Diese Beziehung bezeichnet man als Elektroneutralitätsbedingung.<br />
Den Quotienten von Ionengeschwindigkeit und Feldstärke<br />
bezeichnet man als Ionenbeweglichkeit.<br />
υ±<br />
= u<br />
E<br />
Man erhält also <strong>für</strong> die spezifische <strong>Leitfähigkeit</strong><br />
±<br />
I<br />
χ = = N A e c ( v+<br />
z+<br />
u+<br />
+ v−<br />
z −u<br />
−)<br />
(5)<br />
E ⋅ q<br />
Die Größe NA · e = F (entspricht dem Betrag der Ladung von 1 Mol Elektronen) bezeichnet man<br />
als Faradaykonstante. Betrachtet man außerdem einen unvollständig dissozierten <strong>Elektrolyte</strong>n,<br />
so erhält man:<br />
Man erhält also <strong>für</strong> die molare <strong>Leitfähigkeit</strong><br />
χ = F ⋅ α ⋅ c ⋅ ( ν + z+<br />
u+<br />
+ ν −z<br />
−u<br />
− )<br />
(6)<br />
χ<br />
Λ = = α ⋅ F ( ν + z+<br />
u+<br />
+ ν − z−u<br />
c<br />
2<br />
−<br />
)<br />
(4)<br />
(7)
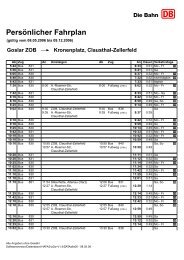
TU Clausthal Stand 10/01/2007<br />
<strong>Institut</strong> <strong>für</strong> <strong>Physikalische</strong> Chemie<br />
Grundpraktikum 13. LEITFÄHIGKEIT SCHWACHER ELEKTROLYTE<br />
Früher wurde auch häufig die sog. Äquivalentfähigkeit verwendet, bei der die spez.<br />
<strong>Leitfähigkeit</strong> nicht auf die Stoffmengenkonzentration, sondern auf die Zahl der „Äquivalente“<br />
pro Volumeneinheit ν · c, bezogen wurde:<br />
Hierbei ist v = v+<br />
z+<br />
= v−<br />
z−<br />
.<br />
' ( + −)<br />
+ ⋅ α =<br />
χ<br />
Λ = F u u<br />
v ⋅ c<br />
Achtung:<br />
−1<br />
−1<br />
Ω ⋅ cm<br />
Λ (und Λ') hat üblicherweise die Einheit −3<br />
mol ⋅cm<br />
3<br />
cm<br />
=<br />
mol<br />
2 1 Ω ⋅<br />
−<br />
S ⋅ cm<br />
=<br />
mol<br />
Die Konzentration wird jedoch oft in mol · L -1 angegeben, daher hat man häufig den<br />
Umrechnungsfaktor 10 3 (1 mol · L –1 =ˆ 10 3 mol · cm –3 ) zu berücksichtigen.<br />
Die Größe F · u · |z| ≡ λ bezeichnet man als molare Ionenleitfähigkeit.<br />
Wir erhalten aus (7):<br />
2<br />
(8)<br />
Λ = α ( ν + λ+<br />
+ ν − λ−<br />
)<br />
(9)<br />
Für c → 0 geht α → 1 und man erhält das Kohlrauschsche Gesetz der unabhängigen<br />
Ionenwanderung:<br />
Λ = ν λ + ν λ<br />
(10)<br />
0<br />
0<br />
0 + + − −<br />
Es besagt, dass sich die <strong>Leitfähigkeit</strong> bei unendlicher Verdünnung additiv aus den<br />
<strong>Leitfähigkeit</strong>en der Ionen zusammensetzt.<br />
Bei hoher Konzentration ist dieses Gesetz aus verschiedenen Gründen nicht mehr gültig.<br />
Zunächst muss bei schwachen <strong>Elektrolyte</strong>n der Dissoziationsgrad berücksichtigt werden<br />
(Ostwaldsches Verdünnungsgesetz). Auch bei starken <strong>Elektrolyte</strong>n ist die molare <strong>Leitfähigkeit</strong><br />
konzentrationsabhängig, weil die Ionen stark miteinander wechselwirken. Ohne ins Detail zu<br />
gehen, geben wir das Kohlrauschsche Quadratwurzelgesetz an:<br />
k ist hier eine empirische Konstante<br />
Λ = Λ 0<br />
Gleichung (10) ist ein typisches Grenzgesetz. Deshalb sind auch nur die Größen<br />
die einzelnen Ionen charakteristisch, nicht jedoch λ + und λ − .<br />
Dividiert man Gleichung (9) und (10) durcheinander, so erhält man:<br />
− k<br />
c<br />
0<br />
λ + und<br />
0<br />
λ − <strong>für</strong>
TU Clausthal Stand 10/01/2007<br />
<strong>Institut</strong> <strong>für</strong> <strong>Physikalische</strong> Chemie<br />
Grundpraktikum 13. LEITFÄHIGKEIT SCHWACHER ELEKTROLYTE<br />
Λ<br />
α =<br />
(11)<br />
Λ<br />
0<br />
Diese Gleichung gibt also die Möglichkeit, den Dissoziationsgrad aus <strong>Leitfähigkeit</strong>smessungen<br />
zu bestimmen. Man muss sich jedoch klar sein, dass Gleichung (11) nur eine Näherung ist, da<br />
bei endlicher Konzentration die <strong>Leitfähigkeit</strong> auch noch von anderen konzentrationsabhängigen<br />
Faktoren als dem Dissoziationsgrad beeinflusst wird (Kohlrauschsches Quadratwurzelgesetz).<br />
Betrachten wir nun einen binären <strong>Elektrolyte</strong>n<br />
AB → ← A + + B –<br />
so ist die Konzentration c(AB) = (1 – α) c0, die Konzentrationen von A + und B – sind gleich<br />
α · c0.<br />
Eingesetzt in die Formel des Massenwirkungsgesetzes ergibt sich daraus das Ostwaldsche<br />
Verdünnungsgesetz:<br />
Mit (11) ergibt sich<br />
K c<br />
2<br />
a ⋅ c<br />
=<br />
1 − a<br />
4<br />
0<br />
(12)<br />
2<br />
Λ ⋅ c0<br />
Kc =<br />
(13)<br />
2 ⎛ Λ ⎞<br />
Λ0<br />
⎜<br />
⎜1<br />
−<br />
⎟<br />
⎝ Λ0<br />
⎠<br />
Gleichung (13) bildet also eine Möglichkeit, das Massenwirkungsgesetz mit Hilfe von<br />
<strong>Leitfähigkeit</strong>smessung zu prüfen. Diese Formel gilt jedoch nur <strong>für</strong> stark verdünnte Lösungen<br />
<strong>schwacher</strong> <strong>Elektrolyte</strong>, da <strong>für</strong> stärker konzentrierte Lösungen andere Konzentrationsabhängigkeiten<br />
mit ins Spiel kommen. Formt man Gleichung (13) um, so ergibt sich:<br />
3. Orientieren Sie sich über<br />
1<br />
Λ<br />
=<br />
K<br />
Λ c<br />
⋅<br />
⋅<br />
c<br />
Λ<br />
0<br />
2<br />
0<br />
1<br />
+<br />
Λ<br />
− Eigenschaften von Elektrolytlösungen<br />
− Massenwirkungsgesetz<br />
− Messmethoden <strong>für</strong> den elektrischen Widerstand<br />
0<br />
(14)
TU Clausthal Stand 10/01/2007<br />
<strong>Institut</strong> <strong>für</strong> <strong>Physikalische</strong> Chemie<br />
Grundpraktikum 13. LEITFÄHIGKEIT SCHWACHER ELEKTROLYTE<br />
4. Literatur<br />
Wedler G. „Lehrbuch der <strong>Physikalische</strong>n Chemie“, 3. Aufl.<br />
Kap. 1.6 Einführung in die Elektrochemie<br />
Moore/Hummel „<strong>Physikalische</strong> Chemie“, 4. Aufl.<br />
Kap. 10 Elektrochemie I<br />
Kortüm G. „Lehrbuch der Elektrochemie“, 5. Aufl.<br />
Kap. 1 Definitionen und Grundlagen<br />
Kap. 6 Schwache und starke <strong>Elektrolyte</strong><br />
Kap. 9 Ergebnisse und Anwendungsmöglichkeiten<br />
Jost/Troe „Kurzes Lehrbuch der <strong>Physikalische</strong>n Chemie“, Aufl. 18<br />
Kap. 3 Elektrochemie<br />
D. A. Mac Innes “The Principles of Electrochemistry”<br />
E. G. Jäger, K. Schöre, Elektrolytgleichgewichte und Elektrochemie<br />
5. Aufgabe<br />
Messen Sie die <strong>Leitfähigkeit</strong> der Säure (Essigsäure oder Propionsäure) in den angegebenen<br />
Konzentrationen. Berechnen Sie die spezifischen <strong>Leitfähigkeit</strong>en bzw. nach (8) die molaren<br />
<strong>Leitfähigkeit</strong>en. Bestimmen Sie 0 Λ und die Dissoziationskonstante K c .<br />
Berechnen Sie nach (11) die Dissoziationsgrade <strong>für</strong> die einzelnen Verdünnungen und prüfen Sie<br />
das Ostwaldsche Verdünnungsgesetz.<br />
6. Versuchsdurchführung<br />
Kalibrieren Sie zunächst die Apparatur mit Hilfe einer 0,01 mol/L KCl - Lösung<br />
(χ = 1409 µS · cm –1 bei 25°C).<br />
Stellen Sie anschließend aus der bereitgestellten 1 mol/L Säure 200 ml 0,1 mol/L - Lösung her,<br />
mit der Sie Ihre Messreihe beginnen und verdünnen Sie diese dann weiter in folgenden<br />
Verhältnissen: 1/2, 1/4, 1/8, 1/16, 1/32, 1/64, 1/128 und bestimmen Sie deren <strong>Leitfähigkeit</strong>en.<br />
Bei jeder <strong>Leitfähigkeit</strong>smessung ist auf konstante Temperatur (25°C) zu achten, da z. B. <strong>für</strong><br />
Kochsalz die empirische Beziehung<br />
χT = χT 0 [1 + 0,022 (T – T0) ]<br />
5
TU Clausthal Stand 10/01/2007<br />
<strong>Institut</strong> <strong>für</strong> <strong>Physikalische</strong> Chemie<br />
Grundpraktikum 13. LEITFÄHIGKEIT SCHWACHER ELEKTROLYTE<br />
gilt, die auf den relativ großen Temperaturkoeffizienten der Viskosität der Lösung zurückzuführen<br />
ist (T0: internationale Referenztemperatur 25°C).<br />
Schließlich ist noch die <strong>Leitfähigkeit</strong> des verwendeten Wassers zu ermitteln und ggf. von den<br />
gefundenen <strong>Leitfähigkeit</strong>en der Messreihe abzuziehen („Blindversuch“).<br />
7. Auswertung<br />
Tragen Sie Λ –1 gegen Λ · c0 auf (Gleichung(14)). Bestimmen Sie mittels Regressionsrechnung<br />
- den Ordinatenabschnitt<br />
1<br />
- die Steigung 2<br />
K ⋅ Λ<br />
c<br />
0<br />
Λ<br />
−1<br />
0<br />
und berechnen Sie daraus die gesuchten Größen.<br />
Diskutieren Sie die erhaltene Regressionsgerade unter Berücksichtigung des Korrelationskoeffizienten.<br />
Berechnen Sie diesen mit der Formel aus dem Beiblatt zur Fehler- und<br />
Ausgleichsrechnung.<br />
Tragen Sie die ermittelten Dissoziationsgrade gegen die Konzentrationen auf und erklären Sie<br />
den Kurvenverlauf.<br />
Ermitteln Sie die Standardabweichung der nach dem Ostwaldschen Verdünnungsgesetz<br />
berechneten Gleichgewichtskonstanten kc.<br />
8. R/S Sätze der verwendeten Chemikalien<br />
Essigsäure:<br />
R: 34 Verursacht Verätzungen<br />
S: 23.2 Dampf nicht einatmen<br />
26 Bei Berührung mit den Augen sofort gründlich mit Wasser abspülen und Arzt<br />
konsultieren<br />
45 Bei Unfall oder Unwohlsein sofort Arzt zuziehen (wenn möglich, dieses Etikett<br />
vorzeigen)<br />
Propionsäure :<br />
R: 34 Verursacht Verätzungen<br />
S: 23.2 Dampf nicht einatmen<br />
36 Bei der Arbeit geeignete Schutzkleidung tragen<br />
45 Bei Unfall oder Unwohlsein sofort Arzt zuziehen (wenn möglich, dieses Etikett<br />
vorzeigen)<br />
6