Reak1_V11_Reale Reaktoren Festbett - TCI @ Uni-Hannover.de ...
Reak1_V11_Reale Reaktoren Festbett - TCI @ Uni-Hannover.de ...
Reak1_V11_Reale Reaktoren Festbett - TCI @ Uni-Hannover.de ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
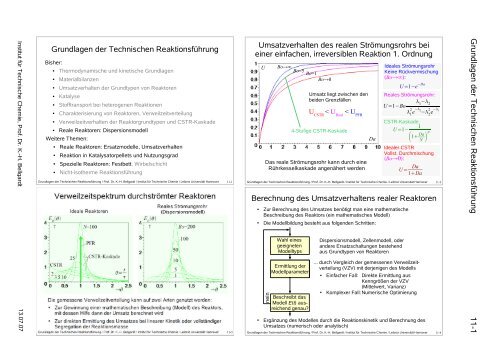
Institut für Technische Chemie, Prof. Dr. K.-H. BellgardtGrundlagen <strong>de</strong>r Technischen ReaktionsführungBisher:●●●●●●●●●●●●Thermodynamische und kinetische GrundlagenMaterialbilanzenUmsatzverhalten <strong>de</strong>r Grundtypen von <strong>Reaktoren</strong>KatalyseStofftransport bei heterogenen ReaktionenCharakterisierung von <strong>Reaktoren</strong>, VerweilzeitverteilungVerweilzeitverhalten <strong>de</strong>r Reaktorgrundtypen und CSTR-Kaska<strong>de</strong><strong>Reale</strong> <strong>Reaktoren</strong>: Dispersionsmo<strong>de</strong>llWeitere Themen:<strong>Reale</strong> <strong>Reaktoren</strong>: Ersatzmo<strong>de</strong>lle, UmsatzverhaltenReaktion in Katalysatorpellets und NutzungsgradSpezielle <strong>Reaktoren</strong>: <strong>Festbett</strong>, WirbelschichtNicht-isotherme ReaktionsführungGrundlagen <strong>de</strong>r Technischen Reaktionsführung / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / Leibniz <strong>Uni</strong>versität <strong>Hannover</strong> 11-1Umsatzverhalten <strong>de</strong>s realen Strömungsrohrs beieiner einfachen, irreversiblen Reaktion 1. OrdnungUBo→∞Bo=5Bo=1Bo→0Umsatz liegt zwischen <strong>de</strong>nbei<strong>de</strong>n GrenzfällenU CSTR< U Real< U PFR4-Stufige CSTR-Kaska<strong>de</strong>Das reale Strömungsrohr kann durch eineRührkesselkaska<strong>de</strong> angenähert wer<strong>de</strong>nGrundlagen <strong>de</strong>r Technischen Reaktionsführung / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / Leibniz <strong>Uni</strong>versität <strong>Hannover</strong> 11-2DaI<strong>de</strong>ales StrömungsrohrKeine Rückvermischung(Bo→∞):U=1−e −Da<strong>Reale</strong>s Strömungsrohr: 1− 2U=1−Bo 2 1e − 2− 2 2e − 1CSTR-Kaska<strong>de</strong>:1U=1−Da1N NI<strong>de</strong>aler CSTRVollst. Durchmischung(Bo→0):U= Da1DaBerechnung <strong>de</strong>s Umsatzverhaltens realer <strong>Reaktoren</strong>●●Zur Berechnung <strong>de</strong>s Umsatzes benötigt man eine mathematischeBeschreibung <strong>de</strong>s Reaktors (ein mathematisches Mo<strong>de</strong>ll)Die Mo<strong>de</strong>llbildung besteht aus folgen<strong>de</strong>n Schritten:Grundlagen <strong>de</strong>r Technischen ReaktionsführungWahl einesgeeignetenMo<strong>de</strong>lltypsDispersionsmo<strong>de</strong>ll, Zellenmo<strong>de</strong>ll, o<strong>de</strong>ran<strong>de</strong>re Ersatzschaltungen bestehendaus Grundtypen von <strong>Reaktoren</strong>13.07.07●neinErmittlung <strong>de</strong>rMo<strong>de</strong>llparameterBeschreibt dasMo<strong>de</strong>ll E(t) ausreichendgenau?... durch Vergleich <strong>de</strong>r gemessenen Verweilzeitverteilung(VZV) mit <strong>de</strong>rjenigen <strong>de</strong>s Mo<strong>de</strong>lls●●Einfacher Fall: Direkte Ermittlung ausKenngrößen <strong>de</strong>r VZV(Mittelwert, Varianz)Komplexer Fall: Numerische OptimierungErgänzung <strong>de</strong>s Mo<strong>de</strong>lles durch die Reaktionskinetik und Berechnung <strong>de</strong>sUmsatzes (numerisch o<strong>de</strong>r analytisch)Grundlagen <strong>de</strong>r Technischen Reaktionsführung / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / Leibniz <strong>Uni</strong>versität <strong>Hannover</strong> 11-411-1
Institut für Technische Chemie, Prof. Dr. K.-H. Bellgardt13.07.07Einfache Reaktorersatzschaltungen<strong>Reale</strong>s StrömungsrohrLaminares StrömungsrohrE(t)E(t)Grundlagen <strong>de</strong>r Technischen Reaktionsführung / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / Leibniz <strong>Uni</strong>versität <strong>Hannover</strong> 11-5●●ttZellenmo<strong>de</strong>llCSTRPFRCSTRDispersionsmo<strong>de</strong>llPFR + CSTRErmittlung <strong>de</strong>s Parameters D ax beimDispersionsmo<strong>de</strong>llBesser durch Verweilzeitexperiment ermittelnFür genügend schmale E(t)(Bo>50) kann diese durch dieGauß-Funktion angenähert wer<strong>de</strong>n: ↑ E(θ)E≈ BoBo4 1−2⋅e−4Aus <strong>de</strong>r gemessenen Halbwertsbreite ½≈2.5CSTRDer axialen Dispersionskoeffizient ist nicht genau voraus berechenbar!Grobe Näherung bei turbulenter Strömung (Re>2000):1= 3⋅107 1,35Pe2,1x Re ReBo= L 1/8D ax= Lud Pe xBoerhält man dann über die Varianz 2 ≈ 2 Bo<strong>de</strong>n axialen DispersionskoeffizientenBo=400CSTR= t → θGrundlagen <strong>de</strong>r Technischen Reaktionsführung / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / Leibniz <strong>Uni</strong>versität <strong>Hannover</strong> 11-7E max½E max50∆θ½200100KurzschlussTotzoneEinfache ReaktorersatzschaltungenE(t)E(t)OhneTotzoneGrundlagen <strong>de</strong>r Technischen Reaktionsführung / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / Leibniz <strong>Uni</strong>versität <strong>Hannover</strong> 11-6ttParallelschaltungRückführungErmittlung <strong>de</strong>r Stufenzahl beim Zellenmo<strong>de</strong>llVerweilzeitspektrum <strong>de</strong>r Kaska<strong>de</strong>E N t=N N −1! Nt N−1 1Varianz <strong>de</strong>r Verteilung 2 = 1 NBei ausreichend kleiner Dispersion(Bo>50) ergeben das Zellenmo<strong>de</strong>llund das Dispersionsmo<strong>de</strong>llpraktisch äquivalente Verteilungenund es gilt dannN ≈ Bo2− Nt e Gemessenes Verweilzeitspektrum E mt Gemessene Varianz:t /Die gemessene mittlere Verweilzeit=∫ t E m tdt0sollte gleich <strong>de</strong>r hydrodynamischenVerweilzeit seinGrundlagen <strong>de</strong>r Technischen Reaktionsführung / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / Leibniz <strong>Uni</strong>versität <strong>Hannover</strong> 11-8∞∞ m 2 =∫0t− 2 E m t dtGrundlagen <strong>de</strong>r Technischen Reaktionsführung11-2
Institut für Technische Chemie, Prof. Dr. K.-H. Bellgardt13.07.07∂c S∂ tVerweilzeitverteilung und Umsatz beiReaktionen mit Kinetik 1. OrdnungBeispiel: <strong>Reale</strong>s StrömungsrohrStoffbilanz <strong>de</strong>s Eduktes: (einfache, irreversible Reaktion)∂c 1= −u ∂c 1∂t ∂z D ∂ 2 c 1ax∂z 2 −k c 1Spurstoffbilanz: (keine Reaktion!)e −kt ∂c S∂t= −u ∂c S∂ z D ∂ 2 c Sax∂z 2= −u⋅e −k t ∂c S∂z D ax e−k t ∂2 c S∂ z 2∂C∂t k C = −u ∂C∂ z∂C∂t∂ 2 C D ax∂ z 2=−u ∂C∂ z D ∂ 2 Cax∂ z −k C 2∣⋅e −k tc i (t,z) V RGrundlagen <strong>de</strong>r Technischen Reaktionsführung / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / Leibniz <strong>Uni</strong>versität <strong>Hannover</strong> 11-10c i0Substitution: C t , z =e −k t c St , z∂C ∂c∂ z =e−k t S∂ z∂ 2 C∂ z 2 =e−k t ∂2 c S∂ z 2c S0 (t)uzz=Lc iE∂C∂t =e−k t ∂c S∂t −k e−k t c Se −k t ∂c S∂t = ∂C∂ t k Cc SE (t)Wenn c Seine (gemessene) Lösung <strong>de</strong>r Spurstoffbilanzist, dann ist C eine Lösung <strong>de</strong>r Stoffbilanz!Verweilzeitverteilung und Umsatz beiReaktionen mit Kinetik 1. OrdnungKonzentration am Reaktorausgang:c E ∞1 =∫ c kin 1 t E t dt0Umsatz:U = 1 − c E10c 1U = 1 −∫0∞U =∫0∞U =∫0E t dt−∫0c1− kin 1 t 0c 1∞c kin 1 t E tdtc 10∞c kin 1 t E t dtc 10 E tdt∞U =∫ U kin t E t dt0∣ ∫ ∞E t dt=10Grundlagen <strong>de</strong>r Technischen Reaktionsführung / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / Leibniz <strong>Uni</strong>versität <strong>Hannover</strong> 11-14c 10<strong>Reale</strong>r Reaktormit Reaktion1. Ordnungc 1EVerweilzeitspektrum E(t)SatzreaktorU kinist <strong>de</strong>r aus <strong>de</strong>r Kinetik imSatzreaktor ermittelte UmsatzUmsatz U kin (t)kinKinetik c 1(t)Verweilzeitverteilung und Umsatz beiReaktionen mit Kinetik 1. OrdnungStoffbilanz <strong>de</strong>s Eduktes:Lösung:∂c 1c S0 (t) u ˙V= −u ∂ c 1∂t ∂z D ∂ 2 c 1axc SE (t)∂ z 2 −k c c1 1t , z =e −k t c St , z Spurstoffbilanz: (keine Reaktion!)c i (t,z) V R∂c S= −u ∂c S∂ t ∂ z D ∂ 2 Ec 0cSc ic iax∂z 2 S t , z z z=L0c SE(t)Experiment: Spurstoffpuls c S t , L=E tδ(t)Eduktpulsc 1t , L=e −k t E t∫ dt 0 t 0 tExperiment: Einschalten <strong>de</strong>s Eduktstromes0tc 1c 1E(t)c 0 1t=c 0 1ht c 1 t , L=∫ c 0 1 e −k t E tdt h(t)Stationärer ZustandKonzentration am Reaktorausgang:∞c E 1 =∫0∞c 1 E =∫0c 1 0 e −k t E tdt0 tGrundlagen <strong>de</strong>r Technischen Reaktionsführung / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / Leibniz <strong>Uni</strong>versität <strong>Hannover</strong> 11-13●●●Bisher:0c 1 kin t E t dtMikrofluid und Makrofluid0Kinetik <strong>de</strong>r Reaktionc 1 kin t =c 1 0 e −k t– Die Reaktionsmasse ist an je<strong>de</strong>m Ort im Reaktor bis in <strong>de</strong>nmolekularen Bereich durchmischt●●Nie<strong>de</strong>rviskose Flüssigkeiten, GaseMikrofluid, nicht segregiertes SystemGegenteiliges Extrem:aus Satzrührkessel– Die Reaktionsmasse besteht aus kleinen Volumenelementen, dieihre I<strong>de</strong>ntität behalten und sich nicht vermischen●●●Heterogene Systeme: Suspensionen, EmulsionenInhomogenitäten bis in <strong>de</strong>n mikroskopischen BereichMakrofluid, vollständige SegregationPartielle Segregation:– Heterogene Systeme mit teilweiser Vermischung zwischen <strong>de</strong>nVolumentelementen– Homogene, hochviskose SystemeGrundlagen <strong>de</strong>r Technischen Reaktionsführung / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / Leibniz <strong>Uni</strong>versität <strong>Hannover</strong> 11-15tGrundlagen <strong>de</strong>r Technischen Reaktionsführung11-3
Institut für Technische Chemie, Prof. Dr. K.-H. Bellgardt13.07.07●●PFR:Umsatz bei vollständiger Segregation– Pfropfenströmung, Keine Durchmischung– Umsatz unabhängig vomSegregationsgradCSTR und reale <strong>Reaktoren</strong>:– Je<strong>de</strong>s Volumenelement verhält sich wieein Satzreaktor mit individuellerVerweilzeit t– Das Verweilzeitspektrum repräsentiertdie Häufigkeit, mit <strong>de</strong>r Volumenelementemit einer bestimmten Verweilzeit t amAusgang erscheinen– Die Konzentration <strong>de</strong>s Eduktes in je<strong>de</strong>mdieser Volumenelement ist durch dieReaktionskinetik gegeben– Konzentration am Reaktorausgang(gemittelt über alle Verweilzeiten t):Grundlagen <strong>de</strong>r Technischen Reaktionsführung / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / Leibniz <strong>Uni</strong>versität <strong>Hannover</strong> 11-16c 10Volumentelement<strong>de</strong>s MakrofluidsVerweilzeitspektrum E(t)c 1Ec 1kin(t) ermittelt im Satzprozessc E ∞1 =∫ c kin 1 t E t dt0Relative Häufigkeit <strong>de</strong>r Volumenelemente mit Verweilzeit tZusammenfassung: Umsatz und Verweilzeitverteilung●●●Mikrofluid– Bei einer Reaktion mit Kinetik 1. Ordnung (linear!) kann<strong>de</strong>r Umsatz bei Kenntnis <strong>de</strong>r Verweilzeitverteilungberechnet wer<strong>de</strong>n– Bei einer Reaktion mit nicht-linearer Kinetik ist <strong>de</strong>r Umsatznicht ein<strong>de</strong>utig durch die Verweilzeitverteilung bestimmt,son<strong>de</strong>rn auch durch <strong>de</strong>n Zeitpunkt <strong>de</strong>r DurchmischungGenaues Reaktormo<strong>de</strong>ll erfor<strong>de</strong>rlichFall 1PFRCSTRE 1(t) = E 2(t)U 1≠ U 2CSTRGrundlagen <strong>de</strong>r Technischen Reaktionsführung / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / Leibniz <strong>Uni</strong>versität <strong>Hannover</strong> 11-18PFRFall 2Makrofluid (vollständiger Segregation)– Der Umsatz kann bei Kenntnis <strong>de</strong>r Verweilzeitverteilung beibeliebiger Reaktion berechnet wer<strong>de</strong>nPartielle Segregation <strong>de</strong>r Reaktionsmasse– Es sind zusätzlich hydrodynamische Mo<strong>de</strong>lle erfor<strong>de</strong>rlich,die eine genaue Beschreibung <strong>de</strong>r Strömungsverhältnisseund <strong>de</strong>s Stoffaustausches im Reaktor liefernUmsatz:Graphische Ermittlung <strong>de</strong>s Umsatzesaus experimentellen Daten∞U =∫ U kin t E t dt0Es gilt:E t =dF t dtdF t=E tdt1U =∫ U kin t dF t0Die Zeit kann man auch durchdie Verweilzeitsummenfunktionausdrücken:1U =∫0U kin F dFFür F(t) und U kin(t) könnendie gemessenen Kurvenbenutzt wer<strong>de</strong>n!<strong>Reale</strong>rReaktorU kin (t), F(t)Diagramm von Hofmann und SchönemannGrundlagen <strong>de</strong>r Technischen Reaktionsführung / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / Leibniz <strong>Uni</strong>versität <strong>Hannover</strong> 11-17Foto: BPEdukteGasraumProduktSchüttungReaktorUU kin1c 10U kin(F)Technische Reaktionsführung: Nicht-isotherme <strong>Reaktoren</strong> / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / <strong>Uni</strong> <strong>Hannover</strong>11FU kinc 1EUF(t)U kin(t)<strong>Reaktoren</strong> für heterogene Reaktionen:<strong>Festbett</strong>reaktorZweiphasensystem: Fluid - FestWichtiger Parameter: Schüttporosität S= V GV RVolumen V GStoffdiffusionVolumen V S=V R −V G =1− S V RReaktionVolumen V RReaktionsmasse Katalysatorpellets(Schüttung)= S V RStoffkonvektionWärmekonvektionWärmeleitungFür die Berechnung <strong>de</strong>s Reaktorsmuss die Reaktionsgeschwindigkeitim Katalysatorkorn bekannt sein!t10-19Grundlagen <strong>de</strong>r Technischen Reaktionsführung11-4
Institut für Technische Chemie, Prof. Dr. K.-H. Bellgardt13.07.07●●●●Chemische Reaktion in einem Katalysatorpellet:KatalysatornutzungsgradPhänomene:Diffusion <strong>de</strong>r Reaktan<strong>de</strong>n durch die laminareGrenzschicht (28 Diffusionskoeffizient D i)Transport innerhalb <strong>de</strong>r Pore durchPorendiffusion mit D ieff< D i(37)Adsorption und Reaktion an <strong>de</strong>rPorenoberfläche (4-6)Vermin<strong>de</strong>rung <strong>de</strong>r Eduktkonzentration und<strong>de</strong>r Reaktionsrate über <strong>de</strong>r PorenlängeDer Porennutzungsgrad bzw. Katalysatornutzungsgradcharakterisiert das Ausmaß<strong>de</strong>r Beeinflussung <strong>de</strong>r Reaktion durchTransportvorgänge:= r effVgr VGasraumMittlere Reaktionsgeschwindigkeit im KatalysatorpelletMaximale Reaktionsgeschwindigkeit ohne TransporteffekteDer Nutzungsgrad kann für einfache Geometrien undisotherme Bedingungen berechnet wer<strong>de</strong>n.FeststoffträgerDiffusionsgrenzschichtr V eff =r VgTechnische Reaktionsführung: Nicht-isotherme <strong>Reaktoren</strong> / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / <strong>Uni</strong> <strong>Hannover</strong>●●●Zusammenfassung: KatalysatornutzungsgradDer Nutzungsgrad η charakterisiert das Ausmaß <strong>de</strong>r Beeinflussung <strong>de</strong>rReaktion durch TransportvorgängeBei linearer Kinetik ist η unabhängig von c 1g– Der Nutzungsgrad kann für einfache Geometrien vorab berechnet wer<strong>de</strong>n– Für die Reaktorberechnung müssen nur die Stoffbilanzen <strong>de</strong>r flui<strong>de</strong>nPhase gelöst wer<strong>de</strong>nBei nicht-linearer Kinetik ist η eine Funktion von c 1g– Die Funktion η(c 1g) variiert über <strong>de</strong>n Ort im Reaktor und kann daher nichtvorab ermittelt wer<strong>de</strong>n!– Die Stoffbilanzen und Bilanzen <strong>de</strong>s Katalysatorpellets müssen simultangelöst wer<strong>de</strong>n (extremer Aufwand, i.A. nur numerisch möglich)Technische Reaktionsführung: Nicht-isotherme <strong>Reaktoren</strong> / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / <strong>Uni</strong> <strong>Hannover</strong>10-2010-22Isothermer <strong>Festbett</strong>reaktor: Quasi-homogenes Mo<strong>de</strong>llAusgangspunkt: Lokale Stoffbilanzgleichungen nach <strong>de</strong>m Dispersionsmo<strong>de</strong>ll∂c 1∂t = −u ∂c V1∂ 2 R u= ec z uiD∂ zax∂ z 2 1r V ˙Vu c0Strömung Leitung Reaktion c i (z,t)iu : Strömungsgeschwindigkeit in <strong>de</strong>nzZwischenräumen <strong>de</strong>r SchüttungAnnahmen: Volumenbeständige Reaktion, u= e z uThermoneutrale Reaktion mit ∆ RH ≈ 0Transport und Reaktion nur im GasraumDie Feststoffphase wird nicht explizit berücksichtigtTatsächlich: Reaktion nur in <strong>de</strong>r SchüttungKorrektur <strong>de</strong>r Stoffbilanz für die entsprechen<strong>de</strong>n Teilräume erfor<strong>de</strong>rlichMultiplikation mit <strong>de</strong>n relevanten Teilvolumina (Molenbilanz!)∂c 1∂t =− u ∂c 1∂ 2V V c D i∂zV ax∂z V 2 1r eff ∣ :V V =V −V G G G S VR S R GV G∂c 1V R∂t =−V Gu ∂ c 1V R∂ z V G∂ 2 cD iV axR ∂z V R −V G2Technische Reaktionsführung: Nicht-isotherme <strong>Reaktoren</strong> / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / <strong>Uni</strong> <strong>Hannover</strong>V R 1r Veffz=Lc iE... und weiter geht’s ...˙V10-23Grundlagen <strong>de</strong>r Technischen Reaktionsführung11-5
Institut für Technische Chemie, Prof. Dr. K.-H. BellgardtIsothermer <strong>Festbett</strong>reaktor: Aufstellen <strong>de</strong>r Stoffbilanz... hier ...V G∂c 1V R∂t =−V Gu ∂ c 1V R∂ z∂c 1 S∂t =− S u ∂c 1∂ zv∂c 1S∂t = −v ∂c 1∂ z V G∂ 2 cD iV axR ∂z V R −V G2∂ 2 c ieff SD ax∂ z 2 1− S 1rVeffD ax vd P2Technische Reaktionsführung: Nicht-isotherme <strong>Reaktoren</strong> / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / <strong>Uni</strong> <strong>Hannover</strong>V R 1r Veffv= S u Leerrohrgeschwindigkeit∂ 2 c i∂ z 2 1− S 1r Vg S= V GV RAlleseinsetzenr V eff =r VgD axnicht separat bestimmbar!D eff ax= v d P2Effektiver Dispersionskoeffizient,Korrelation aus empirischenUntersuchungen10-24Isothermer <strong>Festbett</strong>reaktor: Quasi-homogenes Mo<strong>de</strong>llStoffbilanz <strong>de</strong>r Gasphase∂c 1 S∂t = −v ∂c 1 vd P∂ 2 c ig∂ z 2 ∂ z 2 1− S 1r VStrömung Leitung ReaktionAnfangsbedingungenc 1 z ,t=0=c 1 S zWilhelmsche RandbedingungenGesucht:Links: z=0Rechts: z=Lvc 0 1=vc 1z=0,t− vd P ∂c 1z ,t ∂c2 ∂z ∣1z ,t z=0∂z ∣=0z=LeffD axUmsatzverhalten im stationären ZustandSpezialisierung: Einfache, irreversible Reaktion mit Kinetik 1. OrdnungTechnische Reaktionsführung: Nicht-isotherme <strong>Reaktoren</strong> / Prof. Dr. K.-H. Bellgardt / Institut für Technische Chemie / <strong>Uni</strong> <strong>Hannover</strong>˙Vc i0V Rvzc i (z,t) ε Sz=L˙Vc iE10-25Grundlagen <strong>de</strong>r Technischen Reaktionsführung11-613.07.07