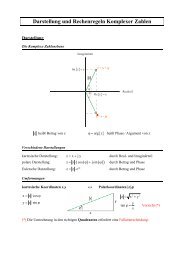
1 EE n
1 EE n
1 EE n
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Beachte:<br />
1.) Die Energieanordnung der Orbitale mit wachsendem z ist nicht streng nach<br />
Schale (n) und „Unterschale“ ( � )<br />
→ „Übergangsmetalle“ (d-Orbitale werden „nachgefüllt“)<br />
→ Lanthanoide, Actinide (f-Orbitale werden „nachgefüllt“)<br />
� 1<br />
2.) Die � -Entartung gibt es nur für ein reines Coulombpotential U( r)<br />
∼ −<br />
r<br />
+ ++ 3+<br />
( H ,He ,Li ,... )<br />
Für Mehrelektronensysteme sieht jedes e − eine Abschirmung des Kerns<br />
durch alle anderen e − .<br />
⇒ U( r) � 1<br />
bleibt kugelsymmetrisch U( r ) , aber ist nicht mehr ∼ − !<br />
r<br />
⇒ Die � -Entartung ist aufgehoben !<br />
Fazit:<br />
Die Entartungsgrade ergeben im Termschema der Atome das Periodensystem der<br />
Elemente. ( → Chemie der Elemente !)<br />
Restliche Chemie:<br />
Quantenmechanik der Valenzelektronen in „Atomgruppierungen“<br />
a.) Moleküle ⇒ Molekülphysik, Molekülchemie → „Molekülorbitale“<br />
b.) periodische Atomverbände ⇒ Festkörperphysik (siehe §7)<br />
c.) Fluide und Gläser: a.) und b., aber inklusive Unterordnung<br />
⇒ sehr schwierig; erst allmählich (mit steigender Computerleistung)<br />
quantenmechanisch zugänglich<br />
71