- Page 1:
ORGANIZACIÓN Red MASyS/ORGANIZAÇ
- Page 7 and 8: Medio ambiente subterráneo y soste
- Page 9 and 10: 9, 10 y 11 de Noviembre de 2011 9,
- Page 11 and 12: ORGANIZACIÓN CYTED/ORGANIZAÇÃO C
- Page 13: GRUPOS DE INVESTIGACIÓN/GRUPOS DE
- Page 16 and 17: PRÓLOGO Cuando hablamos de los pro
- Page 19 and 20: ÍNDICE DE TRABAJOS TÉCNICO-CIENT
- Page 21: REGIME HIDROLÓGICO DA ANTIGA MINA
- Page 25 and 26: Resumen DRENAJES ÁCIDOS DE MINA Al
- Page 27 and 28: químicas destinadas a producir tal
- Page 29 and 30: microbiana cataliza esta reacción
- Page 31 and 32: Esta saturación puede ocurrir lueg
- Page 33 and 34: La figura 6 ilustra una forma const
- Page 35 and 36: Además de las sencillez constructi
- Page 37 and 38: Es posible entonces que las labores
- Page 39 and 40: sistema puede calificarse como pasi
- Page 41 and 42: Fig. 8. Flujograma de decisión ext
- Page 43 and 44: Fig. 9. Vista desde la mina La Meji
- Page 45 and 46: Los tratamientos pasivos para los d
- Page 49 and 50: AVALIAÇÃO DE COBERTURA SECA DE EN
- Page 51 and 52: drenagem ácida pode ser descrito p
- Page 53 and 54: abaixo da camada argilosa, uma cama
- Page 55 and 56: pontos de amostragem (figura 2) na
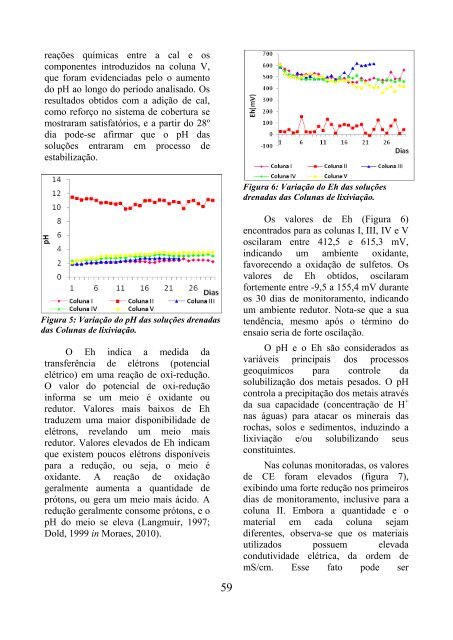
- Page 57: Duração do Ensaio: 40 dias Dimens
- Page 61 and 62: alaranjado. Ressalta-se a eficiênc
- Page 63 and 64: contexto de disposição de resídu
- Page 65 and 66: [19] MELLO, J.W.V; ABRAHÃO, W.A.P.
- Page 69 and 70: EVALUACIÓN DE LA CALIDAD DEL AGUA
- Page 71 and 72: 1.2 Wolfram ore body and the surrou
- Page 73 and 74: Masso galleries pH value is 4, indi
- Page 75 and 76: Metal concentration (ppm) 0.5 0 1 1
- Page 77 and 78: NEUTRALIZAÇÃO NATURAL POR CARBONA
- Page 79 and 80: Tabela 1. Alguns sulfetos important
- Page 81 and 82: Figura 1 - Coluna Estratigráfica I
- Page 83 and 84: QUÍMICA DE NEUTRALIZAÇÃO Para mi
- Page 85: pH neutro ou próximo, não é nece
- Page 88 and 89: a las comunidades y actividades pro
- Page 90 and 91: N° ÁREA MINERA 1 LAS PARALELAS 2
- Page 92 and 93: El principal problema que genera la
- Page 94 and 95: PROPUSTA DE TRATAMIENTO La situaci
- Page 96 and 97: Primero a la poza 1 de sedimentaci
- Page 99 and 100: ANÁLISIS DE ALTERNATIVAS DE SANEAM
- Page 101 and 102: Coahuila, Colima, Michoacán y Zaca
- Page 103 and 104: actividades. Sin embargo, aún qued
- Page 105 and 106: los materiales que se generan duran
- Page 107 and 108: Ocupan un lugar preponderante en ta
- Page 109 and 110:
pueden limitar la amplitud de uso d
- Page 111 and 112:
d. Adsorción de metales por hidró
- Page 113 and 114:
4.3.2. Sistema propuesto El sistema
- Page 115 and 116:
Considerando los resultados puntual
- Page 117 and 118:
Tabla 2. Perspectiva general de las
- Page 119 and 120:
[7] HARI D. SHARMA, SANGEETA P. LEW
- Page 121 and 122:
Capítulo 2 CONTROL DE CONTAMINACI
- Page 123 and 124:
SOSTENIBILIDAD AMBIENTAL DE AGUA DE
- Page 125 and 126:
South America (4%), USA (4%), and r
- Page 127 and 128:
water. This takes into consideratio
- Page 129 and 130:
4. CASE STUDY IN PANASQUEIRA MINE 4
- Page 131 and 132:
The Sustainable Development of the
- Page 133 and 134:
RECUPERACIÓN DE METALES DE DRENAJE
- Page 135 and 136:
Tabla 1. Clasificación de DAMs seg
- Page 137 and 138:
Fig. 1 Posición de la ciudad de El
- Page 139 and 140:
Los dos eventos iniciales de la ope
- Page 141 and 142:
Fig. 6. Propuestas de formas de lix
- Page 143 and 144:
Bibliografía Fig. 7. Aprovechamien
- Page 145 and 146:
ESTUDIO DE DESULFURIZACIÓN DE RELA
- Page 147 and 148:
Los resultados del análisis por di
- Page 149 and 150:
Ca acumulado (mg) 7000 6000 5000 40
- Page 151 and 152:
soluciones de enjuague, es presenta
- Page 153 and 154:
producto non float obtenido mediant
- Page 155 and 156:
es estable químicamente y por tant
- Page 157 and 158:
ALTERNATIVAS PARA EL MANEJO DE LA P
- Page 159 and 160:
2011 deberá iniciarse la construcc
- Page 161 and 162:
En una segunda etapa y medida que c
- Page 163 and 164:
aguas de escorrentía que fluyan de
- Page 165 and 166:
AGRADECMIENTOS Los autores particip
- Page 167 and 168:
CONTROL DE LAS AGUAS DURANTE LA EXP
- Page 169 and 170:
Otros métodos sugieren previamente
- Page 171 and 172:
ejercen influencia en la desigual d
- Page 173 and 174:
Estas se corresponden con el tipo d
- Page 175 and 176:
II III IV Zona de muy agrietada a a
- Page 177 and 178:
La digitalización de los datos tec
- Page 179 and 180:
Homenaje al Profesor Rafael Fernán
- Page 181 and 182:
TRATAMIENTO POR FLOTACIÓN DEL DREN
- Page 183 and 184:
industriales (Barakat, 2010). De aq
- Page 185 and 186:
con amilxantato de potasio, en la f
- Page 187 and 188:
aporte la hidrofobicidad necesaria
- Page 189 and 190:
A continuación se relacionan los m
- Page 191 and 192:
agua potable, se aprecia que si bie
- Page 193 and 194:
• Lazaridis, N. K., E. N. Peleka,
- Page 195 and 196:
ADSORCIÓN EN ZEOLITA Y CARBÓN ACT
- Page 197 and 198:
agruparse en dos categorías, méto
- Page 199 and 200:
“k2” a partir de la pendiente y
- Page 201 and 202:
moléculas del mismo tamaño pero d
- Page 203 and 204:
Las longitudes de onda (Tabla 1) pa
- Page 205 and 206:
sólido-disolución. La cinética d
- Page 207 and 208:
experimentales con la zeolita confi
- Page 209 and 210:
[3] METCALF & EDDY, INC. Wastewater
- Page 211 and 212:
INVESTIGACIÓN PARA EL TRATAMIENTO
- Page 213 and 214:
Cuantificar las desmonteras, que co
- Page 215 and 216:
la concesión, muchas de ellas son
- Page 217 and 218:
Figura 1.- Secuencia general de act
- Page 219 and 220:
4.3.- Recuperación en función del
- Page 221 and 222:
7.0 REFERENCIA BIBLIOGRAFICA 1.- AD
- Page 223 and 224:
TECNICAS DE PREVENCION Y CONTROL DE
- Page 225 and 226:
En el ensayo o test ABA, se estima
- Page 227 and 228:
Si NP/MPA < 1 posible generación d
- Page 229 and 230:
Figura 3. Relación entre NP y AP c
- Page 231 and 232:
Valores de efervescencia 1 o 2 en l
- Page 233 and 234:
7. CONCLUSIONES. El cometido princi
- Page 235 and 236:
DIMENSIONADO DE SISTEMAS DE TRATAMI
- Page 237 and 238:
3. METODOLOGIA. Para llevar adelant
- Page 239 and 240:
Figura 1. Curvas de acidez de agua
- Page 241 and 242:
Límites Máximos Permisibles (LMP
- Page 243 and 244:
En la Foto 3 se muestra los lodos o
- Page 245 and 246:
Foto 4. Lodos obtenidos en el trata
- Page 247 and 248:
El dimensionado del sistema de trat
- Page 249 and 250:
PRODUCCIÓN MÁS LIMPIA Y BUENAS PR
- Page 251 and 252:
principales son si tanto el agua su
- Page 253 and 254:
La sedimentación también puede ob
- Page 255 and 256:
someten a su aplicación, y que en
- Page 257 and 258:
de la aplicación de estrategias am
- Page 259 and 260:
debe incluir, al menos, los siguien
- Page 261 and 262:
ofrece la oportunidad de hacer gest
- Page 263 and 264:
de la extracción de yacimientos de
- Page 265 and 266:
4. ADOPCIÓN DE PROCESOS MÁS LIMPI
- Page 267 and 268:
• Separar las aguas pluviales de
- Page 269 and 270:
• Estudiar la estabilidad geotéc
- Page 271 and 272:
Olivo, Beatriz. Manual de gestión
- Page 273 and 274:
Capítulo 3 CASOS PRÁCTICOS A NIVE
- Page 275 and 276:
ESTUDIO DE LA CALIDAD DE LAS AGUAS
- Page 277 and 278:
espectivamente; por lo que, se cons
- Page 279 and 280:
Parámetro Temperatur a Unida d Tot
- Page 281 and 282:
Parámet ro Unida d Tototr al (1) S
- Page 283 and 284:
Parámetro Unidad Achacol lo (1) 28
- Page 285 and 286:
Parámet ro Unid ad Anteque ra (1)
- Page 287 and 288:
Parámet ro Unid ad Sora Sora (1) P
- Page 289 and 290:
) Calidad de aguas usadas para rieg
- Page 291 and 292:
LAVRA SUSTENTÁVEL E MONITORAMENTO
- Page 293 and 294:
ibeirão Água Quente (Rio Quente),
- Page 295 and 296:
4. ORIGEM DAS ÁGUAS QUENTES Pode-s
- Page 297 and 298:
6. DETERMINAÇÃO DE PARÂMETROS HI
- Page 299 and 300:
nascentes, datação das águas, an
- Page 301 and 302:
ESTUDO DE ÁREA CONTAMINADA POR Hg
- Page 303 and 304:
contaminação de mercúrio no muni
- Page 305 and 306:
mobilização ou mesmo transformaç
- Page 307 and 308:
Figura 3 - Mapa da bacia do ribeir
- Page 309 and 310:
ealizados. As concentrações de me
- Page 311 and 312:
A GESTÃO DE RECURSOS HÍDRICOS NO
- Page 313 and 314:
1- Introdução Na era da pedra las
- Page 315 and 316:
informar a disponibilidade de água
- Page 317 and 318:
Para uso da água ou para realizar
- Page 319 and 320:
Figura1- Cavernas da região de Vaz
- Page 321 and 322:
Referências SILVA, Marina. Minist
- Page 323 and 324:
REGIME HIDROLÓGICO DA ANTIGA MINA
- Page 325 and 326:
Trata-se de um maciço essencialmen
- Page 327 and 328:
A evapotranspiração efetiva, ETe,
- Page 329 and 330:
Tabela 1. Fatores de Correção par
- Page 331 and 332:
Tabela 2 - Boletim Meteorológico f
- Page 333 and 334:
c) Estimativa da entrada de água n
- Page 335 and 336:
135, 85 e 35, até atingir o 1º Pi
- Page 337 and 338:
precipitação média anual 1780 l/
- Page 339 and 340:
O REBAIXAMENTO DO NÍVEL D’ÁGUA
- Page 341 and 342:
complicador ou mesmo inviabilizador
- Page 343 and 344:
Figura 2: Interferência múltipla
- Page 345 and 346:
E criou cinco instrumentos utilizad
- Page 347 and 348:
empreendimentos e comunidades já e
- Page 349 and 350:
USO DE AGUAS SUBTERRANEAS EN LOS PR
- Page 351 and 352:
Water Management Consultants (2004)
- Page 353 and 354:
Método Supuestos Almacenamiento de
- Page 355 and 356:
estación de sumideros 3600 que no
- Page 357 and 358:
de Fe(III) amorfo o Fe(OH)3. En las
- Page 359 and 360:
REQUISITOS DE ABASTECIMIENTO DE AGU
- Page 361 and 362:
PROYECTO DE CODIFICACION DE LA NORM
- Page 363 and 364:
1. ANTECEDENTES HISTÓRICOS La alta
- Page 365 and 366:
sus científicos en lo relacionado
- Page 367 and 368:
8. m. ant. códice ( manuscrito de
- Page 369 and 370:
más profunda y específica con otr
- Page 371 and 372:
• Formar capital para superar pro
- Page 373 and 374:
¿Que se debe preservar en los paí
- Page 375 and 376:
• Los derechos ancestrales de los
- Page 377 and 378:
377
- Page 379 and 380:
379