EQUILIBRIO QUÍMICO
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
QUÍMICA II Dpto. de Química Física<br />
Tema 6 Equilibrio químico<br />
30<br />
Efecto ión común y efecto salino. Comparativa<br />
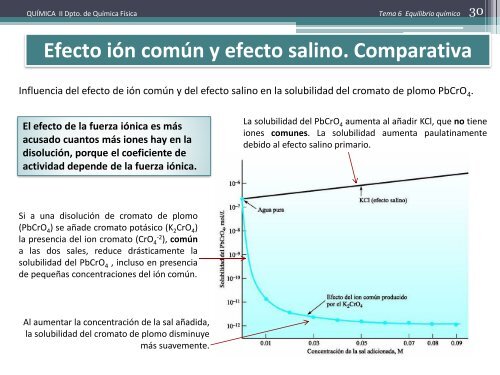
Influencia del efecto de ión común y del efecto salino en la solubilidad del cromato de plomo PbCrO 4 .<br />
El efecto de la fuerza iónica es más<br />
acusado cuantos más iones hay en la<br />
disolución, porque el coeficiente de<br />
actividad depende de la fuerza iónica.<br />
La solubilidad del PbCrO 4 aumenta al añadir KCl, que no tiene<br />
iones comunes. La solubilidad aumenta paulatinamente<br />
debido al efecto salino primario.<br />
Si a una disolución de cromato de plomo<br />
(PbCrO 4 ) se añade cromato potásico (K 2 CrO 4 )<br />
la presencia del ion cromato (CrO 4<br />
-2<br />
), común<br />
a las dos sales, reduce drásticamente la<br />
solubilidad del PbCrO 4 , incluso en presencia<br />
de pequeñas concentraciones del ión común.<br />
Al aumentar la concentración de la sal añadida,<br />
la solubilidad del cromato de plomo disminuye<br />
más suavemente.