Lire l'Article - retinavisionetretinaaudition.fr
Lire l'Article - retinavisionetretinaaudition.fr
Lire l'Article - retinavisionetretinaaudition.fr
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Livre.book Page 159 Jeudi, 26. février 2009 3:40 15<br />
ANNEXES PALPÉ-<br />
CHAPITRE 11<br />
GLAUCOMES CONGÉNITAUX PRIMITIF<br />
ET SECONDAIRES DYSGÉNÉSIQUES<br />
DÉFINITIONS<br />
Comme le strabisme et le nystagmus, le glaucome congénital<br />
est à la fois une maladie et un symptôme.<br />
Il constitue à lui seul une maladie dans ce qu’il est convenu<br />
d’appeler le glaucome congénital primitif classique, mais<br />
devient un symptôme pour tout un ensemble malformatif, les<br />
dysgénésies du segment antérieur de l’œil, responsables de<br />
glaucomes secondaires.<br />
Tous ont en commun une hypertonie oculaire plus ou<br />
moins précoce, des dysfonctionnements de l’horloge embryologique<br />
et une forte connotation héréditaire.<br />
D’autant plus graves que plus précoces, rapidement cécitants,<br />
ils ont vu leur pronostic transformé par une prise en<br />
charge chirurgicale immédiate dès le diagnostic porté, suivi<br />
d’une surveillance attentive et de la prévention des séquelles<br />
fonctionnelles.<br />
La date de survenue de l’hypertonie oculaire dans la vie de<br />
l’enfant détermine l’aspect clinique et permet de distinguer :<br />
– le glaucome congénital par sa buphtalmie liée à la distension<br />
rapide d’une sclère encore extensible chez le nouveau-né<br />
et le nourrisson ;<br />
– du glaucome juvénile, plus tardif, qui fait le lien avec le<br />
glaucome chronique de l’adulte et évolue à bas bruit sans<br />
modifier l’aspect extérieur de l’œil.<br />
L’âge de trois ans est le critère admis pour séparer ces deux<br />
formes cliniques puisque, dès lors, la sclère n’est plus extensible<br />
et le globe a pratiquement acquis sa taille adulte.<br />
Les dysfonctionnements de l’horloge embryologique<br />
impliquant les cellules des crêtes neurales céphaliques font, à<br />
juste titre, entrer le glaucome congénital dans le cadre des<br />
neuro-cristopathies. Leurs potentialités multiples et leur présence<br />
en deux cordons cellulaires tout au long du tube neural<br />
rendent compte des nombreuses associations pathologiques<br />
extraoculaires constituant autant de glaucomes syndromiques<br />
polymalformatifs.<br />
CARACTÈRE HÉRÉDITAIRE<br />
Le caractère héréditaire du glaucome n’est plus à démontrer<br />
du fait de la <strong>fr</strong>équence des cas familiaux, dans la <strong>fr</strong>atrie avec<br />
un fort taux de consanguinité pour le glaucome congénital<br />
primitif classique récessif autosomique, ou dans la lignée<br />
pour les glaucomes secondaires dysgénésiques transmis le<br />
plus souvent sur le mode dominant autosomique. L’examen<br />
J.-L. DUFIER, J. KAPLAN<br />
I – GÉNÉRALITÉS<br />
ophtalmologique de l’entourage du proposant à la recherche<br />
d’anomalies, même a minima (cf. chapitre 4), s’avère donc fondamental<br />
afin d’établir un arbre généalogique exploitable<br />
pour le conseil génétique et la recherche des gènes en cause.<br />
Actuellement, de nombreuses mutations ont été élucidées<br />
affectant des gènes exprimés dans le trabéculum ou impliqués<br />
dans le programme du développement de l’œil. L’altération<br />
de gènes modulateurs interférant avec plusieurs autres gènes<br />
pourrait expliquer la grande variabilité phénotypique intrafamiliale<br />
ou entre les deux yeux d’un même patient.<br />
EMBRYOLOGIE<br />
RÔLE DES CELLULES DES CRÊTES NEURALES<br />
PROSENCÉPHALIQUES<br />
La démonstration du rôle des cellules des crêtes neurales prosencéphaliques<br />
dans la formation de l’œil, plus particulièrement<br />
de son segment antérieur, constitue un apport essentiel<br />
dans la compréhension du glaucome congénital. Qui plus est,<br />
ces cellules participent non seulement à la genèse d’autres<br />
structures oculaires (sclérotique, choroïde, muscle ciliaire,<br />
tissu conjonctif de la musculature oculomotrice, squelette<br />
ostéomembraneux orbitaire) mais aussi à l’induction des arcs<br />
branchiaux d’origine ectodermique (fig. 11-1) : bourgeons<br />
maxillaires et mandibulaires, structures branchiales des 2 e , 3 e ,<br />
4 e arcs viscéraux [11, 17] . Des associations polymalformatives les<br />
plus disparates en apparence, oculaires, craniofaciales et viscérales,<br />
ne sont donc pas surprenantes (fig. 11-2).<br />
DÉVELOPPEMENT NORMAL<br />
DE L’ANGLE IRIDOCORNÉEN<br />
À la troisième semaine de la vie embryonnaire, les fossettes<br />
optiques apparues sur la plaque neurale se transforment en<br />
deux vésicules optiques de part et d’autre du tube neural<br />
antérieur, ou prosencéphale. Celles-ci s’invaginent en cupules<br />
optiques au cours de la quatrième semaine. Parallèlement, la<br />
placode cristallinienne, formée par l’épaississement de l’ectoblaste<br />
de surface, se creuse puis s’isole en vésicule cristallinienne.<br />
L’espace mésenchymateux, délimité entre la cupule<br />
optique en avant et la vésicule cristallinienne en arrière, constitue<br />
alors la future chambre antérieure (fig. 11-3).<br />
GLAUCOMES CONGÉNITAUX PRIMITIF ET SECONDAIRES DYSGÉNÉSIQUES 159
Livre.book Page 160 Jeudi, 26. février 2009 3:40 15<br />
Pour certains auteurs [2] , le clivage entre trabéculum uvéal<br />
et trabéculum scléral, sous l’effet du développement du muscle<br />
ciliaire au cinquième mois, expliquerait la distension des<br />
fibres trabéculaires. Pour d’autres (Bach, Seefelder, Ida Mann,<br />
Barber) [6] , la résorption incomplète de ce mésenchyme aboutirait<br />
à la formation de la membrane de Barkan, assimilée à<br />
un reliquat mésodermique dans l’angle de la chambre antérieure.<br />
Cependant, la matérialité de cette membrane n’a<br />
Fig. 11-1 – Migration des cellules des crêtes neurales prosencéphaliques<br />
dans les arcs branchiaux.<br />
Fig. 11-2 – Syndrome du premier arc. Glaucome congénital et microtie.<br />
Fig. 11-3 – Cupule optique (quatrième semaine). Formation<br />
de la chambre antérieure.<br />
160 ANNEXES PALPÉBRO-CONJONCTIVALES ET SEGMENT ANTÉRIEUR<br />
jamais été prouvée chirurgicalement, ni retrouvée sur des examens<br />
histologiques. Ceux-ci suggèrent plutôt un obstacle trabéculaire<br />
lié à une plus grande densité de la maille [4, 51] dont<br />
les fibres plus épaisses et comprimées ne laissent voir aucun<br />
espace inter-trabéculaire, surtout à proximité du canal de<br />
Schlemm, dont la paroi externe apparaît tapissée par un<br />
matériel amorphe et imperméable. Ces constatations sont en<br />
accord avec l’efficacité de la trabéculectomie externe qui<br />
emporte toute la paroi externe du canal de Schlemm et son<br />
plancher sans ouvrir la chambre antérieure [70] .<br />
Le rôle des cellules de la crête neurale est connu et démontré<br />
dans la formation de l’angle iridocornéen grâce aux travaux<br />
de Coulombre, Le Douarin et Lelièvre [43, 44] , utilisant les<br />
chimères caille-poulet (fig. 11-4), et ceux de Johnston [36] faisant<br />
appel aux cellules marquées par la thymidine tritiée.<br />
Dès la huitième semaine de vie embryonnaire, les cellules<br />
de la crête neurale prosencéphalique colonisent en trois<br />
vagues successives le mésenchyme primaire situé entre l’ectoblaste<br />
de surface et la vésicule cristallinienne (fig. 11-5). La<br />
première vague contribue à la formation de l’endothélium<br />
cornéen et du trabéculum. La seconde forme le stroma cornéen<br />
et la dernière fournit l’iris antérieur. Excepté l’épithé-<br />
Fig. 11-4 – Formation de la chambre antérieure. Chimère caille-poulet :<br />
présence de cellules de crêtes neurales de caille à gros noyau (↑↑) dans<br />
l’endothélium cornéen d’embryon de poulet. (Collection du Pr G. Couly.)<br />
Fig. 11-5 – Formation de la chambre antérieure. Schéma de migration<br />
des cellules de la crête neurale. Première vague : endothélium cornéen<br />
et trabéculum en rouge. En bleu, épithélium cornéen et cristallin d’origine<br />
épiblastique. Deuxième vague : stroma cornéen en jaune. Troisième<br />
vague : iris antérieur en vert.
Livre.book Page 161 Jeudi, 26. février 2009 3:40 15<br />
lium cornéen — d’origine ectoblastique comme le cristallin —<br />
et l’épithélium pigmenté de l’iris — d’origine neurectoblastique<br />
comme la rétine —, la totalité de la chambre antérieure<br />
dérive des cellules de la crête neurale céphalique, qui constituent<br />
une couche ectomésenchymateuse continue depuis<br />
l’endothélium cornéen jusqu’à la face antérieure de l’iris, en<br />
passant par le trabéculum [5] .<br />
Au cinquième mois de gestation, l’angle iridocornéen est<br />
donc formé mais on l’imagine facilement encore peu perméable<br />
car l’iris, dont l’insertion se trouve très antérieure sur le<br />
trabéculum primaire, est tapissé par la couche des cellules<br />
endothéliales cornéennes et la région trabéculaire reste peu<br />
développée, l’angle étant comblé par du tissu uvéal. Par<br />
ailleurs, l’épithéliun ciliaire bi-stratifié sécrète l’humeur<br />
aqueuse, la fente colobomique est déjà fermée depuis la cinquième<br />
semaine, et la sclère fœtale, plus riche en fibres élastiques<br />
que collagènes, s’avère particulièrement extensible.<br />
Tous les facteurs sont donc réunis pour assurer la croissance<br />
du globe sous l’effet de la pression intraoculaire. De façon<br />
similaire, le développement cérébral et la pression du liquide<br />
céphalorachidien induisent la croissance céphalique. En<br />
Une cascade d’événements aussi sophistiqués ne doit rien au<br />
hasard et ne peut être que le résultat d’une orchestration<br />
rigoureuse par des gènes présidant à des phénomènes de<br />
croissance ou d’apoptose (cf. chapitre 5).<br />
Contrairement à ce qui est observé dans les dystrophies<br />
héréditaires de la cornée et de la rétine, les données de la génétique<br />
moléculaire n’ont pas fondamentalement bouleversé<br />
mais plutôt conforté la nosologie des glaucomes congénitaux et<br />
leur classification clinique reste toujours de mise [7, 24, 35] :<br />
– glaucome congénital primitif classique ;<br />
– glaucomes secondaires dysgénésiques ;<br />
– glaucome juvénile ;<br />
– glaucomes syndromiques.<br />
GLAUCOME CONGÉNITAL<br />
PRIMITIF CLASSIQUE<br />
Le glaucome congénital primitif est une affection grave <strong>fr</strong>appant<br />
8 à 15 % des jeunes aveugles selon les centres, rare —<br />
cinq pour 100 000 naissances —, bilatérale dans 80 % des cas<br />
et héréditaire transmise selon le mode récessif autosomique.<br />
Présent dès la naissance dans un tiers des cas, ou apparaissant<br />
au cours de la première année de la vie, il impose, sitôt<br />
le diagnostic établi, un traitement chirurgical, seul à même<br />
d’éviter la cécité.<br />
CLINIQUE<br />
Signes d’appel<br />
La photophobie avec larmoiement clair et blépharospasme<br />
constitue le premier signe d’appel (fig. 11-6). Il est très vite<br />
II – PATHOLOGIE ET GÉNÉTIQUE<br />
pathologie, et par analogie, on serait tenté de penser que le<br />
glaucome congénital constitue l’« hydrocéphalie de l’œil ».<br />
Au cours des trois derniers mois de la gestation se produisent<br />
des événements très importants :<br />
– disparition progressive de la couche endothéliale irienne à<br />
partir du bord pupillaire de l’iris ;<br />
– formation de l’éperon scléral où s’insèrent les fibres longitudinales<br />
du muscle ciliaire ;<br />
– recul de l’insertion irienne au niveau de l’éperon scléral ;<br />
– formation du canal de Schlemm et de la ligne de<br />
Schwalbe avec développement du trabéculum.<br />
Comme pour d’autres structures oculaires, en particulier la<br />
macula, la maturation de l’angle ne va s’achever que pendant la<br />
première année de la vie. Il acquiert alors sa configuration normale<br />
avec l’apparition des fibres circulaires du muscle ciliaire,<br />
une insertion irienne en arrière de l’éperon scléral, un trabéculum<br />
et un canal de Schlemm bien développés et fonctionnels.<br />
Cette notion capitale rend compte des cas de glaucomes<br />
congénitaux spontanément résolutifs [48] et de l’évolution<br />
postopératoire habituellement favorable de ceux qui ont pu<br />
passer le cap d’une année.<br />
Fig. 11-6 – Glaucome congénital. Photophobie, buphtalmie.<br />
suivi d’une buphtalmie par augmentation du diamètre cornéen,<br />
d’un approfondissement de la chambre antérieure et de<br />
ruptures descemétiques horizontales du fait de la distension<br />
limbique sous l’effet de l’hypertonie oculaire. La cornée œdémateuse,<br />
d’abord dépolie, devient alors irrémédiablement<br />
opaque.<br />
L’écoute des antécédents familiaux, des conditions de la<br />
grossesse et de la naissance, l’examen des deux parents, la<br />
recherche de lésions associées éventuelles (malformation,<br />
hémangiome, névrome plexiforme, taches cutanées) et l’examen<br />
pré-anesthésique précèdent immédiatement l’examen<br />
sous anesthésie générale et le geste chirurgical.<br />
Examen sous anesthésie générale<br />
Avec le concours d’une équipe anesthésique rompue à la<br />
prise en charge de polymalformés ou de nouveau-nés de<br />
quelques heures, l’examen est conduit de façon méthodique à<br />
l’aide d’un blépharostat colibri, tous les résultats étant consignés<br />
sur la fiche préétablie.<br />
GLAUCOMES CONGÉNITAUX PRIMITIF ET SECONDAIRES DYSGÉNÉSIQUES 161
Livre.book Page 162 Jeudi, 26. février 2009 3:40 15<br />
Autoré<strong>fr</strong>actométrie<br />
L’autoré<strong>fr</strong>actométre portable, lorsque l’état cornéen l’autorise,<br />
peut mesurer une myopie axile déjà anormale à cet âge et<br />
parfois un fort astigmatisme.<br />
Diamètre cornéen<br />
Le diamètre cornéen mesuré au compas de Sourdille, sur le<br />
méridien horizontal, de « blanc à blanc », est normalement<br />
de : 9,5 mm à la naissance, 10,5 mm à 6 mois, 11,5 mm à<br />
1 an, 12-12,5 mm à 3 ans. Un diamètre cornéen dépassant ces<br />
valeurs de 1 à 2 mm est anormal.<br />
Microscope opératoire<br />
L’examen sous microscope opératoire retrouve les aspects<br />
caractéristiques du glaucome congénital :<br />
– les vergetures de la cornée, pathognonomiques lorsqu’elles<br />
sont associées à une mégalocornée, résultent de ruptures de la<br />
membrane de Descemet, créées par sa distension sous l’effet<br />
de l’hypertonie oculaire (fig. 11-7). Elles apparaissent sous<br />
162 ANNEXES PALPÉBRO-CONJONCTIVALES ET SEGMENT ANTÉRIEUR<br />
forme de stries sinueuses, horizontales au centre et parallèles<br />
au limbe en périphérie. Elles ne sauraient se confondre avec les<br />
ruptures descemétiques isolées, verticales et linéaires, dues à<br />
l’application de forceps ;<br />
– l’œdème de la cornée, diffus ou parfois localisé au voisinage<br />
des vergetures, épithélial au début, puis associé à une<br />
infiltration stromale, lui confère cet aspect terne et trouble,<br />
voire bleuté, empêchant l’examen de l’angle et du fond d’œil ;<br />
– la distension du limbe se traduit par un anneau blanc et<br />
large, modifiant les repères anatomiques de l’angle iridocornéen ;<br />
– la chambre antérieure apparaît anormalement profonde<br />
(fig. 11-8). La base de l’iris, étirée et amincie, semble s’insérer<br />
en arrière des arcades vasculaires du limbe. Il peut exister un<br />
ectropion de l’épithélium pigmenté de l’iris;<br />
– la microphakie relative et l’étirement des fibres zonulaires<br />
ne sont visibles qu’après dilatation pupillaire.<br />
Examen du fond d’œil<br />
La papille optique déjà bien excavée et le rapport C/D (cup/<br />
disc) constituent un élément précieux de la surveillance post-<br />
a b<br />
Fig. 11-7 – UBM. Constitution d’une vergeture de la membrane de Descemet. a. Œdème cornéen. Décollement endothélio-descemétique. b. Rupture<br />
et enroulement de la membrane de Descemet.<br />
Fig. 11-8 – Glaucome congénital. UBM. Distension de la chambre antérieure. Discret œdème cornéen.
Livre.book Page 163 Jeudi, 26. février 2009 3:40 15<br />
opératoire : en effet, la normalisation tensionnelle induit une<br />
stabilisation de l’allongement du globe avec comblement de<br />
cette excavation.<br />
Chez le nourrisson normal, il n’y a pratiquement pas<br />
d’excavation papillaire. Les grandes excavations (0,2 à 0,5),<br />
rondes ou ovalaires, à grand axe horizontal, définitivement<br />
stables, correspondent à des colobomes d’entrée du nerf optique.<br />
L’hypertonie oculaire provoque un recul de la lame criblée<br />
sans altération des fibres visuelles au début, celles-ci étant<br />
simplement rejetées sur le côté. Puis l’excavation progresse<br />
d’abord en profondeur avec maintien d’un anneau neurorétinien<br />
épais et rosé, avant de s’élargir. La verticalisation de<br />
l’excavation, moins <strong>fr</strong>équente que chez l’adulte, est un signe<br />
de gravité traduisant la souf<strong>fr</strong>ance irréversible du nerf optique.<br />
Lorsque le glaucome existe dès la naissance, l’excavation<br />
peut devenir totale en quelques jours.<br />
Enfin, l’asymétrie papillaire reste très suspecte car présente<br />
dans 88 % des glaucomes congénitaux alors que seulement<br />
3 % des enfants normaux ont des disques optiques asymétriques.<br />
Pression intraoculaire<br />
La mesure de la pression intraoculaire (PIO) est un temps<br />
essentiel de l’examen. Seule la mesure à l’aplanation est fiable,<br />
soit avec le tonomètre de Perkins ou de Draeger, soit<br />
avec le tonographe et à condition d’être couplée à une pachymétrie<br />
cornéenne.<br />
Le chif<strong>fr</strong>e normal de PIO chez l’enfant éveillé est de<br />
10 mm Hg avant un an et de 10 à 15 mm Hg entre un an et<br />
cinq ans. Sous anesthésie générale utilisant des dérivés de<br />
l’halothane (Sévorane) — qui abaissent la pression intraoculaire<br />
de 6 mm Hg en moyenne par relâchement de la musculature<br />
extrinsèque de l’œil — et en tenant compte de la<br />
déshydratation du jeûne pré-anesthésique, la PIO normale est<br />
de l’ordre de 4 mm Hg avant un an et inférieure à 10 mm Hg<br />
entre un an et cinq ans. Des valeurs supérieures à 15 mm Hg<br />
sous anesthésie générale sont pathologiques.<br />
Examen de l’angle iridocornéen<br />
L’examen de l’angle iridocornéen a pour but de localiser les<br />
structures anormales de l’angle et de repérer les zones chirurgicales<br />
possibles. Son étude à la lampe à fente du microscope<br />
opératoire, soit avec le verre de Goldmann en gonioscopie<br />
indirecte, ou avec les verres de Köppe, Barkan ou Swann en<br />
gonioscopie directe, est d’interprétation délicate en raison de<br />
la modification des rapports anatomiques entre les diverses<br />
structures angulaires et parce que tous les aspects sont possibles<br />
dans les goniodysgénésies.<br />
Néanmoins, les anomalies généralement retrouvées évoquent<br />
un angle immature et inachevé, manifestement de type<br />
fœtal (fig. 11-9) :<br />
– anneau de Schwalbe et éperon scléral mal visibles ;<br />
– bande ciliaire courte, trabéculum pâle ;<br />
– stroma irien hypoplasique, laissant voir par endroits<br />
l’épithélium pigmenté et les vaisseaux radiaires de l’iris attirés<br />
vers le trabéculum ;<br />
– insertion irienne plate et antérieure sur le trabéculum, ou<br />
postérieure sur l’éperon scléral, ou concave élargissant<br />
l’angle ;<br />
– enfin, et contrairement à une description classique, rien<br />
n’évoque cliniquement une véritable membrane de Barkan<br />
dont l’existence même a été discutée (cf. supra).<br />
Fig. 11-9 – Glaucome congénital. Angle immature de type fœtal.<br />
(Collection du Dr M. Putterman.)<br />
Échographie<br />
En mode A, l’augmentation du diamètre antéro-postérieur,<br />
portant à la fois sur le segment antérieur et sur la cavité<br />
vitréenne, est responsable d’une myopie axile régressant partiellement<br />
après normalisation tensionnelle. Cette mesure a<br />
un intérêt pratique pour la correction optique de ces jeunes<br />
enfants : le tiers d’entre eux se trouve porteur d’une myopie<br />
supérieure à – 3 dioptries.<br />
En mode B, la biométrie s’avère encore plus précise et la<br />
profondeur de l’excavation papillaire quantifiable ; mais<br />
l’intérêt majeur réside dans l’exploration du segment postérieur<br />
lorsque l’œdème cornéen interdit l’accès au fond d’œil<br />
et que la stricte unilatéralité de la buphtalmie fait craindre un<br />
rétinoblastome.<br />
L’ultrabiomicroscopie (UBM) constitue l’examen de choix<br />
pour une exploration fine du segment antérieur de l’œil, en<br />
particulier pour le bilan et le typage des dysgénésies trabéculo-irido-cornéennes<br />
à cornée opaque.<br />
Au terme de l’examen sous anesthésie générale et après avoir<br />
recueilli le consentement éclairé des parents, le traitement<br />
chirurgical, bilatéral si nécessaire, est réalisé dans le même<br />
temps afin de prévenir les complications cécitantes inéluctables<br />
: cornées porcelaine, luxation du cristallin par étirement<br />
puis rupture de la zonule, décollement de la rétine, hémorragie<br />
intraoculaire, rupture traumatique du limbe, atrophie<br />
optique.<br />
DIAGNOSTIC DIFFÉRENTIEL<br />
Le larmoiement clair avec photophobie amène à éliminer aisément<br />
une kératite par l’épreuve à la fluorescéine et l’imperméabilité<br />
congénitale des voies lacrymales où le larmoiement<br />
est purulent.<br />
La buphtalmie avec ou sans opacité de la cornée pose essentiellement<br />
le problème des glaucomes secondaires dysgénésiques,<br />
car la fausse buphtalmie de la myopie forte ne résiste<br />
pas à la mesure de la ré<strong>fr</strong>action et à l’examen du fond d’œil<br />
en ophtalmoscopie directe. Quant aux glaucomes secondaires<br />
à une maladie infectieuse (embryofœtopathie de la rubéole<br />
ou de la toxoplasmose), à une maladie inflammatoire (arthrite<br />
chronique juvénile) ou tumorale (rétinoblastome, nævo-xantho-endothéliome<br />
de l’iris, diktyome du corps ciliaire), le<br />
GLAUCOMES CONGÉNITAUX PRIMITIF ET SECONDAIRES DYSGÉNÉSIQUES 163
Livre.book Page 164 Jeudi, 26. février 2009 3:40 15<br />
contexte est bien différent et la buphtalmie pratiquement<br />
toujours unilatérale.<br />
Les ruptures descemétiques verticales sont quasiment pathognonomiques<br />
de séquelles d’une application de forceps et,<br />
dans certaines circonstances, constituent un argument<br />
médico-légal irréfutable.<br />
L’excavation papillaire du colobome d’entrée du nerf optique<br />
est plutôt à grand axe vertical, stable et sans hypertonie<br />
associée.<br />
ÉTUDE GÉNÉTIQUE<br />
Hérédité du glaucome congénital<br />
Elle a été extrêmement controversée au cours des années<br />
1960-1980, puisque plusieurs publications discordantes ont<br />
tantôt considéré ce type de glaucome comme répondant à un<br />
mode de transmission récessif autosomique avec une pénétrance<br />
plus ou moins complète selon les séries (Waardenburg<br />
1950 [74] , Beiguelman 1963 [8] ), tantôt au contraire considéré le<br />
glaucome congénital comme exemple d’hérédité multifactorielle<br />
et polygénique à seuil (Démenais [19-21] ). Les partisans de<br />
l’hérédité récessive autosomique s’appuyaient sur la <strong>fr</strong>équence<br />
de la consanguinité, d’une part [74] , et sur la ségrégation<br />
du caractère dans environ 25 % des germains d’une<br />
même <strong>fr</strong>atrie, d’autre part. Ceci avait été particulièrement<br />
démontré dans une étude portant sur 45 familles de Gitans de<br />
Slovaquie regroupant 118 individus atteints d’un glaucome<br />
congénital [30] . Au demeurant, dès 1980, deux rapports d’analyse<br />
de ségrégation avaient suggéré une forte hétérogénéité<br />
génétique à l’origine de cette anomalie [29, 56] . Quant aux<br />
défenseurs de l’hérédité polygénique et multifactorielle, il est<br />
probable que leurs analyses avaient été gênées dans leur<br />
interprétation par la confusion nosologique existant à cette<br />
date pour le glaucome congénital, les patients atteints de<br />
glaucome primitif et de glaucome dysgénésique ayant été<br />
mixés dans les échantillons de patients [20] .<br />
Aujourd’hui, à la lumière des premières études de liaison<br />
génétique effectuées dans des cohortes de patients dont le<br />
glaucome avait été rigoureusement classifié et grâce à l’identification<br />
des premiers gènes responsables, il est possible<br />
d’affirmer que, dans la grande majorité des cas, le glaucome<br />
congénital primitif classique, tel qu’il correspond à l’immaturité<br />
de l’angle iridocornéen exposée plus haut, obéit à une<br />
hérédité récessive autosomique à pénétrance complète, tandis<br />
que le glaucome congénital secondaire dysgénésique obéit à<br />
une hérédité dominante autosomique avec une très large<br />
variabilité d’expression, même intrafamiliale.<br />
Décryptage génétique<br />
II fallut attendre l’année 1995 pour que les premières études<br />
de liaison génétique affirment l’hérédité récessive autosomique<br />
et localisent le premier gène causal sur le bras court du<br />
chromosome 2, en 2p21 (GLC3A, Sarfarazi, 1995) [63] . Cette<br />
première étude de liaison, reposant sur une homogénéité clinique<br />
la plus parfaite possible (critères diagnostiques uniformes,<br />
patients vus par le même ophtalmologiste), s’est<br />
appuyée sur une population étroite, puisque dix-sept familles<br />
multiplex sur un total de 86 familles furent sélectionnées sur<br />
des critères cliniques rigoureux correspondant à la description<br />
faite plus haut et étaient toutes originaires de Turquie. Onze<br />
familles sur dix-sept ne montrèrent aucun événement de<br />
164 ANNEXES PALPÉBRO-CONJONCTIVALES ET SEGMENT ANTÉRIEUR<br />
recombinaison avec le locus GLC3A en 2p21, confirmant<br />
ainsi l’hétérogénéité génétique du glaucome congénital primitif<br />
[63] . Cette localisation en 2p21 fut démontrée en 1998 dans<br />
la population de Gitans de Slovaquie [60] .<br />
Mais, dès l’année 1996, l’équipe de Sarfarazi localisait en<br />
Ip36 un second locus de glaucome congénital primitif<br />
(GLC3B). L’étude de liaison génétique avait été effectuée<br />
dans huit familles multiplex non liées au locus GLC1A et une<br />
liaison forte en Ip36 était retrouvée dans quatre de ces huit<br />
familles, apportant la preuve d’au moins un troisième locus<br />
supplémentaire [1] . À ce jour, aucun gène n’a encore été identifié<br />
pour le locus GLC3B. En 1997, la même équipe identifiait<br />
le gène correspondant au locus GLC3A. Il s’agit du gène<br />
CYP1B1 codant le cytochrome P450 de type 1B1 [69] . Depuis,<br />
plusieurs études ont montré que le gène CYP1B1 est sans<br />
conteste le gène majeur à l’origine du glaucome congénital<br />
primitif, dans 50 à 60 % des cas selon les études [16] . Enfin,<br />
très récemment un troisième locus, GLC3C, vient d’être<br />
repéré sur le chromosome 14 (14q23.3-q31.1) (données non<br />
encore publiées, GeneBank n˚ 399565). À ce jour, cette localisation<br />
n’a pas encore été étudiée dans les quatre familles de la<br />
série d’Akarsu excluant GLC3A et GLC3B.<br />
GLAUCOMES SECONDAIRES<br />
DYSGÉNÉSIQUES<br />
Les cornéo-irido-gonio-dysgénésies sont considérées comme<br />
résultant d’une anomalie de migration ou de différenciation<br />
des cellules de la crête neurale céphalique.<br />
ANOMALIES DE MIGRATION<br />
DES CELLULES DE LA CRÊTE NEURALE<br />
Un premier groupe d’affections considéré comme résultant<br />
d’une anomalie de la migration des cellules de la crête neurale<br />
prosencéphalique constitue une suite cohérente de malformations,<br />
de gravité croissante, qui peuvent d’ailleurs s’associer<br />
entre elles chez un même patient ou dans une même famille.<br />
Elles ont pour dénominateur commun la survenue plus ou<br />
moins précoce d’un glaucome et sont le plus souvent transmises<br />
sur le mode dominant autosomique (DA).<br />
Gonio-dysgénésies<br />
Embryotoxon postérieur (DA)<br />
Cette anomalie, uni- ou bilatérale, s’observe dans 10 % de la<br />
population. Elle correspond à l’épaississement de la ligne de<br />
Schwalbe, qui apparaît très antérieure et visible à la lampe à<br />
fente en rétro-illumination, sous forme d’une ligne blanc grisâtre<br />
disposée en anneau rétrocornéen plus ou moins complet<br />
et parallèle au limbe (fig. 11-10).<br />
Habituellement isolé et longtemps muet, il fait cependant<br />
partie de l’hypoplasie ductulaire syndromatique du syndrome<br />
d’Alagille, et peut se compliquer d’hypertonie oculaire, surtout<br />
lorsqu’il est étendu, ce qui justifie la surveillance<br />
annuelle systématique du tonus oculaire.<br />
Anomalie d’Axenfeld (DA)<br />
En 1920, Axenfeld décrit une anomalie héréditaire, bilatérale,<br />
associant un embryotoxon postérieur à des adhérences iridocornéennes<br />
formant des ponts de tissu irien entre la base de
Livre.book Page 165 Jeudi, 26. février 2009 3:40 15<br />
a b<br />
Fig. 11-10 – Embryotoxon. a. Épaississement de la ligne de Schwalbe. b. UBM. Embryotoxon et aniridie.<br />
l’iris et l’embryotoxon postérieur (fig. 11-11). Le glaucome,<br />
présent dans 50 % des cas, se manifeste le plus souvent dans<br />
l’enfance ou l’adolescence et se présente donc comme un<br />
glaucome juvénile.<br />
Irido-gonio-dysgénésies<br />
Anomalie de Rieger (DA)<br />
En 1934, Rieger retrouve les anomalies décrites par Axenfeld,<br />
mais associées à des déformations pupillaires : correctopie en<br />
regard des goniosynéchies, polycorie par déhiscences au sein<br />
des zones d’atrophie irienne (fig. 11-12).<br />
Le glaucome, bilatéral, est présent dans 50 % des cas, souvent<br />
dès la naissance. Il est difficile à traiter en raison de<br />
l’importance des anomalies de l’angle. D’autres anomalies<br />
oculaires sont possibles : cataracte, dégénérescence maculaire,<br />
hypoplasie du nerf optique, décollement de la rétine. Lorsque<br />
l’anomalie de Rieger s’associe à des anomalies dentaires,<br />
faciales, osseuses ou cardiaques, on parle alors de syndrome<br />
de Rieger (cf. in<strong>fr</strong>a, Glaucomes syndromiques).<br />
Étude génétique. — Les glaucomes dysgénésiques se<br />
caractérisent par une extrême variabilité clinique, puisque les<br />
Fig. 11-11 – Anomalie d’Axenfeld.<br />
anomalies décrites se déclinent isolément ou en association<br />
chez l’un ou l’autre des sujets atteints d’une même famille.<br />
L’hétérogénéité génétique est elle-même très grande, sans<br />
aucune corrélation avec l’hétérogénéité phénotypique, même<br />
si le mode de transmission est toujours dominant autosomique,<br />
au moins pour les anomalies oculaires exclusives. En<br />
revanche, la variabilité d’expression est extrêmement grande,<br />
ce qui souligne l’intérêt majeur de l’examen des apparentés<br />
d’un sujet atteint avant de conclure à une mutation de novo (cf.<br />
chapitre 4). Actuellement, deux loci situés sur deux régions<br />
chromosomiques ont été reconnus comme contenant un gène<br />
impliqué dans la genèse d’anomalies oculaires compatibles<br />
avec la description des anciennes « anomalies de clivage de la<br />
chambre antérieure de l’œil », anomalies en cascade :<br />
embryotoxon postérieur, anomalies d’Axenfeld et Rieger. Au<br />
sein de ces deux loci, un seul gène a été cloné et un second<br />
gène a été identifié par approche gène candidat. Le premier<br />
locus sur le chromosome 4q25-p26 a été nommé RIEG1 [33] ,<br />
du fait de son antériorité. Des mutations du gène PITX2 ont<br />
été identifiées comme responsables du phénotype oculaire en<br />
1996 [66] puis en 1998 [3] . Le gène PITX2 est un facteur de transcription<br />
à homéodomaine codant la protéine solurchin et<br />
l’importance de son implication dans la totalité des anomalies<br />
GLAUCOMES CONGÉNITAUX PRIMITIF ET SECONDAIRES DYSGÉNÉSIQUES 165
Livre.book Page 166 Jeudi, 26. février 2009 3:40 15<br />
Fig. 11-12 – Anomalie de Rieger.<br />
d’Axenfeld-Rieger n’est pas clairement évaluée. Une seule<br />
étude ferait état d’une <strong>fr</strong>équence de 9,4 % [46, 47] . La même<br />
méconnaissance existe pour le second locus, RIEG2, localisé<br />
en 13q14, au sein duquel aucun gène n’est aujourd’hui identifié<br />
[59] . Un second gène a été identifié à l’origine des dysgénésies<br />
de l’angle iridocornéen par une approche gène candidat.<br />
Il s’agit d’un facteur de transcription à homéodomaine<br />
FOXC1, également dénommé FKHL7 (Forkhead Homolog-Like<br />
7) [57] . Des mutations de ce gène auraient été retrouvées chez<br />
trois sur dix-huit patients dans une étude de Mears en 1998,<br />
soit 16,66 % [52] . Ce gène a été localisé dès 1995 dans la région<br />
chromosomique en 6p25 [42] . Il faut souligner que les mutations<br />
de PITX2 et FOXC1, ainsi que la liaison génétique au<br />
locus RIEG2 dans les formes familiales, ne couvrent pas la<br />
totalité des cas. D’autres gènes demandent à être reconnus à<br />
l’origine de ces anomalies d’Axenfeld-Rieger. De ce point de<br />
vue, il faut noter que tous les gènes programmeurs de l’œil<br />
sont des gènes candidats potentiels (cf. chapitres 5 et 6). C’est<br />
ainsi que Smith a criblé le gène FOXC2 (FKHL14) localisé en<br />
16q24.3 chez trente-deux patients, mais aucune mutation n’a<br />
pu être identifiée [68] . Le gène PITX3, localisé en 10q25, a également<br />
été testé et des mutations ont été mises en évidence<br />
Fig. 11-13 – Aniridie.<br />
166 ANNEXES PALPÉBRO-CONJONCTIVALES ET SEGMENT ANTÉRIEUR<br />
chez des patients atteints de dysgénésie mésenchymateuse de<br />
la chambre antérieure avec cataracte [65] , mais non chez des<br />
patients atteints d’Axenfeld-Rieger. De même, une mutation<br />
du gène FOXE3 (FKHL12), localisé en 1p32, a été identifiée<br />
dans une forme familiale de dysgénésie mésenchymateuse du<br />
segment antérieur avec cataracte [64] .<br />
Aniridie (DA)<br />
L’aniridie est un désordre complexe du développement oculaire<br />
touchant à un degré variable toutes les structures de<br />
l’œil, mais cette malformation tire son nom de son signe<br />
majeur qui est une aplasie ou une hypoplasie de l’iris. D’une<br />
<strong>fr</strong>équence estimée à 0,01 %, l’aniridie constitue une malformation<br />
congénitale bilatérale sévère, définie — dans sa forme<br />
habituelle de type I — par une absence subtotale de l’iris qui<br />
se trouve réduit à une mince collerette périphérique (fig. 11-<br />
13). Dès la naissance, elle entraîne photophobie, nystagmus<br />
de fixation, comportement visuel anormal et, parfois, buphtalmie.<br />
Toutes les structures oculaires sont impliquées, faisant<br />
suspecter l’altération d’un gène maître dans le développement<br />
de l’œil :
Livre.book Page 167 Jeudi, 26. février 2009 3:40 15<br />
– la dystrophie cornéenne limbique par incompétence des<br />
cellules souches est constante, entraînant un voile opaque<br />
superficiel lentement centripète et, parfois, des ulcérations ;<br />
– le glaucome, présent dans 50 à 75 % des cas, peut être<br />
de type congénital avec buphtalmie, ou tardif juvénile, ce qui<br />
justifie la surveillance annuelle du tonus oculaire de ces<br />
patients tout au long de leur vie ;<br />
– une cataracte congénitale totale ou partielle, avec reliquats<br />
de membrane de Wachendorf, n’est pas rare ;<br />
– l’aplasie maculaire bilatérale, quasi constante, rend<br />
compte du nystagmus et de la profonde amblyopie (fig. 11-14).<br />
Une forme partielle moins sévère, dite de type II, laisse un<br />
plan irien plus ou moins régulier et, surtout, épargne la<br />
macula, entraînant de ce fait un handicap visuel moins prononcé.<br />
Les types III et IV entrent dans le cadre des glaucomes syndromiques.<br />
Le syndrome de Gillespie, ou type III, associe aniridie,<br />
ataxie cérébelleuse et retard mental. Le syndrome<br />
WAGR, ou type IV, est l’acronyme de : tumeur de Wilms,<br />
Aniridie, anomalies des organes Génitaux externes, Retard<br />
des acquisitions [23] .<br />
En absence de complications, la prise en charge se limite à<br />
la prescription de verres correcteurs teintés, à la surveillance<br />
annuelle du tonus oculaire et à l’intégration scolaire la mieux<br />
adaptée au handicap. Le glaucome relève du traitement<br />
médico-chirurgical où la trabéculectomie externe a naturellement<br />
sa place, en raison de son efficacité et du moindre risque<br />
opératoire par rapport à la chirurgie perforante. En cas<br />
d’opacification cornéenne bilatérale et après normalisation<br />
tensionnelle, la greffe de cornée se discute mais son pronostic<br />
reste réservé en raison de la dystrophie épithéliale d’origine<br />
limbique et malgré l’allogreffe de limbe préalable et l’instillation<br />
de ciclosporine. La cataracte ne relève d’une intervention<br />
avec implantation intra-sacculaire et, si possible, iris artificiel<br />
que dans le cas d’un retentissement visuel majeur prenant en<br />
compte l’aplasie maculaire.<br />
Étude génétique. — L’aniridie peut être d’origine chromosomique<br />
ou génétique. Devant un cas isolé, il faut disposer<br />
d’une étude par FISH (Fluorescent In Situ Hybridization) à la<br />
recherche de la délétion chromosomique 11p13 responsable du<br />
Fig. 11-14 – Aniridie. Aplasie maculaire.<br />
syndrome WAGR dit « de gènes contigus » [18] . Elle expose au<br />
néphroblastome ou au gonadoblastome et justifie de maintenir<br />
chez ces enfants une surveillance régulière clinique et par échographie<br />
abdominale. Dans le cas contraire, il s’agit d’une mutation<br />
de novo inaugurant une nouvelle lignée. Dans sa forme<br />
génétique familiale, l’aniridie se transmet toujours comme un<br />
caractère dominant autosomique. Dès 1983, des translocations<br />
équilibrées, ayant toutes en commun un point de cassure en<br />
11p13, avaient suggéré la localisation du gène responsable de<br />
l’aniridie dans cette région chromosomique [55, 58, 67] . Les travaux<br />
de liaison génétique ultérieurs confirmèrent cette localisation [50] ,<br />
après qu’une tentative de localisation sur le chromosome 2 en<br />
1980 [27] fût infirmée par la mise en évidence d’une homogénéité<br />
génétique au locus 11p13 en 1992 [49] . Le gène PAX6 fut cloné<br />
par Ton et al. en 1991 [71] . Les travaux de cette équipe reposèrent<br />
sur la localisation chromosomique du locus de l’aniridie et les<br />
premières mutations furent retrouvées par l’équipe de van Heyningen<br />
en 1993 [32] . Depuis, de très nombreuses études confirmèrent<br />
l’implication de ce gène dans l’aniridie isolée d’une part<br />
(pour revue : OMIM) mais également dans d’autres tableaux cliniques<br />
et de multiples anomalies du développement de l’œil (cf.<br />
chapitres 5 et 6).<br />
Ectropion congénital de l’épithélium pigmenté<br />
de l’iris<br />
Cette anomalie est rare, généralement unilatérale, caractérisée<br />
par la présence d’épithélium pigmenté irien sur tout ou partie<br />
de la face antérieure du bord pupillaire. Le glaucome, très <strong>fr</strong>équent,<br />
se présente sous une forme congénitale avec buphtalmie<br />
ou tardive juvénile. La surveillance du tonus oculaire se<br />
doit d’être systématique devant tout ectropion congénital de<br />
l’uvée.<br />
Son association, très <strong>fr</strong>équente avec la neuro-fibromatose<br />
de von Recklinghausen, est également possible avec l’anomalie<br />
d’Axenfeld-Rieger et les autres dysgénésies du segment<br />
antérieur.<br />
Microcorie congénitale (DA)<br />
L’anomalie, bilatérale, rapportée à un trouble du développement<br />
du muscle dilatateur de l’iris, est définie par une pupille<br />
d’un diamètre inférieur à 2 mm dans le regard au loin. Presque<br />
virtuelle, la pupille peut se réduire à une pointe d’épingle.<br />
Le glaucome associé dans plus de 30 % des cas, apparu dès la<br />
naissance ou dans la première enfance, se caractérise par des<br />
pressions oculaires très élevées relevant d’une chirurgie combinant<br />
une corépraxie à l’intervention anti-glaucomateuse. La<br />
myopie forte, <strong>fr</strong>équente, et parfois une cataracte viennent<br />
encore compliquer la situation.<br />
Étude génétique. — Décrite en 1964, la microcorie<br />
congénitale est transmise en dominance autosomique. Un<br />
gène responsable a été localisé en 13q31-q32 mais non encore<br />
identifié [62] .<br />
Cornéo-gonio-dysgénésies<br />
Mégalocornée congénitale (RLX, DA, RA)<br />
La mégalocornée congénitale, ou mégalophtalmie antérieure<br />
congénitale, désigne une augmentation de taille du segment<br />
antérieur isolée, bilatérale et symétrique, parfois considérable,<br />
le diamètre cornéen pouvant atteindre 15 à 16 mm ; elle ne<br />
manque jamais d’évoquer l’Enfant du Docteur Roulin par Vincent<br />
van Gogh (fig. 11-15). Elle se distingue du glaucome con-<br />
GLAUCOMES CONGÉNITAUX PRIMITIF ET SECONDAIRES DYSGÉNÉSIQUES 167
Livre.book Page 168 Jeudi, 26. février 2009 3:40 15<br />
génital par l’absence de dégradation de la fonction visuelle, de<br />
trouble cornéen, de vergetures de la membrane de Descemet,<br />
de distension du limbe, d’excavation papillaire et bien<br />
entendu d’hypertonie oculaire. Son pronostic est, a priori,<br />
favorable à condition de surveiller annuellement et à vie le<br />
tonus oculaire, car l’apparition insidieuse d’une hypertonie<br />
chronique est possible. Des complications cristalliniennes,<br />
ectopie, cataracte précoce, ont été observées.<br />
Étude génétique. — Lorsque la mégalocornée est isolée, sa<br />
transmission est récessive liée au chromosome X dans 90 % des<br />
cas, exceptionnellement dominante autosomique ou récessive.<br />
Une tentative de localisation en Xq21.3-q22 a été publiée en<br />
1989 mais aucun gène n’a été identifié à ce jour [14] . En revanche,<br />
associée à un retard mental, elle constitue le syndrome de Neuhauser<br />
de transmission récessive autosomique [61, 73] .<br />
Sclérocornée congénitale (RA, DA)<br />
Dysgénésie majeure du segment antérieur, presque toujours<br />
bilatérale, elle est bien reconnaissable par l’aspect d’une<br />
microcornée plus ou moins accusée, blanche comme la sclère<br />
et sillonnée d’anses vasculaires radiaires à départ limbique,<br />
qui en font d’emblée un terrain défavorable à la kératoplastie.<br />
Fig. 11-15 – Mégalocornée congénitale.<br />
168 ANNEXES PALPÉBRO-CONJONCTIVALES ET SEGMENT ANTÉRIEUR<br />
La perte de la transparence cornéenne est due à l’absence de<br />
la totalité du plan endothélio-descemétique, bien visible en<br />
UBM (fig. 11-16), et à l’inorganisation des fibrilles collagènes.<br />
Le bilan lésionnel par l’UBM est indispensable car la sclérocornée<br />
congénitale s’accompagne très souvent d’anomalies de<br />
l’iris, d’adhérences iridocornéennes — qui établissent une<br />
transition avec l’anomalie de Peters —, d’adhérence cristallinienne<br />
(fig. 11-17), de cataracte, parfois de microphtalmie<br />
sévère, et toujours d’une dysgénésie de l’angle responsable<br />
d’un glaucome plus ou moins précoce.<br />
Étude génétique. — La sclérocornée isolée se transmet<br />
comme un caractère dominant autosomique ou récessif autosomique.<br />
Elle est volontiers décrite comme plus sévère<br />
lorsqu’elle est récessive [9] . Néanmoins, des formes familiales<br />
sévères dominantes autosomiques existent, à forte variabilité<br />
clinique intrafamiliale, et peuvent s’accompagner d’une<br />
microphtalmie extrême (données personnelles). Lorsque sclérocornée,<br />
microphtalmie et aplasie dermique coexistent chez<br />
le même patient, on parle de syndrome de MIDAS dont<br />
l’hérédité serait dominante liée au chromosome X, avec létalité<br />
chez le garçon. Le gène responsable serait localisé en<br />
Xp22-pter [45] .
Livre.book Page 169 Jeudi, 26. février 2009 3:40 15<br />
Fig. 11-16 – Sclérocornée congénitale. UBM : irrégularité de la face postérieure de la cornée par absence de plan endothélio-descemétique ; œdème<br />
cornéen ; adhérence du pôle antérieur du cristallin.<br />
Fig. 11-17 – UBM. Sclérocornée congénitale. Non-disjonction du cristallin.<br />
Cornéo-irido-gonio-dysgénésies<br />
Anomalie de Peters (DA, RA)<br />
Découverte par von Hippel en 1887, puis décrite par Peters en<br />
1906, cette malformation apparaît comme une forme partielle<br />
de sclérocornée congénitale qui épargnerait une plus ou<br />
moins grande partie de la cornée périphérique en fonction de<br />
l’étendue plus ou moins large du déficit endothélial. Contrairement<br />
à la précédente, elle laisse voir à la lampe à fente les<br />
adhérences iridocornéennes caractéristiques partant de la collerette<br />
irienne pour s’insérer à la face postérieure de la cornée<br />
au bord du déficit endothélio-descemétique (fig. 11-18). Le<br />
plus souvent bilatérale, l’anomalie de Peters peut être aussi<br />
asymétrique ou unilatérale, associée à une autre forme de<br />
dysgénésie. Compliquée d’anomalies extraoculaires, elle<br />
devient le syndrome de Peters (cf. in<strong>fr</strong>a, Glaucomes syndromiques).<br />
Meilleur que pour la sclérocornée congénitale, le pronostic<br />
de la kératoplastie transfixiante est fonction de<br />
l’importance de l’opacité centrale, des lésions associées et du<br />
glaucome plus ou moins précoce. L’examen attentif des appa-<br />
rentés à la recherche d’anomalies minimes de la périphérie de<br />
la cornée est une donnée précieuse apportée au généticien<br />
pour son conseil génétique.<br />
Étude génétique. — L’anomalie de Peters isolée se transmet<br />
comme un caractère dominant autosomique à forte<br />
variabilité clinique. Il n’est pas rare, en effet, d’observer dans<br />
la même famille des anomalies de Peters, d’Axenfeld et de<br />
von Hippel (fig. 11-19). De nombreux gènes impliqués dans le<br />
développement oculaire peuvent être incriminés dans la survenue<br />
de l’anomalie de Peters, PAX6, PITX2, FOXC, et<br />
d’autres non encore identifiés (cf. chapitres 5 et 6). Lorsque<br />
l’anomalie de Peters est associée à d’autres malformations<br />
viscérales, elle constitue le syndrome de « Peters-plus » [12, 75] .<br />
Anomalie de von Hippel (DA, RA…)<br />
Parfois improprement dénommée kératocône postérieur ou<br />
staphylome postérieur de la cornée, n’ayant strictement rien à<br />
voir avec l’angiomatose de von Hippel-Lindau (cf. chapitre<br />
33), elle réalise un degré malformatif supérieur par rapport<br />
au syndrome de Peters, puisque, en plus du déficit endothé-<br />
GLAUCOMES CONGÉNITAUX PRIMITIF ET SECONDAIRES DYSGÉNÉSIQUES 169
Livre.book Page 170 Jeudi, 26. février 2009 3:40 15<br />
Fig. 11-18 – Anomalie de Peters.<br />
lio-descémétique, le stroma fait défaut au centre cornéen<br />
fermé par le seul épithélium — dont l’origine embryologique<br />
n’est pas neuro-ectoblastique comme le reste de la cornée<br />
mais exclusivement épiblastique comme le cristallin —<br />
(fig. 11-20). Il peut d’ailleurs arriver que ce dernier reste<br />
enchâssé dans le chaton cornéen dont il s’est mal dissocié<br />
(fig. 11-21). L’œil est constamment buphtalme, à la merci<br />
d’un <strong>fr</strong>ottement digital un peu appuyé qui va fissurer le bouton<br />
épithélial et décomprimer transitoirement le globe voire<br />
précipiter son atrophie. Le traitement est extrêmement difficile<br />
et le pronostic très péjoratif. Fort heureusement, la malformation<br />
reste habituellement unilatérale, l’œil adelphe<br />
présentant un autre type de dysgénésie comme, par exemple,<br />
une anomalie de Peters, une anomalie d’Axenfeld ou un simple<br />
embryotoxon. Des malformations extraoculaires sont <strong>fr</strong>équemment<br />
associées, constituant le syndrome de Meckel (cf.<br />
in<strong>fr</strong>a, Glaucomes syndromiques).<br />
ANOMALIES DE PROLIFÉRATION<br />
ET DE DIFFÉRENCIATION<br />
Un second groupe d’affections est rattaché à des anomalies de<br />
la prolifération des cellules de la crête neurale prosencéphali-<br />
170 ANNEXES PALPÉBRO-CONJONCTIVALES ET SEGMENT ANTÉRIEUR<br />
que — comme le syndrome irido-cornéo-endothélial considéré<br />
comme sporadique — ou de leur différenciation — comme la<br />
dystrophie polymorphe postérieure de la cornée transmise sur<br />
le mode dominant autosomique. L’atteinte de l’endothélium<br />
cornéen est prédominante et le glaucome inéluctable [24] .<br />
Syndrome irido-cornéo-endothélial (ICE)<br />
(sporadique)<br />
Ce syndrome, très hétérogène, presque toujours unilatéral,<br />
regroupe :<br />
– l’atrophie essentielle et progressive de l’iris associant correctopie<br />
et ectropion uvéal ;<br />
– le syndrome de Chandler, forme très atténuée de la précédente<br />
mais avec un œdème cornéen constant ;<br />
– le syndrome de Cogan-Reese défini par un nodule pigmenté<br />
bénin de l’iris avec des éléments identiques au syndrome<br />
de Chandler ;<br />
– le syndrome nævique irien lorsqu’on est en présence,<br />
non pas d’un nodule irien, mais de nævi diffus.<br />
Le syndrome ICE débute chez l’adulte jeune, mais des cas<br />
ont été décrits chez l’enfant. Il est dû à une atteinte primitive<br />
de l’endothélium cornéen avec prolifération puis migration<br />
dans l’angle iridocornéen de cellules endothéliales anormales
Livre.book Page 171 Jeudi, 26. février 2009 3:40 15<br />
Axenfeld OD<br />
Von Hippel OG<br />
Peters ODG Axenfeld OG<br />
Von Hippel OD<br />
Enfant N. B.<br />
Enfant C.<br />
Enfant L.<br />
Fig. 11-19 – Pedigrees indépendants démontrant la variabilité clinique<br />
des glaucomes congénitaux dysgénésiques dominants autosomiques.<br />
Fig. 11-20 – Anomalie de von Hippel.<br />
Embryotoxon ODG<br />
Rieger ODG<br />
Embryotoxon<br />
ODG<br />
Von Hippel OG<br />
Peters OD<br />
qui sécrètent une substance collagène. L’hypertonie oculaire<br />
qui en résulte peut être très importante car la membrane<br />
fibrocellulaire forme des gonio-synéchies et participe, en se<br />
contractant, à la constitution de la correctopie et des trous<br />
iriens. Le diagnostic de syndrome ICE peut être facilité par la<br />
Fig. 11-21 – Anomalie de von Hippel. Cristallin dans le chaton cornéen.<br />
microscopie spéculaire, quand elle est possible, qui montre<br />
une diminution de la densité cellulaire et un pléiomorphisme<br />
en taille et en forme des cellules endothéliales.<br />
Dystrophie polymorphe postérieure (DA)<br />
Bilatérale, débutant dans l’enfance, elle résulte d’une différenciation<br />
incomplète des cellules endothéliales cornéennes. Un<br />
dépôt collagène, sécrété par cet endothélium anormal, recouvre<br />
une membrane de Descemet de type fœtal et envahit<br />
l’angle et l’iris, avec pour conséquences une perte progressive<br />
de la transparence de la cornée et un glaucome. Là encore, en<br />
microscopie spéculaire, on observe un pléiomorphisme des<br />
cellules endothéliales. La surveillance ophtalmologique<br />
annuelle permet, à temps, le traitement médical du glaucome<br />
et conduit à la greffe de cornée transfixiante lorsque l’altération<br />
de l’acuité visuelle n’est plus compatible avec les activités<br />
scolaires de l’adolescent. La maladie est transmise sur le<br />
mode dominant autosomique.<br />
GLAUCOME JUVÉNILE<br />
Cette terminologie déjà ancienne a le mérite de situer la date<br />
de survenue du glaucome mais ne préjuge pas de sa cause :<br />
soit glaucome dysgénésique d’expression retardée, soit glaucome<br />
primitif à angle ouvert de survenue très précoce. Il<br />
s’agit d’un glaucome toujours grave car de diagnostic tardif. En<br />
effet, il évolue à bas bruit comme un glaucome chronique<br />
sans distension du globe puisque la sclère n’est plus extensible<br />
au-delà de l’âge de trois ans.<br />
Très souvent secondaire à une anomalie minime de<br />
l’angle, embryotoxon ou anomalie d’Axenfeld de transmission<br />
dominante autosomique, il sera dépisté par l’examen<br />
biomicroscopique et la mesure systématique du tonus oculaire<br />
de tout enfant dont l’un des parents est porteur d’une<br />
dysgénésie du segment antérieur.<br />
Sinon, c’est l’observation d’une fatigue visuelle, de maladresses,<br />
d’un fléchissement scolaire, en rapport avec un déficit<br />
campimétrique témoignant d’un glaucome déjà très évolué<br />
avec une large excavation papillaire qui fera porter le diagnostic<br />
au cours de l’examen oculaire.<br />
GLAUCOMES CONGÉNITAUX PRIMITIF ET SECONDAIRES DYSGÉNÉSIQUES 171
Livre.book Page 172 Jeudi, 26. février 2009 3:40 15<br />
Ceci souligne la nécessité d’un examen ophtalmologique complet<br />
chaque fois qu’un enfant vient consulter pour un trouble visuel qu’il<br />
serait hâtif de mettre sur le compte d’une simple amétropie.<br />
Le traitement initial fait appel aux collyres hypotonisants,<br />
mais il faut bien souvent avoir recours à la chirurgie, en raison<br />
de l’échec du traitement médical.<br />
Étude génétique. — Les études génétiques sont en<br />
accord avec la présentation clinique et confirment la dualité<br />
des glaucomes juvéniles :<br />
– les altérations des gènes RIEG1, RIEG2, FOXC1, PITX3<br />
peuvent avoir une expression phénotypique tardive et être responsables<br />
de la manifestation retardée d’un glaucome secondaire<br />
dysgénésique tel qu’il vient d’être exposé ;<br />
– à l’inverse, les altérations des gènes GLC1A et GLCA1B,<br />
responsables du glaucome primitif à angle ouvert, se manifestant<br />
majoritairement à l’âge adulte (cf. chapitre 12), peuvent<br />
néanmoins être de révélation très précoce, dès l’âge de dix<br />
ans, sans dysgénésie de l’angle, et constituer la forme précoce<br />
infantile du glaucome chronique de l’adulte.<br />
GLAUCOMES SYNDROMIQUES<br />
L’implication des cellules des crêtes neurales dans la formation<br />
de l’œil mais aussi dans celle des structures dérivées des<br />
arcs branchiaux, rend compte des nombreuses associations<br />
malformatives craniofaciales et viscérales.<br />
Syndrome de Rieger (DA)<br />
Le syndrome de Rieger associe à l’anomalie de Rieger des<br />
malformations dentaires, faciales, ombilicales, osseuses et<br />
cardiaques. Les lésions dentaires prédominent sur les incisives<br />
supérieures qui sont absentes ou de petite taille (microdontie).<br />
La dysmorphie faciale consiste en une hypoplasie de la<br />
branche montante du maxillaire inférieur, un aplatissement<br />
de la base du nez et un hypertélorisme. Le défaut de régression<br />
du tissu péri-ombilical pourrait en imposer pour une<br />
véritable hernie (cf. chapitre 5).<br />
172 ANNEXES PALPÉBRO-CONJONCTIVALES ET SEGMENT ANTÉRIEUR<br />
Étude génétique. — Les gènes impliqués dans l’anomalie<br />
de Rieger isolée (cf. supra) sont également incriminés dans le<br />
syndrome de Rieger lequel, au demeurant, est très vraisemblablement<br />
sous-estimé eu égard aux signes souvent <strong>fr</strong>ustes<br />
permettant de le reconnaître, même pour un examinateur<br />
averti des associations malformatives.<br />
Syndrome de Peters ou « Peters-plus » (RA)<br />
Outre l’anomalie oculaire, il comporte de façon variable :<br />
retard mental et statural, brachymorphisme en particulier brachydactylie,<br />
visage rond avec parfois fente palatine, malformations<br />
cardiaques, cérébrales, auriculaires. Il se transmet<br />
comme un caractère récessif autosomique [12, 75] .<br />
Syndrome de Meckel<br />
Il est défini par l’association d’une anomalie de von Hippel<br />
ou, plus rarement, d’une dysgénésie apparentée, à une fente<br />
labio-vélo-palatine et à une méningoencéphalocèle par nonfermeture<br />
du neuropore antérieur, bien visible et palpable en<br />
région occipitale (fig. 11-22). Il peut coexister avec une malformation<br />
de Dandy-Walker, une dysplasie rénale multikystique,<br />
une fibrose hépatique et une polydactylie post-axiale [28] .<br />
Étude génétique. — Le syndrome de Meckel est transmis<br />
sur le mode récessif autosomique et trois loci ont été repérés,<br />
MKS1 en 17q22-q23 (OMIM 249000), MSK2 en 11q13<br />
(OMIM 603194) et MKS3 en 8q24 (OMIM 607361) mais<br />
aucun gène n’a encore été identifié.<br />
Syndrome de Marfan (DA)<br />
Il est caractérisé par la triade clinique : anomalies oculaires, cardiovasculaires<br />
et ostéoarticulaires (cf. chapitre 31). L’ectopie<br />
bilatérale des cristallins, due à une pathologie des fibres zonulaires,<br />
est présente dans 50 % des yeux dès l’âge de cinq ans.<br />
Le glaucome n’est retrouvé que chez 8 % des patients, en<br />
observant que, dans un tiers des cas, il s’agit d’un glaucome<br />
phacogène par blocage pupillaire causé par la subluxation du<br />
cristallin. L’exérèse de ce cristallin subluxé s’avère impérative<br />
pour mettre à l’abri de complications ultérieures à type de<br />
a b<br />
Fig. 11-22 – Syndrome de Meckel. a. Œil droit : anomalie de Peters. Œil gauche : anomalie de von Hippel. Fente labiopalatine. b. Absence de fermeture<br />
du neuropore antérieur.
Livre.book Page 173 Jeudi, 26. février 2009 3:40 15<br />
luxation vraie, antérieure ou postérieure. Les anomalies extraoculaires<br />
sont de deux ordres : cardiovasculaires anévrysme disséquant<br />
ou coarctation de l’aorte — et ostéoarticulaires —<br />
arachnodactylie, hyperlaxité ligamentaire, cyphoscoliose.<br />
Étude génétique. — Le syndrome de Marfan se transmet<br />
toujours en dominance autosomique à pénétrance complète,<br />
mais la variabilité d’expression est telle que certaines formes<br />
très <strong>fr</strong>ustes ont fait suggérer jadis une pénétrance incomplète.<br />
C’est la raison pour laquelle l’examen des apparentés à un<br />
patient doit être le plus complet possible, à la recherche de<br />
signes mineurs. L’individualisation sans ambiguïté des sujets<br />
atteints et indemnes est d’une importance capitale pour le<br />
conseil génétique. Le gène responsable du syndrome de Marfan<br />
fut localisé pour la première fois sur le chromosome 15 en<br />
1990 (MFS1, Kainulainen, 1990) [37] . Cette localisation affinée<br />
en 15q21.1 fut confirmée par plusieurs études, mais Boileau<br />
en 1992 publia pour la première fois l’évidence d’une hétérogénéité<br />
génétique de la maladie [10] . Le gène responsable correspondant<br />
au locus MFS1 fut clone en 1991 par Dietz [22] . Il<br />
s’agit du gène codant la fibrilline/FBN. Des mutations de ce<br />
gène sont retrouvées dans une grande majorité des patients<br />
atteints de syndrome de Marfan, mais également chez des<br />
patients atteints d’ectopie cristallinienne isolée (OMIM<br />
129600), de syndrome de Sphrintzen-Goldberg (OMIM<br />
182212), de syndrome de MASS (OMIM 604308) et de syndrome<br />
de Weil-Marchesani dans sa forme dominante autosomique<br />
(cf. in<strong>fr</strong>a). Un second locus contenant un gène<br />
responsable de syndrome de Marfan (MFS2) fut localisé sur le<br />
bras court du chromosome 3 en 3p24.2-p25 par l’équipe de<br />
Boileau en 1994 [15] . Le gène, à ce locus, vient d’être identifié ;<br />
il code un récepteur au TGFβ (Transforming Growth Factor β),<br />
TGFBR2 [53] .<br />
Syndrome de Weil-Marchesani (RA-DA)<br />
Il se présente comme l’image en contre-type du précédent :<br />
petite taille, mains et pieds courts. Le cristallin petit et rond<br />
— microsphérophaquie — est la conséquence du relâchement<br />
circonférentiel de sa zonule. Il peut s’enclaver dans l’aire<br />
pupillaire réalisant le tableau d’un glaucome aigu par blocage<br />
pupillaire. Les mydriatiques, comme les myotiques, sont<br />
contre-indiqués et le traitement est essentiellement chirurgical<br />
: iridectomie périphérique ou ablation du cristallin migrateur.<br />
Étude génétique. — Le syndrome de Weill-Marchesani<br />
se transmet comme un caractère récessif ou dominant autosomique,<br />
posant le problème des cas sporadiques. Lorsqu’il est<br />
dominant, le syndrome de Weill-Marchesani est allélique au<br />
syndrome de Marfan et dû à des mutations du gène de la<br />
fibrilline-1, considérées comme différentes de celles identifiées<br />
dans le syndrome de Marfan [25] . Lorsqu’il est récessif<br />
autosomique, le gène est localisé en 19p13.3-p13.2 [26] , mais<br />
non encore identifié. Il n’y a pas de corrélation génotype-phénotype.<br />
Homocystinurie (RA)<br />
L’homocystinurie est une maladie métabolique due à un déficit<br />
en cystathionine-β-synthase. Elle est en tout point proche<br />
du syndrome de Marfan tant dans ses anomalies oculaires,<br />
avant tout cristalliniennes, que squelettiques (fig. 11-23). Il s’y<br />
ajoute un retard mental toujours accentué et, surtout, des<br />
thromboses artérielles et veineuses particulièrement à redouter<br />
lors d’interventions sous anesthésie générale si l’on n’a pas<br />
pris soin de préparer l’enfant par un régime pauvre en<br />
Fig. 11-23 – Homocystinurie. Aspect marfanoïde.<br />
méthionine et riche en agents de reméthylation, bétaïne, vitamine<br />
B12, acide folique (cf. chapitre 35).<br />
Étude génétique. — Le gène codant la cystathionine-βsynthase<br />
(CBS) est localisé en 21q22.3. Sa structure génomique<br />
fut identifiée en 1997 [13] et ses mutations reliées à<br />
l’homocystinurie en 1999 [40] .<br />
Phacomatoses<br />
Ce groupe d’affections neuro-glioblastiques ou angiomateuses<br />
à manifestations polyviscérales constitue, par excellence,<br />
un modèle de neurocristopathies.<br />
Maladie de von Recklinghausen,<br />
ou neurofibromatose de type 1 (DA)<br />
Les patients atteints associent en proportion variable des<br />
taches cutanées de couleur café au lait, multiples et disséminées<br />
sur tout le corps, des neurofibromes des nerfs périphériques<br />
et/ou du système nerveux central, une dysplasie<br />
osseuse, une hémi-hypertrophie faciale.<br />
Sur le plan oculaire, névrome plexiforme de la paupière<br />
supérieure, corps de Lisch iriens pathognonomiques, et<br />
gliome du nerf optique sont les manifestations les plus habituelles.<br />
Le glaucome est uni- ou bilatéral, habituellement précoce,<br />
de type congénital avec buphtalmie. Il s’associe dans<br />
50 % des cas à l’hyperplasie de l’épithélium pigmenté de l’iris<br />
et à un névrome plexiforme. Il semble résulter, comme lui,<br />
d’un processus tumoral : infiltration de la gaine de Schwann<br />
des nerfs ciliaires qui viendraient bloquer l’angle. Le traitement<br />
médical local hypotonisant est rarement longtemps suffisant<br />
et doit être relayé par la chirurgie.<br />
Étude génétique. — Cf. chapitre 32.<br />
Maladie de Sturge-Weber-Krabbe (sporadique, DA)<br />
L’angiomatose encéphalo-trigéminée comporte : un angiome<br />
cutané facial en général plan, unilatéral et limité au territoire<br />
de l’ophtalmique de Willis, parfois plus étendu, intéressant<br />
les autres branches du nerf trijumeau, exceptionnellement<br />
bilatéral (fig. 11-24) ; des calcifications intracrâniennes ; un<br />
angiome méningé responsable de signes neurologiques à type<br />
GLAUCOMES CONGÉNITAUX PRIMITIF ET SECONDAIRES DYSGÉNÉSIQUES 173
Livre.book Page 174 Jeudi, 26. février 2009 3:40 15<br />
de crises convulsives ou de signes déficitaires spontanément<br />
régressifs ; enfin, un angiome choroïdien objectivé par<br />
l’angiographie, parfois associé à un angiome rétinien ou<br />
conjonctival. Le glaucome, homolatéral par rapport à<br />
l’angiome cutané, apparaît précocement et peut entraîner une<br />
buphtalmie. Il est dû au lacis capillaire qui infiltre tous les tissus<br />
oculaires, en particulier l’angle, et à l’inflation liquidienne<br />
qui en résulte, a fortiori lorsque l’angiome choroïdien est présent.<br />
Le rôle de l’élévation de la pression veineuse épisclérale<br />
paraît probable mais est discuté. La trabéculectomie externe,<br />
ou perforante d’évidence hémorragique, est efficace mais<br />
requiert souvent un traitement médical d’appoint.<br />
Fig. 11-24 – Syndrome de Sturge-Weber-Krabbe bilatéral.<br />
Maladie de Leber-Coats (sporadique),<br />
maladie de von Hippel-Lindau (DA)<br />
L’angiomatose miliaire de Leber-Coats (cf. chapitre 23) et<br />
l’angiomatose rétino-cérébelleuse de von Hippel-Lindau (cf.<br />
chapitre 33) peuvent se compliquer d’un glaucome ayant les<br />
mêmes caractères cliniques et obéissant aux mêmes mécanismes<br />
physiopathogéniques que la maladie de Sturge-Weber-<br />
Krabbe. En revanche leurs angiomes, du fait de leur localisation<br />
rétinienne, sont efficacement traités par la photocoagulation<br />
au laser et par la cryothérapie qui peuvent éviter ou<br />
retarder l’apparition du glaucome.<br />
Étude génétique. — Cf. chapitres 23 et 33.<br />
Syndrome de Pierre Robin (sporadique)<br />
Décrit en 1923, il désigne une neurocristopathie constituée,<br />
en proportions variables, d’un rétrognathisme avec division<br />
vélopalatine, glossoptose et détresse respiratoire, permettant<br />
de distinguer trois types de gravité croissante. La myopie<br />
forte y est très <strong>fr</strong>équente mais, exceptionnellement, l’aspect<br />
de gros œil peut être en rapport avec un authentique glaucome<br />
congénital (fig. 11-25). Le traitement chirurgical doit<br />
tenir compte des problèmes anesthésiques liés à la glossoptose<br />
et aux troubles cardiorespiratoires.<br />
174 ANNEXES PALPÉBRO-CONJONCTIVALES ET SEGMENT ANTÉRIEUR<br />
Fig. 11-25 – Syndrome de Pierre Robin.<br />
Syndrome oculo-cérébro-rénal de Lowe (LX)<br />
Décrit en 1952, ce syndrome est dû à une anomalie du métabolisme<br />
des acides aminés. Il se caractérise par une dysmorphie<br />
faciale très caractéristique (fig. 11-26), un sévère retard<br />
psychomoteur et staturo-pondéral, un rachitisme vitaminorésistant,<br />
une insuffisance rénale avec protéinurie, une hyperaminoacidurie<br />
et un déséquilibre phosphocalcique (cf. chapitre<br />
35). La cataracte congénitale partielle ou totale quasi constante<br />
s’associe dans 40 % des cas à un glaucome infantile par<br />
anomalie de l’angle. Les femmes conductrices peuvent être<br />
expressives et présenter des opacités cristalliniennes congénitales<br />
minimes (cf. chapitre 4).<br />
Fig. 11-26 – Dysmorphie du syndrome de Lowe.<br />
Étude génétique. — Le syndrome de Lowe est dû à une<br />
mutation dans le gène OCRL1 situé en Xq26.1 codant la<br />
phosphatidyl-inositol 4,5-biphosphate-5-phosphatase impli-
Livre.book Page 175 Jeudi, 26. février 2009 3:40 15<br />
quée dans la polymérisation de l’actine dans l’appareil de<br />
Golgi. Le diagnostic anténatal est possible.<br />
Syndrome SHORT<br />
Cet acronyme désigne S pour « Stature », H pour « Hyperextensibility<br />
of joints », O pour « Ocular depression », R pour « Rieger<br />
anomaly », T pour « Teething delay ». Le syndrome a été décrit<br />
pour la première fois par Gorlin en 1975 [31] . Les signes caractéristiques<br />
ont été réévalués par Toriello en 1985 qui note que<br />
le glaucome peut être observé dès la naissance ou très peu de<br />
temps après [72] . Une forte hypermétropie est possible (cf. chapitre<br />
8). Actuellement, on le considère comme une lipodystrophie<br />
partielle avec anomalie de Rieger et retard statural. Sa<br />
transmission est dominante autosomique à manifestation<br />
variable [39] .<br />
Mucopolysaccharidoses (RA)<br />
Ce groupe de maladies métaboliques est dû à des anomalies<br />
du métabolisme des mucopolysaccharides (MPS) et, selon<br />
l’enzyme déficiente, on en décrit six types : I, Hurler ; II,<br />
Hunter ; III, San Filippo ; IV, Morquio ; V, Scheie ; VI, Maroteaux<br />
et Lamy (cf. chapitre 35). L’accumulation du mucopolysaccharide<br />
intéresse tous les tissus, squelette, foie, rate,<br />
cerveau et l’œil. Les signes oculaires comportent de fines opacités<br />
cornéennes punctiformes grises, épithéliales et stromales,<br />
initialement asymptomatiques puis ultérieurement<br />
responsables de photophobie et d’une profonde chute de<br />
l’acuité visuelle — pouvant justifier une kératoplastie —, un<br />
Le glaucome congénital est une urgence chirurgicale.<br />
La goniotomie, introduite par Barkan en 1936, a longtemps<br />
été, entre des mains expérimentées, l’intervention de choix à<br />
condition que son indication ait été bien posée. Elle s’adressait<br />
aux glaucomes congénitaux primitifs dont les cornées<br />
étaient encore parfaitement claires, ce qui témoignait d’une<br />
forme peu évoluée et modérément sévère. Son but était, ab<br />
interno, d’inciser le trabéculum et de repousser l’insertion trop<br />
antérieure de l’iris.<br />
La trabéculectomie perforante, initialement dévolue au traitement<br />
du glaucome chronique de l’adulte, reste une excellente<br />
intervention pour les glaucomes congénitaux, surtout dans les<br />
formes sévères et dysgénésiques avec perte partielle de la<br />
transparence cornéenne. Cependant, deux conditions sont<br />
indispensables à sa réussite : en raison de la distension limbique,<br />
la dissection sclérale doit être poussée très en avant jusque<br />
dans les premières lames cornéennes et du fait de la forte<br />
pression intraoculaire, il convient de décomprimer lentement<br />
le globe lors de l’incision trabéculaire, puis de pratiquer l’iridectomie<br />
périphérique sans qu’aucune pression ne vienne<br />
provoquer une issue de vitré qui serait catastrophique sur de<br />
tels yeux.<br />
La trabéculotomie a la préférence de certains opérateurs lorsque<br />
la cornée est insuffisamment transparente. Elle consiste à<br />
introduire une sonde dans le canal de Schlemm et à lui imprimer<br />
un mouvement de rotation dans la chambre antérieure<br />
III – TRAITEMENT<br />
glaucome tardif par surcharge mucopolysaccharidique des<br />
structures trabéculaires et, parfois, une dégénérescence rétinienne<br />
et une atrophie optique.<br />
Étude génétique. — Les mucopolysaccharidoses se transmettent<br />
selon le mode récessif autosomique. Pour la maladie<br />
de Hurler, le gène de l’α-L-iduroniase (IDUA) est localisé en<br />
4p16.3 (cf. chapitre 35).<br />
Syndrome de Rubinstein-Taybi<br />
Décrit en 1963, il est caractérisé par un retard mental, un élargissement<br />
en spatule de la phalange terminale du pouce et du<br />
gros orteil et une dysmorphie faite de nanisme, microcéphalie,<br />
épicanthus, fentes palpébrales anti-mongoloïdes, micrognathie.<br />
Quelques cas de glaucomes congénitaux dysgénésiques<br />
ont été rapportés.<br />
Autres syndromes<br />
Des syndromes plus rares peuvent s’accompagner de glaucome<br />
congénital :<br />
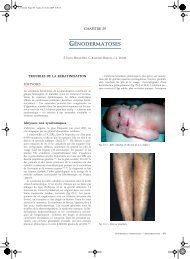
– syndrome oculo-facio-cardio-dental ;<br />
– syndrome de Stickler (RA) (cf. chapitre 23) ;<br />
– syndrome de Marshall ;<br />
– syndrome de Lowry-MacLean (DA) : retard mental, crâniosténose,<br />
fente palatine, glaucome ;<br />
– syndrome de Melnick-Needles (RA) : brachycéphalie,<br />
hypertélorbitisme, cyphose, anomalies des extrémités, glaucome.<br />
afin d’en ouvrir l’angle, réalisant en fait une goniotomie ab<br />
externo.<br />
La trabéculectomie externe, plus sûre que la trabéculectomie<br />
perforante, et tout aussi efficace à la condition d’emporter la<br />
paroi externe du canal de Schlemm, semble actuellement<br />
l’intervention de choix dans la majorité des cas (fig. 11-27).<br />
Elle apporte un argument supplémentaire en faveur de l’existence<br />
d’un obstacle juxta-canalaire plutôt qu’angulaire.<br />
Les indications des valves de Krupin [41] , de Shocket,<br />
d’Ahmed, l’implant de drainage de Molteno [54] naissent des<br />
échecs répétés des interventions précédentes. Cependant, ces<br />
systèmes de drainage ne sont pas dénués de graves complications<br />
: l’hypotonie persistante, source de décollement choroïdien,<br />
d’hémorragies récidivantes, de cataracte, peut mettre en<br />
danger la trophicité même de l’œil ; a contrario, l’arrêt de la filtration<br />
par obturation du tube par l’iris ou par la formation<br />
d’un tissu cicatriciel à son orifice scléral, son déplacement ou<br />
son expulsion, le contact avec la cornée source de prolifération<br />
endothéliale et de dystrophie sont des écueils redoutables.<br />
C’est pourquoi les recherches thérapeutiques se sont tournées<br />
vers d’autres méthodes : chimiothérapie, ultrasons, laser.<br />
Le 5-fluoro-uracile (5-FU) est un antimitotique cytostatique [34] ,<br />
inhibiteur de la croissance fibroblastique, utilisé dans les suites<br />
immédiates de certaines interventions filtrantes antiglaucomateuses<br />
depuis 1984. En effet, l’échec de ces interventions est dû<br />
à une cicatrisation conjonctivale excessive dans la région limbique,<br />
qui colmate la bulle de filtration et empêche le drainage de<br />
GLAUCOMES CONGÉNITAUX PRIMITIF ET SECONDAIRES DYSGÉNÉSIQUES 175
Livre.book Page 176 Jeudi, 26. février 2009 3:40 15<br />
Fig. 11-27 – Chambre de filtration après trabéculectomie externe.<br />
l’humeur aqueuse vers les espaces sous-conjonctivaux. D’autres<br />
produits antimétabolites ont été proposés (daunorubicine,<br />
doxorubicine, colchicine…). Cependant, des complications cornéo-sclérales<br />
ont été rapportées, kératite ponctuée superficielle,<br />
ulcère cornéen, amincissement scléral particulièrement dangereux<br />
sur de tels yeux [38] .<br />
La greffe de cornée, après normalisation tensionnelle,<br />
s’impose lorsque les deux cornées sont totalement opaques.<br />
La goniotomie au laser Nd-YAG pulsé a pu être proposée en<br />
cas de glaucome congénital primitif et la cyclodestruction au<br />
laser diode comme traitement de dernière intention des glaucomes<br />
ré<strong>fr</strong>actaires multiopérés.<br />
Le traitement médical par des collyres hypotonisants est un précieux<br />
adjuvant de la chirurgie.<br />
La prévention de l’amblyopie repose sur la précocité du diagnostic<br />
et du traitement chirurgical, sur une correction optique<br />
exacte après examen sous atropine et sur la rééducation.<br />
La vie de l’enfant glaucomateux opéré et guéri doit être la<br />
plus normale possible, en fonction du handicap visuel résiduel,<br />
tout en sachant que la <strong>fr</strong>agilité de ses globes oculaires<br />
contre-indique certains jeux et sports violents. Plus tard,<br />
l’orientation professionnelle évitera les métiers exposés aux<br />
traumatismes oculaires. Si leur pronostic a été transformé par<br />
une prise en charge immédiate et une chirurgie à l’échelle histologique,<br />
les glaucomes congénitaux n’en demeurent pas<br />
moins des affections graves potentiellement cécitantes pouvant<br />
conduire à l’apprentissage du braille et à une scolarité en<br />
institut spécialisé.<br />
BIBLIOGRAPHIE<br />
[1] Akarsu AN, Turacli ME, Aktan SG, Barsoum-Homsy M, Chevrette L,<br />
Sayli tsà. A second locus (GLC3B) for primary congenital glaucoma<br />
(buphthalmos) maps to the Ip36 région. Hum Molec Genet 1996, 5 : 1199-<br />
1203.<br />
[2] Allen L, Burian H, Brall A. A new concept of the development of the<br />
anterior chamber angle. Arch Ophthalmol 1955, 53 : 783-79 S.<br />
[3] Alward WLM, Semina EV, Kalenak JW, Heon E, Sheth BP, Stone EM,<br />
Murray JC. Autosomal dominant iris hypoplasia is caused by a mutation<br />
in the Rieger syndrome (RIEG/PITX2) gene. Am J Ophthal 1998, 125 : 98-<br />
100.<br />
[4] Anderson DR. The development of the trabecular meshwork and its<br />
abnormality in primary infantile glaucoma. Trans Am Ophtalmol Soc 1981,<br />
79 : 458-85.<br />
176 ANNEXES PALPÉBRO-CONJONCTIVALES ET SEGMENT ANTÉRIEUR<br />
[5] Bahn CF, Falls HF, Vahley GA, Meyeh RF. Edelhauser HF, Bourne WM.<br />
Classification of corneo-endothelial disorders based on neural crest origin.<br />
Ophthalmology 1994, 91 : 558-5S3.<br />
[6] Barber AN. Embryology of the human eye. Mosby O, St Louis, 1955.<br />
[7] Bechetoille A. Glaucome. Japperenard, Angers, 1967 ; pp 373-391.<br />
[8] Beiguelman B, Prado D. Recessive juvenile glaucoma. J Genet Hum 1963,<br />
12 : 53-54.<br />
[9] Bloch N. Les différents types de sclérocornée, leurs modes d’hérédité et<br />
les malformations congénitales concomitantes. J Genet Hum 1965, 14 :<br />
133-172.<br />
[10] Boileau C, Alexandre JA, Hariti G, Babron MC, Coulon M, Salvat C, Jondeau<br />
G, Bourdarias JP, Bonaiti-Pellié C, Junien C. Evidence for genetic<br />
heterogeneity in Marfan syndrome. Cytogenet Cell Genet 58 : 1991, 1992.<br />
[11] Bolande RP. The neurocristopathies. Hum Pathol 1974, 5 : 409-429.<br />
[12] Cabrai de Almeida JC, Reis DF, Lerena Jr, Neto JB, Lopes Pontes R, Middleton<br />
S, Télés LF. Short stature, brachydactyly, and Peters’ anomaly<br />
(Peters’-plus syndrome) : confirmation of autosomal recessive inheritance.<br />
J Med Genet 1991, 28 : 277-279.<br />
[13] Chasse JF, Pul V, Escanez R, Kamoun P, London J. Human cystathionine<br />
beta-synthase : gene organization and expression of different 5-prime<br />
alternative splicing. Mammalian Genomic 1997, 8 : 917-921.<br />
[14] Chen JD, Mackey D, Fuller H, Serravalle S, Olsson J, Denton MJ. X-linked<br />
megalocornea : close linkage to DXS87 and DXS94. Hum Genet<br />
1989, 83 : 292-294.<br />
[15] Collod G, Babron M-C, Jondeau G, Coulon M, Weissenbach J, Dubourg<br />
O, Bourdarias J-P, Bonaiti-Pellié C, Junien C, Boileau C. A second locus<br />
for Marfan syndrome maps to chromosome 3p24.2-p25. Nature Genet<br />
1994, 8 : 264-268.<br />
[16] Colomb E, Kaplan J, Garchon H-J. Novel cytochrome P450 1B1<br />
(CYP1B1) mutations in patients with primary congenital glaucoma in<br />
France. Hum Mutat 2003, 22 : 496.<br />
[17] Couly G, Jacquier A, André J-M. Schmitt J. Crêtes neurales céphaliques<br />
et troubles de la morphogenèse cranio-faciale. Rev Stomatol Maxillofac<br />
1980, 6 : 332-348.<br />
[18] Davis LM, Stallard R, Thomas GH, Couillin P, Junien C, Nowak NJ,<br />
Shows TB. Two anonymous DNA segments distinguish the Wilms’s<br />
tumor and aniridia loci. Science 1988, 241 : 840-842.<br />
[19] Demenais F, Bonaiti C, Briard M-L, Feingold J, Frézal J. Congenital glaucoma<br />
: genetic models. Hum Genet 1979, 46 : 305-317.<br />
[20] Demenais F, Elston RC, Bonaiti C, Briard ML, Kaplan EB, Namboodiri<br />
KK. Segregation analysis of congenital glaucoma : approach by two different<br />
models. Am J Hum Genet 1981, 33 : 300-306.<br />
[21] Demenais F. Further analysis of familial transmission of congenital glaucoma.<br />
Am J Hum Genet 1983, 35 : 1156-1160.<br />
[22] Dietz HC, Cutting GR, Pyeritz RE, Maslen CL, Sakai LY, Corson GM,<br />
Puffenberger E, Hamosh A, Nanthajumar EJ, Curristin SM, Stetten G,<br />
Meyers DA, Francomano CA. Marfan syndrome caused by a recurrent<br />
de novo missense mutation in the fibrillin gene. Nature 1991, 352 : 337-<br />
339.<br />
[23] Dufier J-L, Le Hoang P, Schmelk P, Fekete C, De Grouchy J, Turleau C,<br />
Haye C. Délétion intercalaire du bras court du chromosome 11 : aniridie,<br />
glaucome, retard staturo-pondéral et mental, ambiguïté sexuelle, gonadoblastome,<br />
déficit en catalase. Bull Soc Ophtalmo Fr 1981, 81 : 747-749.<br />
[24] Dufier J-L, Tiret A. Glaucomes congénitaux. Éditions techniques, Encycl<br />
Med Chir (Paris, France). Ophtalmologie 21-280-C-10, 1994 ; 9 p.<br />
[25] Faivre L, Gorlin RJ, Wirtz MK, God<strong>fr</strong>ey M, Dagoneau N, Samples JR, Le<br />
Merrer M, Collod-Béroud G, Boileau C, Munnich A, Cormier-Daire V. In<br />
<strong>fr</strong>ame fibrillin-1 gene deletion in autosomal dominant Weill-Marchesani<br />
syndrome. J Med Genet 2003, 40 : 34-36.<br />
[26] Faivre L, Mégarbané A, Alswaid A, Zylberberg L, Aldohayan N, Campos-Xavier<br />
AB, Bacq D, Legeai-Mallet L, Bonaventure J, Munnich A,<br />
Cormier-Daire. Homozygosity mapping of a Weill-Marchesani syndrome<br />
locus to chromosome 19p13.3-p13.2. Hum Genet 2002, 110 : 366-<br />
370.<br />
[27] Ferrell RE, Chakraverti A, Hittner HM, Riccardi VM. Autosomal dominant<br />
aniridia : probable linkage to acid phosphatase-1 on chromosome 2.<br />
Proc Nat Acad Sci 1980, 77 : 1580-1582.<br />
[28] Fraser FC, Lytwyn A. Spectrum of anomalies in the Meckel syndrome,<br />
or may be there is a malformation syndrome with at least one constant<br />
anomaly. Am J Med Genet 1981, 9 : 67-73.<br />
[29] Gencik A, Gencikova A, Gerinec A. Genetic heterogeneity of congenital<br />
glaucoma. Clin Genet 1980, 17 : 241-248.<br />
[30] Gencikova A, Gencik A. Congenital glaucoma in gypsies <strong>fr</strong>om Slovakia.<br />
Hum Hered 1982, 32 : 270-273.<br />
[31] Gorlin RJ. A selected miscellany. Birth Defects Orig Art Ser 1975, XI : 46-<br />
48.<br />
[32] Hanson IM, Seawright A, Hardman K, Hodgson S, Zaletayev D, Fekete<br />
G, van Heyningen V. PAX6 mutations in aniridia. Hum Molec Genet 1993,<br />
2 : 915-920.<br />
[33] Heon E, Sheth BP, Kalenak JW, Sunden SLF, Streb LM, Taylor CM,<br />
Alward WLM, Sheffield VC, Stone EM. Linkage of autosomal dominant<br />
iris hypoplasia to the région of the Rieger syndrome locus (4q25). Hum<br />
Molec Genet 1995, 4 : 1435-1439.<br />
[34] Heuer DK, Parrish RK, Gressel MQ et al. Intermediate follow up of a<br />
pilot study Fluoro-uracil and glaucoma filtering surgery. Ophthalmology<br />
1986, 93 : 1537-1545.<br />
[35] Hoskins HD, Shafferrn, Hetherington J. Anatomical classification of the<br />
developmental glaucomas. Arch Ophthalmol 1984, 102 : 1331-1336.
Livre.book Page 177 Jeudi, 26. février 2009 3:40 15<br />
[36] Johnston MC, Noden DM, Hazelton RD et al. Origines of avian ocular<br />
and peri-ocular tissues. Exp Eye Res 1979, 29 : 17-43.<br />
[37] Kainulainen K, Pulkkinen L, Savolainen A, Kaitila I, Peltonen L. Location<br />
on chromosome 15 of the gene defect causing Marfan syndrome. New<br />
Eng J Med 1990, 323 : 935-939.<br />
[38] Knapp A. Hever DK, Georges A, Stern MD. Serious corneal complications<br />
of glaucoma filtering surgery with post-operative 5-fluoro-uracile.<br />
Am J Ophthalm 1987, 103 : 183-167.<br />
[39] Koenig R, Brendel L, Fuchs S. Short syndrome. Clin Dysmorph 2003,<br />
12 :45-49.<br />
[40] Kraus JP, Janosik M, Kozich V, Mandell R, Shih V, Sperandeo MP, Sebastio<br />
G, de Franchis R, Andria G, Kluijtmans LAJ, Blom H, Boers GHJ, Gordon<br />
RB, Kamoun P, Tsai MY, Kruger WD, Koch HG, Ohura T,<br />
Gaustadnes M. Cystathionine beta-synthase mutations in homocystinuria.<br />
Hum Mutat 1999, 13 : 362-375.<br />
[41] Krupin TA, Podos SM. Becker B et al. Valve implants in filtering surgery.<br />
Am J Ophthalm 1976, 61 : 232-235.<br />
[42] Larsson C, Hellquist M, Pierrou S, White I, Enerback S, Carlsson<br />
P. Chromosomal localization of six human forkhead genes, <strong>fr</strong>eac-1<br />
(FKHL5), -3 (FKHL7), -4 (FKHL8), -5 (FKHL9), -6 (FKHL10), and-8<br />
(FKHL12). Genomics 1995, 30 : 464-469.<br />
[43] Le Douarin N-M. Particularités du noyau interphasique chez la caille<br />
japonaise. Utilisation de ses particularités comme marquage biologique<br />
dans des recherches sur les interactions tissulaires et les migrations cellulaires<br />
au cours de l’oncogenèse. Bull Biol Fr Belg 1969, 270 : 2587-2860.<br />
[44] Lelievre C, Le Douarin N-M. Mesenchyma derivates of the neural crest<br />
analysis of chimere quail and chick emhryos. J Embryol Exp Morphol<br />
1975, 34 : 125-154.<br />
[45] Lindsay EA, Grillo A, Ferrero GB, Roth EJ, Magenis E, Crompe M, Hulten<br />
M, Gould C, Valdini A, Zoghbi HY, Ballabio A. Microphthalmia<br />
with linear skin defects (MLS) syndrome : clinical, cytogenetic, and<br />
molecular characterization. Am J Med Genet 1994, 49 : 229-234.<br />
[46] Lines MA, Kozlowski K, Kulak SC, Allingham RR, Heon E, Ritch R,<br />
Levin AV, Shields MB, Damji KF, Newlin A, Walter MA. Characterization<br />
and prevalence of PITX2 microdeletions and mutations in Axenfeld-<br />
Rieger malformations. Invest Ophthal Vis Sci 2004, 45 : 828-833.<br />
[47] Lines MA, Kozlowski K, Walter MA. Molecular genetics of Axenfeld-<br />
Rieger malformations. Hum Molec Genet 2002, 11 : 1177-1184.<br />
[48] Lockie P, Elder J. Spontaneous resolution of primary congenital glaucoma.<br />
Aust N Z J Ophtalmol 1989, 17 : 75-7.<br />
[49] Lyons LA, Martha A, Mintz-Hittner HA, Saunders GF, Ferrell RE. Resolution<br />
of the two loci for autosomal dominant aniridia, AN1 and AN2,<br />
to a single locus on chromosome 11pl3. Genomics 1992, 13 : 925-930.<br />
[50] Mannens M, Bleeker-Wagemakers EM, Bliek J, Hoovers J, Mandjes I, van<br />
Toi S, Frants RR, Heyting C, Westerveld A, Slater RL. Autosomal dominant<br />
aniridia linked to the chromosome 11pl3 markers catalase and<br />
D11S151 in a large Dutch family. Cytogenet Cell Genet 1989, 52 : 32-36.<br />
[51] McMenamin PG. A quantitative study of the prenatal development of<br />
the aqueous outflow system in the human eye. Exp Eye Research 1991,<br />
53 : 507-17.<br />
[52] Mears AJ, Jordan T, Mirzayans F, Dubois S, Kume T, Parlée M, Ritch R,<br />
Koop B, Kuo WL, Collins C, Marshall J, Gould DB, Pearce W, Carlsson<br />
P, Enerback S, Morissette J, Bhattacharya S, Hogan B, Raymond V, Walter<br />
MA. Mutations of the forkhead/winged-helix gene, FKHL7, in<br />
patients with Axenfeld-Rieger anomaly. Am J Hum Genet 1998, 63 : 1316-<br />
1328.<br />
[53] Mizyguchi T, Collod-Beroud G, Akiyama T, Abifadel M, Harada N,<br />
Morisaki T, Allard D, Varret M, Claustres M, Morisaki H, Ihara M,<br />
Kinoshita A et al. Heterozygous TGFBR2 mutations in Marfan syndrome.<br />
Nature Genet 2004, 36 : 855-860.<br />
[54] Molteno ACB, Ancker E, Van Biljon G. Surgical technique for advance<br />
juvenile glaucoma. Arch Ophthalm 1984, 102 : 51-57.<br />
[55] Moore JW, Hyman S, Antonarakis SE, Mules EH, Thomas GH. Familial<br />
isolated aniridia associated with a translocation involving chromosomes<br />
11 and 22 [t(11;22)(p13;q12.2)]. Hum Genet 1986, 72 : 297-302.<br />
[56] Morton NE. Heterogeneity in nonsyndromal congenital glaucoma. (Letter)<br />
Am J Med Genet 1982, 12 : 97-102.<br />
[57] Nishimura DY, Swiderski RE, Alward WLM, Searby CC, Patil SR, Bennet<br />
SR, Kanis AB, Gastier JM, Stone EM, Sheffield VC. The forkhead<br />
transcription factor gene FKHL7 is responsible for glaucoma phenotypes<br />
which map to 6p25. Nature Genet 1998, 19 : 140-147.<br />
[58] Pettenati MJ, Weaver RG, Burton BK. Translocation t (5 ; 11) (q13.1 ;<br />
p13) associated with familial aniridia. Am J Med Genet 1989, 34 : 230-<br />
232.<br />
[59] Phillips JC, Del Bono EA, Haines JL, Pralea AM, Cohen JS, Greff LJ,<br />
Wiggs JL. A second locus for Rieger syndrome maps to chromosome<br />
13ql4. Am J Hum Genet 1996, 59 : 613-619.<br />
[60] Plasilova M, Ferakova E, Kadasi L, Polakova H, Gerinec A, Ott J, Ferak<br />
V. Linkage of autosomal recessive primary congenital glaucoma to the<br />
GLC3A locus in Roms (gypsies) <strong>fr</strong>om Slovakia. Hum Hered 1998, 48 : 30-<br />
33.<br />
[61] Raas-Rotchschild A, Berkenstadt M, Goodman RM. Megalocornea and<br />
mental retardation syndrome. Am J med Genet 1988, 29 : 221-222.<br />
[62] Rouillac C, Roche O, Marchant D, Bachner L, Kobetz A, Toulemot PJ,<br />
Orssaud C, Urvoy M, Odent S, Le Marec B, Abitbol M, Dufier J-L. Mapping<br />
of a congenital locus to 13q31-q32. Am J Hum Genet 1998, 62 : 1117-<br />
1122.<br />
[63] Sarfarazi M, Akarsu AN, Hossain A, Turacli ME, Aktan SG, Barsoum-<br />
Homsy M, Chevrette, Sayli BS. Assignment of a locus (GLC3A) for primary<br />
congenital glaucoma (buphthalmos) on 2p21 and evidence for<br />
genetic heterogeneity. Genomics 1995, 30 : 171-177.<br />
[64] Semina EV, Brownell I, Mintz-Hittner HA, Murray JC, Jamrich M. Mutations<br />
in the human forkhead transcription factor FOXE3 associated with<br />
anterior segment ocular dysgenesis and cataracts. Hum Molec Genet 2001,<br />
10 : 231-236.<br />
[65] Semina EV, Ferrell RE, Mintz-Hittner HA, Bitoun P, Alward WLM,<br />
Reiter S, Funkhauser C, Daack-Hirsch S, Murray JC. A novel homeobox<br />
gene PITX3 is mutated in families with autosomal dominant cataracts<br />
and ASMD. Nature Genet 1998, 19 : 167-170.<br />
[66] Semina EV, Reiter R, Leysens NJ, Alward WLM, Small KW, Datson NA,<br />
Siegel-Bartelt J, Bierke-Nelson D, Bitoun P, Zabel BU, Carey JC, Murray<br />
JC. Cloning and Characterization of a novel homeobox transcription factor<br />
gene, RIEG, involved in Rieger syndrome. Nature Genet 1996, 14 :<br />
392-399.<br />
[67] Simola KOJ, Knuutila S, Kaitila I, Pirkola A, Pohja P. Familial aniridia and<br />
translocation (4;lI)(q22;pl3) without Wilms’s tumor. Hum Genet 1983,<br />
63 : 158-161.<br />
[68] Smith RS, Zabaleta A, Kume T, Savinova OV, Kidson SH, Martin JE,<br />
Nishimura DY, Alward WLM, Hogan BLM, John SWM. Haplo-insuffîciency<br />
of the transcription factors FOXC1 and FOXC2 results in aberrant<br />
ocular development. Hum Molec Genet 2000, 9 : 1021-1032.<br />
[69] Stoilov I, Akarsu AN, Sarfarazi M. Identification of three different<br />
truncating mutations in cytochrome P4501B1 (CYP1B1) as the principal<br />
cause of primary congenital glaucoma (Buphthalmos) in families linked<br />
to the GLC2A locus on chromosome 2p21. Hum Molec Genet 1997, 6 :<br />
641-647.<br />
[70] Tixier J, Dureau P, Becquet F, Dufier J-L. Sclérectomie profonde dans le<br />
glaucome congénital. Résultats préliminaires. J Fr Ophtalmol 1999, 22 :<br />
545-8.<br />
[71] Ton CCT, Hirvonen H, Miwa H, Weil MM, Monaghan P, Jordan T, van<br />
Heyningen V, Hastie ND, Meijers-Heijboer H, Drechsler M, Royer-<br />
Pokora B, Collins F, Swaroop A, Strong LC, Saunders GF. Positional cloning<br />
and characterization of a paired box and homeobox containing<br />
gene <strong>fr</strong>om the aniridia region. Cell 1991, 67 : 1059-1074.<br />
[72] Toriello HV, Wakefield S, Komar K, Higgins JV, Waterman DF. Report<br />
of a case and further delineation of the Short syndrome. Am J Med Genet<br />
1985, 22 : 311-314.<br />
[73] Verloes A, Journel H, Elmer C, Mission JP, Le Merrer M, Kaplan J, van<br />
Maldergem L, Deconinck H, Meire F. Heterogeneity versus variability in<br />
megalocornea-mental retardation (MMR) syndromes : report of new<br />
cases and delineation of 4 probable types. Am J med Genet 1993, 46 : 132-<br />
137.<br />
[74] Waardenburg PJ. Uber das familiaere Vorkommen und den Erbgang des<br />
praesenilen und senilen Glaukoms. Genetica 1950, 25 : 79-125.<br />
[75] Wenniger-Prick Lijmm de B, Henenkam RCM. The Peters’ plus syndrome<br />
: a review. Ann Genet 2002, 45 : 97-103.<br />
GLAUCOMES CONGÉNITAUX PRIMITIF ET SECONDAIRES DYSGÉNÉSIQUES 177
Livre.book Page 178 Jeudi, 26. février 2009 3:40 15